Method Article
تطوير نموذج الزراعة المشتركة للخلايا لمحاكاة نقص تروية القلب / التروية في المختبر
In This Article
Summary
المسافة المكانية هي معلمة رئيسية في تقييم إصابة نقص الأكسجة / إعادة الأكسجين في نموذج الزراعة المشتركة لطبقات الخلايا البطانية وخلايا عضلة القلب المنفصلة ، مما يشير ، لأول مرة ، إلى أن تحسين البيئة المكانية للزراعة المشتركة ضروري لتوفير نموذج موات في المختبر لاختبار دور الخلايا البطانية في حماية الخلايا العضلية القلبية.
Abstract
مرض القلب الإقفاري هو السبب الرئيسي للوفاة والعجز في جميع أنحاء العالم. يسبب التروية إصابة إضافية تتجاوز نقص التروية. يمكن للخلايا البطانية (ECs) حماية الخلايا العضلية القلبية (CMs) من إصابة التروية من خلال التفاعلات بين الخلايا الخلوية. يمكن أن تساعد الثقافات المشتركة في التحقيق في دور التفاعلات بين الخلايا والخلايا. الزراعة المشتركة المختلطة هي أبسط نهج ولكنها محدودة لأن العلاجات المعزولة والتحليلات النهائية لأنواع الخلايا المفردة غير ممكنة. للتحقق مما إذا كان بإمكان ECs تخفيف تلف خلايا CM اعتمادا على الجرعة وما إذا كان يمكن تحسين هذه الحماية بشكل أكبر عن طريق تغيير مسافة الاتصال بين خطي الخلايا ، استخدمنا الخلايا البطانية للشريان التاجي الأولي للماوس والخلايا العضلية القلبية للفأر البالغ لاختبار ثلاثة أنواع من إدخالات زراعة الخلايا التي تختلف في مسافة الطبقة بين الخلايا عند 0.5 ، 1.0 ، و 2.0 مم ، على التوالي. في CMs فقط ، زادت الإصابة الخلوية كما تم تقييمها بواسطة إطلاق نازعة هيدروجيناز اللاكتات (LDH) بشكل كبير أثناء نقص الأكسجة وعند إعادة الأكسجين عندما كانت المسافة 2.0 مم مقارنة ب 0.5 و 1.0 مم. عندما كانت ECs و CMs على اتصال مباشر تقريبا (0.5 مم) ، لم يكن هناك سوى تخفيف خفيف لإصابة إعادة الأكسجين ل CMs بعد نقص الأكسجة. مع مسافة 2.0 مم ، خففت ECs إصابة CM أثناء كل من نقص الأكسجة ونقص الأكسجة / إعادة الأكسجين ، مما يشير إلى أن التباعد الثقافي الكافي ضروري ل ECs للتحدث مع CMs ، بحيث يمكن لجزيئات الإشارة المفرزة أن تدور وتحفز المسارات الوقائية بالكامل. تشير النتائج التي توصلنا إليها ، لأول مرة ، إلى أن تحسين البيئة المكانية للثقافة المشتركة بين EC / CM أمر ضروري لتوفير نموذج موات في المختبر لاختبار دور ECs في حماية CM ضد إصابة نقص التروية / التروية المحاكاة. والهدف من هذا التقرير هو توفير نهج تدريجي للمحققين لاستخدام هذا النموذج الهام لصالحهم.
Introduction
مرض نقص تروية القلب هو السبب الرئيسي للوفاة والعجز في جميع أنحاء العالم 1,2. ومع ذلك ، فإن عملية علاج التروية يمكن أن تسبب في حد ذاتها وفاة الخلايا العضلية القلبية ، والمعروفة باسم إصابة نقص تروية عضلة القلب / التروية (IR) ، والتي لا يوجد لها حتى الآن علاج فعال3. تم اقتراح الخلايا البطانية (ECs) لحماية الخلايا العضلية القلبية (CMs) من خلال إفراز إشارات paracrine ، وكذلك التفاعلات من خلية إلى خلية4.
وقد استخدمت نماذج الزراعة المشتركة للخلايا على نطاق واسع للتحقيق في دور التفاعلات بين الخلايا الأوتوتيكرين و/أو الباراكرين في وظيفة الخلية والتمايز. من بين نماذج الزراعة المشتركة ، تعد الزراعة المشتركة المختلطة هي الأبسط ، حيث يكون هناك نوعان مختلفان من الخلايا على اتصال مباشر داخل حجرة زراعة واحدة بنسبة خلية مطلوبة5. ومع ذلك ، فإن العلاجات المنفصلة بين أنواع الخلايا والتحليل النهائي لنوع خلية واحدة ليست ممكنة بسهولة نظرا للسكان المختلطين.
أشارت الدراسات السابقة إلى أن الإهانات الناقصة الأكسجة والإقفارية تسبب أضرارا كبيرة لسلامة غشاء الخلية كما تم قياسها من خلال إطلاق نازعة هيدروجيناز اللاكتات (LDH). تتفاقم هذه الإصابة عند إعادة الأكسجين ، مما يحاكي إصابة إعادة التروية6،7،8. كان الهدف من البروتوكول الحالي هو اختبار الفرضيات القائلة بأن وجود ECs يمكن أن يخفف من تسرب غشاء الخلية من CMs الناجم عن نقص الأكسجة وإعادة الأكسجين (HR) وأن التأثير الوقائي ل ECs يمكن تحسينه عن طريق تغيير مسافة الاتصال بين خطي الخلية. وهكذا ، استخدمنا ثلاثة أنواع من إدراج زراعة الخلايا والخلايا البطانية للشريان التاجي الأولي للفأر والخلايا العضلية القلبية للفأر البالغ. سمحت لنا الإدخالات ، التي تحمل علامة Corning و Merck Millipore و Greiner Bio-One ، بإنشاء ثلاثة ظروف مختلفة للتفاعل بين الخلايا مع مسافات خط بين الخلايا تبلغ 0.5 و 1.0 و 2.0 مم ، على التوالي. تم طلاء 100000 ECs لكل إدراج في كل حالة.
بالإضافة إلى ذلك ، من أجل تحديد ما إذا كانت كثافة ECs في الثقافة المشتركة تساهم في تخفيف إصابات الموارد البشرية في هذا النموذج ، درسنا العلاقة بين الجرعة والاستجابة بين تركيز EC وإطلاق LDH بواسطة CMs. تم طلاء ECs عند 25000 و 50000 و 100000 لكل إدراج ، على التوالي ، في إدراج 2.0 مم.
يقدم هذا التقرير نهجا خطوة بخطوة للمحققين لاستخدام هذا النموذج الهام لصالحهم.
Protocol
1. التحضير التجريبي / الطلاء
- الحفاظ على CMs و ECs وفقا لتعليمات الشركة المصنعة.
- قم بإذابة كلا الخطين الخلويين عند وصولهما من البائعين. طبق في قوارير T25 بعد غسلها بوسائط جديدة. يوصى بشراء كل وسائط زراعة خلايا من نفس البائعين الذين تم شراء الخلايا منهم. في اليوم التالي ، قم بتحديث الخلايا بالوسائط واستخدمها عند الالتقاء.
- حافظ على حاضنة زراعة الخلايا عند 37 درجة مئوية مع 21٪ O2 ، 5٪ CO 2 ، 74٪ N2 واحتفظ بها رطبة.
ملاحظة: يتم عزل الخلايا البطانية للشريان التاجي الأولي للفأر المستخدمة في هذا البروتوكول من الشرايين التاجية للفئران C57BL/6، ويتم عزل الخلايا العضلية القلبية للفئران البالغة من قلوب الفئران C57BL/6J البالغة ويتم الحصول عليها تجاريا (انظر جدول المواد).
- لوحة CMs تحت ظروف معقمة على الجزء السفلي من لوحات 24 بئر (طبقة أدنى). بعد 24 ساعة ، قم بصب ECs في الإدراج (أو الجزء المتفوق) من الثقافة المشتركة جيدا. بعد 24 ساعة من طلاء EC ، ضع إدخالات EC على قواعد لوحة CM ، بدءا من فترة الثقافة المشتركة. اسمح للخلايا بالزراعة المشتركة لمدة 12-24 ساعة على الأقل قبل الاستخدام. يتم وصف هذه الخطوات بالتفصيل أدناه.
- تقدير التقاء خط خلية CM تحت المجهر الضوئي. عندما تبدو الخلايا ملتقية بنسبة 90٪ -100٪ في قوارير المزرعة ، تابع الطلاء التجريبي.
- قم بإزالة الوسائط من القوارير التي تحتوي على مزارع الخلايا المتقاربة والتريبسين مع 3-5 مل من التربسين / حمض الإيثيلين ديامين رباعي الأسيتيك (EDTA) لقوارير T25. حرك القارورة بلطف ، واحتضنها عند 37 درجة مئوية لمدة 2-5 دقائق ، ثم قم بتقييم التقدم الأنزيمي تحت المجهر الضوئي. بمجرد أن تبدأ الخلايا في التقريب ، استخدم مكشطة الخلايا لفصل الخلايا عن السطح.
- بعد الانفصال ، قم بتعطيل محلول التربسين عن طريق إضافة محلول التربسين / الخلية إلى أنبوب سعة 50 مل يحتوي على 10 مل من الوسائط لقوارير T25. الطرد المركزي تعليق الخلية في 120 × غرام لمدة 2 دقيقة للحصول على بيليه خلية لينة. قم بإزالة supernatant وأعد تعليق الكريات في 5 مل من الوسائط.
- لإجراء عد الخلايا وتأكيد صلاحية الخلية ، امزج أليكوت من 10 ميكرولتر من الخلايا المعاد تعليقها و 10 ميكرولتر من صبغة التربان الزرقاء. عد الخلايا الحية باستخدام عداد الخلايا. تمييع الخلايا مع وسائط منتظمة جديدة لتحقيق كثافات البذر المطلوبة. يتم حساب الأحجام اعتمادا على كثافة البذور المطلوبة وتركيز الخلايا لمحاليل المخزون. يجب إجراء جميع عمليات الطلاء في ظل ظروف معقمة.
- لوحة CMs بكثافات البذر من 300,000 لكل بئر على الجزء السفلي من لوحة 24 بئر مغلفة مسبقا مع مصفوفة خارج الخلية. الحفاظ على الخلايا في 37 درجة مئوية مع 21٪ O 2و 5٪ CO2 بين عشية وضحاها.
- بعد 24 ساعة، يتم إدخال ECs في الصفائح بكثافة طلاء مثالية تبلغ 100,000 لكل إدراج (مساحة الاستزراع 33.6 مم2)، (الشكل 1). بعد 24 ساعة من طلاء EC ، ضع إدخالات EC داخل آبار CM ، وابدأ الثقافة المشتركة. اسمح للخلايا بالزراعة المشتركة لمدة 12-24 ساعة قبل إجراء التجارب.
- تأكد من أنه بحلول الوقت الذي يتم فيه إجراء التجارب ، وصل كل من CMs و ECs إلى 80٪ -90٪ من التقاء.
2. نقص الأكسجة / إعادة الأكسجين لمحاكاة نقص التروية / إصابة التروية في المختبر
ملاحظة: يجب تنفيذ الخطوات التالية كما هو موضح، لا تتوقف مؤقتا بينهما.
- تحضير وسائط نقص الأكسجة عن طريق صب ~ 25 مل من الوسائط في أنبوب مخروطي 50 مل. قم بإغلاق الجزء العلوي بالهواء باستخدام غشاء سيليكون واستخدم ماصة معقمة لكمة ثقب. قم بإنشاء ثقب آخر ، هذه المرة ترك الماصة مغمورة بالمياه حوالي 2/3 في الوسائط.
- اغسل الوسائط بغاز نقص الأكسجة (0.0125٪ O 2 ، 5٪ CO 2 ، 94.99٪ N2) لمدة 5 دقائق بمعدل تدفق 30 لتر / دقيقة. هذا يقلل من O 2 المذاب في وسائل الإعلام عندما يبدأ نقص الأكسجة (الخطوة2.5).
- تخلص من وسائط الألواح أو الإدخالات المستزرعة المكونة من 24 بئرا التي تحتوي على خلايا متصلة واغسلها بلطف شديد باستخدام 100 ميكرولتر / بئر من محلول ملحي مخزنة مؤقتا بنسبة 10٪ من الفوسفات (PBS). بعد ذلك ، أضف 500 ميكرولتر من وسائط نقص الأكسجة الطازجة إلى كل بئر من الألواح أو الإدراجات.
ملاحظة: ينقطع نقص الأكسجة في الوسائط بأقصر وقت ممكن خلال هذه الخطوة قبل أن يبدأ نقص الأكسجة الحقيقي للخلايا والوسائط في الخطوة 2.5.- في مجموعة التحكم المعيارية ، استبدل الوسائط الأصلية بوسائط طبيعية جديدة تحتوي على الجلوكوز والمصل.
- ترطيب غرفة نقص الأكسجة عن طريق وضع طبق بتري مملوء بالماء المعقم داخل الغرفة. بعد ذلك ، ضع الألواح التي تضم مجموعات نقص الأكسجة في الغرفة.
- اغسل غرفة نقص الأكسجة بغاز نقص الأكسجة (0.0125٪ O 2 ، 5٪ CO 2 ، 94.99٪ N2) لمدة 5 دقائق عند تدفق 30 لتر / دقيقة. ضع الغرفة في الحاضنة 37 درجة مئوية لمدة 24 ساعة.
- بعد نقص الأكسجة ، قم بزراعة CMs و ECs في ظل الظروف العادية. للقيام بذلك ، تخلص من الوسائط القديمة للألواح / الإدخالات ، واستبدلها بوسائط عادية (تحتوي على الجلوكوز والمصل ؛ 500 ميكرولتر من كل بئر / إدراج) وتخزينها في الحاضنة في ظل ظروف الثقافة العادية (21٪ O 2 ، 5٪ CO 2 ، 74٪ N 2 ، 37 درجة مئوية) لمدة2 ساعة لتقليد التروية.
- للتحكم في أي آثار لاستبدال الوسائط ، قم بتغيير وسائط الخلايا المعيارية في نفس الوقت الذي يتم فيه تغيير وسائط نقص الأكسجين.
ملاحظة: يقدم الشكل 2 لمحة عامة تخطيطية عن هذا البروتوكول.
3. تقييم نقطة النهاية
- انقل وسائط زراعة الخلايا من لوحة 24 بئرا إلى صفيحة 96 بئرا. استخدم 200 ميكرولتر من الوسائط من كل بئر من الصفيحة المكونة من 24 بئرا وقم بتوزيعها بالتساوي في أربعة آبار من لوحة البئر 96 ، وفقا لذلك. استخدم صفيحة واحدة لكل من النورموكسيا مقابل نقص الأكسجة مقابل الموارد البشرية.
- تحديد درجة الإصابة الخلوية، على سبيل المثال، عن طريق قياس امتصاص LDH باستخدام مجموعة فحص السمية الخلوية باتباع تعليمات الشركة المصنعة. قم بإجراء الفحص في لوحة 96 بئرا وفقا للتعليمات الواردة في بروتوكول المقايسة.
4. الإحصائيات
- عرض البيانات البارامترية كانحراف متوسط/معياري وبيانات غير بارامترية كمخططات مربعة ذات نطاق متوسط/ربع سنوي. وينبغي إجراء اختبارات مقارنات متعددة بارامترية كافية مقابل اختبارات مقارنات متعددة غير بارامترية مع اختبارات لاحقة مقبولة لتقليل فرصة حدوث خطأ من النوع 1. عادة ما يتم تعيين الأهمية عند ألفا من 0.05 (ثنائي الذيل).
- بالنسبة لجميع التجارب التي أجريت في الدراسة الحالية ، قم بإجراء ثلاث نسخ متماثلة جيدة على الأقل في تجربة واحدة. كان هناك ثلاثة إلى ستة تكرارات لكل تجربة تستخدم للتحليل الإحصائي.
النتائج
جميع أنواع الإدخالات الثلاثة (A ، B ، C) المستخدمة في هذه التجربة لها نفس حجم المسام البالغ 0.4 ميكرومتر. والفرق الوحيد بينها هو الارتفاع من الإدراج إلى القاعدة، الذي يسمح بأن تكون المسافات بين طبقتي الخلايا المستزرعتين معا 0.5 و 1.0 و 2.0 ملم، على التوالي، (الشكل 3) وأنها من بائعين مختلفين (للاطلاع على التفاصيل، انظر جدول المواد).
لإنشاء نموذج للزراعة المشتركة في المختبر مع طبقات منفصلة من خطين خلويين يخضعان للموارد البشرية لمحاكاة إصابة الأشعة تحت الحمراء ، فحصنا سلامة غشاء الخلية ل CMs المستزرعة بشكل مشترك مع أو بدون ECs. إن استخدام إدراج منفصل ل ECs يمكن وضعه على مسافات متنوعة فوق طبقة CM سمح لنا أيضا بتقييم الآثار التفاضلية لمسافة طبقة الخلية على شدة تلف الغشاء في CMs. في مجموعة منفصلة من التجارب ، قمنا بتنويع كثافة ECs وبالتالي نسبة ECs إلى CMs. بالإضافة إلى ذلك ، للتمييز بين نقص التروية المحاكي وإصابة الأشعة تحت الحمراء المحاكية ، أجريت التجارب في ظل ظروف 1) normoxia ، 2) نقص الأكسجة فقط ، و 3) HR. بالنسبة لهذا النموذج ، استخدمنا نقص الأكسجة لمدة 24 ساعة ، يليه إعادة الأكسجين لمدة 2 ساعة.
مسافات متغيرة
مسافة 0.5 مم بين طبقات الخلايا (أدخل A)
عندما تم استزراع CMs بمفردها ، أدى نقص الأكسجة إلى زيادة كبيرة في إطلاق LDH مقارنة ب normoxia ، بما يتفق مع دراساتنا السابقة (الشكل 4A)6. ومع ذلك ، تم زيادة LDH بشكل طفيف فقط عند إعادة الأكسجين على مدار 2 ساعة مقارنة بمجموعة نقص الأكسجة فقط. عندما تم استزراع ECs و CMs معا على مسافة 0.5 مم ، لم يتم تخفيف الزيادة في إطلاق LDH بواسطة نقص الأكسجة فقط مما يشير إلى أن ECs لم تظهر أي تأثير وقائي (مقارنة بمجموعة CMs وحدها في ظل ظروف نقص الأكسجة فقط). ومع ذلك ، مارست ECs حماية خفيفة ولكنها كبيرة على CMs أثناء الموارد البشرية.
مسافة 1.0 مم بين طبقات الخلايا (إدراج B)
تم إجراء نفس التجربة على النحو الوارد أعلاه ، باستثناء زيادة المسافة بين طبقتي الخلية إلى 1.0 مم (الشكل 4B). وجدنا أن إطلاق LDH زاد أيضا بشكل كبير في CMs فقط عن طريق نقص الأكسجة فقط. ومع ذلك ، على عكس إدراج 0.5 مم ، تم تعزيز زيادة LDH في CMs فقط بواسطة HR على نقص الأكسجة فقط. علاوة على ذلك ، تم تثبيط هذا التعزيز بشكل أكبر وألغيته تقريبا من خلال وجود ECs أثناء إعادة الأكسجين مقارنة بمجموعة CMs فقط.
مسافة 2.0 مم بين طبقات الخلايا (أدخل C)
عندما تم استخدام إدخالات الاستزراع المشترك التي تخلق مسافة 2.0 مم بين خطي الخلية (الشكل 4C) ، وجدنا أيضا زيادة كبيرة في إطلاق LDH بواسطة CMs فقط أثناء نقص الأكسجة ، بنفس الدرجة كما في تجارب 0.5 مم و 1.0 مم. ومن المثير للاهتمام ، مع ذلك ، أن الزيادة الإضافية في إطلاق LDH عن طريق إعادة الأكسجين كانت أكثر وضوحا مما كانت عليه في تجارب 1.0 ملم. وقد تم تخفيف كل من هذه الزيادات، وإن لم يتم إلغاؤها، من خلال وجود ECs، مما يشير إلى أنه بخلاف استخدام إدخالات 0.5 أو 1.0 mm، فإن ECs تحمي CMs بشكل كبير من الإصابة في ظل ظروف نقص الأكسجة فقط والموارد البشرية.
كثافة EC المتغيرة
في مجموعة مختلفة من التجارب ، تمت معايرة تركيز ECs المطلية في إدخالات 2.0 مم إلى 25000 و 50000 و 100000 خلية لكل إدراج ، على التوالي. تم قياس إطلاق LDH بعد 24 ساعة من نقص الأكسجة تليها 2 ساعة من إعادة الأكسجين. أظهرت نتائجنا أن زيادة كثافة EC في الثقافة المشتركة أدت إلى تخفيف يعتمد على الجرعة من إطلاق LDH الناجم عن الموارد البشرية (الشكل 5) ؛ ولم يلاحظ أي أثر من هذا القبيل في ظل الظروف المعيارية.
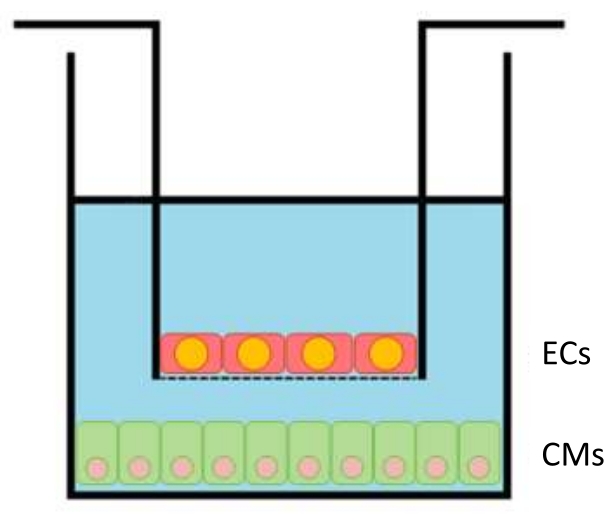
الشكل 1: مخطط الإدراج داخل البئر. يتم نقل الإدخالات مع ECs (ما يصل إلى 100000 خلية لكل إدراج) إلى لوحات 24 بئرا مع CMs (300000 لكل بئر) في قاعها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التصميم التجريبي. يتم استزراع الخلايا في ظل ظروف الأكسجين الطبيعية (21٪ O 2) ، ثم تنقسم إلى مجموعتين: ستستمر مجموعة التحكم المعيارية في الاستزراع في ظل الظروف العادية لمدة 24 ساعة أخرى ، في حين سيتم استزراع مجموعة نقص الأكسجة في غرفة نقص الأكسجة لمدة 24 ساعة مع 0.01٪ O2 فقط وبدون جلوكوز. بعد هذه التدخلات على مدار 24 ساعة ، يتم تحديث كلتا المجموعتين من الخلايا بالوسائط وزرعها باستمرار في بيئة O 2 بنسبة21٪ لمدة 2 ساعة أخرى ، وهي مرحلة إعادة الأكسجين ، قبل إجراء فحص (مقايسات) نقطة النهاية في النهاية ، على سبيل المثال ، تحليل LDH. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
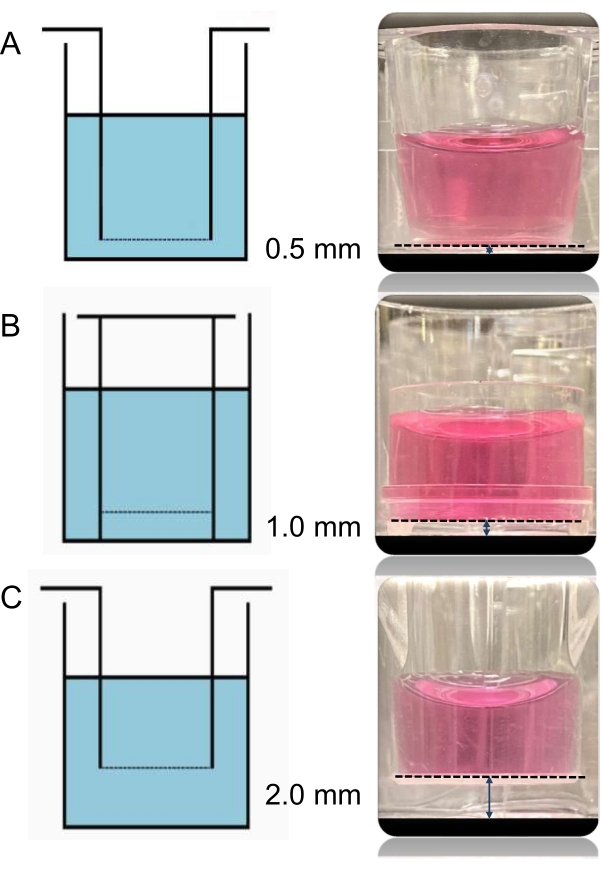
الشكل 3: صور ومخططات للإدراج الثلاثة المختلفة. يمكن تغيير المسافة بين الخلايا البطانية في الإدراج والخلايا العضلية القلبية في أسفل البئر باستخدام إدخالات مختلفة. جميع الأنواع الثلاثة من الإدخالات المستخدمة هنا لها نفس حجم المسام 0.4 ميكرومتر. الفرق الوحيد بينها هو ارتفاع الإدراج إلى القاعدة ، والذي يسمح للمسافات بين طبقتي الخلايا المستزرعتين معا بأن تكون 0.5 (A) و 1.0 (B) و 2.0 مم (C) ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
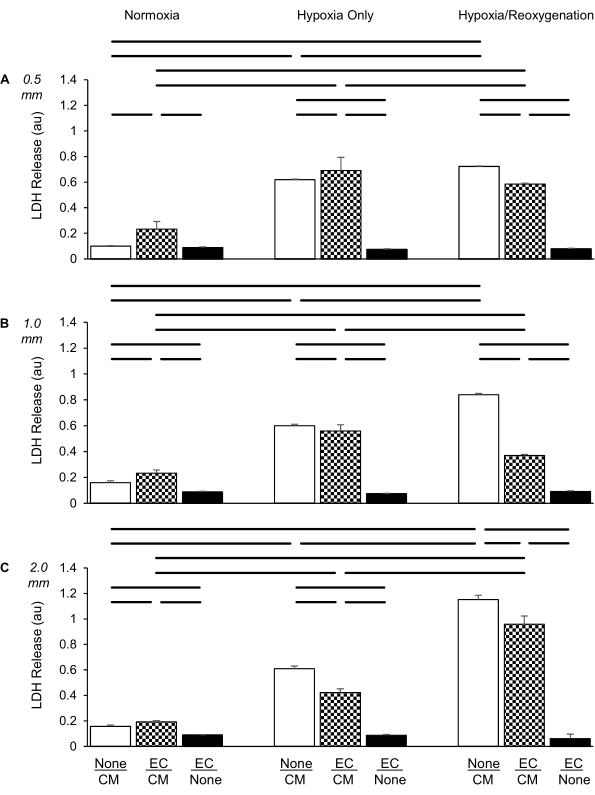
الشكل 4: مقارنة بين ثلاثة أنواع من إدخالات الاستزراع في تقييم إطلاق نازعة هيدروجيناز اللاكتات (LDH ؛ في وحدات الامتصاص [au]) تحت ظروف normoxic (يسار) ، ونقص الأكسجة فقط (في الوسط) ، ونقص الأكسجة / إعادة الأكسجين (يمين) للخلايا العضلية القلبية وحدها (CM ؛ أبيض) ، والخلايا البطانية وحدها (EC ؛ أسود) ، والثقافات المشتركة ل CM مع EC (نمط التحقق). (A) مسافة 0.5 مم ، (B) مسافة 1.0 مم ، (ج) مسافة 2.0 مم بين طبقتي الخلايا المختلفتين. تم طلاء ECs بكثافة 100000 خلية لكل إدراج ، CMs بكثافة 300000 خلية لكل بئر. البيانات هي متوسط ± الانحراف المعياري ، n = 4 لكل مجموعة. الإحصاءات: ANOVA تليها اختبار الطالب نيومان كيلز بعد المخصصات. P < 0.05 (ذو ذيلين) مشار إليه بأشرطة أفقية بين كل زوج مقارنة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
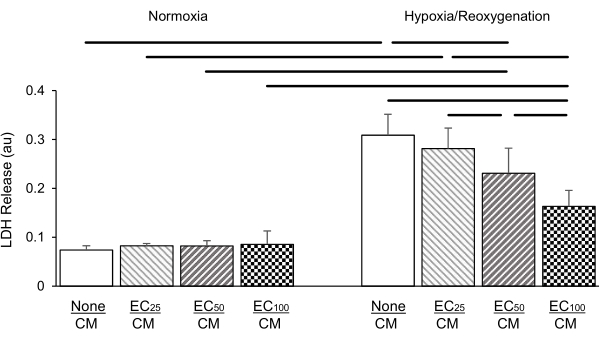
الشكل 5: تركيز الخلايا البطانية المستزرعة (EC؛ 25: 25000 خلية لكل إدراج؛ 50: 50000 خلية لكل إدراج؛ 100: 100000 خلية لكل إدراج) تتأثر بالجرعة حماية الخلايا العضلية القلبية (CM) ضد نقص الأكسجة / إصابة إعادة الأكسجين (يمين) مقارنة بالظروف المعيارية (يسار) كما يتضح من إطلاق نازعة هيدروجيناز اللاكتات (LDH؛ في وحدات الامتصاص [au]). ولم يكن للجماعات الأوروبية أي تأثير على إطلاق LDH في ظل الظروف المعيارية. البيانات هي متوسط ± الانحراف المعياري ، n = 4 لكل مجموعة. الإحصاءات: ANOVA تليها اختبار الطالب نيومان كيلز بعد المخصصات. P < 0.05 (ذو ذيلين) مشار إليه بأشرطة أفقية بين كل زوج مقارنة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الخطوات الحاسمة في البروتوكول
تم استخدام نماذج الزراعة المشتركة للخلايا لدراسة الآليات الخلوية لحماية القلب. وبالتالي ، فإن كيفية إنشاء طبقتين منفصلتين مع مسافة ذات مغزى بينهما أمر بالغ الأهمية لتطوير نموذج مناسب للثقافة المشتركة. التحدي في دراسة محاكاة الأشعة تحت الحمراء ، أي الموارد البشرية ، والإصابة هو أنه ليس فقط نقص التروية (نقص الأكسجة) نفسه ولكن أيضا إعادة التروية (إعادة الأكسجين) يؤدي إلى تفاقم الخلل الوظيفي الخلوي. لذلك ، يجب أن يعكس النموذج الواقعي هذه الخصائص من خلال ، على سبيل المثال ، إظهار زيادة كافية في الإصابة عن طريق إعادة الأكسجين بعد نقص الأكسجة بدلا من نقص الأكسجة وحده ، ولكن مع السماح بتخفيف الإصابة باستخدام الأدوية أو الاستراتيجيات الواقية للخلايا مثل ، في حالتنا ، وجود ECs. ومن المثير للاهتمام أن المسافة بين طبقتي الخلية يبدو أنها تلعب دورا مهما في تطوير نموذج مناسب للزراعة المشتركة. لقد تمكنا من إثبات أن مسافة 1.0 مم و 2.0 مم بين ECs و CMs سمحت بالاستجابة المتوقعة لإصابات الموارد البشرية ، ولكن الأهم من ذلك ، أن 2.0 مم فقط أسفرت عن نتيجة مواتية باستمرار للحماية من الإصابات الخلوية من خلال وجود ECs في ظل كل من ظروف نقص الأكسجة والموارد البشرية.
التعديلات واستكشاف الأخطاء وإصلاحها في الطريقة
تتأثر التفاعلات بين الخلايا والخلية في نماذج الاستزراع المشترك بمتغيرات متعددة مثل عدد المجموعات السكانية المتميزة المستزرعة بشكل مشترك ، ودرجة تشابه أنواع الخلايا ، ودرجة الفصل المادي بينها ، والفرق بين البيئات المحلية للسكان ، وحجم الثقافات وتوقيت النظر في الزراعة المشتركة9،10،11،12 . هناك مقايضات بين هذه العوامل. تتأثر هذه التفاعلات بشدة بالبيئة ، والتي يتم تحديدها بدورها من خلال البروتوكول والإعداد. من الأهمية بمكان تطوير نماذج تجريبية قابلة للتكرار والقياس والمقارنة. كان نهجنا هو التحكم والحد من عدد المتغيرات التي قد تعطل اتساق البيانات التي تم الحصول عليها من التجارب المختلفة التي أجريت في أوقات مختلفة من خلال طلاء عدد دقيق من الخلايا ، باستخدام نفس النسبة من خطين خلويين مستزرعين بشكل مشترك ، ونفس أحجام وسائط زراعة الخلايا وكواشف الفحص ، وما إلى ذلك ، باستثناء إدراج زراعة الخلايا الثلاثة المختلفة.
قيود الطريقة
يعمل نموذجنا بشكل جيد مع ECs و CMs ، ويرجع ذلك على الأرجح إلى وجود ECs في كل مكان في نظام القلب والأوعية الدموية. لم يتم بعد تقييم مدى تفاعل الأنواع الأخرى من خطوط الخلايا ذات الاهتمام المحتمل مع CMs أو الخلايا العصبية أو الخلايا الأخرى ذات الأهمية التي يجب دراستها في المختبر حيث يمكن أن تتفاعل خطوط الخلايا المختلفة بشكل مختلف في بيئة الزراعة المشتركة. يمكن أن يكون أحد الاختلافات بين مجموعات الخلايا المستزرعة المشتركة هو علاقتها البيئية ، على سبيل المثال ، إذا كانوا منافسين طبيعيين أو متعاونين. أيضا ، كما هو الحال في جميع نماذج الخلايا المخبرية الأخرى ، قد لا يمثل الضرر الخلوي الناتج في التجربة الحالة الفسيولوجية المرضية الفعلية للإصابة في الجسم الحي. وعلاوة على ذلك، فإننا نقر بأن المسافات التي تم اختبارها بين ECs و CMs من 0.5 و 1.0 و 2.0 مم لا تعيد إنتاج تباعدها في الجسم الحي؛ للنموذج المعطى في المختبر ؛ ومع ذلك ، فإن نتائجنا تصف الآثار المترتبة على التباعد الأمثل بين طبقتين من الخلايا لدراستها من قبل العلماء الذين يرغبون في الاستفادة من هذه التقنية.
أهمية الطريقة فيما يتعلق بالطرق القائمة / البديلة
وتشمل أساليب الاستزراع المشترك القائمة/البديلة الخلط المباشر لخطوط الخلايا أو تهيئة بيئة منفصلة بدرجة من الفصل مثل استخدام ألواح ترانسويل13 أو منصات الموائع الدقيقة 14 أو السقالات ثلاثية الأبعاد15، ومن بينها لوحات ترانسويل الأقل تكلفة والأسهل المتاحة. على الرغم من القيود الطبيعية ، فإن الثقافات المشتركة ذات صلة كبيرة بأبحاث الأدوية لأنها توفر نموذجا أكثر تمثيلا في الأنسجة الشبيهة بالجسم الحي وتسمح بإجراء اختبارات عالية الإنتاجية ومراقبة متعمقة لتأثيرات الدواء على تفاعلات الخلاياالخلوية 16. تمت معايرة نموذجنا بدقة باستخدام مسافات مكانية محددة جيدا بين ECs و CMs ، بدلا من مزيج كامل وغير منضبط من نوعين مختلفين من الخلايا. علاوة على ذلك ، يسمح هذا النموذج بعلاجات منفصلة ويحلل الأنواع الفردية من الخلايا ، وهو أمر مستحيل تحقيقه في ثقافة مختلطة ، ناهيك عن الجسم الحي. نظرا لأن إصابة الأشعة تحت الحمراء تنطوي على عمليات منفصلة للموارد البشرية ، فإن هذا النموذج مناسب تماما لدراسة الآليات الخلوية لنقص التروية / نقص الأكسجة مقابل تلف التروية / إعادة الأكسجين بشكل منفصل. تشير بياناتنا إلى أنه قد يكون نموذجا عالي القيمة والكفاءة للزراعة المشتركة للخلايا لاستخدامه في دراسات إصابات الأشعة تحت الحمراء المحاكاة. تشير ملاحظاتنا بوضوح إلى أن المسافة المكانية المثلى ، في حالتنا 2.0 مم ، ضرورية لل ECs للتحدث مع CMs في نموذج الثقافة المشتركة المحدد هذا ، بحيث يمكن لجزيئات الإشارة التي يحتمل أن تفرزها ECs أن تدور بفعالية للحماية غير المشروعة ل CMs ضد الإصابة بنقص الأكسجة فقط و / أو HR.
أهمية الأساليب وتطبيقاتها المحتملة في مجالات بحثية محددة
يشير نموذجنا إلى أهمية الجمع بين ECs الشريان التاجي للفأر و CMs للفأر لتحسين التحقيق في التدابير الوقائية ضد إصابة الموارد البشرية. أن تغيير المسافة المكانية للثقافات المشتركة يدل على طريقة فعالة لفهم الظروف المكانية التي تؤثر على الإجراءات الوقائية التي تتخذها الجماعات الأوروبية بشأن إصابة CM الناجمة عن الموارد البشرية فهما أفضل؛ وأن كثافة ECs أو نسبة EC-to-CM ترتبط ارتباطا إيجابيا بمدى الحماية من إصابة الموارد البشرية.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل ، جزئيا ، من قبل وزارة شؤون المحاربين القدامى الأمريكية خدمة البحث والتطوير في المختبرات الطبية الحيوية (I01 BX003482) ومن قبل الصناديق المؤسسية ل M.L.R.
Materials
| Name | Company | Catalog Number | Comments |
| Adult Mouse Cardiomyocytes (CMs) | Celprogen Inc | 11041-14 | Isolated from adult C57BL/6J mouse cardiac tissue |
| Automated Cell Counter Countess II | Invitrogen | A27977 | Cell counting for calculating cell numbers |
| Bio-Safety Cabinet | Nuaire | NU425400 | Cell culture sterile hood |
| Cell Culture Freezing Medium | Cell Biologics Inc | 6916 | Used for cell freezing for long term cell line storage |
| Cell Culture Incubator | Nuaire | Nu-5500 | To provide normal cell living condition (21%O2, 5%CO2, 74%N2, 37°C, humidified) |
| Cell Culture Incubator Gas Tank | A-L Compressed Gases | UN1013 | Gas needed for cell culture incubator |
| Cell Culture Inserts A (0.5 mm) | Corning Inc | 353095 | Used for EC-CM co-culture |
| Cell Culture Inserts B (1.0 mm) | Millicell Millipore | PIHP01250 | Used for EC-CM co-culture |
| Cell Culture Inserts C (2.0 mm) | Greiner Bio-One | 662640 | Used for EC-CM co-culture |
| Centrifuge | Anstel Enterprises Inc | 4235 | For cell culture plating and passaging |
| CMs Cell Culture Flasks T25 | Celprogen Inc | E11041-14 | Used for CMs regular culture, coated by manufacturer |
| CMs Cell Culture Medium Complete | Celprogen Inc | M11041-14S | CMs culture complete medium |
| CMs Cell Culture Medium Complete Phenol free | Celprogen Inc | M11041-14PN | CMs culture medium without phenol red used during LDH measurement |
| CMs Cell Culture Plates 96 well | Celprogen Inc | E11041-14-96well | Used for experiments of LDH measurement, coated by manufacturer |
| CMs Hypoxia Cell Culture Medium | Celprogen Inc | M11041-14GFPN | CMs cell culture under hypoxic condition (glucose- and serum-free) |
| Countess cell counting chamber slides | Invitrogen | C10283 | Counting slides used for cell counter |
| Cyquant LDH Cytotoxicity Kit | Thermo Scientific | C20301 | LDH measurement kit |
| ECs Cell Culture Flasks T25 | Fisher Scientific | FB012935 | Used for ECs regular culture |
| ECs Cell Culture Medium Complete | Cell Biologics Inc | M1168 | ECs culture complete medium |
| ECs Cell Culture Medium Complete Phenol free | Cell Biologics Inc | M1168PF | ECs culture medium without phenol red used during LDH measurement |
| ECs Cell Culture Plates 96 well | Fisher Scientific (Costar) | 3370 | Used for experiments of LDH measurement |
| ECs Culture Gelatin-Based Coating Solution | Cell Biologics Inc | 6950 | Used for coating flasks and plates for ECs |
| ECs Hypoxia Cell Culture Medium | Cell Biologics Inc | GPF1168 | ECs cell culture under hypoxic condition (glucose- and serum-free) |
| Fetal Bovine Serum (FBS) | Fisher Scientific | MT35011CV | FBS-HI USDA-approved for cell culture and maintenance |
| Hypoxia Chamber | StemCell Technologies | 27310 | To create a hypoxic condition with 0.01%O2 environment |
| Hypoxia Chamber Flow Meter | StemCell Technologies | 27311 | To connect with hypoxic gas tank for a consistent gas flow speed |
| Hypoxic Gas Tank (0.01%O2 Cylinder) | A-L Compressed Gases | UN1956 | Used to flush hypoxic medium and chamber (0.01%O2/5%CO2/94.99N2) |
| Microscope | Nikon | TMS | To observe cell condition |
| Mouse Primary Coronary Artery Endothelial Cells (ECs) | Cell Biologics Inc | C57-6093 | Isolated from coronary artery of C57BL/6 mice |
| NUNC 15ML CONICL Tubes | Fisher Scientific | 12565269 | For cell culture process, experiments, solution preparation etc. |
| NUNC 50ML CONICL Tubes | Fisher Scientific | 12565271 | For cell culture process, experiments, solution preparation etc. |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8662 | Used for cell washing during culture or experiments |
| Plate Reader | BioTek Instrument | 11120533 | Colorimetric or fluorometric plate reading |
| Reaction 96 Well Palte (clear no lid) | Fisher Scientific | 12565226 | Used for LDH measurement plate reading |
| Trypsin/EDTA for CMs | Celprogen Inc | T1509-014 | 1 x sterile filtered and tissue culture tested |
| Trypsin/EDTA for ECs | Cell Biologics Inc | 6914/0619 | 0.25%, cell cuture-tested |
References
- Hausenloy, D. J., et al. Ischaemic conditioning and targeting reperfusion injury: a 30 year voyage of discovery. Basic Research in Cardiology. 111 (6), 70 (2016).
- Hausenloy, D. J., Yellon, D. M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target. The Journal of Clinical Investigation. 123 (1), 92-100 (2013).
- Gottlieb, R. A. Cell death pathways in acute ischemia/reperfusion injury. Journal of Cardiovascular Pharmacology and Therapeutics. 16 (3-4), 233-238 (2011).
- Colliva, A., Braga, L., Giacca, M., Zacchigna, S. Endothelial cell-cardiomyocyte crosstalk in heart development and disease. The Journal of Physiology. 598 (14), 2923-2939 (2020).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology Journal. 8 (4), 395-396 (2013).
- Salzman, M. M., Bartos, J. A., Yannopoulos, D., Riess, M. L. Poloxamer 188 protects isolated adult mouse cardiomyocytes from reoxygenation injury. Pharmacology Research & Perspectives. 8 (6), 00639 (2020).
- Kalogeris, T., Baines, C. P., Krenz, M., Korthuis, R. J. Cell biology of ischemia/reperfusion injury. International Review of Cell and Molecular Biology. 298, 229-317 (2012).
- Martindale, J. J., Metzger, J. M. Uncoupling of increased cellular oxidative stress and myocardial ischemia reperfusion injury by directed sarcolemma stabilization. Journal of Molecular and Cellular Cardiology. 67, 26-37 (2014).
- vander Meer, A. D., Orlova, V. V., ten Dijke, P., vanden Berg, A., Mummery, C. L. Three-dimensional co-cultures of human endothelial cells and embryonic stem cell-derived pericytes inside a microfluidic device. Lab on a Chip. 13, 3562-3568 (2013).
- Bidarra, S. J., et al. Phenotypic and proliferative modulation of human mesenchymal stem cells via crosstalk with endothelial cells. Stem Cell Research. 7, 186-197 (2011).
- Campbell, J. J., Davidenko, N., Caffarel, M. M., Cameron, R. E., Watson, C. J. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PloS One. 6, 25661 (2011).
- Mehes, E., Mones, E., Nemeth, V., Vicsek, T. Collective motion of cells mediates segregation and pattern formation in co-cultures. PloS One. 7, 31711 (2012).
- Miki, Y., et al. The advantages of co-culture over mono cell culture in simulating in vivo environment. The Journal of Steroid Biochemistry and Molecular Biology. 131 (3-5), 68-75 (2012).
- Moraes, C., Mehta, G., Lesher-Perez, S. C., Takayama, S. Organs-on-a-chip: a focus on compartmentalized microdevices. Annals of Biomedical Engineering. 40 (6), 1211-1227 (2012).
- Campbell, J., Davidenko, N., Caffarel, M., Cameron, R., Watson, C. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PLoS One. 6, 25661 (2011).
- Wu, M. H., Huang, S. B., Lee, G. B. Microfluidic cell culture systems for drug research. Lab on a Chip. 10, 939-956 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved