Method Article
Desarrollo de un modelo de cocultivo celular para imitar la isquemia/reperfusión cardíaca in vitro
En este artículo
Resumen
La distancia espacial es un parámetro clave en la evaluación de la lesión por hipoxia/reoxigenación en un modelo de cocultivo de capas separadas de células endoteliales y cardiomiocitarias, lo que sugiere, por primera vez, que la optimización del entorno espacial de cocultivo es necesaria para proporcionar un modelo in vitro favorable para probar el papel de las células endoteliales en la protección de los cardiomiocitos.
Resumen
La cardiopatía isquémica es la principal causa de muerte y discapacidad en todo el mundo. La reperfusión causa lesiones adicionales más allá de la isquemia. Las células endoteliales (CE) pueden proteger a los cardiomiocitos (CM) de la lesión por reperfusión a través de las interacciones célula-célula. Los cocultivos pueden ayudar a investigar el papel de las interacciones célula-célula. Un cocultivo mixto es el enfoque más simple, pero es limitado ya que los tratamientos aislados y los análisis posteriores de tipos de células individuales no son factibles. Para investigar si las CE pueden atenuar el daño de las células CM dependiendo de la dosis y si esta protección puede optimizarse aún más variando la distancia de contacto entre las dos líneas celulares, utilizamos células endoteliales de la arteria coronaria primaria de ratón y cardiomiocitos de ratón adulto para probar tres tipos de insertos de cultivo celular que variaron en su distancia de capa intercelular a 0,5, 1,0 y 2,0 mm, respectivamente. Solo en los CM, la lesión celular evaluada por la liberación de lactato deshidrogenasa (LDH) aumentó significativamente durante la hipoxia y más adelante tras la reoxigenación cuando la distancia fue de 2,0 mm en comparación con 0,5 y 1,0 mm. Cuando los CE y los CM estaban en contacto casi directo (0,5 mm), solo hubo una atenuación leve de la lesión por reoxigenación de los CM después de la hipoxia. Esta atenuación aumentó significativamente cuando la distancia espacial fue de 1,0 mm. Con una distancia de 2,0 mm, las CE atenuaron la lesión de CM durante la hipoxia y la hipoxia / reoxigenación, lo que indica que es necesario un distanciamiento de cultivo suficiente para que las CE se diaguen con los CM, de modo que las moléculas de señal secretadas puedan circular y estimular completamente las vías protectoras. Nuestros hallazgos sugieren, por primera vez, que la optimización del entorno espacial de cocultivo CE/CM es necesaria para proporcionar un modelo in vitro favorable para probar el papel de las CE en la protección contra la CM contra la lesión simulada de isquemia/reperfusión. El objetivo de este informe es proporcionar un enfoque paso a paso para que los investigadores utilicen este importante modelo a su favor.
Introducción
La cardiopatía isquémica es la principal causa de muerte y discapacidad en todo el mundo 1,2. Sin embargo, el proceso de tratamiento de la reperfusión puede causar la muerte de los cardiomiocitos, conocida como lesión por isquemia/reperfusión (IR) miocárdica, para la cual todavía no existe un remedio efectivo3. Se ha sugerido que las células endoteliales (CE) protegen los cardiomiocitos (CM) a través de la secreción de señales paracrinas, así como las interacciones de célula a célula4.
Los modelos de cocultivo celular se han utilizado ampliamente para investigar el papel de las interacciones célula-célula autocrina y /o paracrina en la función y diferenciación celular. Entre los modelos de cocultivo, el cocultivo mixto es el más simple, donde dos tipos diferentes de células están en contacto directo dentro de un solo compartimento de cultivo en una proporción celular deseada5. Sin embargo, los tratamientos separados entre tipos de células y el análisis posterior de un solo tipo de célula no son fácilmente factibles dada la población mixta.
Estudios previos indicaron que los insultos hipóxicos e isquémicos causan un daño significativo a la integridad de la membrana celular medido por la liberación de lactato deshidrogenasa (LDH). Esta lesión empeora con la reoxigenación, imitando la lesión por reperfusión 6,7,8. El objetivo del protocolo actual era probar las hipótesis de que la presencia de CE puede atenuar la pérdida de CM en la membrana celular causada por hipoxia y reoxigenación (HR) y que el efecto protector de las CE puede optimizarse variando la distancia de contacto entre las dos líneas celulares. Por lo tanto, empleamos tres tipos de insertos de cultivo celular y células endoteliales de la arteria coronaria primaria del ratón y cardiomiocitos de ratón adulto. Los insertos, marcados por Corning, Merck Millipore y Greiner Bio-One, nos permitieron crear tres condiciones de diafonía de cultivo celular diferentes con distancias de línea intercelular de 0.5, 1.0 y 2.0 mm, respectivamente. Se enchaparon 100.000 CE por inserto en cada caso.
Además, para determinar si la densidad de LAS CE en el cocultivo contribuye a la atenuación de la lesión de la FC en este modelo, estudiamos la relación dosis-respuesta entre la concentración de CE y la liberación de LDH por los CM. Las CE se enchaparon en 25.000, 50.000 y 100.000 por inserto, respectivamente, en el inserto de 2,0 mm.
Este informe proporciona un enfoque paso a paso para que los investigadores utilicen este importante modelo a su favor.
Protocolo
1. Preparación/emplatado experimental
- Mantenga los CM y ECs de acuerdo con las instrucciones del fabricante.
- Descongele ambas líneas celulares cuando lleguen de los vendedores. Placa en matraces T25 después de ser lavada con medios frescos. Se recomienda comprar cada medio de cultivo celular de los mismos proveedores a los que se compraron las células. Al día siguiente, actualice las celdas con medios y úselos cuando sean confluentes.
- Mantener la incubadora de cultivo celular a 37 °C con 21% O2, 5% CO2, 74% N2 y mantenerla humidificada.
NOTA: Las células endoteliales de la arteria coronaria primaria del ratón utilizadas en este protocolo se aíslan de las arterias coronarias de ratones C57BL/6, y los cardiomiocitos de ratón adultos se aíslan de corazones de ratón adultos C57BL/6J y se obtienen comercialmente (ver Tabla de materiales).
- Placas CM en condiciones estériles en el fondo de placas de 24 pocillos (capa inferior). 24 h más tarde, placa eCs en el inserto (o porción superior) del pozo de co-cultivo. 24 h después del recubrimiento EC, coloque los insertos EC sobre las bases de la placa CM, comenzando el período de cocultivo. Permita que las células se coculten durante al menos 12-24 h antes de su uso. Estos pasos se describen en detalle a continuación.
- Estimar la confluencia de la línea celular CM bajo un microscopio de luz. Cuando las células parezcan ser 90% -100% confluentes en matraces de cultivo, proceda con el recubrimiento experimental.
- Retire los medios de los matraces que contienen cultivos celulares confluentes y tripsinize con 3-5 ml de ácido tripsina/etilendiaminotetraacético (EDTA) para los matraces T25. Agite el matraz suavemente, incube a 37 ° C durante 2-5 min y luego evalúe el progreso enzimático bajo un microscopio de luz. Una vez que las celdas comiencen a redondearse, use un raspador de celdas para separar las celdas de la superficie.
- Después del desprendimiento, inactive la solución de tripsina agregando la solución de tripsina/célula a un tubo de 50 ml que contenga 10 ml de medios para los matraces T25. Centrifugar la suspensión celular a 120 x g durante 2 min para obtener un pellet de células blandas. Retire el sobrenadante y vuelva a suspender el pellet en 5 ml de medios.
- Para realizar el conteo celular y confirmar la viabilidad celular, mezcle una alícuota de 10 μL de células resuspendidas y 10 μL de colorante azul tripano. Cuente las células vivas usando un contador de células. Diluya las células con medios regulares frescos para lograr las densidades de siembra deseadas. Los volúmenes se calculan en función de la densidad de semillas deseada y la concentración celular de las soluciones madre. Todo el recubrimiento debe realizarse en condiciones estériles.
- Placas CM a densidades de siembra de 300,000 por pozo en el fondo de una placa de 24 pocillos pre-recubierta con matriz extracelular. Mantenga las células a 37 °C con 21% de O2 y 5% de CO2 durante la noche.
- Después de 24 h, las CE de placa se insertan a una densidad óptima de chapado de 100.000 por inserto (el área de cultivo es de 33,6 mm2), (Figura 1). Después de 24 h de recubrimiento EC, coloque insertos EC dentro de los pozos CM, iniciando el cocultivo. Permita que las células coculten durante 12-24 h antes de realizar los experimentos.
- Asegúrese de que, para cuando se realicen los experimentos, tanto los CM como los CE hayan alcanzado una confluencia del 80% al 90%.
2. Hipoxia/reoxigenación para simular lesión por isquemia/reperfusión in vitro
NOTA: Los siguientes pasos deben realizarse como se describe, no se detenga en el medio.
- Prepare los medios hipóxicos vertiendo ~ 25 ml de medios en un tubo cónico de 50 ml. Selle al aire la parte superior con una membrana de silicona y use una pipeta esterilizada para perforar un agujero. Cree otro agujero, esta vez dejando la pipeta sumergida aproximadamente 2/3 en el medio.
- Enjuague el medio con gas hipóxico (0,0125% O2, 5% CO2, 94,99% N2) durante 5 min a un caudal de 30 L/min. Esto minimiza el O2 disuelto en el medio cuando comienza la hipoxia (paso 2.5).
- Deseche los medios de las placas de 24 pocillos o insertos de cultivo que contienen células adheridas y lave con 100 μL/pocillo de solución salina tamponada con fosfato al 10% (PBS) muy suavemente. Después, agregue 500 μL de los medios hipóxicos recién preparados a cada pocillo de las placas o insertos.
NOTA: La hipoxia en los medios se interrumpe lo más brevemente posible durante este paso antes de que comience la hipoxia verdadera para las células y los medios en el paso 2.5.- En el grupo de control normóxico, reemplace el medio original con medios normales frescos que contengan glucosa y suero.
- Humidifique la cámara de hipoxia colocando una placa de Petri llena de agua estéril dentro de la cámara. A continuación, coloque las placas que comprenden los grupos hipóxicos en la cámara.
- Enjuague la cámara de hipoxia con gas hipóxico (0,0125% O2, 5% CO2, 94,99% N2) durante 5 min a un caudal de 30 L/min. Coloque la cámara en la incubadora de 37 °C durante 24 h.
- Después de la hipoxia, cultive CM y CE en condiciones normales. Para ello, deseche el medio viejo de las placas/insertos, reemplácelo por medio normal (que contenga glucosa y suero; 500 μL de cada pocillo/inserto) y guárdelo en la incubadora en condiciones normales de cultivo (21% O2, 5% CO2, 74% N2, 37 °C) durante 2 h para imitar la reperfusión.
- Para controlar cualquier efecto del reemplazo de medios, cambie los medios de las células normóxicas al mismo tiempo que se cambian los medios hipóxicos.
Nota : la figura 2 proporciona una descripción general esquemática de este protocolo.
3. Evaluación de endpoints
- Transfiera los medios de cultivo celular de la placa de 24 pocillos a una placa de 96 pocillos. Use 200 μL de medios de cada pozo de la placa de 24 pocillos y distribuya equitativamente en cuatro pozos de la placa de 96 pocillos, en consecuencia. Use una placa cada una para normoxia versus hipoxia versus HR.
- Determine el grado de lesión celular, por ejemplo, midiendo la absorbancia de la LDH utilizando un kit de ensayo de citotoxicidad siguiendo las instrucciones del fabricante. Realice el ensayo en una placa de 96 pocillos según las instrucciones del protocolo de ensayo.
4. Estadísticas
- Muestre los datos paramétricos como media/desviación estándar y los datos no paramétricos como gráficos de caja con rango mediano/intercuartílico. Se deben realizar pruebas de comparaciones múltiples paramétricas versus no paramétricas adecuadas con pruebas post-hoc aceptables para disminuir la posibilidad de un error de tipo 1. La significación se establece típicamente en un alfa de 0.05 (dos colas).
- Para todos los experimentos llevados a cabo en el estudio actual, realice al menos tres réplicas de pozos dentro de un experimento. Hubo de tres a seis repeticiones de cada experimento utilizado para el análisis estadístico.
Resultados
Los tres tipos de insertos (A, B, C) utilizados en este experimento tienen el mismo tamaño de poro de 0,4 μm. La única diferencia entre ellos es la altura de inserción a base, que permite que las distancias entre las dos capas de células cocultivadas sean de 0,5, 1,0 y 2,0 mm, respectivamente, (Figura 3) y que sean de diferentes proveedores (para más detalles, consulte la Tabla de materiales).
Para establecer un modelo de cocultivo in vitro con capas separadas de dos líneas celulares sometidas a FC para simular la lesión por IR, examinamos la integridad de la membrana celular de los CM cocultivados con o sin CE. La utilización de un inserto separado para las CE que se puede colocar a distancias variadas por encima de la capa CM nos permitió también evaluar los efectos diferenciales de la distancia de la capa celular en la gravedad del daño de la membrana en los CM. En un conjunto separado de experimentos, variamos la densidad de las CE y, por lo tanto, la proporción de CE a CM. Además, para diferenciar la isquemia simulada de la lesión IR simulada, se llevaron a cabo experimentos en condiciones de 1) normoxia, 2) hipoxia solamente y 3) HR. Para este modelo, se utilizó hipoxia de 24 h, seguida de 2 h de reoxigenación.
Distancias variables
Distancia de 0,5 mm entre las capas de celda (Insertar A)
Cuando los CM se cultivaron solos, la hipoxia condujo a un aumento significativo de la liberación de LDH en comparación con la normoxia, consistente con nuestros estudios previos (Figura 4A)6. Sin embargo, la LDH solo aumentó ligeramente después de la reoxigenación de 2 horas en comparación con el grupo de hipoxia solamente. Cuando las CE y los CM se cocultivaron juntos a una distancia de 0,5 mm, el aumento en la liberación de LDH por hipoxia solamente no se atenuó, lo que indica que los CE no mostraron ningún efecto protector (en comparación con los CM solos en el grupo bajo las condiciones de hipoxia sola). Sin embargo, las CE ejercieron una protección leve pero significativa en los CM durante la FC.
Distancia de 1,0 mm entre las capas de celda (Insertar B)
El mismo experimento se realizó como el anterior, excepto que la distancia entre las dos capas celulares se incrementó a 1,0 mm (Figura 4B). Encontramos que la liberación de LDH también aumentó significativamente en los CM solo por hipoxia. Sin embargo, a diferencia del inserto de 0,5 mm, el aumento de la LDH en los CM solo fue potenciado por la FC sobre la hipoxia solamente. Además, esta potenciación fue más inhibida y casi abolida por la presencia de las CE durante la reoxigenación en comparación con el grupo de solo CM.
Distancia de 2,0 mm entre las capas de celda (Insertar C)
Cuando se utilizaron insertos de cocultivo que crean una distancia de 2,0 mm entre las dos líneas celulares (Figura 4C), también encontramos un aumento significativo de la liberación de LDH por CM,solo durante la hipoxia, en el mismo grado que en los experimentos de 0,5 mm y 1,0 mm. Curiosamente, sin embargo, el aumento adicional en la liberación de LDH por reoxigenación fue aún más pronunciado que en los experimentos de 1,0 mm. Ambos aumentos fueron atenuados, aunque no abolidos, por la presencia de CE, lo que indica que, a diferencia del uso de insertos de 0,5 o 1,0 mm, los CE protegieron significativamente a los CM de lesiones tanto en condiciones de hipoxia como de FC.
Intensidades EC variables
En un conjunto diferente de experimentos, la concentración de CE chapadas en insertos de 2,0 mm se tituló a 25.000, 50.000 y 100.000 células por inserto, respectivamente. La liberación de LDH se midió después de 24 h de hipoxia seguida de 2 h de reoxigenación. Nuestros resultados mostraron que el aumento de la intensidad de la CE en el cocultivo condujo a una atenuación dependiente de la dosis de la liberación de LDH causada por la FC (Figura 5); no se observó tal efecto en condiciones normóxicas.
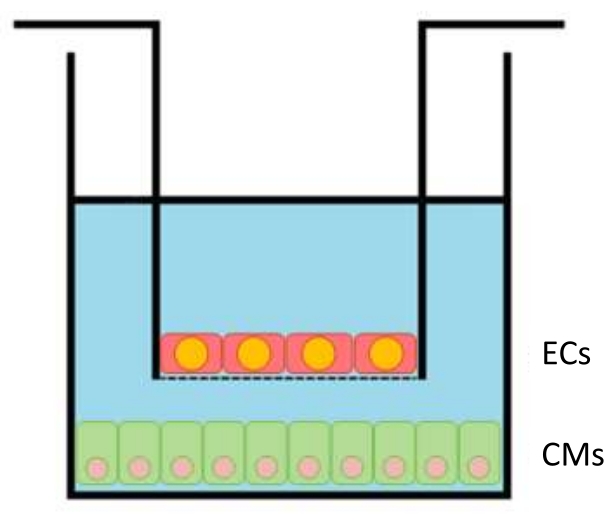
Figura 1: Esquema de inserción dentro del pozo. Los insertos con las CE (hasta 100.000 celdas por inserto) se transfieren a las placas de 24 pocillos con los CM (300.000 por pozo) en su parte inferior. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diseño experimental. Las células se cultivan en condiciones normales de oxígeno (21% O2), y luego se dividen en dos grupos: un grupo de control normóxico continuará cultivándose en condiciones normales durante otras 24 h, mientras que el grupo de hipoxia se cultivará en una cámara de hipoxia durante 24 h con solo 0.01% O2 y sin glucosa. Después de estas intervenciones de 24 h, ambos grupos de células se actualizan con medios y se cultivan continuamente en un entorno de 21% O2 durante otras 2 h, la fase de reoxigenación, antes de realizar finalmente los ensayos finales, por ejemplo, el análisis de LDH. Haga clic aquí para ver una versión más grande de esta figura.
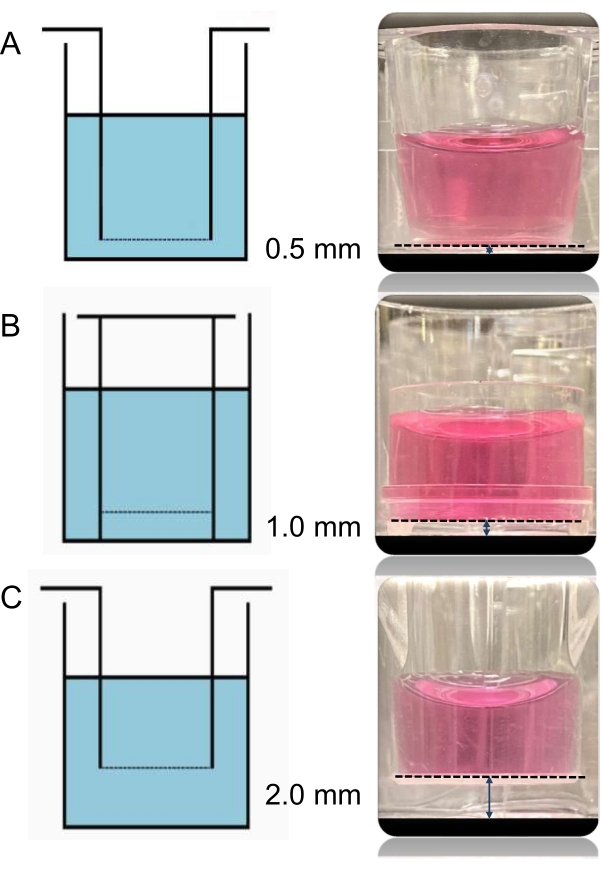
Figura 3: Imágenes y esquemas de los tres insertos diferentes. La distancia entre las células endoteliales en el inserto y los cardiomiocitos en el fondo del pozo se puede variar mediante el uso de diferentes insertos. Los tres tipos de insertos utilizados aquí tienen el mismo tamaño de poro de 0,4 μm. La única diferencia entre ellos es la altura de inserción a base, que permite que las distancias entre las dos capas de células cocultivadas sean de 0.5 (A), 1.0 (B) y 2.0 mm (C), respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
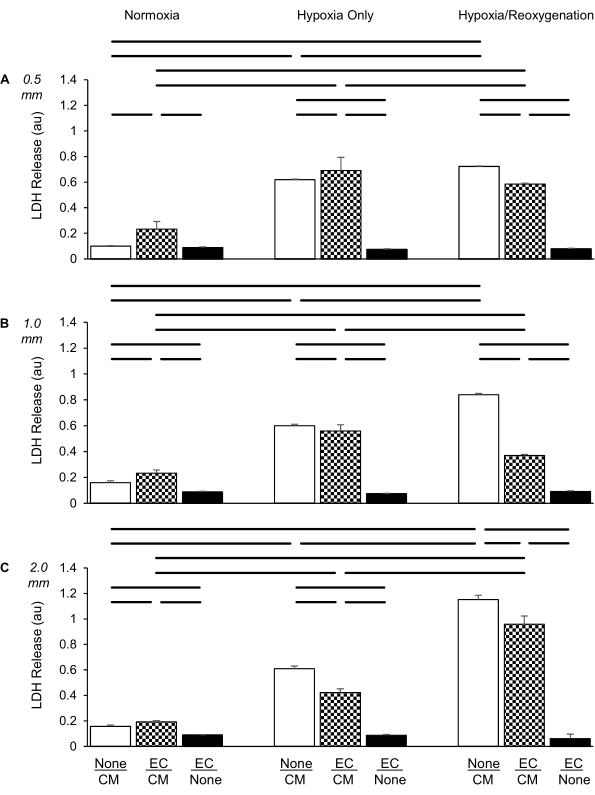
Figura 4: Comparación de tres tipos de insertos de cultivo para evaluar la liberación de lactato deshidrogenasa (LDH; en unidades de absorbancia [au]) en condiciones normóxicas (izquierda), hipoxia sola (centro) e hipoxia/reoxigenación (derecha) para cardiomiocitos solos (CM; blanco), células endoteliales solas (EC; negro) y cocultivos de CM con CE (patrón de control). (A) Distancia de 0,5 mm, (B) Distancia de 1,0 mm, (C) Distancia de 2,0 mm entre las dos capas de celdas diferentes. Los CE se enchaparon a una densidad de 100.000 células por inserto, los CM a una densidad de 300.000 células por pozo. Los datos son medios ± desviación estándar, n = 4 por grupo. Estadísticas: ANOVA seguido de la prueba post-hoc Student-Newman-Keuls. P < 0,05 (de dos colas) indicado por barras horizontales entre cada par comparado. Haga clic aquí para ver una versión más grande de esta figura.
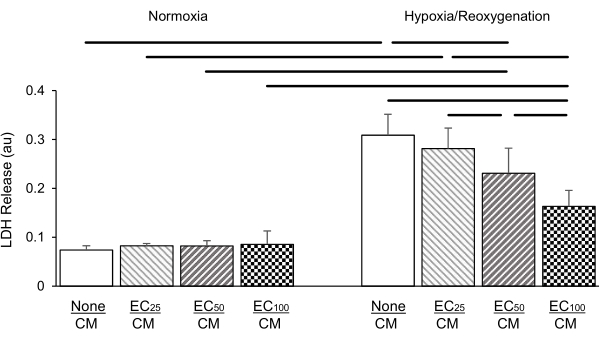
Figura 5: Concentración de células endoteliales cocultivadas (CE; 25: 25.000 células por inserto; 50: 50.000 células por inserto; 100: 100.000 células por inserto) protección de cardiomiocitos (CM) afectada por la dosis contra la lesión por hipoxia/reoxigenación (derecha) en comparación con las condiciones normóxicas (izquierda) como lo demuestra la liberación de lactato deshidrogenasa (LDH; en unidades de absorbancia [au]). Las CE no tuvieron ningún efecto sobre la liberación de LDH en condiciones normóxicas. Los datos son medios ± desviación estándar, n = 4 por grupo. Estadísticas: ANOVA seguido de la prueba post-hoc Student-Newman-Keuls. P < 0,05 (de dos colas) indicado por barras horizontales entre cada par comparado. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Pasos críticos en el protocolo
Se han utilizado modelos de cocultivo celular para estudiar los mecanismos celulares de cardioprotección. Cómo crear dos capas separadas con una distancia significativa entre ellas es, por lo tanto, crucial para el desarrollo de un modelo de co-cultura adecuado. Un desafío en el estudio de la lesión por IR simulada, es decir, la FC, es que no solo la isquemia (hipoxia) en sí, sino también la reperfusión (reoxigenación) agrava la disfunción celular. Por lo tanto, un modelo realista debe reflejar estas características, por ejemplo, demostrando un aumento suficiente de la lesión por reoxigenación después de la hipoxia en lugar de la hipoxia sola, pero aún permitiendo la atenuación de la lesión con medicamentos o estrategias de protección celular como, en nuestro caso, la presencia de CE. Curiosamente, la distancia entre las dos capas celulares parece desempeñar un papel importante en el desarrollo de un modelo de cocultivo adecuado. Pudimos demostrar que una distancia de 1,0 mm y 2,0 mm entre las CE y los CM permitió la respuesta esperada a la lesión de LA FC, pero, lo que es más importante, que solo 2,0 mm produjo un resultado consistentemente favorable para la protección de lesiones celulares por la presencia de CE en condiciones hipóxicas y hr.
Modificaciones y solución de problemas del método
Las interacciones célula-célula en los modelos de cocultivo se ven afectadas por múltiples variables como el número de poblaciones cocultivadas distintas, el grado de similitud de los tipos de células, el grado de separación física entre ellas, la diferencia entre los entornos locales de la población, el volumen de cultivos y la consideración temporal del cocultivo 9,10,11,12 . Existen compensaciones entre estos factores. Estas interacciones se ven fuertemente afectadas por el entorno, que a su vez está determinado por el protocolo y la configuración. Es fundamental desarrollar modelos experimentales que sean replicables, medibles y comparables. Nuestro enfoque fue controlar y limitar el número de variables que pueden alterar la consistencia de los datos obtenidos de diferentes experimentos realizados en diferentes momentos a través del recubrimiento de un número preciso de células, utilizando la misma proporción de dos líneas celulares cocultivadas, los mismos volúmenes de los medios de cultivo celular y los reactivos de ensayo, etc., con la excepción de los tres insertos de cultivo celular diferentes.
Limitaciones del método
Nuestro modelo funciona bien con ECs y CMs, probablemente debido a la presencia ubicua de ECs en el sistema cardiovascular. Aún no se ha evaluado qué tan bien interactúan otros tipos de líneas celulares de interés potencial con CM, neuronas u otras células de interés que se estudiarán in vitro , ya que diferentes líneas celulares podrían interactuar de manera diferente en el entorno del cocultivo. Una diferencia entre las poblaciones de células cocultivadas podría ser su relación ecológica, por ejemplo, si son competidores naturales o cooperadores. Además, como en todos los demás modelos celulares in vitro , el daño celular generado en el experimento podría no representar el estado fisiopatológico real de lesión in vivo. Además, reconocemos que las distancias probadas entre las CE y los CM de 0,5, 1,0 y 2,0 mm no reproducen su espaciado in vivo; para el modelo in vitro dado; sin embargo, nuestros resultados describen las implicaciones del distanciamiento óptimo entre dos capas celulares para ser estudiados por científicos que deseen aprovechar esta técnica.
La importancia del método con respecto a los métodos existentes/alternativos
Los métodos de cocultivo existentes/alternativos incluyen la mezcla directa de líneas celulares o la creación de un entorno separado con un grado de separación, como el uso de placas transwell13, plataformas microfluídicas14 o andamios tridimensionales15, entre los cuales las placas transwell son las menos costosas y más fáciles disponibles. A pesar de las limitaciones naturales, los cocultivos son muy relevantes para la investigación de fármacos porque proporcionan un modelo de tejido in vivo más representativo y permiten realizar pruebas de alto rendimiento y monitorear en profundidad los efectos de los medicamentos en las interacciones célula-célula16. Nuestro modelo se calibró con precisión utilizando distancias espaciales bien definidas entre ECs y CMs, en lugar de una mezcla completa e incontrolada de dos tipos diferentes de células. Además, este modelo permite tratamientos separados y analiza tipos individuales de células, lo que es imposible de lograr en un cocultivo mixto, sin mencionar in vivo. Debido a que la lesión POR INFRARROJOS implica procesos de FC separados, este modelo es muy adecuado para estudiar los mecanismos celulares de la isquemia / hipoxia frente al daño de reperfusión / reoxigenación por separado. Nuestros datos sugieren que puede ser un modelo de cocultivo celular altamente valioso y eficiente para ser utilizado en estudios simulados de lesiones por INFRARROJOS. Nuestras observaciones indican claramente que una distancia espacial óptima, en nuestro caso de 2,0 mm, es necesaria para que las CE puedan diafonía con las CM en este modelo específico de cocultivo, de modo que las moléculas de señalización potencialmente secretadas por las CE puedan circular de manera efectiva a la protección ilícita de las CM contra lesiones por hipoxia sola y / o FC.
Importancia y aplicaciones potenciales de los métodos en áreas de investigación específicas
Nuestro modelo indica la importancia de combinar las CE de la arteria coronaria del ratón con los CM de ratón para mejorar la investigación de las medidas de protección contra la lesión de la FC; que la variación de la distancia espacial de los cocultivos demuestra una forma eficaz de comprender mejor las condiciones espaciales que afectan a la acción protectora de las CE sobre la lesión por CM causada por la FC; y que la densidad de las CE o la relación CE-CM se correlaciona positivamente con el grado de protección contra el daño por HR.
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado, en parte, por el Servicio de I + D del Laboratorio Biomédico del Departamento de Asuntos de Veteranos de los Estados Unidos (I01 BX003482) y por fondos institucionales a M.L.R.
Materiales
| Name | Company | Catalog Number | Comments |
| Adult Mouse Cardiomyocytes (CMs) | Celprogen Inc | 11041-14 | Isolated from adult C57BL/6J mouse cardiac tissue |
| Automated Cell Counter Countess II | Invitrogen | A27977 | Cell counting for calculating cell numbers |
| Bio-Safety Cabinet | Nuaire | NU425400 | Cell culture sterile hood |
| Cell Culture Freezing Medium | Cell Biologics Inc | 6916 | Used for cell freezing for long term cell line storage |
| Cell Culture Incubator | Nuaire | Nu-5500 | To provide normal cell living condition (21%O2, 5%CO2, 74%N2, 37°C, humidified) |
| Cell Culture Incubator Gas Tank | A-L Compressed Gases | UN1013 | Gas needed for cell culture incubator |
| Cell Culture Inserts A (0.5 mm) | Corning Inc | 353095 | Used for EC-CM co-culture |
| Cell Culture Inserts B (1.0 mm) | Millicell Millipore | PIHP01250 | Used for EC-CM co-culture |
| Cell Culture Inserts C (2.0 mm) | Greiner Bio-One | 662640 | Used for EC-CM co-culture |
| Centrifuge | Anstel Enterprises Inc | 4235 | For cell culture plating and passaging |
| CMs Cell Culture Flasks T25 | Celprogen Inc | E11041-14 | Used for CMs regular culture, coated by manufacturer |
| CMs Cell Culture Medium Complete | Celprogen Inc | M11041-14S | CMs culture complete medium |
| CMs Cell Culture Medium Complete Phenol free | Celprogen Inc | M11041-14PN | CMs culture medium without phenol red used during LDH measurement |
| CMs Cell Culture Plates 96 well | Celprogen Inc | E11041-14-96well | Used for experiments of LDH measurement, coated by manufacturer |
| CMs Hypoxia Cell Culture Medium | Celprogen Inc | M11041-14GFPN | CMs cell culture under hypoxic condition (glucose- and serum-free) |
| Countess cell counting chamber slides | Invitrogen | C10283 | Counting slides used for cell counter |
| Cyquant LDH Cytotoxicity Kit | Thermo Scientific | C20301 | LDH measurement kit |
| ECs Cell Culture Flasks T25 | Fisher Scientific | FB012935 | Used for ECs regular culture |
| ECs Cell Culture Medium Complete | Cell Biologics Inc | M1168 | ECs culture complete medium |
| ECs Cell Culture Medium Complete Phenol free | Cell Biologics Inc | M1168PF | ECs culture medium without phenol red used during LDH measurement |
| ECs Cell Culture Plates 96 well | Fisher Scientific (Costar) | 3370 | Used for experiments of LDH measurement |
| ECs Culture Gelatin-Based Coating Solution | Cell Biologics Inc | 6950 | Used for coating flasks and plates for ECs |
| ECs Hypoxia Cell Culture Medium | Cell Biologics Inc | GPF1168 | ECs cell culture under hypoxic condition (glucose- and serum-free) |
| Fetal Bovine Serum (FBS) | Fisher Scientific | MT35011CV | FBS-HI USDA-approved for cell culture and maintenance |
| Hypoxia Chamber | StemCell Technologies | 27310 | To create a hypoxic condition with 0.01%O2 environment |
| Hypoxia Chamber Flow Meter | StemCell Technologies | 27311 | To connect with hypoxic gas tank for a consistent gas flow speed |
| Hypoxic Gas Tank (0.01%O2 Cylinder) | A-L Compressed Gases | UN1956 | Used to flush hypoxic medium and chamber (0.01%O2/5%CO2/94.99N2) |
| Microscope | Nikon | TMS | To observe cell condition |
| Mouse Primary Coronary Artery Endothelial Cells (ECs) | Cell Biologics Inc | C57-6093 | Isolated from coronary artery of C57BL/6 mice |
| NUNC 15ML CONICL Tubes | Fisher Scientific | 12565269 | For cell culture process, experiments, solution preparation etc. |
| NUNC 50ML CONICL Tubes | Fisher Scientific | 12565271 | For cell culture process, experiments, solution preparation etc. |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8662 | Used for cell washing during culture or experiments |
| Plate Reader | BioTek Instrument | 11120533 | Colorimetric or fluorometric plate reading |
| Reaction 96 Well Palte (clear no lid) | Fisher Scientific | 12565226 | Used for LDH measurement plate reading |
| Trypsin/EDTA for CMs | Celprogen Inc | T1509-014 | 1 x sterile filtered and tissue culture tested |
| Trypsin/EDTA for ECs | Cell Biologics Inc | 6914/0619 | 0.25%, cell cuture-tested |
Referencias
- Hausenloy, D. J., et al. Ischaemic conditioning and targeting reperfusion injury: a 30 year voyage of discovery. Basic Research in Cardiology. 111 (6), 70 (2016).
- Hausenloy, D. J., Yellon, D. M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target. The Journal of Clinical Investigation. 123 (1), 92-100 (2013).
- Gottlieb, R. A. Cell death pathways in acute ischemia/reperfusion injury. Journal of Cardiovascular Pharmacology and Therapeutics. 16 (3-4), 233-238 (2011).
- Colliva, A., Braga, L., Giacca, M., Zacchigna, S. Endothelial cell-cardiomyocyte crosstalk in heart development and disease. The Journal of Physiology. 598 (14), 2923-2939 (2020).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology Journal. 8 (4), 395-396 (2013).
- Salzman, M. M., Bartos, J. A., Yannopoulos, D., Riess, M. L. Poloxamer 188 protects isolated adult mouse cardiomyocytes from reoxygenation injury. Pharmacology Research & Perspectives. 8 (6), 00639 (2020).
- Kalogeris, T., Baines, C. P., Krenz, M., Korthuis, R. J. Cell biology of ischemia/reperfusion injury. International Review of Cell and Molecular Biology. 298, 229-317 (2012).
- Martindale, J. J., Metzger, J. M. Uncoupling of increased cellular oxidative stress and myocardial ischemia reperfusion injury by directed sarcolemma stabilization. Journal of Molecular and Cellular Cardiology. 67, 26-37 (2014).
- vander Meer, A. D., Orlova, V. V., ten Dijke, P., vanden Berg, A., Mummery, C. L. Three-dimensional co-cultures of human endothelial cells and embryonic stem cell-derived pericytes inside a microfluidic device. Lab on a Chip. 13, 3562-3568 (2013).
- Bidarra, S. J., et al. Phenotypic and proliferative modulation of human mesenchymal stem cells via crosstalk with endothelial cells. Stem Cell Research. 7, 186-197 (2011).
- Campbell, J. J., Davidenko, N., Caffarel, M. M., Cameron, R. E., Watson, C. J. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PloS One. 6, 25661 (2011).
- Mehes, E., Mones, E., Nemeth, V., Vicsek, T. Collective motion of cells mediates segregation and pattern formation in co-cultures. PloS One. 7, 31711 (2012).
- Miki, Y., et al. The advantages of co-culture over mono cell culture in simulating in vivo environment. The Journal of Steroid Biochemistry and Molecular Biology. 131 (3-5), 68-75 (2012).
- Moraes, C., Mehta, G., Lesher-Perez, S. C., Takayama, S. Organs-on-a-chip: a focus on compartmentalized microdevices. Annals of Biomedical Engineering. 40 (6), 1211-1227 (2012).
- Campbell, J., Davidenko, N., Caffarel, M., Cameron, R., Watson, C. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PLoS One. 6, 25661 (2011).
- Wu, M. H., Huang, S. B., Lee, G. B. Microfluidic cell culture systems for drug research. Lab on a Chip. 10, 939-956 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados