Method Article
Sviluppo di un modello di co-coltura cellulare per imitare l'ischemia/riperfusione cardiaca in vitro
In questo articolo
Riepilogo
La distanza spaziale è un parametro chiave nella valutazione del danno da ipossia/riossigenazione in un modello di co-coltura di strati cellulari endoteliali e cardiomiociti separati, suggerendo, per la prima volta, che l'ottimizzazione dell'ambiente spaziale di co-coltura è necessaria per fornire un modello in vitro favorevole per testare il ruolo delle cellule endoteliali nella protezione dei cardiomiociti.
Abstract
La cardiopatia ischemica è la principale causa di morte e disabilità in tutto il mondo. La riperfusione provoca ulteriori lesioni oltre l'ischemia. Le cellule endoteliali (CE) possono proteggere i cardiomiociti (CM) dalle lesioni da riperfusione attraverso le interazioni cellula-cellula. Le co-colture possono aiutare a studiare il ruolo delle interazioni cellula-cellula. Una co-coltura mista è l'approccio più semplice, ma è limitata in quanto i trattamenti isolati e le analisi a valle di singoli tipi di cellule non sono fattibili. Per indagare se le CE possono attenuare in modo dose-dipendente il danno alle cellule CM e se questa protezione può essere ulteriormente ottimizzata variando la distanza di contatto tra le due linee cellulari, abbiamo utilizzato le cellule endoteliali dell'arteria coronaria primaria del topo e i cardiomiociti del topo adulto per testare tre tipi di inserti di coltura cellulare che variavano nella loro distanza dello strato intercellulare a 0,5, 1,0 e 2,0 mm, rispettivamente. Solo nelle CM, il danno cellulare valutato dal rilascio di lattato deidrogenasi (LDH) è aumentato significativamente durante l'ipossia e ulteriormente dopo la riossigenazione quando la distanza era di 2,0 mm rispetto a 0,5 e 1,0 mm. Quando le EC e le CM erano in contatto quasi diretto (0,5 mm), c'era solo una lieve attenuazione del danno da riossigenazione delle CM a seguito di ipossia. Questa attenuazione è stata significativamente aumentata quando la distanza spaziale era di 1,0 mm. Con una distanza di 2,0 mm, le CE hanno attenuato la lesione della CM sia durante l'ipossia che durante l'ipossia / riossigenazione, indicando che è necessario un sufficiente distanziamento di coltura per le CE per incrociare la diafonia con le CM, in modo che le molecole segnale secrete possano circolare e stimolare completamente le vie protettive. I nostri risultati suggeriscono, per la prima volta, che l'ottimizzazione dell'ambiente spaziale di co-coltura EC/CM è necessaria per fornire un modello in vitro favorevole per testare il ruolo degli EC nella protezione CM contro le lesioni da ischemia/riperfusione simulate. L'obiettivo di questo rapporto è quello di fornire un approccio passo-passo per gli investigatori per utilizzare questo importante modello a loro vantaggio.
Introduzione
La cardiopatia ischemica è la principale causa di morte e disabilità in tutto il mondo 1,2. Tuttavia, il processo di trattamento della riperfusione può causare la morte dei cardiomiociti, nota come lesione da ischemia / riperfusione miocardica (IR), per la quale non esiste ancora un rimedio efficace3. Le cellule endoteliali (CE) sono state suggerite per proteggere i cardiomiociti (CM) attraverso la secrezione di segnali paracrini, nonché le interazioni cellula-cellula4.
I modelli di co-coltura cellulare sono stati ampiamente utilizzati per studiare il ruolo delle interazioni cellula-cellula autocrine e/o paracrine sulla funzione e la differenziazione cellulare. Tra i modelli di co-coltura, la co-coltura mista è la più semplice, in cui due diversi tipi di cellule sono in contatto diretto all'interno di un singolo compartimento di coltura con un rapporto cellulare desiderato5. Tuttavia, trattamenti separati tra tipi di cellule e analisi a valle di un singolo tipo di cellula non sono prontamente fattibili data la popolazione mista.
Studi precedenti hanno indicato che gli insulti ipossici e ischemici causano danni significativi all'integrità della membrana cellulare misurata dal rilascio di lattato deidrogenasi (LDH). Questa lesione è peggiorata con la riossigenazione, imitando la lesione da riperfusione 6,7,8. L'obiettivo dell'attuale protocollo era quello di testare le ipotesi che la presenza di EC possa attenuare in modo dose-dipendente la perdita di CM della membrana cellulare causata da ipossia e riossigenazione (HR) e che l'effetto protettivo degli EC possa essere ottimizzato variando la distanza di contatto tra le due linee cellulari. Pertanto, abbiamo impiegato tre tipi di inserti di coltura cellulare e cellule endoteliali coronariche primarie di topo e cardiomiociti di topo adulti. Gli inserti, marchiati da Corning, Merck Millipore e Greiner Bio-One, ci hanno permesso di creare tre diverse condizioni di diafonia della coltura cellulare con distanze intercellulari di 0,5, 1,0 e 2,0 mm, rispettivamente. 100.000 CE sono stati placcati per inserto in ciascun caso.
Inoltre, al fine di determinare se la densità delle CE in cocoltura contribuisca all'attenuazione del danno hr in questo modello, abbiamo studiato la relazione dose-risposta tra concentrazione CE e rilascio di LDH da parte dei CM. Le CE sono state placcate rispettivamente a 25.000, 50.000 e 100.000 per inserto, nell'inserto da 2,0 mm.
Questo rapporto fornisce un approccio passo-passo per gli investigatori per utilizzare questo importante modello a loro vantaggio.
Protocollo
1. Preparazione/placcatura sperimentale
- Mantenere CM ed EC secondo le istruzioni del produttore.
- Scongelare entrambe le linee cellulari quando arrivano dai fornitori. Piastra in palloni T25 dopo essere stata lavata con mezzi freschi. Si consiglia di acquistare ogni terreno di coltura cellulare dagli stessi fornitori da cui sono state acquistate le cellule. Il giorno successivo, aggiornare le celle con i supporti e utilizzarle quando sono confluenti.
- Mantenere l'incubatore di colture cellulari a 37 °C con 21% O2, 5% CO2, 74% N2 e mantenerlo umidificato.
NOTA: Le cellule endoteliali dell'arteria coronaria primaria del topo utilizzate in questo protocollo sono isolate dalle arterie coronarie dei topi C57BL/6 e i cardiomiociti di topo adulti sono isolati da cuori di topo C57BL/6J adulti e ottenuti commercialmente (vedere Tabella dei materiali).
- Cm di piastre in condizioni sterili sul fondo di piastre a 24 pozzetti (strato inferiore). 24 ore dopo, placcare ECs nell'inserto (o porzione superiore) del pozzo di co-coltura. 24 ore dopo la placcatura CE, posizionare gli inserti EC su basi di piastre CM, iniziando il periodo di co-coltura. Lasciare che le cellule co-colturano per almeno 12-24 ore prima dell'uso. Questi passaggi sono descritti in dettaglio di seguito.
- Stimare la confluenza della linea cellulare CM al microscopio ottico. Quando le cellule sembrano essere confluenti al 90%-100% nei palloni di coltura, procedere con la placcatura sperimentale.
- Rimuovere il materiale dai palloni contenenti colture cellulari confluenti e tripsinizzare con 3-5 mL di tripsina/acido etilendiamminotetraacetico (EDTA) per i palloni T25. Agitare delicatamente il matraccio, incubare a 37 °C per 2-5 minuti, quindi valutare i progressi enzimatici al microscopio ottico. Una volta che le cellule iniziano ad arrotondare, utilizzare un raschietto cellulare per staccare le cellule dalla superficie.
- Dopo il distacco, inattivare la soluzione di tripsina aggiungendo la soluzione di tripsina/cella a un tubo da 50 mL contenente 10 mL di fluido per i palloni T25. Centrifugare la sospensione cellulare a 120 x g per 2 minuti per ottenere un pellet a celle morbide. Rimuovere il surnatante e risospesciare il pellet in 5 ml di supporto.
- Per eseguire il conteggio cellulare e confermare la vitalità cellulare, mescolare un'aliquota di 10 μL di cellule risospese e 10 μL di colorante blu di tripano. Conta le cellule viventi usando un contatore di celle. Diluire le cellule con mezzi regolari freschi per ottenere le densità di semina desiderate. I volumi sono calcolati in base alla densità di seme desiderata e alla concentrazione cellulare delle soluzioni madre. Tutta la placcatura deve essere eseguita in condizioni sterili.
- CM di piastra a densità di semina di 300.000 per pozzetto sul fondo di una piastra a 24 pozzetti pre-rivestita con matrice extracellulare. Mantenere le celle a 37 °C con il 21% di O2 e il 5% di CO2 durante la notte.
- Dopo 24 ore, le cec della piastra in inserti ad una densità di placcatura ottimale di 100.000 per inserto (l'area di coltura è di 33,6 mm2) (Figura 1). Dopo 24 ore di placcatura CE, posizionare gli inserti EC all'interno dei pozzetti CM, avviando la co-coltura. Consentire alle cellule di co-coltivare per 12-24 ore prima di eseguire gli esperimenti.
- Assicurarsi che, al momento dell'esecuzione degli esperimenti, sia i CM che gli EC abbiano raggiunto l'80%-90% di confluenza.
2. Ipossia/reossigenazione per simulare ischemia/danno da riperfusione in vitro
NOTA: i seguenti passaggi devono essere eseguiti come descritto, non mettere in pausa nel mezzo.
- Preparare il mezzo ipossico versando ~ 25 ml di media in un tubo conico da 50 ml. Sigillare ad aria la parte superiore con una membrana in silicone e utilizzare una pipetta sterilizzata per praticare un foro. Creare un altro foro, questa volta lasciando la pipetta immersa di circa 2/3 nel supporto.
- Lavare il fluido con gas ipossico (0,0125% O2, 5% CO2, 94,99% N2) per 5 minuti ad una portata di 30 L/min. Ciò riduce al minimo l'O2 disciolto nel mezzo quando inizia l'ipossia (passaggio 2.5).
- Scartare il mezzo delle piastre a 24 pozzetti o degli inserti di coltura contenenti cellule attaccate e lavare con 100 μL/pozzetto di 10% di fosfato tamponato saline (PBS) molto delicatamente. Successivamente, aggiungere 500 μL del mezzo ipossico appena preparato a ciascun pozzetto delle piastre o degli inserti.
NOTA: l'ipossia nei media viene interrotta il più brevemente possibile durante questo passaggio prima che la vera ipossia per le cellule e i media inizi nel passaggio 2.5.- Nel gruppo di controllo normossico, sostituire il supporto originale con mezzo normale fresco contenente glucosio e siero.
- Umidificare la camera dell'ipossia posizionando una capsula di Petri riempita con acqua sterile all'interno della camera. Quindi, posizionare le piastre che comprendono i gruppi ipossici nella camera.
- Lavare la camera dell'ipossia con gas ipossico (0,0125% O2, 5% CO2, 94,99% N2) per 5 minuti ad una portata di 30 L/min. Posizionare la camera nell'incubatrice a 37 °C per 24 ore.
- Dopo l'ipossia, coltivare CM ed EC in condizioni normali. Per fare ciò, scartare il vecchio mezzo delle piastre/inserti, sostituirlo con un mezzo normale (contenente glucosio e siero; 500 μL di ciascun pozzetto/inserto) e conservarlo nell'incubatore in condizioni normali di coltura (21% O2, 5% CO2, 74% N2, 37 °C) per 2 ore per imitare la riperfusione.
- Per controllare eventuali effetti della sostituzione dei supporti, modificare il mezzo delle cellule normossiche contemporaneamente alla modifica del mezzo ipossico.
Nota : figura 2 fornisce una panoramica schematica di questo protocollo.
3. Valutazione degli endpoint
- Trasferire il terreno di coltura cellulare dalla piastra a 24 pozzetti in una piastra a 96 pozzetti. Utilizzare 200 μL di mezzi da ciascun pozzetto della piastra a 24 pozzetti e distribuire equamente in quattro pozzetti della piastra da 96 pozzetti, di conseguenza. Utilizzare una piastra ciascuno per normossia contro ipossia contro HR.
- Determinare il grado di lesione cellulare, ad esempio, misurando l'assorbanza per LDH utilizzando un kit di analisi della citotossicità seguendo le istruzioni del produttore. Eseguire il test in una piastra a 96 pozzetti come indicato nel protocollo di analisi.
4. Statistiche
- Visualizzare i dati parametrici come deviazione media/standard e i dati non parametrici come box plot con intervallo mediano/interquartile. Dovrebbero essere eseguiti adeguati test di confronto multiplo parametrico rispetto a quelli non parametrici con test post-hoc accettabili per ridurre la possibilità di un errore di tipo 1. La significatività è in genere impostata su un alfa di 0,05 (a due code).
- Per tutti gli esperimenti condotti nel presente studio, eseguire almeno tre ben replicati all'interno di un esperimento. C'erano da tre a sei ripetizioni di ogni esperimento utilizzato per l'analisi statistica.
Risultati
Tutti e tre i tipi di inserti (A, B, C) utilizzati in questo esperimento hanno la stessa dimensione dei pori di 0,4 μm. L'unica differenza tra loro è l'altezza da inserto a base, che consente alle distanze tra i due strati cellulari co-coltivati di essere rispettivamente di 0,5, 1,0 e 2,0 mm (Figura 3) e che provengono da fornitori diversi (per i dettagli vedere Tabella dei materiali).
Per stabilire un modello di co-coltura in vitro con strati separati di due linee cellulari sottoposte a HR per simulare la lesione IR, abbiamo esaminato l'integrità della membrana cellulare dei CM co-coltivati con o senza EC. L'utilizzo di un inserto separato per le CE che può essere posizionato a varie distanze sopra lo strato CM ci ha permesso di valutare anche gli effetti differenziali della distanza dello strato cellulare sulla gravità del danno alla membrana nei CM. In una serie separata di esperimenti, abbiamo variato la densità delle CE e quindi il rapporto tra CE e CM. Inoltre, per differenziare l'ischemia simulata dalla lesione IR simulata, sono stati condotti esperimenti in condizioni di 1) normossia, 2) solo ipossia e 3) HR. Per questo modello, abbiamo usato ipossia di 24 ore, seguita da una riossigenazione di 2 ore.
Distanze variabili
Distanza di 0,5 mm tra gli strati di cella (Inserire A)
Quando le CM sono state coltivate da sole, l'ipossia ha portato a un aumento significativo del rilascio di LDH rispetto alla normossia, in linea con i nostri studi precedenti (Figura 4A)6. Tuttavia, l'LDH è stato solo lievemente ulteriormente aumentato dopo la riossigenazione di 2 ore rispetto al gruppo solo ipossia. Quando CE e CM sono stati co-coltivati insieme a una distanza di 0,5 mm, l'aumento del rilascio di LDH solo per ipossia non è stato attenuato indicando che le CE non hanno mostrato alcun effetto protettivo (rispetto al gruppo di CM da solo nelle condizioni di sola ipossia). Tuttavia, le CE hanno esercitato una protezione lieve ma significativa sui CM durante le risorse umane.
Distanza di 1,0 mm tra gli strati cellulari (Inserire B)
Lo stesso esperimento è stato eseguito come sopra, tranne per il fatto che la distanza tra i due strati cellulari è stata aumentata a 1,0 mm (Figura 4B). Abbiamo scoperto che il rilascio di LDH è stato anche significativamente aumentato nei CM solo per ipossia. Tuttavia, a differenza dell'inserto da 0,5 mm, l'aumento dell'LDH nel solo CM è stato potenziato dall'HR rispetto alla sola ipossia. Inoltre, questo potenziamento è stato più inibito e quasi abolito dalla presenza delle CE durante la riossigenazione rispetto al gruppo solo CM.
Distanza di 2,0 mm tra gli strati di cella (Inserisci C)
Quando sono stati utilizzati inserti di co-coltura che creano una distanza di 2,0 mm tra le due linee cellulari (Figura 4C), abbiamo anche riscontrato un aumento significativo del rilascio di LDH da parte dei CM, solo durante l'ipossia, nella stessa misura degli esperimenti da 0,5 mm e 1,0 mm. È interessante notare, tuttavia, che l'ulteriore aumento del rilascio di LDH per riossigenazione è stato ancora più pronunciato rispetto agli esperimenti da 1,0 mm. Entrambi questi aumenti sono stati attenuati, anche se non aboliti, dalla presenza di CE, il che indica che, a differenza dell'uso di inserti da 0,5 o 1,0 mm, le CE hanno protetto in modo significativo le CM da lesioni sia in condizioni di ipossia che di HR.
Intensità CE variabili
In una serie diversa di esperimenti, la concentrazione di EC placcati in inserti da 2,0 mm è stata titolata rispettivamente a 25.000, 50.000 e 100.000 celle per inserto. Il rilascio di LDH è stato misurato dopo ipossia di 24 ore seguita da una riossigenazione di 2 ore. I nostri risultati hanno mostrato che l'aumento dell'intensità ec nella co-coltura ha portato a un'attenuazione dose-dipendente del rilascio di LDH causata da HR (Figura 5); nessun effetto di questo tipo è stato osservato in condizioni normossiche.
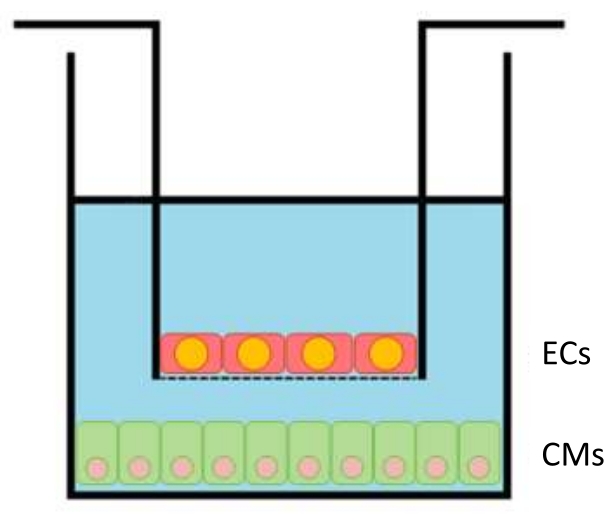
Figura 1: Schema di inserimento all'interno del pozzo. Gli inserti con le CE (fino a 100.000 celle per inserto) vengono trasferiti alle piastre a 24 pozzetti con i CM (300.000 per pozzetto) sul fondo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Progettazione sperimentale. Le cellule vengono coltivate in condizioni normali di ossigeno (21% O2) e quindi divise in due gruppi: un gruppo di controllo normossico continuerà a essere coltivato in condizioni normali per altre 24 ore, mentre il gruppo ipossia sarà coltivato in una camera ipossia per 24 ore con solo lo 0,01% di O2 e nessun glucosio. Dopo questi interventi di 24 ore, entrambi i gruppi di cellule vengono rinfrescati con i mezzi e coltivati continuamente in un ambiente del21 % O 2 per altre 2 ore, la fase di riossigenazione, prima di condurre eventualmente i test endpoint, ad esempio l'analisi LDH. Fare clic qui per visualizzare una versione più grande di questa figura.
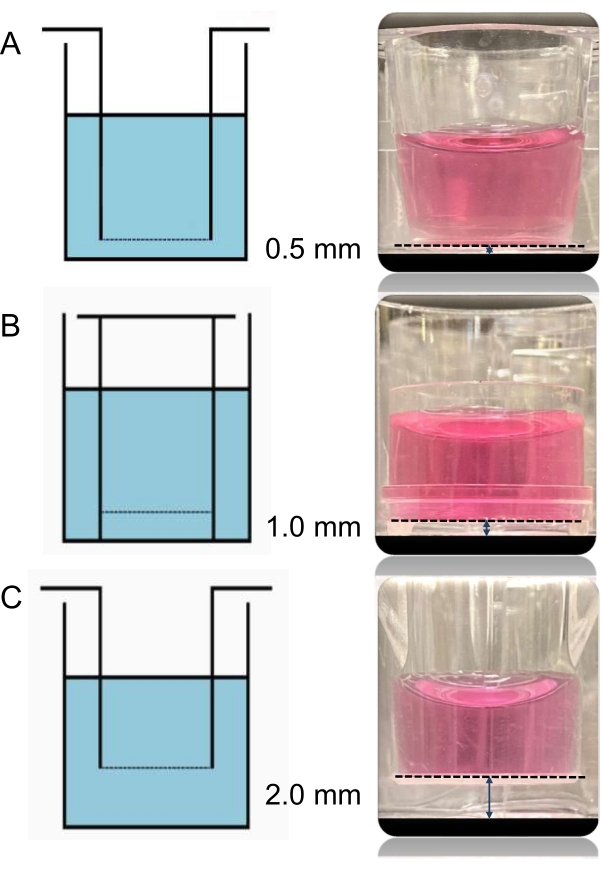
Figura 3: Immagini e schemi dei tre diversi inserti. La distanza tra le cellule endoteliali nell'inserto e i cardiomiociti nella parte inferiore del pozzo può essere variata utilizzando diversi inserti. Tutti e tre i tipi di inserti utilizzati qui hanno la stessa dimensione dei pori di 0,4 μm. L'unica differenza tra loro è l'altezza da inserto a base, che consente alle distanze tra i due strati cellulari co-coltivati di essere rispettivamente 0,5 (A), 1,0 (B) e 2,0 mm (C). Fare clic qui per visualizzare una versione più grande di questa figura.
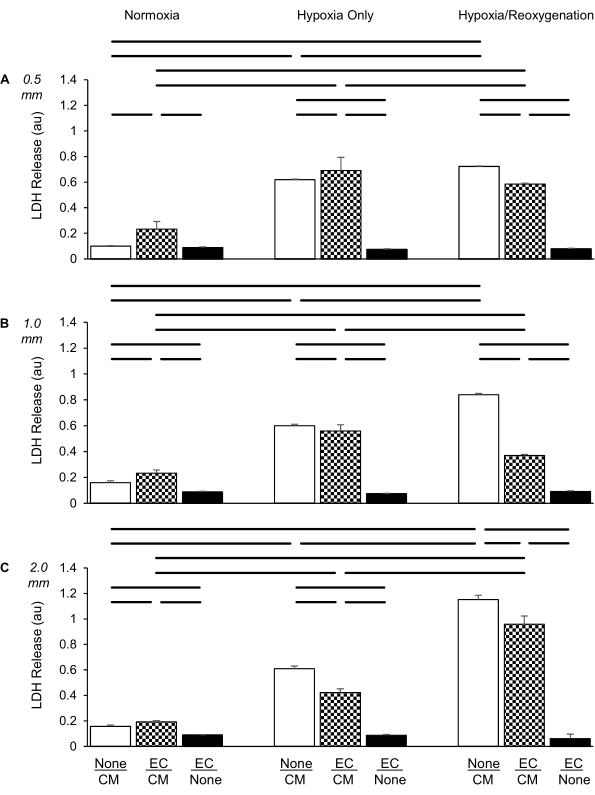
Figura 4: Confronto di tre tipi di inserti di coltura nella valutazione del rilascio di lattato deidrogenasi (LDH; in unità di assorbanza [au]) sotto normossica (sinistra), solo ipossia (al centro) e condizioni di ipossia/riossigenazione (destra) per i cardiomiociti da soli (CM; bianco), le cellule endoteliali da sole (EC; nero) e le co-colture di CM con EC (check pattern). (A) distanza di 0,5 mm, (B) distanza di 1,0 mm, (C) Distanza di 2,0 mm tra i due diversi strati cellulari. Le NC sono state placcate ad una densità di 100.000 celle per inserto, le CM ad una densità di 300.000 celle per pozzetto. I dati sono ± deviazione standard, n = 4 per gruppo. Statistiche: ANOVA seguito da Student-Newman-Keuls test post-hoc. P < 0,05 (a due code) indicato da barre orizzontali tra ogni coppia confrontata. Fare clic qui per visualizzare una versione più grande di questa figura.
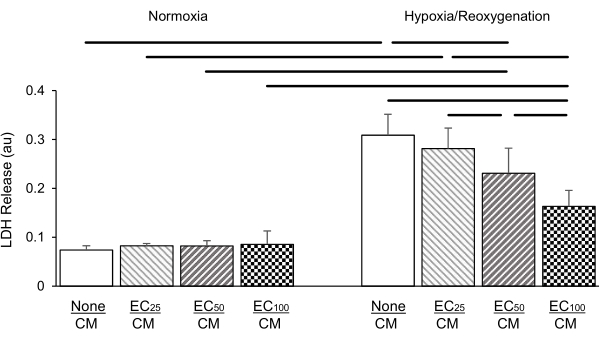
Figura 5: Concentrazione di cellule endoteliali co-coltivate (EC; 25: 25.000 cellule per inserto; 50: 50.000 cellule per inserto; 100: 100.000 cellule per inserto) protezione dose-dipendente dei cardiomiociti (CM) contro ipossia/danno da riossigenazione (a destra) rispetto alle condizioni normossiche (a sinistra) come evidenziato dal rilascio di lattato deidrogenasi (LDH; in unità di assorbanza [au]). Le CE non hanno avuto alcun effetto sul rilascio di LDH in condizioni normossiche. I dati sono ± deviazione standard, n = 4 per gruppo. Statistiche: ANOVA seguito da Student-Newman-Keuls test post-hoc. P < 0,05 (a due code) indicato da barre orizzontali tra ogni coppia confrontata. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Passaggi critici nel protocollo
Modelli di co-coltura cellulare sono stati utilizzati per studiare i meccanismi cellulari di cardioprotezione. Come creare due strati separati con una distanza significativa tra loro è, quindi, cruciale per lo sviluppo di un modello di co-cultura adatto. Una sfida nello studio della lesione IR simulata, cioè HR, è che non solo l'ischemia (ipossia) stessa, ma anche la riperfusione (reossigenazione) aggrava la disfunzione cellulare. Pertanto, un modello realistico deve riflettere queste caratteristiche, ad esempio, dimostrando un danno sufficientemente aumentato per riossigenazione a seguito di ipossia rispetto alla sola ipossia, ma consentendo comunque l'attenuazione della lesione con farmaci o strategie di protezione cellulare come, nel nostro caso, la presenza di EC. È interessante notare che la distanza tra i due strati cellulari sembra svolgere un ruolo importante nello sviluppo di un modello di co-coltura adatto. Siamo stati in grado di dimostrare che una distanza di 1,0 mm e 2,0 mm tra CE e CM consentivano la risposta alle lesioni HR prevista, ma, cosa più importante, che solo 2,0 mm hanno prodotto un risultato costantemente favorevole per la protezione dalle lesioni cellulari dalla presenza di EC in condizioni sia ipossiche che HR.
Modifiche e risoluzione dei problemi del metodo
Le interazioni cellula-cellula nei modelli di co-coltura sono influenzate da molteplici variabili come il numero di distinte popolazioni co-coltivate, il grado di somiglianza dei tipi cellulari, il grado di separazione fisica tra loro, la differenza tra gli ambienti locali della popolazione, il volume delle colture e la considerazione temporale della co-coltura 9,10,11,12 . Esistono compromessi tra questi fattori. Queste interazioni sono fortemente influenzate dall'ambiente, che a sua volta è determinato dal protocollo e dalla configurazione. È fondamentale sviluppare modelli sperimentali replicabili, misurabili e comparabili. Il nostro approccio è stato quello di controllare e limitare il numero di variabili che possono interrompere la coerenza dei dati ottenuti da diversi esperimenti condotti in momenti diversi attraverso la placcatura di un numero accurato di cellule, utilizzando lo stesso rapporto di due linee cellulari co-coltivate, gli stessi volumi del terreno di coltura cellulare e dei reagenti di saggio, ecc., Ad eccezione dei tre diversi inserti di coltura cellulare.
Limitazioni del metodo
Il nostro modello funziona bene con CE e CM, probabilmente grazie alla presenza onnipresente di EC nel sistema cardiovascolare. Quanto bene altri tipi di linee cellulari di potenziale interesse interagiscano con CM, neuroni o altre cellule di interesse da studiare in vitro deve ancora essere valutato in quanto diverse linee cellulari potrebbero interagire in modo diverso nell'ambiente di co-coltura. Una differenza tra le popolazioni cellulari co-coltivate potrebbe essere la loro relazione ecologica, ad esempio, se sono concorrenti naturali o cooperatori. Inoltre, come in tutti gli altri modelli cellulari in vitro , il danno cellulare generato nell'esperimento potrebbe non rappresentare l'effettivo stato fisiopatologico della lesione in vivo. Inoltre, riconosciamo che le distanze testate tra CE e CM di 0,5, 1,0 e 2,0 mm non riproducono la loro spaziatura in vivo; per il modello in vitro dato; tuttavia, i nostri risultati descrivono le implicazioni del distanziamento ottimale tra due strati cellulari da studiare da parte degli scienziati che vorrebbero trarre vantaggio da questa tecnica.
Il significato del metodo rispetto ai metodi esistenti/alternativi
I metodi di co-coltura esistenti / alternativi includono la miscelazione diretta di linee cellulari o la creazione di un ambiente separato con un grado di separazione come l'utilizzo di piastre transwell13, piattaforme microfluidiche14 o scaffold tridimensionali15, tra cui le piastre transwell sono le meno costose e più facili disponibili. Nonostante le limitazioni naturali, le co-colture sono molto rilevanti per la ricerca sui farmaci perché forniscono un modello di tessuto più rappresentativo in vivo e consentono test ad alto rendimento e monitoraggio approfondito degli effetti dei farmaci sulle interazioni cellula-cellula16. Il nostro modello è stato accuratamente calibrato utilizzando distanze spaziali ben definite tra EC e CM, invece di una miscela completa e incontrollata di due diversi tipi di celle. Inoltre, questo modello consente trattamenti separati e analisi individuali tipi di cellule, che è impossibile ottenere in una co-coltura mista, per non parlare in vivo. Poiché la lesione IR coinvolge processi HR separati, questo modello è adatto a studiare separatamente i meccanismi cellulari di ischemia / ipossia rispetto al danno da riperfusione / reossigenazione. I nostri dati suggeriscono che potrebbe essere un modello di co-coltura cellulare altamente prezioso ed efficiente da utilizzare negli studi di lesioni IR simulate. Le nostre osservazioni indicano chiaramente che una distanza spaziale ottimale, nel nostro caso 2,0 mm, è necessaria per le CE per incrociare le CM in questo specifico modello di co-coltura, in modo che le molecole di segnalazione potenzialmente secrete dalle CE possano circolare efficacemente per la protezione illecita delle CM contro le lesioni da ipossia e / o HR.
Importanza e potenziale applicazione dei metodi in specifiche aree di ricerca
Il nostro modello indica l'importanza di combinare le EC coronarie del topo con le CM del topo per migliorare l'indagine delle misure protettive contro le lesioni delle risorse umane; che la variazione della distanza spaziale delle coculture dimostra un modo efficace per comprendere meglio le condizioni spaziali che influenzano l'azione protettiva delle CE sulle lesioni da CM causate dalle risorse umane; e che la densità delle CE o il rapporto CE-CM è positivamente correlato alla portata della protezione contro il danno dell'HR.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato supportato, in parte, dal servizio di ricerca e sviluppo del laboratorio biomedico del Dipartimento degli affari dei veterani degli Stati Uniti (I01 BX003482) e da fondi istituzionali a M.L.R.
Materiali
| Name | Company | Catalog Number | Comments |
| Adult Mouse Cardiomyocytes (CMs) | Celprogen Inc | 11041-14 | Isolated from adult C57BL/6J mouse cardiac tissue |
| Automated Cell Counter Countess II | Invitrogen | A27977 | Cell counting for calculating cell numbers |
| Bio-Safety Cabinet | Nuaire | NU425400 | Cell culture sterile hood |
| Cell Culture Freezing Medium | Cell Biologics Inc | 6916 | Used for cell freezing for long term cell line storage |
| Cell Culture Incubator | Nuaire | Nu-5500 | To provide normal cell living condition (21%O2, 5%CO2, 74%N2, 37°C, humidified) |
| Cell Culture Incubator Gas Tank | A-L Compressed Gases | UN1013 | Gas needed for cell culture incubator |
| Cell Culture Inserts A (0.5 mm) | Corning Inc | 353095 | Used for EC-CM co-culture |
| Cell Culture Inserts B (1.0 mm) | Millicell Millipore | PIHP01250 | Used for EC-CM co-culture |
| Cell Culture Inserts C (2.0 mm) | Greiner Bio-One | 662640 | Used for EC-CM co-culture |
| Centrifuge | Anstel Enterprises Inc | 4235 | For cell culture plating and passaging |
| CMs Cell Culture Flasks T25 | Celprogen Inc | E11041-14 | Used for CMs regular culture, coated by manufacturer |
| CMs Cell Culture Medium Complete | Celprogen Inc | M11041-14S | CMs culture complete medium |
| CMs Cell Culture Medium Complete Phenol free | Celprogen Inc | M11041-14PN | CMs culture medium without phenol red used during LDH measurement |
| CMs Cell Culture Plates 96 well | Celprogen Inc | E11041-14-96well | Used for experiments of LDH measurement, coated by manufacturer |
| CMs Hypoxia Cell Culture Medium | Celprogen Inc | M11041-14GFPN | CMs cell culture under hypoxic condition (glucose- and serum-free) |
| Countess cell counting chamber slides | Invitrogen | C10283 | Counting slides used for cell counter |
| Cyquant LDH Cytotoxicity Kit | Thermo Scientific | C20301 | LDH measurement kit |
| ECs Cell Culture Flasks T25 | Fisher Scientific | FB012935 | Used for ECs regular culture |
| ECs Cell Culture Medium Complete | Cell Biologics Inc | M1168 | ECs culture complete medium |
| ECs Cell Culture Medium Complete Phenol free | Cell Biologics Inc | M1168PF | ECs culture medium without phenol red used during LDH measurement |
| ECs Cell Culture Plates 96 well | Fisher Scientific (Costar) | 3370 | Used for experiments of LDH measurement |
| ECs Culture Gelatin-Based Coating Solution | Cell Biologics Inc | 6950 | Used for coating flasks and plates for ECs |
| ECs Hypoxia Cell Culture Medium | Cell Biologics Inc | GPF1168 | ECs cell culture under hypoxic condition (glucose- and serum-free) |
| Fetal Bovine Serum (FBS) | Fisher Scientific | MT35011CV | FBS-HI USDA-approved for cell culture and maintenance |
| Hypoxia Chamber | StemCell Technologies | 27310 | To create a hypoxic condition with 0.01%O2 environment |
| Hypoxia Chamber Flow Meter | StemCell Technologies | 27311 | To connect with hypoxic gas tank for a consistent gas flow speed |
| Hypoxic Gas Tank (0.01%O2 Cylinder) | A-L Compressed Gases | UN1956 | Used to flush hypoxic medium and chamber (0.01%O2/5%CO2/94.99N2) |
| Microscope | Nikon | TMS | To observe cell condition |
| Mouse Primary Coronary Artery Endothelial Cells (ECs) | Cell Biologics Inc | C57-6093 | Isolated from coronary artery of C57BL/6 mice |
| NUNC 15ML CONICL Tubes | Fisher Scientific | 12565269 | For cell culture process, experiments, solution preparation etc. |
| NUNC 50ML CONICL Tubes | Fisher Scientific | 12565271 | For cell culture process, experiments, solution preparation etc. |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8662 | Used for cell washing during culture or experiments |
| Plate Reader | BioTek Instrument | 11120533 | Colorimetric or fluorometric plate reading |
| Reaction 96 Well Palte (clear no lid) | Fisher Scientific | 12565226 | Used for LDH measurement plate reading |
| Trypsin/EDTA for CMs | Celprogen Inc | T1509-014 | 1 x sterile filtered and tissue culture tested |
| Trypsin/EDTA for ECs | Cell Biologics Inc | 6914/0619 | 0.25%, cell cuture-tested |
Riferimenti
- Hausenloy, D. J., et al. Ischaemic conditioning and targeting reperfusion injury: a 30 year voyage of discovery. Basic Research in Cardiology. 111 (6), 70 (2016).
- Hausenloy, D. J., Yellon, D. M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target. The Journal of Clinical Investigation. 123 (1), 92-100 (2013).
- Gottlieb, R. A. Cell death pathways in acute ischemia/reperfusion injury. Journal of Cardiovascular Pharmacology and Therapeutics. 16 (3-4), 233-238 (2011).
- Colliva, A., Braga, L., Giacca, M., Zacchigna, S. Endothelial cell-cardiomyocyte crosstalk in heart development and disease. The Journal of Physiology. 598 (14), 2923-2939 (2020).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology Journal. 8 (4), 395-396 (2013).
- Salzman, M. M., Bartos, J. A., Yannopoulos, D., Riess, M. L. Poloxamer 188 protects isolated adult mouse cardiomyocytes from reoxygenation injury. Pharmacology Research & Perspectives. 8 (6), 00639 (2020).
- Kalogeris, T., Baines, C. P., Krenz, M., Korthuis, R. J. Cell biology of ischemia/reperfusion injury. International Review of Cell and Molecular Biology. 298, 229-317 (2012).
- Martindale, J. J., Metzger, J. M. Uncoupling of increased cellular oxidative stress and myocardial ischemia reperfusion injury by directed sarcolemma stabilization. Journal of Molecular and Cellular Cardiology. 67, 26-37 (2014).
- vander Meer, A. D., Orlova, V. V., ten Dijke, P., vanden Berg, A., Mummery, C. L. Three-dimensional co-cultures of human endothelial cells and embryonic stem cell-derived pericytes inside a microfluidic device. Lab on a Chip. 13, 3562-3568 (2013).
- Bidarra, S. J., et al. Phenotypic and proliferative modulation of human mesenchymal stem cells via crosstalk with endothelial cells. Stem Cell Research. 7, 186-197 (2011).
- Campbell, J. J., Davidenko, N., Caffarel, M. M., Cameron, R. E., Watson, C. J. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PloS One. 6, 25661 (2011).
- Mehes, E., Mones, E., Nemeth, V., Vicsek, T. Collective motion of cells mediates segregation and pattern formation in co-cultures. PloS One. 7, 31711 (2012).
- Miki, Y., et al. The advantages of co-culture over mono cell culture in simulating in vivo environment. The Journal of Steroid Biochemistry and Molecular Biology. 131 (3-5), 68-75 (2012).
- Moraes, C., Mehta, G., Lesher-Perez, S. C., Takayama, S. Organs-on-a-chip: a focus on compartmentalized microdevices. Annals of Biomedical Engineering. 40 (6), 1211-1227 (2012).
- Campbell, J., Davidenko, N., Caffarel, M., Cameron, R., Watson, C. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PLoS One. 6, 25661 (2011).
- Wu, M. H., Huang, S. B., Lee, G. B. Microfluidic cell culture systems for drug research. Lab on a Chip. 10, 939-956 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon