Method Article
Mikro Yerçekiminde Diş ve Solunum Hücre ve Organlarının Yayılımı
Bu Makalede
Özet
Bu protokol, mikrogravitedeki ameloblast benzeri hücrelerin kültürü ve 3D büyümesi için, uzun ve polarize şekillerini ve emayeye özgü protein ekspresyonunu korumak için bir yöntem sunar. Periodontal mühendislik yapıları kültürü ve mikro yerçekiminde akciğer organları için kültür koşulları da tanımlanmıştır.
Özet
Yerçekimi, insan hücresi fonksiyonunun, proliferasyonun, sitoiskelet mimarisinin ve oryantasyonunun temel belirleyicilerinden biridir. Döner biyoreaktör sistemleri (RCCS'ler), uzayda meydana gelen yerçekimi kaybını taklit eder ve bunun yerine kültürlenmiş hücrelerin veya dokuların sürekli rotasyonu yoluyla bir mikro yerçekimi ortamı sağlar. Bu RCCS'ler, kesintisiz bir besin kaynağı, büyüme ve transkripsiyon faktörleri ve oksijen sağlar ve hareketsiz 2D (iki boyutlu) hücre veya organ kültürü kaplarındaki yerçekimi kuvvetlerinin bazı eksikliklerini giderir. Bu çalışmada RCCS'leri servikal loop hücreleri ve dental pulpa hücrelerini ameloblast haline getirmek, periodontal progenitör/iskele etkileşimlerini karakterize etmek ve inflamasyonun akciğer alveolleri üzerindeki etkisini belirlemek için birlikte kültürlemek için kullandık. RCCS ortamları, ameloblast benzeri hücrelerin büyümesini kolaylaştırdı, iskele kaplamalarına yanıt olarak periodontal progenitör proliferasyonunu teşvik etti ve enflamatuar değişikliklerin kültürlü akciğer alveolleri üzerindeki etkilerinin değerlendirilmesine izin verdi. Bu makale, çevresel koşulları, materyalleri ve yol boyunca adımları özetlemekte ve kritik yönleri ve deneysel ayrıntıları vurgulamaktadır. Sonuç olarak, RCCS'ler, in vitro hücrelerin kültürüne ve 3D (üç boyutlu) büyümesine hakim olmak ve klasik 2D kültür ortamlarına uygun olmayan hücresel sistemlerin veya etkileşimlerin incelenmesine izin vermek için yenilikçi araçlardır.
Giriş
Yerçekimi, bireysel hücrelerin biyolojisi ve organizmalar içindeki işlevleri de dahil olmak üzere Dünya'daki yaşamın tüm yönlerini etkiler. Hücreler mekanoreseptörler aracılığıyla yerçekimini algılar ve sitoiskelet mimarilerini yeniden yapılandırarak ve hücre bölünmesi 1,2,3'ü değiştirerek yerçekimindeki değişikliklere yanıt verir. Mikro yerçekiminin diğer etkileri arasında sıvı dolu veziküllerdeki hidrostatik basınç, organellerin çökelmesi ve akış ve ısının yüzdürme güdümlü konveksiyonu4 bulunur. Yerçekimi kaybının insan hücreleri ve organları üzerindeki etkisi üzerine yapılan çalışmalar başlangıçta uzay uçuşu görevleri sırasında astronotlar üzerindeki ağırlıksız ortamı simüle etmek için yapılmıştır5. Bununla birlikte, son yıllarda, NASA tarafından mikroyerçekimini simüle etmek için geliştirilen bu 3D biyoreaktör teknolojileri, aksi takdirde 2D kültür sistemlerine uygun olmayan hücre popülasyonlarının kültürü için yeni yaklaşımlar olarak giderek daha alakalı hale gelmektedir.
3D Biyoreaktörler, süspansiyondaki hücreleri büyüterek mikro yerçekimini simüle eder ve böylece sürekli bir "serbest düşüş" etkisi yaratır. Dönen biyoreaktörlerin diğer avantajları arasında organ kültürü sistemlerinde karşılaşılan havaya maruz kalma eksikliği, kayma stresi ve türbülansta azalma ve değişen besin kaynaklarına sürekli maruz kalma sayılabilir. Bir Döner Hücre Kültür Sistemi (RCCS) biyoreaktörü tarafından sağlanan bu dinamik koşullar, uzamsal birlikte lokalizasyonu ve tek hücrelerin agregalara üç boyutlu montajınıdesteklemektedir 6,7.
Önceki çalışmalar, kemik rejenerasyonu8, diş mikrobu kültürü9 ve insan diş folikül hücrelerinin kültürü10 için döner bir biyoreaktörün avantajlarını göstermiştir. RCCS'nin EOE hücre proliferasyonunu ve ameloblastlara farklılaşmasını arttırdığını öne süren bir rapor da vardır11. Bununla birlikte, farklılaşmış hücreler, uzamış morfolojileri veya polarize hücre şekilleri dikkate alınmadan, ameloblastin immünofloresansına ve / veya amelogenin ekspresyonuna dayanan ameloblastlar olarak kabul edildi11 .
NASA tarafından geliştirilen döner duvar damarları (RWV) biyoreaktörüne ek olarak, hücrelerden 3D agregalar üretmek için diğer teknolojiler arasında manyetik levitasyon, rastgele konumlandırma makinesi (RPM) ve klinostat12 bulunmaktadır. Manyetik levitasyon elde etmek için, manyetik nanopartiküllerle etiketlenmiş hücreler harici bir manyetik kuvvet kullanılarak havaya kaldırılır, bu da adiposit yapılarının biyofabrikasyonu için kullanılan iskelesiz 3D yapıların oluşumuna neden olur13,14,15. Mikro yerçekimini simüle etmek için başka bir yaklaşım, klinostat16 adı verilen bir cihazın merkezindeki kümülatif yerçekimi vektörünün iptali ile sonuçlanan iki eksen hakkında eşzamanlı dönüşü kontrol ederek çok yönlü G kuvvetlerinin üretilmesidir. Kemik iliği kök hücreleri bir klinostatta kültürlendiğinde, osteoblast farklılaşmasının baskılanması yoluyla yeni kemik oluşumu inhibe edildi ve bu da mikrogravitenin farklılaştırıcı etkilerinden birini gösterdi16.
Ameloblastların sadık kültürünü kolaylaştırmak için in vitro sistemler, diş minesi doku mühendisliğine doğru büyük bir adım atacaktır17. Ne yazık ki, bu tarihe kadar, ameloblastların kültürü zorlu bir girişim olmuştur18,19. Şimdiye kadar, fare ameloblast soy hücre hattı (ALC), sıçan diş epitel hücre hattı (HAT-7), fare LS8 hücre hattı20, domuz PABSo-E hücre hattı 21 ve sıçan SF2-24 hücre hattı22 dahil olmak üzere beş farklı ameloblast benzerihücre hattı bildirilmiştir. Bununla birlikte, bu hücrelerin çoğunluğu 2D kültüründe ayırt edici polarize hücre şeklini kaybetmiştir.
Bu çalışmada, mezenkimal progenitörlerle birlikte kültürlenmiş servikal döngü epitelinden ameloblast benzeri hücrelerin büyümesini kolaylaştırmak ve yerçekimine bağlı besin akışının azalması ve sitoiskelet değişiklikleri de dahil olmak üzere 2D kültür sistemlerinin zorluklarının üstesinden gelmek için bir Döner Hücre Kültürü Biyoreaktör Sistemine (RCCS) döndük. Ek olarak, RCCS, periodontal doku mühendisliği ile ilgili hücre / iskele etkileşimlerinin incelenmesi ve inflamatuar mediatörlerin akciğer alveoler dokuları üzerindeki etkilerinin in vitro olarak incelenmesi için yeni yollar sağlamıştır. Birlikte, bu çalışmalardan elde edilen sonuçlar, mikrogravite tabanlı döner kültür sistemlerinin farklılaşmış epitelinin yayılması ve hücre / iskele etkileşimleri ve enflamatuar koşullara doku yanıtı da dahil olmak üzere in vitro olarak yetiştirilen hücreler üzerindeki çevresel etkilerin değerlendirilmesi için faydalarını vurgulamaktadır.
Protokol
Çalışmanın TAMU kurumsal hayvan bakım kılavuzlarına uygun olmasını sağlamak için gerekli tüm kurumsal onay alınmıştır.
1. Biyoreaktör montajı ve sterilizasyonu
- Plastik alet çevrimindeki bir otoklavda biyoreaktör için dört yüksek en-boy oranlı kabı (HARV), üretici tarafından önerildiği şekilde 121 ° C'de 20 dakika boyunca sterilize edin.
- Sterilizasyondan sonra, biyoreaktörle birlikte verilen vidaları sıkarak kapları bir hücre kültürü davlumbazına monte edin ve ardından kaplar kullanıma hazır hale gelir.
2. Biyoreaktör ko-kültür deneyi için kullanılan iskeleler
- Daha fazla büyüme için gerekli hücre bağlanmasına destek sağlamak için iskeleleri hücrelerle birlikte inkübe edin.
- Ortak kültür çalışmaları için PGA bazlı iskeleler, hidroksiapatit iskeleleri, grafen levhalar, jelatin diskler ve kollajen bazlı iskeleler arasından seçim yapın.
3. Servikal Döngü (CL) diseksiyonu ve tek hücre hazırlığı
- CO2 doz aşımı ile solunum durmasını takiben dekapitasyon ile fareleri kurban edin.
NOT: Tüm hayvan çalışmaları TAMU kurumsal hayvan bakım kılavuzlarına uygundur. - Servikal döngüleri, daha önce yayınlanmış bir protokol23'ün değiştirilmiş bir versiyonunu takiben 6 günlük doğum sonrası (DPN) farelerden disseke edin.
NOT: Çalışmamızda servikal döngünün daha önce yayınlanmış protokolde gösterilmeyen distal kısmı dahil edilmiştir (Şekil 3).- Disseke edilmiş dokuyu sindirimden önce soğuk steril PBS ile yıkayın, kollajenaz 37 ° C'de 30 dakika boyunca dispase ile yıkayın.
- Çözeltiyi 70 μm steril hücre süzgecinden geçirin ve 10 dakika boyunca 800 x g'de daha fazla santrifüj yapın.
- Süper natantı atın. Pelet santrifüjleyin ve 800 x g'da soğuk PBS ile iki kez yıkayın. Süper natantı atın.
- Bir hemositometre kullanarak hücreleri sayın ve damar başına 1 X 105 hücre ekleyin.
4. Diş pulpası hücre kültürü ve hücre hattı genişlemesi
- Plaka diş pulpası hücreleri, 100 mm'lik bir doku kültürü plakasında, 4. geçitte 1 x 105 konsantrasyonunda.
- %10 fetal sığır serumu (FBS) ve %1 antibiyotik/antimikotik (P/S) ile desteklenmiş DMEM yüksek glukoz ortamından oluşan kültür için ortam hazırlayın.
- Hücreler% 85-90 birleşime ulaştığında, ortamı aspire edin ve plakaları önceden ısıtılmış PBS ile iki kez yıkayın.
- PBS yıkamasından sonra, plakaya önceden ısıtılmış% 0.25 Tripsin-EDTA çözeltisi ekleyin ve diş pulpası hücresi içeren plakaları 37 ° C'de 3 dakika boyunca inkübe edin.
- Mikroskop kullanarak görsel inceleme ile hücre ayrılmasını onaylayın.
- Ortamları kültür plakasındaki hücrelerle birlikte toplayın ve 25 mL'lik bir pipetle 50 mL'lik steril konik tüpe aktarın.
- Hücreleri 8 dakika boyunca 800 x g'de santrifüj edin ve süpernatanı atın. Hücreleri taze ortamda yeniden askıya alın ve bir hemositometre kullanarak sayın.
- Servikal döngü hücreleri ile ko-kültür için, biyoreaktördeki diş pulpası hücrelerini damar başına 1 x 104 konsantrasyonda tohumlayın.
5. RCCS biyoreaktörü içindeki bir iskele üzerinde servikal döngü / diş pulpası hücrelerinin ortak kültürü
- Hem hücre tiplerini, servikal döngüyü hem de diş pulpasını keratinosit SFM ortamını içeren kültür ortamına, takviyeli büyüme faktörleri, hücre dışı matriks proteinleri ve iskeleler ile ekleyin.
NOT: Büyüme faktörleri 0.03 μg / mL kemik morfogenetik protein 2 (BMP 2), 0.03 μg / mL kemik morfogenetik protein 4 (BMP-4), 10 ng / mL insan rekombinant fibroblast büyüme faktörü (hFGF) ve 15 ng / mL epidermal büyüme faktörü (hEGF) konsantrasyonunda eklenirken, ECM bileşenleri 200 μg / mL Matrigel, 5 μg / mL laminin ve 5 μg / mL fibronektin içerir. - 1 mg LRAP (Lösin bakımından zengin amelogenin peptid) peptidi, domuz dişlerinden hazırlanan 1 mg liyofilize erken evre emaye matriksi24, 5 μg/mL laminin ve 5 μg/mL fibronektin ile zenginleştirilmiş 500 μL kollajen jeli karışımına sahip kaplama iskeleleri.
NOT: Bu, deneylerimiz için en iyi sonucu verdi. - İskele kaplamasını takiben, biyoreaktöre hem hücreleri hem de iskele ekleyin ve biyoreaktörü kap başına 10 mL ortam ile doldurun.
- Ortam, hücre ve iskelelerin eklenmesinden sonra biyoreaktör kabının doldurma portu kapağını kapatın.
- Steril valfleri deneyin başında şırınga portlarına takın ve deneyin sonuna kadar bir kapakla yerinde tutun.
- Kap% 90 dolduğunda ve dolum portu kapakları kapatılıp sıkıldıktan sonra, steril vanaları açın.
- Her medya değişikliği gerektiğinde iki steril şırınga (3 mL) kullanın. Bir şırıngayı taze ortamla doldurun, diğer şırınga boş bırakın.
- Her iki şırınga valfini de açın ve kabarcıkları boş şırınga portuna doğru yavaşça manevra yapın.
- Dolu şırıngadan taze ortam kaba dikkatlice enjekte edildikten sonra, kabarcıkları boş şırınga portundan çıkarın.
NOT: Bu prosedür, tüm mikro kabarcıklar damarlardan çıkarılana kadar gerçekleştirilir. - Şırınga portlarını kapaklarla kapatın ve şırıngaları keskin bir atık kabına atın.
- Her bir kabı rotatör tabanına takın ve rotatör tabanını %5 CO2 ve 37 °C sıcaklığa sahip bir inkübatöre yerleştirin.
- Gücü açın ve dönme hızını 10,1 rpm'ye ayarlayın.
NOT: İskelelerin kap duvarına dokunmadan süspansiyonda olduğundan emin olmak için hızı ayarlayın. - Medya değişimi için, hücrelerin dibe çöktüğünden emin olmak için damarları dik konuma getirin. Şırınga portlarını açın ve steril şırıngaları portlara bağlayın.
- Beslenme tükenmiş ortamın %75'ini aspire ederek ve diğer porttan taze ortam enjekte ederek aynı prosedürü uygulayın.
6. Akciğer organı hazırlığı ve biyoreaktör bazlı kültür
NOT: Akciğer organlarının hazırlanmasında E15 vahşi tip fare yavruları kullanılmıştır.
- CO2 boğulması ile hamile bir dişi fareyi ötenazi yaptıktan sonra akciğer dokusunu disseke edin.
- Servikal çıkık ile boğulmayı takiben ölüm doğrulandıktan sonra, göğüs boşluğunu açığa çıkarmak için bir neşter kullanın. Bundan sonra, yavruları uterustan çıkarın ve kafa kesme yoluyla ötenazi yapın.
- Ötanizasyondan sonra, akciğerleri bulmak için bir neşterle açarak göğüs boşluğunu hazırlayın. Akciğer dokusunun küçük bölümlerini steril PBS ile yıkayın ve% 5 CO 2 ve 37 °C sıcaklık içeren bir inkübatörde organ kültürü ortamı ile2 saat boyunca önceden sterilize edilmiş bir zar üzerine yerleştirin.
- Akciğer dokuları bir 2D organ kültürü plakasındaki zara bağlandığında, numuneleri biyoreaktör kabına aktarın.
- Medyayı kültüre hazırlayın.
NOT: Kontrol DMEM yüksek glukoz ortamı% 10 fetal sığır serumu (FBS),% 1 antibiyotik çözeltisi (P / S) (penisilin, 100 U / mL, streptomisin, 50 μg / mL) ve 100 μg / mL askorbik asit (AA) içerir ve enflamatuar durumların indüksiyonu için kontrol ortamı 5 ng / mL IL-6 proteini ile desteklenir. - Akciğer kültürü deneyini, yukarıda açıklandığı gibi biyoreaktörde her 48 saatte bir medya değişikliği ile 10 gün boyunca gerçekleştirin.
7. İnsan periodontal ligament (hPDL) hücre kültürü ile kaplanmış iskele
- Kültür insan periodontal ligament hücreleri.
NOT: Hücreler, daha önce yayınlanan protokole göre laboratuvarımızda izole edilir ve kültürlenir25. - Kollajen iskele disklerini kontrol grubu için 30 μL PBS ve nöropeptit galanin (GAL) ile gece boyunca 10-8 konsantrasyonda kaplayın.
- Tohum insan PDL hücreleri kontrol ve GAL kaplı iskele üzerinde 2 saat boyunca 37 °C'de bir kültür plakasında ve hücre tohumlu iskeleleri yukarıda belirtildiği gibi bir biyoreaktör kabına aktarır.
- Analiz için iskeleleri toplamadan önce biyoreaktörde 14 gün boyunca hücre tohumlu iskeleleri kültürleyin.
8. Biyoreaktör temizliği ve bakımı
- İskeleler/hücreler biyoreaktörden toplandıktan sonra, şırınga portlarını gemiden çıkarın.
NOT: Kapların etrafındaki vidalar çıkarılır ve kap sabunlu su ile nazikçe yıkanır. - Kapları temiz suyla durulayın ve vidaları bir kez daha sıkın.
- Otoklavlamadan sonra kapları bir sonraki kullanıma kadar saklayın.
Sonuçlar
Biyoreaktörün iç odası, hücrelerin çoğalması ve farklılaşması, bir iskeleye bağlanması veya doku benzeri montajlar oluşturmak için toplanması için bir ortam sağlar. Her HARV damarı 10 mL'ye kadar ortam tutar ve her hücrenin hayatta kalmak için mükemmel bir şansa sahip olması için sürekli bir besin dolaşımını kolaylaştırır. Şekil 1A , şırınga portlarının, steril tek elden valflerin takılı olduğu kabın ön plakasına tutturulmasını göstermektedir. Bu vanalar kültür odasına kapıcı görevi görür. Orta değişim, taze ortam içeren steril bir şırınganın takılmasını kolaylaştırmak için durdurma musluğu valfinin açılmasını gerektirir. Biyoreaktör içindeki mikro yerçekimi ortamı, hücrelerin iskelelere önceden tohumlama gerektirmeden kap içindeki iskeleye yapışmasını sağlar. Biyoreaktöre yerleştirilen iskele (Şekil 1B ve 1C) sürekli olarak döner ve hücrelerin iskele yüzeylerine yapışmasına ve sitoiskelet ağları oluşturmasına izin verir. Damar plakasının altındaki oksijenatör membranı (Şekil 1B), hücre sağkalımını ve ömrünü artırmak için sürekli gaz değişimine izin verir.
Hücrelerle en uyumlu iskeleyi belirlemek için çeşitli iskeleler test edildi. Şekil 2A ve 2B'deki iskele, %75 grafen ve %25 PLG'den (polilaktik glikolit) oluşan bir grafen tabakasıdır. Bu elektriksel olarak iletken iskele, iskelet kası hücreleri gibi elektriksel stimülasyon gerektirebilecek hücreler için sıklıkla kullanılır26. Çalışmalarımızda, kollajen iskelesi, biyouyumluluk, doku büyümesinin teşviki ve hücresel farklılaşma açısından test edilen diğer tüm çalışmaları geride bırakmıştır. Bu kollajen bazlı iskelenin özel gözenekli yüzeyi (Şekil 2C ve 2D), hücrelerin ve besin maddelerinin iskele boyunca akmasına izin vererek hücre bağlanma ve hücre çoğalması alanını arttırır.
Servikal döngünün fare mandibulası ile ilişkili konumu Şekil 3A ve 3B'de gösterilmiştir. Fare kesici servikal döngü hücrelerini hazırlamak için, iskeletleştirilmiş bir fare mandibulası diseke edildi ve alt fare kesici dişinin en distal-en kısmı açığa çıkarıldı. Rezeke edilen servikal döngünün kesin konumu doğum sonrası 6 günlük fare kesici ucunda (Şekil 3B) belirtilirken, yetişkin iskeletli bir fare mandibulasındaki benzer bir bölge, oryantasyon amacıyla Şekil 3A'da referans olarak verilmiştir. İskeletize edilmiş yetişkin (Şekil 3A) ve 6 dpn taze hazırlanmış fare kesici dişindeki karşılık gelen servikal döngünün alanı iki kırık çizgi ile çerçevelenmiştir (Şekil 3A ve B). Hemi mandibulalarının dişlenmesi üç mandibuler azı dişi ve sürekli büyüyen bir kesici dişten oluşurken, servikal döngü hücre nişi, iç mine epiteli, dış mine epiteli, yıldız retikulumu ve stratum intermedium19 gibi mine oluşumunda rol oynayan karışık bir hücre popülasyonundan oluşur.
Şekil 4, servikal döngü hücrelerinin uzamış, polarize, ameloblast benzeri hücreler salgılayan emaye proteinine başarılı bir şekilde farklılaşmasına odaklanmaktadır. Veriler, ameloblast benzeri hücreler salgılayan uzun, polarize, emaye proteininin başarılı bir şekilde farklılaşmasının, servikal döngü hücrelerinin diş pulpası kök hücreleri gibi mezenkimal kök hücrelerle birlikte kültürlenmesini gerektirdiğini ortaya koymuştur. Kültürlenmiş hücrelere, protokolün 3. adımında açıklandığı gibi uyarlanmış bir mikro ortam sağlandı, bu da bir ucunda çekirdek ve diğer27'de uzun bir hücresel süreç olan polarize hücrelerin oluşumuna neden oldu, bu da ameloblastların tipik bir özelliğidir (Şekil 4A). Tek başına ve büyüme faktörleri ve/veya iskele kaplaması olmadan medyanın uygulanması, anahtar emaye proteinlerini salgılayan ancak uzamayan veya polarize olmayan servikal döngü hücreleri ile sonuçlandı (Şekil 4B).
Galanin kaplı ve kaplanmamış kollajen iskeleleri, bir biyoreaktörde on dört gün boyunca hPDL hücreli bir biyoreaktöre yerleştirildi. Hücreler 3D kültür sisteminde iki haftalık bir kültür periyodundan sağ kurtuldular ve galanin kaplı iskele grubu, kaplanmamış iskeleler içeren kontrol grubuna kıyasla önemli ölçüde daha yüksek bir proliferasyon oranı (Şekil 5B) gösterdi (Şekil 5A). Deney grubundaki hücreler ayrıca kontrole kıyasla bağ dokusu lifleri içeren hücre dışı matriksin önemli ölçüde daha yüksek bir seviyesini göstermiştir.
Biyoreaktör ortamı, 3D mikro yerçekimi ortamında akciğer segmentlerinin büyümesi için başarılı olduğunu kanıtladı (Şekil 6). Bu çalışma için, E15 farelerinden toplanan akciğer dokusu segmentleri (Şekil 6C), iki saat boyunca bir organ kültürü kabında bir nitroselüloz zarına yerleştirildi. Membrana ilk doku bağlanmasını takiben, akciğer dokusu / nitrosellüler membran kompoziti biyoreaktör damarına yerleştirildi ve 10 gün boyunca başarıyla kültürlendi (Şekil 6A). Enflamatuar durumların akciğer dokusu büyümesi üzerindeki etkilerini incelemek için, kültür ortamına IL-6'nın eklenmesi, in vivo görülenlere benzer şekilde alveoler morfolojide tipik inflamasyonla ilişkili değişikliklerle sonuçlanmıştır (Şekil 6B).

Şekil 1. Bir biyoreaktör kabının bileşenleri. Şekil 1, bir biyoreaktör kabının temel bileşenlerini ve bunların montaj öncesi aşamadaki konumlarını göstermektedir. (A) Reaktör odasının, şırınga portlarının ve iskelenin göreceli konumu. (B) Ön plakanın (şeffaf kapak) ve arka plakanın (oksijenatör membranı ile kaplı beyaz plaka) yarı açık pozisyonu. İskele, ön ve arka plaka arasında merkeze yerleştirilmiştir. Siyah renkli grafen iskelesi (C), bir iskelenin kabın içine nasıl yerleştirildiğini ve hücrelerin çoğalması, farklılaşması ve hücresel bir ağ oluşturması için bir destek olarak kullanıldığını gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2. Bu çalışmada test edilen iskelelerin temsili illüstrasyonları. Biyoreaktör çalışmalarımız için beş iskele test edildi ve bunlardan iki örneği burada sunuldu. (A,B), ameloblast benzeri hücre büyümesi için test edilen grafen iskelesini temsil ederken, (C,D), biyoreaktör bazlı hücre kültürü çalışmalarımız için en başarılı kollajen iskelesini temsil eder. Kollajen iskelesinin (C,D) gözenekli yapısına ve grafen iskelesindeki (A,B) paralel yüzey kabartma dizisine dikkat edin. (A,C) dik perspektiften çekilmiş, (B,D) ise 45° açıyla görüntülenen makrograflardır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
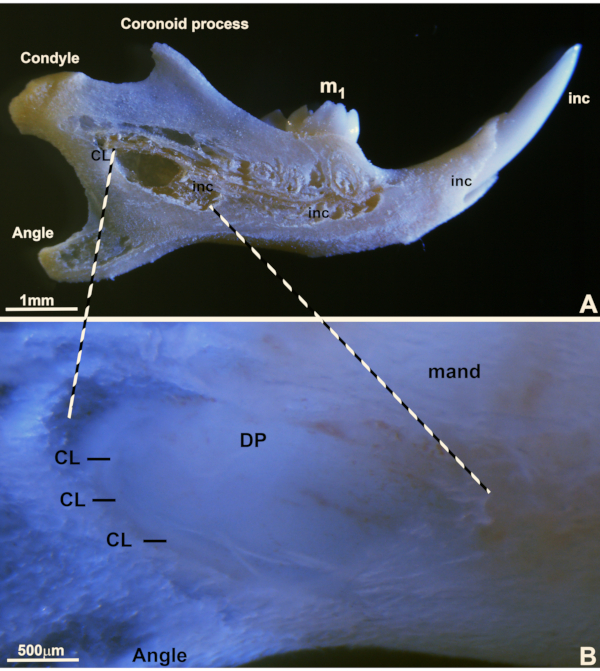
Şekil 3. Servikal döngü hazırlığı. A'daki iskeletleştirilmiş yetişkin fare mandibulası, hücre nişini ameloblast benzeri hücre kültürü ve farklılaşması için hazırlamak için kullanılan servikal döngü bölgesini göstermektedir. Bu makrografik ayrıca, neredeyse tüm mandibuler uzunluğu kapsayan sürekli büyüyen kesici (inc), ilk mandibuler molar (m1) ile birlikte mandibulanın açısı, koronoit süreç ve mandibuler kondilin pozisyonu dahil olmak üzere anatomik belirteçlerin konumunu göstermektedir. Bu iskelet preparatı, (B)'de hazırlanan servikal döngü bölgesi için anatomik bir oryantasyon görevi görür. Referans noktaları arasında mandibuler kemik (mand), dental papilla dokusu (DP), mandibulanın açısı (Açı) ve ameloblast biyoreaktör çalışmalarımız için hücrelerin toplandığı servikal döngünün (CL) konumu bulunmaktadır. Kırık çizgi, iskeletleştirilmiş yetişkin mandibulada (A) ve 6 dpn taze diseke edilmiş mandibulada (B) servikal döngü diseksiyonu için hazırlanan federe mandibuler pencerenin anterior ve distal kısmını gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4. 3D ko-kültür yaklaşımı kullanılarak ameloblast benzeri hücrelerin üretilmesi. (A) Ameloblast benzeri hücrelerin, uygun bir mikro ortamda diş pulpası kök hücreleri ile birlikte kültürlenmiş servikal döngü hücrelerinden başarılı bir şekilde farklılaşması. Ortaya çıkan hücre popülasyonu, mine matriks proteinlerini salgılama yeteneğine sahip uzun, uzun, polarize hücrelerden oluşuyordu. Bu hücreler, bir ucunda bir çekirdeğe (nucl) ve diğer ucundaki gerçek ameloblastlarda (A) gözlendiği gibi Tomes Sürecine benzeyen bir hücresel sürece (proc) sahipti. (B) aynı zamanda ko-kültür koşullarına maruz kalan, ancak büyüme faktörleri veya farklılaşma ajanları içermeyen ortamlarla birlikte, tipik ameloblastları temsil etmeyen yuvarlak hücrelerle sonuçlanan bir kontrol grubu hücre popülasyonunu gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5. Kaplamalı ve kaplamasız iskele yüzeyleri ile tek hücreli periodontal progenitör (pdl) popülasyonunun uzun süreli 3D kültürü. İskele kaplaması, galanin kaplı iskele (B) üzerinde kültürlenen hücrelerde hPDL hücre proliferasyon oranında, kaplanmamış bir iskeleye (A) maruz kalan kontrol grubu hücrelerine kıyasla bir artışa neden olmuştur. Deney grubundaki hücreler ayrıca kontrol grubuna kıyasla bağ dokusu lifleri içeren daha fazla hücre dışı matris salgıladılar (B'ye karşı A). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 6. Bir biyoreaktörde akciğer dokusu kültürü. (A) Bir biyoreaktörde nitroselüloz membran üzerinde on gün boyunca kültürlenen E15 akciğer dokusu segmentleri. (B) E15 akciğer dokusu segmentleri (A)'ya benzer, ancak ortama IL-6 eklenerek enflamatuar koşullara maruz kalır (B). (C) H&E ile boyanmış yeni disseke edilmiş bir E15 akciğer dokusunun parafin bölümü. (A) ve (C) ile karşılaştırıldığında alveoler tip I ve tip II hücre morfolojilerindeki benzerliklere dikkat edin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Mikrogravitedeki hücrelerin büyümesi için protokolün kritik adımları arasında biyoreaktör, iskele, 3D kültür için kullanılan hücreler ve hücre farklılaşmasını indüklemek için bir araç olarak iskele kaplaması bulunur. Çalışmalarımızda kullanılan biyoreaktör tipi, NASA tarafından simüle edilmiş mikro yerçekiminde hücreleri büyütmek için geliştirilen orijinal Döner Hücre Kültür Sistemi (RCCS) dönen silindirik doku kültürü cihazının yakın tarihli bir modifikasyonu olan RCCS-4 biyoreaktörünü içermektedir. Bu RCCS-4 ortamı, kütle transferini ve kültür performansını artıran son derece düşük kesme gerilimleri sağlar. Biyoreaktörün bu versiyonu, aynı anda dört farklı deney için dört kabın aynı anda kullanılmasına izin verdi. RCCS-4 biyoreaktörü, çalışmalarımız için yeterli sayıda hücreyle basit ve düz ileri kültür koşullarını sağlayan yüksek en-boy oranı (HARV) kapları ile donatılmıştır.
Yaklaşımımızın ikinci kritik bileşeni, yüzen hücrelerin eklenmesi ve montajlar oluşturması için şablonlar sağladıkları için iskelelerdir. 2D kültürde iskelelerin kullanımı nekrotik çekirdeklerin oluşumu nedeniyle sınırlı olsa da, döner bir biyoreaktördeki gelişmiş difüzyon, oksijen ve besin akışı, iskelelerin hücre düzeneklerinin yayılması için taşıyıcı olarak uygulanabilirliği üzerine gelişir28,29. Bu çalışmada beş tip iskelenin, poli(laktik-ko-glikolik asit (PLGA) iskelelerinin, kollajenöz ve gözenekli iskelelerin, grafen iskelesinin yanı sıra jelatin disk ve hidrodroksiapatit diskin etkinliğini araştırdık. Ek olarak, membranı akciğer organı prekültür ortamından biyoreaktöre aktardık, kültürlenmiş akciğer segmenti ona bağlıydı. Bunlar arasında, kollajen iskelesi, muhtemelen kolajen bileşimi ve gözenekli yapısı nedeniyle, çalışmalarımızda en uygun iskele olarak ortaya çıkmıştır. PLGA iskelesi canlı hücreler verirken, diğer üç iskele elimizde daha az elverişliydi. Orijinal akciğer organ kültürü sisteminin nitroselüloz zarı, 3D biyoreaktör ortamına aktarıldıktan sonra kültürlenmiş akciğerin bütünlüğünü başarıyla koruduğu için başka bir etkili iskele olduğu kanıtlanmıştır.
Stratejimizin üçüncü bir kritik bileşeni, damarı tohumlamak için kullanılan hücre türleridir. Amelogenez çalışmalarımız için, diş pulpası hücreleri ile birlikte kültürlenen sürekli büyüyen fare kesici dişlerinden hazırlanan servikal döngü hücrelerine güvendik. Servikal döngü hücreleri, kemirgen kesici dişinde sürekli yenilenen orijinal emaye organ progenitörlerinin kaynağı olarak seçildi. Fare veya sıçan kesici dişi, hayvanın yaşamı boyunca var olmaya devam eden kök ve progenitör hücrelerin dikkate değer bir kaynağıdır, emaye organının hücreleri sürekli erüpsiyon ve amelogenez23,30 için yenilenir. Hem periodontal progenitör hücreler hem de diş pulpası hücreleri ko-kültür hücre kaynakları olarak kullanıldı. Epitel hücrelerinin başarılı kültürü için mezenkimal ko-kültür hücre popülasyonlarının kullanımı iyi bilinmektedir31,32. Çalışmalarımızda, dental pulpa hücreleri, mezenkimal özelliklerine göre her ikisi de odontojenik ve mezenkimal ko-kültür adayları olarak uygun olmasına rağmen, ameloblast farklılaşmasının indüklenmesinde periodontal ligament progenitörlerine göre daha etkili olmuştur. Amelogeneze doğru uygulandığında, diş gelişimi sırasında odontojenik epitelin doğal karşılığı olarak diş pulpası hücreleri, terminal ameloblast farklılaşmasının indüksiyonu için uygun epitel-mezenkimal etkileşimleri tetiklemiş olabilir33,34. Bununla birlikte, periodontal doku mühendisliği için iskele etkileşimlerinin incelenmesi için, periodontal progenitörler, tamamen farklılaşmış periodontal ligament fibroblastlarına yol açtıkları için ideal olarak uygundur25,35. Son olarak, bir biyoreaktör ortamında akciğer organlarının kültürü için, disseke edilmiş embriyonik murin akciğer segmentlerine güvendik. Organ kültürü yemeklerinde embriyonik akciğer organlarının kültürlenmesine yönelik prosedürlerdaha önce 36 ve akciğer epitel hücrelerini vasküler veya düz kas hücreleri ile birleştiren bir dizi iki boyutlu hücre kültürü modeli araştırılmıştır37,38,39. Bu çalışmada, 3D biyoreaktör modeli, kültürlenmiş doku bloğunun çekirdeğinin bütünlüğünü korurken sağlam bir yüzey aktif madde sekresyon seviyesini koruyarak bu modeli akciğer dokusu bütünlüğü üzerindeki çevresel etkilerin incelenmesi için uygun hale getirmiştir.
Modelimizin dördüncü önemli yönü, ameloblast benzeri hücre farklılaşmasını tetiklemek için iskele yüzeylerine hücre tipine özgü kaplamaların uygulanmasıdır. Spesifik olarak, LRAP ve emaye matrisi gibi bileşenler, LRAP ve ilk emaye matrisi ile kaplama eksikliğinin uzun ve polarize hücrelerin oluşumunu yasaklaması nedeniyle ameloblast benzeri hücre farklılaşmasına katkıda bulunan kilit faktörler olarak ortaya çıkmıştır. Birlikte, iskele yüzeylerinin kaplanması, biyoreaktörlerdeki karmaşık organların dokuya özgü farklılaşmasını teşvik etmek için güçlü bir araç sağlar.
Bu çalışmanın en önemli yönü, ameloblastların ayırt edici uzatılmış ve polarize hücre şeklini geri kazanma yeteneğiydi. Bu sonuç, 3D biyoreaktör sisteminin, emaye-organ türevi hücrelerini oldukça yuvarlayan 2D kültür sistemlerinin sınırlamaları üzerindeki benzersiz bir yararıdır. Bu sonuç, diğer kültür teknolojileriyle uyumlu olmayan hücreleri kültüre alırken biyoreaktör teknolojilerinin kullanılmasının yararına daha fazla kanıt sağlar40. Ameloblast ko-kültür çalışmalarının başarısını, sürekli besin maddeleri, büyüme ve transkripsiyon faktörleri ve oksijen tedarikinin yanı sıra bireysel hücrelerin çeşitli soylardan ve gelişim aşamalarından hücreler arasında sosyal etkileşimler toplama ve oluşturma yeteneği de dahil olmak üzere döner biyoreaktör sisteminin çeşitli benzersiz özelliklerine bağlıyoruz. Çalışmalar uzamış, polarize ve amelogenin salgılayan ameloblast benzeri hücrelerin büyümesini başarırken, burada yetiştirilen ameloblast benzeri hücreler izolasyonda kalır ve ameloblast hücre sırasının doğal sürekliliği kaybolur. Gelecekteki uygulamalarda, bu teknoloji ile yetiştirilen ameloblast benzeri hücreler, emaye doku mühendisliği uygulamaları için veya diş amelogenezinin yönlerini özetlemek için deneysel bir model olarak kullanılabilir.
Sonuç olarak, 3D biyoreaktör, servikal döngü / diş pulpası ko-kültürlerinin ameloblastlara yayılması, kaplanmış iskelelerde periodontal ligament progenitörlerinin büyümesi ve tüm akciğer organlarının kültürü için başarılı bir ortam olarak ortaya çıkmıştır. Bu verilere dayanarak, biyoreaktör tabanlı teknolojilerin, diş minesi, periodontal ve akciğer araştırması gibi alanlarda ileri doku mühendisliği veya test stratejileri için önemli araçlar olarak ortaya çıkması muhtemeldir.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Çalışmalar, Ulusal Diş ve Kraniofasiyal Araştırma Enstitüsü'nden (UG3-DE028869 ve R01-DE027930) gelen hibelerle cömertçe desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibiotic-antimycotic | ThermoFisher Scientfic | 15240096 | |
| Ascorbic Acid | Sigma Aldrich | A4544 | |
| BGJb Fitton-Jackson Modification media | ThermoFisher Scientfic | 12591 | |
| BIOST PGA scaffold | Synthecon | Custom | Available from the company through a custom order |
| BMP-2 | R&D Systems | 355-BM | |
| BMP-4 | R&D Systems | 314-BP | |
| DMEM Media | Sigma Aldrich | D6429-500mL | |
| FBS | ThermoFisher Scientfic | 16140071 | |
| Fibricol | Advanced Biomatrix | 5133-20mL | |
| Fibronectin | Corning | 354008 | |
| Galanin | Sigma Aldrich | G-0278 | |
| Gelatin disc | Advanced Biomatrix | CytoForm 500 | |
| Graphene sheets | Advanced Biomatrix | CytoForm 300 | |
| hEGF | Peprotech | AF-100-15 | |
| hFGF | ThermoFisher Scientfic | AA1-155 | |
| Hydroxyapatite disc | Advanced Biomatrix | CytoForm 200 | |
| Il-6 protein | PeproTech | 200-06 | |
| Keratinocyte SFM media (1X) | ThermoFisher Scientfic | 17005042 | |
| Laminin | Corning | 354259 | |
| LRAP peptide | Peptide 2.0 | Custom made sequence: MPLPPHPGSPGYINLSYEVLT PLKWYQSMIRQPPLSPILPEL PLEAWPATDKTKREEVD | |
| Matrigel | Corning | 354234 | |
| Millipore Nitrocellulose membrane | Merck Millipore | AABP04700 | |
| RCCS Bioreactor | Synthecon | RCCS 4HD | |
| SpongeCol | Advanced Biomatrix | 5135-25EA | |
| Syring valve one way stopcock w/swivel male luer lock | Smiths Medical | MX5-61L | |
| Syringes with needle 3cc | McKESSON | 16-SN3C211 | |
| Trypsin EDTA (0.25%) | ThermoFisher Scientfic | 25200056 |
Referanslar
- Horneck, G., et al. Life sciences: microorganisms in the space environment. Science. 225 (4658), 226-228 (1984).
- Helmstetter, C. E. Gravity and the orientation of cell division. Proceedings of the National Academy of Sciences. 94 (19), 10195-10198 (1997).
- Bizzarri, M., Monici, M., van Loon, J. J. W. A. How microgravity affects the biology of living systems. BioMed Research International. 2015, 863075(2015).
- Freed, L. E., Vunjak-Novakovic, G. Spaceflight bioreactor studies of cells and tissues. Advances in Space Biology and Medicine. 8, 177-195 (2002).
- Walther, I. Space bioreactors and their applications. Advances in Space Biology and Medicine. 8, 197-213 (2002).
- Morabito, C., et al. RCCS bioreactor-based modelled microgravity induces significant changes on in vitro 3D neuroglial cell cultures. BioMed Research International. 2015, 754283(2015).
- Schwarz, R. P., Goodwin, T. J., Wolf, D. A. Cell culture for three-dimensional modeling in rotating-wall vessels: An application of simulated microgravity. Journal of Tissue Culture Methods. 14 (2), 51-57 (1992).
- Nokhbatolfoghahaei, H., et al. Computational modeling of media flow through perfusion-based bioreactors for bone tissue engineering. Proceedings of the Institution of Mechanical Engineers, Part H. 234 (12), 1397-1408 (2020).
- Sun, F. -y, Wang, X. -m, Li, X. -y An innovative membrane bioreactor (MBR) system for simultaneous nitrogen and phosphorus removal. Process Biochemistry. 48 (11), 1749-1756 (2013).
- Steimberg, N., et al. Advanced 3D Models Cultured to Investigate Mesenchymal Stromal Cells of the Human Dental Follicle. Tissue Engineering Methods (Part C). 24 (3), 187-196 (2018).
- Li, P., et al. RCCS enhances EOE cell proliferation and their differentiation into ameloblasts. Molecular Biology Reports. 39 (1), 309-317 (2012).
- Grimm, D., et al. Tissue engineering under microgravity conditions-use of stem cells and specialized cells. Stem Cells and Development. 27 (12), 787-804 (2018).
- Tasoglu, S., et al. Magnetic Levitational Assembly for Living Material Fabrication. Advanced Healthcare Materials. 4 (10), 1469-1476 (2015).
- Sarigil, O., et al. Scaffold-free biofabrication of adipocyte structures with magnetic levitation. Biotechnology and Bioengineering. 118 (3), 1127-1140 (2021).
- Anil-Inevi, M., et al. Biofabrication of in situ Self Assembled 3D Cell Cultures in a Weightlessness Environment Generated using Magnetic Levitation. Scientific Reports. 8 (1), 7239(2018).
- Nishikawa, M., et al. The effect of simulated microgravity by three-dimensional clinostat on bone tissue engineering. Cell Transplant. 14 (10), 829-835 (2005).
- Pandya, M., Diekwisch, T. G. H. Enamel biomimetics-fiction or future of dentistry. International Journal of Oral Science. 11 (1), 8(2019).
- Klein, O. D., et al. Meeting report: a hard look at the state of enamel research. International Journal of Oral Science. 9 (11), 3(2017).
- Liu, H., Yan, X., Pandya, M., Luan, X., Diekwisch, T. G. Daughters of the Enamel Organ: Development, Fate, and Function of the Stratum Intermedium, Stellate Reticulum, and Outer Enamel Epithelium. Stem Cells and Development. 25 (20), 1580-1590 (2016).
- Chen, L. S., Couwenhoven, R. I., Hsu, D., Luo, W., Snead, M. L. Maintenance of amelogenin gene expression by transformed epithelial cells of mouse enamel organ. Archives of Oral Biology. 37 (10), 771-778 (1992).
- DenBesten, P. K., Gao, C., Li, W., Mathews, C. H., Gruenert, D. C. Development and characterization of an SV40 immortalized porcine ameloblast-like cell line. European Journal of Oral Sciences. 107 (4), 276-281 (1999).
- Arakaki, M., et al. Role of epithelial-stem cell interactions during dental cell differentiation. Journal of Biological Chemistry. 287 (13), 10590-10601 (2012).
- Au - Chavez, M. G., et al. Isolation and Culture of Dental Epithelial Stem Cells from the Adult Mouse Incisor. Journal of Visualized Experiments. (87), e51266(2014).
- Pandya, M., et al. Posttranslational Amelogenin Processing and Changes in Matrix Assembly during Enamel Development. Frontiers in Physiology. 8, 790(2017).
- Dangaria, S. J., Ito, Y., Luan, X., Diekwisch, T. G. Differentiation of neural-crest-derived intermediate pluripotent progenitors into committed periodontal populations involves unique molecular signature changes, cohort shifts, and epigenetic modifications. Stem Cells and Development. 20 (1), 39-52 (2011).
- Ahadian, S., et al. Electrical stimulation as a biomimicry tool for regulating muscle cell behavior. Organogenesis. 9 (2), 87-92 (2013).
- Smith, C. E. Cellular and chemical events during enamel maturation. Critical Reviews in Oral Biology & Medicine. 9 (2), 128-161 (1998).
- Pei, M., et al. Bioreactors mediate the effectiveness of tissue engineering scaffolds. The FASEB Journal. 16 (12), 1691-1694 (2002).
- Ahmed, S., Chauhan, V. M., Ghaemmaghami, A. M., Aylott, J. W. New generation of bioreactors that advance extracellular matrix modelling and tissue engineering. Biotechnology Letters. 41 (1), 1-25 (2019).
- Seidel, K., et al. Resolving stem and progenitor cells in the adult mouse incisor through gene co-expression analysis. Elife. 6, (2017).
- Green, H., Rheinwald, J. G., Sun, T. T. Properties of an epithelial cell type in culture: the epidermal keratinocyte and its dependence on products of the fibroblast. Progress in Clinical and Biological Research. 17, 493-500 (1977).
- Green, H. The birth of therapy with cultured cells. Bioessays. 30 (9), 897-903 (2008).
- Zeichner-David, M., et al. Control of ameloblast differentiation. International Journal of Developmental Biology. 39 (1), 69-92 (1995).
- Bei, M., Stowell, S., Maas, R. Msx2 controls ameloblast terminal differentiation. Developmental Dynamics. 231 (4), 758-765 (2004).
- Dangaria, S. J., Ito, Y., Luan, X., Diekwisch, T. G. Successful periodontal ligament regeneration by periodontal progenitor preseeding on natural tooth root surfaces. Stem Cells and Development. 20 (10), 1659-1668 (2011).
- Del Moral, P. M., Warburton, D. Explant culture of mouse embryonic whole lung, isolated epithelium, or mesenchyme under chemically defined conditions as a system to evaluate the molecular mechanism of branching morphogenesis and cellular differentiation. Methods in Molecular Biology. 633, 71-79 (2010).
- Hermanns, M. I., Unger, R. E., Kehe, K., Peters, K., Kirkpatrick, C. J. Lung epithelial cell lines in coculture with human pulmonary microvascular endothelial cells: development of an alveolo-capillary barrier in vitro. Laboratory Investigation. 84 (6), 736-752 (2004).
- Duell, B. L., Cripps, A. W., Schembri, M. A., Ulett, G. C. Epithelial cell coculture models for studying infectious diseases: benefits and limitations. Journal of Biomedicine and Biotechnolog. 2011, 852419(2011).
- Kuppan, P., Sethuraman, S., Krishnan, U. M. In vitro co-culture of epithelial cells and smooth muscle cells on aligned nanofibrous scaffolds. Materials Science and Engineering: C. 81, 191-205 (2017).
- Navran, S. The application of low shear modeled microgravity to 3-D cell biology and tissue engineering. Biotechnology Annual Review. 14, 275-296 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır