Method Article
Vektörlü Gen Teslimatı için İnsan Olmayan Bir Primatta Stensen Kanalı aracılığıyla Retrograd Parotid Bezi İnfüzyonu
Bu Makalede
Özet
Tükürük bezleri, özellikle gen transferi ile aşılama alanında gen tedavisi için doku hedef bölgesi olarak önerilmiştir. Retrograd parotis infüzyonu kullanarak insan olmayan bir primat modelinde gen iletimi gösteriyoruz.
Özet
Tükürük bezleri gen tedavisi için çekici bir doku hedefidir ve umut verici sonuçlar zaten insan deneylerine yol açıpmaktadır. Doğal olarak kan dolaşımına protein salgılayabilirler ve kolayca erişilebilirler, bu da onları gen transferi ile hormon üretimi veya aşılanması için potansiyel olarak üstün doku bölgeleri haline getirir. Gen iletimi için önerilen yöntemler arasında transkütan enjeksiyon ve tükürük kanalları yoluyla retrograd infüzyon bulunur. İnsan olmayan primatlarda Retrograd Tükürük Bezi İnfüzyonunun (RSGI) nasıl gerçekleştirildiğini gösteriyoruz. Temel diş aletleri, polietilen boru ve siyanoakrilat kullanarak Stensen Kanalı'nı kanüle etmek ve sızdırmaz hale getirebilir atraumatik bir yöntem olan parotis papillanın tanımlanması ve uygun infüzyon oranı da dahil olmak üzere önemli anatomik simgesel yapıları açıklıyoruz. Bu en az travmatik doğum yöntemi olmakla birlikte, yöntem hala teslim edilebilen hacim (<0,5 mL) ve kanal ve bezde travma potansiyeli ile sınırlıdır. Floroskopi kullanarak bir infüzyonun beze tam olarak teslim edilebileceğini gösteriyoruz ve immünhistokimya ile tipik bir vektörün transdüksiyonunun ve verilen genin ekspresyonunun daha da gösterileceğini gösteriyoruz.
Giriş
Tükürük bezleri tükürük ekzokrin üretimi ile iyi bilinirken, araştırmacılar proteinleri doğrudan kan dolaşımına salgılama yeteneklerini uzun zamandır fark etmişlerdir 1 , bu da onları yedek hormonlar veya antikor üretimi gibi sistemik uygulama için gen tedavisi için potansiyel bir hedefhalinegetirmektedir. Aslında, tükürük bezleri, salgı için protein üretme yeteneği (bir özellik kaslarının eksikliği), vektör difüzyonunu sınırlandırabilen ağır kapsülleme ve entegre olmayan vektörler için stabilite sağlayan iyi ayırt edilmiş doku gibi diğer doku hedeflerine göre çeşitli avantajlar sunar. Ayrıca, ciddi bir olumsuz olay durumunda, tükürük bezleri yaşam için kritik değildir ve cerrahi olarak çıkarılabilir. Hemen sezgisel olmasa da, parotis bezlerine ana boşaltım kanalı olan Stensen's Duct2aracılığıyla ağızdan kolayca erişilebilir.
Tükürük dokusunun gen tedavisi için avantajları göz önüne alındığında, bu doku hedefini keşfetmeye olan ilgi artmaktadır. Kemirgen, köpek ve insan dışı primat modellerinde çok sayıda çalışma zaten yapıldı ve en az bir insan klinik çalışması devam ediyor3,4,5. Gen tedavisi amacıyla bu doku hedefinin yararını daha fazla araştırmak ve geliştirmek için daha fazla insan dışı primat çalışması yapılması gerekecektir. Bu makalede, insan olmayan primat modelinde transdüksiyon için vektörel bir gen sunmak için Stensen Kanalı aracılığıyla parotis bezlerine erişmek için bir yöntem açıklanmaktadır. İnfüzyonun doğumunun ve kanalın beze girerken anatomisinin gözle görülür bir şekilde ortaya konmasını sağlamak için radyokontrast kullanılarak floroskopi yapıldı. Bir vektörün başarılı bir şekilde transdüksiyonunun ortaya konması için Adenovirüs serotip 5 (Ad5) vektörlü egfp geni kullanılmıştır. Ad5 tükürük dokusunu transdükleyebilen iyi tanımlanmış bir vektördür. Nihai klinik kullanım için çok immünojenik olmasına rağmen, verimli transdüksiyon sağlamak için bu gösteri çalışması için bir Ad5 vektörü seçilmiştir. Geliştirilmiş Yeşil Floresan Protein (EGFP) üretiminin değerlendirilmesi, transdüksiyondan sonra vektörel bir genin başarılı transkripsiyonunu ve çevirisini göstermek için iyi tanımlanmış bir yöntemdir ve burada yapılmıştır.
Protokol
Tüm işlemler hayvan çalışmaları için Wake Forest School of Medicine Clarkson Kampüsü'nde gerçekleştirildi. Etik hususlar için Kurumsal Hayvan Bakım ve Kullanım Komitesi'ne (IACUC) danışıldı ve prosedürlerin ayrıntıları incelenmek üzere sunuldu. Wake Forest IACUC çalışma protokolümüzü onayladı ve tüm prosedürler IACUC onaylı protokol #A17-147 kapsamında yapıldı.
1. infüzyon cihazının hazırlanması
- Bir makas kullanarak 10 Polietilen Tüp (PET10) boyutunu 25 cm uzunluklarda kesin.
- PET10'u siyah bir işaretleyici kullanarak bir uçtan 1 cm ve 2 cm olarak işaretleyin.
- 0,5 mL Ad5-EGFP çözeltisini (109 viral parçacık/mL) 1 mL (tüberkülin) şırınna önceden doldurun.
- PET10 tüpünün işaretlenmemiş ucunun şırıngaya bağlı 29-31 G iğnenin üzerine kaydırın. Bu görevi büyütme altında gerçekleştirmek genellikle daha kolaydır.
- Boru tamamen dolana kadar çözeltiyi PET10'a demleyin (serbest uçta görünür damla).
- Cerrahi önlük, uzun kollu gece elbisesi, geçirimsiz eldiven, cerrahi maske, yüz siperliği, saç bonesi ve ayakkabı kılıfları dahil olmak üzere tam standart KKD kullanın.
2. Hayvanın hazırlanması
NOT: Video gösterimi için cynomolgus makaklar kullanılmıştır. Diğer insan olmayan ve insan primatların anatomisi çok benzerdir ve protokol diğer türlere çevrilebilir olmalıdır.
- Tükürük salgılarını en aza indirmek ve infüzyonun dağılımını ve tutulmasını optimize etmek için işlemden önce 0,05 mg/kg atropin 15 dk deri altından enjekte edin.
- İntramüsküler ketamin/midazolam (10-15 mg/kg ketamin ve 0.01-0.05 mg/kg midazolam) ile 5 mL şırıngır kullanarak anestezi sağlayın. Sakinleştirilmiş hayvan bilinçsiz hale geldiğinde ve uyaranlara tepki veremediğinde uygun anesteziyi onaylayın.
3. Prosedürün gerçekleştirilmesi
- Ağzı açmak için oral retraktörler kullanın.
- Retraktörün bir ucunun kauçuk pedini, üst dişlerin arkasındaki sert damağa, aşılanacak bezin karşısındaki ağzın kenarına yerleştirin. Diğer ucun kauçuk pedini alt köpek üzerine üst retraktörle aynı tarafa yerleştirin. Retraktörün yay eyleminin ağzı genişletmesine ve açmasına yavaşça izin verin.
- Parotis papillayı, Stensen Kanalı'nın açılmasını, arka yanakta, üst 2nd azı dişine bitişik olarak tanımlayın. Bu en iyi büyütme için diş döngüleri kullanılarak görselleştirilir.
- Parotis papillayı konik dilatör noktasıyla hafifçe genişletin. Dilatörün noktasını papillanın ortasına veya açıklığına yerleştirmek ve ardından hafifçe ileri geri döndürmek en iyisidir. Nokta yavaşça papillaya girmeli ve yaklaşık 20 - 30 sn hafif döndürme üzerinde genişletilmelidir.
- PET10 boruyu genişlemiş parotis papillaya yerleştirin. Bu, PET10 tüpünün işaretli ucunu distal ucundan yaklaşık 0,5 cm cımbızla tutarak ve tüpün ucunu genişlemiş papillaya hafifçe yerleştirerek elde edilir.
- Tüpün kaymasına yardımcı olmak için genellikle küçük dönen hareketlerle kolaylaştırılan tüpü hafifçe ilerletin, ardından cımbızın önceki kavramaya 0,5 cm proksimal olarak yeniden doğrulanması. 2 cm işareti parotis papillaya ulaşana kadar bunu tekrarlayın.
- Papilla ve eklenen tüpün etrafındaki yanağa siyanoakrilat uygulayın ve kurumasını bekleyin (belirli bir miktar kaydedilmedi, sadece Stensen'in kanal papillasının girişini mühürlemek için yeterli). Bu genellikle bir dakikadan az sürer ve parotis papillanın sızdırmazlığına ve ağız boşluğuna geri infüze dökülmesini azaltmaya yardımcı olur.
- Şırınd içeriğini 100 μL/dk hızında 5 dakikadan fazla yavaşça itin. Bu yavaş infüzyon oranı, kanal içi basınçtaki ani artış nedeniyle kanal yaralanması riskini en aza indirir.
- pet10 infüzyon tamamlandıktan sonra en az 5 dakika yerinde bırakın. Kanalı kapalı tutun ve infüzyonun parotis bezinde kalmasına izin verin.
- PET10'ı hafif çekiş gücüyle çıkarın. Siyanoakrilat tüple serbest kalacak.
- Karşı tarafta 3.2 ile 3.8 arasında olan adımları yineleyin.
- Her iki parotis aşılandıktan ve her iki PET10 tüpü çıkarıldıktan sonra yavaşça oral retraktörleri serbest bırakın.
NOT: Her iki taraf için de tüm prosedür 30 dakikadan az sürmelidir.
4. Prosedür sonrası bakım
- infüzyon tamamlandıktan ve Stensen'in kanalı dekannüle edildikten sonra, anestezi etkisi geçene kadar hayvanları gözlemleyin (genellikle işlem sonrası 20-30 dakika arasında).
- Hayvan içeceklerini ve daha sonra tamamen uyandıktan sonra yiyecek sunun ve rutin bakıma devam edin.
Sonuçlar
Başarılı prosedür, transdüksiyon ve transkripsiyon
Şekil 1, arka üst yanak üzerindeki 2nd azı dişine bitişik parotis papillayı gösterir. Görüntü ayrıca ağız ayracı, bir lastik ucu sert damakta ve diğer lastik ucun ipsilateral köpek üzerinde doğru yerleşimini gösterir. Şekil 2, PAROTID papillanın PET10'daki 2 cm işaretinde başarılı bir şekilde canülasyonundan sonra çekilen bir görüntüyü göstermektedir. Şekil 3, çözeltinin Stensen Kanalı'ndan ve parotis bezine dallanmasını gösteren bir radyokontrast infüzyonu anında bir floroskopi görüntüsü göstermektedir. Bu floroskopik görüntü sadece bir infüzyonun anatomisini ve dağılımını göstermek amacıyla gerçekleştirildi. Vektör doğumu için bu işlem yapılırken floroskopi gerekli değildir. Şekil 4'te EGFP'nin histopatolojide kırmızı ile immünostain olduğu gösterilmiştir. Hem düktal hem de acinar hücreler kırmızıya boyanmış, bu da her iki hücre tipinde de başarılı transdüksiyon ve transkripsiyon olduğunu gösterir. Özetle, bu dört şekil anatominin görselleştirilmesi ve Ad5 vektörlü EGFP'nin transdüksiyonu ile uygun RSGI'yi göstermektedir.
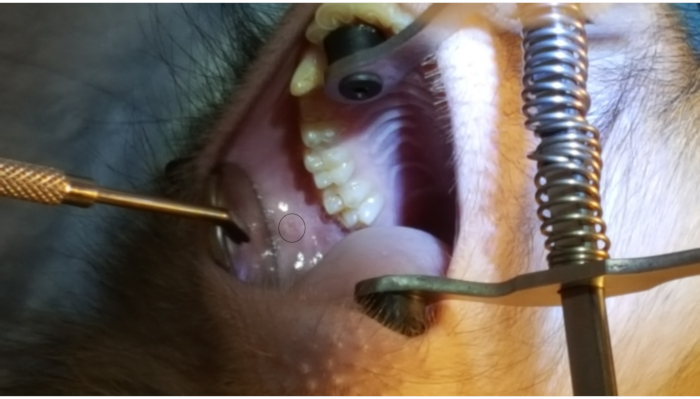
Şekil 1: Parotid papilla. Arka yanak üzerindeki 2nd azı dişine bitişik parotis papillayı vurgulayan figürdeki daireye dikkat edin. Ayrıca, bir lastik ucu sert damakta ve diğer lastik bant alt köpekte olacak şekilde ağız ayracı yerleşimine dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
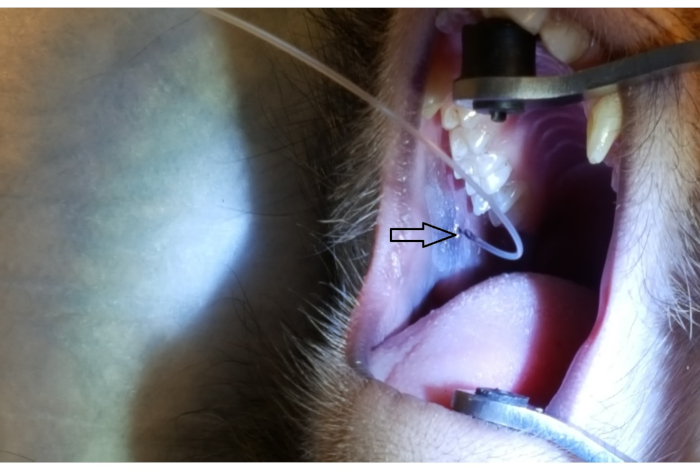
Şekil 2: PET10 tarafından parotid papilla cannülasyonu. PET10 tüpünde, arka yanakta, 2nd üst azı dişinin bitişiğinde bulunan parotis papillada (ok ucu) görülebilen 2 cm işaretine dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Parotis bezine difüzyon gösteren floroskopi görüntüsü. Parotis bezinde (Daire) daha küçük kanallara dallanırken Stensen kanalının (ok ucu) sonunda dallanmayı not edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Parotis bezinin patoloji slaytı. Düktal/acinar parotis dokusu ile EGFP 'nin (kırmızı lekeli) not ifadesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, Stensen Kanalı aracılığıyla parotis bezine retrograd infüzyon protokolünü açıklıyoruz. Açıklanan metodoloji, gen tedavisi ve diğer uygulamalar için bir alan olarak tükürük dokusunun yararını araştıran araştırmacılar tarafından potansiyel olarak kullanılabilecek rehberlik sunmaktadır.
Yordamın başarısını sağlamak için birden çok kritik adım vardır. Her şeyden önce, tüm prosedür adımları nazikçe tamamlanmalıdır. Ağzın güçlü bir şekilde sert bir şekilde sertlenmesi mandibular subluxasyona neden olabilir. Parotis papillanın zorla kavrulması veya çözeltinin Stensen Kanalına hızlı infüzyonu akut düktal yırtıklara veya kronik düktal darlığa neden olabilir.
İkincisi, anestezinin uygulandığını ve etkili olduğundan emin olun. Uygun anestezi olmadan, adımların hiçbiri kolayca gerçekleştirilemez ve hayvan ve insan yaralanması riski önemli ölçüde artar. İnsan dışı primat çalışmalarında standart bir rejim olan ketamin ve midazolam ile kas içi anesteziyi tercih ettik6. Atropinin işlem sırasında tükürük salgılarını azaltmak, anatominin görünürlüğünü artırmak ve transdüksiyondan önce infüzyonun yıkanmasını azaltmak için önemli olduğunu düşünüyoruz7,8.
Genellikle zor olan bir adım, PET10'un parotis papilla ve Stensen Kanalı'na ilk kavruldu ve ilerlemesidir. Pet10'un takarken nazik bir şekilde dönmesi bu adımları kolaylaştırır. Aşırı itme düktal yaralanmalara yol açabilir.
Prosedür esas olarak kırılganlık ve dokunun büyüklüğü ile sınırlıdır. Bu, uygun kanülasyonu, borunun ilerlemesini ve infüzyonun teslimini sağlamak için çok nazik bir teknik ve büyüteç döngülerinin ve küçük aletlerin kullanılmasını gerektirir. Bir diğer potansiyel sınırlama, parotis bezlerinin uyum sağlayabilecek kapasitede olduğu infüzyon hacmidir. Önceki çalışmalar, her parotis bezine maksimum 0,5 mL hacim aşılamıştır, hayvan başına toplam 1 mL6,9,10. Bu, infüzyondaki ilaç konsantrasyonuna bağlı olarak prosedürün kendisini doğrudan etkilemese de, istenen fizyolojik etki için sınırlayıcı olabilir.
Tükürük bezi infüzyonu isteniyorsa RSGI en az travmatik seçeneği sunar. Transkütan veya ABD güdümlü perkütan enjeksiyonlar gibi alternatifler yüz sinir yaralanması riski taşır. Ayrıca, bu prosedürler tüm beze yeterli dağılımı sağlayamayabilirken, RSGI dağıtımı sağlamak için kanal sistemini kullanır. Floroskopi, RSGI'nin tüm bez boyunca iyi dağılım ile tam bir infüzyon sağladığını göstermek için sadece bu makalenin amacı için standart radyokontrast çözeltisi ile gerçekleştirildi. Bu, Ad5 vektörün gerçek infüzyonundan ayrı olarak gerçekleştirildi. RSGI sırasında gen vektörlerinin teslimi için yapılan floroskopi ve/veya diğer röntgen görüntülemeleri yardımcı olmaz ve önerilmez.
Gen transferi ile terapötik alanı gelişmeye devam ettikçe, hedef doku olarak tükürük bezleri zaten popülerlik kazanıyor2,5. Ponzio ve arkadaşları, tükürük bezlerinin bağışıklama için hedef olarak avantajları hakkında harika bir inceleme sunmaktadır4. Gösterdiğimiz kapsüllenmiş, hayati olmayan glandüler dokuya kolayca erişilebildiğini gösterdiğimiz için parotis bezleri ideal bir gen tedavi platformu oluşturmaktadır. RSGI bezlere gen transferi için en az travmatik tekniği sunar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, Prosedürün filme alınmasındaki görsel-işitsel desteği için Bay Cagney Gentry'ye teşekkür etmek istiyorlar. Ayrıca, bu projenin takibinde akademik destek için Hefner VA tıp merkezini de kabul etmek istiyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 500 µL U100 syringes with 30-gauge needles | Becton Dickinson | 328466 | fixed needle for less waste |
| Adhesive (e.g., Ethicon Dermabond) | Various | Cyanoacrylate adhesive to seal and keep the tubing in the duct during infusion. | |
| Atropine injectable solution | Patterson Veterinary | 07 869-6061 | Atropine inj. 0.54 mg/mL |
| BD Ultra-Fine Insulin Syringes 30G | Walmart | N/A | Avilable in 0.5 mL and 1.0 mL sizes. |
| Cyanoacrylate (medical glue) | Ethicon | DNX12 | Dermabond topical skin adhesive |
| Dental loops with light | Amazon (DDP) | B012M3IV80 | Used to enhance visualization of Stensen's duct papilla |
| Infant Lacrimal Dilator | Surgipro | SPOI-137 | |
| Ketamine injectable solution | Patterson Veterinary | 07-803-6637 | Ketaset inj. 100 mg/mL |
| Lacrimal Dilator | Surgipro | SPOI-132 | Used to dialate the Stensen's duct. |
| Midazolam injectable solution | Patterson Veterinary | 07 890-6698 | Midazolam inj. 5mg/mL |
| Pair of scissors | Amazon (DDP) | N/A | Used to cut PET10 tube |
| Polyethylene Tubing (PE-10) | Scientific Comodities, Inc | BB31695-PE/1 | Tubing connecting the 30G syringe and inserted into the duct. |
| Q-tips | Walmart | N/A | Used to spread cyanoacrylate on the cheek |
| Size 10 Polyethylene Tube (PET 10) | Scientific Commodities | BB31695-PE/1 | low density polyethylene tubing |
| Small Animal Mouth Opener | Amazon (DDP) | B01F3LVJXC | Used to keep the animal's mouth open. |
| Tweezers | Amazon (DDP) | N/A | Used to insert PET10 tube into Stenson's duct |
| Zinc Chloride | Sigma-Aldrich | 7646-86-7 | Included in plasmid DNA infusates |
Referanslar
- Isenman, L., Liebow, C., Rothman, S. The secretion of mammalian digestive enzymes by exocrine glands. The American Journal of Physiology. 276, 223-232 (1999).
- Perez, P., et al. Salivary epithelial cells: An unassuming target site for gene therapeutics. The International Journal of Biochemistry & Cell Biology. 42, 773-777 (2010).
- Kochel, T. J., et al. A dengue virus serotype-1 DNA vaccine induces virus neutralizing antibodies and provides protection from viral challenge in Aotus monkeys. Vaccine. 18, 3166-3173 (2000).
- Ponzio, T. A., Sanders, J. W. The salivary gland as a target for enhancing immunization response. Tropical Diseases, Travel Medicine and Vaccines. 3, 4(2017).
- Baum, B. J., et al. Early responses to adenoviral-mediated transfer of the aquaporin-1 cDNA for radiation-induced salivary hypofunction. Proceedings of the National Academy of Sciences of the United States of America. 109, 19403-19407 (2012).
- Voutetakis, A., et al. Sorting of Transgenic Secretory Proteins in Rhesus Macaque Parotid Glands After Adenovirus-Mediated Gene Transfer. Human Gene Therapy. 19, 1401-1405 (2008).
- Niedzinski, E. J., et al. Enhanced systemic transgene expression after nonviral salivary gland transfection using a novel endonuclease inhibitor/DNA formulation. Gene Therapy. 10, 2133-2138 (2003).
- Niedzinski, E. J., et al. Zinc Enhancement of Nonviral Salivary Gland Transfection. Molecular Therapy. 7, 396-400 (2003).
- Samuni, Y., Baum, B. J. Gene delivery in salivary glands: From the bench to the clinic. Biochimica et Biophysica Acta - Molecular Basis of Disease. , (2011).
- Voutetakis, A., et al. Adeno-Associated Virus Serotype 2-Mediated Gene Transfer to The Parotid Glands of Nonhuman Primates. Human Gene Therapy. 18, 142-150 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır