Method Article
Ретроградная инфузия рядовидной железы через проток Стенсена у нечеловеческого примата для векторной доставки генов
В этой статье
Резюме
Слюнные железы были предложены в качестве тканевого целевого участка для генной терапии, особенно в области вакцинации путем переноса генов. Мы демонстрируем доставку генов в модели нечеловеческих приматов, использующей ретроградную инфузию прилежащей артерии.
Аннотация
Слюнные железы являются привлекательной тканевой мишенью для генной терапии с многообещающими результатами, уже приводящими к испытаниям на людях. Они по своей природе способны секретить белки в кровоток и легко доступны, что делает их потенциально превосходными тканевыми участками для производства замещающих гормонов или вакцинации путем переноса генов. Предлагаемые методы доставки генов включают чрескожную инъекцию и ретроградную инфузию через слюнные протоки. Мы демонстрируем, как выполнять ретроградную инфузию слюнных желез (RSGI) у нечеловеческих приматов. Мы описываем важные анатомические ориентиры, включая идентификацию сосочка рядового, атравматический метод каннюляции и герметизации протока Стенсена с использованием основных стоматологических инструментов, полиэтиленовых трубок и цианоакрилата, а также соответствующую скорость инфузии. Хотя это наименее травматичный метод доставки, метод по-прежнему ограничен объемом, который может быть доставлен (<0,5 мл) и возможностью травмирования протока и железы. Мы демонстрируем с помощью рентгеноскопии, что инфузия может быть полностью доставлена в железу, и дополнительно демонстрируем иммуногистохимией трансдукцию типичного вектора и экспрессию доставленного гена.
Введение
В то время как слюнные железы хорошо известны своей экзокринной выработкой слюны, исследователи давно признали их способность секретировать белки непосредственно в кровоток1,что делает их потенциальной мишенью для генной терапии для системного введения, такого как заместительные гормоны или выработка антител. Фактически, слюнные железы предлагают несколько преимуществ по сравнению с другими тканевыми мишенями, такими как врожденная способность производить белки для секреции (недостаток свойств мышц), тяжелая инкапсуляция, которая может ограничить диффузию векторов, и хорошо дифференцированная ткань, обеспечивающая стабильность для неинтегрируемых векторов. Кроме того, в случае серьезного неблагоприятного события слюнные железы не являются критическими для жизни и могут быть удалены хирургическим путем. Хотя и не сразу интуитивно понятные, почтительные железы также легко доступны изо рта через их главный выделительный проток, проток Стенсена2.
Учитывая преимущества слюнной ткани для генной терапии, растет интерес к изучению этой тканевой мишени. Многочисленные исследования уже были проведены на моделях грызунов, соб и нечеловеческих приматов, и, по крайнеймере,одно клиническое испытание на людях проводится3,4,5. Для дальнейшего изучения и развития полезности этой тканевой мишени для целей генной терапии необходимо будет провести больше исследований приматов, не являющихся людьми. В этой статье описывается метод доступа к правоушным железам через проток Стенсена для доставки векторного гена трансдукции в модели нечеловеческих приматов. Чтобы наглядно продемонстрировать доставку инфузии и анатомию протока при его поступлении в железу, была проведена рентгеноскопия с использованием радиоконтраста. Для демонстрации успешной трансдукции вектора был использован векторный ген egfp серотипа Аденовируса 5 (Ad5). Ad5 является хорошо описанным вектором, способным пропускать слюноотделение. Хотя он слишком иммуногенен для конечного клинического использования, вектор Ad5 был выбран для этого демонстрационного исследования, чтобы обеспечить эффективную трансдукцию. Оценка производства улучшенного зеленого флуоресцентного белка (EGFP) является хорошо описанным методом демонстрации успешной транскрипции и трансляции векторного гена после трансдукции и была сделана здесь.
протокол
Все процедуры были выполнены в Медицинской школе Уэйк Форест Кларксон Кампус для исследований на животных. Были проведены консультации с Институциональным комитетом по уходу за животными и их использованию (IACUC) по этическим соображениям, и подробная информация о процедурах была представлена на рассмотрение. Wake Forest IACUC одобрил наш протокол исследования, и все процедуры были выполнены в соответствии с утвержденным протоколом IACUC #A17-147.
1. Подготовка инфузионного устройства
- Разрежьте полиэтиленовую трубку размера 10 (PET10) на 25 см длиной с помощью ножниц.
- Марки PET10 на 1 см и 2 см с одного конца с помощью черного маркера.
- Предварительно засыпнуть 0,5 мл раствора Ad5-EGFP(10 9 вирусных частиц/мл) в шприц 1 мл (туберкулин).
- Сдвиньте немаркированный конец трубки ПЭТ10 над иглой 29-31 г, прикрепленной к шприцу. Как правило, эту задачу легче выполнять при увеличении.
- Вливать раствор в ПЭТ10 до полного наполнения пробирки (видимая капля на свободном конце).
- Используйте полные стандартные СИЗ, включая хирургические скрабы, халат с длинными рукавами, непроницаемые перчатки, хирургическую маску, защитный экран для лица, чепчик для волос и бахилы.
2. Подготовка животного
ПРИМЕЧАНИЕ: Макаки Cynomolgus были использованы для видеодемонструи. Анатомия других нечеловеческих и человеческих приматов очень похожа, и протокол должен быть переведен на другие виды.
- Вводят подкожно 0,05 мг/кг атропина за 15 мин до процедуры, чтобы свести к минимуму секрецию слюны и оптимизировать распределение и удержание инфузии.
- Обеспечить анестезию используют шприцы 5 мл с внутримышечной кетамином/мидазоламом (10-15 мг/кг кетамина и 0,01-0,05 мг/кг мидазолама). Подтвердите правильную анестезию, когда успокоенное животное теряет сознание и не может реагировать на раздражители.
3. Выполнение процедуры
- Используйте оральные втягивющие средства, чтобы затянуть открытый рот.
- Поместите резиновую прокладку одного конца втягивлятеля на твердое небо за верхними зубами на стороне рта, противоположной железе, которая будет вливаться. Поместите резиновую прокладку другого конца на нижнюю ковку с той же стороны, что и верхний втягиватель. Осторожно позвольте пружине втягивателя расшириться и открыть рот.
- Определите приотитный сосочек, отверстие протока Стенсена, на задней щеке, прилегающее к верхнему2-му моляру. Это лучше всего визуализировать с помощью зубных петель для увеличения.
- Осторожно расширьте сосося рядовой с оковальней конического расширителя. Лучше всего поместить точку расширителя в центр или отверстие сосочки, а затем осторожно повернуть его вперед и назад. Точка должна медленно входить в сосочек и расширять его примерно на 20 - 30 с мягкого вращения.
- Вставьте трубку PET10 в расширенный сосоц рядовой. Этого лучше всего достичь, удерживая отмеченный конец трубки PET10 пинцетом примерно на 0,5 см от дистального конца и осторожно вставляя кончик трубки в расширенный сосочек.
- Осторожно выдвигайте трубку, чему часто способствуют небольшие вращающиеся движения, чтобы помочь трубке скользить, с последующей корректировкой пинцета на 0,5 см проксимально к предыдущему захвату. Повторяйте это до тех пор, пока отметка 2 см не достигнет сосочка.
- Нанесите цианоакрилат на щеку вокруг сосочки и вставленной трубки и подождите, пока он высохнет (никакого конкретного количества не зафиксировано, достаточно, чтобы запечатать вход сосочки Стенсена). Это обычно занимает менее минуты и помогает запечатать околоушный сосочек и уменьшить разлив инфузии обратно в ротовую полость.
- Медленно нажимайте на содержимое шприца в течение 5 мин со скоростью 100 мкл/мин. Эта медленная скорость инфузии сводит к минимуму риск повреждения протоков из-за внезапного увеличения внутрипротокового давления.
- Оставьте PET10 на месте не менее чем на 5 мин после завершения инфузии. Держите проток герметичным и дайте настою остаться в приушной железе.
- Удалите PET10 с мягким сцеплением. Цианоакрилат будет свободно тянуть вместе с трубкой.
- Повторите шаги с 3.2 по 3.8 на противоположной стороне.
- Медленно высвобождайте пероральные ретракторы после того, как обе паротиды были введены и обе трубки PET10 удалены.
ПРИМЕЧАНИЕ: Вся процедура для обеих сторон должна занять менее 30 минут.
4. Постпроцедурный уход
- После завершения инфузии и декандуляции протока Стенсена наблюдайте за животными до тех пор, пока эффект анестезии не исчезнет (обычно между 20-30 мин после процедуры).
- Предложите животным напитки, а затем еду после того, как они полностью проснутся и возобновят рутинный уход.
Результаты
Успешная процедура, трансдукция и транскрипция
На рисунке 1 показан примыкающий к2-му моляру на задней верхней щеке. На изображении также показано правильное размещение скобы для рта, один резиновый конец на твердом небе, а другой резиновый конец на ипсилатеральном клыке. На рисунке 2 показано изображение, взятое после успешного каннуляции сосочкового сосачка на отметке 2 см на PET10. На рисунке 3 показано рентгеноскопическое изображение в момент инфузии радиоконтраста, демонстрирующее разветвление раствора через проток Стенсена в приотушную железу. Это флюороскопическое изображение было выполнено с единственной целью продемонстрировать анатомию и распределение инфузии. Рентгеноскопия не требуется при выполнении этой процедуры для векторной доставки. На рисунке 4 показан иммуноокраженный EGFP в красном цвете при гистопатологии. Как протоковые, так и ацинарные клетки были окрашены в красный цвет, что указывает на успешную трансдукцию и транскрипцию в обоих типах клеток. Таким образом, эти четыре рисунка демонстрируют соответствующий RSGI с визуализацией анатомии и трансдукции векторного EGFP Ad5.
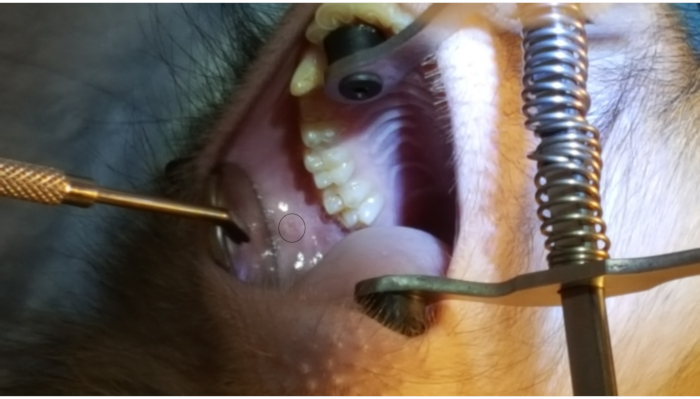
Рисунок 1:Околоушный сосочек. Обратите внимание на круг на фигуре, выделяющий прилежащий к2-му моляру на задней щеке. Также обратите внимание на размещение скобы для рта, с одним резиновым концом на твердом небе и другой резинкой на нижней клыке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
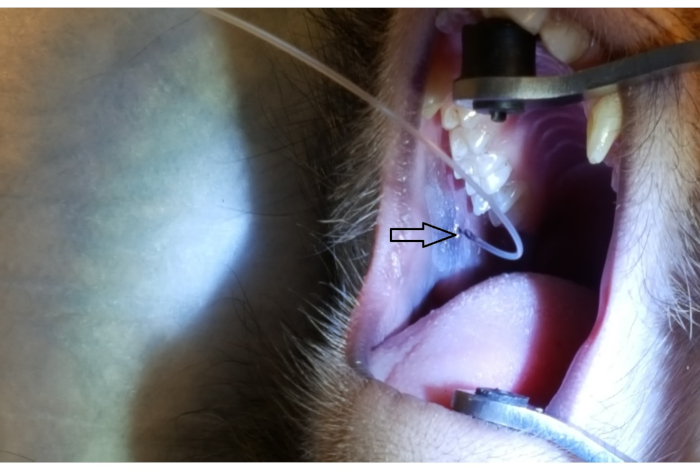
Рисунок 2:Канюляция околоушного сосочков PET10. Обратите внимание на отметку 2 см на трубке PET10, видимую на сосочке рядового (наконечник стрелы), расположенном на задней щеке, прилегающей ко2-му верхнему моляру. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3:Рентгеноскопическое изображение, показывающее диффузию в околоушную железу. Обратите внимание на ветвление на конце протока Стенсена (наконечник стрелы), когда он разветвляется на более мелкие протоки в околоушной железе (Круг). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Патология скольжения околоушной железы. Обратите внимание на экспрессию EGFP (окрашенного в красный цвет) протоковой/ацинарной околоушной тканью. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Здесь мы описываем протокол ретроградной инфузии в приушную железу через проток Стенсена. Описанная методология предлагает руководство, которое потенциально может быть использовано исследователями, изучающими полезность слюнной ткани в качестве места для генной терапии и других применений.
Существует несколько критических шагов для обеспечения успеха процедуры. В первую очередь, все процедурные шаги должны быть выполнены аккуратно. Принудительное крепление рта может привести к подвывиху нижней части. Принудительное каннуляция сососка рядотищного или быстрая инфузия раствора в проток Стенсена может привести к острым разрывам протоков или хроническому стенозу протоков.
Во-вторых, убедитесь, что анестезия была введена и эффективна. Без надлежащей анестезии ни один из шагов не может быть легко выполнен, и риск травм животных и человека значительно увеличивается. Мы выбрали внутримышечную анестезию кетамином и мидазоламом, что является стандартной схемой в исследованиях приматов, не связанных с человеком6. Мы считаем, что атропин важен для уменьшения слюнных выделений во время процедуры, улучшения видимости анатомии и уменьшения вымывания инфузии перед трансдукцией7,8.
Шагом, который часто является сложным, является начальная каннуляция и продвижение PET10 в сосохушку и проток Стенсена. Мягкое вращение PET10 при вставке облегчает эти шаги. Чрезмерное толкание может привести к травмам протоков.
Процедура в основном ограничивается хрупкостью и размерами ткани. Это требует очень щадящей техники и использования увеличительного контура и небольших инструментов для обеспечения надлежащей канюляции, продвижения трубки и доставки инфузии. Другим потенциальным ограничением является объем инфузии, который паровидная железа способна аккомодировать. Предыдущие исследования вливали максимальный объем 0,5 мл в каждую предушную железу, в общей сложности 1 мл на животное6,9,10. Хотя это напрямую не влияет на саму процедуру, в зависимости от концентрации препарата в инфузии, это может оказаться ограничивающим для желаемого физиологического эффекта.
RSGI предлагает наименее травматичный вариант, если желательна инфузия слюнных желез. Альтернативы, такие как чрескожные или чрескожные инъекции под руководством США, несут риск повреждения лицевого нерва. Кроме того, эти процедуры могут не обеспечить адекватного распределения по всей железе, в то время как RSGI использует систему протоков для обеспечения распределения. Рентгеноскопия была выполнена стандартным радиоконтрастным раствором исключительно с целью этой статьи, чтобы продемонстрировать, что RSGI обеспечивает полный инфузию с хорошим распределением по всей железе. Это было выполнено отдельно от фактической инфузии вектора Ad5. Рентгеноскопия и / или другая рентгеновская визуализация, выполняемая во время RSGI для доставки генных векторов, не будет полезной и не рекомендуется.
Поскольку область терапии путем переноса генов продолжает развиваться, слюнные железы как ткань-мишень уже набирают популярность2,5. Ponzio et al. предлагают большой обзор о преимуществах слюнных желез в качестве мишеней для иммунизации4. Поскольку инкапсулированная, нежиотичная железистая ткань, которую мы продемонстрировали, легко доступна, почтительные железы представляют собой идеальную платформу генной терапии. RSGI предлагает наименее травматичную технику переноса генов в железы.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотят поблагодарить г-на Кэгни Джентри за его аудиовизуальную поддержку в съемках процедуры. Мы также хотим поблагодарить медицинский центр Hefner VA за академическую поддержку в реализации этого проекта.
Материалы
| Name | Company | Catalog Number | Comments |
| 500 µL U100 syringes with 30-gauge needles | Becton Dickinson | 328466 | fixed needle for less waste |
| Adhesive (e.g., Ethicon Dermabond) | Various | Cyanoacrylate adhesive to seal and keep the tubing in the duct during infusion. | |
| Atropine injectable solution | Patterson Veterinary | 07 869-6061 | Atropine inj. 0.54 mg/mL |
| BD Ultra-Fine Insulin Syringes 30G | Walmart | N/A | Avilable in 0.5 mL and 1.0 mL sizes. |
| Cyanoacrylate (medical glue) | Ethicon | DNX12 | Dermabond topical skin adhesive |
| Dental loops with light | Amazon (DDP) | B012M3IV80 | Used to enhance visualization of Stensen's duct papilla |
| Infant Lacrimal Dilator | Surgipro | SPOI-137 | |
| Ketamine injectable solution | Patterson Veterinary | 07-803-6637 | Ketaset inj. 100 mg/mL |
| Lacrimal Dilator | Surgipro | SPOI-132 | Used to dialate the Stensen's duct. |
| Midazolam injectable solution | Patterson Veterinary | 07 890-6698 | Midazolam inj. 5mg/mL |
| Pair of scissors | Amazon (DDP) | N/A | Used to cut PET10 tube |
| Polyethylene Tubing (PE-10) | Scientific Comodities, Inc | BB31695-PE/1 | Tubing connecting the 30G syringe and inserted into the duct. |
| Q-tips | Walmart | N/A | Used to spread cyanoacrylate on the cheek |
| Size 10 Polyethylene Tube (PET 10) | Scientific Commodities | BB31695-PE/1 | low density polyethylene tubing |
| Small Animal Mouth Opener | Amazon (DDP) | B01F3LVJXC | Used to keep the animal's mouth open. |
| Tweezers | Amazon (DDP) | N/A | Used to insert PET10 tube into Stenson's duct |
| Zinc Chloride | Sigma-Aldrich | 7646-86-7 | Included in plasmid DNA infusates |
Ссылки
- Isenman, L., Liebow, C., Rothman, S. The secretion of mammalian digestive enzymes by exocrine glands. The American Journal of Physiology. 276, 223-232 (1999).
- Perez, P., et al. Salivary epithelial cells: An unassuming target site for gene therapeutics. The International Journal of Biochemistry & Cell Biology. 42, 773-777 (2010).
- Kochel, T. J., et al. A dengue virus serotype-1 DNA vaccine induces virus neutralizing antibodies and provides protection from viral challenge in Aotus monkeys. Vaccine. 18, 3166-3173 (2000).
- Ponzio, T. A., Sanders, J. W. The salivary gland as a target for enhancing immunization response. Tropical Diseases, Travel Medicine and Vaccines. 3, 4 (2017).
- Baum, B. J., et al. Early responses to adenoviral-mediated transfer of the aquaporin-1 cDNA for radiation-induced salivary hypofunction. Proceedings of the National Academy of Sciences of the United States of America. 109, 19403-19407 (2012).
- Voutetakis, A., et al. Sorting of Transgenic Secretory Proteins in Rhesus Macaque Parotid Glands After Adenovirus-Mediated Gene Transfer. Human Gene Therapy. 19, 1401-1405 (2008).
- Niedzinski, E. J., et al. Enhanced systemic transgene expression after nonviral salivary gland transfection using a novel endonuclease inhibitor/DNA formulation. Gene Therapy. 10, 2133-2138 (2003).
- Niedzinski, E. J., et al. Zinc Enhancement of Nonviral Salivary Gland Transfection. Molecular Therapy. 7, 396-400 (2003).
- Samuni, Y., Baum, B. J. Gene delivery in salivary glands: From the bench to the clinic. Biochimica et Biophysica Acta - Molecular Basis of Disease. , (2011).
- Voutetakis, A., et al. Adeno-Associated Virus Serotype 2-Mediated Gene Transfer to The Parotid Glands of Nonhuman Primates. Human Gene Therapy. 18, 142-150 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены