Method Article
ベクター化遺伝子導入のための非ヒト霊長類におけるステンセンダクトによる逆行性耳下腺注入
要約
唾液腺は、遺伝子治療の組織標的部位として、特に遺伝子導入によるワクチン接種の領域において提案されている。逆行性の耳下腺注入を利用した非ヒト霊長類モデルにおける遺伝子導入を実証する。
要約
唾液腺は、すでにヒトの試験につながる有望な結果を有する遺伝子治療のための魅力的な組織標的である。彼らは本質的に血流中にタンパク質を分泌することができ、容易にアクセス可能であり、遺伝子導入による置換ホルモン産生またはワクチン接種のための潜在的に優れた組織サイトを作る。遺伝子導入の推奨方法としては、唾液管を介した経皮注射および逆行注入が挙げられる。ヒト以外の霊長類で逆行唾液腺注入(RSGI)を行う方法を実演する。我々は、耳下腺乳頭の同定、基本的な歯科用具、ポリエチレンチューブ、シアノアクリル酸塩を利用したステンセンのダクトをカニューララットおよびシールする無外傷性方法、および適切な注入速度を含む重要な解剖学的ランドマークを記述する。これは最も外傷性の低い送達方法ですが、この方法は、引き渡し可能な体積(<0.5 mL)と、ダクトおよび腺への外傷の可能性によって依然として制限されています。蛍光検査を用いて、蛍光検査を用いて、インフューズトを完全に腺に送達できることを実証し、免疫体系化学によって、典型的なベクターの導入と、送達された遺伝子の発現を更に実証する。
概要
唾液腺は唾液の外分泌産生でよく知られていますが、研究者は長い間、タンパク質を血流1に直接分泌する能力を認識しており、置換ホルモンや抗体産生などの全身投与のための遺伝子治療の潜在的な標的となっています。実際、唾液腺は、分泌のためのタンパク質を産生する固有の能力(プロパティ筋不足)、ベクター拡散を制限できる重いカプセル化、非統合ベクターの安定性を提供する十分に分化された組織など、他の組織ターゲットに対していくつかの利点を提供します。さらに、重篤な有害事象が発生した場合、唾液腺は生命にとって重要ではなく、外科的に除去することができる。直ちに直ぐには直視できないが、耳下腺は口から主な排泄管、ステンセンのダクト2を通して容易にアクセスできる。
遺伝子治療のための唾液組織の利点を考えると、この組織標的を探索することに関心が高まっている。げっ歯類、イヌ、ヒト以外の霊長類モデルでは既に数多くの研究が行われ、少なくとも1つのヒト臨床試験が3、4、5で進行中である。遺伝子治療目的のためにこの組織標的の有用性をさらに探求し、開発するためには、より多くの非ヒト霊長類研究が行われる必要がある。本論文では、Stensenのダクトを介して、アオシド腺にアクセスし、非ヒト霊長類モデルにおける形質導入のためのベクター化遺伝子を送達する方法について述べている。腺に入る場合のインフューズートの送達及びダクトの解剖学を目に見えて実証するために、放射コントラストを用いた蛍光視が行われた。ベクターの正常な伝達を実証するために、アデノウイルス血清型5(Ad5)ベクター化egfp遺伝子を用いた。Ad5は、唾液組織を導入し得る、よく説明したベクターである。究極の臨床使用には免疫原性が高すぎるが、効率的な導入を保証するためにこの実証研究のためにAd5ベクターが選ばれた。強化された緑色蛍光タンパク質(EGFP)の生産を評価することは、転写後のベクター遺伝子の転写と翻訳を成功させたことを実証するためのよく説明された方法であり、ここで行われました。
プロトコル
すべての手順は、動物研究のためにウェイクフォレスト医学部クラークソンキャンパスで行われました。制度的動物管理・使用委員会(IACUC)は倫理的配慮について協議され、手続きの詳細は審査のために提出された。ウェイクフォレストIACUCは、私たちの研究プロトコルを承認し、すべての手順は、IACUC承認プロトコル#A17-147の下で行われました。
1. 輸液装置の準備
- サイズ10ポリエチレンチューブ(PET10)をハサミで25cmの長さにカット。
- 黒いマーカーを使用して片端から1 cmと2 cmでPET10をマークします。
- Ad5-EGFP溶液(109 ウイルス粒子/mL)を1mL(結核)シリンジにプレフィル0.5 mL。
- 29-31 G針に取り付けられたPET10チューブの無印の端を注射器に取り付けます。一般的に、このタスクは拡大率で実行する方が簡単です。
- チューブが完全に満杯になるまでPET10に溶液を注入します(フリーエンドで目に見える落下)。
- 外科用スクラブ、長袖ガウン、不浸透性手袋、外科用マスク、フェイスシールド、ヘアボンネット、靴カバーを含むフルスタンダードPPEを使用してください。
2. 動物の準備
注:サイノモルガスのマカクは、ビデオデモンストレーションのために使用されました。他の非ヒト霊長類とヒト霊長類の解剖学は非常に類似しており、プロトコルは他の種に翻訳可能であるべきである。
- 唾液分泌を最小限に抑え、注入体の分布と保持を最適化する手順の15分前に、皮下0.05mg/kgのアトロピンを注入します。
- 筋肉内ケタミン/ミダゾラム(10-15 mg/kgのケタミンと0.01-0.05 mg/kgミダゾラム)を用いて5mL注射器を使用して麻酔を提供する。鎮静動物が無意識になり、刺激に反応することができないときに適切な麻酔を確認する。
3. 手順の実行
- 口を開くブレースに経口レトラクターを使用してください。
- リトラクターの一端のゴムパッドを、注入される腺の反対側の口の側の上歯の後ろの硬い口蓋に置きます。上部レトラクタと同じ側の下のイヌの反対側にもう一方の端のゴムパッドを置きます。レトラクターのスプリングアクションをそっと広げ、口を開きます。
- 上部2nd モルに隣接する後頬の、ステンセンのダクトの開口部である耳下腺乳頭を特定します。これは、倍率のための歯科ループを使用して最もよく視覚化されます。
- 円錐状のディレーターの点で、耳蓋状乳頭を軽く広げます。ディラトールのポイントを乳頭の中心または開口部に配置し、前後にそっと回転させるのが最善です。ポイントはゆっくりと乳頭に入り、穏やかな回転の約20〜30 s以上にそれを拡張する必要があります。
- PET10チューブを拡張した耳下腺乳頭に挿入します。これは、遠位端から約0.5cmのピンセットでPET10チューブのマークされた端を保持し、チューブの先端を拡張乳頭にそっと挿入することによって最も良い達成されます。
- チューブのスライドを助けるために小さな回転運動によってしばしば促進されるチューブを穏やかに進め、続いてピンセットの0.5 cm近位を前のグリップに再調整する。2cmマークが耳下蓋乳頭に達するまでこれを繰り返します。
- 乳頭と挿入チューブの周りの頬にシアノアクリル酸を適用し、それが乾燥するのを待ちます(特定の量は記録されず、ステンセンのダクト乳頭の入り口を密封するのに十分です)。これは通常、1分未満かかり、耳下腺乳頭を密封し、口腔内に戻ってインフュージングのこぼれを減らすのに役立ちます。
- 100 μL/minの速度で5分以上ゆっくりとシリンジの含有量を押し込みます。この遅い注入速度は管内圧力の突然の増加によるダクト傷害の危険を最小にする。
- 注入が完了した後、少なくとも5分間PET10を所定の位置に置いておきます。ダクトを密閉し、インフューズを耳下腺に留まらなくてはなっておいてください。
- 優しい牽引力でPET10を取り外します。シアノアクリル酸はチューブで自由に引っ張ります。
- 反対側のステップ 3.2 ~ 3.8 を繰り返します。
- 両方の耳下垂体が注入され、両方のPET10チューブが除去された後、経口リトラクタをゆっくりと放出する。
注:両側の手順全体は30分未満かかります。
4. 手続き後のケア
- 注入が完了し、ステンセンのダクトが脱狭した後、麻酔効果が消えるまで動物を観察します(通常、20〜30分の後の手順)。
- 動物の飲み物を提供し、彼らは完全に目を覚まし、定期的なケアを再開した後、食べ物。
結果
成功した手順、伝達および転写
図1 は、後部上頬の2番目 の大臼歯に隣接する耳下腺乳頭を示す。画像はまた、口のブレースの正しい配置を示しています, 硬口蓋に一方のゴム端とイプシラテラレのイプシラテラの上に他のゴム端. 図2 は、PET10上の2cmマークでの耳蓋乳頭のカヌリン化に成功した後に撮影した画像を示す。 図3 は、狭窄管を通って耳下腺に溶液の分岐を示す放射コントラスト注入の瞬間の透視検査画像を示す。この蛍光顕微鏡像は、解剖学とインフューズンの分布を実証する唯一の意図のために行われた。ベクターデリバリーのためにこの手順を実行する場合、蛍光検査は必要ありません。 図4 は、組織病理学上の赤で染色されたEGFP免疫を示す。両管細胞とアシナル細胞はいずれも赤色に染色されており、両方の細胞タイプでの転写および転写に成功したことを示している。要約すると、これら4つの図は、Ad5ベクターEGFPの解剖学および導入の可視化を伴う適切なRSGIを示す。
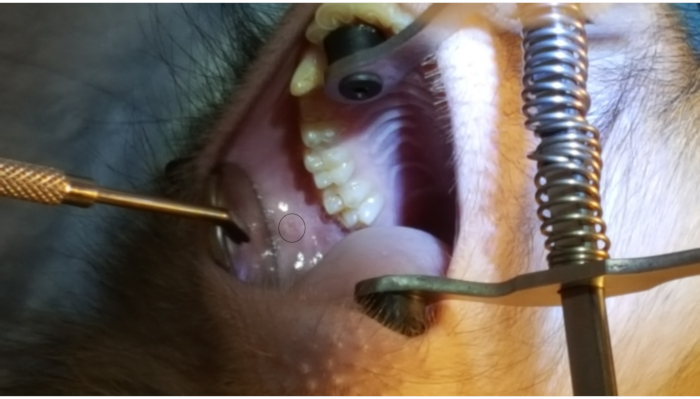
図1:耳下腺乳頭 後頬の2番目 の大臼歯に隣接する耳下腺乳頭を強調する図の円に注意してください。また、口のブレースの配置に注意してください, 硬口蓋に一方のゴム端と下のイニの上に他のゴムバンド. この図の大きなバージョンを表示するには、ここをクリックしてください。
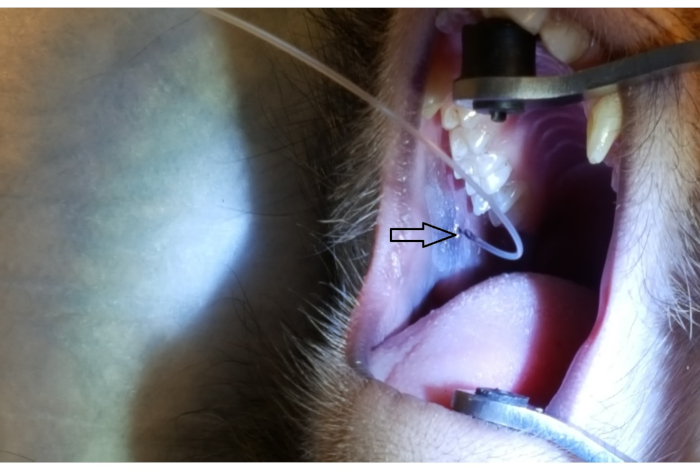
図2:PET10による耳蓋管蓋カヌリン化 耳下蓋乳頭(矢頭)で見えるPET10管の2cmのマークは、後頬に位置し、第2の 上部モルに隣接しています。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:耳下腺への拡散を示す蛍光検査画像 狭間腺(円)の小さなダクトに分岐するステンセンのダクト(矢印頭)の端に分岐することに注意してください。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:耳下腺の病理スライド なお、管状/アシナルの耳下腺組織によるEGFP(赤色染色)の発現。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、ステンセンのダクトを介して耳下腺への逆行注入のプロトコルについて説明します。説明された方法論は、遺伝子治療やその他のアプリケーションの部位として唾液組織の有用性を探求する研究者によって潜在的に使用することができるガイダンスを提供する。
この手順を成功させるためには、複数の重要な手順があります。まず第一に、すべての手順は穏やかに完了する必要があります。口の強引なブレースは、下顎下の亜脱力をもたらす可能性があります。耳下腺乳頭の強引なカヌリン化またはステンセンのダクトへの溶液の急速な注入は、急性乳管の涙または慢性管狭窄を引き起こす可能性がある。
第二に、麻酔が投与され、有効であることを確認します。適切な麻酔がなければ、どのステップも容易に達成することはなく、動物および人的傷害のリスクは有意に増加する。我々は、ケタミンとミダゾラムを用いた筋肉内麻酔を選んだが、これはヒト以外の霊長類研究における標準的なレジメンである6.我々は、アトロピンが処置中に唾液分泌物を減少させ、解剖学の視認性を向上させ、トランスダクション7,8に先立ってインフューズ剤の洗浄を低減するために重要であると考える。
しばしば挑戦的なステップは、PET10の最初のカヌレーションとパオシド乳頭とステンセンのダクトへの前進です。挿入中のPET10の穏やかな回転は、これらのステップを容易にする。過度の押し込みは、管内損傷につながる可能性があります。
手順は、主に脆弱性と組織のサイズによって制限されます。これは、非常に穏やかな技術と拡大ループと適切な缶取、チューブの前進と注入体の配信を確保するための小さなツールの使用を必要とします。もう一つの潜在的な制限は、耳下腺が収容可能であることをインフューズートの体積である。これまでの研究では、各アローシド腺に0.5 mLの最大体積を注入し、動物1匹あたり合計1mL6、9、10を注入した。これは、プロシージャ自体に直接影響を与えませんが、インフューズン物中の薬物濃度に応じて、所望の生理的効果を制限することを証明し得る。
唾液腺注入が望まれる場合、RSGIは最も外傷性の低い選択肢を提供する。経皮的または米国導きの経皮注射のような代替手段は顔面神経損傷の危険を運ぶ。さらに、これらの手順は、全体の腺への適切な分布を達成するために失敗する可能性がありますが、RSGIは、分布を保証するためにダクトシステムを利用しています。蛍光法は、RSGIが全腺全体に良好な分布を有する完全な浸透を提供することを実証するために、この記事の目的のためだけに標準的な放射対照溶液で行われた。これは、Ad5ベクターの実際の注入とは別に行った。遺伝子ベクターを送達するためにRSGI中に行われた蛍光検査および/または他のX線イメージングは役に立たず、推奨されません。
遺伝子導入による治療薬の分野が進化し続ける中、標的組織としての唾液腺はすでに2,5の人気を集めている。Ponzioらは、唾液腺の利点について、免疫の標的として優れたレビューを提供する。我々が実証した非重要な腺組織がカプセル化されるように、簡単にアクセス可能であり、耳下腺は理想的な遺伝子治療プラットフォームを構成する。RSGIは、腺への遺伝子導入のための最も外傷性の低い技術を提供する。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、手順の撮影における彼の視聴覚サポートのためにキャグニー・ジェントリー氏に感謝したいと考えています。また、このプロジェクトを追求するヘフナーVA医療センターの学術支援を認めたいと考えています。
資料
| Name | Company | Catalog Number | Comments |
| 500 µL U100 syringes with 30-gauge needles | Becton Dickinson | 328466 | fixed needle for less waste |
| Adhesive (e.g., Ethicon Dermabond) | Various | Cyanoacrylate adhesive to seal and keep the tubing in the duct during infusion. | |
| Atropine injectable solution | Patterson Veterinary | 07 869-6061 | Atropine inj. 0.54 mg/mL |
| BD Ultra-Fine Insulin Syringes 30G | Walmart | N/A | Avilable in 0.5 mL and 1.0 mL sizes. |
| Cyanoacrylate (medical glue) | Ethicon | DNX12 | Dermabond topical skin adhesive |
| Dental loops with light | Amazon (DDP) | B012M3IV80 | Used to enhance visualization of Stensen's duct papilla |
| Infant Lacrimal Dilator | Surgipro | SPOI-137 | |
| Ketamine injectable solution | Patterson Veterinary | 07-803-6637 | Ketaset inj. 100 mg/mL |
| Lacrimal Dilator | Surgipro | SPOI-132 | Used to dialate the Stensen's duct. |
| Midazolam injectable solution | Patterson Veterinary | 07 890-6698 | Midazolam inj. 5mg/mL |
| Pair of scissors | Amazon (DDP) | N/A | Used to cut PET10 tube |
| Polyethylene Tubing (PE-10) | Scientific Comodities, Inc | BB31695-PE/1 | Tubing connecting the 30G syringe and inserted into the duct. |
| Q-tips | Walmart | N/A | Used to spread cyanoacrylate on the cheek |
| Size 10 Polyethylene Tube (PET 10) | Scientific Commodities | BB31695-PE/1 | low density polyethylene tubing |
| Small Animal Mouth Opener | Amazon (DDP) | B01F3LVJXC | Used to keep the animal's mouth open. |
| Tweezers | Amazon (DDP) | N/A | Used to insert PET10 tube into Stenson's duct |
| Zinc Chloride | Sigma-Aldrich | 7646-86-7 | Included in plasmid DNA infusates |
参考文献
- Isenman, L., Liebow, C., Rothman, S. The secretion of mammalian digestive enzymes by exocrine glands. The American Journal of Physiology. 276, 223-232 (1999).
- Perez, P., et al. Salivary epithelial cells: An unassuming target site for gene therapeutics. The International Journal of Biochemistry & Cell Biology. 42, 773-777 (2010).
- Kochel, T. J., et al. A dengue virus serotype-1 DNA vaccine induces virus neutralizing antibodies and provides protection from viral challenge in Aotus monkeys. Vaccine. 18, 3166-3173 (2000).
- Ponzio, T. A., Sanders, J. W. The salivary gland as a target for enhancing immunization response. Tropical Diseases, Travel Medicine and Vaccines. 3, 4 (2017).
- Baum, B. J., et al. Early responses to adenoviral-mediated transfer of the aquaporin-1 cDNA for radiation-induced salivary hypofunction. Proceedings of the National Academy of Sciences of the United States of America. 109, 19403-19407 (2012).
- Voutetakis, A., et al. Sorting of Transgenic Secretory Proteins in Rhesus Macaque Parotid Glands After Adenovirus-Mediated Gene Transfer. Human Gene Therapy. 19, 1401-1405 (2008).
- Niedzinski, E. J., et al. Enhanced systemic transgene expression after nonviral salivary gland transfection using a novel endonuclease inhibitor/DNA formulation. Gene Therapy. 10, 2133-2138 (2003).
- Niedzinski, E. J., et al. Zinc Enhancement of Nonviral Salivary Gland Transfection. Molecular Therapy. 7, 396-400 (2003).
- Samuni, Y., Baum, B. J. Gene delivery in salivary glands: From the bench to the clinic. Biochimica et Biophysica Acta - Molecular Basis of Disease. , (2011).
- Voutetakis, A., et al. Adeno-Associated Virus Serotype 2-Mediated Gene Transfer to The Parotid Glands of Nonhuman Primates. Human Gene Therapy. 18, 142-150 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved