Method Article
Infusión de la glándula parótida retrógrada a través del conducto de Stensen en un primate no humano para la entrega de genes vectores
En este artículo
Resumen
Las glándulas salivales se han propuesto como un sitio objetivo tisular para la terapia génica, especialmente en el área de la vacunación por transferencia de genes. Demostramos la entrega de genes en un modelo de primates no humanos utilizando infusión de parótida retrógrada.
Resumen
Las glándulas salivales son un objetivo tisular atractivo para la terapia génica con resultados prometedores que ya conducen a ensayos en humanos. Son inherentemente capaces de secretar proteínas en el torrente sanguíneo y son fácilmente accesibles, lo que los convierte en sitios de tejido potencialmente superiores para la producción de hormonas de reemplazo o la vacunación por transferencia de genes. Los métodos sugeridos para la administración de genes incluyen la inyección transcutánea y la infusión retrógrada a través de conductos salivales. Demostramos cómo realizar la infusión retrógrada de glándulas salivales (RSGI) en primates no humanos. Describimos los hitos anatómicos importantes, incluida la identificación de la papila parótida, un método atraumático de canulación y sellado del conducto de Stensen que utiliza herramientas dentales básicas, tubos de polietileno y cianoacrilato, y la velocidad adecuada de infusión. Si bien este es el método de parto menos traumático, el método todavía está limitado por el volumen que se puede administrar (<0.5 ml) y el potencial de trauma en el conducto y la glándula. Demostramos mediante fluoroscopia que un infusato se puede administrar completamente en la glándula, y demostramos además por inmunohistoquímica la transducción de un vector típico y la expresión del gen entregado.
Introducción
Si bien las glándulas salivales son bien conocidas por su producción exocrina de saliva, los investigadores han reconocido durante mucho tiempo su capacidad para secretar proteínas directamente en el torrente sanguíneo1,lo que las convierte en un objetivo potencial para la terapia génica para la administración sistémica, como las hormonas de reemplazo o la producción de anticuerpos. De hecho, las glándulas salivales ofrecen varias ventajas sobre otros objetivos tisulares, como la capacidad inherente de producir proteínas para la secreción (una propiedad de la que carecen los músculos), la encapsulación pesada que puede limitar la difusión vectorial y el tejido bien diferenciado que proporciona estabilidad para los vectores no integradores. Además, en caso de un evento adverso grave, las glándulas salivales no son críticas para la vida y pueden extirparse quirúrgicamente. Aunque no son inmediatamente intuitivas, las glándulas parótidas también son fácilmente accesibles desde la boca a través de su conducto excretor principal, el conducto2de Stensen.
Dadas las ventajas del tejido salival para la terapia génica, existe un creciente interés en explorar este objetivo tisular. Ya se han realizado numerosos estudios en modelos de roedores, caninos y primates no humanos y al menos un ensayo clínico en humanos está en marcha3,4,5. Para explorar y desarrollar aún más la utilidad de este objetivo tisular con fines de terapia génica, se necesitarán más estudios de primates no humanos. Este artículo describe un método para acceder a las glándulas parótidas a través del conducto de Stensen para entregar un gen vector para la transducción en el modelo de primates no humanos. Para demostrar visiblemente la entrega de la infusión y la anatomía del conducto a medida que ingresa a la glándula, se realizó fluoroscopia con radiocontraste. Para demostrar la transducción exitosa de un vector, se utilizó un gen egfp vectorado por adenovirus serotipo 5 (Ad5). Ad5 es un vector bien descrito capaz de transducir tejido salival. Aunque es demasiado inmunogénico para el uso clínico final, se eligió un vector Ad5 para este estudio de demostración para garantizar una transducción eficiente. La evaluación de la producción mejorada de proteína fluorescente verde (EGFP) es un método bien descrito para demostrar la transcripción y traducción exitosas de un gen vectorado después de la transducción y se realizó aquí.
Protocolo
Todos los procedimientos se realizaron en wake Forest School of Medicine Clarkson Campus para estudios en animales. Se consultó al Comité Institucional de Cuidado y Uso de Animales (IACUC) por consideraciones éticas y se sometieron a revisión los detalles de los procedimientos. Wake Forest IACUC aprobó nuestro protocolo de estudio y todos los procedimientos se realizaron bajo el protocolo aprobado por IACUC #A17-147.
1. Preparación del dispositivo de perfusión
- Corte el tamaño 10 Tubo de polietileno (PET10) en longitudes de 25 cm con un par de tijeras.
- Marque PET10 a 1 cm y 2 cm de un extremo utilizando un marcador negro.
- Rellenar previamente 0,5 ml de solución de Ad5-EGFP (109 partículas virales/ml) en una jeringa de 1 ml (tuberculina).
- Deslice el extremo no marcado del tubo PET10 sobre una aguja de 29-31 G unida a una jeringa. En general, es más fácil realizar esta tarea bajo aumento.
- Infundir la solución en el PET10 hasta que el tubo esté completamente lleno (gota visible en el extremo libre).
- Use EPP estándar completo, que incluya exfoliantes quirúrgicos, bata de manga larga, guantes impermeables, máscara quirúrgica, protector facial, capó para el cabello y cubiertas para zapatos.
2. Preparación del animal
NOTA: Se utilizaron macacos Cynomolgus para la demostración en video. La anatomía de otros primates no humanos y humanos es muy similar, y el protocolo debe ser traducible a otras especies.
- Inyecte por vía subcutánea 0,05 mg/kg de atropina 15 min antes del procedimiento para minimizar las secreciones salivales y optimizar la distribución y retención de la infusión.
- Proporcionar anestesia con jeringas de 5 ml con ketamina/midazolam intramuscular (10-15 mg/kg de ketamina y 0,01-0,05 mg/kg de midazolam). Confirme la anestesia adecuada cuando el animal sedado quede inconsciente y no pueda reaccionar a los estímulos.
3. Realización del procedimiento
- Use retractores orales para sujetar la boca abierta.
- Coloque la almohadilla de goma de un extremo del retractor en el paladar duro detrás de los dientes superiores en el lado de la boca opuesto a la glándula que se infundirá. Coloque la almohadilla de goma del otro extremo en el canino inferior en el mismo lado que el retractor superior. Permita suavemente que la acción del resorte del retractor se expanda y abra la boca.
- Identifique la papila parótida, la abertura del conducto de Stensen, en la mejilla posterior, adyacente al2º molar superior. Esto se visualiza mejor usando bucles dentales para la ampliación.
- Dilate suavemente la papila parótida con la punta del dilatador cónico. Es mejor colocar el punto del dilatador en el centro o la abertura de la papila y luego girarlo suavemente hacia adelante y hacia atrás. El punto debe entrar lentamente en la papila y dilatarla durante aproximadamente 20 - 30 s de rotación suave.
- Inserte el tubo PET10 en la papila parótida dilatada. Esto se logra mejor sosteniendo el extremo marcado del tubo PET10 con pinzas aproximadamente a 0,5 cm del extremo distal e insertando suavemente la punta del tubo en la papila dilatada.
- Avance suavemente el tubo, lo que a menudo se ve facilitado por pequeños movimientos giratorios para ayudar a que el tubo se deslice, seguido de un reajuste de las pinzas 0,5 cm proximal al agarre anterior. Repita esto hasta que la marca de 2 cm llegue a la papila parótida.
- Aplique cianoacrilato en la mejilla alrededor de la papila y el tubo insertado y espere a que se seque (no se registra una cantidad específica, solo lo suficiente para sellar la entrada de la papila del conducto de Stensen). Esto generalmente toma menos de un minuto y ayuda a sellar la papila parótida y reducir el derrame de infusión en la cavidad oral.
- Empuje lentamente el contenido de la jeringa durante 5 minutos a una velocidad de 100 μL/min. Esta velocidad de infusión lenta minimiza el riesgo de lesión del conducto debido al aumento repentino de la presión intraductal.
- Deje pet10 en su lugar durante al menos 5 minutos después de que se complete la infusión. Mantenga el conducto sellado y permita que la infusión permanezca en la glándula parótida.
- Retire el PET10 con una tracción suave. El cianoacrilato se liberará con el tubo.
- Repita los pasos 3.2 a 3.8 en el lado opuesto.
- Libere lentamente los retractores orales después de que se hayan infundido ambas parótidas y se hayan eliminado ambos tubos de PET10.
NOTA: Todo el procedimiento para ambas partes debe tomar menos de 30 minutos.
4. Cuidados post-procesales
- Después de que se complete la infusión y se descanule el conducto de Stensen, observe a los animales hasta que el efecto de la anestesia desaparezca (generalmente entre 20-30 minutos después del procedimiento).
- Ofrezca al animal bebidas y luego comida después de que estén completamente despiertos y reanude el cuidado de rutina.
Resultados
Procedimiento, transducción y transcripción exitosos
La Figura 1 muestra la papila parótida adyacente al 2º molar en la mejilla superior posterior. La imagen también muestra la colocación correcta del aparato ortopédico bucal, un extremo de goma en el paladar duro y el otro extremo de goma en el canino ipsilateral. La Figura 2 muestra una imagen tomada después de la canulación exitosa de la papila parótida en la marca de 2 cm en el PET10. La Figura 3 muestra una imagen de fluoroscopia en el momento de una infusión de radiocontraste que demuestra la ramificación de la solución a través del conducto de Stensen y en la glándula parótida. Esta imagen fluoroscópica se realizó con la única intención de demostrar la anatomía y distribución de una infusión. No se requiere fluoroscopia cuando se realiza este procedimiento para la administración de vectores. La Figura 4 muestra EGFP inmunoestiñido en rojo en histopatología. Tanto las células ductales como las acinares se han teñido en rojo, lo que indica una transducción y transcripción exitosas en ambos tipos de células. En resumen, estas cuatro figuras demuestran un RSGI apropiado con visualización de la anatomía y de la transducción de Ad5 vectored EGFP.
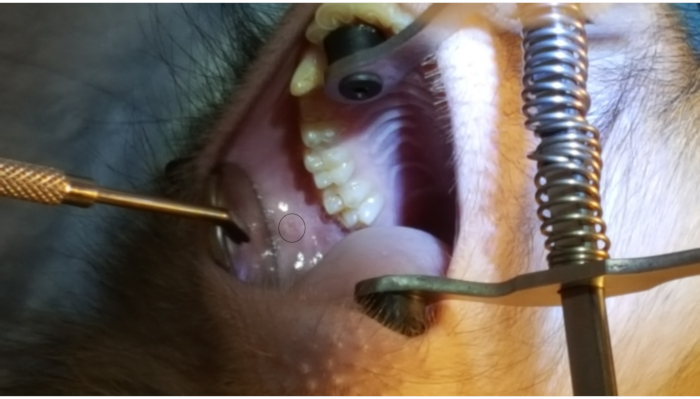
Figura 1: Papila parótida. Observe el círculo en la figura que resalta la papila parótida adyacente al2º molar en la mejilla posterior. También tenga en cuenta la colocación del aparato ortopédico bucal, con un extremo de goma en el paladar duro y la otra banda elástica en el canino inferior. Haga clic aquí para ver una versión más grande de esta figura.
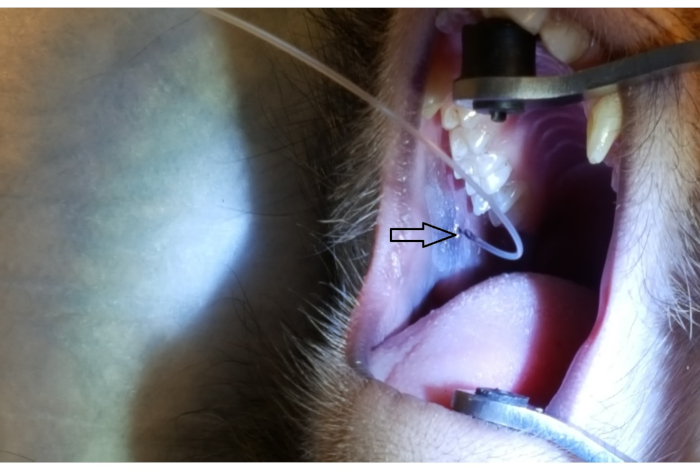
Figura 2: Cántula de papila parótida por PET10. Nótese la marca de 2 cm en el tubo PET10 visible en la papila parótida (punta de flecha), ubicada en la mejilla posterior, adyacente al2º molar superior. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3:Imagen de fluoroscopia que muestra la difusión en la glándula parótida. Observe la ramificación al final del conducto de Stensen (punta de flecha) a medida que se ramifica en conductos más pequeños en la glándula parótida (Círculo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Diapositiva de patología de la glándula parótida. Observe la expresión de EGFP (teñida en rojo) por tejido parótido ductal/acinar. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí describimos un protocolo de infusión retrógrada en la glándula parótida a través del conducto de Stensen. La metodología descrita ofrece orientación que potencialmente puede ser utilizada por investigadores que exploran la utilidad del tejido salival como un sitio para la terapia génica y otras aplicaciones.
Hay múltiples pasos críticos para garantizar el éxito del procedimiento. En primer lugar, todos los pasos del procedimiento deben completarse suavemente. El refuerzo contundente de la boca podría resultar en subluxación mandibular. La cánulación forzante de la papila parótida o la infusión rápida de la solución en el conducto de Stensen podrían provocar desgarros ductales agudos o estenosis ductal crónica.
En segundo lugar, asegúrese de que la anestesia se ha administrado y es eficaz. Sin la anestesia adecuada, ninguno de los pasos se puede lograr fácilmente y el riesgo de lesiones animales y humanas aumenta significativamente. Se optó por la anestesia intramuscular con ketamina y midazolam, que es un régimen estándar en estudios de primates no humanos6. Consideramos que la atropina es importante para reducir las secreciones salivales durante el procedimiento, mejorar la visibilidad de la anatomía y reducir el lavado de la infusión antes de la transducción7,8.
Un paso que a menudo es desafiante es la canulación inicial y el avance de la PET10 en la papila parótida y el conducto de Stensen. La rotación suave del PET10 durante la inserción facilita estos pasos. El empuje excesivo podría provocar lesiones ductales.
El procedimiento está limitado principalmente por la fragilidad y el tamaño del tejido. Esto requiere una técnica muy suave y el uso de bucles de aumento y pequeñas herramientas para garantizar la canulación adecuada, el avance de los tubos y la entrega de la infusión. Otra limitación potencial es el volumen de infusión que las glándulas parótidas son capaces de acomodar. Estudios previos han infundido un volumen máximo de 0,5 mL en cada glándula parótida, totalizando 1 mL por animal6,9,10. Si bien esto no afecta directamente el procedimiento en sí, dependiendo de la concentración del medicamento en la infusión, puede resultar limitante para un efecto fisiológico deseado.
RSGI ofrece la opción menos traumática si se desea la infusión de glándulas salivales. Alternativas como las inyecciones percutáneas transcutáneas o guiadas por los Estados Unidos conllevan el riesgo de lesión del nervio facial. Además, estos procedimientos pueden no lograr una distribución adecuada a toda la glándula, mientras que RSGI utiliza el sistema de conductos para asegurar la distribución. La fluoroscopia se realizó con solución de radiocontraste estándar únicamente con el propósito de este artículo para demostrar que RSGI proporciona una infusión completa con una buena distribución en toda la glándula. Esto se realizó por separado de la infusión real del vector Ad5. La fluoroscopia y/ u otras imágenes de rayos X realizadas durante rsgi para administrar vectores genéticos no serían útiles y no se recomiendan.
A medida que el campo de la terapéutica por transferencia de genes continúa evolucionando, las glándulas salivales como tejido diana ya están ganando popularidad2,5. Ponzio et al. ofrecen una gran revisión sobre las ventajas de las glándulas salivales como objetivos de inmunización4. Como tejido glandular encapsulado y no vital que hemos demostrado que es de fácil acceso, las glándulas parótidas constituyen una plataforma de terapia génica ideal. RSGI ofrece la técnica menos traumática para la transferencia de genes a las glándulas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores quieren agradecer al Sr. Cagney Gentry su apoyo audiovisual en la filmación del procedimiento. También queremos reconocer al centro médico Hefner VA por su apoyo académico en la búsqueda de este proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| 500 µL U100 syringes with 30-gauge needles | Becton Dickinson | 328466 | fixed needle for less waste |
| Adhesive (e.g., Ethicon Dermabond) | Various | Cyanoacrylate adhesive to seal and keep the tubing in the duct during infusion. | |
| Atropine injectable solution | Patterson Veterinary | 07 869-6061 | Atropine inj. 0.54 mg/mL |
| BD Ultra-Fine Insulin Syringes 30G | Walmart | N/A | Avilable in 0.5 mL and 1.0 mL sizes. |
| Cyanoacrylate (medical glue) | Ethicon | DNX12 | Dermabond topical skin adhesive |
| Dental loops with light | Amazon (DDP) | B012M3IV80 | Used to enhance visualization of Stensen's duct papilla |
| Infant Lacrimal Dilator | Surgipro | SPOI-137 | |
| Ketamine injectable solution | Patterson Veterinary | 07-803-6637 | Ketaset inj. 100 mg/mL |
| Lacrimal Dilator | Surgipro | SPOI-132 | Used to dialate the Stensen's duct. |
| Midazolam injectable solution | Patterson Veterinary | 07 890-6698 | Midazolam inj. 5mg/mL |
| Pair of scissors | Amazon (DDP) | N/A | Used to cut PET10 tube |
| Polyethylene Tubing (PE-10) | Scientific Comodities, Inc | BB31695-PE/1 | Tubing connecting the 30G syringe and inserted into the duct. |
| Q-tips | Walmart | N/A | Used to spread cyanoacrylate on the cheek |
| Size 10 Polyethylene Tube (PET 10) | Scientific Commodities | BB31695-PE/1 | low density polyethylene tubing |
| Small Animal Mouth Opener | Amazon (DDP) | B01F3LVJXC | Used to keep the animal's mouth open. |
| Tweezers | Amazon (DDP) | N/A | Used to insert PET10 tube into Stenson's duct |
| Zinc Chloride | Sigma-Aldrich | 7646-86-7 | Included in plasmid DNA infusates |
Referencias
- Isenman, L., Liebow, C., Rothman, S. The secretion of mammalian digestive enzymes by exocrine glands. The American Journal of Physiology. 276, 223-232 (1999).
- Perez, P., et al. Salivary epithelial cells: An unassuming target site for gene therapeutics. The International Journal of Biochemistry & Cell Biology. 42, 773-777 (2010).
- Kochel, T. J., et al. A dengue virus serotype-1 DNA vaccine induces virus neutralizing antibodies and provides protection from viral challenge in Aotus monkeys. Vaccine. 18, 3166-3173 (2000).
- Ponzio, T. A., Sanders, J. W. The salivary gland as a target for enhancing immunization response. Tropical Diseases, Travel Medicine and Vaccines. 3, 4 (2017).
- Baum, B. J., et al. Early responses to adenoviral-mediated transfer of the aquaporin-1 cDNA for radiation-induced salivary hypofunction. Proceedings of the National Academy of Sciences of the United States of America. 109, 19403-19407 (2012).
- Voutetakis, A., et al. Sorting of Transgenic Secretory Proteins in Rhesus Macaque Parotid Glands After Adenovirus-Mediated Gene Transfer. Human Gene Therapy. 19, 1401-1405 (2008).
- Niedzinski, E. J., et al. Enhanced systemic transgene expression after nonviral salivary gland transfection using a novel endonuclease inhibitor/DNA formulation. Gene Therapy. 10, 2133-2138 (2003).
- Niedzinski, E. J., et al. Zinc Enhancement of Nonviral Salivary Gland Transfection. Molecular Therapy. 7, 396-400 (2003).
- Samuni, Y., Baum, B. J. Gene delivery in salivary glands: From the bench to the clinic. Biochimica et Biophysica Acta - Molecular Basis of Disease. , (2011).
- Voutetakis, A., et al. Adeno-Associated Virus Serotype 2-Mediated Gene Transfer to The Parotid Glands of Nonhuman Primates. Human Gene Therapy. 18, 142-150 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados