Method Article
Infusão de glândula parotóide retrógrada através do duto de Stensen em um primata não humano para entrega de genes vetoriados
Neste Artigo
Resumo
As glândulas salivares têm sido propostas como um local alvo tecidual para a terapia genética, especialmente na área de vacinação por transferência genética. Demonstramos a entrega de genes em um modelo de primata não humano utilizando infusão parotída retrógrada.
Resumo
As glândulas salivares são um alvo atraente para a terapia genética com resultados promissores já levando a testes em humanos. Eles são inerentemente capazes de segregar proteínas na corrente sanguínea e são facilmente acessíveis, tornando-os locais de tecido potencialmente superior para a produção de hormônios de reposição ou vacinação por transferência genética. Os métodos sugeridos para a entrega de genes incluem injeção transcutânea e infusão retrógrada através de dutos salivares. Demonstramos como realizar a Infusão de GlândulaS Salivares Retrógradas (RSGI) em primatas não humanos. Descrevemos os importantes marcos anatômicos, incluindo a identificação da papila parótida, um método atrauático de cânulação e vedação do Duto de Stensen utilizando ferramentas básicas dentárias, tubos de polietileno e cianoacrilato, e a taxa apropriada de infusão. Embora este seja o método menos traumático de entrega, o método ainda é limitado pelo volume capaz de ser entregue (<0,5 mL) e o potencial de trauma no duto e na glândula. Demonstramos usando fluoroscopia que um infusor pode ser totalmente entregue na glândula, e demonstramos ainda pela imunohistoquímica a transdução de um vetor típico e expressão do gene entregue.
Introdução
Embora as glândulas salivares sejam bem conhecidas por sua produção exócrina de saliva, os pesquisadores há muito reconhecem sua capacidade de segregar proteínas diretamente na corrente sanguínea1, tornando-as um alvo potencial para a terapia genética para administração sistêmica, como hormônios de reposição ou produção de anticorpos. De fato, as glândulas salivares oferecem várias vantagens sobre outros alvos teciduais, como a capacidade inerente de produzir proteínas para secreção (falta de músculos de propriedade), encapsulamento pesado que pode limitar a difusão vetorial e tecido bem diferenciado que proporciona estabilidade para vetores não integradores. Além disso, no caso de um evento adverso grave, as glândulas salivares não são críticas para a vida e podem ser removidas cirurgicamente. Embora não seja imediatamente intuitiva, as glândulas parótida também são facilmente acessíveis da boca através de seu principal ducto excretório, o Ducto2de Stensen .
Dadas as vantagens do tecido salivar para a terapia genética, há um interesse crescente em explorar esse alvo tecidual. Inúmeros estudos já foram realizados em modelos de primatas roedores, caninos e não humanos e pelo menos um ensaio clínico humano está em andamento3,4,5. Para explorar e desenvolver ainda mais a utilidade desse alvo tecidual para fins de terapia genética, mais estudos de primatas não humanos precisarão ser realizados. Este artigo descreve um método para acessar as glândulas parótidas através do Ducto de Stensen para fornecer um gene vetorial para transdução no modelo de primata não humano. Para demonstrar visivelmente a entrega do infundido e a anatomia do duto ao entrar na glândula, foi realizada fluoroscopia por radiocontrato. Para demonstrar a transdução bem sucedida de um vetor, foi utilizado um sorotipo Adenovírus 5 (Ad5) vetored gene egfp. O Ad5 é um vetor bem descrito capaz de transduir tecido salivar. Embora seja muito imunogênico para o uso clínico final, um vetor Ad5 foi escolhido para este estudo de demonstração para garantir uma transdução eficiente. Avaliar a produção de Proteína Fluorescente Verde Aprimorada (EGFP) é um método bem descrito para demonstrar transcrição e tradução bem-sucedidas de um gene vetorial após a transdução e foi feito aqui.
Protocolo
Todos os procedimentos foram realizados na Wake Forest School of Medicine Clarkson Campus para estudos em animais. O Comitê Institucional de Atenção e Uso de Animais (IACUC) foi consultado para considerações éticas e detalhes dos procedimentos foram submetidos à revisão. A Wake Forest IACUC aprovou nosso protocolo de estudo e todos os procedimentos foram feitos sob o protocolo aprovado pela IACUC #A17-147.
1. Preparando o dispositivo de infusão
- Corte tamanho 10 Tubo de polietileno (PET10) em comprimentos de 25 cm usando um par de tesouras.
- Marque PET10 a 1 cm e 2 cm de uma extremidade usando um marcador preto.
- Prefill 0,5 mL de solução Ad5-EGFP (109 partículas virais/mL) em uma seringa de 1 mL (tuberculina).
- Deslize a extremidade não marcada do tubo PET10 sobre a agulha de 29-31 G presa a uma seringa. Geralmente é mais fácil realizar essa tarefa sob ampliação.
- Infunda a solução no PET10 até que o tubo esteja completamente cheio (gota visível na extremidade livre).
- Use EPI padrão completo, incluindo esfoliações cirúrgicas, vestido de manga comprida, luvas impermeáveis, máscara cirúrgica, escudo facial, capô de cabelo e tampas de sapato.
2. Preparando o animal
NOTA: Macaques cynomolgus foram usados para a demonstração de vídeo. A anatomia de outros primatas não humanos e humanos é muito semelhante, e o protocolo deve ser traduzível para outras espécies.
- Injete subcutâneamente 0,05 mg/kg de atropina 15 min antes do procedimento para minimizar secreções salivares e otimizar a distribuição e retenção do infusor.
- Forneça anestesia utilizando seringas de 5 mL com cetamina intramuscular/midazolam (10-15 mg/kg de cetamina e 0,01-0,05 mg/kg de midazolam). Confirme a anestesia adequada quando o animal sedado ficar inconsciente e não conseguir reagir a estímulos.
3. Realização do procedimento
- Use retráteis orais para preparar a boca aberta.
- Coloque a almofada de borracha de uma extremidade do retrátil no paladar duro atrás dos dentes superiores na lateral da boca em frente à glândula que será infundida. Coloque a almofada de borracha da outra extremidade no canino inferior no mesmo lado do retrátil superior. Deixe suavemente a ação de mola do retrátil para expandir e abrir a boca.
- Identifique a papila parotída, a abertura do Ducto de Stensen, na bochecha posterior, adjacente ao2º molar superior. Este é melhor visualizado usando laços dentários para ampliação.
- Dilate suavemente a papila parótida com o ponto do dilatador cônico. É melhor colocar o ponto do dilatador no centro ou abertura da papila e, em seguida, girar suavemente para frente e para trás. O ponto deve entrar lentamente na papila e dilatar-na ao longo de aproximadamente 20 - 30 s de rotação suave.
- Insira a tubulação PET10 na papila parótida dilatada. Isso é melhor conseguido segurando a extremidade marcada do tubo PET10 com pinças aproximadamente 0,5 cm da extremidade distal e inserindo suavemente a ponta do tubo na papila dilatada.
- Avance suavemente o tubo, que muitas vezes é facilitado por pequenos movimentos rotativos para ajudar o tubo a deslizar, seguido de reajuste da pinça de 0,5 cm proximal para a aderência anterior. Repita isso até que a marca de 2 cm atinja a papila parótida.
- Aplique cianoacrilato na bochecha ao redor da papila e do tubo inserido e espere que ele seque (nenhuma quantidade específica registrada, apenas o suficiente para selar a entrada da papila ducta de Stensen). Isso normalmente leva menos de um minuto e ajuda a selar a papila parótida e reduzir o derramamento de infusão de volta na cavidade oral.
- Empurre lentamente o teor de seringa por mais de 5 min a uma taxa de 100 μL/min. Esta lenta taxa de infusão minimiza o risco de lesão do ducto devido ao aumento repentino da pressão intra-ductal.
- Deixe PET10 no lugar por pelo menos 5 minutos após a infusão estiver completa. Mantenha o duto selado e deixe que o infusor permaneça na glândula parótida.
- Remova PET10 com tração suave. O cianoacrilato se soltará com o tubo.
- Repita as etapas 3.2 até 3.8 no lado oposto.
- Solte lentamente os retráteis orais depois que ambos os parotídeos foram infundidos e ambos os tubos PET10 removidos.
NOTA: Todo o procedimento para ambos os lados deve levar menos de 30 minutos.
4. Cuidados pós-processuais
- Após a infusão ser concluída e o duto de Stensen descanalizado, observe os animais até que o efeito anestesia desapaixe (geralmente entre 20-30 min pós-procedimento).
- Ofereça as bebidas animais e depois a comida depois que eles estiverem totalmente acordados e retome os cuidados de rotina.
Resultados
Procedimento bem sucedido, transdução e transcrição
A Figura 1 mostra a papila parótida adjacente ao 2º molar na bochecha superior posterior. A imagem também mostra a colocação correta da cinta bucal, uma extremidade de borracha no paladar duro e a outra ponta de borracha no canino ipsilateral. A Figura 2 mostra uma imagem tirada após a canulação bem sucedida da papila parotíide na marca de 2 cm no PET10. A Figura 3 mostra uma imagem de fluoroscopia no momento de uma infusão de radiocontrast demonstrando ramificação da solução através do Ducto de Stensen e na glândula parótide. Esta imagem fluoroscópica foi realizada com a única intenção de demonstrar a anatomia e distribuição de um infusor. Fluoroscopia não é necessária ao realizar este procedimento para entrega de vetores. A Figura 4 mostra imunossumanhás de EGFP em vermelho na histopatologia. Ambas as células ductais e acinar foram manchadas em vermelho, indicando transdução e transcrição bem sucedidas em ambos os tipos de células. Em resumo, essas quatro figuras demonstram RSGI apropriado com visualização da anatomia e transdução de EGFP vetorial Ad5.
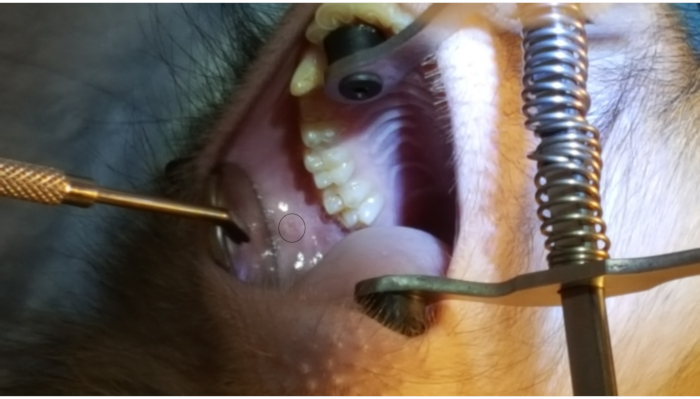
Figura 1: Papila parotída. Observe o círculo sobre a figura destacando a papila parótida adjacente ao2º molar na bochecha posterior. Observe também a colocação da cinta bucal, com uma extremidade de borracha no paladar duro e a outra elça de borracha no canino inferior. Clique aqui para ver uma versão maior desta figura.
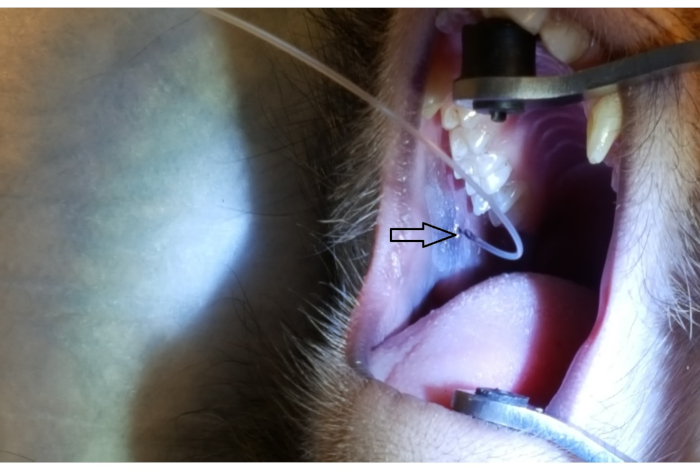
Figura 2: Cannulação de papila parótida por PET10. Observe a marca de 2 cm no tubo PET10 visível na papila parótida (ponta de flecha), localizada na bochecha posterior, adjacente ao molar2º superior. Clique aqui para ver uma versão maior desta figura.

Figura 3: Imagem de fluoroscopia mostrando difusão na glândula parótida. Observe ramificação no final do duto de Stensen (ponta de flecha) enquanto se ramifica em dutos menores na glândula parótida (Círculo). Clique aqui para ver uma versão maior desta figura.

Figura 4: Deslizamento patológico da glândula parótida. Nota expressão de EGFP (manchado em vermelho) por tecido parotídeo ductal/acinar. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui descrevemos um protocolo de infusão retrógrada na glândula parótida através do Duto de Stensen. A metodologia descrita oferece orientações que podem ser potencialmente utilizadas por pesquisadores que exploram a utilidade do tecido salivar como local para terapia genética e outras aplicações.
Existem várias etapas críticas para garantir o sucesso do procedimento. Em primeiro lugar, todas as etapas processuais devem ser concluídas suavemente. O forte aumento da boca pode resultar em subluxação mandibular. A forte isolamento da papila parótide ou a rápida infusão da solução no Ducto de Stensen podem resultar em lágrimas ductais agudas ou estenose ductal crônica.
Em segundo lugar, certifique-se de que a anestesia tenha sido administrada e seja eficaz. Sem anestesia adequada, nenhuma das etapas pode ser facilmente realizada e o risco de lesões animais e humanas é significativamente aumentado. Optamos por anestesia intramuscular com cetamina e midazolam, que é um regime padrão em estudos de primatas não humanos6. Consideramos a atropina importante para reduzir as secreções salivares durante o procedimento, melhorando a visibilidade da anatomia e reduzindo a lavagem do infusor antes da transdução7,8.
Um passo que muitas vezes é desafiador é a canulação inicial e o avanço do PET10 na papila parótida e no Ducto de Stensen. A rotação suave do PET10 ao inserir facilita essas etapas. O empurrão excessivo pode levar a lesões ductais.
O procedimento é limitado principalmente pela fragilidade e pelo tamanho do tecido. Isso requer uma técnica muito suave e uso de laços de ampliação e pequenas ferramentas para garantir a cannulação adequada, avanço da tubulação e entrega do infusor. Outra limitação potencial é o volume de infusão que as glândulas parótidas são capazes de acomodar. Estudos anteriores infundiram um volume máximo de 0,5 mL em cada glândula parótida, totalizando 1 mL por animal6,9,10. Embora isso não afete diretamente o procedimento em si, dependendo da concentração de drogas no infusor, pode ser limitador para um efeito fisiológico desejado.
O RSGI oferece a opção menos traumática se a infusão da glândula salivar for desejada. Alternativas como injeções percutâneas transcutâneas ou norte-americanas carregam o risco de lesão no nervo facial. Além disso, esses procedimentos podem não conseguir uma distribuição adequada para toda a glândula, enquanto o RSGI utiliza o sistema de dutos para garantir a distribuição. A fluoroscopia foi realizada com solução de radiocontrast padrão exclusivamente com o propósito deste artigo para demonstrar que o RSGI oferece uma infusão completa com boa distribuição em toda a glândula. Isso foi realizado separadamente da infusão real do vetor Ad5. Fluoroscopia e/ou outras imagens de raios-X realizadas durante o RSGI para o parto de vetores genéticos não seriam úteis e não é recomendado.
À medida que o campo da terapêutica por transferência genética continua a evoluir, as glândulas salivares como tecido alvo já estão ganhando popularidade2,5. Ponzio et al. oferecem uma grande revisão sobre as vantagens das glândulas salivares como metas para a imunização4. Como tecido glandular encapsulado e não vital que demonstramos ser facilmente acessível, as glândulas parótidas constituem uma plataforma ideal de terapia genética. O RSGI oferece a técnica menos traumática para transferência genética para as glândulas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores querem agradecer ao Sr. Cagney Gentry por seu apoio audiovisual na filmagem do procedimento. Também queremos reconhecer o centro médico Hefner VA para apoio acadêmico em busca deste projeto.
Materiais
| Name | Company | Catalog Number | Comments |
| 500 µL U100 syringes with 30-gauge needles | Becton Dickinson | 328466 | fixed needle for less waste |
| Adhesive (e.g., Ethicon Dermabond) | Various | Cyanoacrylate adhesive to seal and keep the tubing in the duct during infusion. | |
| Atropine injectable solution | Patterson Veterinary | 07 869-6061 | Atropine inj. 0.54 mg/mL |
| BD Ultra-Fine Insulin Syringes 30G | Walmart | N/A | Avilable in 0.5 mL and 1.0 mL sizes. |
| Cyanoacrylate (medical glue) | Ethicon | DNX12 | Dermabond topical skin adhesive |
| Dental loops with light | Amazon (DDP) | B012M3IV80 | Used to enhance visualization of Stensen's duct papilla |
| Infant Lacrimal Dilator | Surgipro | SPOI-137 | |
| Ketamine injectable solution | Patterson Veterinary | 07-803-6637 | Ketaset inj. 100 mg/mL |
| Lacrimal Dilator | Surgipro | SPOI-132 | Used to dialate the Stensen's duct. |
| Midazolam injectable solution | Patterson Veterinary | 07 890-6698 | Midazolam inj. 5mg/mL |
| Pair of scissors | Amazon (DDP) | N/A | Used to cut PET10 tube |
| Polyethylene Tubing (PE-10) | Scientific Comodities, Inc | BB31695-PE/1 | Tubing connecting the 30G syringe and inserted into the duct. |
| Q-tips | Walmart | N/A | Used to spread cyanoacrylate on the cheek |
| Size 10 Polyethylene Tube (PET 10) | Scientific Commodities | BB31695-PE/1 | low density polyethylene tubing |
| Small Animal Mouth Opener | Amazon (DDP) | B01F3LVJXC | Used to keep the animal's mouth open. |
| Tweezers | Amazon (DDP) | N/A | Used to insert PET10 tube into Stenson's duct |
| Zinc Chloride | Sigma-Aldrich | 7646-86-7 | Included in plasmid DNA infusates |
Referências
- Isenman, L., Liebow, C., Rothman, S. The secretion of mammalian digestive enzymes by exocrine glands. The American Journal of Physiology. 276, 223-232 (1999).
- Perez, P., et al. Salivary epithelial cells: An unassuming target site for gene therapeutics. The International Journal of Biochemistry & Cell Biology. 42, 773-777 (2010).
- Kochel, T. J., et al. A dengue virus serotype-1 DNA vaccine induces virus neutralizing antibodies and provides protection from viral challenge in Aotus monkeys. Vaccine. 18, 3166-3173 (2000).
- Ponzio, T. A., Sanders, J. W. The salivary gland as a target for enhancing immunization response. Tropical Diseases, Travel Medicine and Vaccines. 3, 4 (2017).
- Baum, B. J., et al. Early responses to adenoviral-mediated transfer of the aquaporin-1 cDNA for radiation-induced salivary hypofunction. Proceedings of the National Academy of Sciences of the United States of America. 109, 19403-19407 (2012).
- Voutetakis, A., et al. Sorting of Transgenic Secretory Proteins in Rhesus Macaque Parotid Glands After Adenovirus-Mediated Gene Transfer. Human Gene Therapy. 19, 1401-1405 (2008).
- Niedzinski, E. J., et al. Enhanced systemic transgene expression after nonviral salivary gland transfection using a novel endonuclease inhibitor/DNA formulation. Gene Therapy. 10, 2133-2138 (2003).
- Niedzinski, E. J., et al. Zinc Enhancement of Nonviral Salivary Gland Transfection. Molecular Therapy. 7, 396-400 (2003).
- Samuni, Y., Baum, B. J. Gene delivery in salivary glands: From the bench to the clinic. Biochimica et Biophysica Acta - Molecular Basis of Disease. , (2011).
- Voutetakis, A., et al. Adeno-Associated Virus Serotype 2-Mediated Gene Transfer to The Parotid Glands of Nonhuman Primates. Human Gene Therapy. 18, 142-150 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados