Method Article
Aksin2-mTurkuaz2 Raportör Timositlerde Düşük Wnt Ekspresyonunun Flow Sitometrisi ve Konfokal Görüntüleme Analizi
Bu Makalede
Özet
Sinyal seviyelerinin hücre kaderini düzenlediği bilinmektedir, bu da Wnt sinyalinin düzenlenmesinin ilginç bir terapötik hedef oluşturduğunu göstermektedir. Burada, farklı Wnt sinyal seviyelerini ölçen sağlam bir murin kanonik Wnt sinyalleme raportör modeli için akış sitometrisi ve konfokal mikroskopi analiz yöntemlerini açıklıyoruz.
Özet
Yeni Wnt terapötik hedeflerini belirlemeye veya test etmeye çalışırken Wnt ekspresyon seviyelerinin ölçülmesi çok önemlidir. Önceki çalışmalar, kanonik Wnt sinyallemesinin dozaj güdümlü bir mekanizma aracılığıyla çalıştığını ve çeşitli hücre tiplerinde Wnt sinyalini inceleme ve ölçme ihtiyacını motive ettiğini göstermiştir. Fizyolojik Wnt ekspresyonunu temsil etmek için birkaç raportör model önerilmiş olsa da, ya genetik bağlam ya da raportör protein, bu araçların geçerliliğini, doğruluğunu ve esnekliğini büyük ölçüde etkilemiştir. Bu makale, mutasyona uğramış bir Axin2em1Fstl aleli içeren Axin2-mTurquoise2 fare Wnt raportör modeli ile elde edilen verilerin elde edilmesi ve analiz edilmesi için yöntemleri açıklamaktadır. Bu model, geniş bir Wnt aktivitesi aralığı boyunca tek tek hücrelerde endojen kanonik Wnt sinyallemesinin incelenmesini kolaylaştırır.
Bu protokol, hücre yüzeyi belirteçleri veya β-katenin hücre içi boyama ile birlikte hematopoietik sistemin hücre popülasyon analizini kullanarak Axin2-mTurkuaz2 raportör aktivitesinin nasıl tam olarak takdir edileceğini açıklar. Bu prosedürler, ilgilenilen diğer dokularda veya hücrelerde uygulama ve üreme için bir temel görevi görür. Floresanla aktive edilen hücre sınıflandırması ve konfokal görüntülemeyi birleştirerek, farklı kanonik Wnt ekspresyon seviyeleri görselleştirilebilir. Önerilen ölçüm ve analiz stratejileri, kanonik Wnt sinyalizasyonunun hassas bir şekilde değerlendirilmesi için floresan ekspresyon seviyeleri hakkında nicel veriler sağlar. Bu yöntemler, kanonik Wnt ekspresyon örüntüleri için Axin2-mTurquise2 modelini kullanmak isteyen araştırmacılar için faydalı olacaktır.
Giriş
Kanonik Wnt sinyali, sağlıklı doku homeostazında ve hastalıkta rol oynayan korunmuş bir sinyal yoludur. Wnt sinyal seviyelerinin hassas bir şekilde düzenlenmesinin embriyonik gelişimde önemli olduğu gösterilmiştir, ancak yetişkin dokularda da büyük önem taşımaktadır. Kanonik Wnt sinyalinin bağırsak, deri ve hematopoetik sistem gibi çeşitli organların doku rejenerasyonunda önemli bir rol oynadığı bulunmuştur. Bu nedenle, Wnt sinyali deregüle edildiğinde ciddi patolojiler ortaya çıkar. Kolorektal, karaciğer ve cilt kanseri, nörolojik hastalık ve bazı hematolojik maligniteler, düzensiz Wnt sinyalizasyonunun nedensel faktör veya katkıda bulunduğu örnek patolojilerdir1. Bu nedenle, farklı Wnt hedefleri için çeşitli inhibitörler şu anda Wnt ile ilişkili kanser terapötikleri2 olarak klinik çalışmalarda test edilmektedir.
Ek olarak, nörolojik iyileşme, yaşa bağlı nörolojik bozukluklar ve konjenital otizm spektrum bozuklukları için Wnt terapötik potansiyelinde ilginç ilerlemeler meydana gelmektedir 3,4,5. Wnt sinyalleri, sonraki transplantasyon için kök hücrelerin ex vivo genişlemesi için araştırılmıştır6. Bununla birlikte, kanonik Wnt sinyalinin terapötik hedeflemesi, birçok temel hücre fonksiyonundaki önemi ve diğer yolaklarla çapraz konuşmasınedeniyle zor bir çabadır 7,8,9, bu Wnt terapötik ajanlarının etkilerini yorumlaması kolay bir modelde hassas bir şekilde ölçme ihtiyacına neden olur. Kanonik Wnt sinyali, komşu hücreler tarafından salgılanan veya çeşitli Wnt'ye duyarlı kök hücre tiplerinde bildirildiği gibi otokrin atılımı olarak salgılanan kısa menzilli, çözünür Wnt ligandları tarafından yönlendirilir.
Wnt Frizzled reseptörü ve lipoprotein reseptörü ile ilişkili protein (LRP) ko-reseptörleri, hücre içi bir sinyal kaskadını tetikleyen bu ligandlara yanıt verir. Wnt sinyali kapalı olduğunda, Eksen İnhibitörü (Aksin), tümör baskılayıcı gen ürünü, Adenomatöz Polipozis Coli (APC), Kazein Kinaz1 (CK1α) ve Glikojen Sentaz Kinaz'dan (GSK-3β) oluşan bir yıkım kompleksi, proteazomal bozunma ile β-katenin (CTNNB1) birikimini önler. Wnt ligand-reseptör bağlanması üzerine, yıkım kompleksi inaktive edilir, bu da sitoplazmada β-kateninin birikmesine ve stabilizasyonuna yol açar. Aktif β-katenin, Wnt hedef genlerinin transkripsiyonunu başlatmak için Transkripsiyon Faktörü / Lenfoid Arttırıcı Bağlayıcı Faktör (TCF / LEF) transkripsiyon faktörlerine bağlandığı çekirdeğe göç edebilir. Axin2, Wnt yolu10'un doğrudan hedefi olduğu için bir hedef gen olarak kabul edilir. Ek olarak, Axin2, aktif kanonik Wnt sinyali11,12 için bir raportör genin yanı sıra negatif bir düzenleyici olarak hizmet eder.
Literatürde birkaç kanonik Wnt sinyal muhabiri tanımlanmıştır ve Wnt sinyalinin embriyonik gelişimdeki rolünü anlamada büyük fayda sağlamıştır. Bu raportörlerin çoğu, endojen bir hedef gen 13,14,15,16,17,18,19 kullanmayan sentetik olarak yerleştirilmiş TCF/LEF bağlanma bölgelerini kullanır. Ek olarak, 11,20,21,22,23 geninin doğal konumuna saygı duyan Axin2 knock-in stratejileri kullanılmıştır ve bunların Axin2-LacZ'si genellikle en sağlam kanonik Wnt raportörü olarak kabul edilir11. Bununla birlikte, raportör protein LacZ, çoğu dokuda kullanımı kolay olsa da, canlı hücreler için sert olduğu kabul edilen bir β-galaktosidaz substratı gerektirir24. Özellikle kök hücreler ve timositler için, sert LacZ tespit koşulları, hücre süspansiyonlarını ele alırken hücresel ölümü (kendi bildirilmemiş verileri) artırır.
LacZ boyamanın neden olduğu sinyal amplifikasyonu, düşük sinyalleri tespit etmek için uygun olsa da, nicelemeyi daha az doğrudan ve dolayısıyla tartışmalı bir şekilde daha az güvenilir hale getirir. Bu nedenle, bir murin raportör modeli, Axin2-LacZ genetik stratejisini taklit etmek için tasarlanmıştır, ancak bir mTurquoise2 raportör proteini21 ile, daha doğrudan ve fizyolojik ifade seviyelerine daha yakın bir okuma sağlamak için tasarlanmıştır. mTurquoise2 floresan proteini, yüksek parlaklığı (kuantum verimi (QY) = 0.93), geniş hücre yüzeyi karakterizasyonu için diğer floresan proteinlerle kombinasyon halinde esnekliği ve eksojen bir substrata ihtiyaç duymaması nedeniyle LacZ için mükemmel bir alternatiftir. Ayrıca, yeşil floresan proteini (GFP) ile yakın genetik ilişkisi, gerekirse Wnt'ye son derece duyarlı hücrelerde daha güçlü sinyal tespiti için GFP'yi tanıyan floresan antikorların çoğunu kullanma imkanı sunar25.
Axin2-mTurquoise2 modeli sadece kanonik bir Wnt raportörü değil, aynı zamanda Axin2 heterozigot ve homozigot (Axin2 nakavt) fenotiplerini inceleme imkanı da sunar. Axin2'nin başlangıç bölgesine mTurquoise2'nin hedeflenen yerleştirilmesi, bozulmuş bir Axin2 proteini21 ile sonuçlanır. İletken olarak da bilinen Axin2, Wnt yıkım kompleksinin bir parçası olduğundan ve yıkım kompleksi β-katenin aracılı transkripsiyonu sıkı bir şekilde düzenlediğinden, kısmi veya tam yokluğu çeşitli patolojileri incelemek için ilgi çekici olabilir. Örneğin, kolorektal kanserde, Wnt hiperaktivasyonu11 nedeniyle Axin2 seviyeleri nispeten yüksektir; Bununla birlikte, diğer patolojilerdeki rolü hala büyük ölçüde bilinmemektedir. Axin2'nin β-kateninin bozunmasında sınırlı bir rol oynadığı düşünülse de, Wnt regülasyonundaki rolü, Wnt aracılı kolorektal kanser büyümesini bloke eden küçük bir peptitin eklenmesiyle arttırılabilir26.
Toplamda, Wnt terapötik hedefleri aracılığıyla dikkatli Wnt regülasyonu, ciddi patolojilerin başlangıcını veya gelişimini değiştirmek için fırsatlar yaratabilir ve raportör kapasitesine sahip modellerde daha fazla araştırılmalıdır. Bu raporda, akış sitometrisi ve konfokal görüntüleme için Axin2-mTurkuaz2 fare modelinin en iyi uygulama analiz yöntemimizi açıklıyoruz. Wnt dozaj seviyeleri bağlamında, çok düşük kanonik Wnt sinyalizasyon seviyelerinin tespit edilmesi zordur, bu nedenle gelişmiş algılama ve analiz yetenekleri, bu modelin faydalarından tam olarak yararlanmak için bir avantaj sağlar. Timositler, kırılgan hücre canlılıkları, düşük kanonik Wnt sinyal ekspresyonu ve Axin2-mTurkuaz2 modelinin algılama hassasiyetini temsil etmek için yoğunlaştırılmış sitoplazma alanı nedeniyle bir model sistem olarak kullanılır. Ek olarak, sitoplazmik β-katenin seviyelerini ölçmek ve raportör ile kombinasyon halinde nükleer aktif kanonik Wnt sinyalini doğrulamak için timosit hücre süspansiyonları için histolojik bir toplam β-katenin boyama prosedürü açıklanmaktadır.
Protokol
NOT: Tüm fare prosedürleri, Leiden Üniversitesi Tıp Merkezi (LUMC) Hayvan Deneyleri Etik Komitesi'nin onayı ile gerçekleştirilmiştir. Erkek ve dişi, 6-12 haftalık, vahşi tip (wt), Axin2-mTurquoise2 raportör yapısının bir eklenmesi ile ve dolayısıyla bir Axin2-murquoise2 raportör yapısının eklenmesi ile heterozigot (Tg/0) ve her iki alelde Axin2-mTurkuaz2 raportör yapısının eklenmesi ile homozigot (Tg/Tg) ve böylece iki bozulmuş Axin2 geni; Axin2-mTurkuaz2 fareler (B6; Deneylerde CBA-Axin2em1Fstl/J fareleri) kullanılmıştır. Hayvanlar, organ izolasyonundan önce CO2 ötenazi ile sakrifiye edildi. Prosedür boyunca, numunelerin ışığa maruz kalmasını en aza indirin ve aksi belirtilmedikçe her zaman buz veya 4 °C üzerinde tutun. Numuneleri alüminyum folyo ile kaplayın. Tüm adımlar biyogüvenlik kabini olan standart bir laboratuvarda gerçekleştirilmelidir.
1. Timosit hücre süspansiyonunun hazırlanması
- Farelerin karnını keserek ve timusu forseps ile çıkararak kan kontaminasyonu olmadan timusu farelerden dikkatlice hasat edin. %2,5 fetal buzağı serumu (FCS) içeren buz gibi Iscove'un Modifiye Dulbecco's Medium'unda (IMDM) geçici olarak saklayın/taşıyın.
NOT: Kan dökülmesini ve olası timus hasarını önlemek için, fareleri servikal çıkık ile feda etmeyin. - 70 μm hücre süzgeci ile 50 mL'lik bir tüp hazırlayın ve filtreyi 1 mL soğuk IMDM /% 2.5 FCS ortamı ile ıslatın.
- Soğuk IMDM /% 2.5 FCS ortamı ile iki kez yıkarken organı 1 mL şırınga pistonunun arka ucuyla ezin (Şekil 1A). İstenirse, ölü hücre topaklanmasını önlemek için IMDM /% 2.5 FCS ortamına 50 U / mL DNAse I'lik bir son konsantrasyon ekleyin. Filtreyi 2x soğuk IMDM /% 2.5 FCS ortamı ile durulayın ve 50 mL tüpte hafifçe yeniden süspanse edin.
NOT: 10 mL'lik toplam uç hacmini aşmayın. Sonraki adımlar için ve kullanılmadığı zamanlarda hücreleri buz üzerinde ve karanlıkta tutun. - 330 × g'da 4 ° C'de 5 dakika santrifüjleyin ve süpernatanı hücre peletinden nazikçe aspire edin. Hücre peletini soğuk eksik IMDM /% 2.5 FCS ortamında nazikçe yeniden süspanse edin ve hücre sayımı için hazırlanın.
NOT: Gerekirse, daha sonra deney yapmak için timositleri dondurun ve FCS-10% dimetilsülfoksit içinde sıvı nitrojen içinde saklayın. Uygun hücre dondurma ve çözme, aşırı hücre ölümünü azaltacaktır. Ortalama olarak, timositlerin yarısı, timustaki doğal T hücresi seçimi nedeniyle çözüldükten sonra apoptotik olabilir, bu da kriyo-flakon başına kaç timositin dondurulacağına karar verirken dikkate alınmalıdır. Flakon başına en az 2,5 × 106 timosit dondurulmalıdır.
2. Timosit akış sitometrisi hazırlığı
- Buz gibi soğuk fosfat tamponlu salin (PBS, pH 7.4) içinde boyama numunesi başına 2.5 ×10 6 timosit hazırlayarak hücre yüzeyi boyama prosedürü için timositleri hazırlayın (Şekil 1B). Timositler daha önce dondurulmuşsa, çözüldükten sonra canlı hücrelerin sayısını sayın. Gerekirse, ölü hücre topaklanmasını önlemek için 50 U / mL DNAse I'lik bir son konsantrasyon ekleyin.
- Tam bir timosit alt kümesinin hücre yüzeyi karakterizasyonu için antikor boyama panellerini kullanın.
NOT: Diğer florokrom kombinasyonları seçilebilir. Parlak floresan florokromlar için nadir popülasyon belirteçleri seçin ve mümkünse bir canlı-ölü işaretleyici ekleyin. Spektral örtüşme nedeniyle ne V450 ne de V500 florokromlar, mTurquoise2 floresan raportör ile birlikte kullanılmamalıdır. Her zaman mTurquoise2'nin floresan spektrumlarını mavi ve yeşil florokromlarla birlikte kontrol edin (Ek Şekil 1A).- Soy negatif (Lin-) panellerin önceden tanımlanmış oranlarındaki antikorları, PBS /% 0.2 sığır serum albümini (BSA)/% 0.1NaN3 (sodyum azid) tamponunda ayrı ayrı karıştırın.
NOT: Tüm istenmeyen hücreler (timusta bulunan timosit olmayanlar) bir streptavidin ikincil antikoru (bu örnekte, fikoeritrin (Pe)-Cy7 ve allofikosiyanin (APC)-Cy7) ile 2 aşamalı bir işlemde boyanır ve akış sitometrisi analizinde bir "boşaltma kapısı" kullanılarak dışlanabilir. - Çift Negatif (DN) boyama panelinin önceden tanımlanmış oranlarındaki antikorları, PBS /% 0.2 BSA /% 0.1 NaN3 tamponunda streptavidin ikincil antikoru Pe-Cy7 ile karıştırın. Lin-panel'i bu karışımdan çıkarın (Tablo 1).
- Antikorları, Olgunlaşmamış Tek Pozitif (ISP), Çift Pozitif (DP) ve Tek Pozitif (SP) boyama panelinin önceden tanımlanmış oranlarında, PBS /% 0.2 BSA /% 0.1 NaN3 tamponunda streptavidin ikincil antikoru APC-Cy7 ile karıştırın. Lin-panel'i bu karışımdan çıkarın (Tablo 1).
- İlk olarak, karanlıkta buz üzerinde 30 dakika boyunca Lin-panellerinin biyotin primer antikor karışımlarını kullanarak timositleri istenmeyen T hücre dışı popülasyonlarla boyayın.
NOT: Her Lin-panel farklı bir hücre grubudur ve bu nedenle tek bir numunede birlikte boyanmamalıdır. - 300 × g'da, 4 °C'de 5 dakika döndürün ve süpernatanı çıkarın. Timositleri 150 μL buz gibi soğuk PBS /% 0.2 BSA /% 0.1 NaN3 tamponu ile yıkayın ve 300 × g, 4 ° C'de 5 dakika döndürün.
- DN paneli ve ilgili Lin- boyanın ISP/DP/SP paneli ile karanlıkta buz üzerinde 30 dakika boyunca boyayın. 300 × g'da, 4 °C'de 5 dakika döndürün ve süpernatanı çıkarın. Timositleri 150 μL buz gibi soğuk PBS/%0.2 BSA/%0.1NaN3 tamponu ile yıkayın ve 300 × g, 4 °C'de 5 dakika döndürün.
- Soy negatif (Lin-) panellerin önceden tanımlanmış oranlarındaki antikorları, PBS /% 0.2 sığır serum albümini (BSA)/% 0.1NaN3 (sodyum azid) tamponunda ayrı ayrı karıştırın.
- 35 μm'lik bir hücre süzgeç tüpü ile homojenize ederek ve hücreleri PBS/%0.2 BSA/%0.1NaN3 tamponunda alarak hücreleri akış sitometrisi ölçümü için hazırlayın. Hücreleri ışıktan koruyun ve akış sitometresi ölçümü sırasında ve sırasında buz üzerinde tutun.
NOT: NaN3 (sodyum azid) oldukça toksik ve ölümcüldür. Bu madde ile çalışırken özel dikkat gösterilmelidir. Kullandıktan sonra ellerinizi iyice yıkayın ve NaN3 yutulursa hemen bir zehir kontrol merkezini veya doktoru/doktoru arayın.
3. Akış sitometresi ölçümü
NOT: mTurquoise2 sinyalinin diğer birkaç florokromla kombinasyon halinde ölçülmesi, deneyin deneyim ve bilgili bir şekilde planlanmasını gerektirdiğinden, deneyimsiz kullanıcılar önce akış sitometresi eğitimi almalıdır. Akış sitometresi hakkında bilgi için Malzeme Tablosuna bakın.
- Akış sitometresini kullanım kılavuzuna veya diğer yerleşik protokole göre başlatın. Optimum floresan algılama stratejisi için akış sitometresindeki bant geçiren filtre setlerini kontrol edin ve gerekirse ayarlayın.
NOT: mTurquoise2 için önerilen bir filtre, ultraviyole 405 nm, 407 nm veya daha az yaygın olan 440 nm lazer çizgisinde 470/20 nm'dir. - Piyasada bulunan kompanzasyon boncukları ve stabil şekilde transfekte edilmiş, mTurquoise2 eksprese eden 293T hücreleri ile kompanzasyon ayarları oluşturarak akış sitometresini kalibre edin.
NOT: Kompanzasyon boncukları yerine tek lekeli wt timositler kullanılabilir. Bu durumda, boncuklarla kompanzasyon, hücrelerin kullanılmasından eşit derecede verimli ve daha uygundu.- Boncukları, deneyde kullanılan her bir florokrom ile etiketleyin ve lekelenmemiş boncukları dahil edin. Bir kompanzasyon ayar paneli oluşturmak için boncukları ölçün ve boncuklarda kullanılabilecek mTurkuaz2 için eşleşen florokrom olmadığından mTurkuaz2 ifade eden 293T hücrelerini ölçün. Gerçek deneyde kullanmak için telafi ayarlarını kaydedin.
NOT: Kompanzasyon ayarı için kullanılan mTurquoise2 eksprese eden hücreler, gerçek deneyin mTurquoise2 eksprese eden timositlerinden daha parlak veya daha parlak olmalıdır. Ayrıca mTurquoise2-negatif 293T hücrelerinin de mevcut olduğundan emin olun. - Deney için, mTurquoise2 FMO için bir wt numunesi ve analiz kısmı için pozitif kontroller olarak her fare genotipinin boyanmamış bir timosit numunesi dahil olmak üzere floresan eksi bir (FMO) Tg / Tg ile boyanmış timositleri dahil edin.
NOT: Bu kontroller, pozitif hücreler için kapıları doğru şekilde ayarlamak için önemlidir. Deney numunelerinin geri kalanı komple boyama paneli ile boyanır (Tablo 1).- Bir deney oluşturun, akış sitometresi yazılımında tüp sayısını ekleyin ve adlandırın ve tüm florokrom seti için lekeli hücreleri görselleştirmek için dağılım grafikleri oluşturun.
- Daha önce oluşturulan telafi ayarlarını denemeye uygulayın. Saçılma grafiğinde tam hücre popülasyonu görünene kadar boyanmamış wt timositlerle ileri saçılmayı (FSC) ve yan saçılmayı (SSC) ayarlayın. Pozitif popülasyonun görünür olduğundan emin olmak için önce boyanmamış Tg / Tg mTurkuaz2 eksprese eden timositleri ölçün.
- Tg/Tg tamamen boyanmış bir timosit örneğini ölçün ve tüm florokrom kombinasyonlarını kontrol edin. Gerekirse, yanlış kompanzasyon gösteren florokromlar için önceden belirlenmiş kompanzasyon değerlerini ayarlayın. Deney numunelerinin geri kalanını ölçün ve numunelerin ölçümü sırasında herhangi bir ayar yapmayın.
NOT: Müteakip kompanzasyon ayarlaması da analiz yazılım paketinde gerçekleştirilebilir. Mevcut hücre sayısı sınırlayıcı bir faktör olsa da, ölçüm sırasında bu adımın gerçekleştirilmesi tavsiye edilir. mTurkuaz2 yoğunluk değerlerinin karşılaştırılması için ayarları tüm numuneler arasında eşit tutun.
- Boncukları, deneyde kullanılan her bir florokrom ile etiketleyin ve lekelenmemiş boncukları dahil edin. Bir kompanzasyon ayar paneli oluşturmak için boncukları ölçün ve boncuklarda kullanılabilecek mTurkuaz2 için eşleşen florokrom olmadığından mTurkuaz2 ifade eden 293T hücrelerini ölçün. Gerçek deneyde kullanmak için telafi ayarlarını kaydedin.
4. Akış sitometrik analizi
NOT: Akış sitometrik analizi, Malzeme Tablosunda belirtilen özel yazılım kullanılarak gerçekleştirilmiştir; Bununla birlikte, başka akış sitometrik analiz programları da mevcuttur.
- FSC ve SSC değerlerine göre canlı hücreleri ve timosit alt kümelerini kapılayın.
- Florokrom paraziti olmadığından ve taşmayı veya taşmayı önlemek için uygun kompanzasyonun gerçekleştiğinden emin olmak için numunenin solunda bulunan kompanzasyon matrisi iletişim kutusundaki kompanzasyon ayarlarını kontrol edin.
- Edinim tanımlı matrisin ayarlanması gerekiyorsa, popülasyonun neredeyse mükemmel bir yatay veya dikey çizgi göstermemesi için her florokrom kombinasyonunun telafi değerini basitçe artırarak veya azaltarak telafi matrisindeki değerleri değiştirin (Ek Şekil 1B).
- Uygun pozitif geçit için mTurquoise2 yoğunluğunu görsel olarak yaymak için mTurquoise2 X ekseni ekranını doğrusal olarak değiştirin (Ek Şekil 2).
- mTurquoise2 FMO kontrolünü, mTurquoise2 pozitif sinyal kapısı için negatif kontrol olarak kullanın. Hücre popülasyonu başına doğru eşik kapısını revize edin (Şekil 2).
NOT: (wt) mTurquoise2 FMO kontrol hücreleri mTurquoise2 işaretleyicisine sahip değildir ve bu nedenle Axin2 raportör aktivitesi için bir arka plan eşiği olarak kullanılabilir.
- mTurquoise2 FMO kontrolünü, mTurquoise2 pozitif sinyal kapısı için negatif kontrol olarak kullanın. Hücre popülasyonu başına doğru eşik kapısını revize edin (Şekil 2).
- Kaç hücrenin Wnt pozitif olduğunu tanımlamak için mTurquoise2-pozitif hücreleri uygun algılama kanalıyla kapatın.
- İlgilenilen hücrelerdeki floresan yoğunluğu miktarını tanımlamak için geometrik ortalamayı ve medyanı hesaplayın.
- İstatistiklere tıklayın | Panele mTurquoise2 pozitif hücreleri gösteren istatistik ekleyin.
- mTurquoise2'nin istatistik yöntemini, ilgilenilen popülasyonu ve algılama kanalını tanımlayın ve Ekle'ye tıklayın. Grafikleri çizmek için geometrik ortalamayı ve medyan floresan yoğunluğunu Keyfi Birimler (AU) cinsinden temsil edin.
NOT: Medyan, floresan yoğunluğunun orta değerini temsil eder ve bu nedenle floresan yoğunluğu popülasyon kayması hakkında bilgi sağlar. Gerekirse, bir arka plan düzeltmesi, mTurquoise2 raporlayıcı etkinliğinin dinamik aralığının daha net bir şekilde görselleştirilmesine yardımcı olabilir. Bu, wt arka plan boyama frekanslarının, geçitli spesifik hücre tipinin mTurkuaz2-pozitif hücrelerinin toplam frekansından çıkarılmasıyla yapılabilir.
5. Konfokal görüntüleme için timosit sitospinlerinin hazırlanması
NOT: Timosit sitospinleri, yapışmayan hücrelerin hücre süspansiyonları ile çalışırken önerilir. Timositlerde Axin2-mTurkuaz2 ekspresyonu timus epitel hücrelerine göre daha düşük olduğu için görüntüleme için filtrelenmiş timosit hücre süspansiyonları kullanıldı.
- Taze hasat edilmiş veya donmuş timositlerin hücre süspansiyonu ile başlayın. Timosit genotipi başına 100 μL soğuk PBS /% 0.5 BSA /% 10 FCS'de ~ 20.000 timosit süspansiyonu yapın.
NOT: Gerekirse, önceden donmuş timositlerle çalışırken maksimum hücre canlılığını korumak için hücreleri nazikçe çözün. Bu, hücreleri görüntülerken daha az otofloresan sağlamaya yardımcı olacaktır. Numunenin kalitesinden emin olmak için hücre canlılığını kontrol edin. Sitospin prosedürü, kırılgan timositlere uyarlanmış mekanik bir kuvvet kullanır; Bununla birlikte, oldukça uygun bir başlangıç popülasyonu gerektirir. Daha yüksek canlılık sağlamak için, donmuş timositler yerine taze hasat edilmiş ile başlanması tavsiye edilir. - Filtre kartlarının açıklığının etrafındaki alanı PBS ile önceden ıslatın. Sitospin numune haznesi tutucusunu kılavuza göre monte edin (Şekil 1C).
- Filtre kartını donma sürgüsüne yerleştirin (düz tarafı cam sürgüye karşı). Her iki öğeyi de numune haznesi tutucusuna yerleştirin. Filtre kartını tam olarak numune haznesi tutucu deliğine yerleştirmeye dikkat edin ve komple numune haznesi tutucusunu rotora yerleştirin.
- Timositleri dikkatlice yeniden süspanse edin ve numune odalarına 100 μL hücre süspansiyonu ekleyin. Timosit süspansiyonunu 4 dakika boyunca ~ 350 × g'da don kızaklarının üzerine döndürün. Hücrelere dokunmadan filtre kartını donma slaytından dikkatlice çıkarın. Sitorepsiyonları oda sıcaklığında 1 saat ile gece arasında değişen bir süre boyunca havayla kurutun.
NOT: Diğer hücre tipleriyle çalışırken, en iyi sonuçları elde etmek için farklı hücre yoğunluklarını test edin. Sitospinler, daha sonra deney yapmak için kapalı bir kutuda -20 ° C'de dondurulabilir. Oda sıcaklığında 1 saat boyunca daha fazla işlem için sitospinleri çözün.
6. Toplam β-katenin ile sitospin immün boyama
- Sitospinleri oda sıcaklığında 15 dakika boyunca% 100 metanol içinde sabitleyin. Slaytları oda sıcaklığında 10 dakika havayla kurutun. Hidrofobik bir kalemle cam slayt üzerindeki timosit popülasyonunun etrafına bir daire çizin.
NOT: Bu sabitleme adımı, β-katenin boyama için özel olarak optimize edilmiştir. - Slaytları oda sıcaklığında 10 dakika boyunca PBS/%0,05 Tween-20 içine yerleştirin ve ardından blokaj ve inkübasyon adımları sırasında koyu nemli bir kutuya aktarın. Slayt başına 100 μL PBS /% 10 normal fare serumu (NMS) ekleyin ve oda sıcaklığında 10 dakika nemli kutuda bırakın. % 10 NMS'yi çıkarmak için slayta dokunun, slayt başına 100 μL PBS /% 10 normal keçi serumu (NGS) ekleyin ve oda sıcaklığında 30 dakika nemli kutuda bırakın.
NOT: PBS/%10 NMS ile inkübasyon, spesifik olmayan primer antikor bağlanmasını bloke eder (Şekil 1D), PBS/%10 NGS ise spesifik olmayan sekonder antikor bağlanmasını bloke eder. - Hücresel boyama için ek antikorlar hazırlayın. Toplam β-katenin antikorunun 0.5 μg'ını AF568 etiketli parçalarla karıştırın.
NOT: Bu ayarda, birincil anti-fare toplam β-kateninin, timositlere eklenmeden önce Alexa Fluor 568 (AF568) florokrom etiketli ikincil keçi-anti-fare IgG1 Fab fragmanları ile ön etiketlenmesi için ticari olarak temin edilebilen bir etiketleme kiti kullanılmıştır. Birkaç konsantrasyonun test edilmesi gerekebileceğinden, etiketlemeyi üreticinin protokolüne göre gerçekleştirin. Toplam β-katenin-AF568 işaretli antikoru 30 dakika içinde kullanın. - Nemli bir kutuda gece boyunca 4 ° C'de sitospin lamı başına toplam β-katenin-AF568 etiketli antikorun 50 μL (0.5 μg) ekleyin. Üreticinin protokolüne göre bir negatif boyama kontrolü veya doğrudan etiketleme protokolü olması durumunda bir izotip kontrolü ekleyin.
- Oda sıcaklığında PBS/%0.05 Tween-20 ile 20 dakika yıkayın. Daha sonra, karıştırarak bir kavanozda oda sıcaklığında PBS ile 20 dakika yıkayın. Antikorun antijene bağlanmasını sağlamak için ikinci bir fiksasyon adımı gerçekleştirin: nemli bir kutuda PBS'de 100 μL% 4 paraformaldehit (PFA) ile oda sıcaklığında 10 dakika.
NOT: Slaytları karanlıkta tutun. Ne metanol ne de PFA fiksasyonu, mTurkuaz2 ekspresyonunu27 önemli ölçüde etkilemeyecektir. - Slaytları PBS'ye batırın. Nemli kutuda oda sıcaklığında 10 dakika boyunca 50 μL TO-PRO-3 (1:1500) ile nükleer boyama yapın. Slaytları PBS ile oda sıcaklığında bir kavanozda karıştırarak 20 dakika yıkayın.
NOT: TO-PRO3 konsantrasyonu, yakındaki floresan spektrumlarına sahip diğer florokromların kullanımına bağlı olarak titre edilebilir. - Numuneleri üreticinin protokolüne göre bir antifade reaktifi ile gömün ve bir lamel ile örtün. Oda sıcaklığında 24 saat havayla kurutun. Slaytları doğrudan floresan veya konfokal mikroskop altında görüntüleyin veya daha sonra görüntülemek için -20 °C'de saklayın.
7. Konfokal mikroskobik ölçüm
NOT: Konfokal mikroskop hakkında bilgi için Malzeme Tablosuna bakın.
- Konfokal mikroskobu manuel veya yerleşik protokole göre açın. Konfokal ayarların birincil ayarlaması için negatif ve pozitif kararlı bir şekilde transfekte edilmiş mTurquoise2 293T hücre hattı kontrollerini kullanın. Daha sonra, mTurquoise2 sinyalinin düşük pozlamasını önlemek için sırasıyla negatif ve pozitif kontroller olarak wt Axin2-mTurquoise2 ve Tg / Tg (nakavt) Axin2-mTurquoise2 timositlerini kullanın.
- Lazerleri ve filtre genişliklerini programlayarak yazılımı sıralı tarama için hazırlayın. Önce en yüksek dalga boylu lazer çizgisiyle başlayın ve en düşük dalga boyuna doğru çalışın. Tüm sıralı tarama adımları yüklendiğinde, numuneyi mikroskop aşamasına yükleyin, numuneyi odaklayın ve konfokal yazılım veya isteğe bağlı manuel paneldeki ilgili düğmeleri kullanarak lazer gücünü ve Smart Gain'i optimize etmek için Canlı'ya basın.
NOT: Potansiyel foto ağartma potansiyel olarak meydana gelebileceğinden, lamın numune bölümü sinyal ölçümü için görüntülenmemelidir. Bununla birlikte, mTurquoise2 yüksek fotostabiliteyesahiptir 25. - Çok düşük mTurquoise2 ekspresyonu durumunda, bir floresan sinyali gözlemlenene kadar lazer gücünü ve Smart Gain'i artırın ve gerçek bir pozitif sinyal olduğundan emin olmak için negatif kontrol numunesi ile kontrol edin. Timositleri 40x 1.4 yağ merceği, 63x 1.4 yağ merceği veya 100x 1.4 yağ merceği ile görselleştirin.
NOT: Bu çalışma için bir Leica SP5 mikroskobu kullanılmıştır. - Numuneyi ölçmeden önce mikroskopta bu konfokal görüntüleme ayarlarını kullanın.
- Yapılandırma | Ayarlar | Daha geniş bir yoğunluk ölçeği oluşturmak ve böylece düşük ve yüksek floresan sinyalleri arasında daha fazla ayrım yapmak için Bit derinliği seçeneğinde 12 bit olarak değiştirin.
- XY'ye tıklayarak görüntüleme çözünürlüğünü ayarlayın ve Formatı 1024 x 1024'e yükseltin, bu da tarama süresini iki katına çıkaracaktır. Hız | Ayarları manuel olarak değiştirmek için daha fazlası. Ek olarak, Çift Yönlü tarama seçeneğini etkinleştirin.
- Arka plan sinyalini azaltmak için hassasiyet kaydırıcısını ayarlayın. Hızlı LUT (Arama Tablosu) seçeneğiyle doğru lazer gücünü ve Akıllı Kazancı optimize edin.
NOT: 12 bitlik görüntüde, kaydırıcı 0 ile 4095 arasında gri bir ölçek yoğunluğu değerine sahiptir. Bu, daha sonra ücretsiz çevrimdışı Las X yazılımı ile de yapılabilir. Yeşil renk siyah arka planı, mavi renk ise örneğin doymuş piksellerini gösterir.
- Tüm görüntüleme ayarları optimize edildiğinde, üç kanalın da sıralı görüntülemesini başlatacak olan Başlat'a tıklayarak örneği ölçün.
- TO-PRO-3 nükleer floresan sinyalini ölçün. TO-PRO-3'ü 633 nm lazer ve HyD 640-750 nm ile tespit edin.
NOT: Bu kurulumda, %6 akıllı kazançta %15 lazer gücü kullanılmıştır. Bu ayar, TO-PRO-3 boyamanın yoğunluğuna bağlı olarak değişebilir. Çok parlaksa, aşırı uyarıldığında düşük yoğunluklu florokromları etkileyebilir. Böyle bir durumda, boyama konsantrasyonunu azaltın. - β-katenin, nükleer ve sitoplazmik floresan sinyallerini ölçün. 561 nm lazer ve HyD 580-605 nm ile β-katenini tespit edin. Düşük AF2 sinyali durumunda yazılımdaki XY kutusundaki ayarı satır ortalaması 2 olacak şekilde ayarlayarak bir görüntü için 568 adede kadar tarama biriktirin.
NOT: Bu kurulumda, %87 akıllı kazançta %85 lazer gücü kullanılmıştır. - mTurquoise2 sitoplazmik floresan sinyalini ölçün. 458 nm lazer ve HyD 490-600 nm ile mTurquoise2'yi tespit edin. Düşük mTurquoise2 sinyali durumunda hat ortalaması 4 olan yazılımdaki XY kutusundaki ayarı ayarlayarak bir görüntü için 4 adede kadar tarama biriktirin.
NOT: Bu protokol için kullanılan konfokal mikroskop üzerindeki eski lazerler ve düşük mTurquoise2 sinyali nedeniyle, %90 lazer gücünde 405 nm, %100 lazer gücünde 458 nm ve 476 nm lazerler ile %100 akıllı kazançta HyD 490-550 nm kullanıldı. 440 nm'lik bir lazer, konfokal mikroskopta daha az yaygın olarak bulunsa da en uygun olanıdır. Yüksek lazer gücü dikkatli kullanılmalı ve sadece sıralı görüntüleme ile yapılmalıdır. Dedektörün aşırı maruz kalmasını önlemek için acil durum ayarlarının yerinde olduğundan emin olun. Diğer konfokal mikroskoplardaki lazer gücü, daha güçlü veya daha yeni lazerler nedeniyle bu protokolde önerilenlerden daha düşük olabilir. Görüntülemeden önce floresan sinyalinin kaybolmadığından emin olmak için bir beyazlatma testi yapılabilir. Önerilen kurulumda, mTurquoise2'nin foto ağartılması kabul edilebilirdi. - Toplam hücre görselleştirmesi için parlak alan görüntülemesi gerçekleştirin. 488 nm lazer ve PMT Scan-DIC ile timositleri tespit edin. Görüntü analizi için Lif dosyalarını dışa aktarın.
NOT: Bu kurulumda, 212 V kazanç ve -%4,3 veri ofseti ile %59 lazer gücü kullanılmıştır. Lif dosyaları, görüntü düzeltme için çevrimdışı LAS x yazılımında okunabilir.
- TO-PRO-3 nükleer floresan sinyalini ölçün. TO-PRO-3'ü 633 nm lazer ve HyD 640-750 nm ile tespit edin.
8. Konfokal mikroskopi analizi
- Görüntüleri bir görüntü işleme yazılımı28 kullanarak analiz edin (Ek Şekil 3). Görüntüleri yazılıma yükleyin.
NOT: Birden çok biçim kabul edilir, ancak LUT'lu TIFF dosyaları veya Lif dosyalarının görüntü işleme yazılımına doğrudan içe aktarılması önerilir. - Timosit çekirdeklerindeki aktif β-katenin sinyalini ölçün.
- Aktif β-katenin analizi için kırmızı gri değer görüntüsündeki TO-PRO-3 ile boyanmış timositlerin çekirdeklerini seçin. Bunu manuel olarak yapın veya yazılımda otomatik hücre seçimini kullanın.
NOT: Otomatik hücre seçimi, uygun eşikleme ve partikül analizi için görüntü işlemeye ihtiyaç duyabilir. Manuel hücre seçimi zahmetli olabilir, ancak genellikle herhangi bir görüntü işleme gerektirmez ve bu protokolde önerilir. - Çalışma çubuğundaki seçim araçlarından herhangi biriyle manuel seçimi etkinleştirin.
- Çekirdeğin konturunu seçin ve İlgi Bölgesi (ROI) yöneticisine ekleyin. Analiz Et'e tıklayarak ROI yöneticisini etkinleştirin | Araçlar | ROI Yöneticisi ve yeni bir ROI yöneticisi penceresi açıldığında, ilk seçenek olan Ekle (t) seçeneğine tıklayın veya t klavye kısayolunu kullanın. Tüm çekirdekler tanımlanana ve ROI yöneticisine eklenene kadar önceki adımı tekrarlayın. Seçili hücreleri görselleştirmek için ROI yöneticisindeki Tümünü göster seçeneğini kullanın.
- Hücre bulunmayan >3 arka plan alanını seçin ve bunları ROI yöneticisine ekleyin.
NOT: Bu durumda boyut ve şekil önemli değildir. Bu bölgeler, nihai hesaplama için arka plan gürültüsü ölçümleri olarak işlev görecektir.- Analiz Et'e tıklayarak görüntü üzerinde ölçümü tanımlayın | Ölçümleri ayarlayın. Farklı ölçüm seçenekleri ile açılan yeni pencerede Alan, Entegre Yoğunluk ve Ortalama gri değeri etkinleştirin | Tamam'a tıklayın.
- Üzerine tıklayarak β-katenin gri değer görüntüsünü etkinleştirin ve ROI yöneticisinde Tümünü göster'e tıklayarak seçilen çekirdekleri ve arka plan alanlarını görselleştirin. Artık β-katenin görüntüsünde görünen tüm seçili alanları gözlemleyin.
- ROI Yöneticisi'nde Ölç'e tıklayın veya Analiz Et | Ölçün. ROI'ler içindeki β-katenin sinyalinin sonuçlarını gösteren yeni Sonuçlar penceresini gözlemleyin.
- Düzenle'ye tıklayarak sonuçları bir elektronik tablo hesaplama programına aktarın | Tümünü seç; ve daha fazla hesaplama için listeyi elektronik tabloya kopyalayıp yapıştırın. Daha fazla | Kurtarmak....
- Otomatik hücre seçimi için, birçok görüntü işleme ayarı geri alınamayacağından, işlenecek görüntünün Kopyalarını (Klavye Ctrl D) yapın.
NOT: Otomatik nükleer etiketleme, çoğu durumda çekirdeği otomatik ve doğru bir şekilde tanımlamak için görüntü işleme gerektirir. Görüntü işleme sadece alan seçimi amacıyla yapılmalıdır. İşlenmiş görüntüler, piksel değerleri değiştiği için floresan yoğunluk ölçümü için kullanışlı değildir.- İşlem | Filtreler | Görüntüyü yumuşatmak için Gauss Bulanıklığı. Birden fazla Sigma (Radius) değerini test edin ve Tamam'a tıklamadan önce efekti görselleştirmek için Önizleme seçeneğini etkinleştirin.
- Düzenle'ye tıklayarak görüntüyü ters çevirin | Ters çevir. Görüntüye tıklayarak Parlaklığı ve Kontrastı kontrol edin | Ayarla | Parlaklık/Kontrast. Otomatik seçeneğini kullanın veya tercihen değerleri manuel olarak değiştirin.
NOT: Görüntü özelliklerini değiştireceği için değişiklikleri uygulamayın . İstenilen görüntü elde edildiğinde B&C penceresini kapatmanız yeterlidir. - Resme tıklayarak bir Eşik oluşturun | Ayarla | Eşik'i seçin ve tüm hücrelerin çoğunlukla görünür olduğu en iyi Eşik ayarlarını tanımlayın. Eşik ayarlarını uygulamak için Uygula'ya tıklayın.
NOT: Delik gösteren hücrelere bir eşik uygulanmamışsa, İşlem | İkili | Hücrelerin içindeki boşlukları doldurmak için Delikleri Doldurun. Hücreler eşik ayarlarıyla birleştirilmişse, İşlem | İkili | Bu hücreleri ayırmak için havza. İnce bir 1 piksellik çizgi, programın kaynaşmış olarak yorumladığı herhangi bir hücreyi ayıracaktır. - Freehand seçim aracıyla tercih ettiğiniz bir çekirdeği manuel olarak seçerek görüntüdeki en küçük ve en büyük çekirdeği tanımlayın, bunu ROI yöneticisine ekleyin ve Alanı ölçün.
- Analiz Et'e tıklayarak parçacıkları (çekirdekleri) analiz edin | Parçacıkları Analiz Edin ve Boyut (^2) kutusuna en küçük Alanı ve en büyük Alanı aralarında kısa çizgi (-) olacak şekilde ekleyin. Tamam'a tıklamadan önce Sonuçları görüntüle, Yöneticiye ekle ve Kenarlarda hariç tut kutularını etkinleştirin. Protokolü tamamlamak için adım 8.2.3 ile devam edin.
- Aktif β-katenin analizi için kırmızı gri değer görüntüsündeki TO-PRO-3 ile boyanmış timositlerin çekirdeklerini seçin. Bunu manuel olarak yapın veya yazılımda otomatik hücre seçimini kullanın.
- Timositlerdeki sitoplazmik mTurkuaz2 ve β-katenin sinyallerini ölçün.
- Yukarıdakiyle aynı adımları izleyerek parlak alan görüntüsündeki tüm timositlerin konturunu seçin.
- Hücre bulunmayan >3 arka plan alanını seçin ve bunları ROI yöneticisine ekleyin.
NOT: Bu durumda boyut ve şekil önemli değildir. Bu bölgeler, nihai hesaplama için arka plan gürültüsü ölçümleri olarak işlev görecektir.- Üzerine tıklayarak mTurquoise2 gri değer görüntüsünü etkinleştirin ve ROI yöneticisinde Tümünü göster'e tıklayarak seçilen toplam hücre ROI'lerini ve arka plan alanlarını görselleştirin. mTurquoise2 görüntüsünde görünen tüm seçili alanları gözlemleyin.
- ROI Yöneticisi'nde Ölç'e tıklayın veya Analiz Et | Ölçün. mTurquoise2 sinyalinin ölçüm sonuçlarıyla birlikte açılan yeni Sonuçlar penceresini gözlemleyin.
- Düzenle'ye tıklayarak sonuçları bir elektronik tablo hesaplama programına aktarın | Tümünü seçin ve daha fazla hesaplama için listeyi elektronik tabloya kopyalayıp yapıştırın.
- Üzerine tıklayarak β-katenin gri değer görüntüsünü etkinleştirin ve ROI yöneticisinde Tümünü göster'e tıklayarak seçilen toplam hücre ROI'lerini ve arka plan alanlarını görselleştirin. β-katenin görüntüsünde görünen tüm seçili alanları gözlemleyin.
- ROI Yöneticisi'nde Ölç'e tıklayın veya Analiz Et | Ölçün. Toplam hücresel β-katenin sinyalinin ölçüm sonuçlarıyla açılan yeni Sonuçlar penceresine dikkat edin.
- Düzenle'ye tıklayarak sonuçları bir elektronik tablo hesaplama programına aktarın | Tümünü seçin ve daha fazla hesaplama için listeyi elektronik tabloya kopyalayıp yapıştırın. Daha fazla | Kurtarmak....
- Denklem 1'i kullanarak aktif β-katenin için Düzeltilmiş Toplam Nükleer Floresanı (CTNF) hesaplayın.
CTNF = Entegre yoğunluk - (Alan × Ortalama arka plan alanlarının ortalaması) (1) - Denklem 2'yi kullanarak mTurquoise2 için Düzeltilmiş toplam Hücre Floresansını (CTCF) hesaplayın.
CTCF = Entegre yoğunluk - (Alan × Ortalama arka plan alanlarının ortalaması) (2) - Adım 8.2.3.3'te elde edilen nükleer β-katenin değerlerini çıkararak aktif nükleer β-katenin ve sitoplazmik β-katenin arasında ayrım yapın. sitoplazmik inaktif β-katenini elde etmek için adım 8.3.2.5'te elde edilen toplam hücre β-katenin değerlerinden.
NOT: Ölçümlerin aynı hücre içinde yapıldığından emin olun.- Arka plan alanlarının Ortalama yoğunluğunun ortalamasını hesaplayın. Denklem 1 ve 2'yi kullanarak CTNF ve CTCF'yi hesaplayın. IntDen'i (seçili alandaki tüm piksellerin toplamı) RawIntDen olarak değil, Tümleşik yoğunluk olarak düşünün.
- Gerekirse, grafikleri çizmek için IntDen değerlerinin Standart sapmasını hesaplayın. Mann-Whitney U-testini kullanarak istatistiksel analiz için 200'e kadar ayrı hücre düşünün.
- Sonuçları ayrı bir veri noktası grafiğinde çizin ve y eksenini CTNF veya CTCF değerleriyle Bağıl Floresan Birimler (RFU) olarak etiketleyin.
Sonuçlar
Kanonik Wnt sinyalizasyonunun rolünü araştırmak için, bir Axin2-mTurquoise2 kanonik Wnt raportör modeli, β-katenin protein ekspresyonu ile kombinasyon halinde test edilmiştir. Timositlerin kırılgan olduğu, timosit olgunlaşma sürecinin çeşitli aşamalarında düşük kanonik Wnt sinyali gösterdiği ve düşük sitoplazmik/nükleer orana sahip olduğu bilinmektedir; tüm bu faktörler sitoplazmik mTurkuaz2 veya β-kateninin saptanmasını engeller. Protokolü takip ederek, murin Axin2-mTurkuaz2 timositleri timustan hasat edildi ve hem Axin2-mTurkuaz2 hem de toplam β-kateninin akış sitometrik ve sitospin konfokal analizi (Şekil 1) için tek hücreli süspansiyonlara işlendi.
Akış sitometrik analizi, aktif kanonik Wnt sinyali için raportör protein olarak hücre alt kümesi başına mTurquoise2 florokromun varlığını ölçmek için farklı timosit olgunlaşma aşamalarının karakterizasyonunu kolaylaştırır. Axin2-mTurquoise2 genotiplerinde-wildtype (wt), heterozigot (Tg/0) ve homozigot (Tg/Tg)-mTurquoise2 sinyali, çift pozitif (DP) timositler içindeki kanonik Wnt sinyalinin aktivasyon seviyesini temsil eden artan seviyelerde mevcuttu (Şekil 2). Eklenmiş bir mTurquoise2 proteini olmadığından, wt mTurquoise2 seviyeleri arka plan gürültüsünü gösterir; bununla birlikte, kanonik Wnt sinyali bu hücrelerde hala meydana gelebilir, ancak bir raportör aracılığıyla basitçe görselleştirilmez. Bununla birlikte, Axin2 genlerinden birinin (Tg/0) veya ikisinin (Tg/Tg) olmaması, kanonik Wnt sinyalleme aktivitesini etkileyebilir, çünkü Axin2, aktif kanonik Wnt sinyalini negatif olarak düzenlemek için yıkım kompleksinde önemli bir rol oynar.
Axin2-mTurkuaz2 raportör modelinin ekspresyon seviyelerini araştırmak için ortalama veya medyan floresan yoğunluğu incelenebilir. Medyan floresan yoğunluğu ve geometrik ortalama (Şekil 2C), floresan histogramları için en çok tercih edilen birinci ve ikinci grafiksel gösterimlerdir. Tg/0'a kıyasla Tg/Tg'deki Axin2 ekspresyonundaki artış, fonksiyonel Axin2'nin olmaması ve dolayısıyla işlevsiz yıkım kompleksi nedeniyle kanonik Wnt sinyalinin artan aktivasyonuna işaret eder. Kanonik Wnt sinyal yolunun aktivasyon seviyelerini daha fazla doğrulamak için, Axin2-mTurkuaz2 timositleri içinde toplam β-katenin ile bir sitospin immün boyama gerçekleştirildi. β-kateninin hücresel konumu, kanonik Wnt sinyalinin aktive olup olmadığını gösterdiğinden, nükleer veya sitoplazmik β-kateninin varlığını ölçtük.
mTurkuaz2 sitozolde eksprese edilir ve esas olarak çekirdeklerin çevresinde görülebilir (Şekil 3A'da TO-PRO-3 kırmızısı ile gösterilmiştir). Timositler çok az sitoplazmaya sahip olduğundan, tüm sinyali ölçmek için alan seçimi dikkatli bir şekilde yapılmalıdır (Ek Şekil 3). Beyaz oklarla gösterildiği gibi yanlış pozitif boyama veya otofloresan sinyaline özel dikkat gösterilmelidir. Bu floresan sinyalleri normalde hücre kalıntıları tarafından üretilir ve her ikisi de mTurquoise2 ve AF568 görüntülerinde görülebilirdi (Şekil 3B,C ve Şekil 3D,E). Boyanmamış wt kontrol görüntüleri, Axin2-mTurquoise2 raportör yapısını içermemelerine rağmen, mTurquoise2'nin bu timositlerde de görülebildiğini göstermektedir. Bu arka plan gürültüsü muhtemelen otofloresan ve timositlerdeki kompakt sitoplazmadankaynaklanmaktadır 29. Bununla birlikte, dikkatli alan seçimi ve CTCF formülü kullanılarak doğru arka plan düzeltmesi ile Şekil 3B, DP timositlerinde akış sitometrik analizinde görüldüğü gibi pan-timositlerde artan bir Axin2-mTurkuaz2 ekspresyonunu göstermektedir.
Axin2-mTurkuaz2 raportör yapısı nedeniyle hasar görmüş Axin2 geninin yıkım kompleksi üzerindeki etkisini ve dolayısıyla β-kateninin varlığını daha iyi anlamak için, timositlerde nükleer veya sitoplazmik β-katenin AF568'in ekspresyonunu ölçtük. Aktif kanonik Wnt sinyali, TCF/LEF transkripsiyon faktörleri ile etkileşime gireceği ve ardından yol aktivasyonunu azaltmak için hedef gen olarak Axin2'yi aktive edeceği çekirdeğe β-katenin göçü ile yönlendirilir. Axin2, sitoplazmik β-katenini proteazomal bozunmaya hedeflemede önemli bir rol oynayan yıkım kompleksinin bir parçasını oluşturduğundan, Axin2 proteininin yokluğu veya bozulması, nükleer ve/veya sitoplazmik β-katenin birikimine neden olabilir.
Heterozigot (Tg/0) Axin2-mTurkuaz pan-timositlerin, vahşi tipe (wt) kıyasla daha az nükleer ve sitoplazmik β-katenin ekspresyonuna sahip olduğunu gösteriyoruz, bu da β-kateninin kendisinin regülasyonunun değiştiğini gösteriyor. Bununla birlikte, homozigot (Tg/Tg) Axin2-mTurkuaz pan-timositlerde, sitoplazmik β-katenin her iki genotip arasında benzer olmasına rağmen, nükleer β-katenin wt'den daha yüksektir (Şekil 3C). Bu, toplam β-katenin seviyelerinin ölçülmesinin, proteazomal bozunmaya yönelik olmayan β-katenini spesifik olarak tespit eden fosforillenmemiş β-katenini doğrudan ölçmenin aksine, kanonik Wnt yolu hakkında ek bilgi verebileceğini düşündürmektedir. Bununla birlikte, β-kateninin Axin2 gibi kanonik Wnt güdümlü gen ekspresyonuna doğru düzenlenmesinin, bu protokolde test edilmemiş diğer birkaç protein tarafından düzenlendiği akılda tutulmalıdır.

Şekil 1: Protokolün şematik ve basitleştirilmiş genel bakışı. (A) Hücre süspansiyonuna timus işleme, (B) akış sitometrisi protokolü, (C) sitospin düzeneği, (D) hücre içi boyama protokolü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
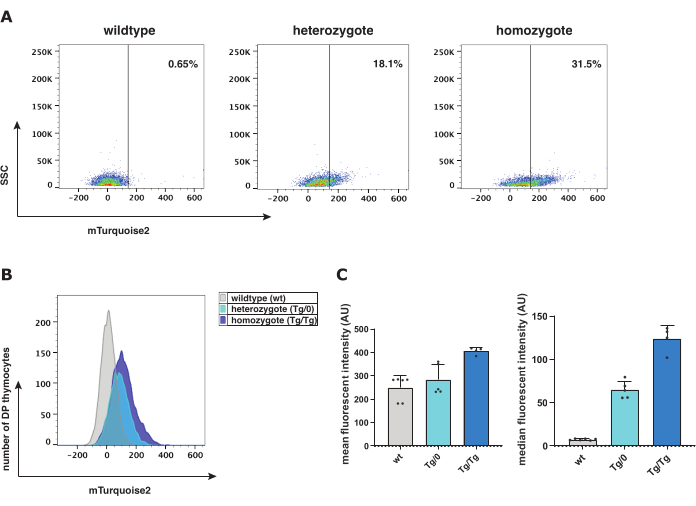
Şekil 2: Yabani tip (wt), heterozigot (Tg/0) ve homozigot (Tg/Tg) Axin2-mTurquoise2 farelerinin akış sitometrisi analizi. (A) Axin2-mTurkuaz2 genotipine göre mTurquoise2 DP timosit geçiti ve popülasyon yer değiştirmesi ile nokta grafiğinin temsili. (B) DP timositlerinin fare genotipleri arasındaki floresan yoğunluk aralıklarını gösteren bir mTurkuaz2 histogramının temsili. (C) DP timositlerindeki Axin2-mTurkuaz2 genotiplerinin standart sapma hata çubukları ile ortalama ve medyan floresan yoğunluğunun çubuk grafik gösterimi (toplam 5 wt; 5 Tg / 0 ve 4 Tg / Tg fare). Kısaltmalar: DP = çift pozitif. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
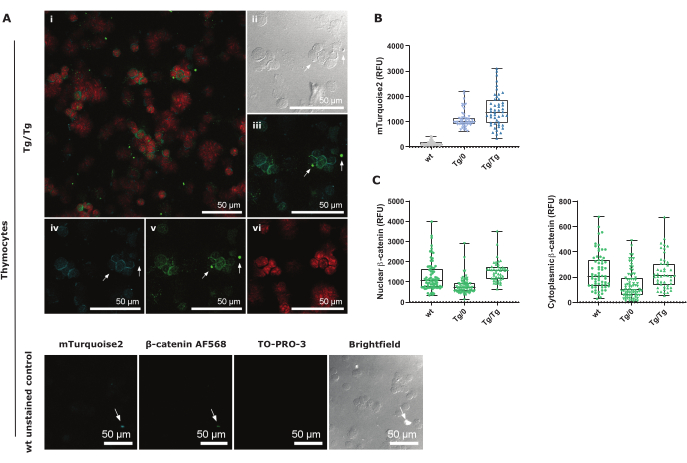
Şekil 3: Total timosit sitospin prosedürünün konfokal görüntü gösterimi ve 1.5 yakınlaştırma faktörü ile 40x'te görüntülenen kontroller. (A) Tg/Tg (homozigot) Axin2-mTurkuaz2 timositleri, nükleer TO-PRO-3 ve toplam β-katenin AF568 ile boyanmış ve ayrıca endojen sitoplazmik mTurkuaz2 ekspresyonu. I, her üç rengin de yer paylaşımlı bir konfokal görüntüsüdür; II bir parlak alan görüntüsüdür; iii Axin2-mTurkuaz2 ve toplam β-katenin AF568 kaplamasıdır; iv bir mTurquoise2 yakın çekimdir; v, toplam β-katenin AF568 yakın çekimidir; vi, nükleer bir TO-PRO-3 yakın çekimidir. Alt panel, görüntülenen her kanal için wt boyanmamış kontrol görüntüleri içerir. Beyaz oklar, tüm görüntülerde aynı konumu temsil eder ve döküntü nedeniyle yanlış pozitif sinyali gösterir. Ölçek çubukları = 50 μm. (B) Tüm Axin2-mTurkuaz2 genotipleri için CTCF mTurkuaz2 yoğunluk değerlerinin kutu grafiği gösterimi (genotip başına 50-70 hücre). (C) Tüm Axin2-mTurkuaz2 genotipleri için (genotip başına 50-70 hücre) sırasıyla nükleer aktif β-katenin ve inaktif sitozolik β-katenin için toplam β-katenin AF568 CTNF ve CTCF-CTNF yoğunluk değerlerinin kutu grafiği temsili. Kısaltmalar: CTCF = Düzeltilmiş Toplam Hücre Floresansı; CTNF = Düzeltilmiş Toplam Nükleer Floresan; RFU = Bağıl Floresan Birimleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| DN boyama paneli | Florokrom | Antikor |
| FITC (Finans Finans Kurumu) | CD127 Serisi | |
| PE | CD25 Serisi | |
| PE-CY7 Serisi | Streptavidin (SAV) | |
| APC | CD117 Serisi | |
| APC-CY7 Serisi | CD44 Serisi | |
| CP Başına | CD135 Serisi | |
| V450 Serisi | x | |
| V500 Serisi | x | |
| Lin- | ||
| Biotin | Ter119 Serisi | |
| GR1 Serisi | ||
| CD11b | ||
| B220 Serisi | ||
| NK1.1 | ||
| CD3 (İngilizce) | ||
| CD4 (İngilizce) | ||
| CD8 Serisi | ||
| ISP/DP/SP boyama paneli | ||
| FITC (Finans Finans Kurumu) | TCRb | |
| PE | TCRgd | |
| PE-CY7 Serisi | CD4 (İngilizce) | |
| APC | CD3 (İngilizce) | |
| APC-CY7 Serisi | Streptavidin (SAV) | |
| CP Başına | CD8 Serisi | |
| V450 Serisi | x | |
| V500 Serisi | x | |
| Lin- | ||
| Biotin | Ter119 Serisi | |
| GR1 Serisi | ||
| CD11b | ||
| B220 Serisi | ||
| NK1.1 | ||
| 1. Timositleri Biotin soy negatif (Lin-) panel ile boyayın. | ||
| 2. Timositleri timosit hücre işaretleyici paneli ile boyayın. | ||
Tablo 1: Akış sitometrisi için hücre yüzeyi karakterizasyonu antikor panelleri. İki aşamalı DN timosit boyama, iki aşamalı ISP, DP ve SP timosit boyama. Kısaltmalar: DN = çift negatif; DP = çift pozitif; SP = tek pozitif; ISP = olgunlaşmamış tek pozitif; PE = fikoeritrin; APC = allofikosiyanin; FITC = floresein izotiyosiyanat.
Ek Şekil 1: mTurquoise2 ve FITC florokrom uyumluluğu (A) Minimum spektral örtüşmeyi temsil eden mTurquoise2 (mavi) ve FITC'nin (yeşil) floresan uyarma ve emisyon spektrumları. İnce çizgiler, mTurquoise2 (405 nm) ve FITC'yi (488 nm) uyarmak için lazer çizgilerini temsil eder. Doldurulmamış eğriler, belirtilen florokromların emisyon spektrumlarını temsil ederken, doldurulmuş eğriler uyarma spektrumlarını temsil eder. Mavi, mTurkuaz2'ye karşılık gelir ve yeşil, FITC'ye karşılık gelir. Akış sitometrisi sırasında mTurquoise2 ve FITC için sırasıyla 470/20 ve 530/30 bant geçiren filtreler (emisyon spektrumlarını kaplayan gri alan) kullanıldı. (B) Axin2-mTurkuaz2 DP timositlerinin akış sitometrik analiz programı içinde, mTurkuaz2 (y ekseni) ve DP timosit karakterizasyonu için kullanılan diğer florokromlar (x ekseni) arasındaki florokrom spektral sızıntısını gösteren yazılım florokrom emisyon kompanzasyon matrisi. mTurkuaz2 ve FITC (yeşil kutu) arasında spektral kanama tespit edilmezken, mTurquoise2 ve AmCyan camgöbeği benzeri florokrom (kırmızı kutu) arasında spektral kanama problemleri tespit edildi. V450 akış sitometresi kanalı, y ekseninde comp-mTurquoise2 olarak temsil edilen mTurquoise2 florokromunu ölçmek için kullanıldı. Kısaltmalar: FITC = floresein izotiyosiyanat; DP = çift pozitif; V450 = Menekşe 450. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: mTurquoise2 pozitif hücreler geçit stratejisi için akış sitometrisi yazılım analizi iş akışı şeması. Daha iyi mTurquoise2 geçit stratejisi için dönüştürme ayarlarının ayarlanmasının adım adım açıklaması. Axin2-mTurkuaz2 Tg/Tg (homozigot) çift pozitif timosit popülasyonunun bir temsili. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: Floresan yoğunluk ölçümü için görüntü analiz yazılımı iş akışı şeması. mTurkuaz2'nin CTCF hesaplaması veya aktif β-katenin-AF568'in CTNF hesaplaması için floresan yoğunluk verilerinin seçilmesi ve ölçülmesinin kademeli açıklaması. (A) Parlak alan görüntüsü; (B) bir mTurquoise2 görüntüsü; (C) nükleer TO-PRO-3 boyama; (D) toplam β-katenin AF568 görüntü. Kare kutular, CTCF ve CTNF hesaplamalarında kullanılacak arka plan sinyal alanlarıdır. Ölçek çubukları = 50 μm. Kısaltmalar: CTCF = Düzeltilmiş Toplam Hücre Floresansı; CTNF = Düzeltilmiş Toplam Nükleer Floresan. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Farklı raportör duyarlılığına ve gerçek raportör proteinlerine sahip birkaç kanonik Wnt raportörü mevcuttur. Sentetik olarak tanıtılan multimerize TCF/LEF bağlanma bölgelerini kullanan raportör modelleri, floresan raportör proteinleri ile mevcuttur; bununla birlikte, transgenlerin bu tür tekrarları, üreme veya uzun in vivo deneyler sırasında kaybolabilir ve raportör ekspresyonunu etkileyen çevredeki genomik dizilerden gelen Wnt olmayan sinyallere duyarlı olabilir. Bu nedenle, en çok kullanılan raportör, canlı hücrelerde kullanmanın zorluğuna rağmen, eski varyant Axin2-LacZ olmaya devam etmektedir.
Axin2-mTurquoise2 kanonik Wnt raportör modeli, parlak ve nispeten kararlı bir floresan raportör proteininin basitliğine rağmen, Axin2-LacZ ile aynı raportör güvenilirliğini sunar. Bu camgöbeği varyantı floresan proteini, uzun süreli görüntüleme için yararlıdır ve en sık kullanılan antikor florokromları25 ile kolayca birleştirilebilir. Bununla birlikte, bu model29 kullanılırken 3D penetrasyon ve otofloresan ile ilgili olası sınırlamalar dikkate alınmalıdır. β-katenin nükleer stabilizasyonu kanonik bir Wnt raportör sürücüsü olduğundan, çoğu moleküler deney, aktif Wnt sinyalini doğrulamak için artan toplam veya aktif β-kateninin tespit edilmesini gerektirir. Bununla birlikte, β-katenin ekspresyonu herkesin bildiği gibi düşüktür ve tespit edilmesi zordur, bu da Axin2'nin aslında daha iyi bir belirteç olabileceği anlamına gelir. Bu protokolde, düşük floresan sinyalizasyonuna rağmen Axin2-mTurquoise2 raportör modelinin, nükleer total β-katenin-AF568'in tek hücreli timosit sitolojik boyaması ile nasıl birleştirileceğini açıklıyoruz.
Bu modelle ilgili kritik adımlar, esas olarak düşük Axin2-mTurkuaz2 ve β-katenin-AF568 ekspresyonunun uygun şekilde tespit edilmesiyle ilgilidir. Bu nedenle, bu protokol, düşük hücre canlılığına sahip olduğu bilinen ve otofloresansın artmasına neden olan timositlerde mümkün olan maksimum sinyal tespitini tanımlar. Bu, timusta fizyolojik ortam altında timosit seçimi sırasında doğal apoptoza uğrayan timositler için geçerlidir. Bu nedenle, bu hücrelerde hem Axin2-mTurkuaz2 hem de β-katenin-AF568'in düşük ekspresyonunun tespitinin gösterilmesinin, Axin2-mTurkuaz2 modelinin uygulanabilirliğini artıracağına inanıyoruz.
Güvenilir sonuçlar elde etmek için, ekipmanın uygun şekilde ince ayarına özel dikkat gösterilmelidir. Gerçek sinyal ile arka plan sinyali arasındaki ayrımı sağlamak için, akış sitometrisini ve konfokal görüntüleme ekipmanını doğru şekilde kalibre etmek için birkaç pozitif ve negatif kontrolün dahil edilmesi gerekir. Transfeksiyon kolaylığı, geniş bir yoğunluk spektrumu üzerinde kararlı durum kanonik Wnt ekspresyonu ve lityum klorür (LiCl), 6-bromoindirubin-3'-oksim veyaCHIR99021 31,32,33 gibi Wnt yolu aktive edici bileşiklere duyarlılıkları nedeniyle pozitif kontrol olarak 293T hücreleri gibi kararlı mTurkuaz2 eksprese eden hücre hatlarının kullanılmasını öneriyoruz . Uyarma, emisyon spektrumları ve floresan yoğunluğu, akış sitometrisindeki diğer florokromların spektral yayılmasına karşı telafi değerlerini veya konfokal mikroskopide algılama filtresi aralıklarının tanımını belirlediğinden, tam olarak aynı mTurquoise2 raportör proteini ile kontrollerin kullanılması son derece önemlidir.
Ek olarak, Axin2-mTurquoise2 raportör yapısının 2 katını içeren ilgili hücrelerin ikinci bir Axin2-mTurkuaz2 homozigot pozitif kontrolünün, özellikle düşük eksprese eden hücreler söz konusu olduğunda, fizyolojik olarak ifade edilen mTurkuaz2 floresan yoğunluk aralıklarına ayarlanması önerilir. Kanonik Wnt sinyallemesinin dozaja bağlı olduğu ve bunun da dalgalı raportör ifadesine yol açtığı göz önüne alındığında, lazer gücünün aşırı maruz kalmasını dışlamak, makul bir sinyal/gürültü oranı tanımlamak ve gerçek pozitif mTurquoise2 ekspresyon eşiğini tanımlamak için negatif bir kontrol gereklidir.
Akış sitometrisinde olduğu gibi, çoklu karakterizasyon belirteçlerinin eklenmesi geleneksel uygulamadır; Eşleşen florokromlar, minimum spektral yayılma ile seçilmelidir. FITC veya Alexa Fluor 488'in (AF488) mTurqoise2 raportör proteini ile kombinasyonu, bu protokolde sunulan akış sitometresi ayarında minimum spektral girişim sağlamalıdır. Her iki florokromun floresan spektrumları karşılaştırıldığında, mTurquoise2, özellikle düşük eksprese eden mTurquoise2 raportör hücrelerinde ihmal edilebilen 488 lazer (%1 verimlilik) tarafından minimum düzeyde uyarılır. Bu nedenle, timositlerde herhangi bir önemli yanlış pozitif FITC sinyali beklenmeyen bir durumdur. Konfokal mikroskopi durumunda ve özellikle önerilen konfokal ayarlarda, FITC veya AF488 florokromların kullanılması tavsiye edilmez, çünkü bir görüntü işleme yazılımında önemli sinyal karışımının çözülmesi dışında kompanzasyon olasılığı yoktur. Bunun yerine, herhangi bir spektral örtüşme sorunu olmadan düşük mTurkuaz2 ekspresyonunu tam olarak tespit etmek için AF568 gibi diğer florokromlar seçilmelidir.
Yüksek mTurkuaz2 eksprese eden hücrelerle çalışırken veya konfokal mikroskopta 440 nm'lik bir lazerin mevcudiyetine ve emisyon filtre aralığının daraltılmasına sahip olduğunda, FITC veya AF488'in kullanılması mümkün olabilir, ancak Axin2 ekspresyonunun çoğu yetişkin dokusunda düşük olduğu bilinmektedir. Protokolümüzde, β-katenin gibi düşük konjuge stabiliteye sahip proteinlerin etkili bir şekilde immün boyanmasını sağlayan, önceden etiketlenmiş iki aşamalı yüksek performanslı bir AF568 etiketleme prosedürü ile toplam β-katenin ekspresyonunu ölçtük. İmmün boyama protokolündeki adımlar, yüksek arka plan sinyali olmadan sitoplazmada veya çekirdekte gerçek pozitif β-katenini ölçmek için optimize edilmiştir. Benzer bir boyama protokolü birincil kültürlerde ve kriyokesitlerde kullanılabilir, ancak farklı hücre tipleriyle çalışırken fiksasyon adımları test edilmelidir. Axin2-mTurquoise2 modeli yalnızca bir raportör işlevine sahiptir ve bu nedenle, diğer Axin2 knock-in modelleri22 gibi hücre izleme deneyleri için yararlı olmayacaktır. Aslında, bu zarif Cre-rejoint Wnt modelleri, çevresel bağlamlarını kaybeden hücre süspansiyonları için değil, çoğunlukla doku görüntüleme deneyleri için kullanışlıdır. Axin2-mTurquoise2 modeli, genetik eklenmesi nedeniyle Axin2 gen işlevselliğini bozsa da, bu özellik Wnt terapötik hedefleri için Axin2 nakavt modellerini incelemek için kullanışlıdır.
Bir homozigot fare, yıkım kompleksinde34 β-kateninin fosforilasyonu için protein etkileşimini engelleyen Axin2 işlevselliğinden yoksundur; bununla birlikte, mTurquoise2 raportör ifadesi, kanonik Wnt sinyalinin alternatif bir yol aracılığıyla aktif kalıp kalmadığını göstermeye yardımcı olur. Dikkat çekici bir şekilde, Axin2 ayrıca Wnt ligandının bağlanması üzerine Wnt kıvırcık/LRP reseptör kompleksinde önemli bir rol oynar ve sinyal kaskad35'te başka bir ilginç Wnt düzenleme noktası sunar. Axin2-mTurquoise2 murin modelinden ayrı olarak, benzer bir raportör yapısı geçici transgenez için kullanışlıdır ve CRISPR-Cas9 teknolojisi21 aracılığıyla endojen Axin2 lokusuna özel olarak hedeflenebilir. Özetle, bu rapor, düşük Aksin2 eksprese eden timositler için Axin2-mTurkuaz2 raportör modelini analiz etmenin kolay ve sağlam bir yolunu açıklamaktadır. Bu protokol, ilaç taramaları ve fonksiyonel Wnt terapötik hedef tanımı için diğer kanonik Wnt eksprese eden hücre tiplerine uygulanabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma kısmen, yeni fare modelleri geliştirmek için Alan Rejeneratif Tıbbın profilini çıkarmak için Leiden Üniversitesi'nden bir hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BD FACScantoII flow cytometer | BD Biosciences | not aplicable | Serial number V96300710. The flow cytometer setup in this protocol contains a 405 nm laser line with 505 longpass filter and 530/30 nm bandpass filter, and 470/20 nm bandpass filter; a 488 nm laser with 735 nm longpass filter and 780/60 nm bandpass filter, 670 nm longpass filter and 655 nm longpass filter, 610 nm longpass filter, 550 nm longpass filter and 575/26 nm bandpass filter, 505 nm longpass filter and 530/30 nm bandpass filter, and 488/10 nm bandpass filter; and a 633 nm laser line with 735 nm longpass filter and 780/60 nm bandpass filter, 685 nm longpass filter, and 660/20 nm bandpass filter. |
| BSA | Sigma | A9647 | |
| Corning 70 μm cell strainer | Falcon/Corning | 352350 | |
| Cytospin 4 Type A78300101 | Thermo Scientific | not aplicable | |
| DMSO | Sigma Aldrich | D5879-1L | |
| DNAse I | Sigma | A9647 | |
| Falcon 50 mL Conical Centrifuge tubes | Greiner bio-one | 227261 | |
| Falcon round-bottom Polystyrene Test tubes with cell strainer snap cap | Fisher Scientific | 352235 | |
| Fetal Calf Serum (FCS) | Greiner Bio-One B.V. | not aplicable | Depends on origin |
| Fiji software | ImageJ | not aplicable | Version 1.53 |
| Filter card white (for cytospin) | VWR | SHAN5991022 | |
| FlowJo 10 software | Treestar | not aplicable | Version 10.5.3 |
| Frost slides | Klinipath | ||
| Gibco IMDM medium | Fisher Scientific | 12440053 | |
| HCX PL APLO 40x 1.4 OIL lens | Leica microsystems | not aplicable | |
| Hydrophobic pen: Omm Edge pen | Vector | not aplicable | |
| Leica TCS SP5 DMI6000 | Leica microsystems | not aplicable | The microscope setup in this protocol consisted of an HCX PL APO 40x/1.2 oil-immersion objective with 8-bit resolution, 1024 pixels x 1024 pixels, 400 Hz speed, pinhole 68 µm, and zoom factor of 1.5 at room temperature. This system contains a 405 diode laser, argon laser, DPSS 561 laser, HeNe 594 laser and HeNe 633 laser with 4 hybrid detectors (HyDs) and 5 photomultiplier tubes (PMTs). |
| Methanol | VWR | 1060091000 | |
| NaN3/sodium azide | Hospital farmacy | not aplicable | |
| Normal mouse serum | Own mice | not aplicable | |
| PBS | Lonza | BE17-517Q | |
| ProLong Diamond Antifade Mountant | Fisher Scientific | P36965 | |
| Purified mouse anti-β-catenin (CTNNB1) | BD Biosciences | 610154 | |
| TO-PRO-3 Iodide | Thermofisher | T3605 | |
| Transparent nailpolish | at any drugstore | not aplicable | |
| Tween-20 | Sigma Aldrich | P1379-500ml | |
| Zenon Alexa Fluor 568 Mouse IgG1 labeling kit | Thermofisher | Z25006 |
Referanslar
- Kahn, M. Can we safely target the WNT pathway. Nature Reviews. Drug Discovery. 13 (7), 513-532 (2014).
- Jung, Y. S., Park, J. I. Wnt signaling in cancer: therapeutic targeting of Wnt signaling beyond beta-catenin and the destruction complex. Experimental & Molecular Medicine. 52 (2), 183-191 (2020).
- Gao, K., Zhang, T., Wang, F., Lv, C. Therapeutic Potential of Wnt-3a in neurological recovery after spinal cord injury. European Neurology. 81 (3-4), 197-204 (2019).
- Jia, L., Pina-Crespo, J., Li, Y. Restoring Wnt/beta-catenin signaling is a promising therapeutic strategy for Alzheimer's disease. Molecular Brain. 12 (1), 104(2019).
- Bae, S. M., Hong, J. Y. The Wnt signaling pathway and related therapeutic drugs in autism spectrum disorder. Clinical Psychopharmacology and Neuroscience. 16 (2), 129-135 (2018).
- Tajer, P., Pike-Overzet, K., Arias, S., Havenga, M., Staal, F. J. T. Ex vivo expansion of hematopoietic stem cells for therapeutic purposes: Lessons from development and the niche. Cells. 8 (2), 169(2019).
- Yanai, K., et al. Crosstalk of hedgehog and Wnt pathways in gastric cancer. Cancer Letters. 263 (1), 145-156 (2008).
- Blank, U., et al. An in vivo reporter of BMP signaling in organogenesis reveals targets in the developing kidney. BMC Developmental Biology. 8, 86(2008).
- Duncan, A. W., et al. Integration of Notch and Wnt signaling in hematopoietic stem cell maintenance. Nature Immunology. 6 (3), 314-322 (2005).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- Lustig, B., et al. Negative feedback loop of Wnt signaling through upregulation of conductin/Axin2 in colorectal and liver tumors. Molecular and Cellular Biology. 22 (4), 1184-1193 (2002).
- Bernkopf, D. B., Hadjihannas, M. V., Behrens, J. Negative-feedback regulation of the Wnt pathway by conductin/axin2 involves insensitivity to upstream signalling. Journal of Cell Science. 128 (1), 33-39 (2015).
- Vassar, R., Rosenberg, M., Ross, S., Tyner, A., Fuchs, E. Tissue-specific and differentiation-specific expression of a human K14 keratin gene in transgenic mice. Proceedings of the National Academy of Sciences of the United States of America. 86 (5), 1563-1567 (1989).
- DasGupta, R., Fuchs, E. Multiple roles for activated LEF/TCF transcription complexes during hair follicle development and differentiation. Development. 126 (20), 4557-4568 (1999).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
- Mohamed, O. A., Clarke, H. J., Dufort, D. beta-catenin signaling marks the prospective site of primitive streak formation in the mouse embryo. Developmental Dynamics. 231 (2), 416-424 (2004).
- Moriyama, A., et al. GFP transgenic mice reveal active canonical Wnt signal in neonatal brain and in adult liver and spleen. Genesis. 45 (2), 90-100 (2007).
- Currier, N., et al. Dynamic expression of a LEF-EGFP Wnt reporter in mouse development and cancer. Genesis. 48 (3), 183-194 (2010).
- Ferrer-Vaquer, A., et al. A sensitive and bright single-cell resolution live imaging reporter of Wnt/beta-catenin signaling in the mouse. BMC Developmental Biology. 10, 121(2010).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- de Roo, J. J. D., et al. Axin2-mTurquoise2: A novel reporter mouse model for the detection of canonical Wnt signalling. Genesis. 55 (10), (2017).
- van de Moosdijk, A. A. A., van de Grift, Y. B. C., de Man, S. M. A., Zeeman, A. L., van Amerongen, R. A novel Axin2 knock-in mouse model for visualization and lineage tracing of WNT/CTNNB1 responsive cells. Genesis. 58 (9), 23387(2020).
- Choi, Y. S., et al. Distinct functions for Wnt/beta-catenin in hair follicle stem cell proliferation and survival and interfollicular epidermal homeostasis. Cell Stem Cell. 13 (6), 720-733 (2013).
- Nolan, G. P., Fiering, S., Nicolas, J. F., Herzenberg, L. A. Fluorescence-activated cell analysis and sorting of viable mammalian cells based on beta-D-galactosidase activity after transduction of Escherichia coli lacZ. Proceedings of the National Academy of Sciences of the United States of America. 85 (8), 2603-2607 (1988).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3, 751(2012).
- Bernkopf, D. B., Bruckner, M., Hadjihannas, M. V., Behrens, J. An aggregon in conductin/axin2 regulates Wnt/beta-catenin signaling and holds potential for cancer therapy. Nat Commun. 10 (1), 4251(2019).
- Joosen, L., Hink, M. A., Gadella, T. W., Goedhart, J. Effect of fixation procedures on the fluorescence lifetimes of Aequorea victoria derived fluorescent proteins. Journal of Microscopy. 256 (3), 166-176 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Reviews. 11, 227-256 (2005).
- Henriksson, J., et al. Endrov: an integrated platform for image analysis. Nature Methods. 10 (6), 454-456 (2013).
- Hedgepeth, C. M., et al. Activation of the Wnt signaling pathway: a molecular mechanism for lithium action. Developmental Biology. 185 (1), 82-91 (1997).
- Sato, N., Meijer, L., Skaltsounis, L., Greengard, P., Brivanlou, A. H. Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nature Medicine. 10 (1), 55-63 (2004).
- Ring, D. B., et al. Selective glycogen synthase kinase 3 inhibitors potentiate insulin activation of glucose transport and utilization in vitro and in vivo. Diabetes. 52 (3), 588-595 (2003).
- Liu, C., et al. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 108 (6), 837-847 (2002).
- Zeng, X., et al. Initiation of Wnt signaling: control of Wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions. Development. 135 (2), 367-375 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır