Method Article
Axin2-mTurquoise2 报告基因胸腺细胞中低 Wnt 表达的流式细胞术和共聚焦成像分析
摘要
已知信号转导水平可调节细胞命运,表明 Wnt 信号转导的调节构成了一个有趣的治疗靶点。在这里,我们描述了流式细胞术和共聚焦显微镜分析方法,用于测量不同 Wnt 信号传导水平的稳健小鼠经典 Wnt 信号报告基因模型。
摘要
在尝试识别或测试新的 Wnt 治疗靶点时,测量 Wnt 表达水平至关重要。先前的研究表明,经典 Wnt 信号转导通过剂量驱动机制起作用,这激发了研究和测量各种细胞类型中 Wnt 信号转导的需求。尽管已经提出了几种报告基因模型来代表生理 Wnt 表达,但遗传环境或报告基因蛋白都极大地影响了这些工具的有效性、准确性和灵活性。本文描述了获取和分析使用 Axin2-mTurquoise2 小鼠 Wnt 报告基因模型获得的数据的方法,该模型包含突变的 Axin2em1Fstl 等位基因。该模型有助于研究单个细胞中较宽 Wnt 活性范围内的内源性经典 Wnt 信号转导。
该方案描述了如何使用造血系统的细胞群分析,结合细胞表面标志物或 β-catenin 细胞内染色来充分理解 Axin2-mTurquoise2 报告基因活性。这些程序可作为在其他感兴趣的组织或细胞中实施和繁殖的基础。通过结合荧光激活细胞分选和共聚焦成像,可以可视化不同的经典 Wnt 表达水平。推荐的测量和分析策略提供了荧光表达水平的定量数据,用于精确评估经典 Wnt 信号转导。这些方法对于希望将 Axin2-mTurquise2 模型用于规范 Wnt 表达模式的研究人员非常有用。
引言
经典 Wnt 信号转导是一种与健康组织稳态和疾病有关的保守信号转导通路。Wnt 信号转导水平的精确调节已被证明在胚胎发育中很重要,但在成体组织中也非常重要。已发现经典 Wnt 信号转导在肠道、皮肤和造血系统等多个器官的组织再生中起重要作用。因此,当 Wnt 信号转导失调时,会出现严重的病理。结直肠癌、肝癌和皮肤癌、神经系统疾病以及某些血液系统恶性肿瘤是典型病症,其中失调的 Wnt 信号传导是致病因素或促成因素1。因此,针对不同 Wnt 靶点的几种抑制剂目前正在临床试验中作为 Wnt 相关癌症疗法进行测试2。
此外,Wnt 在神经功能恢复、与年龄相关的神经系统疾病和先天性自闭症谱系障碍的治疗潜力方面正在取得有趣的进展 3,4,5。Wnt 信号已被探索用于干细胞离体扩增以进行后续移植6。然而,经典 Wnt 信号转导的治疗靶向是一项艰巨的工作,因为它在许多基本细胞功能中很重要,并且与其他通路 7,8,9 相互作用,因此需要在易于解释的模型中精确测量这些 Wnt 治疗药物的效果。经典 Wnt 信号转导由短程可溶性 Wnt 配体驱动,这些配体由邻近细胞分泌或作为自分泌排泄,如各种 Wnt 反应性干细胞类型中报道的那样。
Wnt 卷曲受体和脂蛋白受体相关蛋白 (LRP) 辅助受体对这些配体有反应,从而触发细胞内信号级联反应。当 Wnt 信号转导关闭时,由轴抑制剂 (Axin)、抑癌基因产物、大肠腺瘤性息肉病 (APC)、酪蛋白激酶 1 (CK1α) 和糖原合酶激酶 (GSK-3β) 组成的破坏复合物会阻止 β-catenin (CTNNB1) 通过蛋白酶体降解而积累。Wnt 配体-受体结合后,破坏复合物失活,导致 β-catenin 在细胞质中积累和稳定。活性 β-catenin 可以迁移到细胞核,在那里它与转录因子/淋巴增强子结合因子 (TCF/LEF) 转录因子结合以启动 Wnt 靶基因的转录。Axin2 被认为是靶基因,因为它是 Wnt 通路10 的直接靶标。此外,Axin2 还作为负调节因子以及活性经典 Wnt 信号转导的报告基因11,12。
文献中已经描述了几种经典的 Wnt 信号转导报告基因,它们在理解 Wnt 信号转导在胚胎发育中的作用方面具有很大的用处。这些报告基因中的大多数利用合成插入的 TCF/LEF 结合位点,这些位点不使用内源靶基因 13,14,15,16,17,18,19。此外,已使用的 Axin2 敲入策略尊重基因 11,20,21,22,23 的自然位置,其中 Axin2-LacZ 通常被认为是最稳健的经典 Wnt 报告基因11。然而,报告蛋白 LacZ 尽管在大多数组织中易于使用,但需要 β-半乳糖苷酶底物,这被认为对活细胞有刺激性24。特别是对于干细胞和胸腺细胞,在处理细胞悬液时,恶劣的 LacZ 检测条件会增加细胞死亡(自己的未报告数据)。
尽管 LacZ 染色引起的信号放大便于检测低信号,但它使定量不太直接,因此可以说不太可靠。因此,小鼠报告基因模型被设计为模拟 Axin2-LacZ 遗传策略,但使用 mTurquoise2 报告基因蛋白21,以提供更直接和更接近生理表达水平的读数。mTurquoise2 荧光蛋白是 LacZ 的极好替代品,因为它具有高亮度 (量子产率 (QY) = 0.93)、与其他荧光蛋白组合用于广泛细胞表面表征的灵活性,并且不需要外源性底物。此外,它与绿色荧光蛋白 (GFP) 的密切遗传关系提供了在必要时使用大多数识别 GFP 的荧光抗体在极其敏感的 Wnt 细胞中进行更强信号检测的可能性25。
Axin2-mTurquoise2 模型不仅是经典的 Wnt 报告基因,而且还提供了研究 Axin2 杂合子和纯合子(Axin2 敲除)表型的可能性。mTurquoise2 靶向插入 Axin2 的起始位点会导致 Axin2 蛋白被破坏21。由于 Axin2,也称为 Conductin,是 Wnt 破坏复合物的一部分,并且破坏复合物严格调节 β-catenin 介导的转录,因此其部分或完全缺失可能对研究各种病理感兴趣。例如,在结直肠癌中,由于 Wnt 过度激活,Axin2 水平相对较高11;然而,它在其他病理中的作用在很大程度上仍然未知。尽管 Axin2 被认为在 β-catenin 的降解中起的作用有限,但其在 Wnt 调节中的作用可以通过添加小肽来增强,小肽可阻断 Wnt 介导的结直肠癌生长26。
总而言之,通过 Wnt 治疗靶点进行仔细的 Wnt 调节可以为改变严重病理的发生或发展提供机会,应在具有报告基因能力的模型中进一步研究。在本报告中,我们解释了用于流式细胞术和共聚焦成像的 Axin2-mTurquoise2 小鼠模型的最佳实践分析方法。在 Wnt 剂量水平的背景下,非常低的经典 Wnt 信号转导水平难以检测,为此,先进的检测和分析能力为充分获得该模型的优势提供了优势。胸腺细胞因其脆弱的细胞活力、低经典 Wnt 信号表达和浓缩的细胞质面积而被用作模型系统,以代表 Axin2-mTurquoise2 模型的检测灵敏度。此外,解释了胸腺细胞悬液的组织学总 β-catenin 染色程序,以测量细胞质 β-catenin 水平并结合报告基因验证核活性经典 Wnt 信号传导。
研究方案
注意:所有小鼠程序均经莱顿大学医学中心 (LUMC) 动物实验伦理委员会批准进行。雄性和雌性,6-12 周龄,野生型 (wt),没有插入 Axin2-mTurquoise2 报告基因构建体,杂合子 (Tg/0) 插入 Axin2-murquoise2 报告基因构建体,因此,一个 Axin2 基因被破坏,纯合子 (Tg/Tg) 在两个等位基因中插入 Axin2-mTurquoise2 报告基因构建体,因此,两个被破坏的 Axin2 基因;Axin2-mTurquoise2 小鼠(B6;CBA-Axin2em1Fstl/J 小鼠)用于实验。在器官分离之前,通过 CO2 安乐死杀死了这些动物。在整个过程中,尽量减少样品暴露在光线下,并始终保持在冰或 4 °C 上,除非另有说明。用铝箔覆盖样品。所有步骤都应在带有生物安全柜的标准实验室中进行。
1. 胸腺细胞悬液的制备
- 切开小鼠的腹部并用镊子提取胸腺,小心地从小鼠身上收获胸腺,避免血液污染。在含有 2.5% 胎牛血清 (FCS) 的冰冷的 Iscove 改良 Dulbecco 培养基 (IMDM) 中临时储存/运输。
注意:为避免血液溢出和可能的胸腺损伤,请勿因宫颈脱位而牺牲小鼠。 - 制备一根带有 70 μm 细胞过滤器的 50 mL 试管,并用 1 mL 冷 IMDM/2.5% FCS 培养基润湿过滤器。
- 用 1 mL 注射器柱塞的后尖捣碎器官,同时用冷 IMDM/2.5% FCS 培养基洗涤两次(图 1A)。如果需要,向 IMDM/2.5% FCS 培养基中加入终浓度为 50 U/mL 的 DNAse I,以防止死细胞结块。用冷的 IMDM/2.5% FCS 培养基冲洗过滤器 2 次,然后轻轻重悬于 50 mL 试管中。
注:总最终体积不要超过 10 mL。将细胞置于冰上和黑暗中,以备后续步骤和不处理时使用。 - 在 4 °C 下以 330 × g 离心 5 分钟,然后从细胞沉淀中轻轻吸出上清液。将细胞沉淀轻轻重悬于冷的不完全 IMDM/2.5% FCS 培养基中,并准备进行细胞计数。
注:如果需要,将胸腺细胞冷冻并储存在 FCS-10% 二甲基亚砜的液氮中,以备以后实验使用。适当的细胞冻融将减少细胞过度死亡。平均而言,由于胸腺中的自然 T 细胞选择,解冻后有一半的胸腺细胞可以凋亡,在决定每个冻存瓶要冷冻多少胸腺细胞时应考虑这一点。每瓶应冷冻不少于 2.5 × 106 个胸腺细胞。
2. 胸腺细胞流式细胞术制备
- 通过在冰冷的磷酸盐缓冲盐水 (PBS,pH 7.4) 中为每个染色样品制备 2.5 × 106 个胸腺细胞,为细胞表面染色程序准备胸腺细胞(图 1B)。如果胸腺细胞先前已被冷冻,请重新计算解冻后活细胞的数量。如果需要,添加终浓度为 50 U/mL 的 DNAse I,以防止死细胞聚集。
- 使用抗体染色组合对完整的胸腺细胞亚群进行细胞表面表征。
注:可以选择其他荧光染料组合。为明亮的荧光荧光染料选择稀有的群体标记物,如果可能,添加活死标记物。由于光谱重叠,V450 和 V500 荧光染料均不应与 mTurquoise2 荧光报告基因结合使用。始终检查 mTurquoise2 与蓝色和绿色荧光染料结合的荧光光谱(补充图 1A)。- 将抗体分别混合在 PBS/0.2% 牛血清白蛋白 (BSA)/0.1% NaN3 (叠氮化钠)缓冲液中,以先前定义的谱系阴性 (Lin-) 组合比例混合。
注:所有不需要的细胞(胸腺中存在的非胸腺细胞)均使用链霉亲和素二抗(在本例中为藻红蛋白 (Pe)-Cy7 和别藻蓝蛋白 (APC)-Cy7)在 2 步法中染色,并且可以通过在流式细胞术分析中使用“转储门”来排除。 - 将抗体按先前定义的双阴性 (DN) 染色组合比例与链霉亲和素二抗 Pe-Cy7 在 PBS/0.2% BSA/0.1% NaN3 缓冲液中混合。从此混合物中排除 Lin- 面板(表 1)。
- 将抗体按先前定义的未成熟单阳性 (ISP)、双阳性 (DP) 和单阳性 (SP) 染色组比例与链霉亲和素二抗 APC-Cy7 在 PBS/0.2% BSA/0.1% NaN3 缓冲液中混合。从此混合物中排除 Lin- 面板(表 1)。
- 首先,通过使用 Lin-panel 的生物素一抗混合物在黑暗中的冰上 30 分钟,用不需要的非 T 细胞群对胸腺细胞进行染色。
注意:每个 Lin- panel 是一组不同的细胞,因此不应在一个样品中一起染色。 - 在 300 × g、4 °C 下旋转 5 分钟并去除上清液。用 150 μL 冰冷的 PBS/0.2% BSA/0.1% NaN3 缓冲液洗涤胸腺细胞,并在 300 × g、4 °C 下旋转 5 分钟。
- 用 DN 面板和相应 Lin-染色的 ISP/DP/SP 面板在黑暗中在冰上染色 30 分钟。在 300 × g、4 °C 下旋转 5 分钟,然后去除上清液。用 150 μL 冰冷的 PBS/0.2% BSA/0.1% NaN3 缓冲液洗涤胸腺细胞,并在 300 × g、4 °C 下旋转 5 分钟。
- 将抗体分别混合在 PBS/0.2% 牛血清白蛋白 (BSA)/0.1% NaN3 (叠氮化钠)缓冲液中,以先前定义的谱系阴性 (Lin-) 组合比例混合。
- 通过使用 35 μm 细胞过滤器管匀浆并在 PBS/0.2% BSA/0.1% NaN3 缓冲液中吸收细胞,准备用于流式细胞术测量的细胞。保护细胞避光,并在流式细胞仪测量之前和期间保持冰状态。
注:NaN3 (叠氮化钠)具有剧毒和致命性。处理该物质时应特别小心。处理后彻底洗手,如果吞下 NaN3 ,请立即致电中毒控制中心或医生/医师。
3. 流式细胞仪测量
注意:没有经验的用户应首先参加流式细胞仪培训,因为 mTurquoise2 信号与其他几种荧光染料的测量需要经验和知识渊博的实验计划。有关流式细胞仪的信息,请参阅 材料表 。
- 根据用户手册或其他既定方案启动流式细胞仪。检查并根据需要调整流式细胞仪中的带通滤光片设置,以获得最佳荧光检测策略。
注:mTurquoise2 的推荐滤光片在紫外 405 nm、407 nm 或不太常见的 440 nm 激光线上为 470/20 nm。 - 通过使用市售补偿微球和稳定转染的表达 mTurquoise2 的 293T 细胞建立补偿设置来校准流式细胞仪。
注:可以使用单染色的 wt 胸腺细胞代替补偿珠。在这种情况下,使用磁珠进行补偿与使用细胞一样有效且更方便。- 用实验中使用的每种荧光染料标记珠子,并包括未染色的珠子。测量磁珠以设置补偿设置面板,并测量表达 mTurquoise2 的 293T 细胞,因为没有可用于磁珠的 mTurquoise2 的匹配荧光染料。保存补偿设置以用于实际实验。
注:用于补偿设置的表达 mTurquoise2 的细胞必须与实际实验中表达 mTurquoise2 的胸腺细胞一样亮或更亮。确保还存在 mTurquoise2 阴性 293T 细胞。 - 对于实验,包括荧光减一 (FMO) Tg/Tg 染色的胸腺细胞,包括 mTurquoise2 FMO 的 wt 样品和每种小鼠基因型的胸腺细胞的未染色样品,作为分析部分的阳性对照。
注:这些对照对于正确设置阳性细胞的门很重要。其余实验样品用完整的染色面板染色(表 1)。- 创建一个实验,在流式细胞仪软件中添加并命名试管数量,并创建散点图以可视化整套荧光染料的染色细胞。
- 将先前建立的补偿设置应用于实验。用未染色的 wt 胸腺细胞调整前向散射 (FSC) 和侧向散射 (SSC),直到在散点图中可以看到完整的细胞群。首先测量未染色的表达 Tg/Tg mTurquoise2 的胸腺细胞,以确保阳性群体可见。
- 测量 Tg/Tg 完全染色的胸腺细胞样品,并检查所有荧光染料组合。如有必要,调整先前为显示错误补偿的荧光染料建立的补偿值。测量其余的实验样品,并且在样品测量过程中不要调整任何设置。
注:后续补偿调整也可以在分析软件包中执行。尽管可用单元的数量可能是一个限制因素,但建议在测量期间执行此步骤。保持所有样本之间的设置相等,以比较 mTurquoise2 强度值。
- 用实验中使用的每种荧光染料标记珠子,并包括未染色的珠子。测量磁珠以设置补偿设置面板,并测量表达 mTurquoise2 的 293T 细胞,因为没有可用于磁珠的 mTurquoise2 的匹配荧光染料。保存补偿设置以用于实际实验。
4. 流式细胞术分析
注:流式细胞术分析使用 材料表中提到的特定软件进行;但是,也可以使用其他流式细胞术分析程序。
- 根据 FSC 和 SSC 值对活细胞和胸腺细胞亚群进行门控。
- 检查样品左侧的 补偿矩阵 对话框中的补偿设置,以确保没有荧光染料干扰,并且已进行适当的补偿以避免溢出或渗漏。
- 如果必须调整采集定义的矩阵,只需增加或减少每个荧光染料组合的补偿值即可更改补偿矩阵中的值,以便群体不会显示近乎完美的水平或垂直线(补充图 1B)。
- 为了直观地传播 mTurquoise2 强度以实现适当的正门控,请将 mTurquoise2 X 轴显示更改为线性(补充图 2)。
- 使用 mTurquoise2 FMO 对照作为 mTurquoise2 正信号门控的阴性对照。修改每个细胞群的正确阈值门控(图 2)。
注意:(wt) mTurquoise2 FMO 对照细胞没有 mTurquoise2 标记,因此可用作 Axin2 报告基因活性的背景阈值。
- 使用 mTurquoise2 FMO 对照作为 mTurquoise2 正信号门控的阴性对照。修改每个细胞群的正确阈值门控(图 2)。
- 使用适当的检测通道对 mTurquoise2 阳性细胞进行门控,以确定有多少细胞是 Wnt 阳性的。
- 计算几何平均值和中位数,以定义目标细胞中的荧光强度量。
- 点击 统计 |在 显示 mTurquoise2 阳性细胞的面板中添加统计数据。
- 定义 mTurquoise2 的统计方法、感兴趣的种群和检测通道,然后单击 Add。以任意单位 (AU) 表示几何平均值和中位荧光强度以绘制图形。
注:中位数表示荧光强度的中间值,因此提供有关荧光强度群体变化的信息。如果需要,背景校正有助于更清晰地可视化 mTurquoise2 报告基因活动的动态范围。这可以通过从门控的特定细胞类型的 mTurquoise2 阳性细胞的总频率中减去 wt 背景染色频率来完成。
5. 制备胸腺细胞离心涂片用于共聚焦成像
注:当处理非粘附细胞的细胞悬液时,建议使用胸腺细胞离心涂片。由于 Axin2-mTurquoise2 在胸腺细胞中的表达低于胸腺上皮细胞,因此使用过滤的胸腺细胞悬液进行成像。
- 从新鲜收获或冷冻的胸腺细胞的细胞悬液开始。将 ~20,000 个胸腺细胞悬浮在 100 μL 冷 PBS/0.5% BSA/10% FCS 中,每种胸腺细胞基因型。
注:如果需要,在处理先前冷冻的胸腺细胞时,请轻轻解冻细胞以保持最大的细胞活力。这将有助于减少细胞成像时的自发荧光。检查细胞活力以确保样品质量。细胞离心涂片程序采用适用于脆弱胸腺细胞的机械力;尽管如此,它需要一个非常可行的起始种群。为确保更高的活力,建议从新鲜收获的胸腺细胞开始,而不是冷冻的胸腺细胞。 - 用 PBS 预润湿滤卡开口周围的区域。根据手册组装 cytospin 样品室支架(图 1C)。
- 将滤光片卡放在霜载玻片上(光滑的一面靠在载玻片上)。将两件物品都放在样品室支架上。小心地将滤光片卡完全放在样品室支架孔上,并将完整的样品室支架放入转子中。
- 小心地重悬胸腺细胞,并在样品室中加入 100 μL 细胞悬液。将胸腺细胞悬液以 ~350 × g 的速度旋转到霜载玻片上 4 分钟。小心地从霜载玻片上取下滤卡,不要接触细胞。在室温下将细胞离心片风干 1 小时至过夜。
注:使用其他细胞类型时,请测试不同的细胞密度以获得最佳结果。细胞离心涂片可以在 -20 °C 的密封盒中冷冻以备以后实验。解冻细胞离心涂片,以便在室温下进一步处理 1 小时。
6. 用总 β-catenin 进行细胞离心涂片免疫染色
- 在室温下用 100% 甲醇固定细胞离心涂片 15 分钟。在室温下将载玻片风干 10 分钟。用疏水笔在载玻片上的胸腺细胞群周围画一个圆圈。
注:此固定步骤专门针对 β-catenin 染色进行了优化。 - 将载玻片在室温下在 PBS/0.05% Tween-20 中放置 10 分钟,然后在封闭和孵育步骤中将它们转移到黑暗潮湿的盒子中。每张载玻片加入 100 μL PBS/10% 正常小鼠血清 (NMS),并在室温下在潮湿箱中放置 10 分钟。点击载玻片以去除 10% NMS,每张载玻片添加 100 μL PBS/10% 正常山羊血清 (NGS),并在室温下在潮湿箱中放置 30 分钟。
注:与 PBS/10% NMS 孵育会阻断非特异性一抗结合(图 1D),而 PBS/10% NGS 会阻断非特异性二抗结合。 - 准备用于细胞染色的其他抗体。将 0.5 μg β-catenin 总抗体与 AF568 标记的片段混合。
注:在这种情况下,使用市售标记试剂盒用 Alexa Fluor 568 (AF568) 荧光染料标记用次级山羊抗小鼠 IgG1 Fab 片段预标记初级抗小鼠总 β-连环蛋白,然后再将其添加到胸腺细胞中。根据制造商的方案进行标记,因为可能需要测试几种浓度。在 30 分钟内使用 β-catenin-AF568 标记的总抗体。 - 每个细胞离心涂片在 4 °C 下在潮湿的盒子中过夜,每个细胞离心涂片加入 50 μL (0.5 μg) β-catenin-AF568 标记的总抗体。根据制造商的方案包括阴性染色对照,或者在直接标记方案的情况下包括同种型对照。
- 在室温下用 PBS/0.05% Tween-20 洗涤 20 分钟。然后,在室温下用 PBS 在罐子中搅拌洗涤 20 分钟。执行第二个固定步骤以确保抗体与抗原结合:在室温下用 100 μL 4% 多聚甲醛 (PFA) 的 PBS 溶液在潮湿的盒子中放置 10 分钟。
注意:将载玻片放在黑暗中。甲醇和 PFA 固定都不会显著影响 mTurquoise2 表达27。 - 将载玻片浸入 PBS 中。在潮湿箱中,在室温下用 50 μL TO-PRO-3 (1:1500) 进行细胞核染色 10 分钟。在室温下用 PBS 在罐子中搅拌洗涤载玻片 20 分钟。
注:TO-PRO3 浓度可以根据使用其他荧光染料和附近荧光光谱进行滴定。 - 根据制造商的方案,用抗淬灭试剂包埋标本,并用盖玻片盖住。在室温下风干 24 小时。直接在荧光或共聚焦显微镜下查看载玻片,或储存在 -20 °C 以供以后成像。
7. 共聚焦显微镜测量
注:有关共聚焦显微镜的信息,请参阅 材料表 。
- 根据手册或既定方案打开共聚焦显微镜。使用阴性和阳性稳定转染的 mTurquoise2 293T 细胞系对照对共聚焦设置进行初步调整。随后,分别使用 wt Axin2-mTurquoise2 和 Tg/Tg (敲除)Axin2-mTurquoise2 胸腺细胞作为阴性和阳性对照,以确保 mTurquoise2 信号没有曝光不足。
- 通过对激光器和滤光片宽度进行编程,准备用于顺序扫描的软件。首先从最高波长的激光线开始,然后朝着最低波长努力。安装所有顺序扫描步骤后,将样品加载到显微镜载物台上,聚焦样品,然后使用共聚焦软件或可选手动面板上的相应按钮按 实时 按钮以优化 激光功率 和 智能增益 。
注意:不应对载玻片的标本部分进行成像以进行信号定量,因为可能会发生潜在的光漂白。然而,mTurquoise2 具有高光稳定性25。 - 如果 mTurquoise2 表达非常低,则增加激光功率和 Smart Gain,直到观察到荧光信号,并使用阴性对照样品检查以确保真阳性信号。使用 40x 1.4 油镜片、63x 1.4 油镜片或 100x 1.4 油镜片观察胸腺细胞。
注意:本研究使用了 Leica SP5 显微镜。 - 在测量样品之前,请在显微镜上使用这些共聚焦成像设置。
- 通过单击 配置 |设置 |在 Bit depth 选项中更改为 12 位,以创建更宽的强度范围,从而更好地区分低荧光信号和高荧光信号。
- 通过单击 XY 调整成像分辨率,然后增加 格式 到 1024 x 1024,这也将使扫描时间加倍。通过单击将扫描速度调整为 400-600 Hz,方法是单击 速度 |More 以手动更改设置。此外,激活 Bidirectional scanning 选项。
- 调整灵敏度滑块以减少背景信号。使用 Quick LUT(查找表) 选项优化正确的激光功率和 Smart Gain。
注意:在 12 位图像中,滑块具有从 0 到 4095 的灰度强度值。这也可以在之后使用免费的离线 Las X 软件来完成。绿色将显示黑色背景,蓝色将显示样本的饱和像素。
- 优化所有成像设置后,单击 “开始”测量样品,这将启动所有三个通道的顺序成像。
- 测量 TO-PRO-3 核荧光信号。使用 633 nm 激光器和 HyD 640-750 nm 检测 TO-PRO-3。
注意:在此设置中,使用 6% 的激光功率和 15% 的智能增益。此设置可以根据 TO-PRO-3 染色的强度而变化。如果非常亮,则在过度激发时可能会影响较低强度的荧光染料。在这种情况下,请降低染色浓度。 - 测量 β-catenin 核和细胞质荧光信号。使用 561 nm 激光器和 HyD 580-605 nm 检测 β-catenin。在AF568信号较低的情况下,通过调整软件中 XY 框中的设置,将平均行数设置为2,最多可为一张图像累积2次扫描。
注意:在此设置中,使用 85% 的激光功率和 87% 的智能增益。 - 测量 mTurquoise2 细胞质荧光信号。使用 458 nm 激光器和 HyD 490-600 nm 检测 mTurquoise2。通过调整软件中 XY 框中的设置,在 mTurquoise2 信号较低的情况下,将平均行数设置为 4,从而为一张图像累积最多 4 次扫描。
注意:由于共聚焦显微镜上用于此协议的旧激光器和低 mTurquoise2 信号,因此在 90% 激光功率下使用 405 nm,以及在 100% 激光功率下使用 458 nm 和 476 nm 激光器与 HyD 490-550 nm 在 100% 智能增益。440 nm 激光是最佳选择,尽管在共聚焦显微镜上不太常见。应小心处理高激光功率,并且只能进行顺序成像。确保紧急设置已到位,以避免探测器过度曝光。由于激光更强大或更新,其他共聚焦显微镜上的激光功率可能低于本协议中提出的激光。可以进行漂白测试以确保在成像前没有荧光信号丢失。在建议的设置中,mTurquoise2 的光漂白是可以接受的。 - 进行明场成像以实现总细胞可视化。使用 488 nm 激光和 PMT Scan-DIC 检测胸腺细胞。导出 Lif 文件以进行图像分析。
注意:在此设置中,使用了 59% 的激光功率,增益为 212 V,数据偏移为 -4.3%。可以在离线 LAS x 软件中读取 LIF 文件以进行图像校正。
- 测量 TO-PRO-3 核荧光信号。使用 633 nm 激光器和 HyD 640-750 nm 检测 TO-PRO-3。
8. 共聚焦显微镜分析
- 使用图像处理软件28 分析图像(补充图 3)。在软件中加载图像。
注意:接受多种格式,但建议使用带有 LUT 的 TIFF 文件或将 Lif 文件直接导入图像处理软件。 - 测量胸腺细胞核中的活性 β-catenin 信号。
- 在红灰色值图像中选择 TO-PRO-3 染色的胸腺细胞核,用于分析活性 β-catenin。手动执行此作,或使用软件中的自动细胞选择。
注:自动细胞选择可能需要图像处理以进行适当的阈值和颗粒分析。手动细胞选择可能很费力,但通常不需要任何图像处理,因此在本实验步骤中推荐使用。 - 使用工作栏中的任何选择工具激活手动选择。
- 选择原子核的轮廓,并将其添加到感兴趣区域 (ROI) 管理器中。通过单击 Analyze |工具 |ROI Manager,当新的 ROI Manager 窗口打开时,单击第一个选项 Add (t) 或使用键盘快捷键 t。重复上一步,直到定义所有核心并添加到 ROI 管理器中。使用 ROI 管理器中的 Show all 选项可视化所选单元格。
- 选择 >3 个不存在单元格的背景区域,然后将其添加到 ROI 管理器中。
注意:在这种情况下,大小和形状并不重要。这些区域将用作最终计算的背景噪声测量值。- 通过单击 分析 |设置 Measurements。在打开的具有不同测量选项的新窗口中,激活 面积、 积分密度 和 平均灰度值 |单击 确定。
- 单击激活 β-catenin 灰度值图像,然后单击 ROI 管理器中的 Show all (全部显示 ) 来可视化选定的原子核和背景区域。观察现在在 β-catenin 图像中可见的所有选定区域。
- 单击 ROI Manager 中的 Measure 或单击 Analyze |测量。观察打开的新 Results 窗口,其中显示了 ROI 中 β-catenin 信号的结果。
- 通过单击 Edit |全选;并将列表复制/粘贴到电子表格中以进行进一步计算。保存 ROI 管理器以供将来参考,而无需通过单击 More |救。。。。
- 要自动选择单元格,请对要处理的图像进行 重复 (键盘 Ctrl D),因为许多图像处理设置无法撤消。
注:在大多数情况下,自动细胞核标记需要图像处理,以自动准确地定义细胞核。图像处理应仅用于区域选择目的。处理后的图像对于荧光强度测量没有用,因为像素值会发生变化。- 通过单击 Process |过滤器 |Gaussian Blur 使图像平滑。测试多个 Sigma (Radius) 值,并激活 Preview 选项以可视化效果,然后单击 OK。
- 通过单击 “编辑 | ”来反转图像反转。通过单击检查 亮度 和 对比度 图片 |Adjust |亮度/对比度。使用 Auto 选项,或者最好手动更改值。
注意:请勿 应用 更改,因为这会更改图像属性。只需在获得所需图像后关闭 B&C 窗口。 - 通过单击 图像 |Adjust |Threshold 的 Threshold,并定义所有单元格都大多可见的最佳 Threshold 设置。单击 Apply 以应用 Threshold 设置。
注意:如果尚未将阈值应用于显示孔洞的单元格,请单击 Process |二进制 |Fill Holes 填充单元格内的空隙。如果单元格与阈值设置融合在一起,请单击 Process |二进制 |分水岭 来分隔这些像元。一条细的 1 像素线将分隔程序解释为融合的任何单元格。 - 通过使用 手绘选择 工具手动选择所需的原子核,将其添加到 ROI 管理器中,然后测量面积,定义图像中的最小和最大的原子核。
- 通过单击 Analyze |分析粒子,然后在 大小 (^2) 框中插入最小面积和最大面积,中间有一个连字符 (-)。激活 Display results、Add to manager 和 Exclude on edges 框,然后单击 OK。继续执行步骤 8.2.3 以完成协议。
- 在红灰色值图像中选择 TO-PRO-3 染色的胸腺细胞核,用于分析活性 β-catenin。手动执行此作,或使用软件中的自动细胞选择。
- 测量胸腺细胞中的细胞质 mTurquoise2 和 β-catenin 信号。
- 按照与上述相同的步骤,在明场图像中选择整个胸腺细胞的轮廓。
- 选择 >3 个不存在单元格的背景区域,然后将其添加到 ROI 管理器中。
注意:在这种情况下,大小和形状不是必需的。这些区域将用作最终计算的背景噪声测量值。- 通过单击激活 mTurquoise2 灰度值图像,并通过单击 ROI 管理器中的“ 全部显示 ”来可视化选定的总单元格 ROI 和背景区域。观察 mTurquoise2 图像中可见的所有选定区域。
- 单击 ROI Manager 中的 Measure ,或单击 Analyze |测量。观察打开的新 Results (结果 ) 窗口,其中包含 mTurquoise2 信号的测量结果。
- 通过单击 Edit |全选,然后将列表复制/粘贴到电子表格中以进行进一步计算。
- 单击激活 β-catenin 灰度值图像,然后单击 ROI 管理器中的 Show all (全部显示 ) 来可视化选定的总单元格 ROI 和背景区域。观察 β-catenin 图像中可见的所有选定区域。
- 单击 ROI Manager 中的 Measure ,或单击 Analyze |测量。请注意打开的新 Results 窗口,其中包含总蜂窝 β-catenin 信号的测量结果。
- 通过单击 Edit |全选,然后将列表复制/粘贴到电子表格中以进行进一步计算。保存 ROI 管理器以供将来参考,而无需通过单击 More |救。。。。
- 使用公式 1 计算活性 β-catenin 的校正总核荧光 (CTNF)。
CTNF = 积分密度 - (面积×平均背景面积的平均值) (1) - 使用公式 2 计算 mTurquoise2 的校正总细胞荧光 (CTCF)。
CTCF = 积分密度 - (面积 × 平均背景面积的平均值) (2) - 通过减去在步骤 8.2.3.3 中获得的核 β-catenin 值,区分活性核 β-catenin 和细胞质 β-catenin。从步骤 8.3.2.5 中获得的总细胞 β-catenin 值获得细胞质无活性β-catenin。
注意:确保在同一单元格内进行测量。- 计算背景区域的平均强度的平均值。使用公式 1 和 2 计算 CTNF 和 CTCF。将 IntDen (所选区域内所有像素的总和)视为 Integrated 密度,而不是 RawIntDen。
- 如果需要,计算用于绘制图形的 IntDen 值的标准差。考虑使用 Mann-Whitney U 检验进行多达 200 个单独的单元格进行统计分析。
- 在单个数据点图中绘制结果,并使用 CTNF 或 CTCF 值标记 y 轴作为相对荧光单位 (RFU)。
结果
为了研究经典 Wnt 信号传导的作用,已经将 Axin2-mTurquoise2 经典 Wnt 报告基因模型与 β-catenin 蛋白表达相结合进行了测试。已知胸腺细胞很脆弱,在胸腺细胞成熟过程的几个阶段表现出低经典 Wnt 信号转导,并且细胞质与细胞核的比率较低;所有这些因素都阻碍了细胞质 mTurquoise2 或 β-catenin 的检测。按照该方案,从胸腺中收获小鼠 Axin2-mTurquoise2 胸腺细胞并加工成单细胞悬液,用于 Axin2-mTurquoise2 和总 β-catenin 的流式细胞术和细胞离心涂片共聚焦分析(图 1)。
流式细胞术分析有助于表征不同的胸腺细胞成熟阶段,以测量每个细胞亚群中是否存在 mTurquoise2 荧光染料作为活性经典 Wnt 信号传导的报告蛋白。在 Axin2-mTurquoise2 基因型中,野生型 (wt)、杂合子 (Tg/0) 和纯合子 (Tg/Tg)-mTurquoise2 信号水平增加,这代表了双阳性 (DP) 胸腺细胞内经典 Wnt 信号的激活水平(图 2)。由于没有插入的 mTurquoise2 蛋白,wt mTurquoise2 水平表现出背景噪音;然而,经典 Wnt 信号转导仍可能发生在这些细胞中,但根本无法通过报告基因进行可视化。尽管如此,缺乏一个 (Tg/0) 或两个 (Tg/Tg) 的 Axin2 基因会影响经典 Wnt 信号转导活性,因为 Axin2 在破坏复合物中发挥重要作用,负向调节活性经典 Wnt 信号转导。
可以检查平均或中位荧光强度以研究 Axin2-mTurquoise2 报告基因模型的表达水平。中位荧光强度和几何平均值(图 2C)是荧光直方图的第一和第二首选图形表示。与 Tg/0 相比,Tg/Tg 中 Axin2 表达的增加暗示由于缺乏功能性 Axin2 而导致经典 Wnt 信号转导的激活增加,因此导致功能障碍破坏复合物。为了进一步验证经典 Wnt 信号通路的激活水平,对 Axin2-mTurquoise2 胸腺细胞内的总 β-catenin 进行了细胞离心涂片免疫染色。由于 β-catenin 的细胞位置表明经典 Wnt 信号转导是否被激活,因此我们测量了细胞核或细胞质 β-catenin 的存在。
mTurquoise2 在胞质溶胶中表达,主要在细胞核周围可见(如图 3A 中的 TO-PRO-3 红色所示)。由于胸腺细胞的细胞质非常少,因此应仔细进行区域选择以测量所有信号(补充图 3)。应特别注意假阳性染色或自发荧光信号,如白色箭头所示。这些荧光信号通常由细胞碎片产生,并且在 mTurquoise2 和 AF568 图像中都可见(图 3B,C 和图 3D,E)。未染色的 wt 对照图像显示,mTurquoise2 在这些胸腺细胞中也可见,尽管它们不包含 Axin2-mTurquoise2 报告基因构建体。这种背景噪声可能是由于自发荧光和胸腺细胞中致密的细胞质造成的 29。然而,通过使用 CTCF 公式仔细选择区域和正确的背景校正,图 3B 显示泛胸腺细胞中 Axin2-mTurquoise2 表达增加,如 DP 胸腺细胞的流式细胞术分析所示。
为了进一步了解由于 Axin2-mTurquoise2 报告基因构建体而受损的 Axin2 基因对破坏复合物的影响,因此,β-catenin 的存在,我们测量了胸腺细胞中细胞核或细胞质 β-catenin AF568 的表达。活性经典 Wnt 信号转导由 β-catenin 迁移到细胞核驱动,在那里它将与 TCF/LEF 转录因子相互作用,随后激活 Axin2 作为靶基因以抑制通路激活。由于 Axin2 形成破坏复合物的一部分,在靶向细胞质 β-catenin 进行蛋白酶体降解中起重要作用,因此 Axin2 蛋白的缺失或破坏可能导致细胞核和/或细胞质 β-catenin 的积累。
我们表明,与野生型 (wt) 相比,杂合子 (Tg/0) Axin2-mTurquoise 泛胸腺细胞的核和细胞质 β-catenin 表达较低,表明 β-catenin 本身的调节发生了变化。然而,在纯合子 (Tg/Tg) Axin2-mTurquoise 泛胸腺细胞中,核 β-catenin 高于 wt,尽管两种基因型之间的细胞质 β-catenin 相似(图 3C)。这表明测量总 β-catenin 水平可以提供有关经典 Wnt 通路的额外信息,而不是直接测量未磷酸化的 β-catenin,后者特异性检测不注定于蛋白酶体降解的 β-catenin。尽管如此,应该记住,β-catenin 对经典 Wnt 驱动基因表达(例如 Axin2 )的调节受本协议中尚未测试的其他几种蛋白质的调节。

图 1:该方案的示意图和简化概述。 (A) 胸腺加工成细胞悬液,(B) 流式细胞术方案,(C) 细胞离心涂片组装,(D) 细胞内染色方案。 请单击此处查看此图的较大版本。
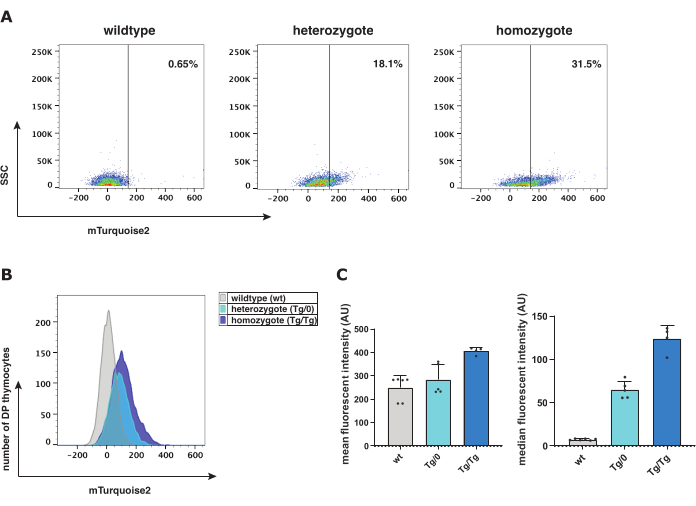
图 2:野生型 (wt)、杂合子 (Tg/0) 和纯合子 (Tg/Tg) Axin2-mTurquoise2 小鼠的流式细胞术分析。 (A) 根据 Axin2-mTurquoise2 基因型,mTurquoise2 DP 胸腺细胞门控和群体位移的点图表示。(B) mTurquoise2 直方图的表示,显示了 DP 胸腺细胞的小鼠基因型之间的荧光强度范围。(C) DP 胸腺细胞 (总共 5 wt;5 Tg/0 和 4 Tg/Tg 小鼠) 中 Axin2-mTurquoise2 基因型的平均和中位荧光强度与标准偏差误差线的条形图表示。缩写: DP = 双正。 请单击此处查看此图的较大版本。
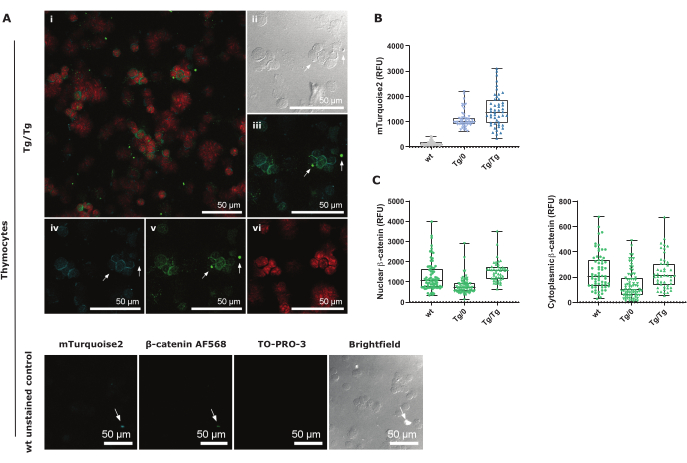
图 3:总胸腺细胞细胞离心涂片程序和对照的共聚焦图像表示,以 40 倍放大倍数和 1.5 缩放因子成像。 (A) 用核 TO-PRO-3 和总 β-catenin AF568 染色的 Tg/Tg (纯合子)Axin2-mTurquoise2 胸腺细胞,以及内源性细胞质 mTurquoise2 表达。i 是所有三种颜色的叠加共聚焦图像;II 是明场图像;iii 是 Axin2-mTurquoise2 和总 β-catenin AF568 叠加;iv 是 mTurquoise2 特写;v 是总 β-catenin AF568 特写;vi 是核 TO-PRO-3 特写。下面板包含每个成像通道的 wt 未染色对照图像。白色箭头表示所有图像中的相同位置,并显示了由于碎片引起的假阳性信号。比例尺 = 50 μm。(B) 所有 Axin2-mTurquoise2 基因型(每个基因型 50-70 个细胞)的 CTCF mTurquoise2 强度值的箱线图表示。(C) 所有 Axin2-mTurquoise2 基因型(每个基因型 50-70 个细胞)的核活性 β-catenin 和非活性胞质 β-catenin 的总 β-catenin AF568 CTNF 和 CTCF-CTNF 强度值的箱线图表示。缩写:CTCF = 校正总细胞荧光;CTNF = 校正总核荧光;RFU = 相对荧光单位。 请单击此处查看此图的较大版本。
| DN 染色板 | 荧光染料 | 抗体 |
| FITC | CD127的 | |
| 体育 | CD25的 | |
| PE-Cy7 系列 | 链霉亲和素 (SAV) | |
| APC公司 | CD117的 | |
| APC-Cy7 系列 | CD44的 | |
| PerCP | CD135的 | |
| V450 系列 | x | |
| V500 系列 | x | |
| 林- | ||
| 生物素 | 特119 | |
| GR1 | ||
| CD11乙 | ||
| B220 系列 | ||
| NK1.1 | ||
| CD3 系列 | ||
| CD4 | ||
| CD8型 | ||
| ISP/DP/SP 染色面板 | ||
| FITC | TCRb | |
| 体育 | TCRgd | |
| PE-Cy7 系列 | CD4 | |
| APC公司 | CD3 系列 | |
| APC-Cy7 系列 | 链霉亲和素 (SAV) | |
| PerCP | CD8型 | |
| V450 系列 | x | |
| V500 系列 | x | |
| 林- | ||
| 生物素 | 特119 | |
| GR1 | ||
| CD11乙 | ||
| B220 系列 | ||
| NK1.1 | ||
| 1. 用生物素谱系阴性 (Lin-) 面板对胸腺细胞进行染色。 | ||
| 2. 用胸腺细胞标志物面板对胸腺细胞进行染色。 | ||
表 1:用于流式细胞术的细胞表面表征抗体检测组合。 两步法 DN 胸腺细胞染色、两步法 ISP、DP 和 SP 胸腺细胞染色。缩写: DN = 双否定;DP = 双正;SP = 单正;ISP = 未成熟单阳性;PE = 藻红蛋白;APC = 别藻蓝蛋白;FITC = 异硫氰酸荧光素。
补充图 1:mTurquoise2 和 FITC 荧光染料兼容性 (A) mTurquoise2(蓝色)和 FITC(绿色)的荧光激发和发射光谱,代表光谱重叠最小。细线表示激发 mTurquoise2 (405 nm) 和 FITC (488 nm) 的激光线。未填充的曲线表示激发光谱,因为填充的曲线表示指定荧光染料的发射光谱。蓝色对应于 mTurquoise2,绿色对应于 FITC。在流式细胞术中,分别使用 mTurquoise2 和 FITC 的带通滤光片(覆盖发射光谱的灰色区域)470/20 和 530/30。(B) Axin2-mTurquoise2 DP 胸腺细胞流式细胞术分析程序中的软件荧光染料发射补偿矩阵,显示了 mTurquoise2(y 轴)和用于 DP 胸腺细胞表征的其他荧光染料(x 轴)之间的荧光染料光谱渗出。在 mTurquoise2 和 FITC(绿框)之间未检测到光谱渗漏,而在 mTurquoise2 和 AmCyan 青色样荧光染料(红框)之间检测到光谱渗漏问题。V450 流式细胞仪通道用于测量 mTurquoise2 荧光染料,其在 y 轴上表示为 comp-mTurquoise2。缩写: FITC = 异硫氰酸荧光素;DP = 双正;V450 = 紫罗兰色 450。 请点击此处下载此文件。
补充图 2:mTurquoise2 阳性细胞设门策略的流式细胞术软件分析工作流程方案。 逐步说明调整变换设置以获得更好的 mTurquoise2 门控策略。Axin2-mTurquoise2 Tg/Tg (纯合子)双阳性胸腺细胞群的表示。 请点击此处下载此文件。
补充图 3:用于荧光强度测量的图像分析软件工作流程方案。 逐步解释为 mTurquoise2 的 CTCF 计算或活性 β-catenin-AF568 的 CTNF 计算选择和测量荧光强度数据。(A) 明场图像;(B) mTurquoise2 图像;(C) 细胞核 TO-PRO-3 染色;(D) 总 β-catenin AF568 图像。方框是用于 CTCF 和 CTNF 计算的背景信号区域。比例尺 = 50 μm。缩写:CTCF = 校正总细胞荧光;CTNF = 校正后的总核荧光。 请点击此处下载此文件。
讨论
有几种经典的 Wnt 报告基因具有不同的报告基因灵敏度和实际报告基因蛋白。使用合成引入的多聚化 TCF/LEF 结合位点的报告基因模型可用于荧光报告蛋白;然而,这种转基因重复可能在育种或长时间 体内 实验中丢失,并且可能对来自周围基因组序列的、影响报告基因表达的非 Wnt 信号敏感。因此,最常用的报告基因仍然是较旧的变体 Axin2-LacZ,尽管在活细胞中难以使用。
Axin2-mTurquoise2 经典 Wnt 报告基因模型提供与 Axin2-LacZ 相同的报告基因可靠性,尽管具有明亮且相对稳定的荧光报告蛋白的简单性。这种青色变体荧光蛋白可用于长期成像,并且可以轻松与最常用的抗体荧光染料结合使用25。但是,在使用此模型时,应考虑有关 3D 穿透和自发荧光的可能限制29。由于 β-catenin 核稳定是典型的 Wnt 报告基因驱动因素,因此大多数分子实验需要检测增加的总或活性 β-catenin 以验证活性 Wnt 信号传导。然而,众所周知,β-catenin 表达很低且难以检测,而 Axin2 实际上可能是更好的标记物。在该协议中,我们解释了如何将 Axin2-mTurquoise2 报告基因模型与核总 β-catenin-AF568 的单细胞胸腺细胞细胞学染色相结合,尽管荧光信号较低。
该模型的关键步骤主要与正确检测低 Axin2-mTurquoise2 和 β-catenin-AF568 表达有关。因此,该方案描述了胸腺细胞中最大可能的信号检测,已知胸腺细胞的细胞活力较低,导致自发荧光增加。这与胸腺细胞有关,胸腺细胞在胸腺的生理环境下,胸腺细胞选择过程中会发生自然凋亡。因此,我们相信证明在这些细胞中检测到 Axin2-mTurquoise2 和 β-catenin-AF568 的低表达将促进 Axin2-mTurquoise2 模型的适用性。
为了获得可靠的结果,应特别注意对设备进行适当的微调。为了确保区分真实信号和背景信号,需要包含几个阳性和阴性对照,以正确校准流式细胞术和共聚焦成像设备。我们建议使用稳定的表达 mTurquoise2 的细胞系(例如 293T 细胞)作为阳性对照,因为它们易于转染、在宽强度谱上具有稳态规范 Wnt 表达,并且对氯化锂 (LiCl)、6-溴二红素-3'-肟或 CHIR99021 31,32,33 等 Wnt 通路激活化合物敏感.使用具有相同 mTurquoise2 报告蛋白的对照至关重要,因为激发、发射光谱和荧光强度决定了流式细胞术中其他荧光染料光谱溢出的补偿值或共聚焦显微镜中检测滤光片范围的定义。
此外,建议对目标细胞进行第二个 Axin2-mTurquoise2 纯合子阳性对照,其中包含 2 倍的 Axin2-mTurquoise2 报告基因构建体,以调整到生理表达的 mTurquoise2 荧光强度范围,尤其是在低表达细胞的情况下。考虑到经典 Wnt 信号转导是剂量依赖性的,这会导致报告基因表达波动,因此需要阴性对照以排除激光功率的过度曝光,定义合理的信噪比并定义真正的阳性 mTurquoise2 表达阈值。
与流式细胞术一样,添加多个特征标记物是常规做法;应选择光谱溢出最小的匹配荧光染料。FITC 或 Alexa Fluor 488 (AF488) 与 mTurqoise2 报告蛋白的组合应在本协议中提出的流式细胞仪设置中提供最小的光谱干扰。在比较两种荧光染料的荧光光谱时,mTurquoise2 被 488 激光激发最小(效率为 1%),这在低表达 mTurquoise2 报告细胞中尤其容易忽略。因此,胸腺细胞中任何显著的假阳性 FITC 信号都是意想不到的。在共聚焦显微镜的情况下,尤其是使用建议的共聚焦设置,不建议使用 FITC 或 AF488 荧光染料,因为除了在图像处理软件中进行显着信号混合外,没有其他补偿的可能性。相反,应选择其他荧光染料,例如 AF568,以完全检测低 mTurquoise2 表达,而不会出现任何光谱重叠问题。
当使用高表达 mTurquoise2 的细胞或在共聚焦显微镜上具有 440 nm 激光并且发射滤光片范围变窄时,可以使用 FITC 或 AF488,但是,已知 Axin2 表达在大多数成人组织中较低。在我们的方案中,我们使用预先标记的两步高性能 AF568 标记程序测量了 β-catenin 的总表达,该程序确保对低结合物稳定性的蛋白质(如 β-catenin)进行有效免疫染色。免疫染色方案中的步骤已经过优化,可在不存在高背景信号的情况下测量细胞质或细胞核中的真阳性 β-catenin。类似的染色方案可用于原代培养物和冷冻切片,但是,当处理不同的细胞类型时,应测试固定步骤。Axin2-mTurquoise2 模型仅具有报告基因功能,因此不适用于细胞示踪实验,例如其他 Axin2 敲入模型22。事实上,这些优雅的 Cre 重组 Wnt 模型主要用于组织成像实验,而不适用于失去环境背景的细胞悬液。尽管 Axin2-mTurquoise2 模型由于基因插入而破坏了 Axin2 基因的功能,但这一特征对于研究 Wnt 治疗靶点的 Axin2 敲除模型很有用。
纯合子小鼠缺乏 Axin2 功能,这阻碍了其蛋白质相互作用以磷酸化破坏复合物中的 β-catenin34;然而,mTurquoise2 报告基因表达有助于显示经典 Wnt 信号转导是否通过替代途径保持活性。值得注意的是,Axin2 在 Wnt 配体结合后的 Wnt 卷曲/LRP 受体复合物中也起重要作用,在信号级联35 中提供了另一个有趣的 Wnt 调节点。除了 Axin2-mTurquoise2 鼠模型外,类似的报告基因构建体也可用于瞬时转基因,并且可以通过 CRISPR-Cas9 技术特异性靶向内源性 Axin2 基因座21。总之,本报告描述了一种简单而稳健的方法来分析低 Axin2 表达胸腺细胞的 Axin2-mTurquoise2 报告基因模型。该方案可应用于其他经典 Wnt 表达细胞类型,用于药物筛选和功能性 Wnt 治疗靶点定义。
披露声明
作者声明没有利益冲突。
致谢
这项工作部分得到了莱顿大学对分析领域再生医学的资助,以开发新的小鼠模型。
材料
| Name | Company | Catalog Number | Comments |
| BD FACScantoII flow cytometer | BD Biosciences | not aplicable | Serial number V96300710. The flow cytometer setup in this protocol contains a 405 nm laser line with 505 longpass filter and 530/30 nm bandpass filter, and 470/20 nm bandpass filter; a 488 nm laser with 735 nm longpass filter and 780/60 nm bandpass filter, 670 nm longpass filter and 655 nm longpass filter, 610 nm longpass filter, 550 nm longpass filter and 575/26 nm bandpass filter, 505 nm longpass filter and 530/30 nm bandpass filter, and 488/10 nm bandpass filter; and a 633 nm laser line with 735 nm longpass filter and 780/60 nm bandpass filter, 685 nm longpass filter, and 660/20 nm bandpass filter. |
| BSA | Sigma | A9647 | |
| Corning 70 μm cell strainer | Falcon/Corning | 352350 | |
| Cytospin 4 Type A78300101 | Thermo Scientific | not aplicable | |
| DMSO | Sigma Aldrich | D5879-1L | |
| DNAse I | Sigma | A9647 | |
| Falcon 50 mL Conical Centrifuge tubes | Greiner bio-one | 227261 | |
| Falcon round-bottom Polystyrene Test tubes with cell strainer snap cap | Fisher Scientific | 352235 | |
| Fetal Calf Serum (FCS) | Greiner Bio-One B.V. | not aplicable | Depends on origin |
| Fiji software | ImageJ | not aplicable | Version 1.53 |
| Filter card white (for cytospin) | VWR | SHAN5991022 | |
| FlowJo 10 software | Treestar | not aplicable | Version 10.5.3 |
| Frost slides | Klinipath | ||
| Gibco IMDM medium | Fisher Scientific | 12440053 | |
| HCX PL APLO 40x 1.4 OIL lens | Leica microsystems | not aplicable | |
| Hydrophobic pen: Omm Edge pen | Vector | not aplicable | |
| Leica TCS SP5 DMI6000 | Leica microsystems | not aplicable | The microscope setup in this protocol consisted of an HCX PL APO 40x/1.2 oil-immersion objective with 8-bit resolution, 1024 pixels x 1024 pixels, 400 Hz speed, pinhole 68 µm, and zoom factor of 1.5 at room temperature. This system contains a 405 diode laser, argon laser, DPSS 561 laser, HeNe 594 laser and HeNe 633 laser with 4 hybrid detectors (HyDs) and 5 photomultiplier tubes (PMTs). |
| Methanol | VWR | 1060091000 | |
| NaN3/sodium azide | Hospital farmacy | not aplicable | |
| Normal mouse serum | Own mice | not aplicable | |
| PBS | Lonza | BE17-517Q | |
| ProLong Diamond Antifade Mountant | Fisher Scientific | P36965 | |
| Purified mouse anti-β-catenin (CTNNB1) | BD Biosciences | 610154 | |
| TO-PRO-3 Iodide | Thermofisher | T3605 | |
| Transparent nailpolish | at any drugstore | not aplicable | |
| Tween-20 | Sigma Aldrich | P1379-500ml | |
| Zenon Alexa Fluor 568 Mouse IgG1 labeling kit | Thermofisher | Z25006 |
参考文献
- Kahn, M. Can we safely target the WNT pathway. Nature Reviews. Drug Discovery. 13 (7), 513-532 (2014).
- Jung, Y. S., Park, J. I. Wnt signaling in cancer: therapeutic targeting of Wnt signaling beyond beta-catenin and the destruction complex. Experimental & Molecular Medicine. 52 (2), 183-191 (2020).
- Gao, K., Zhang, T., Wang, F., Lv, C. Therapeutic Potential of Wnt-3a in neurological recovery after spinal cord injury. European Neurology. 81 (3-4), 197-204 (2019).
- Jia, L., Pina-Crespo, J., Li, Y. Restoring Wnt/beta-catenin signaling is a promising therapeutic strategy for Alzheimer's disease. Molecular Brain. 12 (1), 104(2019).
- Bae, S. M., Hong, J. Y. The Wnt signaling pathway and related therapeutic drugs in autism spectrum disorder. Clinical Psychopharmacology and Neuroscience. 16 (2), 129-135 (2018).
- Tajer, P., Pike-Overzet, K., Arias, S., Havenga, M., Staal, F. J. T. Ex vivo expansion of hematopoietic stem cells for therapeutic purposes: Lessons from development and the niche. Cells. 8 (2), 169(2019).
- Yanai, K., et al. Crosstalk of hedgehog and Wnt pathways in gastric cancer. Cancer Letters. 263 (1), 145-156 (2008).
- Blank, U., et al. An in vivo reporter of BMP signaling in organogenesis reveals targets in the developing kidney. BMC Developmental Biology. 8, 86(2008).
- Duncan, A. W., et al. Integration of Notch and Wnt signaling in hematopoietic stem cell maintenance. Nature Immunology. 6 (3), 314-322 (2005).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- Lustig, B., et al. Negative feedback loop of Wnt signaling through upregulation of conductin/Axin2 in colorectal and liver tumors. Molecular and Cellular Biology. 22 (4), 1184-1193 (2002).
- Bernkopf, D. B., Hadjihannas, M. V., Behrens, J. Negative-feedback regulation of the Wnt pathway by conductin/axin2 involves insensitivity to upstream signalling. Journal of Cell Science. 128 (1), 33-39 (2015).
- Vassar, R., Rosenberg, M., Ross, S., Tyner, A., Fuchs, E. Tissue-specific and differentiation-specific expression of a human K14 keratin gene in transgenic mice. Proceedings of the National Academy of Sciences of the United States of America. 86 (5), 1563-1567 (1989).
- DasGupta, R., Fuchs, E. Multiple roles for activated LEF/TCF transcription complexes during hair follicle development and differentiation. Development. 126 (20), 4557-4568 (1999).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
- Mohamed, O. A., Clarke, H. J., Dufort, D. beta-catenin signaling marks the prospective site of primitive streak formation in the mouse embryo. Developmental Dynamics. 231 (2), 416-424 (2004).
- Moriyama, A., et al. GFP transgenic mice reveal active canonical Wnt signal in neonatal brain and in adult liver and spleen. Genesis. 45 (2), 90-100 (2007).
- Currier, N., et al. Dynamic expression of a LEF-EGFP Wnt reporter in mouse development and cancer. Genesis. 48 (3), 183-194 (2010).
- Ferrer-Vaquer, A., et al. A sensitive and bright single-cell resolution live imaging reporter of Wnt/beta-catenin signaling in the mouse. BMC Developmental Biology. 10, 121(2010).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- de Roo, J. J. D., et al. Axin2-mTurquoise2: A novel reporter mouse model for the detection of canonical Wnt signalling. Genesis. 55 (10), (2017).
- van de Moosdijk, A. A. A., van de Grift, Y. B. C., de Man, S. M. A., Zeeman, A. L., van Amerongen, R. A novel Axin2 knock-in mouse model for visualization and lineage tracing of WNT/CTNNB1 responsive cells. Genesis. 58 (9), 23387(2020).
- Choi, Y. S., et al. Distinct functions for Wnt/beta-catenin in hair follicle stem cell proliferation and survival and interfollicular epidermal homeostasis. Cell Stem Cell. 13 (6), 720-733 (2013).
- Nolan, G. P., Fiering, S., Nicolas, J. F., Herzenberg, L. A. Fluorescence-activated cell analysis and sorting of viable mammalian cells based on beta-D-galactosidase activity after transduction of Escherichia coli lacZ. Proceedings of the National Academy of Sciences of the United States of America. 85 (8), 2603-2607 (1988).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3, 751(2012).
- Bernkopf, D. B., Bruckner, M., Hadjihannas, M. V., Behrens, J. An aggregon in conductin/axin2 regulates Wnt/beta-catenin signaling and holds potential for cancer therapy. Nat Commun. 10 (1), 4251(2019).
- Joosen, L., Hink, M. A., Gadella, T. W., Goedhart, J. Effect of fixation procedures on the fluorescence lifetimes of Aequorea victoria derived fluorescent proteins. Journal of Microscopy. 256 (3), 166-176 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Reviews. 11, 227-256 (2005).
- Henriksson, J., et al. Endrov: an integrated platform for image analysis. Nature Methods. 10 (6), 454-456 (2013).
- Hedgepeth, C. M., et al. Activation of the Wnt signaling pathway: a molecular mechanism for lithium action. Developmental Biology. 185 (1), 82-91 (1997).
- Sato, N., Meijer, L., Skaltsounis, L., Greengard, P., Brivanlou, A. H. Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nature Medicine. 10 (1), 55-63 (2004).
- Ring, D. B., et al. Selective glycogen synthase kinase 3 inhibitors potentiate insulin activation of glucose transport and utilization in vitro and in vivo. Diabetes. 52 (3), 588-595 (2003).
- Liu, C., et al. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 108 (6), 837-847 (2002).
- Zeng, X., et al. Initiation of Wnt signaling: control of Wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions. Development. 135 (2), 367-375 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。