Method Article
Проточная цитометрия и конфокальный визуализационный анализ низкой экспрессии Wnt в репортерных тимоцитах Axin2-mTurquoise2
В этой статье
Резюме
Известно, что уровни передачи сигналов регулируют судьбу клеток, что указывает на то, что регуляция передачи сигналов Wnt представляет собой интересную терапевтическую мишень. В данной работе мы описываем методы анализа проточной цитометрии и конфокальной микроскопии для надежной канонической модели репортера Wnt мышей, которая измеряет различные уровни Wnt-сигнализации.
Аннотация
Измерение уровней экспрессии Wnt имеет важное значение при попытке идентифицировать или протестировать новые терапевтические мишени Wnt. Предыдущие исследования показали, что каноническая передача сигналов Wnt работает через механизм, управляемый дозировкой, что мотивирует необходимость изучения и измерения передачи сигналов Wnt в различных типах клеток. Несмотря на то, что было предложено несколько репортерных моделей для представления физиологической экспрессии Wnt, либо генетический контекст, либо репортерный белок сильно повлияли на валидность, точность и гибкость этих инструментов. В данной работе описаны методы получения и анализа данных, полученных с помощью модели репортера Wnt мыши Axin2-mTurquoise2, которая содержит мутировавший аллель Axin2em1Fstl . Эта модель облегчает изучение эндогенной канонической передачи сигналов Wnt в отдельных клетках в широком диапазоне активности Wnt.
В этом протоколе описывается, как в полной мере оценить репортерную активность Axin2-mTurquoise2 с помощью анализа клеточной популяции кроветворной системы в сочетании с маркерами клеточной поверхности или внутриклеточным окрашиванием β-катенином . Эти процедуры служат основой для осуществления и размножения в других тканях или клетках, представляющих интерес. Комбинируя флуоресцентно-активируемую сортировку клеток и конфокальную визуализацию, можно визуализировать различные канонические уровни экспрессии Wnt. Рекомендуемые стратегии измерения и анализа предоставляют количественные данные об уровнях флуоресцентной экспрессии для точной оценки канонической передачи сигналов Wnt. Эти методы будут полезны для исследователей, которые хотят использовать модель Axin2-mTurquise2 для канонических паттернов экспрессии Wnt.
Введение
Каноническая передача сигналов Wnt является консервативным сигнальным путем, участвующим в гомеостазе здоровых тканей, а также в развитии заболеваний. Было показано, что точная регуляция уровней передачи сигналов Wnt важна для эмбрионального развития, но также имеет большое значение для тканей взрослого человека. Было обнаружено, что каноническая передача сигналов Wnt играет важную роль в регенерации тканей нескольких органов, таких как кишечник, кожа и кроветворная система. Следовательно, когда передача сигналов Wnt нарушается, возникают тяжелые патологии. Колоректальный рак, рак печени и кожи, неврологические заболевания, а также некоторые гематологические злокачественные новообразования являются показательными патологиями, в которых нерегулируемая передача сигналов Wnt является причинным фактором или фактором. Таким образом, несколько ингибиторов для различных мишеней Wnt в настоящее время тестируются в клинических испытаниях в качестве Wnt-ассоциированных противораковых препаратов2.
Кроме того, наблюдаются интересные успехи в области терапевтического потенциала Wnt для неврологического восстановления, возрастных неврологических расстройств и врожденных расстройств аутистического спектра 3,4,5. Были исследованы сигналы Wnt для ex vivo экспансии стволовых клеток для последующей трансплантации6. Тем не менее, терапевтическое нацеливание на каноническую передачу сигналов Wnt является сложной задачей из-за его важности для многих основных клеточных функций и перекрестного взаимодействия с другими путями 7,8,9, что приводит к необходимости точного измерения эффектов этих терапевтических агентов Wnt в легко интерпретируемой модели. Каноническая передача сигналов Wnt управляется растворимыми Wnt-лигандами короткого действия, которые секретируются соседними клетками или в виде аутокринной экскреции, как это происходит в различных типах Wnt-чувствительных стволовых клеток.
Рецептор Wnt Frizzled и рецептор-ассоциированный белок липопротеинов (LRP) реагируют на эти лиганды, что запускает внутриклеточный сигнальный каскад. Когда передача сигналов Wnt выключена, комплекс деструкции, состоящий из ингибитора оси (аксин), гена-супрессора опухолей, аденоматозного полипоза кишечной палочки (APC), казеинкиназы1 (CK1α) и гликогенсинтазыкиназы (GSK-3β), предотвращает накопление β-катенина (CTNNB1) путем протеасомной деградации. При связывании Wnt лиганд-рецептор разрушающий комплекс инактивируется, что приводит к накоплению и стабилизации β-катенина в цитоплазме. Активный β-катенин может мигрировать в ядро, где он связывается с факторами транскрипции транскрипционного фактора/лимфоидного энхансер-связывающего фактора (TCF/LEF), чтобы инициировать транскрипцию генов-мишеней Wnt. Axin2 считается геном-мишенью, поскольку он является прямой мишенью пути Wnt10. Кроме того, Axin2 служит негативным регулятором, а также репортерным геном для активной канонической передачи сигналов Wnt11,12.
В литературе описано несколько канонических репортеров сигналов Wnt, которые были очень полезны для понимания роли передачи сигналов Wnt в эмбриональном развитии. Большинство из этих репортеров используют синтетически вставленные сайты связывания TCF/LEF, которые не используют эндогенный ген-мишень 13,14,15,16,17,18,19. Кроме того, были использованы стратегии Axin2, которые учитывают естественное местоположение гена 11,20,21,22,23, из которых Axin2-LacZ обычно считается наиболее надежным каноническим репортером Wnt 11. Однако репортерный белок LacZ, хотя и прост в использовании в большинстве тканей, требует субстрата β-галактозидазы, который признан агрессивным для живых клеток24. Особенно для стволовых клеток и тимоцитов, жесткие условия обнаружения LacZ увеличивают гибель клеток (собственные неопубликованные данные) при работе с клеточными суспензиями.
Несмотря на то, что усиление сигнала, вызванное окрашиванием LacZ, удобно обнаруживать слабые сигналы, оно делает количественное определение менее прямым и, следовательно, менее надежным. Таким образом, мышиная репортерная модель была разработана таким образом, чтобы имитировать генетическую стратегию Axin2-LacZ , но с репортерным белком21 mTurquoise2, чтобы обеспечить более прямое считывание и приближение к физиологическим уровням экспрессии. Флуоресцентный белок mTurquoise2 является отличной заменой LacZ благодаря своей высокой яркости (квантовый выход (QY) = 0,93), гибкости в сочетании с другими флуоресцентными белками для обширной характеристики клеточной поверхности и отсутствию необходимости в экзогенном субстрате. Кроме того, его тесное генетическое родство с зеленым флуоресцентным белком (GFP) дает возможность использовать большинство GFP-распознавающих флуоресцентных антител для более сильного обнаружения сигнала, если это необходимо, в клетках, чрезвычайно чувствительных к Wnt25.
Модель Axin2-mTurquoise2 является не только каноническим репортером Wnt, но и дает возможность изучать фенотипы гетерозиготы и гомозиготы Axin2 (нокаут Axin2 ). Целенаправленное введение mTurquoise2 в начальный сайт Axin2 приводит к разрушению белка Axin221. Поскольку Axin2, также известный как Conductin, является частью комплекса Wnt-деструкции, а комплекс деструкции жестко регулирует транскрипцию, опосредованную β-катенином, его частичное или полное отсутствие может представлять интерес для изучения различных патологий. Например, при колоректальном раке уровни Axin2 относительно высоки из-за гиперактивации Wnt11; Однако его роль в других патологиях до сих пор в значительной степени неизвестна. Несмотря на то, что считается, что Axin2 играет ограниченную роль в деградации β-катенина, его роль в регуляции Wnt может быть усилена добавлением небольшого пептида, который блокирует Wnt-опосредованныйрост колоректального рака.
В целом, тщательная регуляция Wnt с помощью терапевтических мишеней Wnt может открыть возможности для изменения начала или развития тяжелых патологий и должна быть дополнительно исследована на моделях с репортерной способностью. В этом отчете мы объясняем наш передовой метод анализа мышиной модели Axin2-mTurquoise2 для проточной цитометрии и конфокальной визуализации. В контексте уровней дозировки Wnt очень низкие канонические уровни передачи сигналов Wnt трудно обнаружить, для чего расширенные возможности обнаружения и анализа дают преимущество для полного использования преимуществ этой модели. Тимоциты используются в качестве модельной системы из-за их хрупкой жизнеспособности клеток, низкой канонической сигнальной экспрессии Wnt и конденсированной площади цитоплазмы для представления чувствительности обнаружения модели Axin2-mTurquoise2. Кроме того, объясняется процедура гистологического окрашивания общим β-катенином суспензий клеток тимоцитов для измерения уровней цитоплазматического β-катенина и проверки ядерно-активной канонической передачи сигналов Wnt в сочетании с репортером.
протокол
ПРИМЕЧАНИЕ: Все процедуры на мышах были проведены с одобрения Этического комитета по экспериментам на животных Медицинского центра Лейденского университета (LUMC). Самец и самка, в возрасте 6-12 недель, дикого типа (wt), у которых нет инсерции репортерной конструкции Axin2-mTurquoise2, гетерозиготные (Tg/0) с одной вставкой репортерной конструкции Axin2-murquoise2 и, таким образом, с одним нарушенным геном Axin2 , и гомозиготные (Tg/Tg) со вставкой репортерной конструкции Axin2-mTurquoise2 в оба аллеля и, таким образом, два нарушенных гена Axin2 ; Axin2-mTurquoise2 мыши (B6; мышей CBA-Axin2em1Fstl/J). Животные были принесены в жертву путем эвтаназии CO2 перед выделением органов. На протяжении всей процедуры сведите к минимуму воздействие света на образцы и постоянно держите их на льду или при температуре 4 °C, если не указано иное. Накройте образцы алюминиевой фольгой. Все действия должны выполняться в стандартной лаборатории с шкафом биобезопасности.
1. Приготовление суспензии клеток тимоцитов
- Извлекайте вилочковую железу у мышей осторожно без заражения крови, разрезая брюшную полость мышей и извлекая вилочковую железу с помощью щипцов. Храните/транспортируйте временно в ледяной холодной модифицированной среде Dulbecco's Medium (IMDM) от Iscove, содержащей 2,5% эмбриональной сыворотки теленка (FCS).
ПРИМЕЧАНИЕ: Во избежание пролития крови и возможного повреждения тимуса, не приносите мышей в жертву из-за вывиха шейки матки. - Приготовьте пробирку объемом 50 мл с клеточным фильтром 70 мкм и смочите фильтр 1 мл холодной среды IMDM/2,5% FCS.
- Разомните орган задним кончиком поршня шприца объемом 1 мл во время двукратного промывания холодной средой IMDM/2,5% FCS (Рисунок 1A). При желании добавьте конечную концентрацию 50 Ед/мл ДНКазы I в среду IMDM/2,5% FCS, чтобы предотвратить слипание мертвых клеток. Промойте фильтр 2 раза холодной средой IMDM/2,5% FCS и аккуратно суспендируйте в пробирке объемом 50 мл.
ПРИМЕЧАНИЕ: Не превышайте общий конечный объем 10 мл. Держите клетки на льду и в темноте для последующих шагов и когда их нельзя трогать. - Центрифугируйте при 330 × г в течение 5 мин при 4 °C и осторожно отсасывайте надосадочную жидкость из клеточной гранулы. Осторожно суспендируйте клеточную гранулу в холодной неполной среде IMDM/2,5% FCS и подготовьте к подсчету клеток.
ПРИМЕЧАНИЕ: При необходимости заморозьте и храните тимоциты в жидком азоте в FCS-10% диметилсульфоксиде для последующих экспериментов. Правильное замораживание и размораживание клеток уменьшит чрезмерную гибель клеток. В среднем, половина тимоцитов может подвергаться апоптозе после размораживания из-за естественного отбора Т-клеток в тимусе, что следует учитывать при принятии решения о том, сколько тимоцитов замораживать в одном криофлаконе. В одном флаконе следует замораживать не менее 2,5 ×10-6 тимоцитов.
2. Препарат проточной цитометрии тимоцитов
- Подготовьте тимоциты к процедуре окрашивания клеточной поверхности, получив 2,5 × 106 тимоцитов на каждый образец окрашивания в ледяном фосфатно-солевом буфере (PBS, pH 7,4) (рис. 1B). Подсчитайте количество живых клеток после размораживания, если тимоциты были ранее заморожены. При необходимости добавьте концентрацию ДНКазы I в размере 50 Ед/мл, чтобы предотвратить слипание мертвых клеток.
- Используйте панели для окрашивания антител для характеристики клеточной поверхности полного субпопуляции тимоцитов.
ПРИМЕЧАНИЕ: Можно выбрать и другие комбинации флуорохромов. Выберите редкие популяционные маркеры для ярких флуоресцентных флуорохромов и, если возможно, добавьте маркер живого-мертвого. Ни флуорохромы V450, ни V500 не следует использовать в сочетании с флуоресцентным репортером mTurquoise2 из-за спектрального перекрытия. Всегда проверяйте спектры флуоресценции mTurquoise2 в сочетании с синими и зелеными флуорохромами (дополнительный рисунок 1A).- Смешайте антитела в ранее определенных соотношениях линейно-отрицательных (Lin-) панелей отдельно в буфере PBS/0,2% бычьего сывороточного альбумина (BSA)/0,1% NaN3 (азид натрия).
Примечание: Все нежелательные клетки (нетимоциты, присутствующие в тимусе) окрашиваются в двухэтапном процессе вторичным антителом стрептавидина (в данном примере фикоэритрином (Pe)-Cy7 и аллофикоцианином (APC)-Cy7) и могут быть исключены с помощью «дамп-гейта» при анализе проточной цитометрии. - Смешайте антитела в заранее определенных соотношениях окрашивающей панели с двойным негативом (DN) с вторичным антителом к стрептавидину Pe-Cy7 в буфере PBS/0,2% BSA/0,1% NaN3 . Исключите из этой смеси панель Lin- (табл. 1).
- Смешайте антитела в ранее определенных соотношениях окрашивающей панели Immature Single Positive (ISP), Double Positive (DP) и Single Positive (SP) с вторичным антителом к стрептавидину APC-Cy7 в буфере PBS/0,2% BSA/0,1% NaN3 . Исключите из этой смеси панель Lin- (табл. 1).
- Во-первых, окрашивают тимоциты нежелательными не-Т-клеточными популяциями с использованием смесей первичных антител биотина из панелей Lin-, в течение 30 минут на льду в темноте.
ПРИМЕЧАНИЕ: Каждая Lin-панель представляет собой отдельный набор ячеек и поэтому не должна окрашиваться вместе в одном образце. - Уменьшите температуру до 300 × g, 4 °C в течение 5 минут и удалите надосадочную жидкость. Промойте тимоциты 150 μL ледяного PBS/0,2% BSA/0,1% NaN3 буфера и уменьшите при 300 × г, 4 °C в течение 5 минут.
- Окрашивание DN-панелью и ISP/DP/SP панелью соответствующего лин-окрашивания на 30 мин на льду в темноте. Уменьшите температуру до 300 × g, 4 °C в течение 5 минут и удалите надосадочную жидкость. Промойте тимоциты 150 μL ледяного PBS/0,2% BSA/0,1% NaN3 буфера и уменьшите при 300 × г, 4 °C в течение 5 минут.
- Смешайте антитела в ранее определенных соотношениях линейно-отрицательных (Lin-) панелей отдельно в буфере PBS/0,2% бычьего сывороточного альбумина (BSA)/0,1% NaN3 (азид натрия).
- Подготовьте клетки к измерению проточной цитометрии путем гомогенизации с помощью пробирки клеточного фильтра длиной 35 мкм и введения в буфер PBS/0,2% BSA/0,1% NaN3 . Защищайте клетки от света и держите на льду до и во время измерения проточного цитометра.
Примечание: NaN3 (азид натрия) очень токсичен и смертелен. Особую осторожность следует проявлять при работе с этим веществом. Тщательно вымойте руки после обработки и немедленно позвоните в токсикологический центр или к врачу в случае проглатывания NaN3 .
3. Измерение проточным цитометром
ПРИМЕЧАНИЕ: Неопытным пользователям следует сначала пройти обучение по проточному цитометру, так как измерение сигнала mTurquoise2 в сочетании с несколькими другими флуорохромами требует опыта и компетентного планирования эксперимента. Информацию о проточном цитометре см. в Таблице материалов .
- Запустите проточный цитометр в соответствии с инструкцией пользователя или другим установленным протоколом. Проверьте и, при необходимости, отрегулируйте набор полосового фильтра в проточном цитометре для оптимальной стратегии обнаружения флуоресценции.
ПРИМЕЧАНИЕ: Рекомендуемый фильтр для mTurquoise2 составляет 470/20 нм на ультрафиолетовой 405 нм, 407 нм или менее распространенной лазерной линии 440 нм. - Откалибруйте проточный цитометр, установив настройки компенсации с помощью компенсационных шариков и стабильно трансфицированных клеток 293T, экспрессирующих mTurquoise2.
ПРИМЕЧАНИЕ: Вместо компенсационных бусин можно использовать тимоциты с однократным окрашиванием. В этом случае компенсация бусинами была столь же эффективной и более удобной, чем с помощью ячеек.- Пометьте бусины каждым отдельным флуорохромом, использованным в эксперименте, и включите в них неокрашенные бусины. Измерьте шарики, чтобы настроить панель настройки компенсации, и измерьте клетки 293T, экспрессирующие mTurquoise2, поскольку нет подходящего флуорохрома для mTurquoise2, который можно было бы использовать на шариках. Сохраните настройки компенсации для использования в реальном эксперименте.
Примечание: Клетки, экспрессирующие mTurquoise2, используемые для настройки компенсации, должны быть такими же яркими или ярче, чем тимоциты, экспрессирующие mTurquoise2 в реальном эксперименте. Убедитесь, что в нем также присутствуют mTurquoise2-отрицательные 293T-клетки. - Для эксперимента включите окрашенные флуоресценцией минус один (FMO) тимоциты Tg/Tg, включая wt-образец для mTurquoise2 FMO и неокрашенный образец тимоцитов каждого генотипа мыши в качестве положительного контроля для анализируемой части.
ПРИМЕЧАНИЕ: Эти элементы управления важны для правильной настройки стробов для положительных клеток. Остальные экспериментальные образцы окрашиваются с помощью комплектной окрашивающей панели (табл. 1).- Создайте эксперимент, добавьте и назовите количество пробирок в программном обеспечении проточного цитометра, а также создайте диаграммы рассеяния для визуализации окрашенных клеток для полного набора флуорохромов.
- Примените к эксперименту ранее установленные настройки компенсации. Отрегулируйте прямое рассеяние (FSC) и боковое рассеяние (SSC) с неокрашенными wt тимоцитами до тех пор, пока на диаграмме рассеяния не будет видна полная популяция клеток. Сначала измерьте неокрашенные тимоциты, экспрессирующие Tg/Tg mTurquoise2, чтобы убедиться, что положительная популяция видна.
- Измерьте полностью окрашенный образец тимоцитов Tg/Tg и проверьте наличие всех комбинаций флуорохромов. При необходимости отрегулируйте ранее установленные значения компенсации для флуорохромов, которые показывают неправильную компенсацию. Измерьте остальные экспериментальные образцы и не регулируйте никаких настроек во время измерения образцов.
ПРИМЕЧАНИЕ: Последующая корректировка компенсации также может быть выполнена в программном пакете для анализа. Хотя количество доступных ячеек может быть ограничивающим фактором, рекомендуется выполнить этот шаг во время измерения. Для сравнения значений интенсивности mTurquoise2 установите одинаковые настройки между всеми образцами.
- Пометьте бусины каждым отдельным флуорохромом, использованным в эксперименте, и включите в них неокрашенные бусины. Измерьте шарики, чтобы настроить панель настройки компенсации, и измерьте клетки 293T, экспрессирующие mTurquoise2, поскольку нет подходящего флуорохрома для mTurquoise2, который можно было бы использовать на шариках. Сохраните настройки компенсации для использования в реальном эксперименте.
4. Проточный цитометрический анализ
ПРИМЕЧАНИЕ: Проточный цитометрический анализ проводился с использованием специального программного обеспечения, указанного в Таблице материалов; Тем не менее, доступны и другие программы проточного цитометрического анализа.
- Гейт живых клеток и субпопуляций тимоцитов в соответствии со значениями FSC и SSC.
- Проверьте настройки компенсации в диалоговом окне матрицы компенсации , расположенном слева от образца, чтобы убедиться в отсутствии интерференции флуорохрома и в том, что была произведена надлежащая компенсация во избежание перетекания или просвечивания.
- Если матрица, определенная для сбора данных, должна быть скорректирована, измените значения в матрице компенсации, просто увеличив или уменьшив значение компенсации каждой комбинации флуорохрома таким образом, чтобы популяция не показывала почти идеальную горизонтальную или вертикальную линию (дополнительный рисунок 1B).
- Чтобы визуально распределить интенсивность mTurquoise2 для правильного положительного стробирования, измените отображение по оси X mTurquoise2 на линейное (дополнительный рисунок 2).
- Используйте регулятор mTurquoise2 FMO в качестве отрицательного регулятора для стробирования положительного сигнала mTurquoise2. Проверьте правильное пороговое стробирование для популяции клеток (рисунок 2).
ПРИМЕЧАНИЕ: Контрольные ячейки (wt) mTurquoise2 FMO не имеют маркера mTurquoise2 и, следовательно, могут использоваться в качестве фонового порога для активности репортера Axin2.
- Используйте регулятор mTurquoise2 FMO в качестве отрицательного регулятора для стробирования положительного сигнала mTurquoise2. Проверьте правильное пороговое стробирование для популяции клеток (рисунок 2).
- Gate mTurquoise2-положительные клетки с соответствующим каналом детектирования для определения количества Wnt-положительных клеток.
- Вычислите среднее геометрическое и медиану, чтобы определить величину интенсивности флуоресценции в интересующих клетках.
- Нажмите на Статистика | Добавьте статистику внутри панели, показывающую mTurquoise2-положительные клетки.
- Определите статистический метод, интересующую популяцию и канал обнаружения mTurquoise2 и нажмите кнопку Добавить. Представьте среднее геометрическое и медианную интенсивность флуоресценции в условных единицах (AU) для построения графиков.
ПРИМЕЧАНИЕ: Медиана представляет собой среднее значение интенсивности флуоресценции и, следовательно, предоставляет информацию о сдвиге интенсивности флуоресцентной популяции. При необходимости коррекция фона может помочь получить более четкую визуализацию динамического диапазона активности репортера mTurquoise2. Это можно сделать путем вычитания частот фонового окрашивания wt из общей частоты mTurquoise2-положительных клеток конкретного типа клеток, которые забиты.
5. Подготовка цитоспинов тимоцитов к конфокальной визуализации
ПРИМЕЧАНИЕ: Цитоспины тимоцитов рекомендуются при работе с клеточными суспензиями неадгезивных клеток. Поскольку экспрессия Axin2-mTurquoise2 в тимоцитах ниже, чем в эпителиальных клетках тимуса, для визуализации использовали отфильтрованные суспензии клеток тимоцитов.
- Начните с клеточной суспензии из свежесобранных или замороженных тимоцитов. Суспендируйте ~20 000 тимоцитов в 100 мкл холодного PBS/0,5% BSA/10% FCS на генотип тимоцитов.
ПРИМЕЧАНИЕ: При необходимости аккуратно размораживайте клетки, чтобы сохранить максимальную жизнеспособность клеток при работе с ранее замороженными тимоцитами. Это поможет снизить аутофлуоресценцию при визуализации клеток. Проверьте жизнеспособность клеток, чтобы убедиться в качестве образца. При процедуре цитоспина используется механическая сила, адаптированная к хрупкому тимоциту; Тем не менее, для этого требуется очень жизнеспособная начальная популяция. Чтобы обеспечить более высокую жизнеспособность, рекомендуется начинать со свежесобранных, а не замороженных тимоцитов. - Предварительно смочите область вокруг отверстия фильтрующих карт с помощью PBS. Соберите держатель камеры для образцов цитоспина в соответствии с инструкцией (рисунок 1C).
- Поместите карту фильтра на предметное стекло (гладкой стороной против предметного стекла). Поместите оба предмета на держатель камеры для образцов. Позаботьтесь о том, чтобы поместить фильтровальную карту точно в отверстие держателя камеры для образцов, а весь держатель камеры для образцов поместите в ротор.
- Тщательно ресуспендируйте тимоциты и добавьте 100 мкл клеточной суспензии в камеры для образцов. Вращайте суспензию тимоцитов в течение 4 мин при ~350 × г на предметных стеклах. Осторожно снимите фильтрующую карту с предметного стекла, не касаясь ячеек. Высушите цитоспины на воздухе в течение от 1 часа до ночи при комнатной температуре.
ПРИМЕЧАНИЕ: При работе с другими типами клеток проверяйте различную плотность клеток для достижения оптимальных результатов. Цитоспины можно замораживать при температуре -20 °C в герметичной коробке для последующих экспериментов. Разморозьте цитоспины для дальнейшей обработки в течение 1 ч при комнатной температуре.
6. Иммуноокрашивание цитоспином с общим β-катенином
- Зафиксируйте цитоспины на 15 мин при комнатной температуре в 100% метаноле. Высушите слайды на воздухе в течение 10 минут при комнатной температуре. Нарисуйте круг вокруг популяции тимоцитов на предметном стекле с помощью гидрофобной ручки.
ПРИМЕЧАНИЕ: Этот этап фиксации оптимизирован специально для окрашивания β-катенином. - Поместите предметные стекла в PBS/0,05% Tween-20 на 10 минут при комнатной температуре, а затем перенесите их в темную влажную коробку на этапах блокировки и инкубации. Добавьте 100 μл PBS/10% нормальной сыворотки мыши (NMS) на предметное стекло и оставьте во влажной коробке на 10 минут при комнатной температуре. Коснитесь предметного стекла, чтобы удалить 10% NMS, добавьте 100 μL PBS/10% обычной козьей сыворотки (NGS) на предметное стекло и оставьте во влажной коробке на 30 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Инкубация с PBS/10% NMS блокирует связывание неспецифических первичных антител (Рисунок 1D), в то время как PBS/10% NGS блокирует связывание неспецифических вторичных антител. - Подготовьте дополнительные антитела для клеточного окрашивания. Смешайте 0,5 мкг общего антитела к β-катенину с фрагментами, меченными AF568.
ПРИМЕЧАНИЕ: В этих условиях коммерчески доступный набор для мечения первичного антимышиного общего β-катенина вторичными фрагментами IgG1 Fab козьего антимышиного типа с флуорохромной меткой Alexa Fluor 568 (AF568) перед добавлением его в тимоциты. Выполняйте маркировку в соответствии с протоколом производителя, так как может потребоваться проверка нескольких концентраций. Используйте общее антитело, меченное β-катенин-AF568, в течение 30 минут. - Добавьте 50 мкл (0,5 мкг) от общего количества антител, меченных β-катенин-AF568, на предметное стекло цитоспина в течение ночи при 4 °C во влажной коробке. Включите контроль отрицательного окрашивания в соответствии с протоколом производителя или контроль изотипа в случае протокола прямой маркировки.
- Стирать в течение 20 минут с PBS/0,05% Tween-20 при комнатной температуре. Затем промыть в течение 20 мин с PBS при комнатной температуре в банке с помешиванием. Выполните второй этап фиксации для обеспечения связывания антитела с антигеном: 10 мин при комнатной температуре со 100 мкл 4% параформальдегида (PFA) в PBS во влажной коробке.
ПРИМЕЧАНИЕ: Храните слайды в темноте. Ни метанол, ни фиксация PFA не оказывают существенного влиянияна экспрессию mTurquoise227. - Окуните слайды в PBS. Провести ядерное окрашивание 50 μл TO-PRO-3 (1:1500) в течение 10 минут при комнатной температуре во влажном боксе. Вымыть предметные стекла в течение 20 мин PBS при комнатной температуре в банке при помешивании.
ПРИМЕЧАНИЕ: Концентрацию TO-PRO3 можно титровать в зависимости от использования других флуорохромов с близкими флуоресцентными спектрами. - Заделайте образцы с реагентом против выцветания в соответствии с протоколом производителя и накройте покровным стеклом. Сушить на воздухе в течение 24 часов при комнатной температуре. Просматривайте слайды непосредственно под флуоресцентным или конфокальным микроскопом или храните при температуре -20 °C для последующей визуализации.
7. Конфокальные микроскопические измерения
ПРИМЕЧАНИЕ: Информацию о конфокальном микроскопе см. в Таблице материалов .
- Включите конфокальный микроскоп в соответствии с инструкцией или установленным протоколом. Используйте отрицательные и положительные элементы управления клеточной линией mTurquoise2 293T для первичной регулировки конфокальных настроек. Затем используют тимоциты Axin2-mTurquoise2 и Tg/Tg (нокаут) Axin2-mTurquoise2 в качестве отрицательного и положительного контроля, соответственно, чтобы гарантировать недопущение недостаточной экспозиции сигнала mTurquoise2.
- Подготовьте программное обеспечение для последовательного сканирования, запрограммировав лазеры и ширину фильтров. Начните с лазерной линии с самой высокой длиной волны и двигайтесь к самой низкой длине волны. После установки всех этапов последовательного сканирования загрузите образец на предметный столик микроскопа, сфокусируйте образец и нажмите кнопку Live для оптимизации мощности лазера и интеллектуального усиления с помощью соответствующих кнопок на конфокальном программном обеспечении или дополнительной ручной панели.
ПРИМЕЧАНИЕ: Образец предметного стекла не следует визуализировать для количественного определения сигнала, так как потенциально может произойти потенциальное фотообесцвечивание. Тем не менее, mTurquoise2 обладает высокойфотостабильностью 25. - В случае очень низкой экспрессии mTurquoise2 увеличьте мощность лазера и Smart Gain до тех пор, пока не будет наблюдаться флуоресцентный сигнал, и проверьте с помощью отрицательного контрольного образца, чтобы убедиться в истинном положительном сигнале. Визуализируйте тимоциты с помощью масляной линзы 40x 1,4, масляной линзы 63x 1,4 или масляной линзы 100x 1,4.
ПРИМЕЧАНИЕ: Для этого исследования использовался микроскоп Leica SP5. - Используйте эти настройки конфокальной визуализации на микроскопе перед измерением образца.
- Настройте диапазон значений интенсивности на 12-битное изображение, нажав на Конфигурация | Настройки | измените значение на 12-битное в опции Битовая глубина , чтобы создать более широкую шкалу интенсивности и, таким образом, большее различие между низкими и высокими флуоресцентными сигналами.
- Отрегулируйте разрешение изображения, нажав на XY, и увеличьте Формат до 1024 x 1024, что также удвоит время сканирования. Отрегулируйте скорость сканирования на 400-600 Гц, нажав на Скорость | Более того , можно вручную изменить настройки. Кроме того, активируйте опцию Двунаправленное сканирование.
- Отрегулируйте ползунок чувствительности, чтобы уменьшить фоновый сигнал. Оптимизируйте правильную мощность лазера и интеллектуальное усиление с помощью опции Quick LUT (Look-Up Table).
ПРИМЕЧАНИЕ: В 12-битном изображении ползунок имеет значение интенсивности шкалы серого от 0 до 4095. Это также можно сделать позже с помощью бесплатного оффлайн программного обеспечения Las X. Зеленым цветом будет показан черный фон, а синим цветом будут показаны насыщенные пиксели образца.
- Когда все настройки изображения будут оптимизированы, измерьте образец, нажав кнопку «Пуск», что запустит последовательное изображение всех трех каналов.
- Измерьте ядерный флуоресцентный сигнал TO-PRO-3. Детектирование TO-PRO-3 с помощью лазера 633 нм и HyD 640-750 нм.
ПРИМЕЧАНИЕ: В этой конфигурации использовалось 6% мощности лазера при 15% интеллектуального усиления. Эта настройка может меняться в зависимости от интенсивности окрашивания TO-PRO-3. Если он очень яркий, он может влиять на флуорохромы более низкой интенсивности при перевозбуждении. В таком случае уменьшите концентрацию окрашивания. - Измерьте ядерные и цитоплазматические флуоресцентные сигналы β-катенина. Детектирование β-катенина с помощью лазера 561 нм и HyD 580-605 нм. Накапливайте до 2 сканов для одного изображения, регулируя настройку в блоке XY в программном обеспечении со средним значением строки 2 в случае низкого сигнала AF568.
ПРИМЕЧАНИЕ: В этой конфигурации использовалось 85% мощности лазера при 87% интеллектуального усиления. - Измерьте цитоплазматический флуоресцентный сигнал mTurquoise2. Детектирование mTurquoise2 с помощью лазера с длиной волны 458 нм и HyD с длиной волны 490-600 нм. Накапливайте до 4 сканов для одного изображения, регулируя настройку в поле XY в программном обеспечении со средним значением строки 4 в случае низкого сигнала mTurquoise2.
ПРИМЕЧАНИЕ: Из-за старых лазеров на конфокальном микроскопе, используемого для этого протокола, и низкого сигнала mTurquoise2, 405 нм использовалась при 90% мощности лазера, наряду с лазерами 458 нм и 476 нм при 100% мощности лазера с HyD 490-550 нм при 100% интеллектуальном усилении. Наиболее оптимальным является лазер с длиной волны 440 нм, хотя и реже присутствующий на конфокальном микроскопе. С высокой мощностью лазера следует обращаться осторожно и выполнять только с помощью последовательной визуализации. Убедитесь, что установлены аварийные настройки, чтобы избежать передержки датчика. Мощность лазера на других конфокальных микроскопах может быть ниже предложенных в этом протоколе из-за более мощных или новых лазеров. Перед получением изображения можно провести тест на обесцвечивание, чтобы убедиться в отсутствии потери флуоресцентного сигнала. В предложенной конфигурации фотообесцвечивание mTurquoise2 было приемлемым. - Выполняйте визуализацию в светлом поле для полной визуализации клеток. Детектируйте тимоциты с помощью лазера с длиной волны 488 нм и PMT Scan-DIC. Экспортируйте файлы Lif для анализа изображений.
ПРИМЕЧАНИЕ: В этой конфигурации использовалось 59% мощности лазера с коэффициентом усиления 212 В и смещением данных -4,3%. Файлы Lif могут быть прочитаны в автономном программном обеспечении LAS x для коррекции изображений.
- Измерьте ядерный флуоресцентный сигнал TO-PRO-3. Детектирование TO-PRO-3 с помощью лазера 633 нм и HyD 640-750 нм.
8. Конфокальный микроскопический анализ
- Анализируйте изображения с помощью программного обеспечения для обработки изображений28 (Дополнительный рисунок 3). Загрузите изображения в программу.
ПРИМЕЧАНИЕ: Допускаются различные форматы, но рекомендуется использовать файлы TIFF с таблицей LUT или прямой импорт файлов Lif в программное обеспечение для обработки изображений. - Измерьте активный сигнал β-катенина в ядрах тимоцитов.
- Выберите ядра окрашенных TO-PRO-3 тимоцитов на красно-сером изображении для анализа активного β-катенина. Сделайте это вручную, или воспользуйтесь автоматическим выбором ячеек в программном обеспечении.
ПРИМЕЧАНИЕ: Для автоматического выбора клеток может потребоваться обработка изображений для правильного определения пороговых значений и анализа частиц. Ручной выбор ячеек может быть трудоемким, но, как правило, не требует какой-либо обработки изображений и рекомендуется в этом протоколе. - Активируйте ручной выбор с помощью любого из инструментов выбора на рабочей панели.
- Выберите контур ядра и добавьте его в диспетчер областей интереса (ROI). Активируйте менеджер ROI, нажав на кнопку «Анализ» | Инструменты | Менеджер ROI, и когда откроется новое окно менеджера ROI, нажмите на первую опцию Добавить (t) или используйте сочетание клавиш t. Повторяйте предыдущий шаг до тех пор, пока все ядра не будут определены и добавлены в менеджер ROI. Используйте опцию Показать все в менеджере ROI для визуализации выбранных ячеек.
- Выберите >3 области фона, в которых нет ячеек, и добавьте их в менеджер ROI.
ПРИМЕЧАНИЕ: Размер и форма в данном случае не имеют значения. Эти области будут служить для измерения фонового шума для окончательного расчета.- Определите измерение на изображении, нажав на кнопку «Анализ» | Установите мерки. В открывшемся новом окне с различными параметрами измерения активируйте Площадь, Интегрированную плотность и Среднее значение серого | нажмите «ОК».
- Активируйте изображение с серым значением β-катенина, щелкнув по нему, и визуализируйте выбранные ядра и области фона, нажав на кнопку «Показать все » в менеджере ROI. Наблюдайте за всеми выделенными областями, которые теперь видны на изображении с β-катенином.
- Нажмите на «Измерить » в менеджере ROI или нажмите на «Анализ» | Измерьте. Обратите внимание на новое окно «Результаты », в котором отображаются результаты сигнала β-катенина в пределах ROI.
- Перенесите результаты в программу для расчетов электронных таблиц, нажав на кнопку «Правка» | Выберите все; и скопируйте/вставьте список в таблицу для дальнейшего расчета. Сохраните менеджер ROI для дальнейшего использования без необходимости повторять выбор ядер, нажав на Еще | Спасать....
- Для автоматического выбора ячеек сделайте дубликаты (Ctrl D) обрабатываемого изображения, так как многие настройки обработки изображения нельзя отменить.
ПРИМЕЧАНИЕ: Автоматизированная маркировка ядер в большинстве случаев требует обработки изображений для автоматического и точного определения ядер. Обработка изображения должна выполняться только в целях выделения области. Обработанные изображения бесполезны для измерения интенсивности флуоресцентной лампы, поскольку значения пикселей изменяются.- Выполните фильтр по Гауссу, нажав на Процесс | Фильтры | Размытие по Гауссу для сглаживания изображения. Протестируйте несколько значений сигма (радиус) и активируйте опцию предварительного просмотра, чтобы визуализировать эффект, прежде чем нажать OK.
- Инвертируйте изображение, нажав на Редактировать | Инвертировать. Проверьте яркость и контрастность, нажав на Изображение | Настройка | Яркость/контрастность. Используйте опцию Авто или, что предпочтительнее, вручную измените значения.
ПРИМЕЧАНИЕ: Не применяйте изменения, так как это приведет к изменению свойств изображения. Просто закройте окно B&C , когда желаемое изображение будет получено. - Создайте порог, нажав на Изображение | Настройка | Порог и определите наилучшие настройки порога, при которых все ячейки будут наиболее заметны. Нажмите « Применить », чтобы применить настройки порога.
ПРИМЕЧАНИЕ: Если пороговое значение не было применено к ячейкам, в которых видны отверстия, нажмите на кнопку Обработать | Двоичный | Заполните отверстия , чтобы заполнить пробелы внутри ячеек. Если ячейки объединены вместе с настройками порога, нажмите на Процесс | Двоичный | Водораздел для разделения этих клеток. Тонкая линия в 1 пиксель разделит любую ячейку, которую программа интерпретирует как слитую. - Определите наименьшее и самое большое ядро на изображении, вручную выбрав выбранное ядро с помощью инструмента Произвольное выделение , добавьте его в менеджер ROI и измерьте Площадь.
- Проанализируйте частицы (ядра), нажав на кнопку «Анализировать» | Проанализируйте частицы и вставьте самую маленькую и самую большую площади в поле Размер (^2) с дефисом (-) между ними. Активируйте поля Отображать результаты, Добавить в менеджер и Исключить по краям , прежде чем нажать OK . Перейдите к шагу 8.2.3, чтобы завершить протокол.
- Выберите ядра окрашенных TO-PRO-3 тимоцитов на красно-сером изображении для анализа активного β-катенина. Сделайте это вручную, или воспользуйтесь автоматическим выбором ячеек в программном обеспечении.
- Измерьте цитоплазматические сигналы mTurquoise2 и β-катенина в тимоцитах.
- Выберите контур цельных тимоцитов на светлопольном изображении, выполнив те же действия, что и выше.
- Выберите >3 области фона, в которых нет ячеек, и добавьте их в менеджер ROI.
ПРИМЕЧАНИЕ: Размер и форма в этом случае не имеют значения. Эти области будут служить для измерения фонового шума для окончательного расчета.- Активируйте изображение с серым значением mTurquoise2, щелкнув по нему, и визуализируйте выбранные общие ROI ячеек и области фона, нажав на «Показать все » в менеджере ROI. Наблюдайте за всеми выделенными областями, которые видны на изображении mTurquoise2.
- Нажмите на «Измерить » в менеджере ROI или нажмите на «Анализ» | Измерьте. Обратите внимание на новое окно результатов , которое открывается с результатами измерений сигнала mTurquoise2.
- Перенесите результаты в программу для расчетов электронных таблиц, нажав на кнопку «Правка» | Выберите все и скопируйте/вставьте список в таблицу для дальнейшего расчета.
- Активируйте изображение серого цвета β-катенина, щелкнув по нему, и визуализируйте выбранные общие ROI ячеек и области фона, нажав на кнопку «Показать все » в менеджере ROI. Наблюдайте за всеми выделенными областями, которые видны на изображении с β-катенином.
- Нажмите на «Измерить » в менеджере ROI или нажмите на «Анализ» | Измерьте. Обратите внимание на новое окно «Результаты », которое открывается с результатами измерения общего сигнала клеточного β-катенина.
- Перенесите результаты в программу для расчетов электронных таблиц, нажав на кнопку «Правка» | Выберите все и скопируйте/вставьте список в таблицу для дальнейшего расчета. Сохраните менеджер ROI для дальнейшего использования без необходимости повторять выбор ячеек, нажав на Еще | Спасать....
- Рассчитайте скорректированную общую ядерную флуоресценцию (CTNF) для активного β-катенина, используя уравнение 1.
CTNF = Интегрированная плотность - (Площадь × среднее от средних фоновых площадей) (1) - Рассчитайте скорректированную общую флуоресценцию клеток (CTCF) для mTurquoise2, используя уравнение 2.
CTCF = Интегрированная плотность - (Площадь × среднее от средних фоновых площадей) (2) - Дифференцируйте активный ядерный β-катенин и цитоплазматический β-катенин путем вычитания значений ядерного β-катенина, полученных на шаге 8.2.3.3. Из общих значений клеточного β-катенина, полученных на шаге 8.3.2.5, получить цитоплазматический неактивный β-катенин.
ПРИМЕЧАНИЕ: Убедитесь, что измерения выполняются в пределах одной ячейки.- Вычислите среднее значение Средней интенсивности фоновых областей. Рассчитаем CTNF и CTCF с помощью уравнений 1 и 2. Рассматривайте IntDen (сумму всех пикселей в выбранной области) в качестве интегрированной плотности, а не RawIntDen.
- При необходимости рассчитайте стандартное отклонение значений IntDen для построения графиков. Рассмотрим до 200 отдельных ячеек для статистического анализа с помощью U-критерия Манна-Уитни.
- Отобразите результаты на графике отдельных точек данных и обозначьте ось y значениями CTNF или CTCF как относительные флуоресцентные единицы (RFU).
Результаты
Для исследования роли канонической передачи сигналов Wnt была протестирована каноническая репортерная модель Wnt Axin2-mTurquoise2 в сочетании с экспрессией белка β-катенина. Тимоциты, как известно, хрупки, демонстрируют низкую каноническую передачу сигналов Wnt на нескольких этапах процесса созревания тимоцитов и имеют низкое цитоплазматическое отношение к ядерному ядру; Все эти факторы препятствуют выявлению цитоплазматического mTurquoise2 или β-катенина. Следуя протоколу, тимоциты мышиного Axin2-mTurquoise2 были собраны из тимуса и обработаны в одиночные клеточные суспензии для проточного цитометрического и цитоспинового конфокального анализа (Рисунок 1) как Axin2-mTurquoise2, так и общего β-катенина.
Проточный цитометрический анализ облегчает характеристику различных стадий созревания тимоцитов для измерения присутствия флуорохрома mTurquoise2 на субпопуляцию клеток в качестве репортерного белка для активной канонической передачи сигналов Wnt. В генотипах Axin2-mTurquoise2 сигнал дикого типа (wt), гетерозиготы (Tg/0) и гомозиготы (Tg/Tg)-mTurquoise2 присутствовал в возрастающих уровнях, что представляет собой уровень активации канонической передачи сигналов Wnt в двойных положительных (DP) тимоцитах (рис. 2). Поскольку в него не вставлен белок mTurquoise2, wt уровни mTurquoise2 демонстрируют фоновый шум; тем не менее, каноническая передача сигналов Wnt все еще может происходить в этих клетках, но просто не визуализируется с помощью репортера. Несмотря на это, отсутствие одного (Tg/0) или двух (Tg/Tg) генов Axin2 может повлиять на каноническую сигнальную активность Wnt, поскольку Axin2 играет важную роль в комплексе деструкции для негативной регуляции активной канонической передачи сигналов Wnt.
Для исследования уровней экспрессии репортерной модели Axin2-mTurquoise2 можно исследовать либо среднюю, либо медианную интенсивность флуоресценции. Медиана интенсивности флуоресценции и среднее геометрическое (рис. 2C) являются первым и вторым наиболее предпочтительными графическими представлениями для гистограмм флуоресценции. Увеличение экспрессии Axin2 в Tg/Tg по сравнению с Tg/0 указывает на повышенную активацию канонической передачи сигналов Wnt из-за отсутствия функционального Axin2 и, следовательно, дисфункционального комплекса разрушения. Для дальнейшей верификации уровней активации канонического сигнального пути Wnt было проведено цитоспиновое иммуноокрашивание общим β-катенином в тимоцитах Axin2-mTurquoise2. Поскольку клеточное расположение β-катенина указывает на то, активируется ли каноническая передача сигналов Wnt, мы измерили присутствие либо ядерного, либо цитоплазматического β-катенина.
mTurquoise2 экспрессируется в цитозоле и в первую очередь виден вокруг ядер (изображен красным цветом TO-PRO-3 на рисунке 3A). Поскольку тимоциты имеют очень мало цитоплазмы, выбор области должен быть выполнен тщательно, чтобы измерить весь сигнал (дополнительный рисунок 3). Особую осторожность следует проявлять при ложноположительном окрашивании или сигнале автофлуоресценции, на что указывают белые стрелки. Эти флуоресцентные сигналы обычно производятся клеточным мусором и были видны на изображениях mTurquoise2 и AF568 (рис. 3B,C и рис. 3D,E). Неокрашенные контрольные изображения показывают, что mTurquoise2 также виден в этих тимоцитах, хотя они не содержат репортерную конструкцию Axin2-mTurquoise2. Этот фоновый шум, вероятно, обусловлен автофлуоресценцией и компактной цитоплазмой в тимоцитах29. Тем не менее, при тщательном выборе области и правильной коррекции фона с использованием формулы CTCF, на рисунке 3B показана возрастающая экспрессия Axin2-mTurquoise2 в пантимоцитах, как видно при проточном цитометрическом анализе в тимоцитах DP.
Чтобы лучше понять влияние поврежденного гена Axin2 из-за репортерной конструкции Axin2-mTurquoise2 на комплекс деструкции и, следовательно, присутствие β-катенина, мы измерили экспрессию ядерного или цитоплазматического β-катенина AF568 в тимоцитах. Активная каноническая передача сигналов Wnt обусловлена миграцией β-катенина в ядро, где он будет взаимодействовать с факторами транскрипции TCF/LEF и впоследствии активировать Axin2 в качестве гена-мишени, чтобы ослабить активацию пути. Поскольку Axin2 является частью комплекса деструкции, который играет важную роль в нацеливании цитоплазматического β-катенина на протеасомную деградацию, отсутствие или нарушение белка Axin2 может привести к накоплению ядерного и/или цитоплазматического β-катенина.
Мы показываем, что гетерозиготы (Tg/0) Axin2-mTurquoise пантимоциты имеют меньшую ядерную и цитоплазматическую экспрессию β-катенина по сравнению с диким типом (wt), что позволяет предположить, что регуляция самого β-катенина изменена. Однако в гомозиготных (Tg/Tg) пан-турюзовых пантимоцитах ядерный β-катенин выше, чем в wt, хотя цитоплазматический β-катенин сходен между обоими генотипами (рис. 3C). Это говорит о том, что измерение общего уровня β-катенина может дать дополнительную информацию о каноническом пути Wnt в отличие от прямого измерения нефосфорилированного β-катенина, который специфически обнаруживает β-катенин, не предназначенный для протеасомной деградации. Тем не менее, следует иметь в виду, что регуляция β-катенина в направлении канонической экспрессии генов, управляемых Wnt, такой как Axin2, регулируется несколькими другими белками, которые не были протестированы в этом протоколе.

Рисунок 1: Схематический и упрощенный обзор протокола. (A) процессинг тимуса в клеточную суспензию, (B) протокол проточной цитометрии, (C) сборка цитоспина, (D) протокол внутриклеточного окрашивания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
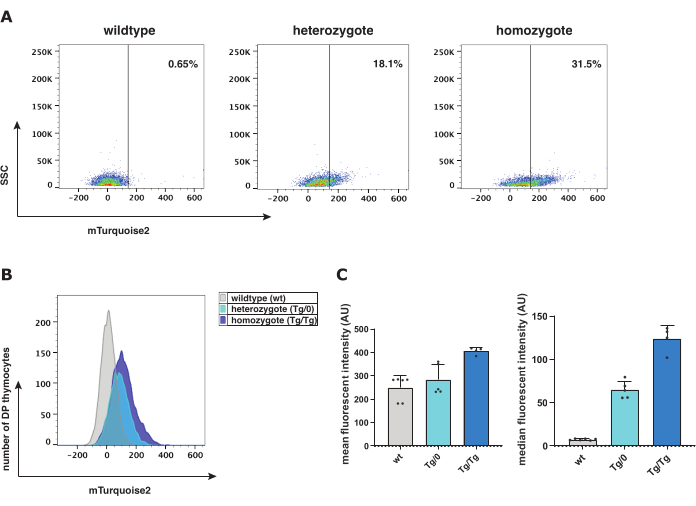
Рисунок 2: Анализ проточной цитометрии мышей дикого типа (wt), гетерозиготы (Tg/0) и гомозиготы (Tg/Tg) Axin2-mTurquoise2. (A) Представление точечной диаграммы с гейтированием тимоцитов mTurquoise2 DP и перемещением популяции в соответствии с генотипом Axin2-mTurquoise2. (B) Представление гистограммы mTurquoise2, показывающей диапазоны интенсивности флуоресценции между мышиными генотипами тимоцитов DP. (C) Гистограмма, показывающая среднюю и медианную интенсивность флуоресценции со стандартным отклонением генотипов Axin2-mTurquoise2 в тимоцитах DP (всего 5 масс; 5 Tg/0 и 4 Tg/Tg мышей). Сокращения: DP = двойное положительное. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
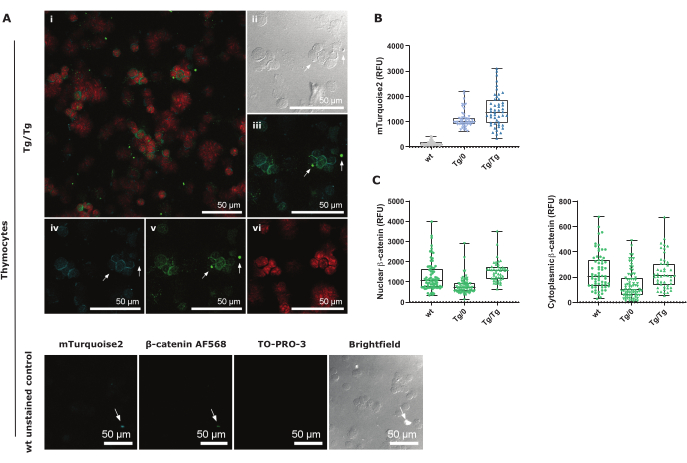
Рисунок 3: Конфокальное изображение процедуры тотального цитоспина тимоцитов и контрольной группы, визуализированное с 40-кратным увеличением с коэффициентом увеличения 1,5 . (A) Tg/Tg (гомозигота) тимоциты Axin2-mTurquoise2, окрашенные ядерным TO-PRO-3 и общим β-катенином AF568, а также эндогенной экспрессией цитоплазматического mTurquoise2. i — наложенное конфокальное изображение всех трех цветов; ii — светлопольное изображение; iii - это наложение Axin2-mTurquoise2 и общего β-катенина AF568; iv — крупный план mTurquoise2; v — общий β-катенин AF568 крупным планом; vi — это ядерный TO-PRO-3 крупным планом. Нижняя панель содержит незапятнанные контрольные изображения для каждого отображаемого канала. Белые стрелки обозначают идентичное местоположение на всех изображениях и демонстрируют ложное срабатывание сигнала из-за обломков. Масштабные линейки = 50 мкм. (B) Ящичковое представление значений интенсивности CTCF mTurquoise2 для всех генотипов Axin2-mTurquoise2 (50-70 клеток на генотип). (C) Блочная диаграмма представления значений общей интенсивности β-катенина AF568 CTNF и CTCF-CTNF для ядерного активного β-катенина и неактивного цитозольного β-катенина, соответственно, для всех генотипов Axin2-mTurquoise2 (50-70 клеток на генотип). Сокращения: CTCF = скорректированная общая флуоресценция клеток; CTNF = скорректированная общая ядерная флуоресценция; RFU = относительные флуоресцентные единицы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Панель окрашивания DN | Флуорохром | Антитело |
| ФИТК | КД127 | |
| ПЭ | СД25 | |
| ПЭ-CY7 | Стрептавидин (SAV) | |
| БТР | СД117 | |
| БТР-CY7 | КД44 | |
| ПерХПГ | КД135 | |
| В450 | x | |
| В500 | x | |
| Лин- | ||
| Биотин | Тер119 | |
| ГР1 | ||
| CD11b | ||
| В220 | ||
| НК1.1 | ||
| CD3 | ||
| СД4 | ||
| СД8 | ||
| Панель для окрашивания ISP/DP/SP | ||
| ФИТК | ТКРБ | |
| ПЭ | TCRgd | |
| ПЭ-CY7 | СД4 | |
| БТР | CD3 | |
| БТР-CY7 | Стрептавидин (SAV) | |
| ПерХПГ | СД8 | |
| В450 | x | |
| В500 | x | |
| Лин- | ||
| Биотин | Тер119 | |
| ГР1 | ||
| CD11b | ||
| В220 | ||
| НК1.1 | ||
| 1. Окрашивайте тимоциты с помощью панели Biotin lineage-negative (Lin-). | ||
| 2. Окрасьте тимоциты с помощью маркерной панели клеток тимоцитов. | ||
Таблица 1: Панели антител для определения характеристик клеточной поверхности для проточной цитометрии. Двухэтапное окрашивание DN тимоцитов, двухэтапное окрашивание ISP, DP и SP тимоцитов. Сокращения: DN = двойное отрицательное; DP = двойное положительное; SP = одиночный положительный; ISP = незрелый одиночный положительный; ПЭ = фикоэритрин; APC = аллофикоцианин; FITC = флуоресцеин изотиоцианат.
Дополнительный рисунок 1: Совместимость mTurquoise2 и FITC с флуорохромом (A) Спектры возбуждения и излучения флуоресценции mTurquoise2 (синий) и FITC (зеленый), представляющие минимальное спектральное перекрытие. Тонкими линиями обозначены лазерные линии для возбуждения mTurquoise2 (405 нм) и FITC (488 нм). Незакрашенные кривые представляют спектры возбуждения, так же как закрашенные кривые представляют спектры излучения указанных флуорохромов. Синим цветом соответствует mTurquoise2, а зеленым — FITC. При проточной цитометрии использовались полосовые фильтры (серая зона, накладывающаяся на спектры излучения) 470/20 и 530/30 для mTurquoise2 и FITC соответственно. (B) Программная матрица компенсации эмиссии флуорохрома в рамках программы проточного цитометрического анализа тимоцитов Axin2-mTurquoise2 DP, показывающая спектральное просачивание флуорохрома между mTurquoise2 (ось y) и другими флуорохромами (ось x), используемыми для характеристики тимоцитов DP. Между mTurquoise2 и FITC (зеленый прямоугольник) не было обнаружено спектрального просвечивания, в то время как между mTurquoise2 и голубым флуорохромом AmCyan (красный прямоугольник) были обнаружены проблемы со спектральным прохождением. Канал проточного цитометра V450 был использован для измерения флуорохрома mTurquoise2, который представлен по оси y как comp-mTurquoise2. Сокращения: FITC = флуоресцеин изотиоцианат; DP = двойное положительное; V450 = Фиолетовый 450. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Схема рабочего процесса анализа программного обеспечения для проточной цитометрии для стратегии гейтирования mTurquoise2 положительных клеток. Пошаговое объяснение настройки настроек преобразования для лучшей стратегии гейтинга mTurquoise2. Представление популяции двуположительных тимоцитов Axin2-mTurquoise2 Tg/Tg (гомозиготы). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Схема рабочего процесса программного обеспечения для анализа изображений для измерения интенсивности флуоресцентной лампы. Пошаговое объяснение выбора и измерения данных интенсивности флуоресценции для расчета CTCF mTurquoise2 или расчета CTNF активного β-катенина-AF568. (A) Светлое изображение; (B) изображение mTurquoise2; (В) ядерное окрашивание ТО-ПРО-3; (D) изображение с общим β-катенином AF568. Квадратные прямоугольники — это области фонового сигнала, которые будут использоваться при расчетах CTCF и CTNF. Масштабные линейки = 50 μм. Сокращения: CTCF = скорректированная общая флуоресценция клеток; CTNF = скорректированная общая ядерная флуоресценция. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Доступно несколько канонических репортеров Wnt с различной чувствительностью репортеров и фактическими репортерными белками. Репортерные модели с использованием синтетически введенных мультимеризованных сайтов связывания TCF/LEF доступны с флуоресцентными репортерными белками; однако такие повторы трансгенов могут быть потеряны во время разведения или длительных экспериментов in vivo и могут быть чувствительны к сигналам, отличным от Wnt, от окружающих геномных последовательностей, которые влияют на экспрессию репортера. Поэтому наиболее используемым репортером остается более старый вариант Axin2-LacZ, несмотря на сложность его использования в живых клетках.
Каноническая модель репортера Wnt Axin2-mTurquoise2 обеспечивает такую же надежность репортера, как и Axin2-LacZ, хотя и с простотой яркого и относительно стабильного флуоресцентного репортерного белка. Этот голубой вариант флуоресцентного белка полезен для долгосрочной визуализации и может быть легко комбинирован с наиболее часто используемыми антителами флуорохромами25. Тем не менее, при использовании данной модели29 следует учитывать возможные ограничения в отношении 3D-проникновения и автофлуоресценции. Поскольку ядерная стабилизация β-катенина является каноническим репортерным драйвером Wnt, большинство молекулярных экспериментов требуют обнаружения повышенного общего или активного β-катенина для проверки активной передачи сигналов Wnt. Тем не менее, экспрессия β-катенина, как известно, низкая, и ее трудно обнаружить, для чего Axin2 на самом деле может быть лучшим маркером. В этом протоколе мы объясняем, как совместить репортерную модель Axin2-mTurquoise2 с цитологическим окрашиванием одноклеточных тимоцитов ядерным общим β-катенин-AF568, несмотря на низкую флуоресцентную сигнализацию.
Критические шаги в этой модели в основном связаны с правильным определением низкой экспрессии Axin2-mTurquoise2 и β-катенина-AF568. Таким образом, данный протокол описывает максимально возможное обнаружение сигнала в тимоцитах, которые, как известно, имеют низкую жизнеспособность клеток, что приводит к повышению аутофлуоресценции. Это актуально для тимоцитов, которые подвергаются естественному апоптозу во время селекции тимоцитов в физиологических условиях в тимусе. Таким образом, мы считаем, что демонстрация детектирования низкой экспрессии как Axin2-mTurquoise2, так и β-катенина-AF568 в этих клетках будет способствовать применимости модели Axin2-mTurquoise2.
Для получения достоверных результатов следует проявлять особую тщательность при правильной тонкой настройке оборудования. Чтобы обеспечить различие между истинным сигналом и фоновым сигналом, требуется включение нескольких положительных и отрицательных элементов управления для правильной калибровки оборудования для проточной цитометрии и конфокальной визуализации. Мы предлагаем использовать стабильные клеточные линии, экспрессирующие mTurquoise2, такие как клетки 293T, в качестве положительного контроля из-за их простоты трансфекции, стационарной канонической экспрессии Wnt в широком спектре интенсивности и чувствительности к соединениям, активирующим путь Wnt, таким как хлорид лития (LiCl), 6-броминдирубин-3'-оксим или CHIR99021 31,32,33. Крайне важно использовать контрольные элементы с точно таким же репортерным белком mTurquoise2, поскольку возбуждение, спектры излучения и интенсивность флуоресценции определяют значения компенсации против спектрального распространения других флуорохромов в проточной цитометрии или определение диапазонов детектирующего фильтра в конфокальной микроскопии.
Кроме того, второй гомозиготный положительный контроль Axin2-mTurquoise2 представляющих интерес клеток, который содержит в 2 раза больше репортерной конструкции Axin2-mTurquoise2, рекомендуется для адаптации к физиологически выраженным диапазонам интенсивности флуоресценции mTurquoise2, особенно в случае клеток с низкой экспрессией. Учитывая, что каноническая передача сигналов Wnt зависит от дозы, что приводит к колебаниям экспрессии репортера, необходим отрицательный контроль для исключения чрезмерного воздействия мощности лазера, определения разумного соотношения сигнал/шум и определения истинно положительного порога экспрессии mTurquoise2.
Как и в проточной цитометрии, добавление множественных маркеров характеризации является общепринятой практикой; Подходящие флуорохромы следует выбирать с минимальным спектральным побочным эффектом. Комбинация FITC или Alexa Fluor 488 (AF488) с репортерным белком mTurqoise2 должна обеспечить минимальную спектральную интерференцию в настройках проточного цитометра, представленных в этом протоколе. При сравнении флуоресцентных спектров обоих флуорохромов mTurquoise2 минимально возбуждается лазером 488 (эффективность 1%), которым можно пренебречь, особенно в репортерных клетках mTurquoise2 с низкой экспрессией. Поэтому любой значимый ложноположительный сигнал FITC в тимоцитах является неожиданным. В случае конфокальной микроскопии и особенно с предлагаемыми конфокальными настройками использование флуорохромов FITC или AF488 не рекомендуется, поскольку нет никакой возможности для компенсации, кроме значительного смешивания сигнала в программном обеспечении для обработки изображений. Вместо этого следует выбирать другие флуорохромы, такие как AF568, чтобы полностью обнаруживать низкую экспрессию mTurquoise2 без каких-либо проблем со спектральным перекрытием.
При работе с клетками с высокой экспрессией mTurquoise2 или при наличии лазера с длиной волны 440 нм на конфокальном микроскопе и сужении диапазона эмиссионного фильтра может быть возможно использование FITC или AF488, однако известно, что экспрессия Axin2 низка в большинстве тканей взрослого человека. В нашем протоколе мы измерили общую экспрессию β-катенина с помощью предварительно меченой двухэтапной высокоэффективной процедуры мечения AF568, которая обеспечивает эффективное иммуноокрашивание белков с низкой конъюгатной стабильностью, таких как β-катенин. Этапы протокола иммуноокрашивания были оптимизированы для измерения истинно положительного β-катенина в цитоплазме или ядре без присутствия высокого фонового сигнала. Подобный протокол окрашивания может быть использован на первичных культурах и криосекциях, однако при работе с разными типами клеток следует протестировать этапы фиксации. Модель Axin2-mTurquoise2 имеет только функцию репортера и поэтому не может быть полезной для экспериментов по отслеживанию клеток, таких как другие модели22 Axin2. На самом деле, эти элегантные модели Wnt, рекомбинирующие Cre, в основном полезны для экспериментов по визуализации тканей, а не для клеточных суспензий, которые теряют свой экологический контекст. Несмотря на то, что модель Axin2-mTurquoise2 нарушает функциональность гена Axin2 из-за его генетической вставки, эта функция полезна для изучения моделей нокаутирования Axin2 для терапевтических мишеней Wnt.
У гомозиготной мыши отсутствует функциональность Axin2, что препятствует ее белковому взаимодействию для фосфорилирования β-катенина в разрушающем комплексе34; тем не менее, репортерное выражение mTurquoise2 помогает показать, остается ли каноническая передача сигналов Wnt активной по альтернативному пути. Следует отметить, что Axin2 также играет важную роль в комплексе Wnt frizzled/LRP рецепторов при связывании Wnt-лиганда, предлагая еще одну интересную точку регуляции Wnt в сигнальном каскаде35. Помимо мышиной модели Axin2-mTurquoise2, аналогичная репортерная конструкция полезна для транзиторного трансгенеза и может быть специально нацелена на эндогенный локус Axin2 с помощью технологии CRISPR-Cas921. Таким образом, в этом отчете описывается простой и надежный способ анализа репортерной модели Axin2-mTurquoise2 для тимоцитов с низкой экспрессией Axin2. Этот протокол может быть применен к другим каноническим типам клеток, экспрессирующих Wnt, для скрининга лекарственных препаратов и определения функциональной терапевтической мишени Wnt.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была частично поддержана грантом Лейденского университета для профилирования области регенеративной медицины для разработки новых моделей мышей.
Материалы
| Name | Company | Catalog Number | Comments |
| BD FACScantoII flow cytometer | BD Biosciences | not aplicable | Serial number V96300710. The flow cytometer setup in this protocol contains a 405 nm laser line with 505 longpass filter and 530/30 nm bandpass filter, and 470/20 nm bandpass filter; a 488 nm laser with 735 nm longpass filter and 780/60 nm bandpass filter, 670 nm longpass filter and 655 nm longpass filter, 610 nm longpass filter, 550 nm longpass filter and 575/26 nm bandpass filter, 505 nm longpass filter and 530/30 nm bandpass filter, and 488/10 nm bandpass filter; and a 633 nm laser line with 735 nm longpass filter and 780/60 nm bandpass filter, 685 nm longpass filter, and 660/20 nm bandpass filter. |
| BSA | Sigma | A9647 | |
| Corning 70 μm cell strainer | Falcon/Corning | 352350 | |
| Cytospin 4 Type A78300101 | Thermo Scientific | not aplicable | |
| DMSO | Sigma Aldrich | D5879-1L | |
| DNAse I | Sigma | A9647 | |
| Falcon 50 mL Conical Centrifuge tubes | Greiner bio-one | 227261 | |
| Falcon round-bottom Polystyrene Test tubes with cell strainer snap cap | Fisher Scientific | 352235 | |
| Fetal Calf Serum (FCS) | Greiner Bio-One B.V. | not aplicable | Depends on origin |
| Fiji software | ImageJ | not aplicable | Version 1.53 |
| Filter card white (for cytospin) | VWR | SHAN5991022 | |
| FlowJo 10 software | Treestar | not aplicable | Version 10.5.3 |
| Frost slides | Klinipath | ||
| Gibco IMDM medium | Fisher Scientific | 12440053 | |
| HCX PL APLO 40x 1.4 OIL lens | Leica microsystems | not aplicable | |
| Hydrophobic pen: Omm Edge pen | Vector | not aplicable | |
| Leica TCS SP5 DMI6000 | Leica microsystems | not aplicable | The microscope setup in this protocol consisted of an HCX PL APO 40x/1.2 oil-immersion objective with 8-bit resolution, 1024 pixels x 1024 pixels, 400 Hz speed, pinhole 68 µm, and zoom factor of 1.5 at room temperature. This system contains a 405 diode laser, argon laser, DPSS 561 laser, HeNe 594 laser and HeNe 633 laser with 4 hybrid detectors (HyDs) and 5 photomultiplier tubes (PMTs). |
| Methanol | VWR | 1060091000 | |
| NaN3/sodium azide | Hospital farmacy | not aplicable | |
| Normal mouse serum | Own mice | not aplicable | |
| PBS | Lonza | BE17-517Q | |
| ProLong Diamond Antifade Mountant | Fisher Scientific | P36965 | |
| Purified mouse anti-β-catenin (CTNNB1) | BD Biosciences | 610154 | |
| TO-PRO-3 Iodide | Thermofisher | T3605 | |
| Transparent nailpolish | at any drugstore | not aplicable | |
| Tween-20 | Sigma Aldrich | P1379-500ml | |
| Zenon Alexa Fluor 568 Mouse IgG1 labeling kit | Thermofisher | Z25006 |
Ссылки
- Kahn, M. Can we safely target the WNT pathway. Nature Reviews. Drug Discovery. 13 (7), 513-532 (2014).
- Jung, Y. S., Park, J. I. Wnt signaling in cancer: therapeutic targeting of Wnt signaling beyond beta-catenin and the destruction complex. Experimental & Molecular Medicine. 52 (2), 183-191 (2020).
- Gao, K., Zhang, T., Wang, F., Lv, C. Therapeutic Potential of Wnt-3a in neurological recovery after spinal cord injury. European Neurology. 81 (3-4), 197-204 (2019).
- Jia, L., Pina-Crespo, J., Li, Y. Restoring Wnt/beta-catenin signaling is a promising therapeutic strategy for Alzheimer's disease. Molecular Brain. 12 (1), 104(2019).
- Bae, S. M., Hong, J. Y. The Wnt signaling pathway and related therapeutic drugs in autism spectrum disorder. Clinical Psychopharmacology and Neuroscience. 16 (2), 129-135 (2018).
- Tajer, P., Pike-Overzet, K., Arias, S., Havenga, M., Staal, F. J. T. Ex vivo expansion of hematopoietic stem cells for therapeutic purposes: Lessons from development and the niche. Cells. 8 (2), 169(2019).
- Yanai, K., et al. Crosstalk of hedgehog and Wnt pathways in gastric cancer. Cancer Letters. 263 (1), 145-156 (2008).
- Blank, U., et al. An in vivo reporter of BMP signaling in organogenesis reveals targets in the developing kidney. BMC Developmental Biology. 8, 86(2008).
- Duncan, A. W., et al. Integration of Notch and Wnt signaling in hematopoietic stem cell maintenance. Nature Immunology. 6 (3), 314-322 (2005).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- Lustig, B., et al. Negative feedback loop of Wnt signaling through upregulation of conductin/Axin2 in colorectal and liver tumors. Molecular and Cellular Biology. 22 (4), 1184-1193 (2002).
- Bernkopf, D. B., Hadjihannas, M. V., Behrens, J. Negative-feedback regulation of the Wnt pathway by conductin/axin2 involves insensitivity to upstream signalling. Journal of Cell Science. 128 (1), 33-39 (2015).
- Vassar, R., Rosenberg, M., Ross, S., Tyner, A., Fuchs, E. Tissue-specific and differentiation-specific expression of a human K14 keratin gene in transgenic mice. Proceedings of the National Academy of Sciences of the United States of America. 86 (5), 1563-1567 (1989).
- DasGupta, R., Fuchs, E. Multiple roles for activated LEF/TCF transcription complexes during hair follicle development and differentiation. Development. 126 (20), 4557-4568 (1999).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
- Mohamed, O. A., Clarke, H. J., Dufort, D. beta-catenin signaling marks the prospective site of primitive streak formation in the mouse embryo. Developmental Dynamics. 231 (2), 416-424 (2004).
- Moriyama, A., et al. GFP transgenic mice reveal active canonical Wnt signal in neonatal brain and in adult liver and spleen. Genesis. 45 (2), 90-100 (2007).
- Currier, N., et al. Dynamic expression of a LEF-EGFP Wnt reporter in mouse development and cancer. Genesis. 48 (3), 183-194 (2010).
- Ferrer-Vaquer, A., et al. A sensitive and bright single-cell resolution live imaging reporter of Wnt/beta-catenin signaling in the mouse. BMC Developmental Biology. 10, 121(2010).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- de Roo, J. J. D., et al. Axin2-mTurquoise2: A novel reporter mouse model for the detection of canonical Wnt signalling. Genesis. 55 (10), (2017).
- van de Moosdijk, A. A. A., van de Grift, Y. B. C., de Man, S. M. A., Zeeman, A. L., van Amerongen, R. A novel Axin2 knock-in mouse model for visualization and lineage tracing of WNT/CTNNB1 responsive cells. Genesis. 58 (9), 23387(2020).
- Choi, Y. S., et al. Distinct functions for Wnt/beta-catenin in hair follicle stem cell proliferation and survival and interfollicular epidermal homeostasis. Cell Stem Cell. 13 (6), 720-733 (2013).
- Nolan, G. P., Fiering, S., Nicolas, J. F., Herzenberg, L. A. Fluorescence-activated cell analysis and sorting of viable mammalian cells based on beta-D-galactosidase activity after transduction of Escherichia coli lacZ. Proceedings of the National Academy of Sciences of the United States of America. 85 (8), 2603-2607 (1988).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3, 751(2012).
- Bernkopf, D. B., Bruckner, M., Hadjihannas, M. V., Behrens, J. An aggregon in conductin/axin2 regulates Wnt/beta-catenin signaling and holds potential for cancer therapy. Nat Commun. 10 (1), 4251(2019).
- Joosen, L., Hink, M. A., Gadella, T. W., Goedhart, J. Effect of fixation procedures on the fluorescence lifetimes of Aequorea victoria derived fluorescent proteins. Journal of Microscopy. 256 (3), 166-176 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Reviews. 11, 227-256 (2005).
- Henriksson, J., et al. Endrov: an integrated platform for image analysis. Nature Methods. 10 (6), 454-456 (2013).
- Hedgepeth, C. M., et al. Activation of the Wnt signaling pathway: a molecular mechanism for lithium action. Developmental Biology. 185 (1), 82-91 (1997).
- Sato, N., Meijer, L., Skaltsounis, L., Greengard, P., Brivanlou, A. H. Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nature Medicine. 10 (1), 55-63 (2004).
- Ring, D. B., et al. Selective glycogen synthase kinase 3 inhibitors potentiate insulin activation of glucose transport and utilization in vitro and in vivo. Diabetes. 52 (3), 588-595 (2003).
- Liu, C., et al. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 108 (6), 837-847 (2002).
- Zeng, X., et al. Initiation of Wnt signaling: control of Wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions. Development. 135 (2), 367-375 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
ISSN 2578-2746
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.