Method Article
ציטומטריית זרימה וניתוח הדמיה קונפוקלית של ביטוי Wnt נמוך בתימוציטים מדווחים Axin2-mTurquoise2
In This Article
Summary
ידוע שרמות איתות מווסתות את גורל התא, מה שמצביע על כך שוויסות איתות Wnt מהווה מטרה טיפולית מעניינת. כאן, אנו מתארים שיטות ניתוח ציטומטריית זרימה ומיקרוסקופיה קונפוקלית עבור מודל מדווח איתות Wnt קנוני עכברי חזק המודד רמות איתות Wnt מובהקות.
Abstract
מדידת רמות ביטוי Wnt חיונית כאשר מנסים לזהות או לבדוק מטרות טיפוליות חדשות של Wnt. מחקרים קודמים הראו כי איתות Wnt קנוני פועל באמצעות מנגנון מונע מינון, מה שמניע את הצורך לחקור ולמדוד איתות Wnt בסוגי תאים שונים. למרות שהוצעו מספר מודלים מדווחים לייצוג ביטוי Wnt פיזיולוגי, ההקשר הגנטי או חלבון המדווח השפיעו מאוד על התוקף, הדיוק והגמישות של כלים אלה. מאמר זה מתאר שיטות לרכישה וניתוח נתונים המתקבלים עם מודל הדיווח של עכבר Axin2-mTurquoise2 Wnt, המכיל אלל Axin2em1Fstl שעבר מוטציה. מודל זה מקל על חקר איתות Wnt קנוני אנדוגני בתאים בודדים על פני טווח רחב של פעילות Wnt.
פרוטוקול זה מתאר כיצד להעריך באופן מלא את פעילות המדווח של Axin2-mTurquoise2 באמצעות ניתוח אוכלוסיית תאים של המערכת ההמטופויאטית, בשילוב עם סמני פני התא או צביעה תוך-תאית של β-catenin . הליכים אלה משמשים בסיס ליישום ורבייה ברקמות או תאים מעניינים אחרים. על ידי שילוב של מיון תאים המופעל על ידי פלואורסצנטיות והדמיה קונפוקלית, ניתן לדמיין רמות ביטוי Wnt קנוניות מובהקות. אסטרטגיות המדידה והניתוח המומלצות מספקות נתונים כמותיים על רמות הביטוי הפלואורסצנטי להערכה מדויקת של איתות Wnt קנוני. שיטות אלו יהיו שימושיות עבור חוקרים שרוצים להשתמש במודל Axin2-mTurquise2 עבור דפוסי ביטוי Wnt קנוניים.
Introduction
איתות Wnt קנוני הוא מסלול איתות משומר המעורב בהומאוסטזיס של רקמות בריאות כמו גם במחלות. ויסות מדויק של רמות איתות Wnt הוכח כחשוב בהתפתחות העוברית, אך יש לו חשיבות רבה גם ברקמות בוגרות. נמצא כי איתות Wnt קנוני ממלא תפקיד חשוב בהתחדשות רקמות של מספר איברים כגון המעיים, העור והמערכת ההמטופויאטית. לפיכך, כאשר איתות Wnt אינו מוסדר, מתעוררות פתולוגיות קשות. סרטן המעי הגס, הכבד והעור, מחלות נוירולוגיות, כמו גם ממאירויות המטולוגיות מסוימות הן פתולוגיות מופתיות שבהן איתות Wnt לא מוסדר הוא הגורם הסיבתי או התורם1. לכן, מספר מעכבים למטרות Wnt שונות נבדקים כעת בניסויים קליניים כטיפולי סרטן הקשורים ל-Wnt2.
בנוסף, התקדמות מעניינת מתרחשת בפוטנציאל הטיפולי של Wnt להתאוששות נוירולוגית, הפרעות נוירולוגיות הקשורות לגיל והפרעות מולדות על הספקטרום האוטיסטי 3,4,5. אותות Wnt נחקרו להרחבה ex vivo של תאי גזע להשתלה לאחר מכן6. עם זאת, מיקוד טיפולי של איתות Wnt קנוני הוא מאמץ קשה בשל חשיבותו בתפקודי תאים בסיסיים רבים ודיבור צולב עם מסלולים אחרים 7,8,9, וכתוצאה מכך הצורך למדוד במדויק את ההשפעות של חומרים טיפוליים אלה של Wnt במודל קל לפרשנות. איתות Wnt קנוני מונע על ידי ליגנדים Wnt מסיסים קצרי טווח, המופרשים על ידי תאים שכנים או כהפרשה אוטוקרינית כפי שדווח בסוגים שונים של תאי גזע המגיבים ל-Wnt.
קולטני Wnt Frizzled וחלבון הקשור לקולטן ליפופרוטאין (LRP) מגיבים לליגנדים אלה, מה שמפעיל מפל איתות תוך תאי. כאשר איתות Wnt כבוי, קומפלקס הרס המורכב ממעכב ציר (Axin), תוצר גן מדכא גידול, אדנומטוס פוליפוזיס קולי (APC), קזאין קינאז 1 (CK1α) וגליקוגן סינתאז קינאז (GSK-3β), מונע הצטברות של β-catenin (CTNNB1) על ידי פירוק פרוטאזומלי. עם קשירת קולטן ליגנד Wnt, קומפלקס ההרס מושבת, מה שמוביל להצטברות וייצוב של β-catenin בציטופלזמה. ה-β-catenin הפעיל יכול לנדוד לגרעין, שם הוא נקשר לגורמי השעתוק של גורם השעתוק/גורם הקישור למשפר הלימפה (TCF/LEF) כדי ליזום את השעתוק של גני המטרה של Wnt. Axin2 נחשב לגן מטרה מכיוון שהוא מטרה ישירה של מסלול Wnt10. בנוסף, Axin2 משמש כמווסת שלילי כמו גם כגן מדווח לאיתות Wnt קנוני פעיל11,12.
מספר מדווחי איתות Wnt קנוניים תוארו בספרות והיו שימושיים מאוד בהבנת תפקידו של איתות Wnt בהתפתחות העוברית. רוב המדווחים הללו עושים שימוש באתרי קשירה TCF/LEF שהוכנסו באופן סינתטי, שאינם משתמשים בגן מטרה אנדוגני 13,14,15,16,17,18,19. בנוסף, נעשה שימוש באסטרטגיות דפיקה של Axin2 המכבדות את המיקום הטבעי של הגן 11,20,21,22,23, מתוכם Axin2-LacZ מקובל בדרך כלל כמדווח Wnt הקנוני החזק ביותר 11. עם זאת, החלבון המדווח LacZ, אם כי קל לשימוש ברוב הרקמות, דורש מצע β-גלקטוזידאז, המוכר כקשה לתאים חיים24. במיוחד עבור תאי גזע ותימוציטים, תנאי הזיהוי הקשים של LacZ מגבירים את המוות התאי (נתונים לא מדווחים משלו) בעת טיפול בתרחיפי תאים.
למרות שהגברת האות הנגרמת על ידי צביעת LacZ נוחה לזיהוי אותות נמוכים, היא הופכת את הכימות לפחות ישיר ולכן ניתן לטעון פחות אמין. לכן, מודל מדווח עכברים תוכנן לחקות את האסטרטגיה הגנטית של Axin2-LacZ , אך עם חלבון מדווח mTurquoise221, כדי לספק קריאה ישירה יותר וקרובה יותר לרמות הביטוי הפיזיולוגיות. החלבון הפלואורסצנטי mTurquoise2 הוא תחליף מצוין ל-LacZ בשל הבהירות הגבוהה שלו (תפוקה קוונטית (QY) = 0.93), גמישותו בשילוב עם חלבונים פלואורסצנטיים אחרים לאפיון נרחב של פני התא, והיעדר צורך במצע אקסוגני. יתר על כן, הקשר הגנטי ההדוק שלו לחלבון פלואורסצנטי ירוק (GFP) מציע את האפשרות להשתמש ברוב הנוגדנים הפלואורסצנטיים המזהים GFP לזיהוי אותות חזק יותר, במידת הצורך, בתאים רגישים מאוד ל-Wnt25.
מודל Axin2-mTurquoise2 הוא לא רק מדווח Wnt קנוני, אלא גם מציע אפשרות לחקור פנוטיפים הטרוזיגוטיים והומוזיגוטים של Axin2 (נוק-אאוט Axin2 ). ההחדרה הממוקדת של mTurquoise2 באתר ההתחלה של Axin2 גורמת לשיבוש חלבון Axin221. מכיוון ש-Axin2, הידוע גם בשם Conductin, הוא חלק ממכלול ההרס Wnt, ומתחם ההרס מווסת היטב את השעתוק בתיווך β-catenin, היעדרו החלקי או המוחלט יכול להיות מעניין לחקור פתולוגיות מגוונות. לדוגמה, בסרטן המעי הגס, רמות Axin2 גבוהות יחסית עקב היפראקטיביות Wnt11; עם זאת, תפקידו בפתולוגיות אחרות עדיין לא ידוע במידה רבה. למרות ש-Axin2 נחשב כממלא תפקיד מוגבל בפירוק של β-catenin, ניתן לשפר את תפקידו בוויסות Wnt על ידי הוספת פפטיד קטן, החוסם את צמיחת סרטן המעי הגס בתיווך Wnt26.
בסך הכל, ויסות Wnt זהיר באמצעות יעדים טיפוליים של Wnt יכול לפתוח הזדמנויות לשנות את הופעתן או התפתחותן של פתולוגיות חמורות ויש לחקור אותן עוד יותר במודלים עם יכולת דיווח. בדוח זה, אנו מסבירים את שיטת הניתוח המומלצת שלנו של מודל העכברים Axin2-mTurquoise2 לזרימה ציטומטרית והדמיה קונפוקלית. בהקשר של רמות מינון Wnt, קשה לזהות רמות איתות Wnt קנוניות נמוכות מאוד, שעבורן יכולות זיהוי וניתוח מתקדמות מספקות יתרון כדי להפיק את מלוא היתרונות של מודל זה. תימוציטים משמשים כמערכת מודל בשל כדאיות התאים השבריריים שלהם, ביטוי איתות Wnt קנוני נמוך ואזור הציטופלזמה המעובה כדי לייצג את רגישות הזיהוי של מודל Axin2-mTurquoise2. בנוסף, מוסבר הליך צביעה היסטולוגי כולל של β-catenin עבור תרחיפי תאי תימוציטים כדי למדוד רמות β-catenin ציטופלזמיות ולאמת איתות Wnt קנוני פעיל גרעיני בשילוב עם המדווח.
Protocol
הערה: כל הליכי העכברים בוצעו באישור הוועדה האתית של המרכז הרפואי של אוניברסיטת ליידן (LUMC) לניסויים בבעלי חיים. זכר ונקבה, בני 6-12 שבועות, מסוג בר (wt), שאין להם החדרה של מבנה המדווח Axin2-mTurquoise2, הטרוזיגוט (Tg/0) עם החדרה אחת של מבנה המדווח Axin2-murquoise2 וכך, גן Axin2 משובש אחד, והומוזיגוטי (Tg/Tg) עם החדרת מבנה המדווח Axin2-mTurquoise2 בשני האללים וכך, שני גנים משובשים של Axin2 ; Axin2-mטורקיז2 עכברים (B6; CBA-Axin2em1Fstl/J עכברים) שימשו בניסויים. בעלי החיים הוקרבו על ידי המתת חסדCO2 לפני בידוד האיברים. לאורך כל ההליך, צמצם את חשיפת הדגימות לאור, ושמור על קרח או 4 מעלות צלזיוס בכל עת, אלא אם כן צוין אחרת. מכסים את הדגימות בנייר אלומיניום. יש לבצע את כל השלבים במעבדה סטנדרטית עם ארון בטיחות ביולוגית.
1. הכנת תרחיף תאי תימוציט
- קצרו את בלוטת התימוס מעכברים בזהירות ללא זיהום דם על ידי חיתוך הבטן של העכברים וחילוץ התימוס בעזרת מלקחיים. אחסון/הובלה זמנית במדיום Dulbecco's Modified (IMDM) של Iscove המכיל 2.5% סרום עגל עוברי (FCS).
הערה: כדי למנוע שפיכת דם ונזק אפשרי לתימוס, אין להקריב את העכברים על ידי פריקת צוואר הרחם. - הכן צינור של 50 מ"ל עם מסננת תאים של 70 מיקרומטר, והרטיב את המסנן עם 1 מ"ל של IMDM קר/2.5% מדיום FCS.
- מועכים את האיבר עם הקצה האחורי של בוכנת מזרק של 1 מ"ל תוך כדי שטיפה פעמיים עם IMDM קר/2.5% מדיום FCS (איור 1A). אם תרצה, הוסף ריכוז סופי של 50 U/mL של DNAse I למדיום IMDM/2.5% FCS כדי למנוע גוש תאים מתים. שטפו את המסנן פעמיים עם IMDM קר/2.5% מדיום FCS, והשעו בעדינות בצינור של 50 מ"ל.
הערה: אין לחרוג מנפח קצה כולל של 10 מ"ל. שמור תאים על קרח ובחושך לשלבים הבאים וכאשר לא מטפלים. - צנטריפוגה ב-330 × גרם למשך 5 דקות ב-4 מעלות צלזיוס, ושואב בעדינות את הסופרנטנט מכדור התא. השעו מחדש את גלולת התא בעדינות במדיום IMDM / 2.5% FCS קר ולא שלם, והתכוננו לספירת תאים.
הערה: במידת הצורך, הקפיאו ואחסנו את התימוציטים בחנקן נוזלי ב-FCS-10% דימתיל-סולפוקסיד לניסויים מאוחרים יותר. הקפאה והפשרה נכונה של תאים יפחיתו מוות מוגזם של תאים. בממוצע, מחצית מהתימוציטים יכולים להיות אפופטוטיים לאחר ההפשרה עקב הברירה הטבעית של תאי T בתימוס, שיש לקחת בחשבון כאשר מחליטים כמה תימוציטים להקפיא לכל בקבוקון קריו. יש להקפיא לא פחות מ -2.5 × 106 תימוציטים לכל בקבוקון.
2. הכנת ציטומטריית זרימת תימוציטים
- הכן תימוציטים להליך צביעת פני התא על ידי הכנת 2.5 ×10 6 תימוציטים לדגימת צביעה בתמיסת מלח עם פוספט קר כקרח (PBS, pH 7.4) (איור 1B). ספר מחדש את מספר התאים החיים לאחר ההפשרה, אם תימוציטים הוקפאו בעבר. במידת הצורך, הוסף ריכוז סופי של 50 U/mL של DNAse I כדי למנוע גוש תאים מתים.
- השתמש בלוחות צביעת הנוגדנים לאפיון פני התא של תת-קבוצה שלמה של תימוציטים.
הערה: ניתן לבחור שילובים אחרים של פלואורוכרום. בחר סמני אוכלוסייה נדירים עבור פלואורוכרומים פלואורסצנטיים בהירים ואם אפשר, הוסף סמן חי-מת. אין להשתמש בפלואורוכרום V450 או V500 בשילוב עם מדווח הפלואורסצנטי mTurquoise2 עקב חפיפה ספקטרלית. בדוק תמיד את ספקטרום הקרינה של mTurquoise2 בשילוב עם פלואורוכרומים כחולים וירוקים (איור משלים 1A).- מערבבים את הנוגדנים ביחסים שהוגדרו בעבר של לוחות השושלת השליליים (Lin-) בנפרד במאגר PBS/0.2% אלבומין בסרום בקר (BSA)/0.1% NaN3 (נתרן אזיד).
הערה: כל התאים הלא רצויים (שאינם תימוציטים הקיימים בתימוס) נצבעים בתהליך דו-שלבי בנוגדנים משניים של סטרפטווידין (בדוגמה זו, פיקואריתרין (Pe)-Cy7 ואלופיקוציאנין (APC)-Cy7) וניתן לשלול אותם באמצעות "שער השלכה" בניתוח ציטומטריית הזרימה. - ערבבו את הנוגדנים ביחסים שהוגדרו קודם לכן של לוח הצביעה הכפול השלילי (DN) עם הנוגדן המשני סטרפטווידין Pe-Cy7 במאגר PBS/0.2% BSA/0.1% NaN3 . אל תכלול את לוח ה-Lin מתערובת זו (טבלה 1).
- ערבבו את הנוגדנים ביחסים שהוגדרו קודם לכן של פאנל הצביעה הלא בוגר סינגל חיובי (ISP), דאבל חיובי (DP) וסינגל חיובי (SP) עם הנוגדן המשני סטרפטווידין APC-Cy7 במאגר PBS/0.2% BSA/0.1% NaN3 . אל תכלול את לוח ה-Lin מתערובת זו (טבלה 1).
- ראשית, צבעו את התימוציטים באוכלוסיות לא רצויות של תאים שאינם T על ידי שימוש בתערובות הנוגדנים הראשוניות של ביוטין של לוחות ה-Lin למשך 30 דקות על קרח בחושך.
הערה: כל לוח Lin הוא קבוצה שונה של תאים ולכן אין לצבוע אותו יחד בדגימה אחת. - יש לסובב בחום של 300 × גרם, 4 מעלות צלזיוס למשך 5 דקות ולהוציא את הסופרנטנט. שטפו את התימוציטים עם 150 מיקרוליטר PBS קר כקרח/0.2% BSA/ 0.1% NaN3 buffer, וסובבו מטה ב-300 × גרם, 4 מעלות צלזיוס למשך 5 דקות.
- מכתים עם לוח ה-DN ולוח ה-ISP/DP/SP של ה-Lin- המתאים מכתים למשך 30 דקות על קרח בחושך. יש לסובב בטמפרטורה של 300 × גרם, 4 מעלות צלזיוס למשך 5 דקות, ולהוציא את הסופרנטנט. שטפו את התימוציטים עם 150 מיקרוליטר PBS קר כקרח/0.2% BSA/0.1% NaN3 buffer, וסובבו כלפי מטה ב-300 × גרם, 4 מעלות צלזיוס למשך 5 דקות.
- מערבבים את הנוגדנים ביחסים שהוגדרו בעבר של לוחות השושלת השליליים (Lin-) בנפרד במאגר PBS/0.2% אלבומין בסרום בקר (BSA)/0.1% NaN3 (נתרן אזיד).
- הכן את התאים למדידת זרימה ציטומטרית על ידי הומוגניזציה עם צינור מסננת תאים של 35 מיקרומטר והעלאת התאים במאגר PBS/0.2% BSA/0.1% NaN3 . הגן על התאים מפני אור, והשאר על קרח עד ובמהלך מדידת ציטומטר זרימה.
הערה: NaN3 (נתרן אזיד) רעיל מאוד וקטלני. יש לנקוט בזהירות מיוחדת בעבודה עם חומר זה. יש לשטוף ידיים ביסודיות לאחר השימוש, ולהתקשר מיד למרכז למידע על הרעלות או לרופא/רופא במקרה של בליעת NaN3 .
3. מדידת ציטומטר זרימה
הערה: משתמשים חסרי ניסיון צריכים תחילה לעבור אימון ציטומטר זרימה שכן מדידת האות mTurquoise2 בשילוב עם מספר פלואורוכרומים אחרים דורשת ניסיון ותכנון בקיא של הניסוי. עיין בטבלת החומרים למידע על ציטומטר הזרימה.
- הפעל את ציטומטר הזרימה בהתאם למדריך למשתמש או לפרוטוקול קבוע אחר. בדוק, ובמידת הצורך כוונן את מסנן פס הפס בציטומטר הזרימה לאסטרטגיית זיהוי פלואורסצנטי אופטימלית.
הערה: מסנן מומלץ עבור mTurquoise2 הוא 470/20 ננומטר בקו הלייזר האולטרה סגול 405 ננומטר, 407 ננומטר או קו הלייזר הפחות נפוץ של 440 ננומטר. - כייל את ציטומטר הזרימה על ידי קביעת הגדרות פיצוי עם חרוזי פיצוי זמינים מסחרית ותאי 293T מבטאים mTurquoise2 ביציבות.
הערה: ניתן להשתמש בתימוציטים מוכתמים יחידים במקום חרוזי פיצוי. במקרה זה, הפיצוי בחרוזים היה יעיל ונוח באותה מידה משימוש בתאים.- סמן את החרוזים עם כל פלואורוכרום בודד ששימש בניסוי, וכלול חרוזים לא מוכתמים. מדוד את החרוזים כדי להקים לוח הגדרת פיצוי, ומדוד תאי 293T המבטאים mTurquoise2 מכיוון שאין פלואורוכרום תואם ל-mTurquoise2, שניתן להשתמש בו על החרוזים. שמור את הגדרות הפיצוי לשימוש בניסוי בפועל.
הערה: התאים המבטאים mTurquoise2 המשמשים להגדרת הפיצוי חייבים להיות בהירים או בהירים יותר מהתימוציטים המבטאים mTurquoise2 של הניסוי בפועל. ודא שיש גם תאי 293T שליליים mTurquoise2. - לצורך הניסוי, כלול תימוציטים מוכתמים ב-Tg/Tg פלואורסצנטי מינוס אחד (FMO), כולל דגימת wt עבור mTurquoise2 FMO ודגימה לא מוכתמת של תימוציטים מכל גנוטיפ של עכבר כבקרות חיוביות לחלק הניתוח.
הערה: פקדים אלה חשובים להגדרה נכונה של השערים עבור תאים חיוביים. שאר דגימות הניסוי מוכתמות בלוח הצביעה השלם (טבלה 1).- צור ניסוי, הוסף ותן שם למספר הצינורות בתוכנת ציטומטר הזרימה, וצור עלילות פיזור כדי לדמיין את התאים המוכתמים עבור הסט השלם של פלואורוכרומים.
- החל את הגדרות הפיצוי שנקבעו בעבר על הניסוי. כוונן את הפיזור קדימה (FSC) ואת הפיזור הצדדי (SSC) עם תימוציטים wt לא מוכתמים עד שאוכלוסיית התאים המלאה נראית בתרשים הפיזור. מדוד תחילה את התימוציטים הלא מוכתמים Tg/Tg mTurquoise2 כדי לוודא שהאוכלוסייה החיובית נראית לעין.
- מדוד דגימת תימוציט מוכתמת לחלוטין של Tg/Tg, ובדוק אם יש את כל שילובי הפלואורוכרום. במידת הצורך, התאם את ערכי הפיצוי שנקבעו בעבר עבור הפלואורוכרומים המציגים פיצוי שגוי. מדוד את שאר דגימות הניסוי, ואל תתאים הגדרות כלשהן במהלך מדידת הדגימות.
הערה: ניתן לבצע התאמת פיצוי לאחר מכן גם בחבילת תוכנת הניתוח. למרות שמספר התאים הזמינים יכול להוות גורם מגביל, רצוי לבצע שלב זה במהלך המדידה. שמור על ההגדרות שוות בין כל הדגימות להשוואה של ערכי העוצמה mTurquoise2.
- סמן את החרוזים עם כל פלואורוכרום בודד ששימש בניסוי, וכלול חרוזים לא מוכתמים. מדוד את החרוזים כדי להקים לוח הגדרת פיצוי, ומדוד תאי 293T המבטאים mTurquoise2 מכיוון שאין פלואורוכרום תואם ל-mTurquoise2, שניתן להשתמש בו על החרוזים. שמור את הגדרות הפיצוי לשימוש בניסוי בפועל.
4. אנליזה ציטומטרית זרימה
הערה: ניתוח ציטומטרי זרימה בוצע באמצעות תוכנה ספציפית המוזכרת בטבלת החומרים; עם זאת, קיימות גם תוכניות אחרות לניתוח זרימה ציטומטרית.
- שער תאים חיים ותת-קבוצות תימוציטים לפי ערכי FSC ו-SSC.
- בדוק את הגדרות הפיצוי בתיבת הדו-שיח של מטריצת הפיצוי שנמצאת משמאל לדגימה כדי לוודא שאין הפרעות פלואורוכרום ושהתרחש פיצוי מתאים כדי למנוע זליגה או דימום.
- אם יש להתאים את המטריצה המוגדרת-רכישה, שנה את הערכים במטריצת הפיצוי על ידי הגדלה או הקטנה של ערך הפיצוי של כל שילוב פלואורוכרום כך שהאוכלוסייה לא תראה קו אופקי או אנכי כמעט מושלם (איור משלים 1B).
- כדי לפזר חזותית את עוצמת mTurquoise2 עבור שער חיובי תקין, שנה את תצוגת ציר ה-X mTurquoise2 לליניארית (איור משלים 2).
- השתמש בבקרת mTurquoise2 FMO כבקרה שלילית עבור שער אות חיובי mTurquoise2. תקן את שער הסף הנכון לכל אוכלוסיית תאים (איור 2).
הערה: לתאי הבקרה mTurquoise2 FMO (wt) אין את סמן mTurquoise2 ולכן ניתן להשתמש בהם כסף רקע לפעילות מדווח Axin2.
- השתמש בבקרת mTurquoise2 FMO כבקרה שלילית עבור שער אות חיובי mTurquoise2. תקן את שער הסף הנכון לכל אוכלוסיית תאים (איור 2).
- תאים חיוביים ל-Gate mTurquoise2 עם ערוץ הזיהוי המתאים כדי להגדיר כמה תאים חיוביים ל-Wnt.
- חשב את הממוצע והחציון הגיאומטרי כדי להגדיר את כמות עוצמת הפלואורסצנט בתאים המעניינים.
- לחץ על סטטיסטיקה | הוסף סטטיסטיקה בתוך הפאנל המציג תאים חיוביים ל- mTurquoise2.
- הגדירו את השיטה הסטטיסטית, את אוכלוסיית העניין ואת ערוץ הזיהוי של mTurquoise2, ולחצו על הוסף. ייצג את הממוצע הגיאומטרי ואת עוצמת הפלואורסצנט החציונית ביחידות שרירותיות (AU) כדי לשרטט גרפים.
הערה: החציון מייצג את הערך האמצעי של עוצמת הפלואורסצנט ומכאן מספק מידע על שינוי אוכלוסיית עוצמת הפלואורסצנט. במידת הצורך, תיקון רקע יכול לעזור להשיג הדמיה ברורה יותר של הטווח הדינמי של פעילות המדווח mTurquoise2. ניתן לעשות זאת על ידי הפחתת תדירות צביעת הרקע של wt מהתדר הכולל של תאים חיוביים mTurquoise2 מסוג התא הספציפי המגודר.
5. הכנת ציטוספינים של תימוציטים להדמיה קונפוקלית
הערה: ציטוספינים של תימוציטים מומלצים בעבודה עם תרחיפי תאים של תאים שאינם נדבקים. מכיוון שהביטוי של Axin2-mTurquoise2 בתימוציטים נמוך יותר מאשר בתאי האפיתל של התימוס, נעשה שימוש בתרחיפי תאי תימוציט מסוננים להדמיה.
- התחל עם תרחיף תאים של תימוציטים טריים או קפואים. השעו ~20,000 תימוציטים ב-100 מיקרוליטר של PBS קר/0.5% BSA/10% FCS לכל גנוטיפ תימוציט.
הערה: במידת הצורך, הפשירו את התאים בעדינות כדי לשמור על כדאיות תאים מקסימלית בעת עבודה עם תימוציטים שהוקפאו בעבר. זה יסייע בפחות אוטופלואורסצנטיות בעת הדמיית התאים. בדוק את כדאיות התא כדי להבטיח את איכות הדגימה. הליך הציטוספין מפעיל כוח מכני שהותאם לתימוציט השביר; עם זאת, זה דורש אוכלוסייה התחלתית בת קיימא מאוד. כדי להבטיח כדאיות גבוהה יותר, רצוי להתחיל עם תימוציטים טריים שנקטפו במקום קפואים. - הרטיבו מראש את האזור סביב פתיחת כרטיסי הסינון בעזרת PBS. הרכיבו את מחזיק תא הדגימה של הציטוספין לפי המדריך (איור 1C).
- הנח את כרטיס המסנן על מגלשת הכפור (הצד החלק כנגד מגלשת הזכוכית). הנח את שני הפריטים על מחזיק תא הדגימה. הקפד להניח את כרטיס המסנן בדיוק על חור מחזיק תא הדגימה, והנח את מחזיק תא הדגימה השלם ברוטור.
- השעו בזהירות את התימוציטים, והוסיפו 100 מיקרוליטר של תרחיף התאים בתאי הדגימה. סובב את מתלה התימוציט למשך 4 דקות בטמפרטורה של ~350 × גרם על מגלשות הכפור. הסר את כרטיס המסנן בזהירות ממגלשת הכפור מבלי לגעת בתאים. יבש את הציטוספינים באוויר לתקופה שנעה בין שעה עד לילה בטמפרטורת החדר.
הערה: בעת עבודה עם סוגי תאים אחרים, בדוק צפיפויות תאים שונות לקבלת תוצאות מיטביות. ניתן להקפיא ציטוספינים בטמפרטורה של -20 מעלות צלזיוס בקופסה אטומה לניסויים מאוחרים יותר. הפשירו את הציטוספינים להמשך טיפול למשך שעה בטמפרטורת החדר.
6. צביעה חיסונית של ציטוספינים עם סה"כ β-קטנין
- תקן את הציטוספינים למשך 15 דקות בטמפרטורת החדר ב 100% מתנול. יבש את המגלשות באוויר למשך 10 דקות בטמפרטורת החדר. צייר עיגול סביב אוכלוסיית התימוציטים על מגלשת הזכוכית בעזרת עט הידרופובי.
הערה: שלב קיבוע זה מותאם במיוחד לצביעה β-קטנין. - הנח את השקופיות ב-PBS/0.05% Tween-20 למשך 10 דקות בטמפרטורת החדר, ולאחר מכן, העביר אותן לקופסה לחה וחשוכה במהלך שלבי החסימה והדגירה. הוסף 100 מיקרוליטר של PBS/10% סרום עכבר רגיל (NMS) לכל שקופית, והשאיר בקופסה הלחה למשך 10 דקות בטמפרטורת החדר. הקש על השקופית כדי להסיר את 10% NMS, הוסף 100 מיקרוליטר של PBS/10% סרום עיזים רגיל (NGS) לכל שקופית, והשאיר בקופסה הלחה למשך 30 דקות בטמפרטורת החדר.
הערה: דגירה עם PBS/10% NMS חוסמת קשירת נוגדנים ראשוניים לא ספציפיים (איור 1D), בעוד PBS/10% NGS חוסם קשירת נוגדנים משניים לא ספציפיים. - הכן נוגדנים נוספים לצביעה סלולרית. מערבבים 0.5 מיקרוגרם מסך הנוגדן β-catenin עם השברים המסומנים ב-AF568.
הערה: בהגדרה זו, נעשה שימוש בערכת תיוג זמינה מסחרית לתיוג מראש של ה-β-catenin הראשוני נגד עכבר עם שברי IgG1 Fab משניים נגד עכבר עם תווית פלואורוכרום Alexa Fluor 568 (AF568) לפני הוספתו לתימוציטים. בצע את התיוג בהתאם לפרוטוקול היצרן מכיוון שייתכן שיהיה צורך לבדוק מספר ריכוזים. השתמש בנוגדנים הכוללים β-catenin-AF568 תוך 30 דקות. - הוסף 50 מיקרוליטר (0.5 מיקרוגרם) מסך הנוגדן המסומן ב-β-catenin-AF568 לכל שקופית ציטוספין למשך הלילה ב-4 מעלות צלזיוס בקופסה לחה. כלול בקרת צביעה שלילית בהתאם לפרוטוקול היצרן או בקרת איזוטיפ במקרה של פרוטוקול תיוג ישיר.
- יש לכבס במשך 20 דקות עם PBS/0.05% Tween-20 בטמפרטורת החדר. לאחר מכן, יש לשטוף במשך 20 דקות עם PBS בטמפרטורת החדר בצנצנת תוך ערבוב. בצע שלב קיבוע שני כדי להבטיח את קשירת הנוגדן לאנטיגן: 10 דקות בטמפרטורת החדר עם 100 מיקרוליטר של 4% פרפורמלדהיד (PFA) ב-PBS בקופסה לחה.
הערה: שמור את השקופיות בחושך. לא מתנול ולא קיבוע PFA ישפיעו באופן משמעותי על ביטוי mTurquoise227. - טבלו את השקופיות ב-PBS. בצע צביעה גרעינית עם 50 מיקרוליטר של TO-PRO-3 (1:1500) למשך 10 דקות בטמפרטורת החדר בקופסה הלחה. שוטפים את השקופיות למשך 20 דקות עם PBS בטמפרטורת החדר בצנצנת תוך ערבוב.
הערה: ניתן לטטר את ריכוז TO-PRO3 בהתאם לשימוש בפלואורוכרומים אחרים עם ספקטרום פלואורסצנטי סמוך. - הטמיעו את הדגימות עם מגיב נגד דהייה בהתאם לפרוטוקול היצרן, וכסו בכיסוי. יש לייבש באוויר במשך 24 שעות בטמפרטורת החדר. צפה בשקופיות ישירות תחת מיקרוסקופ פלואורסצנטי או קונפוקלי, או אחסן בטמפרטורה של -20 מעלות צלזיוס להדמיה מאוחרת יותר.
7. מדידה מיקרוסקופית קונפוקלית
הערה: עיין בטבלת החומרים למידע על המיקרוסקופ הקונפוקלי.
- הפעל את המיקרוסקופ הקונפוקלי בהתאם לפרוטוקול הידני או שנקבע. השתמש בבקרות קו תאים mTurquoise2 293T שליליות וחיוביות להתאמה ראשונית של ההגדרות הקונפוקליות. לאחר מכן, השתמש בתימוציטים wt Axin2-mTurquoise2 ו-Tg/Tg (נוק-אאוט) Axin2-mTurquoise2 כבקרות שליליות וחיוביות, בהתאמה, כדי להבטיח שאין תת-חשיפה של האות mTurquoise2.
- הכן את התוכנה לסריקה רציפה על ידי תכנות הלייזרים ורוחב המסננים. התחל תחילה עם קו הלייזר באורך הגל הגבוה ביותר, ועבוד לכיוון אורך הגל הנמוך ביותר. כאשר כל שלבי הסריקה הרציפים מותקנים, טען את הדגימה על המיקרוסקופtagה, מקד את הדגימה ולחץ בשידור חי כדי לייעל את עוצמת הלייזר ואת הרווח החכם באמצעות הכפתורים המתאימים בתוכנה הקונפוקלית או בפאנל הידני האופציונלי.
הערה: אין לצלם את קטע הדגימה של השקופית לצורך כימות האות מכיוון שפוטנציאל להלבנת אור עלול להתרחש. עם זאת, ל-mTurquoise2 יש יציבות פוטו-יציבות גבוהה25. - במקרה של ביטוי mTurquoise2 נמוך מאוד, הגדל את עוצמת הלייזר ואת הרווח החכם עד שנצפה אות פלואורסצנטי, ובדוק עם דגימת הבקרה השלילית כדי להבטיח אות חיובי אמיתי. דמיין את התימוציטים עם עדשת שמן 40x 1.4, עדשת שמן 63x 1.4 או עדשת שמן 100x 1.4.
הערה: מיקרוסקופ Leica SP5 שימש למחקר זה. - השתמש בהגדרות הדמיה קונפוקליות אלה במיקרוסקופ לפני מדידת הדגימה.
- התאם את טווח ערכי העוצמה לתמונה של 12 סיביות על ידי לחיצה על תצורה | הגדרות | שנה ל-12 סיביות באפשרות עומק סיביות כדי ליצור סולם רחב יותר של עוצמה ובכך להבחין יותר בין אותות פלואורסצנטיים נמוכים וגבוהים.
- התאם את רזולוציית ההדמיה על ידי לחיצה על XY, והגדל את הפורמט ל-1024 x 1024, מה שגם יכפיל את זמן הסריקה. התאם את מהירות הסריקה ל-400-600 הרץ על ידי לחיצה על מהירות | עוד כדי לשנות את ההגדרות באופן ידני. בנוסף, הפעל את אפשרות הסריקה הדו-כיוונית.
- כוונן את מחוון הרגישות כדי להפחית את אות הרקע. מטב את עוצמת הלייזר הנכונה ואת הרווח החכם עם האפשרות Quick LUT (טבלת חיפוש).
הערה: בתמונה של 12 סיביות, המחוון כולל ערך עוצמה בגווני אפור מ-0 עד 4095. ניתן לעשות זאת גם לאחר מכן עם תוכנת Las X החינמית הלא מקוונת. הצבע הירוק יציג את הרקע השחור, והצבע הכחול יציג פיקסלים רוויים של הדגימה.
- כאשר כל הגדרות ההדמיה מותאמות, מדוד את הדגימה על ידי לחיצה על התחל, מה שיפעיל את ההדמיה הרציפה של כל שלושת הערוצים.
- מדוד את האות הפלואורסצנטי הגרעיני TO-PRO-3. זיהוי TO-PRO-3 עם לייזר 633 ננומטר ו-HyD 640-750 ננומטר.
הערה: בהגדרה זו, נעשה שימוש בכוח לייזר של 6% ברווח חכם של 15%. הגדרה זו יכולה להשתנות בהתאם לעוצמת הצביעה של TO-PRO-3. אם הוא בהיר מאוד, הוא יכול להשפיע על פלואורוכרומים בעוצמה נמוכה יותר כאשר הוא נרגש יתר על המידה. במקרה כזה, הפחיתו את ריכוז הצביעה. - מדוד את האותות הפלואורסצנטיים הגרעיניים והציטופלזמיים של β-catenin. זיהוי β-catenin עם לייזר 561 ננומטר ו-HyD 580-605 ננומטר. צבור עד 2 סריקות לתמונה אחת על ידי התאמת ההגדרה בתיבת XY בתוכנה עם ממוצע קו 2 במקרה של אות AF568 נמוך.
הערה: בהגדרה זו, נעשה שימוש ב-85% כוח לייזר ברווח חכם של 87%. - מדוד את האות הפלואורסצנטי הציטופלזמי mTurquoise2. זהה mTurquoise2 עם לייזר 458 ננומטר ו-HyD 490-600 ננומטר. צבור עד 4 סריקות לתמונה אחת על ידי התאמת ההגדרה בתיבת XY בתוכנה עם ממוצע קו 4 במקרה של אות mTurquoise2 נמוך.
הערה: בשל לייזרים ישנים במיקרוסקופ הקונפוקלי המשמש לפרוטוקול זה ואות mTurquoise2 הנמוך, נעשה שימוש ב-405 ננומטר ב-90% עוצמת לייזר, יחד עם לייזרים של 458 ננומטר ו-476 ננומטר ב-100% עוצמת לייזר עם HyD 490-550 ננומטר ברווח חכם של 100%. לייזר 440 ננומטר הוא האופטימלי ביותר, אם כי פחות נפוץ במיקרוסקופ קונפוקלי. יש לטפל בעוצמת לייזר גבוהה בזהירות ולבצע אותה רק עם הדמיה עוקבת. ודא שהגדרות החירום קיימות כדי למנוע חשיפת יתר של הגלאי. עוצמת הלייזר במיקרוסקופים קונפוקליים אחרים עשויה להיות נחותה מאלה המוצעים בפרוטוקול זה בשל לייזרים חזקים יותר או חדשים יותר. ניתן לבצע בדיקת הלבנה כדי להבטיח שלא יאבד אות פלורסנט לפני ההדמיה. בהגדרה המוצעת, ההלבנה של mTurquoise2 הייתה מקובלת. - בצע הדמיית שדה בהיר להדמיה מלאה של התאים. זהה תימוציטים באמצעות לייזר 488 ננומטר ו-PMT Scan-DIC. ייצא את קבצי ה-Lif לניתוח תמונה.
הערה: בהגדרה זו, נעשה שימוש בהספק לייזר של 59% עם רווח של 212 וולט והיסט נתונים של -4.3%. ניתן לקרוא קבצי Lif בתוכנת LAS x הלא מקוונת לתיקון תמונה.
- מדוד את האות הפלואורסצנטי הגרעיני TO-PRO-3. זיהוי TO-PRO-3 עם לייזר 633 ננומטר ו-HyD 640-750 ננומטר.
8. ניתוח מיקרוסקופיה קונפוקלית
- נתח את התמונות באמצעות תוכנת עיבוד תמונה28 (איור משלים 3). טען את התמונות בתוכנה.
הערה: פורמטים מרובים מתקבלים, אך מומלץ להשתמש בקובצי TIFF עם LUT או ייבוא ישיר של קובצי Lif לתוכנת עיבוד התמונה. - מדוד את אות ה-β-catenin הפעיל בגרעיני התימוציט.
- בחר את הגרעינים של התימוציטים המוכתמים ב-TO-PRO-3 בתמונת הערך האפור האדום לניתוח β-catenin פעיל. עשה זאת באופן ידני, או השתמש בבחירת תאים אוטומטית בתוכנה.
הערה: בחירת תאים אוטומטית עשויה להזדקק לעיבוד תמונה לצורך סף וניתוח חלקיקים נאותים. בחירת תאים ידנית יכולה להיות מייגעת, אך בדרך כלל אינה דורשת עיבוד תמונה כלשהו ומומלצת בפרוטוקול זה. - הפעל בחירה ידנית עם כל אחד מכלי הבחירה בסרגל העבודה.
- בחר את קווי המתאר של הגרעין והוסף אותו למנהל אזור העניין (ROI). הפעל את מנהל ההחזר על ההשקעה על ידי לחיצה על ניתוח | כלים | מנהל החזר ROI, וכאשר נפתח חלון חדש של מנהל החזר ROI, לחץ על האפשרות הראשונה הוסף (t), או השתמש בקיצור המקשים t. חזור על השלב הקודם עד שכל הגרעינים יוגדרו ויתווספו למנהל ה-ROI. השתמש באפשרות הצג הכל במנהל ההחזר על ההשקעה כדי להציג באופן חזותי את התאים שנבחרו.
- בחר >3 אזורי רקע שבהם אין תאים והוסף אותם למנהל ההחזר על ההשקעה.
הערה: גודל וצורה אינם חשובים במקרה זה. אזורים אלה ישמשו כמדידות רעשי רקע לחישוב הסופי.- הגדר את המדידה בתמונה על ידי לחיצה על ניתוח | הגדר מידות. בחלון החדש שנפתח עם אפשרויות מדידה שונות, הפעל שטח, צפיפות משולבת וערך אפור ממוצע | לחץ על אישור.
- הפעל את תמונת הערך האפור של β-catenin על ידי לחיצה עליה, והמחיש את הגרעינים ואזורי הרקע שנבחרו על ידי לחיצה על הצג הכל במנהל ההחזר על ההשקעה. שימו לב לכל האזורים שנבחרו הגלויים כעת בתמונת β-catenin.
- לחץ על מדידה במנהל החזר ההשקעה או לחץ על ניתוח | למדוד. שימו לב לחלון התוצאות החדש שנפתח, המציג את התוצאות של אות β-catenin בתוך ההחזר על ההשקעה.
- העבר את התוצאות לתוכנת חישוב גיליון אלקטרוני על ידי לחיצה על ערוך | בחר הכל; והעתק/הדבק את הרשימה בגיליון האלקטרוני לצורך חישוב נוסף. שמור את מנהל ההחזר על ההשקעה לעיון עתידי מבלי שתצטרך לחזור על בחירת הגרעינים על ידי לחיצה על עוד | שמר....
- לבחירת תאים אוטומטית, הפוך כפילויות (מקלדת Ctrl D) של התמונה לעיבוד מכיוון שלא ניתן לבטל הגדרות עיבוד תמונה רבות.
הערה: תיוג גרעיני אוטומטי דורש עיבוד תמונה, ברוב המקרים, כדי להגדיר את הגרעינים באופן אוטומטי ומדויק. עיבוד תמונה צריך להיעשות רק למטרות בחירת אזור. תמונות מעובדות אינן שימושיות למדידת עוצמת פלואורסצנט מכיוון שערכי הפיקסלים משתנים.- בצע מסנן גאוס על ידי לחיצה על תהליך | מסננים | טשטוש גאוס כדי להחליק את התמונה. בדוק ערכי סיגמא (רדיוס) מרובים, והפעל את האפשרות תצוגה מקדימה כדי להמחיש את האפקט לפני לחיצה על אישור.
- הפוך את התמונה על ידי לחיצה על ערוך | הפוך. בדוק את הבהירות והניגודיות על ידי לחיצה על תמונה | התאם | בהירות/ניגודיות. השתמש באפשרות אוטומטי או עדיף לשנות ידנית את הערכים.
הערה: אל תחיל את השינויים מכיוון שהדבר ישנה את מאפייני התמונה. כל שעליך לעשות הוא לסגור את חלון ה-B&C כאשר התמונה הרצויה מתקבלת. - צור סף על ידי לחיצה על תמונה | התאם | סף, והגדר את הגדרות הסף הטובות ביותר שבהן כל התאים גלויים ברובם. לחץ על החל כדי להחיל את הגדרות הסף.
הערה: אם לא הוחל סף על התאים, המציגים חורים, לחץ על תהליך | בינארי | מלא חורים כדי למלא את החסר בתוך התאים. אם התאים מתמזגים יחד עם הגדרות הסף, לחץ על תהליך | בינארי | קו פרשת מים כדי להפריד בין תאים אלה. קו דק של פיקסל אחד יפריד בין כל תא שהתוכנית מפרשת כמאוחד. - הגדירו את הגרעין הקטן והגדול ביותר בתמונה על ידי בחירה ידנית של גרעין לבחירה באמצעות כלי הבחירה Freehand , הוסיפו אותו למנהל ההחזר על ההשקעה ומדדו את השטח.
- ניתוח החלקיקים (גרעינים) על ידי לחיצה על ניתוח | נתח חלקיקים, והוסף את השטח הקטן ביותר ואת השטח הגדול ביותר בתיבה גודל (^2) עם מקף (-) ביניהם. הפעל את התיבות הצג תוצאות, הוסף למנהל ואל תכלול בקצוות לפני לחיצה על אישור. המשך לשלב 8.2.3 כדי להשלים את הפרוטוקול.
- בחר את הגרעינים של התימוציטים המוכתמים ב-TO-PRO-3 בתמונת הערך האפור האדום לניתוח β-catenin פעיל. עשה זאת באופן ידני, או השתמש בבחירת תאים אוטומטית בתוכנה.
- מדוד את האותות הציטופלזמיים mTurquoise2 ו-β-catenin בתימוציטים.
- בחר את קווי המתאר של תימוציטים שלמים בתמונת השדה הבהיר לפי אותם שלבים לעיל.
- בחר >3 אזורי רקע שבהם אין תאים והוסף אותם למנהל ההחזר על ההשקעה.
הערה: גודל וצורה אינם חיוניים במקרה זה. אזורים אלה ישמשו כמדידות רעשי רקע לחישוב הסופי.- הפעל את תמונת הערך האפור mTurquoise2 על ידי לחיצה עליה, והצג באופן חזותי את סך החזר ה-ROI של התאים ואזורי הרקע שנבחרו על ידי לחיצה על הצג הכל במנהל ההחזר על ההשקעה. שימו לב לכל האזורים שנבחרו המוצגים בתמונת mTurquoise2.
- לחצו על מדידה במנהל ההחזר על ההשקעה, או על ניתוח | למדוד. שימו לב לחלון התוצאות החדש שנפתח עם תוצאות המדידה של אות mTurquoise2.
- העבר את התוצאות לתוכנת חישוב גיליון אלקטרוני על ידי לחיצה על ערוך | בחר הכל והעתק/הדבק את הרשימה בגיליון האלקטרוני לצורך חישוב נוסף.
- הפעל את תמונת הערך האפור של β-catenin על ידי לחיצה עליה, ודמיין את סך החזר ה-ROI של התאים ואזורי הרקע שנבחרו על ידי לחיצה על הצג הכל במנהל ההחזר על ההשקעה. שימו לב לכל האזורים שנבחרו הגלויים בתמונת β-catenin.
- לחצו על מדידה במנהל ההחזר על ההשקעה, או על ניתוח | למדוד. שימו לב לחלון התוצאות החדש שנפתח עם תוצאות המדידה של האות הסלולרי הכולל β-catenin.
- העבר את התוצאות לתוכנת חישוב גיליון אלקטרוני על ידי לחיצה על ערוך | בחר הכל והעתק/הדבק את הרשימה בגיליון האלקטרוני לצורך חישוב נוסף. שמור את מנהל ההחזר על ההשקעה לעיון עתידי מבלי שתצטרך לחזור על בחירת התא על ידי לחיצה על עוד | שמר....
- חשב את הקרינה הגרעינית הכוללת המתוקנת (CTNF) עבור β-catenin פעיל באמצעות משוואה 1.
CTNF = צפיפות משולבת - (שטח × ממוצע שטחי רקע ממוצעים) (1) - חשב את הקרינה הכוללת המתוקנת של התאים (CTCF) עבור mTurquoise2 באמצעות משוואה 2.
CTCF = צפיפות משולבת - (שטח × ממוצע שטחי רקע ממוצעים) (2) - הבדיל בין β-קטנין גרעיני פעיל לבין β-קטנין ציטופלזמי על ידי הפחתת ערכי β-קטנין גרעיניים שהתקבלו בשלב 8.2.3.3. מסך ערכי β-catenin שהתקבלו בשלב 8.3.2.5 כדי להשיג את β-catenin הלא פעיל הציטופלזמי.
הערה: ודא שהמדידות נעשות באותו תא.- חשב את ממוצע העוצמה הממוצעת של אזורי הרקע. חשב CTNF ו-CTCF באמצעות משוואות 1 ו-2. התייחס ל - IntDen (סכום כל הפיקסלים באזור שנבחר) כצפיפות המשולבת ולא ל- RawIntDen.
- במידת הצורך, חשב את סטיית התקן של ערכי IntDen להתוויית גרפים. שקול עד 200 תאים נפרדים לניתוח סטטיסטי באמצעות מבחן Mann-Whitney U.
- התווה את התוצאות בגרף נקודת נתונים בודד וסמן את ציר ה- y בערכי CTNF או CTCF כיחידות פלואורסצנטיות יחסיות (RFU).
תוצאות
כדי לחקור את תפקידו של איתות Wnt קנוני, נבדק מודל מדווח Wnt קנוני Axin2-mTurquoise2 בשילוב עם ביטוי חלבון β-catenin. ידוע כי תימוציטים שבירים, מראים איתות Wnt קנוני נמוך במספר שלבים בתהליך התבגרות התימוציטים, ויש להם יחס ציטופלזמי לגרעין נמוך; כל הגורמים הללו מעכבים את הזיהוי של mTurquoise2 או β-catenin ציטופלזמי. על ידי ביצוע הפרוטוקול, תימוציטים של עכברים Axin2-mTurquoise2 נאספו מהתימוס ועובדו לתרחיפים חד-תאיים לניתוח ציטומטרי זרימה וקונפוקלי ציטוספין (איור 1) הן של Axin2-mTurquoise2 והן של סך β-catenin.
ניתוח ציטומטרי זרימה מקל על אפיון שלבי ההתבגרות השונים של התימוציטים כדי למדוד את נוכחותו של הפלואורוכרום mTurquoise2 לכל תת-קבוצה של תא כחלבון מדווח לאיתות Wnt קנוני פעיל. באות Axin2-mTurquoise2 גנוטיפים פראיים (wt), הטרוזיגוט (Tg/0) והומוזיגוט (Tg/Tg)-mTurquoise2 היה נוכח ברמות עולות, המייצגות את רמת ההפעלה של איתות Wnt קנוני בתוך תימוציטים כפולים חיוביים (DP) (איור 2). מכיוון שאין חלבון mTurquoise2 מוכנס, רמות wt mTurquoise2 מדגימות רעשי רקע; עם זאת, איתות Wnt קנוני עדיין יכול להתרחש בתאים אלה, אך פשוט אינו מומחש באמצעות מדווח. למרות זאת, היעדר אחד (Tg/0) או שניים (Tg/Tg) מהגנים Axin2 יכול להשפיע על פעילות האיתות הקנונית של Wnt מכיוון ש-Axin2 ממלא תפקיד חשוב בקומפלקס ההרס כדי לווסת לרעה את איתות ה-Wnt הקנוני הפעיל.
ניתן לבחון את עוצמת הפלואורסצנט הממוצעת או החציונית כדי לחקור את רמות הביטוי של מודל המדווח Axin2-mTurquoise2. עוצמת הפלואורסצנט החציונית והממוצע הגיאומטרי (איור 2C) הם הייצוגים הגרפיים הראשונים והשניים המועדפים ביותר עבור היסטוגרמות פלואורסצנטיות. העלייה בביטוי Axin2 ב-Tg/Tg בהשוואה ל-Tg/0, מרמזת על הפעלה מוגברת של איתות Wnt קנוני עקב היעדר Axin2 פונקציונלי ולכן, קומפלקס הרס לא מתפקד. כדי לאמת עוד יותר את רמות ההפעלה של מסלול האיתות הקנוני Wnt, בוצע צביעה חיסונית של ציטוספינים עם סך β-catenin בתוך תימוציטים Axin2-mTurquoise2. מכיוון שהמיקום הסלולרי של β-catenin מציין אם איתות ה-Wnt הקנוני מופעל, מדדנו את נוכחותו של β-catenin גרעיני או ציטופלזמי.
mTurquoise2 מתבטא בציטוזול ונראה בעיקר סביב הגרעינים (מתואר באדום TO-PRO-3 באיור 3A). מכיוון שלתימוציטים יש מעט מאוד ציטופלזמה, בחירת האזור צריכה להיעשות בזהירות כדי למדוד את כל האות (איור משלים 3). יש לנקוט בזהירות מיוחדת עם צביעה חיובית כוזבת או אות אוטופלואורסצנטי, כפי שמצוין על ידי החצים הלבנים. אותות הקרינה האלה מיוצרים בדרך כלל על ידי פסולת תאים ושניהם נראו בתמונות mTurquoise2 ו-AF568 (איור 3B,C ואיור 3D,E). תמונות בקרת wt לא מוכתמות מראות כי mTurquoise2 נראה גם בתימוציטים אלה אם כי הם אינם מכילים את מבנה המדווח Axin2-mTurquoise2. רעש רקע זה נובע ככל הנראה מאוטופלואורסצנציה והציטופלזמה הקומפקטית בתימוציטים29. עם זאת, עם בחירת שטח קפדנית ותיקון רקע נכון באמצעות נוסחת CTCF, איור 3B מראה ביטוי הולך וגובר של Axin2-mTurquoise2 בפאן-תימוציטים כפי שניתן לראות בניתוח הציטומטרי של הזרימה בתימוציטים DP.
כדי להבין עוד יותר את ההשפעה של הגן Axin2 הפגוע עקב מבנה המדווח Axin2-mTurquoise2 על קומפלקס ההרס וכך, הנוכחות של β-catenin, מדדנו את הביטוי של β-catenin AF568 גרעיני או ציטופלזמי בתימוציטים. איתות Wnt קנוני פעיל מונע על ידי נדידת β-catenin לתוך הגרעין, שם הוא יתקשר עם גורמי שעתוק TCF/LEF ולאחר מכן יפעיל את Axin2 כגן מטרה כדי לדכא את הפעלת המסלול. מכיוון ש-Axin2 מהווה חלק מקומפלקס ההרס הממלא תפקיד חשוב במיקוד β-catenin הציטופלזמי לפירוק פרוטאזומלי, היעדר או שיבוש של חלבון Axin2 עלול לגרום להצטברות של β-catenin גרעיני ו/או ציטופלזמי.
אנו מראים כי להטרוזיגוטה (Tg/0) Axin2-mTurquoise pan-thymocytes יש פחות ביטוי β-catenin גרעיני וציטופלזמי בהשוואה ל-wildtype (wt), מה שמרמז על כך שהוויסות של β-catenin עצמו משתנה. עם זאת, ב-Axin2-mTurquoise pan-thymocytes הומוזיגוט (Tg/Tg), ה-β-catenin הגרעיני גבוה יותר מאשר ב-wt, אף על פי שה-β-catenin הציטופלזמי דומה בין שני הגנוטיפים (איור 3C). זה מצביע על כך שמדידת רמות ה-β-catenin הכוללות יכולה לתת מידע נוסף על מסלול Wnt הקנוני בניגוד למדידה ישירה של β-catenin לא זרחני, המזהה באופן ספציפי β-catenin שאינו מיועד לפירוק פרוטאזומלי. עם זאת, יש לזכור כי הוויסות של β-catenin כלפי ביטוי גנים מונע Wnt קנוני, כגון של Axin2, מווסת על ידי מספר חלבונים אחרים שלא נבדקו בפרוטוקול זה.

איור 1: סקירה סכמטית ופשוטה של הפרוטוקול. (A) עיבוד בלוטת התימוס לתרחיף תאים, (B) פרוטוקול ציטומטריית זרימה, (C) הרכבת ציטוספינים, (D) פרוטוקול צביעה תוך-תאית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
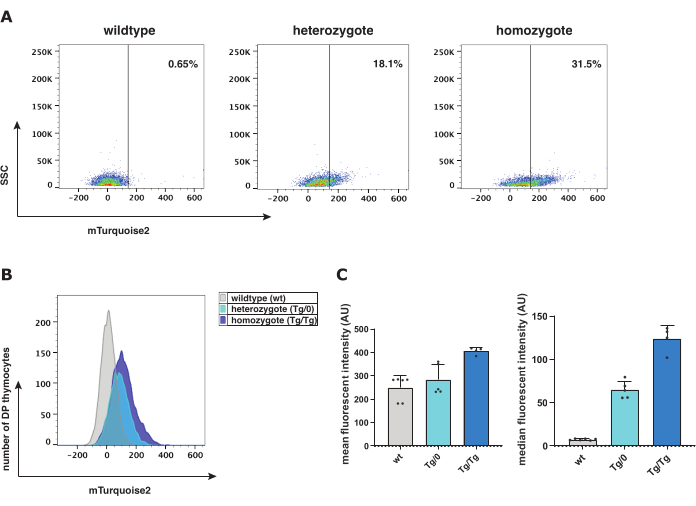
איור 2: ניתוח ציטומטריית זרימה של עכברי פרא (wt), הטרוזיגוט (Tg/0) והומוזיגוט (Tg/Tg) Axin2-mTurquoise2. (A) ייצוג של עלילת נקודות עם שער תימוציט mTurquoise2 DP ותזוזה של אוכלוסייה לפי גנוטיפ Axin2-mTurquoise2. (B) ייצוג של היסטוגרמה mTurquoise2 שמראה את טווחי עוצמת הקרינה בין גנוטיפים של עכברים של תימוציטים DP. (C) ייצוג גרף עמודות של עוצמת הפלואורסצנט הממוצעת והחציונית עם פסי שגיאה של סטיית תקן של גנוטיפים Axin2-mTurquoise2 בתימוציטים DP (סה"כ 5 wt; 5 Tg/0 ו-4 Tg/Tg עכברים). קיצורים: DP = חיובי כפול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
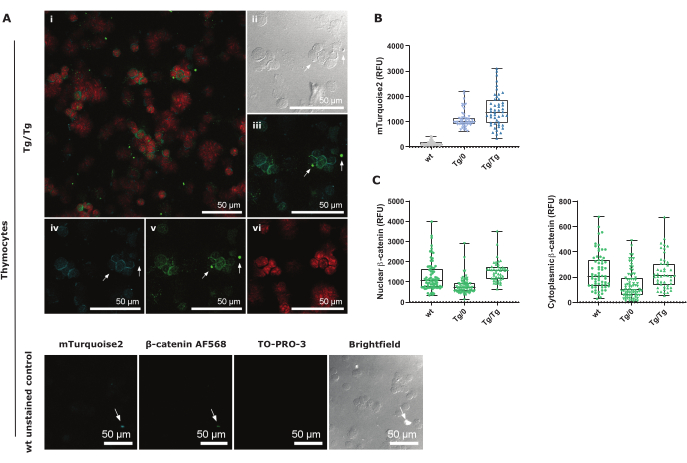
איור 3: ייצוג תמונה קונפוקלי של הליך הציטוספין הכולל של תימוציט ובקרות שצולמו ב-40x עם גורם זום של 1.5. (A) Tg/Tg (הומוזיגוט) Axin2-mTurquoise2 תימוציטים צבועים בגרעין TO-PRO-3 וסך β-catenin AF568, כמו גם ביטוי mTurquoise2 ציטופלזמי אנדוגני. i הוא דימוי קונפוקלי של כל שלושת הצבעים; II היא תמונה בהירה; iii הוא Axin2-mTurquoise2 וסה"כ β-catenin AF568; iv הוא תקריב mTurquoise2; v הוא תקריב כולל של β-catenin AF568; vi הוא תקריב גרעיני TO-PRO-3. החלונית התחתונה מכילה תמונות בקרה לא מוכתמות עבור כל ערוץ תמונה. חיצים לבנים מייצגים מיקום זהה בכל התמונות ומדגימים את האות החיובי השגוי עקב פסולת. פסי קנה מידה = 50 מיקרומטר. (B) ייצוג Boxplot של ערכי עוצמת CTCF mTurquoise2 עבור כל הגנוטיפים של Axin2-mTurquoise2 (50-70 תאים לכל גנוטיפ). (C) ייצוג Boxplot של ערכי העוצמה הכוללים של β-catenin AF568 CTNF ו-CTCF-CTNF עבור β-catenin פעיל גרעיני ו-β-catenin ציטוזולי לא פעיל, בהתאמה, עבור כל הגנוטיפים של Axin2-mTurquoise2 (50-70 תאים לכל גנוטיפ). קיצורים: CTCF = פלואורסצנטיות תאים כוללת מתוקנת; CTNF = פלואורסצנציה גרעינית כוללת מתוקנת; RFU = יחידות פלואורסצנטיות יחסיות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| לוח מכתים DN | פלואורוכרום | נוגדן |
| פיטק | תקליטור 127 | |
| PE | CD25 | |
| PE-CY7 | סטרפטווידין (SAV) | |
| נגמ"ש | תקליטור 117 | |
| נגמ"ש - CY7 | CD44 | |
| PerCP | תקליטור 135 | |
| V450 | x | |
| V500 | x | |
| לין- | ||
| ביוטין | טר119 | |
| GR1 | ||
| CD11b | ||
| ב220 | ||
| NK1.1 | ||
| תקליטור 3 | ||
| תקליטור 4 | ||
| תקליטור 8 | ||
| לוח צביעה ISP/DP/SP | ||
| פיטק | TCRb | |
| PE | TCRgd | |
| PE-CY7 | תקליטור 4 | |
| נגמ"ש | תקליטור 3 | |
| נגמ"ש - CY7 | סטרפטווידין (SAV) | |
| PerCP | תקליטור 8 | |
| V450 | x | |
| V500 | x | |
| לין- | ||
| ביוטין | טר119 | |
| GR1 | ||
| CD11b | ||
| ב220 | ||
| NK1.1 | ||
| 1. צבעו את התימוציטים עם לוח שושלת ביוטין שלילי (Lin-). | ||
| 2. מכתים את התימוציטים בלוח סמן תאי התימוציט. | ||
טבלה 1: לוחות נוגדנים לאפיון פני התא עבור ציטומטריית זרימה. צביעת תימוציט DN דו-שלבי, צביעת תימוציט ISP, DP ו-SP דו-שלבית. קיצורים: DN = שלילי כפול; DP = חיובי כפול; SP = חיובי יחיד; ISP = חיובי יחיד לא בשל; PE = פיקואריתרין; APC = אלופיקוציאנין; FITC = פלואורסצאין איזותיוציאנט.
איור משלים 1: תאימות פלואורוכרום mTurquoise2 ו-FITC (A) ספקטרום עירור ופליטה פלואורסצנטי של mTurquoise2 (כחול) ו-FITC (ירוק), המייצגים חפיפה ספקטרלית מינימלית. קווים דקים מייצגים את קווי הלייזר כדי לעורר mTurquoise2 (405 ננומטר) ו-FITC (488 ננומטר). עקומות לא ממולאות מייצגות את ספקטרום העירור כפי שהעקומות המלאות מייצגות את ספקטרום הפליטה של הפלואורוכרומים שצוינו. כחול מתאים ל-mTurquoise2, וירוק מתאים ל-FITC. מסנני הפס (אזור אפור המכסה את ספקטרום הפליטה) 470/20 ו-530/30 עבור mTurquoise2 ו-FITC, בהתאמה, שימשו במהלך ציטומטריית זרימה. (B) מטריצת פיצוי פליטת פלואורוכרום תוכנה בתוך תוכנית הניתוח הציטומטרי של הזרימה של תימוציטים Axin2-mTurquoise2 DP המציגה את הדימום הספקטרלי של הפלואורוכרום בין mTurquoise2 (ציר y) לבין הפלואורוכרומים האחרים (ציר x) המשמשים לאפיון תימוציטים DP. לא זוהה דימום ספקטרלי בין mTurquoise2 ל-FITC (תיבה ירוקה), בעוד שבעיות דימום ספקטרלי זוהו בין mTurquoise2 לפלואורוכרום דמוי ציאן AmCyan (קופסה אדומה). ערוץ ציטומטר הזרימה V450 שימש למדידת הפלואורוכרום mTurquoise2, המיוצג על ציר ה-y כ-comp-mTurquoise2. קיצורים: FITC = פלואורסצאין איזותיוציאנט; DP = חיובי כפול; V450 = סגול 450. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: תוכנית זרימת עבודה של תוכנת ניתוח ציטומטריית זרימה עבור אסטרטגיית שער תאים חיוביים mTurquoise2. הסבר שלב על התאמת הגדרות הטרנספורמציה לאסטרטגיית שער mTurquoise2 טובה יותר. ייצוג של אוכלוסיית תימוציטים חיוביים כפולים Axin2-mTurquoise2 Tg/Tg (הומוזיגוט). אנא לחץ כאן להורדת קובץ זה.
איור משלים 3: סכמת זרימת עבודה של תוכנת ניתוח תמונה למדידת עוצמת פלורסנט. הסבר שלב על בחירה ומדידה של נתוני עוצמת הפלואורסצנט לחישוב CTCF של חישוב mTurquoise2 או CTNF של β-catenin-AF568 פעיל. (א) תמונת שדה בהיר; (B) תמונת mTurquoise2; (C) צביעה גרעינית TO-PRO-3; (D) תמונת AF568 כוללת של β קטנין. תיבות מרובעות הן אזורי אות רקע לשימוש בחישובי CTCF ו-CTNF. פסי קנה מידה = 50 מיקרומטר. קיצורים: CTCF = פלואורסצנטיות תאים כוללת מתוקנת; CTNF = פלואורסצנטיות גרעינית כוללת מתוקנת. אנא לחץ כאן להורדת קובץ זה.
Discussion
מספר מדווחים קנוניים של Wnt זמינים עם רגישות מדווח שונה וחלבוני מדווח בפועל. מודלים מדווחים המשתמשים באתרי קשירה מרובי TCF/LEF שהוכנסו באופן סינתטי זמינים עם חלבוני מדווח פלואורסצנטיים; עם זאת, חזרות כאלה של טרנסגנים עלולות ללכת לאיבוד במהלך רבייה או ניסויים ארוכים in vivo ויכולות להיות רגישות לאותות שאינם Wnt מרצפים גנומיים מסביב המשפיעים על ביטוי המדווח. לכן, המדווח הנפוץ ביותר נותר הגרסה הישנה יותר Axin2-LacZ, למרות הקושי להשתמש בו בתאים חיים.
מודל הדיווח הקנוני של Axin2-mTurquoise2, מציע את אותה אמינות מדווח כמו Axin2-LacZ, אם כי בפשטות של חלבון מדווח פלואורסצנטי בהיר ויציב יחסית. חלבון פלואורסצנטי זה של וריאנט ציאן שימושי להדמיה ארוכת טווח וניתן לשלב אותו בקלות עם הנוגדנים הנפוצים ביותר פלואורוכרומים25. עם זאת, יש לקחת בחשבון מגבלות אפשריות לגבי חדירה תלת מימדית ואוטופלואורסצנציה בעת שימוש במודלזה 29. מכיוון שייצוב גרעיני β-catenin הוא מניע מדווח Wnt קנוני, רוב הניסויים המולקולריים דורשים זיהוי של β-catenin מוגבר או פעיל כדי לאמת איתות Wnt פעיל. עם זאת, ביטוי β-catenin ידוע לשמצה נמוך וקשה לזהות עבורו Axin2 עשוי להיות סמן טוב יותר. בפרוטוקול זה, אנו מסבירים כיצד לשלב את מודל המדווח Axin2-mTurquoise2 עם צביעה ציטולוגית של תימוציט חד-תאי של סך β-catenin-AF568 גרעיני למרות איתות פלואורסצנטי נמוך.
שלבים קריטיים במודל זה קשורים בעיקר לזיהוי נכון של ביטוי Axin2-mTurquoise2 ו-β-catenin-AF568 הנמוך. לפיכך, פרוטוקול זה מתאר את זיהוי האותות המקסימלי האפשרי בתימוציטים, הידועים כבעלי כדאיות תאים נמוכה, מה שמוביל לאוטופלואורסצנציה מוגברת. זה רלוונטי לתימוציטים, שעוברים אפופטוזיס טבעי במהלך בחירת התימוציטים תחת הגדרה פיזיולוגית בתימוס. לכן, אנו מאמינים כי הדגמת זיהוי ביטוי נמוך של Axin2-mTurquoise2 ו-β-catenin-AF568 בתאים אלה תקדם את הישימות של מודל Axin2-mTurquoise2.
כדי להשיג תוצאות אמינות, יש לנקוט בזהירות מיוחדת בכוונון עדין נכון של הציוד. כדי להבטיח הבחנה בין אות אמיתי לאות רקע, נדרשת הכללה של מספר בקרות חיוביות ושליליות כדי לכייל נכון את ציטומטריית הזרימה וציוד הדמיה קונפוקלי. אנו מציעים שימוש בקווי תאים יציבים המבטאים mTurquoise2, כגון תאי 293T, כבקרה חיובית בשל קלות הטרנספקציה שלהם, ביטוי Wnt קנוני במצב יציב על פני ספקטרום עוצמה רחב, ורגישות לתרכובות המפעילות מסלול Wnt כגון ליתיום כלוריד (LiCl), 6-bromoindirubin-3'-oxime, או CHIR99021 31,32,33. יש חשיבות עליונה להשתמש בבקרות עם אותו חלבון מדווח mTurquoise2 בדיוק, שכן העירור, ספקטרום הפליטה ועוצמת הפלואורסצנט קובעים את ערכי הפיצוי כנגד זליגה ספקטרלית של פלואורוכרומים אחרים בציטומטריית זרימה או הגדרת טווחי מסנן הזיהוי במיקרוסקופיה קונפוקלית.
בנוסף, בקרה חיובית הומוזיגוטה שנייה של Axin2-mTurquoise2 על התאים המעניינים, המכילה פי 2 ממבנה המדווח Axin2-mTurquoise2, מומלצת כדי להתאים לטווחי עוצמת פלואורסצנטיות mTurquoise2 המתבטאים פיזיולוגית, במיוחד במקרה של תאים בעלי ביטוי נמוך. בהתחשב בכך שאיתות Wnt קנוני תלוי במינון מה שמוביל לביטוי מדווח תנודתי, יש צורך בבקרה שלילית כדי לשלול חשיפת יתר של עוצמת הלייזר, להגדיר יחס אות/רעש סביר ולהגדיר את סף הביטוי החיובי האמיתי של mTurquoise2.
כמו בזרימה ציטומטרית, תוספת של סמני אפיון מרובים היא פרקטיקה קונבנציונלית; יש לבחור פלואורוכרומים תואמים עם זליגה ספקטרלית מינימלית. השילוב של FITC או Alexa Fluor 488 (AF488) עם חלבון המדווח mTurqoise2 אמור לתת הפרעה ספקטרלית מינימלית בהגדרת ציטומטר הזרימה המוצגת בפרוטוקול זה. כאשר משווים את הספקטרום הפלואורסצנטי של שני הפלואורוכרומים, mTurquoise2 נרגש באופן מינימלי על ידי לייזר 488 (יעילות של 1%), שניתן להזניח במיוחד בתאי מדווח mTurquoise2 בעלי ביטוי נמוך. לכן, כל אות FITC חיובי כוזב משמעותי בתימוציטים אינו צפוי. במקרה של מיקרוסקופיה קונפוקלית ובמיוחד עם ההגדרות הקונפוקליות המוצעות, השימוש בפלואורוכרומים FITC או AF488 אינו מומלץ מכיוון שאין אפשרות לפיצוי מלבד ביטול משמעותי של אותות בתוכנת עיבוד תמונה. במקום זאת, יש לבחור פלואורוכרומים אחרים, כגון AF568, כדי לזהות באופן מלא את ביטוי mTurquoise2 הנמוך ללא בעיות חפיפה ספקטרליות.
כאשר עובדים עם תאים המבטאים mTurquoise2 גבוהים או שיש להם זמינות של לייזר 440 ננומטר במיקרוסקופ הקונפוקלי וצמצום טווח מסנן הפליטה, השימוש ב-FITC או AF488 יכול להיות אפשרי, עם זאת, ידוע שביטוי Axin2 נמוך ברוב הרקמות הבוגרות. בפרוטוקול שלנו, מדדנו את הביטוי הכולל של β-catenin עם הליך תיוג AF568 דו-שלבי בעל ביצועים גבוהים המבטיח צביעה חיסונית יעילה של חלבונים בעלי יציבות מצומדת נמוכה כגון β-catenin. השלבים בפרוטוקול הצביעה החיסונית עברו אופטימיזציה למדידת β-catenin חיובי אמיתי בציטופלזמה או בגרעין ללא נוכחות של אות רקע גבוה. ניתן להשתמש בפרוטוקול צביעה דומה על תרביות ראשוניות והקפאות, אולם כאשר עובדים עם סוגי תאים שונים, יש לבדוק את שלבי הקיבוע. למודל Axin2-mTurquoise2 יש רק פונקציית מדווח ולכן לא יהיה שימושי לניסויי מעקב אחר תאים כמו מודלים אחרים של Axin222. למעשה, מודלים אלגנטיים אלה של Cre-re-combination Wnt שימושיים בעיקר לניסויי הדמיית רקמות ולא לתרחיפים תאים שמאבדים את ההקשר הסביבתי שלהם. למרות שמודל Axin2-mTurquoise2 משבש את פונקציונליות הגן Axin2 עקב החדרתו הגנטית, תכונה זו שימושית לחקר מודלים של נוק-אאוט של Axin2 עבור מטרות טיפוליות של Wnt.
לעכבר הומוזיגוט חסר פונקציונליות של Axin2, מה שמעכב את אינטראקציית החלבון שלו לזרחון של β-catenin בקומפלקס ההרס34; עם זאת, ביטוי המדווח mTurquoise2 עוזר להראות אם איתות Wnt קנוני נשאר פעיל דרך מסלול חלופי. יש לציין כי Axin2 ממלא גם תפקיד חשוב בקומפלקס הקולטן המקורזל/LRP של Wnt על קשירת ליגנד Wnt, ומציע נקודת ויסות Wnt מעניינת נוספת במפל האיתות35. מלבד מודל העכברים Axin2-mTurquoise2, מבנה מדווח דומה שימושי לטרנסגנזה חולפת וניתן למקד אותו במיוחד ללוקוס Axin2 האנדוגני באמצעות טכנולוגיית CRISPR-Cas921. לסיכום, דוח זה מתאר דרך קלה וחזקה לנתח את מודל המדווח Axin2-mTurquoise2 עבור תימוציטים בעלי ביטוי Axin2 נמוך. ניתן ליישם פרוטוקול זה על סוגי תאים קנונים אחרים המבטאים Wnt להקרנות תרופות והגדרת מטרה טיפולית פונקציונלית של Wnt.
Disclosures
המחברים מצהירים שאין ניגוד עניינים.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי מענק מאוניברסיטת ליידן לתחום הפרופיל רפואה רגנרטיבית לפיתוח מודלים חדשים של עכברים.
Materials
| Name | Company | Catalog Number | Comments |
| BD FACScantoII flow cytometer | BD Biosciences | not aplicable | Serial number V96300710. The flow cytometer setup in this protocol contains a 405 nm laser line with 505 longpass filter and 530/30 nm bandpass filter, and 470/20 nm bandpass filter; a 488 nm laser with 735 nm longpass filter and 780/60 nm bandpass filter, 670 nm longpass filter and 655 nm longpass filter, 610 nm longpass filter, 550 nm longpass filter and 575/26 nm bandpass filter, 505 nm longpass filter and 530/30 nm bandpass filter, and 488/10 nm bandpass filter; and a 633 nm laser line with 735 nm longpass filter and 780/60 nm bandpass filter, 685 nm longpass filter, and 660/20 nm bandpass filter. |
| BSA | Sigma | A9647 | |
| Corning 70 μm cell strainer | Falcon/Corning | 352350 | |
| Cytospin 4 Type A78300101 | Thermo Scientific | not aplicable | |
| DMSO | Sigma Aldrich | D5879-1L | |
| DNAse I | Sigma | A9647 | |
| Falcon 50 mL Conical Centrifuge tubes | Greiner bio-one | 227261 | |
| Falcon round-bottom Polystyrene Test tubes with cell strainer snap cap | Fisher Scientific | 352235 | |
| Fetal Calf Serum (FCS) | Greiner Bio-One B.V. | not aplicable | Depends on origin |
| Fiji software | ImageJ | not aplicable | Version 1.53 |
| Filter card white (for cytospin) | VWR | SHAN5991022 | |
| FlowJo 10 software | Treestar | not aplicable | Version 10.5.3 |
| Frost slides | Klinipath | ||
| Gibco IMDM medium | Fisher Scientific | 12440053 | |
| HCX PL APLO 40x 1.4 OIL lens | Leica microsystems | not aplicable | |
| Hydrophobic pen: Omm Edge pen | Vector | not aplicable | |
| Leica TCS SP5 DMI6000 | Leica microsystems | not aplicable | The microscope setup in this protocol consisted of an HCX PL APO 40x/1.2 oil-immersion objective with 8-bit resolution, 1024 pixels x 1024 pixels, 400 Hz speed, pinhole 68 µm, and zoom factor of 1.5 at room temperature. This system contains a 405 diode laser, argon laser, DPSS 561 laser, HeNe 594 laser and HeNe 633 laser with 4 hybrid detectors (HyDs) and 5 photomultiplier tubes (PMTs). |
| Methanol | VWR | 1060091000 | |
| NaN3/sodium azide | Hospital farmacy | not aplicable | |
| Normal mouse serum | Own mice | not aplicable | |
| PBS | Lonza | BE17-517Q | |
| ProLong Diamond Antifade Mountant | Fisher Scientific | P36965 | |
| Purified mouse anti-β-catenin (CTNNB1) | BD Biosciences | 610154 | |
| TO-PRO-3 Iodide | Thermofisher | T3605 | |
| Transparent nailpolish | at any drugstore | not aplicable | |
| Tween-20 | Sigma Aldrich | P1379-500ml | |
| Zenon Alexa Fluor 568 Mouse IgG1 labeling kit | Thermofisher | Z25006 |
References
- Kahn, M. Can we safely target the WNT pathway. Nature Reviews. Drug Discovery. 13 (7), 513-532 (2014).
- Jung, Y. S., Park, J. I. Wnt signaling in cancer: therapeutic targeting of Wnt signaling beyond beta-catenin and the destruction complex. Experimental & Molecular Medicine. 52 (2), 183-191 (2020).
- Gao, K., Zhang, T., Wang, F., Lv, C. Therapeutic Potential of Wnt-3a in neurological recovery after spinal cord injury. European Neurology. 81 (3-4), 197-204 (2019).
- Jia, L., Pina-Crespo, J., Li, Y. Restoring Wnt/beta-catenin signaling is a promising therapeutic strategy for Alzheimer's disease. Molecular Brain. 12 (1), 104(2019).
- Bae, S. M., Hong, J. Y. The Wnt signaling pathway and related therapeutic drugs in autism spectrum disorder. Clinical Psychopharmacology and Neuroscience. 16 (2), 129-135 (2018).
- Tajer, P., Pike-Overzet, K., Arias, S., Havenga, M., Staal, F. J. T. Ex vivo expansion of hematopoietic stem cells for therapeutic purposes: Lessons from development and the niche. Cells. 8 (2), 169(2019).
- Yanai, K., et al. Crosstalk of hedgehog and Wnt pathways in gastric cancer. Cancer Letters. 263 (1), 145-156 (2008).
- Blank, U., et al. An in vivo reporter of BMP signaling in organogenesis reveals targets in the developing kidney. BMC Developmental Biology. 8, 86(2008).
- Duncan, A. W., et al. Integration of Notch and Wnt signaling in hematopoietic stem cell maintenance. Nature Immunology. 6 (3), 314-322 (2005).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- Lustig, B., et al. Negative feedback loop of Wnt signaling through upregulation of conductin/Axin2 in colorectal and liver tumors. Molecular and Cellular Biology. 22 (4), 1184-1193 (2002).
- Bernkopf, D. B., Hadjihannas, M. V., Behrens, J. Negative-feedback regulation of the Wnt pathway by conductin/axin2 involves insensitivity to upstream signalling. Journal of Cell Science. 128 (1), 33-39 (2015).
- Vassar, R., Rosenberg, M., Ross, S., Tyner, A., Fuchs, E. Tissue-specific and differentiation-specific expression of a human K14 keratin gene in transgenic mice. Proceedings of the National Academy of Sciences of the United States of America. 86 (5), 1563-1567 (1989).
- DasGupta, R., Fuchs, E. Multiple roles for activated LEF/TCF transcription complexes during hair follicle development and differentiation. Development. 126 (20), 4557-4568 (1999).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
- Mohamed, O. A., Clarke, H. J., Dufort, D. beta-catenin signaling marks the prospective site of primitive streak formation in the mouse embryo. Developmental Dynamics. 231 (2), 416-424 (2004).
- Moriyama, A., et al. GFP transgenic mice reveal active canonical Wnt signal in neonatal brain and in adult liver and spleen. Genesis. 45 (2), 90-100 (2007).
- Currier, N., et al. Dynamic expression of a LEF-EGFP Wnt reporter in mouse development and cancer. Genesis. 48 (3), 183-194 (2010).
- Ferrer-Vaquer, A., et al. A sensitive and bright single-cell resolution live imaging reporter of Wnt/beta-catenin signaling in the mouse. BMC Developmental Biology. 10, 121(2010).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- de Roo, J. J. D., et al. Axin2-mTurquoise2: A novel reporter mouse model for the detection of canonical Wnt signalling. Genesis. 55 (10), (2017).
- van de Moosdijk, A. A. A., van de Grift, Y. B. C., de Man, S. M. A., Zeeman, A. L., van Amerongen, R. A novel Axin2 knock-in mouse model for visualization and lineage tracing of WNT/CTNNB1 responsive cells. Genesis. 58 (9), 23387(2020).
- Choi, Y. S., et al. Distinct functions for Wnt/beta-catenin in hair follicle stem cell proliferation and survival and interfollicular epidermal homeostasis. Cell Stem Cell. 13 (6), 720-733 (2013).
- Nolan, G. P., Fiering, S., Nicolas, J. F., Herzenberg, L. A. Fluorescence-activated cell analysis and sorting of viable mammalian cells based on beta-D-galactosidase activity after transduction of Escherichia coli lacZ. Proceedings of the National Academy of Sciences of the United States of America. 85 (8), 2603-2607 (1988).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3, 751(2012).
- Bernkopf, D. B., Bruckner, M., Hadjihannas, M. V., Behrens, J. An aggregon in conductin/axin2 regulates Wnt/beta-catenin signaling and holds potential for cancer therapy. Nat Commun. 10 (1), 4251(2019).
- Joosen, L., Hink, M. A., Gadella, T. W., Goedhart, J. Effect of fixation procedures on the fluorescence lifetimes of Aequorea victoria derived fluorescent proteins. Journal of Microscopy. 256 (3), 166-176 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Reviews. 11, 227-256 (2005).
- Henriksson, J., et al. Endrov: an integrated platform for image analysis. Nature Methods. 10 (6), 454-456 (2013).
- Hedgepeth, C. M., et al. Activation of the Wnt signaling pathway: a molecular mechanism for lithium action. Developmental Biology. 185 (1), 82-91 (1997).
- Sato, N., Meijer, L., Skaltsounis, L., Greengard, P., Brivanlou, A. H. Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nature Medicine. 10 (1), 55-63 (2004).
- Ring, D. B., et al. Selective glycogen synthase kinase 3 inhibitors potentiate insulin activation of glucose transport and utilization in vitro and in vivo. Diabetes. 52 (3), 588-595 (2003).
- Liu, C., et al. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 108 (6), 837-847 (2002).
- Zeng, X., et al. Initiation of Wnt signaling: control of Wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions. Development. 135 (2), 367-375 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved