Method Article
Axin2-mTurquoise2 Reporter Thymocytes에서 낮은 Wnt 발현의 유세포 분석 및 컨포칼 이미징 분석
요약
신호 수준은 세포의 운명을 조절하는 것으로 알려져 있으며, 이는 Wnt 신호 전달의 조절이 흥미로운 치료 표적을 구성한다는 것을 나타냅니다. 여기에서는 뚜렷한 Wnt 신호 수준을 측정하는 강력한 쥐 표준 Wnt 신호 리포터 모델에 대한 유세포 분석 및 컨포칼 현미경 분석 방법에 대해 설명합니다.
초록
Wnt 발현 수준을 측정하는 것은 새로운 Wnt 치료 표적을 식별하거나 테스트하려고 할 때 필수적입니다. 이전 연구에서는 표준 Wnt 신호전달이 투여 기반 메커니즘을 통해 작동한다는 것을 보여주었으며, 이는 다양한 세포 유형에서 Wnt 신호전달을 연구하고 측정해야 할 필요성을 유발했습니다. 생리학적 Wnt 발현을 나타내기 위해 여러 리포터 모델이 제안되었지만, 유전적 맥락 또는 리포터 단백질이 이러한 도구의 유효성, 정확성 및 유연성에 큰 영향을 미쳤습니다. 본 논문은 변이된 Axin2em1Fstl 대립유전자를 포함하는 Axin2-mTurquoise2 마우스 Wnt 리포터 모델로 얻은 데이터를 획득하고 분석하는 방법을 설명합니다. 이 모델은 광범위한 Wnt 활성에 걸쳐 개별 세포에서 내인성 표준 Wnt 신호 전달에 대한 연구를 용이하게 합니다.
이 프로토콜은 세포 표면 마커 또는 β-catenin 세포 내 염색과 결합된 조혈계의 세포 집단 분석을 사용하여 Axin2-mTurquoise2 리포터 활성을 완전히 평가하는 방법을 설명합니다. 이러한 절차는 다른 관심 조직 또는 세포에서 구현 및 증식을 위한 기초 역할을 합니다. 형광 활성화 세포 분류와 컨포칼 이미징을 결합하여 뚜렷한 표준 Wnt 발현 수준을 시각화할 수 있습니다. 권장되는 측정 및 분석 전략은 표준 Wnt 신호의 정확한 평가를 위해 형광 발현 수준에 대한 정량적 데이터를 제공합니다. 이러한 방법은 표준 Wnt 발현 패턴에 Axin2-mTurquise2 모델을 사용하려는 연구자에게 유용할 것입니다.
서문
표준 Wnt 신호전달은 건강한 조직 항상성 및 질병과 관련된 보존된 신호 전달 경로입니다. Wnt 신호 수준의 정확한 조절은 배아 발달에 중요한 것으로 밝혀졌지만 성체 조직에서도 매우 중요합니다. 표준 Wnt 신호는 장, 피부 및 조혈계와 같은 여러 기관의 조직 재생에 중요한 역할을 하는 것으로 밝혀졌습니다. 따라서 Wnt 신호전달이 규제가 완화되면 심각한 병리가 발생합니다. 대장암, 간암, 피부암, 신경질환 및 특정 혈액 악성 종양은 조절되지 않은 Wnt 신호가 원인 요인 또는 기여자인 예시적인 병리학이다1. 따라서, 서로 다른 Wnt 표적에 대한 여러 억제제가 현재 Wnt 관련 암 치료제2로 임상 시험에서 테스트되고 있습니다.
또한, 신경학적 회복, 노화 관련 신경 장애 및 선천성 자폐 스펙트럼 장애에 대한 Wnt 치료 잠재력에 대한 흥미로운 발전이 이루어지고 있습니다 3,4,5. Wnt 신호는 후속 이식을 위한 줄기세포의 체외 확장에 대해 탐색되었습니다6. 그러나 표준 Wnt 신호전달의 치료적 표적화는 많은 기본 세포 기능에서의 중요성과 다른 경로와의 혼선으로 인해 어려운 시도이며, 7,8,9 해석하기 쉬운 모델에서 이러한 Wnt 치료제의 효과를 정확하게 측정해야 할 필요가 있습니다. 표준 Wnt 신호전달은 단거리의 용해성 Wnt 리간드에 의해 유도되며, 이는 인접 세포에 의해 분비되거나 다양한 Wnt 반응성 줄기세포 유형에서 보고된 바와 같이 자가분비 배설로 분비됩니다.
Wnt Frizzled 수용체와 지단백질 수용체 관련 단백질(LRP) 공동 수용체는 이러한 리간드에 반응하여 세포 내 신호 캐스케이드를 유발합니다. Wnt 신호가 꺼지면 축억제제(Axin), 종양억제인자 유전자 산물, 선종성 용종대장균(APC), 카제인 키나아제1(CK1α), 글리코겐 합성효소효소(GSK-3β)로 구성된 파괴 복합체가 프로테아좀 분해에 의한 β-카테닌(CTNNB1)의 축적을 방지합니다. Wnt 리간드-수용체 결합에 따라 파괴 복합체가 비활성화되어 세포질에서 β-카테닌이 축적되고 안정화됩니다. 활성 β-카테닌은 핵으로 이동하여 전사 인자/림프구 인핸서 결합 인자(TCF/LEF) 전사 인자에 결합하여 Wnt 표적 유전자의 전사를 시작할 수 있습니다. Axin2는 Wnt 경로10의 직접 표적이기 때문에 표적 유전자로 간주됩니다. 또한, Axin2는 활성 표준 Wnt 신호전달 11,12에 대한 리포터 유전자뿐만 아니라 음성 조절자 역할을합니다.
몇 가지 표준 Wnt 신호 보고자가 문헌에 설명되어 있으며 배아 발달에서 Wnt 신호의 역할을 이해하는 데 큰 도움이 되었습니다. 이러한 기자들의 대부분은 내인성 표적 유전자 13,14,15,16,17,18,19를 사용하지 않는 합성으로 삽입된 TCF/LEF 결합 부위를 사용합니다. 또한, 유전자 11,20,21,22,23의 자연적 위치를 존중하는 Axin2 넉인 전략이 사용되었으며, 그 중 Axin2-LacZ는 일반적으로 가장 강력한 표준 Wnt 리포터11로 받아들여집니다. 그러나 리포터 단백질 LacZ는 대부분의 조직에서 사용하기 쉽지만 살아있는 세포에 가혹한 것으로 알려진 β-갈락토시다아제 기질을 필요로 합니다24. 특히 줄기세포와 흉선세포의 경우, 가혹한 LacZ 검출 조건은 세포 현탁액을 처리할 때 세포 사멸(자체 보고되지 않은 데이터)을 증가시킵니다.
LacZ 염색으로 인한 신호 증폭은 낮은 신호를 감지하는 데 편리하지만, 정량화를 덜 직접적으로 만들어 신뢰성이 떨어집니다. 따라서 쥐 리포터 모델은 Axin2-LacZ 유전자 전략을 모방하도록 설계되었지만 mTurquoise2 리포터 단백질21을 사용하여 생리학적 발현 수준에 더 직접적이고 가까운 판독값을 제공합니다. mTurquoise2 형광 단백질은 높은 밝기(양자 수율(QY)= 0.93), 광범위한 세포 표면 특성화를 위한 다른 형광 단백질과 결합할 수 있는 유연성, 외인성 기질이 필요하지 않기 때문에 LacZ를 대체할 수 있는 탁월한 단백질입니다. 또한, 녹색 형광 단백질(GFP)과의 밀접한 유전적 관계는 극도로 Wnt에 민감한 세포에서 필요한 경우 더 강력한 신호 검출을 위해 대부분의 GFP 인식 형광 항체를 사용할 수 있는 가능성을 제공합니다25.
Axin2-mTurquoise2 모델은 표준 Wnt 리포터일 뿐만 아니라 Axin2 이형접합체 및 동형접합체(Axin2 knock-out) 표현형을 연구할 수 있는 가능성을 제공합니다. Axin2 의 시작 부위에 mTurquoise2를 표적 삽입하면 Axin2 단백질이 파괴됩니다21. Conductin으로도 알려진 Axin2는 Wnt 파괴 복합체의 일부이고 파괴 복합체는 β-catenin 매개 전사를 엄격하게 조절하기 때문에 부분적 또는 완전한 부재는 다양한 병리학을 연구하는 데 흥미로울 수 있습니다. 예를 들어, 결장직장암에서 Axin2 수치는 Wnt 과활성화11로 인해 상대적으로 높습니다. 그러나 다른 병리학에서 그 역할은 아직 크게 알려지지 않았습니다. 비록 액신2가 β-카테닌의 분해에 제한적인 역할을 하는 것으로 간주되지만, Wnt-매개 결장직장암 성장을 차단하는 작은 펩타이드를 첨가함으로써 Wnt 조절에 대한 액신2의 역할을 강화할 수 있다26.
전체적으로 Wnt 치료 표적을 통한 신중한 Wnt 조절은 심각한 병리학의 발병 또는 발달을 변화시킬 수 있는 기회를 열 수 있으며 보고자 역량이 있는 모델에서 추가 조사가 이루어져야 합니다. 이 보고서에서는 유세포 분석 및 컨포칼 이미징을 위한 Axin2-mTurquoise2 쥐 모델의 모범 사례 분석 방법을 설명합니다. Wnt 투여량 수준의 맥락에서 매우 낮은 표준 Wnt 신호 수준은 감지하기 어려우며, 이에 대해 고급 감지 및 분석 기능은 이 모델의 이점을 완전히 도출할 수 있는 이점을 제공합니다. 흉선세포는 취약한 세포 생존력, 낮은 표준 Wnt 신호 발현 및 응축된 세포질 영역으로 인해 Axin2-mTurquoise2 모델의 검출 민감도를 나타내는 모델 시스템으로 사용됩니다. 또한, 흉선세포 세포 현탁액에 대한 조직학적 총 β β-카테닌 염색 절차를 통해 세포질 -카테닌 수치를 측정하고 리포터와 함께 핵 활성 표준 Wnt 신호를 검증할 수 있다고 설명합니다.
프로토콜
참고: 모든 생쥐 절차는 Leiden University Medical Center(LUMC) 동물 실험 윤리 위원회의 승인을 받아 수행되었습니다. 수컷 및 암컷, 6-12주령, Axin2-mTurquoise2 리포터 구조체가 삽입되지 않은 야생형(wt), Axin2-murquoise2 리포터 구조체를 한 번 삽입한 이형접합성(Tg/0), 따라서 하나는 Axin2 유전자를 파괴하고, Axin2-mTurquoise2 리포터 구조체를 삽입한 동형접합적(Tg/Tg)은 두 대립유전자 모두에 Axin2-mTurquoise2 리포터 구조체를 삽입하여 두 개의 Axin2 유전자를 파괴했습니다. Axin2-mTurquoise2 마우스 (B6; CBA-Axin2em1Fstl/J 마우스)를 실험에 사용하였다. 동물은 장기 격리 전에 CO2 안락사에 의해 희생되었습니다. 절차 전반에 걸쳐 샘플이 빛에 노출되는 것을 최소화하고 달리 표시되지 않는 한 항상 얼음 또는 4°C에 보관하십시오. 샘플을 알루미늄 호일로 덮으십시오. 모든 단계는 생물 안전 작업대가 있는 표준 실험실에서 수행해야 합니다.
1. 흉선세포 세포 현탁액의 준비
- 생쥐의 복부를 절개하고 집게로 흉선을 추출하여 혈액 오염 없이 조심스럽게 생쥐에서 흉선을 수확합니다. 2.5% 태아 송아지 혈청(FCS)을 함유한 얼음처럼 차가운 Iscove의 Modified Dulbecco's Medium(IMDM)에 임시로 보관/운송합니다.
알림: 혈액 유출 및 흉선 손상을 방지하려면 경추 탈구로 인해 마우스를 희생하지 마십시오. - 70μm 세포 여과기가 있는 50mL 튜브를 준비하고 1mL의 차가운 IMDM/2.5% FCS 배지로 필터를 적십니다.
- 1mL 주사기 플런저의 뒤쪽 끝으로 장기를 으깨고 차가운 IMDM/2.5% FCS 배지로 두 번 세척합니다(그림 1A). 원하는 경우, dead cell clumping을 방지하기 위해 IMDM/2.5% FCS 배지에 최종 농도 50 U/mL의 DNAse I를 첨가합니다. 차가운 IMDM/2.5% FCS 매체로 필터를 2번 헹구고 50mL 튜브에 부드럽게 다시 현탁시킵니다.
참고: 총 말단 부피가 10mL를 초과하지 마십시오. 다음 단계를 위해 그리고 취급하지 않을 때 세포를 얼음 위와 어두운 곳에 보관하십시오. - 330 × g 에서 4 °C에서 5 분 동안 원심 분리기를 원심 분리기하고 세포 펠릿에서 상층액을 부드럽게 흡입합니다. 세포 펠릿을 차갑고 불완전한 IMDM/2.5% FCS 배지에 부드럽게 재현탁하고 세포 계수를 준비합니다.
알림: 필요한 경우 나중에 실험할 수 있도록 흉선세포를 FCS-10% 디메틸설폭사이드의 액체 질소에 동결하고 보관하십시오. 적절한 세포 동결 및 해동은 과도한 세포 사멸을 줄입니다. 평균적으로 흉선의 절반은 흉선의 자연적인 T 세포 선택으로 인해 해동 후 세포사멸이 될 수 있으며, 이는 cryo-vial당 얼마나 많은 흉선세포를 동결할지 결정할 때 고려해야 합니다. 바이알당 2.5 × 106 개 이상의 흉선세포를 동결해야 합니다.
2. 흉선세포 유세포 분석 준비
- 얼음처럼 차가운 인산염 완충 식염수(PBS, pH 7.4)에서 염색 샘플당 2.5 × 106 개의 흉선세포를 준비하여 세포 표면 염색 절차를 위한 흉선세포를 준비합니다(그림 1B). 흉선세포가 이전에 동결된 경우 해동 후 살아있는 세포의 수를 자세히 설명합니다. 필요한 경우 최종 농도 50 U/mL의 DNAse I를 추가하여 사체 세포 응집을 방지합니다.
- 항체 염색 패널을 사용하여 완전한 흉선세포 subset의 세포 표면 특성을 분석합니다.
참고: 다른 형광 색소 조합을 선택할 수 있습니다. 밝은 형광 형광 색소에 대한 희귀 개체군 마커를 선택하고 가능한 경우 살아있는 죽은 마커를 추가합니다. V450 또는 V500 형광 색소는 스펙트럼 중복으로 인해 mTurquoise2 형광 리포터와 함께 사용해서는 안 됩니다. 항상 파란색 및 녹색 형광 색소와 함께 mTurquoise2의 형광 스펙트럼을 확인하십시오(보충 그림 1A).- 항체를 PBS/0.2% 소 혈청 알부민(BSA)/0.1% NaN3 (아지드화나트륨) 완충액에서 별도로 리니지 음성(Lin-) 패널의 미리 정의된 비율로 혼합합니다.
참고: 원치 않는 모든 세포(흉선에 존재하는 비흉선세포)는 스트렙타비딘 2차 항체(이 예에서는 phycoerythrin (Pe)-Cy7 및 allophycocyanin (APC)-Cy7)로 2단계 공정으로 염색되며 유세포 분석 분석에서 "dump gate"를 사용하여 제외할 수 있습니다. - 이중 음성(DN) 염색 패널의 사전 정의된 비율로 항체를 PBS/0.2% BSA/0.1% NaN3 완충액의 스트렙타비딘 2차 항체 Pe-Cy7과 혼합합니다. 이 혼합에서 Lin- 패널을 제외합니다(표 1).
- 미성숙 단일 양성(ISP), 이중 양성(DP) 및 단일 양성(SP) 염색 패널의 미리 정의된 비율로 항체를 PBS/0.2% BSA/0.1% NaN3 완충액의 스트렙타비딘 2차 항체 APC-Cy7과 혼합합니다. 이 혼합에서 Lin- 패널을 제외합니다(표 1).
- 먼저, 어두운 곳에서 얼음 위에서 30분 동안 Lin-panel의 비오틴 1차 항체 혼합물을 사용하여 원치 않는 non-T 세포 집단으로 흉선세포를 염색합니다.
참고: 각 Lin-panel은 서로 다른 세포 세트이므로 하나의 샘플에서 함께 염색해서는 안 됩니다. - 300 × g, 4 °C에서 5 분 동안 스핀 다운하고 상층액을 제거합니다. 150 μL의 얼음처럼 차가운 PBS/0.2% BSA/ 0.1% NaN3 완충액으로 흉선세포를 세척하고 300 × g, 4 °C에서 5분 동안 회전합니다.
- DN 패널과 해당 Lin-의 ISP/DP/SP 패널로 어두운 곳에서 얼음 위에서 30분 동안 염색합니다. 300 × g, 4 ° C에서 5 분 동안 스핀 다운하고 상층액을 제거합니다. 150 μL의 얼음처럼 차가운 PBS/0.2% BSA/0.1% NaN3 완충액으로 흉선세포를 세척하고 300 × g, 4 °C에서 5분 동안 회전합니다.
- 항체를 PBS/0.2% 소 혈청 알부민(BSA)/0.1% NaN3 (아지드화나트륨) 완충액에서 별도로 리니지 음성(Lin-) 패널의 미리 정의된 비율로 혼합합니다.
- 35μm 세포 스트레이너 튜브로 균질화하고 PBS/0.2% BSA/0.1% NaN3 완충액에서 세포를 취하여 유세포 분석을 위해 세포를 준비합니다. 빛으로부터 세포를 보호하고, 유세포분석기 측정 전과 측정 도중에 얼음 위에 보관하십시오.
참고 : NaN3 (아지드 화나트륨)는 독성이 강하고 치명적입니다. 이 물질로 작업할 때는 특별한 주의를 기울여야 합니다. 취급 후에는 손을 철저히 씻고 NaN3 를 삼킨 경우 즉시 독극물 관리 센터 또는 의사/의사에게 연락하십시오.
3. 유량 세포분석기 측정
참고: 다른 여러 형광 색소와 함께 mTurquoise2 신호를 측정하려면 실험에 대한 경험과 지식이 풍부한 평탄화가 필요하므로 경험이 없는 사용자는 먼저 유세포 분석기 교육을 받아야 합니다. 유세포 분석기에 대한 정보는 Table of Materials 를 참조하십시오.
- 사용자 설명서 또는 기타 확립된 프로토콜에 따라 유세포 분석기를 시작합니다. 최적의 형광 검출 전략을 위해 유세포 분석기의 대역 통과 필터 세트를 확인하고 필요한 경우 조정합니다.
참고: mTurquoise2에 권장되는 필터는 자외선 405nm, 407nm 또는 덜 일반적인 440nm 레이저 라인에서 470/20nm입니다. - 시중에서 판매되는 compensation beads와 안정적으로 transfection된 mTurquoise2 발현 293T cell로 보상 설정을 설정하여 유세포 분석기를 보정합니다.
참고: 보상 비드 대신 단일 염색 wt 흉선세포를 사용할 수 있습니다. 이 경우 비드를 사용한 보상은 세포를 사용하는 것보다 똑같이 효율적이고 편리했습니다.- 실험에 사용된 각 개별 형광 색소로 구슬에 레이블을 붙이고 염색되지 않은 구슬을 포함합니다. 비드를 측정하여 보상 설정 패널을 설정하고, 비드에 사용할 수 있는 mTurquoise2와 일치하는 형광 색소가 없으므로 mTurquoise2 발현 293T 셀을 측정합니다. 실제 실험에 사용할 수 있도록 보정 설정을 저장합니다.
참고: 보상 설정에 사용되는 mTurquoise2 발현 세포는 실제 실험의 mTurquoise2 발현 흉선세포보다 밝거나 더 밝아야 합니다. mTurquoise2 음성 293T 세포도 존재하는지 확인합니다. - 실험을 위해 mTurquoise2 FMO에 대한 wt 샘플과 각 마우스 유전자형의 염색되지 않은 흉선 샘플을 포함하여 형광 마이너스 1(FMO) Tg/Tg 염색 흉선세포를 분석 부분에 대한 양성 대조군으로 포함합니다.
알림: 이러한 컨트롤은 양성 셀에 대한 게이트를 적절하게 설정하는 데 중요합니다. 나머지 실험 샘플은 완전한 염색 패널로 염색됩니다(표 1).- 실험을 생성하고, 유세포 분석기 소프트웨어에서 튜브 수를 추가하고 이름을 지정하고, 산점도를 생성하여 전체 형광 색소 세트에 대한 염색된 세포를 시각화합니다.
- 이전에 설정된 보정 설정을 실험에 적용합니다. 산점도에서 세포의 전체 집단이 보일 때까지 염색되지 않은 wt thymocytes로 전방 산란(FSC) 및 측면 산란(SSC)을 조정합니다. 염색되지 않은 Tg/Tg mTurquoise2를 발현하는 흉선세포를 먼저 측정하여 양성 모집단이 보이는지 확인합니다.
- Tg/Tg가 완전히 염색된 흉선세포 샘플을 측정하고 모든 형광 색소 조합을 확인합니다. 필요한 경우 잘못된 보정을 표시하는 형광 색에 대해 이전에 설정된 보정 값을 조정합니다. 나머지 실험 샘플을 측정하고 샘플을 측정하는 동안 설정을 조정하지 마십시오.
참고: 후속 보상 조정은 분석 소프트웨어 패키지에서도 수행할 수 있습니다. 사용 가능한 셀의 수가 제한 요인이 될 수 있지만 측정 중에 이 단계를 수행하는 것이 좋습니다. mTurquoise2 강도 값을 비교하기 위해 모든 샘플 간에 설정을 동일하게 유지합니다.
- 실험에 사용된 각 개별 형광 색소로 구슬에 레이블을 붙이고 염색되지 않은 구슬을 포함합니다. 비드를 측정하여 보상 설정 패널을 설정하고, 비드에 사용할 수 있는 mTurquoise2와 일치하는 형광 색소가 없으므로 mTurquoise2 발현 293T 셀을 측정합니다. 실제 실험에 사용할 수 있도록 보정 설정을 저장합니다.
4. 유세포 분석
참고: 유세포 분석은 재료 표에 언급된 특정 소프트웨어를 사용하여 수행되었습니다. 그러나 다른 유세포 분석 프로그램도 사용할 수 있습니다.
- FSC 및 SSC 값에 따라 살아있는 세포와 흉선 세포 부분 집합을 게이트합니다.
- 샘플 왼쪽에 있는 보상 매트릭스 대화 상자에서 보정 설정을 확인하여 형광 간섭이 없는지, 유출 또는 블리드스루를 방지하기 위해 적절한 보정이 이루어졌는지 확인합니다.
- 획득 정의 매트릭스를 조정해야 하는 경우, 모집단이 거의 완벽한 수평 또는 수직선을 나타내지 않도록 모든 형광 색소 조합의 보상 값을 단순히 증가 또는 감소시켜 보상 매트릭스의 값을 변경합니다(보충 그림 1B).
- 적절한 포지티브 게이팅을 위해 mTurquoise2 강도를 시각적으로 분산시키려면 mTurquoise2 X축 디스플레이를 선형으로 변경합니다(보충 그림 2).
- mTurquoise2 FMO 컨트롤을 mTurquoise2 포지티브 신호 게이팅에 대한 네거티브 컨트롤로 사용합니다. 세포 집단당 올바른 임계값 게이팅을 수정합니다(그림 2).
참고: (wt) mTurquoise2 FMO 제어 셀에는 mTurquoise2 마커가 없으므로 Axin2 리포터 활동에 대한 배경 임계값으로 사용할 수 있습니다.
- mTurquoise2 FMO 컨트롤을 mTurquoise2 포지티브 신호 게이팅에 대한 네거티브 컨트롤로 사용합니다. 세포 집단당 올바른 임계값 게이팅을 수정합니다(그림 2).
- 적절한 검출 채널이 있는 mTurquoise2 양성 세포를 게이트하여 Wnt 양성 세포의 수를 정의합니다.
- 기하 평균(geometric mean)과 중앙값(median)을 계산하여 관심 세포의 형광 강도(fluorescent intensity)의 양을 정의합니다.
- Statistics( 통계) | mTurquoise2 양성 세포를 보여주는 패널 내에 통계를 추가합니다.
- 통계 방법, 관심 모집단 및 mTurquoise2의 검출 채널을 정의하고 추가를 클릭합니다. 기하 평균(geometric mean)과 중앙값 형광 강도(median fluorescent intensity)를 AU(Arbitrary Units)로 표시하여 그래프를 플로팅합니다.
참고: 중앙값은 형광 강도의 중간 값을 나타내므로 형광 강도 인구 이동에 대한 정보를 제공합니다. 필요한 경우 배경 보정을 통해 mTurquoise2 리포터 활동의 동적 범위를 보다 명확하게 시각화할 수 있습니다. 이는 게이트된 특정 세포 유형의 mTurquoise2 양성 세포의 총 빈도에서 wt 배경 염색 빈도를 빼서 수행할 수 있습니다.
5. 컨포칼 이미징을 위한 흉선세포 사이토스핀의 준비
참고: Thymocyte cytospins는 비부착 세포의 세포 현탁액으로 작업할 때 권장됩니다. 흉선세포에서 Axin2-mTurquoise2의 발현이 흉선 상피 세포보다 낮기 때문에 여과된 흉선세포 세포 현탁액을 이미징에 사용했습니다.
- 갓 채취하거나 동결된 흉선세포의 세포 현탁액으로 시작하십시오. 흉선 세포 유전자형당 100 μL의 차가운 PBS/0.5% BSA/10% FCS에 ~20,000개의 흉선세포를 현탁시킵니다.
참고: 필요한 경우 세포를 부드럽게 해동하여 이전에 동결된 흉선세포로 작업할 때 최대 세포 생존력을 보존합니다. 이렇게 하면 세포를 이미징할 때 자가형광을 줄이는 데 도움이 됩니다. 샘플의 품질을 보장하기 위해 세포 생존력을 확인합니다. 사이토스핀 절차는 연약한 흉선세포에 적응된 기계적 힘을 사용합니다. 그럼에도 불구하고 매우 실행 가능한 시작 개체군이 필요합니다. 더 높은 생존력을 보장하려면 냉동 흉선 세포 대신 갓 수확한 흉선세포로 시작하는 것이 좋습니다. - 필터 카드 입구 주변을 PBS로 미리 적십니다. 설명서에 따라 cytospin 시료 챔버 홀더를 조립합니다(그림 1C).
- 필터 카드를 서리 슬라이드에 놓습니다(유리 슬라이드에 대한 부드러운 면). 두 항목을 모두 샘플 챔버 홀더에 놓습니다. 필터 카드를 샘플 챔버 홀더 구멍에 정확히 배치하고 전체 샘플 챔버 홀더를 로터에 배치합니다.
- 흉선세포를 조심스럽게 재현탁시키고 시료 챔버에 100μL의 세포 현탁액을 추가합니다. 흉선세포 현탁액을 ~350g에서 4분 동안 회전× 프로스트 슬라이드 에 올려놓습니다. 셀을 건드리지 않고 서리 슬라이드에서 필터 카드를 조심스럽게 제거하십시오. 사이토스핀을 실온에서 1시간에서 하룻밤까지 자연 건조합니다.
참고: 다른 세포 유형으로 작업할 때 최적의 결과를 위해 다른 세포 밀도를 테스트하십시오. 사이토스핀은 추후 실험을 위해 밀봉된 상자에서 -20°C에서 동결할 수 있습니다. 실온에서 1시간 동안 추가 처리를 위해 사이토스핀을 해동합니다.
6. 총 β-catenin를 가진 Cytospin immunostaining
- 사이토스핀을 100% 메탄올로 실온에서 15분 동안 고정합니다. 슬라이드를 실온에서 10분 동안 자연 건조합니다. 소수성 펜으로 유리 슬라이드의 흉선 세포 집단 주위에 원을 그립니다.
참고: 이 고정 단계는 β-카테닌 염색에 특별히 최적화되어 있습니다. - 슬라이드를 PBS/0.05% Tween-20에 실온에서 10분 동안 놓은 다음 차단 및 배양 단계 동안 어둡고 습한 상자로 옮깁니다. 슬라이드당 100μL의 PBS/10% 일반 마우스 혈청(NMS)을 추가하고 실온에서 10분 동안 습한 상자에 그대로 둡니다. 슬라이드를 탭하여 10% NMS를 제거하고, 슬라이드당 PBS 100μL/일반 염소 혈청 100%를 추가한 다음 실온에서 30분 동안 습도 상자에 그대로 둡니다.
참고: PBS/10% NMS를 사용한 배양은 비특이적 1차 항체 결합을 차단하고(그림 1D), PBS/10% NGS는 비특이적 2차 항체 결합을 차단합니다. - 세포 염색을 위한 추가 항체를 준비합니다. 총 β-카테닌 항체 중 0.5 μg을 AF568 표지 단편과 혼합합니다.
참고: 이 설정에서는 시중에서 판매되는 라벨링 키트를 사용하여 Alexa Fluor 568(AF568) 형광 라벨을 사용하여 1차 안티 마우스 β-카테닌을 Alexa Fluor 568(AF568) 형광 라벨로 1차 안티 마우스 총 IgG1 단편으로 사전 라벨링한 후 흉선세포에 첨가했습니다. 여러 농도를 테스트해야 할 수 있으므로 제조업체의 프로토콜에 따라 라벨링을 수행하십시오. 30분 이내에 총 β-catenin-AF568 표지 항체를 사용하십시오. - 시토스핀당 총 β-catenin-AF568 표지 항체 중 50 μL(0.5 μg)를 습한 상자에서 4°C에서 밤새 뜯습니다. 제조업체의 프로토콜에 따른 음성 염색 대조군 또는 직접 라벨링 프로토콜의 경우 isotype 대조군을 포함하십시오.
- 실온에서 PBS/0.05% Tween-20으로 20분 동안 세탁합니다. 그런 다음 병에 넣고 실온에서 PBS로 20분 동안 저어주면서 씻습니다. 항체가 항원에 결합하는지 확인하기 위해 두 번째 고정 단계를 수행합니다: 습한 상자에 PBS에 100μL의 4% 파라포름알데히드(PFA)를 넣고 실온에서 10분.
참고: 슬라이드를 어두운 곳에 보관하십시오. 메탄올이나 PFA 고정은 mTurquoise2 발현에 유의한 영향을 미치지 않습니다27. - PBS에 슬라이드를 담그십시오. 50μL의 TO-PRO-3(1:1500)로 습한 상자에서 실온에서 10분 동안 핵 염색을 수행합니다. 항아리에 PBS를 넣고 실온에서 20분 동안 슬라이드를 저어가며 세척합니다.
참고: TO-PRO3 농도는 근처의 형광 스펙트럼을 가진 다른 형광 색소의 사용에 따라 적정될 수 있습니다. - 제조업체의 프로토콜에 따라 퇴색 방지 시약으로 표본을 삽입하고 커버슬립으로 덮습니다. 실온에서 24시간 동안 자연 건조합니다. 형광 또는 컨포칼 현미경으로 슬라이드를 직접 보거나 나중에 이미징할 수 있도록 -20°C에서 보관하십시오.
7. 컨포칼 현미경 측정
알림: 컨포칼 현미경에 대한 정보는 재료 표를 참조하십시오.
- 수동 또는 확립된 프로토콜에 따라 컨포칼 현미경을 켭니다. 컨포칼 설정의 1차 조정을 위해 negative 및 positive 안정적으로 transfection된 mTurquoise2 293T 세포주 대조군을 사용합니다. 그런 다음 wt Axin2-mTurquoise2 및 Tg/Tg (녹아웃) Axin2-mTurquoise2 흉선세포를 각각 음성 및 양성 대조군으로 사용하여 mTurquoise2 신호의 노출 부족을 방지합니다.
- 레이저와 필터 폭을 프로그래밍하여 순차 스캔을 위해 소프트웨어를 준비합니다. 가장 높은 파장의 레이저 라인부터 시작하여 가장 낮은 파장을 향해 작업합니다. 모든 순차 스캐닝 단계가 설치되면 현미경 스테이지에 샘플을 로드하고 샘플에 초점을 맞춘 다음 Live 를 눌러 컨포칼 소프트웨어 또는 수동 패널(옵션)의 해당 버튼을 사용하여 레이저 출력 과 스마트 게인을 최적화합니다.
참고: 슬라이드의 표본 섹션은 잠재적인 광표백이 잠재적으로 발생할 수 있으므로 신호 정량화를 위해 이미지화해서는 안 됩니다. 그러나 mTurquoise2는 높은 광안정성을 가지고 있습니다25. - mTurquoise2 발현이 매우 낮은 경우 형광 신호가 관찰될 때까지 레이저 출력과 스마트 게인을 증가시키고 네거티브 대조군을 확인하십시오.amp진정한 포지티브 신호를 확인합니다. 40x 1.4 오일 렌즈, 63x 1.4 오일 렌즈 또는 100x 1.4 오일 렌즈로 흉선 세포를 시각화합니다.
참고: 이 연구에는 Leica SP5 현미경이 사용되었습니다. - 샘플을 측정하기 전에 현미경에서 이러한 컨포칼 이미징 설정을 사용하십시오.
- Configuration (구성) | 설정 | Bit depth 옵션에서 12-bit로 변경하면 더 넓은 강도 스케일을 만들 수 있으므로 낮은 형광 신호와 높은 형광 신호를 더 잘 구분할 수 있습니다.
- XY를 클릭하여 이미징 해상도를 조정하고 형식을 1024 x 1024로 늘리면 스캔 시간도 두 배로 늘어납니다. Speed(속도) | 더 보기를 클릭하여 수동으로 설정을 변경합니다. 또한 양방향 스캔 옵션을 활성화합니다.
- 감도 슬라이더를 조정하여 배경 신호를 줄입니다. Quick LUT(Look-Up Table) 옵션을 사용하여 올바른 레이저 출력과 스마트 게인을 최적화하십시오.
참고: 12비트 이미지에서 슬라이더는 0에서 4095 사이의 그레이 스케일 강도 값을 갖습니다. 이것은 나중에 무료 오프라인 Las X 소프트웨어를 사용하여 수행 할 수도 있습니다. 녹색은 검은색 배경을 표시하고 파란색은 샘플의 채도가 높은 픽셀을 표시합니다.
- 모든 이미징 설정이 최적화되면 시작을 클릭하여 샘플을 측정하면 세 채널 모두의 순차 이미징이 시작됩니다.
- TO-PRO-3 핵 형광 신호를 측정합니다. 633nm 레이저 및 HyD 640-750nm로 TO-PRO-3를 검출합니다.
참고: 이 설정에서는 15% 스마트 게인에서 6% 레이저 출력이 사용되었습니다. 이 설정은 TO-PRO-3 염색 강도에 따라 변경될 수 있습니다. 매우 밝으면 과도하게 흥분할 때 더 낮은 강도의 형광 색소에 영향을 줄 수 있습니다. 이 경우 염색 농도를 낮추십시오. - β-카테닌 핵 및 세포질 형광 신호를 측정합니다. 561nm 레이저 및 HyD 580-605nm로 β-catenin을 검출합니다. AF568 신호가 낮은 경우 라인 평균 2로 소프트웨어의 XY 상자 설정을 조정하여 하나의 이미지에 대해 최대 2개의 스캔을 누적할 수 있습니다.
참고: 이 설정에서는 87% 스마트 게인에서 85% 레이저 출력이 사용되었습니다. - mTurquoise2 세포질 형광 신호를 측정합니다. 458nm 레이저 및 HyD 490-600nm로 mTurquoise2를 감지합니다. mTurquoise2 신호가 낮은 경우 라인 평균 4로 소프트웨어의 XY 상자에서 설정을 조정하여 하나의 이미지에 대해 최대 4개의 스캔을 누적할 수 있습니다.
참고: 이 프로토콜에 사용된 컨포칼 현미경의 오래된 레이저와 낮은 mTurquoise2 신호로 인해 405nm는 90% 레이저 출력에서 사용되었으며, 458nm 및 476nm 레이저는 100% 레이저 출력에서 HyD 490-550nm로 100% 스마트 게인으로 사용되었습니다. 440nm 레이저가 가장 최적이지만 컨포칼 현미경에는 덜 일반적입니다. 높은 레이저 출력은 주의해서 다루어야 하며 순차 이미징으로만 수행해야 합니다. 감지기 과다 노출을 방지하기 위해 비상 설정이 되어 있는지 확인하십시오. 다른 컨포칼 현미경의 레이저 출력은 더 강력하거나 새로운 레이저로 인해 이 프로토콜에서 제안된 것보다 열등할 수 있습니다. 이미징 전에 형광 신호가 손실되지 않는지 확인하기 위해 표백 테스트를 수행할 수 있습니다. 제안된 설정에서 mTurquoise2의 광표백은 허용되었습니다. - 전체 세포 시각화를 위한 명시야 이미징을 수행합니다. 488nm 레이저 및 PMT Scan-DIC로 흉선세포를 검출합니다. 이미지 분석을 위해 Lif 파일을 내보냅니다.
참고: 이 설정에서는 212V의 게인과 -4.3%의 데이터 오프셋으로 59% 레이저 출력이 사용되었습니다. Lif 파일은 이미지 보정을 위해 오프라인 LAS x 소프트웨어에서 읽을 수 있습니다.
- TO-PRO-3 핵 형광 신호를 측정합니다. 633nm 레이저 및 HyD 640-750nm로 TO-PRO-3를 검출합니다.
8. 컨포칼 현미경 분석
- 이미지 프로세싱 소프트웨어(28 )를 사용하여 이미지를 분석한다(보충 그림 3). 소프트웨어에서 이미지를 로드합니다.
참고: 여러 형식이 허용되지만 LUT가 있는 TIFF 파일 또는 Lif 파일을 이미지 처리 소프트웨어로 직접 가져오는 것이 좋습니다. - 흉선세포핵에서 활성 β-카테닌 신호를 측정합니다.
- 활성 β-카테닌 분석을 위해 적회색 값 이미지에서 TO-PRO-3 염색 흉선세포의 핵을 선택합니다. 이 작업을 수동으로 수행하거나 소프트웨어에서 자동 셀 선택을 사용하십시오.
참고: 자동 세포 선택은 적절한 임계값 설정 및 입자 분석을 위해 이미지 처리가 필요할 수 있습니다. 수동 셀 선택은 힘들 수 있지만 일반적으로 이미지 처리가 필요하지 않으며 이 프로토콜에서 권장됩니다. - 작업 표시줄에 있는 선택 도구 중 하나를 사용하여 수동 선택을 활성화합니다.
- 핵의 윤곽을 선택하고 ROI(Region of Interest) 관리자에 추가합니다. Analyze(분석) | 도구 | ROI Manager를 선택하고 새 ROI Manager 창이 열리면 첫 번째 옵션인 Add(t)를 클릭하거나 키보드 단축키 t를 사용합니다. 모든 핵이 정의되고 ROI 관리자에 추가될 때까지 이전 단계를 반복합니다. ROI 관리자에서 모두 표시 옵션을 사용하여 선택한 셀을 시각화합니다.
- 셀이 없는 >3개의 배경 영역을 선택하고 ROI 관리자에 추가합니다.
참고: 이 경우 크기와 모양은 중요하지 않습니다. 이 영역은 최종 계산을 위한 배경 잡음 측정으로 사용됩니다.- Analyze(분석) | 측정값을 설정합니다. 다양한 측정 옵션이 있는 새 창에서 Area(영역), Integrated Density(통합 밀도) 및 Mean grey value(평균 회색 값) | 확인을 클릭합니다.
- β-catenin grey value 이미지를 클릭하여 활성화하고, ROI 관리자에서 Show all 을 클릭하여 선택한 핵 및 배경 영역을 시각화합니다. 이제 β-catenin 이미지에서 볼 수 있는 선택된 모든 영역을 관찰합니다.
- ROI Manager에서 Measure(측정 )를 클릭하거나 Analyze(분석)를 클릭합니다 . 측정. ROI 내에서 β-카테닌 신호의 결과를 보여주는 새로운 결과 창이 열리는지 확인합니다.
- Edit(편집) | 모두 선택하십시오. 추가 계산을 위해 목록을 스프레드시트에 복사/붙여넣습니다. More(추가) | 구해내다....
- 자동 셀 선택의 경우 많은 이미지 처리 설정을 취소할 수 없으므로 처리할 이미지의 중복 (키보드 Ctrl D)을 만듭니다.
참고: 자동 핵 라벨링은 대부분의 경우 핵을 자동으로 정확하게 정의하기 위해 이미지 처리가 필요합니다. 이미지 처리는 영역 선택 목적으로만 수행해야 합니다. 처리된 이미지는 픽셀 값이 변경되기 때문에 형광 강도 측정에 유용하지 않습니다.- Process(프로세스) | 필터 | 가우시안 블러를 사용하여 이미지를 매끄럽게 합니다. 여러 Sigma (Radius) 값을 테스트하고 OK를 클릭하기 전에 Preview 옵션을 활성화하여 효과를 시각화합니다.
- Edit(편집) | 반전. 밝기와 대비를 확인하려면 Image(이미지)를 클릭합니다. 조정 | 밝기/대비. 자동 옵션을 사용하거나 값을 수동으로 변경하는 것이 좋습니다.
참고: 이미지 속성이 변경되므로 변경 사항을 적용 하지 마십시오. 원하는 이미지를 얻었을 때 B&C 창을 닫기만 하면 됩니다. - Image (이미지)를 클릭하여 임계값 만들기 | 조정 | 임계값을 선택하고 모든 셀이 대부분 표시되는 최상의 임계값 설정을 정의합니다. Apply( 적용 )를 클릭하여 Threshold 설정을 적용합니다.
참고: 구멍을 표시하는 셀에 임계값이 적용되지 않은 경우 Process(프로세스)를 클릭하십시오. 바이너리 | 구멍 채우기 - 셀 내의 간격을 채웁니다. 셀이 임계값 설정과 함께 융합된 경우 Process(프로세스) 를 클릭합니다. 바이너리 | 이러한 세포를 분리하기 위한 유역. 미세한 1픽셀 선은 프로그램이 융합된 것으로 해석하는 모든 셀을 분리합니다. - Freehand selection tool을 사용하여 선택한 핵을 수동으로 선택하여 이미지에서 가장 작은 핵과 가장 큰 핵을 정의하고, 이를 ROI manager에 추가하고, Area를 측정합니다.
- Analyze(분석) | 파티클을 분석하고, 크기(^2) 상자에 가장 작은 영역과 가장 큰 영역을 삽입하고 그 사이에 하이픈(-)을 삽입합니다. OK를 클릭하기 전에 Display results, Add to manager 및 Exclude on edges 상자를 활성화합니다. 8.2.3단계를 계속하여 프로토콜을 완료합니다.
- 활성 β-카테닌 분석을 위해 적회색 값 이미지에서 TO-PRO-3 염색 흉선세포의 핵을 선택합니다. 이 작업을 수동으로 수행하거나 소프트웨어에서 자동 셀 선택을 사용하십시오.
- 흉선세포에서 세포질 mTurquoise2 및 β-catenin 신호를 측정합니다.
- 위와 동일한 단계에 따라 명시야 이미지에서 전체 흉선세포의 윤곽을 선택합니다.
- 셀이 없는 >3개의 배경 영역을 선택하고 ROI 관리자에 추가합니다.
참고: 이 경우 크기와 모양은 중요하지 않습니다. 이 영역은 최종 계산을 위한 배경 잡음 측정으로 사용됩니다.- mTurquoise2 그레이 값 이미지를 클릭하여 활성화하고 ROI 관리자에서 Show all 을 클릭하여 선택한 총 셀 ROI 및 배경 영역을 시각화합니다. mTurquoise2 이미지에서 볼 수 있는 선택된 모든 영역을 관찰합니다.
- ROI Manager에서 Measure(측정 )를 클릭하거나 Analyze(분석) | 측정. mTurquoise2 신호의 측정 결과와 함께 열리는 새로운 결과 창을 관찰합니다.
- Edit(편집) | 모두 선택하고 추가 계산을 위해 목록을 스프레드시트에 복사/붙여넣습니다.
- β-catenin grey value 이미지를 클릭하여 활성화하고, ROI 관리자에서 Show all 을 클릭하여 선택한 총 셀 ROI와 배경 영역을 시각화합니다. β-catenin 이미지에서 볼 수 있는 선택된 모든 영역을 관찰합니다.
- ROI Manager에서 Measure(측정 )를 클릭하거나 Analyze(분석) | 측정. 전체 세포 β-카테닌 신호의 측정 결과와 함께 열리는 새로운 결과 창에 주목하십시오.
- Edit(편집) | 모두 선택하고 추가 계산을 위해 목록을 스프레드시트에 복사/붙여넣습니다. More(추가) | 구해내다....
- 방정식 1을 사용하여 활성 β-카테닌에 대한 CTNF(Corrected Total Nuclear Fluorescence)를 계산합니다.
CTNF = 적분 밀도 - (평균 배경 면적의 면적 × 평균) (1) - 방정식 2를 사용하여 mTurquoise2에 대한 CTCF(Corrected Total Cell Fluorescence)를 계산합니다.
CTCF = Integrated density - (평균 배경 면적의 평균× 면적) (2) - 8.2.3.3단계에서 얻은 핵 β-카테닌 값을 빼서 활성 핵 β-카테닌과 세포질 β-카테닌을 구별합니다. 8.3.2.5단계에서 얻은 총 세포 β-카테닌 값에서 세포질 비활성 β-카테닌을 얻습니다.
알림: 측정이 동일한 셀 내에서 수행되었는지 확인하십시오.- 배경 영역의 Mean intensity(평균 강도)의 평균을 계산합니다. 방정식 1 과 2를 사용하여 CTNF와 CTCF를 계산합니다. IntDen (선택한 영역 내의 모든 픽셀의 합)을 RawIntDen이 아닌 통합 밀도로 간주합니다.
- 필요한 경우 그래프를 플로팅하기 위한 IntDen 값의 표준 편차를 계산합니다. Mann-Whitney U-test를 사용한 통계 분석을 위해 최대 200개의 개별 셀을 고려하십시오.
- 결과를 개별 데이터 포인트 그래프에 플로팅하고 CTNF 또는 CTCF 값으로 y축에 RFU(상대 형광 단위)로 레이블을 지정합니다.
결과
표준 Wnt 신호전달의 역할을 조사하기 위해 Axin2-mTurquoise2 표준 Wnt 리포터 모델을 β-catenin 단백질 발현과 함께 테스트했습니다. 흉선세포는 취약하고, 흉선세포 성숙 과정의 여러 단계에서 낮은 표준 Wnt 신호를 보이며, 세포질 대 핵 비율이 낮은 것으로 알려져 있습니다. 이러한 모든 요인은 세포질 mTurquoise2 또는 β-catenin의 검출을 방해합니다. 프로토콜에 따라 흉선에서 쥐 Axin2-mTurquoise2 흉선세포를 수확하여 Axin2-mTurquoise2 및 total β-catenin의 유세포 분석 및 사이토스핀 공초점 분석(그림 1)을 위한 단일 세포 현탁액으로 처리했습니다.
유세포 분석은 다양한 흉선세포 성숙 단계의 특성화를 용이하게 하여 활성 표준 Wnt 신호전달을 위한 리포터 단백질로서 세포 서브세트당 mTurquoise2 형광색소의 존재를 측정합니다. Axin2-mTurquoise2 유전자형에서 야생형(wt), 이형접합체(Tg/0) 및 동형접합체(Tg/Tg)-mTurquoise2 신호는 이중 양성(DP) 흉선세포 내에서 표준 Wnt 신호의 활성화 수준을 나타내는 증가하는 수준으로 존재했습니다(그림 2). 삽입된 mTurquoise2 단백질이 없기 때문에 wt mTurquoise2 수준은 배경 소음을 나타냅니다. 그러나 표준 Wnt 신호는 이러한 세포에서 여전히 발생할 수 있지만 단순히 리포터를 통해 시각화되지 않습니다. 그럼에도 불구하고, Axin2 유전자 중 하나(Tg/0) 또는 두 개(Tg/Tg)가 부족하면 Axin2가 파괴 복합체에서 중요한 역할을 하여 활성 표준 Wnt 신호전달을 부정적으로 조절하기 때문에 표준 Wnt 신호 활성에 영향을 미칠 수 있습니다.
평균 또는 중앙값 형광 강도를 검사하여 Axin2-mTurquoise2 리포터 모델의 발현 수준을 조사할 수 있습니다. 중앙값 형광 강도 및 기하 평균(그림 2C)은 형광 히스토그램에 대해 첫 번째와 두 번째로 선호되는 그래픽 표현입니다. Tg/0에 비해 Tg/Tg에서 Axin2 발현의 증가는 기능적 Axin2의 부족으로 인해 표준 Wnt 신호의 활성화가 증가하여 파괴 복합체가 제대로 작동하지 않음을 암시합니다. 표준 Wnt 신호 경로의 활성화 수준을 추가로 확인하기 위해 Axin2-mTurquoise2 흉선세포 내에서 총 β-카테닌으로 사이토스핀 면역염색을 수행했습니다. β-catenin의 세포 위치는 표준 Wnt 신호가 활성화되었는지 여부를 나타내기 때문에 핵 또는 세포질 β-catenin의 존재를 측정했습니다.
mTurquoise2는 세포질에서 발현되며 주로 핵 주변에서 볼 수 있습니다( 그림 3A에서 TO-PRO-3 빨간색으로 표시). 흉선세포는 세포질이 거의 없기 때문에 모든 신호를 측정하기 위해 영역 선택을 신중하게 수행해야 합니다(보충 그림 3). 흰색 화살표로 표시된 것처럼 위양성 염색 또는 자가형광 신호에 특별한 주의를 기울여야 합니다. 이러한 형광 신호는 일반적으로 세포 파편에 의해 생성되며 mTurquoise2 및 AF568 이미지에서 모두 볼 수 있습니다(그림 3B, C 및 그림 3D, E). 염색되지 않은 wt 대조군 이미지는 mTurquoise2가 Axin2-mTurquoise2 리포터 구조체를 포함하지 않지만 이러한 흉선세포에서도 볼 수 있음을 보여줍니다. 이 배경 소음은 아마도 자가형광과 흉선세포의 조밀한 세포질 때문일 것입니다29. 그러나 CTCF 공식을 사용한 신중한 영역 선택과 올바른 배경 보정을 통해 그림 3B 는 DP 흉선세포의 유세포 분석에서 볼 수 있듯이 범흉선세포에서 Axin2-mTurquoise2 발현이 증가하고 있음을 보여줍니다.
Axin2-mTurquoise2 리포터 구조체로 인해 손상된 Axin2 유전자가 파괴 복합체에 미치는 영향과 그에 따른 β-catenin의 존재를 더 자세히 이해하기 위해 흉선세포에서 핵 또는 세포질 β-catenin AF568의 발현을 측정했습니다. 활성 표준 Wnt 신호전달은 핵으로의 β-catenin 이동에 의해 주도되며, 여기서 TCF/LEF 전사 인자와 상호 작용한 후 Axin2 를 표적 유전자로 활성화하여 경로 활성화를 약화시킵니다. Axin2는 세포질 β-catenin을 표적으로 하여 프로테아좀 분해를 유발하는 데 중요한 역할을 하는 파괴 복합체의 일부를 형성하기 때문에 Axin2 단백질의 부재 또는 파괴는 핵 및/또는 세포질 β-catenin의 축적을 유발할 수 있습니다.
우리는 이형접합체(Tg/0) Axin2-mTurquoise pan-thymocyte가 야생형(wt)에 비해 핵 및 세포질 β-catenin 발현이 적다는 것을 보여주며, 이는 β-catenin 자체의 조절이 변경되었음을 시사합니다. 그러나 동형접합체(Tg/Tg) Axin2-mTurquoise pan-thymocytes에서 핵 β-catenin은 wt보다 높지만 세포질 β-catenin은 두 유전자형 간에 유사합니다(그림 3C). 이는 총 β-카테닌 수치를 측정하는 것이 프로테아솜 분해를 향하지 않는 β-카테닌을 특이적으로 검출하는 비인산화된 β-카테닌을 직접 측정하는 것과는 대조적으로 표준 Wnt 경로에 대한 추가 정보를 제공할 수 있음을 시사합니다. 그럼에도 불구하고, Axin2 와 같은 표준 Wnt 주도 유전자 발현에 대한 β-catenin의 조절은 이 프로토콜에서 테스트되지 않은 몇 가지 다른 단백질에 의해 조절된다는 점을 명심해야 합니다.

그림 1: 프로토콜의 개략적이고 단순화된 개요. (A) 세포 현탁액으로의 흉선 처리, (B) 유세포 분석 프로토콜, (C) 사이토스핀 어셈블리, (D) 세포 내 염색 프로토콜. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
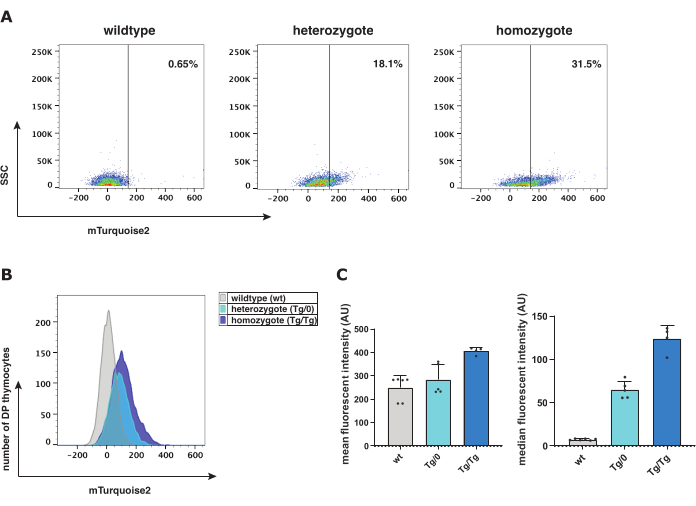
그림 2: 야생형(wt), 이형접합체(Tg/0) 및 동형접합체(Tg/Tg) Axin2-mTurquoise2 마우스의 유세포 분석 분석. (A) Axin2-mTurquoise2 유전자형에 따른 mTurquoise2 DP 흉선세포 게이팅 및 집단 변위를 사용한 점도표 표현. (B) DP 흉선세포의 마우스 유전자형 사이의 형광 강도 범위를 보여주는 mTurquoise2 히스토그램의 표현. (C) DP 흉선세포에서 Axin2-mTurquoise2 유전자형의 표준 편차 오차 막대를 사용한 평균 및 중앙값 형광 강도의 막대 그래프 표현(총 5 wt; 5 Tg/0 및 4 Tg/Tg 마우스). 약어: DP = 이중 긍정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
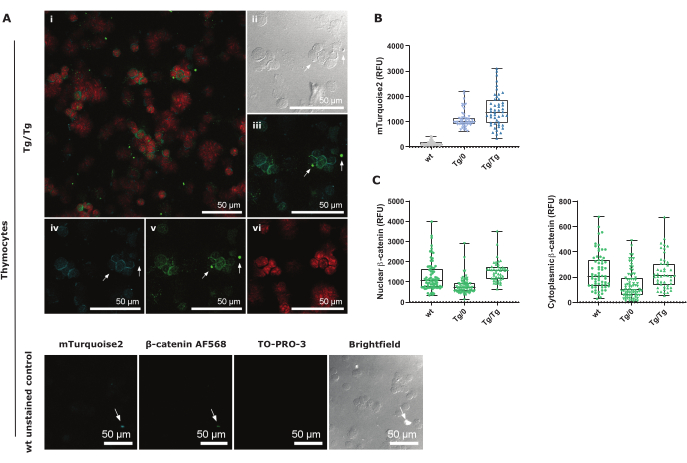
그림 3: 1.5 줌 팩터로 40x에서 이미징된 총 흉선세포 사이토스핀 절차 및 대조군의 컨포칼 이미지 표현. (A) 핵 TO-PRO-3 및 총 β-카테닌 AF568로 염색된 Tg/ Tkñcêse2-mTurquoise2 흉선세포 및 내인성 세포질 mTurquoise2 발현. i는 세 가지 색상 모두의 오버레이 컨포칼 이미지입니다. II는 명시야 이미지입니다. iii는 Axin2-mTurquoise2 및 총 β-catenin AF568 오버레이입니다. iv는 mTurquoise2 클로즈업입니다. v는 총 β-catenin AF568 클로즈업입니다. vi는 핵 TO-PRO-3 클로즈업입니다. 하단 패널에는 이미징된 각 채널에 대한 wt 염색되지 않은 제어 이미지가 포함되어 있습니다. 흰색 화살표는 모든 이미지에서 동일한 위치를 나타내며 파편으로 인한 거짓 긍정 신호를 나타냅니다. 스케일 바 = 50 μm. (B) 모든 Axin2-mTurquoise2 유전자형(유전자형당 50-70개 세포)에 대한 CTCF mTurquoise2 강도 값의 상자 그림 표현. (C) 모든 Axin2-mTurquoise2 유전자형(유전자형당 50-70개 세포)에 대한 핵 활성 β-catenin 및 비활성 세포질 β-catenin에 대한 총 β-catenin AF568 CTNF 및 CTCF-CTNF 강도 값의 상자 그림 표현. 약어: CTCF = Corrected Total Cell Fluorescence; CTNF = Corrected Total Nuclear Fluorescence(보정된 총 핵 형광); RFU = 상대 형광 단위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| DN 염색 패널 | 형광 색소 | 항체 |
| FITC (영어) | CD127 | |
| 체육 | CD25 (영어) | |
| PE-Cy7 | 스트렙타비딘(SAV) | |
| APC (에이피씨) | CD117 | |
| APC-싸이7 | CD44 | |
| 퍼CP | CD135 | |
| V450 시리즈 | x | |
| V500 시리즈 | x | |
| 린- | ||
| 비오 틴 | 테르119 | |
| GR1 | ||
| CD11b | ||
| 나220 | ||
| NK1.1 | ||
| CD3 | ||
| CD4 | ||
| CD8 | ||
| ISP/DP/SP 염색 패널 | ||
| FITC (영어) | TCRb | |
| 체육 | TCRgd | |
| PE-Cy7 | CD4 | |
| APC (에이피씨) | CD3 | |
| APC-싸이7 | 스트렙타비딘(SAV) | |
| 퍼CP | CD8 | |
| V450 시리즈 | x | |
| V500 시리즈 | x | |
| 린- | ||
| 비오 틴 | 테르119 | |
| GR1 | ||
| CD11b | ||
| 나220 | ||
| NK1.1 | ||
| 1. 비오틴 계통 음성(Lin-) 패널로 흉선세포를 염색합니다. | ||
| 2. 흉선 세포 마커 패널로 흉선 세포를 염색합니다. | ||
표 1: 유세포 분석을 위한 세포 표면 특성화 항체 패널. 2단계 DN 흉선세포 염색, 2단계 ISP, DP 및 SP 흉선세포 염색. 약어: DN = 이중 부정; DP = 이중 양성; SP = 단일 긍정; ISP = 미성숙 단일 긍정; PE = 피코에리트린; APC = 알로피코시아닌; FITC = 플루오레세인 이소티오시아네이트.
보충 그림 1: mTurquoise2 및 FITC 형광 색소 호환성 (A) mTurquoise2(파란색) 및 FITC(녹색)의 형광 여기 및 방출 스펙트럼은 최소 스펙트럼 중복을 나타냅니다. 가는 선은 mTurquoise2(405nm) 및 FITC(488nm)를 여기하는 레이저 라인을 나타냅니다. 채워지지 않은 곡선은 여기 스펙트럼을 나타내며, 채워진 곡선은 지정된 형광 색소의 방출 스펙트럼을 나타냅니다. 파란색은 mTurquoise2에 해당하고 녹색은 FITC에 해당합니다. mTurquoise2 및 FITC에 대한 대역통과 필터(방출 스펙트럼을 오버레이하는 회색 영역) 470/20 및 530/30은 각각 유세포 분석 중에 사용되었습니다. (B) DP 흉선세포 특성화에 사용되는 mTurquoise2(y축)와 다른 형광색소(x축) 사이의 형광 스펙트럼 블리드스루를 보여주는 Axin2-mTurquoise2 DP thymocytes의 유세포 분석 프로그램 내 소프트웨어 형광 방출 보상 매트릭스. mTurquoise2와 FITC(녹색 상자) 사이에서는 스펙트럼 블리드 스루가 검출되지 않은 반면, mTurquoise2와 AmCyan 청록색과 같은 형광 색소(빨간색 상자) 사이에서는 스펙트럼 블리드 스루 문제가 감지되었습니다. V450 유세포 분석기 채널은 y축에 comp-mTurquoise2로 표시되는 mTurquoise2 형광 색소를 측정하는 데 사용되었습니다. 약어: FITC = 플루오레세인 이소티오시아네이트; DP = 이중 양성; V450 = 바이올렛 450. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: mTurquoise2 양성 세포 게이팅 전략을 위한 유세포 분석 소프트웨어 분석 워크플로우 체계. 더 나은 mTurquoise2 게이팅 전략을 위한 변환 설정 조정에 대한 단계별 설명. Axin2-mTurquoise2 Tg/Tg( 동형접합체) 이중 양성 흉선세포 집단의 표현. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: 형광 강도 측정을 위한 이미지 분석 소프트웨어 워크플로우 구성표. mTurquoise2의 CTCF 계산 또는 활성 β-catenin-AF568의 CTNF 계산을 위한 형광 강도 데이터의 선택 및 측정에 대한 단계별 설명. (A) 명시야 이미지; (B) mTurquoise2 이미지; (C) 핵 TO-PRO-3 염색; (D) 총 β-catenin AF568 이미지. 정사각형 상자는 CTCF 및 CTNF 계산에 사용되는 배경 신호 영역입니다. 눈금 막대 = 50μm. 약어: CTCF = Corrected Total Cell Fluorescence; CTNF = Corrected Total Nuclear Fluorescence(보정된 총 핵 형광). 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여러 표준 Wnt 리포터는 리포터 민감도와 실제 리포터 단백질이 다른 상태로 사용할 수 있습니다. 합성으로 도입된 다중합체 TCF/LEF 결합 부위를 사용하는 리포터 모델은 형광 리포터 단백질과 함께 사용할 수 있습니다. 그러나, 이러한 전이유전자의 반복은 육종 또는 장기간 의 생체 내 실험 동안에 손실될 수 있으며, 리포터 발현에 영향을 미치는 주변 게놈 서열로부터의 비-Wnt 신호에 민감할 수 있다. 따라서 가장 많이 사용되는 리포터는 살아있는 세포에서 사용하기 어려움에도 불구하고 이전 변이체인 Axin2-LacZ로 남아 있습니다.
Axin2-mTurquoise2 표준 Wnt 리포터 모델은 밝고 상대적으로 안정적인 형광 리포터 단백질의 단순성에도 불구하고 Axin2-LacZ와 동일한 리포터 신뢰성을 제공합니다. 이 청록색 변이체 형광 단백질은 장기 이미징에 유용하며 가장 일반적으로 사용되는 항체 형광 색소와 쉽게 결합할 수 있습니다25. 그러나, 3D 침투 및 자가형광에 관한 가능한 제한들은 이 모델(29)을 사용할 때 고려되어야 한다. β-카테닌 핵 안정화는 표준 Wnt 리포터 드라이버이기 때문에 대부분의 분자 실험에서는 활성 Wnt 신호를 확인하기 위해 증가된 총 또는 활성 β-카테닌의 검출이 필요합니다. 그러나 β-catenin 발현은 악명이 높으며 Axin2가 실제로 더 나은 마커일 수 있는 것을 감지하기 어렵습니다. 이 프로토콜에서는 낮은 형광 신호에도 불구하고 Axin2-mTurquoise2 리포터 모델을 핵 총 β-catenin-AF568의 단세포 흉선 세포학적 염색과 결합하는 방법을 설명합니다.
이 모델의 중요한 단계는 주로 낮은 Axin2-mTurquoise2 및 β-catenin-AF568 발현의 적절한 검출과 관련이 있습니다. 따라서 이 프로토콜은 세포 생존율이 낮아 자가형광이 증가하는 것으로 알려진 흉선세포에서 가능한 최대 신호 검출을 설명합니다. 이것은 흉선의 생리학적 환경에서 흉선세포 선택 과정에서 자연적인 세포사멸을 겪는 흉선세포와 관련이 있습니다. 따라서 이러한 세포에서 Axin2-mTurquoise2 및 β-catenin-AF568의 낮은 발현을 입증하면 Axin2-mTurquoise2 모델의 적용 가능성이 촉진될 것이라고 믿습니다.
신뢰할 수 있는 결과를 얻으려면 장비를 적절하게 미세 조정할 때 특별한 주의를 기울여야 합니다. 실제 신호와 배경 신호를 구별하려면 유세포 분석 및 컨포칼 이미징 장비를 올바르게 보정하기 위해 몇 가지 positive 및 negative control을 포함해야 합니다. 293T 세포와 같은 안정적인 mTurquoise2 발현 세포주를 양성 대조군으로 사용할 것을 제안하는데, 이는 형질주입이 용이하고, 광범위한 강도 스펙트럼에서 정상 상태 표준 Wnt 발현이며, 염화리튬(LiCl), 6-브로모인디루빈-3'-옥심 또는 CHIR99021 31,32,33과 같은 Wnt 경로 활성화 화합물에 대한 민감성으로 인해 양성 대조군으로 사용됩니다. 여기(excitation), 방출 스펙트럼 및 형광 강도(fluorescent intensity)가 유세포 분석에서 다른 형광 색소의 스펙트럼 유출에 대한 보상 값 또는 컨포칼 현미경 검사에서 검출 필터 범위의 정의를 결정하기 때문에 정확히 동일한 mTurquoise2 리포터 단백질로 대조군을 사용하는 것이 가장 중요합니다.
또한, Axin2-mTurquoise2 리포터 구조체의 2배를 포함하는 관심 세포의 두 번째 Axin2-mTurquoise2 동형접합체 양성 대조군은 특히 발현이 낮은 세포의 경우 생리학적으로 발현된 mTurquoise2 형광 강도 범위에 맞게 조정하기 위해 권장됩니다. 표준 Wnt 신호전달이 투여량에 따라 달라져 리포터 발현이 변동한다는 점을 고려할 때, 레이저 출력의 과다 노출을 배제하고 합리적인 신호/잡음비를 정의하며 진양성 mTurquoise2 발현 임계값을 정의하기 위해 네거티브 컨트롤이 필요합니다.
유세포 분석에서와 마찬가지로 여러 특성화 마커를 추가하는 것은 일반적인 관행입니다. 일치하는 형광 색소는 스펙트럼 스필오버를 최소화하면서 선택해야 합니다. FITC 또는 Alexa Fluor 488 (AF488)과 mTurqoise2 리포터 단백질의 조합은 이 프로토콜에 제시된 유세포 분석기 설정에서 최소한의 스펙트럼 간섭을 제공해야 합니다. 두 형광 색소의 형광 스펙트럼을 비교할 때, mTurquoise2는 488 레이저 (1 % 효율)에 의해 최소 여기되며, 이는 특히 발현이 낮은 mTurquoise2 리포터 세포에서 무시될 수 있습니다. 따라서 흉선세포에서 유의미한 위양성 FITC 신호는 예상치 못한 것입니다. 컨포칼 현미경 검사의 경우, 특히 제안된 컨포칼 설정의 경우, 이미지 처리 소프트웨어에서 상당한 신호 불혼화 외에 다른 보상의 가능성이 없기 때문에 FITC 또는 AF488 형광 색소의 사용은 권장되지 않습니다. 대신, AF568과 같은 다른 형광 색소를 선택하여 스펙트럼 중첩 문제 없이 낮은 mTurquoise2 발현을 완전히 검출해야 합니다.
mTurquoise2 발현이 높은 세포로 작업하거나 컨포칼 현미경에서 440nm 레이저를 사용할 수 있고 방출 필터 범위를 좁힐 때 FITC 또는 AF488을 사용할 수 있지만 Axin2 발현은 대부분의 성인 조직에서 낮은 것으로 알려져 있습니다. 당사의 프로토콜에서는 β-카테닌과 같은 접합체 안정성이 낮은 단백질의 효과적인 면역염색을 보장하는 사전 라벨링된 2단계 고성능 AF568 라벨링 절차로 총 β-카테닌 발현을 측정했습니다. 면역염색 프로토콜의 단계는 높은 백그라운드 신호의 존재 없이 세포질 또는 핵에서 진양성 β-카테닌을 측정하도록 최적화되었습니다. 1차 배양 및 동결절제술에 유사한 염색 프로토콜을 사용할 수 있지만, 다른 세포 유형으로 작업할 때는 고정 단계를 테스트해야 합니다. Axin2-mTurquoise2 모델은 리포터 기능만 가지고 있으므로 다른 Axin2 knock-in 모델(22)과 같은 세포 추적 실험에는 유용하지 않습니다. 사실, 이러한 우아한 Cre-재조합 Wnt 모델은 조직 이미징 실험에 대부분 유용하며 환경적 맥락을 잃는 세포 현탁액에는 유용하지 않습니다. Axin2-mTurquoise2 모델은 유전자 삽입으로 인해 Axin2 유전자 기능을 방해하지만 이 기능은 Wnt 치료 표적에 대한 Axin2 knock-out 모델을 연구하는 데 유용합니다.
동형접합체 마우스는 Axin2 기능이 부족하여 파괴 복합체34에서 β-catenin의 인산화를 위한 단백질 상호 작용을 방해합니다. 그러나, mTurquoise2 리포터 표현식은 표준 Wnt 신호전달이 대체 경로를 통해 활성 상태로 유지되는지 여부를 보여주는 데 도움이 됩니다. 주목할 점은, Axin2는 또한 Wnt 리간드 결합에 대한 Wnt 프리즐드/LRP 수용체 복합체에서 중요한 역할을 하며, 신호 캐스케이드35에서 또 다른 흥미로운 Wnt 조절 지점을 제공한다. Axin2-mTurquoise2 쥐 모델 외에도 유사한 리포터 구조체는 일시적인 형질전환에 유용하며 CRISPR-Cas9 기술을 통해 내인성 Axin2 유전자 자리에 특이적으로 표적화될 수 있습니다21. 요약하면, 이 보고서는 Axin2-mTurquoise2 리포터 모델을 낮은 Axin2 발현 흉선세포에 대해 분석하는 쉽고 강력한 방법을 설명합니다. 이 프로토콜은 약물 스크리닝 및 기능적 Wnt 치료 표적 정의를 위한 다른 표준 Wnt 발현 세포 유형에 적용할 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 새로운 마우스 모델을 개발하기 위한 프로파일링 Area Regenerative Medicine을 위한 Leiden University의 보조금으로 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| BD FACScantoII flow cytometer | BD Biosciences | not aplicable | Serial number V96300710. The flow cytometer setup in this protocol contains a 405 nm laser line with 505 longpass filter and 530/30 nm bandpass filter, and 470/20 nm bandpass filter; a 488 nm laser with 735 nm longpass filter and 780/60 nm bandpass filter, 670 nm longpass filter and 655 nm longpass filter, 610 nm longpass filter, 550 nm longpass filter and 575/26 nm bandpass filter, 505 nm longpass filter and 530/30 nm bandpass filter, and 488/10 nm bandpass filter; and a 633 nm laser line with 735 nm longpass filter and 780/60 nm bandpass filter, 685 nm longpass filter, and 660/20 nm bandpass filter. |
| BSA | Sigma | A9647 | |
| Corning 70 μm cell strainer | Falcon/Corning | 352350 | |
| Cytospin 4 Type A78300101 | Thermo Scientific | not aplicable | |
| DMSO | Sigma Aldrich | D5879-1L | |
| DNAse I | Sigma | A9647 | |
| Falcon 50 mL Conical Centrifuge tubes | Greiner bio-one | 227261 | |
| Falcon round-bottom Polystyrene Test tubes with cell strainer snap cap | Fisher Scientific | 352235 | |
| Fetal Calf Serum (FCS) | Greiner Bio-One B.V. | not aplicable | Depends on origin |
| Fiji software | ImageJ | not aplicable | Version 1.53 |
| Filter card white (for cytospin) | VWR | SHAN5991022 | |
| FlowJo 10 software | Treestar | not aplicable | Version 10.5.3 |
| Frost slides | Klinipath | ||
| Gibco IMDM medium | Fisher Scientific | 12440053 | |
| HCX PL APLO 40x 1.4 OIL lens | Leica microsystems | not aplicable | |
| Hydrophobic pen: Omm Edge pen | Vector | not aplicable | |
| Leica TCS SP5 DMI6000 | Leica microsystems | not aplicable | The microscope setup in this protocol consisted of an HCX PL APO 40x/1.2 oil-immersion objective with 8-bit resolution, 1024 pixels x 1024 pixels, 400 Hz speed, pinhole 68 µm, and zoom factor of 1.5 at room temperature. This system contains a 405 diode laser, argon laser, DPSS 561 laser, HeNe 594 laser and HeNe 633 laser with 4 hybrid detectors (HyDs) and 5 photomultiplier tubes (PMTs). |
| Methanol | VWR | 1060091000 | |
| NaN3/sodium azide | Hospital farmacy | not aplicable | |
| Normal mouse serum | Own mice | not aplicable | |
| PBS | Lonza | BE17-517Q | |
| ProLong Diamond Antifade Mountant | Fisher Scientific | P36965 | |
| Purified mouse anti-β-catenin (CTNNB1) | BD Biosciences | 610154 | |
| TO-PRO-3 Iodide | Thermofisher | T3605 | |
| Transparent nailpolish | at any drugstore | not aplicable | |
| Tween-20 | Sigma Aldrich | P1379-500ml | |
| Zenon Alexa Fluor 568 Mouse IgG1 labeling kit | Thermofisher | Z25006 |
참고문헌
- Kahn, M. Can we safely target the WNT pathway. Nature Reviews. Drug Discovery. 13 (7), 513-532 (2014).
- Jung, Y. S., Park, J. I. Wnt signaling in cancer: therapeutic targeting of Wnt signaling beyond beta-catenin and the destruction complex. Experimental & Molecular Medicine. 52 (2), 183-191 (2020).
- Gao, K., Zhang, T., Wang, F., Lv, C. Therapeutic Potential of Wnt-3a in neurological recovery after spinal cord injury. European Neurology. 81 (3-4), 197-204 (2019).
- Jia, L., Pina-Crespo, J., Li, Y. Restoring Wnt/beta-catenin signaling is a promising therapeutic strategy for Alzheimer's disease. Molecular Brain. 12 (1), 104(2019).
- Bae, S. M., Hong, J. Y. The Wnt signaling pathway and related therapeutic drugs in autism spectrum disorder. Clinical Psychopharmacology and Neuroscience. 16 (2), 129-135 (2018).
- Tajer, P., Pike-Overzet, K., Arias, S., Havenga, M., Staal, F. J. T. Ex vivo expansion of hematopoietic stem cells for therapeutic purposes: Lessons from development and the niche. Cells. 8 (2), 169(2019).
- Yanai, K., et al. Crosstalk of hedgehog and Wnt pathways in gastric cancer. Cancer Letters. 263 (1), 145-156 (2008).
- Blank, U., et al. An in vivo reporter of BMP signaling in organogenesis reveals targets in the developing kidney. BMC Developmental Biology. 8, 86(2008).
- Duncan, A. W., et al. Integration of Notch and Wnt signaling in hematopoietic stem cell maintenance. Nature Immunology. 6 (3), 314-322 (2005).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- Lustig, B., et al. Negative feedback loop of Wnt signaling through upregulation of conductin/Axin2 in colorectal and liver tumors. Molecular and Cellular Biology. 22 (4), 1184-1193 (2002).
- Bernkopf, D. B., Hadjihannas, M. V., Behrens, J. Negative-feedback regulation of the Wnt pathway by conductin/axin2 involves insensitivity to upstream signalling. Journal of Cell Science. 128 (1), 33-39 (2015).
- Vassar, R., Rosenberg, M., Ross, S., Tyner, A., Fuchs, E. Tissue-specific and differentiation-specific expression of a human K14 keratin gene in transgenic mice. Proceedings of the National Academy of Sciences of the United States of America. 86 (5), 1563-1567 (1989).
- DasGupta, R., Fuchs, E. Multiple roles for activated LEF/TCF transcription complexes during hair follicle development and differentiation. Development. 126 (20), 4557-4568 (1999).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
- Mohamed, O. A., Clarke, H. J., Dufort, D. beta-catenin signaling marks the prospective site of primitive streak formation in the mouse embryo. Developmental Dynamics. 231 (2), 416-424 (2004).
- Moriyama, A., et al. GFP transgenic mice reveal active canonical Wnt signal in neonatal brain and in adult liver and spleen. Genesis. 45 (2), 90-100 (2007).
- Currier, N., et al. Dynamic expression of a LEF-EGFP Wnt reporter in mouse development and cancer. Genesis. 48 (3), 183-194 (2010).
- Ferrer-Vaquer, A., et al. A sensitive and bright single-cell resolution live imaging reporter of Wnt/beta-catenin signaling in the mouse. BMC Developmental Biology. 10, 121(2010).
- Jho, E. H., et al. Wnt/beta-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Molecular and Cellular Biology. 22 (4), 1172-1183 (2002).
- de Roo, J. J. D., et al. Axin2-mTurquoise2: A novel reporter mouse model for the detection of canonical Wnt signalling. Genesis. 55 (10), (2017).
- van de Moosdijk, A. A. A., van de Grift, Y. B. C., de Man, S. M. A., Zeeman, A. L., van Amerongen, R. A novel Axin2 knock-in mouse model for visualization and lineage tracing of WNT/CTNNB1 responsive cells. Genesis. 58 (9), 23387(2020).
- Choi, Y. S., et al. Distinct functions for Wnt/beta-catenin in hair follicle stem cell proliferation and survival and interfollicular epidermal homeostasis. Cell Stem Cell. 13 (6), 720-733 (2013).
- Nolan, G. P., Fiering, S., Nicolas, J. F., Herzenberg, L. A. Fluorescence-activated cell analysis and sorting of viable mammalian cells based on beta-D-galactosidase activity after transduction of Escherichia coli lacZ. Proceedings of the National Academy of Sciences of the United States of America. 85 (8), 2603-2607 (1988).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93. Nature Communications. 3, 751(2012).
- Bernkopf, D. B., Bruckner, M., Hadjihannas, M. V., Behrens, J. An aggregon in conductin/axin2 regulates Wnt/beta-catenin signaling and holds potential for cancer therapy. Nat Commun. 10 (1), 4251(2019).
- Joosen, L., Hink, M. A., Gadella, T. W., Goedhart, J. Effect of fixation procedures on the fluorescence lifetimes of Aequorea victoria derived fluorescent proteins. Journal of Microscopy. 256 (3), 166-176 (2014).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnology Annual Reviews. 11, 227-256 (2005).
- Henriksson, J., et al. Endrov: an integrated platform for image analysis. Nature Methods. 10 (6), 454-456 (2013).
- Hedgepeth, C. M., et al. Activation of the Wnt signaling pathway: a molecular mechanism for lithium action. Developmental Biology. 185 (1), 82-91 (1997).
- Sato, N., Meijer, L., Skaltsounis, L., Greengard, P., Brivanlou, A. H. Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nature Medicine. 10 (1), 55-63 (2004).
- Ring, D. B., et al. Selective glycogen synthase kinase 3 inhibitors potentiate insulin activation of glucose transport and utilization in vitro and in vivo. Diabetes. 52 (3), 588-595 (2003).
- Liu, C., et al. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 108 (6), 837-847 (2002).
- Zeng, X., et al. Initiation of Wnt signaling: control of Wnt coreceptor Lrp6 phosphorylation/activation via frizzled, dishevelled and axin functions. Development. 135 (2), 367-375 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
ISSN 2578-2746
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.