Method Article
Hızlı ve Nicel Intravital Chick Chorioallantoic Membran Modeli Kullanılarak Metastatik Regülatörlerin Keşfi
Bu Makalede
Özet
Bu, kanser metastazının baskılayıcılarını veya sürücülerini taramak için etkili bir yöntemdir. Bir ifade kütüphanesi ile transdüklenen hücreler, metastatik koloniler oluşturmak için tavuk chorioallantoic membran vaskülatürüne enjekte edilir. İnvazivliği azalmış veya artmış koloniler, fenotiplerini doğrulamak için ekscised, genişletilmiş, reenjected ve son olarak, yüksek verim sıralaması kullanılarak analiz edilir.
Özet
Kanser araştırmalarındaki son gelişmeler, kanser metastazının son derece karmaşık doğasını göstermektedir. Birden fazla gen veya gen ağının, kanser tipine, dokusuna ve bireysel hasta özelliklerine bağlı olarak kanser metastatik basamaklı genlerini ve gen ürünlerini farklı bir şekilde düzenlemede rol aldığı bulunmuştur. Bunlar genetik terapötikler ve kişiselleştirilmiş tıp yaklaşımları için potansiyel olarak önemli hedefleri temsil eder. Bu genetik hedeflerin belirlenmesi için hızlı tarama platformlarının geliştirilmesi şarttır.
Civciv chorioallantoic membran (CAM), yumurta kabuğunun altında bulunan ve gelişmekte olan embriyoda gaz değişimine izin veren son derece damarlı, kollajen bakımından zengin bir zardır. CAM'ın konumu ve damarlanması nedeniyle, kollajen zengin matrisi ve vaskülat ile kanser hücresi etkileşimlerinin sağlam insan kanseri hücre ksinograftingini ve gerçek zamanlı görüntülenmesini sağlayan intravital bir insan kanseri metastaz modeli olarak geliştirdik.
Bu model kullanılarak, kanser metastazının yeni sürücülerinin veya baskılayıcılarının tanımlanması için nicel bir tarama platformu tasarlanmıştır. Tam bir insan genom shRNA gen kütüphanesine sahip bir baş ve boyun HEp3 kanser hücresi havuzu dönüştürdük, sonra hücreleri düşük yoğunlukta CAM vaskülatına enjekte ettik. Hücreler çoğaldı ve tek tümörlü hücre kolonileri oluşturdu. CAM dokusuna istila edemeyen bireysel koloniler kompakt bir koloni fenotipi olarak görülebilir ve hücrelerde bulunan transdüklenmiş shRNA'nın tanımlanması için eksilirdi. Bireysel kolonilerin görüntüleri istilacı oldukları için değerlendirildi. Yanlış pozitiflerin oranını azaltmak için birden fazla seçim turu gerçekleştirildi. Bireysel, izole kanser hücre klonları veya ilgi genlerini ifade eden yeni tasarlanmış klonlar primer tümör oluşumu testine veya kanser hücresi vaskülat ko-seçenek analizine tabi tutuldu. Özetle, metastatik karşıtı hedef tanımlamasına ve dinamik ve karmaşık bir olay basamaklanmasının intravital analizine olanak tanıyan hızlı bir tarama platformu sunuyoruz.
Giriş
Metastaz, kanser hastasının ölümünün ana nedenidir1,2,3. Metastatik kanser hücreleri, metastatik basamaklamanın beş adımı boyunca kanser türüne bağlı olarak farklı sinyal yolları kullanır: yerel istila, intravazasyon, dolaşımda sağkalım, ekstravazasyon ve uzak metastatik bölgelerde koloni genişlemesi. Bu metastatik sürecin mevcut anlayışı, iki darboğaz adımı olduğunu, birinin birincil tümörden kanser hücresinin yönlü istilası olduğunu ve ikincisi uzak bölge metastatik lezyonunun kurulması olduğunu göstermektedir4,5,6. Her iki adım da kanser hücrelerinin ilk istila veya uzak metastatik lezyon oluşumu bölgelerinde kollajen ve vaskülat ile aktif olarak etkileşime girmesini gerektirir. Bu nedenle, metastatik kanser hücreleri hücrelere bağlanabilmeli, kollajen liflerini yeniden şekillendirebilmeli ve damar duvarları boyunca yönlü istila edebilmelidir7. Kanser hücrelerinin bu adımları tamamlamasını engellemek için antimetastatik terapötik hedefleri hızla belirleyebilen tarama modelleri en yüksek öneme sahiptir. Mevcut in vitro tarama modelleri karmaşık canlı doku ortamını tam olarak taklit etmez. Fare modelleri maliyetli ve zaman alıcıdır. Bu nedenle, karmaşık canlı doku ortamları ve hedeflerin hızlı tanımlanmasını sağlayan intravital tarama platformlarına acil ihtiyaç vardır.
Son on yıl içinde, tavuk embriyosu insan kanseri metastazının sağlam ve uygun maliyetli bir modeli olarak kurulmuştur 8,9,10,11,12. Chick chorioallantoic membran (CAM) dokusu ince ve yarı saydamdır, bu da primer tümör ve/veya metastatik bölgelerde hücre ve koloni davranışlarının intravital mikroskobik görüntülenmesi için idealdir12. Birden fazla insan kanser hücre hattından primer tümör büyümesi, CAM dokusuna mikroenjeksiyondan sadece birkaç gün sonra başlatılabilir ve metastaz yapılabilir. Kanser hücreleri CAM dokusuna intravenöz, intra-CAM veya kollajen onplantlar da dahil olmak üzere çeşitli şekillerde uygulanabilir, bu esneklik araştırmacının kanser ilerlemesinin belirli aşamalarına, örneğin metastatik lezyon oluşumuna, primer tümörden invazyona veya anjiogeneze odaklanmasını sağlar.
Burada, kanser hücrelerinin invaziv metastatik lezyonlar oluşturma yeteneğini ölçmek için kullanılabilecek nicel bir tarama platformunu açıklıyoruz. Bir ifade kütüphanesi ile transdüklenmiş kanser hücreleri, düşük yoğunlukta CAM vaskülat içine intravenöz olarak enjekte edilir. Metastatik koloniler 4-5 gün boyunca oluşur, daha sonra ortaya çıkan kolonilerin istila kapasitesi ve vaskülat etkileşimi değerlendirilir. İstilacı olamayan bireysel koloniler eksize edilir, yayılır ve fenotipleri, koloni kompaktlığı ve kanser hücre-kan damarı temaslarının reenjeksiyonu ve niceliği ile CAM'de doğrulanır. Tek metastatik koloni mutant fenotipinden sorumlu ifade kütüphanesi yapıları, yüksek verim sıralaması yoluyla izole edilmiş koloni genomik DNA'sından tanımlanır. Aynı platform, bir gen ile gözlenen fenotip arasındaki nedensel bağlantıyı doğrulamak veya gözlemlenen fenotip üzerinde derinlemesine mekanistik çalışmalar yapmak için daha fazla kullanılabilir.
Protokol
Tüm deneyler Alberta Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi'nin yönetmelik ve yönergelerine uygun olarak gerçekleştirildi. Kuş embriyoları birçok araştırma enstitüsü tarafından canlı hayvan olarak kabul edilmiyor ve hayvan protokolüne gerek yok. Bununla birlikte, kuş embriyolarının ağrı hissedebileceği ve bu nedenle mümkün olduğunca insancıl bir şekilde tedavi edilmesi gerektiği kabul edilen bir görüşdür. Uygun düzenlemelere uyulmasını sağlamak için herhangi bir araştırma çalışmasına başlamadan önce yerel hayvan araştırma otoritesi ile iletişime geçilmelidir.
1. Kabuksuz yumurta kültürü
- Yerel sağlayıcıdan döllenmiş tavuk yumurtaları alın. Bu deneyde White Leghorn tavuk ırkı bunların kullanımı; bununla birlikte, diğer ırklar da kullanılabilir.
NOT: Embriyoların bir kısmının çatlama sırasında hasar görmesi ve bu protokolde kullanılamaması durumunda ihtiyaçtan %10 daha fazla yumurta elde edilmesi önerilir. - Gerekli sayıda yumurtayı% 60 nemlendirilmiş sallanan bir inkübatöre aktarın. Yumurtaların geri kalanı canlılık kaybı olmadan 12 ° C'de iki haftaya kadar saklanabilir.
- Yumurtaları dört gün boyunca nemlendirilmiş sallanan inkübatörde kuluçkaya yatırın.
NOT: 1. gün, yumurtaların sallanan inkübatöre aktarıldığı gündür. - Kabuksuz yumurta kültürü için tartım yemeklerini ve plastik kapakları hazırlayın. Embriyoya verimli hava erişimi sağlamak için tartım yemeklerinin her birinin köşelerinden birini kesin (Şekil 1A).
- Hazırlanan tartım tabaklarını akış başlığında sıralar halinde düzenleyin. (Şekil 1B).
- Ayrı bir tartım kabında yumurta durulama için% 70 etanol hazırlayın.
- Yumurtayı kısaca% 70 etanol içine batırın, ardından yumurtanın en büyük latitudinal çapına paralel dört adet 2-3 mm kesim yapmak için elektrikli döner aleti dikkatlice kullanın (Şekil 1C).
- Kesilmiş yumurtayı bir tartım kabına aktarın ve yumurta kabuğunda bir çatlak oluşana kadar yumurtayı yavaşça tabak tabanına bastırın (Şekil 1D).
- Embriyonun tartım kabına kaymasına izin vererek yumurta kabuğu yarılarını ayırın. Yumurta kabuğunü atın ve tartım kabını bir kapakla örtün.
- Embriyoları nemlendirilmiş sallanmayan inkübatöre aktarın (Şekil 1E).
NOT: Embriyoları içeren tartım yemekleri ayrı plastik kaplara (12 embriyo/kap) yerleştirilir. Bu embriyo canlılığını arttırır ve deneye özgü embriyo organizasyonuna izin verir. - Embriyoları 6 gün daha kuluçkaya yatır (10 güne kadar). Günlük ölü veya kontamine embriyoları kontrol edin ve inkübatörden çıkarın.
NOT: Embriyolar havadaki küf sporları ile kontamine olabilir. Küf kontaminasyonu başlangıçta embriyo CAM yüzeyinde beyaz benekler olarak kendini gösterir. Kontamine embriyoları derhal çıkarın ve kirlenmeyi önlemek için inkübatöre haftalık olarak% 70 etanol silin. Deneyimlerimize göre kontaminasyon seviyeleri çok düşüktür ~ 1-3%. - Bu embriyoları 10.
2. Kanser hücrelerinin enjeksiyon için hazırlanması
NOT: Metastatik koloni seçimi, floresan kanser hücreleri tarafından kurulan, yeşil veya kırmızı floresan protein gibi floresan proteinle etiketlenmiş bir ifade kütüphanesinden veya vektörden türetilen bir fenotipe dayanmaktadır (Şekil 2A'dakitüm ekran akışına bakın). Kanser hücrelerinin çoğalması ve düzensiz lekelemenin neden olduğu sinyalin hızlı solması nedeniyle floresan proteinlerle geçici olarak enfekte olmuş veya hücre geçirgen floresan boyalarla etiketlenmiş hücrelerin kullanılması önerilmez.
- Enjeksiyon sırasında% 60-70 izdiah için kültür kanseri hücreleri. Kanser hücrelerinin daha yüksek izdiah seviyelerinde kullanılması canlılıklarını azaltacak ve metastatik koloni oluşumunun düşük verimine neden olacaktır. Kullanılan kanser hücrelerinin mikoplazma içermemesini sağlayın, çünkü mikoplazma kontaminasyonu tavuk embriyosu canlılığının azalmasına neden olabilir.
- Hücreleri 1x PBS pH 7.4 ile iki kez durulayın. Kalan PBS'yi çıkarın, ardından% 0.5 Trypsin-EDTA ekleyin ve tüm hücreler kültür yemeği yüzeyinden kaldırılana kadar 2-5 dakika boyunca 37 ° C'de kuluçkaya yatırın.
- Hücre süspansiyonu 5 dakika boyunca 200 x g oda sıcaklığında 15 mL konik tüp ve santrifüj hücrelerine aktarın.
- Tripsin ve antibiyotik gibi diğer kültür medya bileşenlerini çıkarmak için hücreleri 10 mL PBS'de yeniden 2.3.
NOT: Kanser hücresi süspansiyonunda tripsin veya antibiyotik gibi hücre kültürü bileşenlerinin varlığı tavuk embriyosu canlılığının azalmasına neden olabilir. - 1 mL buz gibi PBS ile süpernatant ve resuspend hücreleri dikkatlice emiş.
- Hemositometre veya mevcut başka bir hücre sayma ekipmanı kullanarak hücre sayısını sayın.
NOT: Bu tarama protokolü, her metastatik koloninin tek bir hücre tarafından başlatılmasını gerektirir. Hücreleri sayarken, hücrelerin tamamen trypsinized olduğundan ve tek bir hücre süspansiyonu olarak varolduğundan emin olun (hücre kümeleri yoktur). - İntravenöz (IV) enjeksiyon konsantre hücreleri için 0,5 x 106 ila 1,0 x 106 hücre/mL. Hücre konsantrelerini seyreltmek ve/veya yeniden kullanmak için buz gibi 1x PBS kullanın. Her on embriyo için yaklaşık 1 mL hücre süspansiyonuna ihtiyaç duyulacağını bekleyin.
NOT: Süspansiyonda gerekli hücre süspansiyon konsantrasyonu esas olarak deney deneyimi seviyesine göre belirlenir. Daha fazla bilgi için lütfen sonraki bölüme bakın.
3. Metastatik koloni oluşumu için kanser hücrelerinin intravenöz enjeksiyonu
NOT: Bu protokole uyarak bir gün içinde yüz kadar embriyo enjekte edilebilir. Genellikle metastatik kolonileri izole etmek daha uzun zaman alır (Adım 5) daha sonra kanser hücrelerini enjekte etmek ve bu nedenle, tüm adımları tamamlamak için gereken süreyi tahmin etmek için ilk bir deney yapılması önerilir. Diferansiyel kanser hücresi floresan etiketlerinin kullanılması, hayvan sayılarını ve her deney için gereken süreyi azaltmaya yardımcı olur. Örneğin, kontrol hücreleri RFP (kırmızı floresan protein) ile etiketlenebilirken, mutant tümör hücreleri alternatif olarak GFP (yeşil floresan protein) ile etiketlenebilir. Bu durumda, her deney, embriyolar arası değişkenliği düzelten yerleşik bir kontrole sahiptir.
- Enjeksiyon cihazını Şekil 2B'degösterildiği gibi monte edin. Önce şırıngaya bir iğne takın ve ardından şırınga iğnesini 3-5 cm uzunluğunda boru parçası ile uzatın.
- İnce asaları (~20-60 μL genişliğinde) kullanarak borosilikat iğnesinin ucunu kırın.
- Şırıngayı kanser hücresi süspansiyonu (50-200 μL) ile yükleyin ve borosilikat iğneyi boruya yerleştirin (Şekil 2B).
- Hücre tıkanıklıkları ve hava kabarcıkları için borosilikat iğnesini inceleyin. Her metastatik koloninin tek bir hücre tarafından başlatıldığından emin olmak için hücrelerin tek bir hücre süspansiyonu olarak enjekteilmesi önemlidir.
NOT: Kanser hücreleri PBS'de 1-2 saat sonrası trypsinizasyon içinde toplanma eğilimindedir ve bu nedenle enjeksiyondan hemen önce hazırlanmalıdır. Gerekirse, enjeksiyonlar için kullanılan 1 mL şırınga kullanılarak hücreler periyodik olarak yeniden kullanılabilir (borosilikat iğnesi olmadan). - Kılcal damar içinde hücre tıkanıklığı görülürse, kılcal damarı çıkarın, hücreleri yeniden askıya alın ve yeni bir kılcal damarla değiştirin. Kabarcıkları dışarı itmek için pistonu kullanın. Hücre tıkanıklık veya kabarcıklar gözlenmezse, bir sonraki adıma geçin.
- Kapak kapağını çıkarın ve embriyoyu stereoskop altında aktarın. CAM yüzeyine enjekte edilecek uygun damarı tanımlayın. Damarlar ve arterler CAM dokusu içindeki karmaşık ağı oluşturur (Şekil 2C). Damarlar, embriyoya oksijen bakımından zengin kan taşıdıkları için daha parlak kırmızı renkle ayırt edilir.
NOT: Genel embriyo manipülasyonu, kanser hücresi enjeksiyonu ve metastatik koloni eksizyonu için, görselleştirme için 0.8x ve 1.5x hedefleri ve 10x göz merceği ile donatılmış floresan stereomikroskop kullanın. Kullanıcıların deneyim düzeyine bağlı olarak, bu prosedürler için daha az gelişmiş mikroskop da başarıyla kullanılabilir. Okuyucular daha ayrıntılı öneriler için yazarlarla iletişime geçebilir. - Normalde borosilikat iğne ucunun çapından biraz daha geniş (%10-20) olan ve embriyo ile tartım kabı duvarının ortasında bulunan hücreleri enjekte etmek için ideal damarı bulun. Damar çatallanmasının hemen bitişiğindeki noktaya enjekte etmek genellikle daha kolaydır.
NOT: Daha büyük bir damara enjeksiyon daha kolay görünebilir, ancak aşırı kanamaya ve embriyo sağkalımlarının azalmasına neden olur. - İğnenin ucunu kan damarı duvarına bastırın ve kan akışıyla aynı yönde hafif basınç uygulayın. Gerekirse, enjekte edilen kabın tutturulması veya stabilize edilmesine yardımcı olmak için bir pamuklu çubuk (diğer elde tutulur) kullanın.
- Şırınd pistonu yavaşça bastırın. Kanser hücresi süspansiyonu kan akışına girdiğinde kan damarının "temizlenmesini" gözlemleyerek başarılı bir enjeksiyonu görselleştirebilirsiniz.
- İstenilen süspansiyon hacmi damarın kan akışına enjekte edilene kadar şırınna pistonunun basıncını 2-10 sn depresyona devam edin. Tek bir embriyonun enjeksiyonu, kullanıcının deneyim seviyesine bağlı olarak 1-10 dakika sürebilir. Enjeksiyon yerinde aşırı kanama veya berrak sıvı birikimi görülürse embriyoyu atın.
NOT: Bir embriyoya "aşırı enjekte etmek" kolaydır. Akılda tutulması gereken genel düşünce, metastatik kolonilerin 4-5 günlük bir büyüme döneminden sonra birbirlerine dokunmaması gerektiğidir. İdeal olarak ~% 5-10 terminal CAM ven kılcal damarlarının içinde başarılı bir enjeksiyondan sonra hareketsiz hücreler olmalıdır (Şekil 2D, E). 2. adımda belirtildiği gibi, bir dizi hücre konsantrasyonu kullanılabilir (0,5 x 106 - 1,0 x 106 hücre/mL). Daha düşük konsantrasyonlar daha uzun enjeksiyon süresi gerektirecektir, ancak iğne tıkanmasını azaltacaktır. Daha yüksek konsantrasyonlar daha kısa enjeksiyon süreleri gerektirecektir, ancak iğne tıkanmasını artıracaktır. Bir operatör için en rahat olanı bulmak için birkaç konsantrasyon denemeniz önerilir. Genellikle enjeksiyon süresini azaltmak için daha yüksek konsantrasyon (1.0 x10 6 hücre/mL) tercih edilir. - İğneyi CAM'dan çıkarın ve herhangi bir kan veya fazla kanser hücresini çıkarmak için enjeksiyon bölgesini hafifçe pamuklu çubukla dablayın.
- Embriyoyu tartım kabında bir kapakla örtün ve enjekte edilen tavuk embriyosunu inkübatöre geri verin.
- Tüm embriyolar enjekte edilene kadar işlemi bir sonraki embriyo ile tekrarlayın.
4. Metastatik koloni büyümesi sırasında embriyo bakımı
- Embriyoları görsel olarak inceleyin. Ölü ve/veya bakteri veya küfle kirlenmiş varsa, bunları inkübatörden çıkarın, ardından laboratuvar imha prosedürlerine göre otoklavlayın ve atın.
NOT: Embriyoların metastatik koloni büyümesi için her gün (1, 3, 5. gün kanser sonrası hücre enjeksiyonu) kontrol edilir. Embriyo hasarına ve/veya ölüme neden olabileceğinden enjekte edilen embriyoları gereksiz yere hareket ettirmekten kaçının. - Hücreler aşırı büyüme (metastatik koloniler birbiriyle çakışır) veya CAM dokusu içindeki düzensiz dağılımı (CAM yüzeyinin küçük alt alanında bulunan metastatik koloniler) görüntülerse, bu embriyoyu deneyden çıkarın. Atılan embriyoları deneyden çıkarıldıktan hemen sonra -20 °C'de (veya onaylanmış başka bir yöntemde) dondurarak ötenazi yapın. CAM dokusundaki canlı metastatik hücrelerin sayısı başlangıçta azalacak (1-2 gün) ve daha sonra artacaktır (gün 2-5).
NOT: Bazı embriyolar kanser hücrelerini "reddedebilir", yani tüm kanser hücreleri CAM dokusundan kaybolacaktır. Bu embriyolar deneyden çıkarılmalıdır. Normalde kanser hücre kolonileri tartım kabı açılmadan floresan stereo mikroskop altındaki şeffaf kapaktan görülebilir. - Metastatik kolonilerin tekdüze göründüğünden emin olun (enjeksiyondan sonra ilk 1-3 gün). Enjeksiyon sonrası 4-5 gün içinde invaziv veya invaziv olmayan metastatik kolonileri tanımlayın (daha fazla ayrıntı için Bölüm 5'e bakın).
5. Metastatik kolonilerin izolasyonu
- Enjeksiyon sonrası 5. günde embriyoları inkübatörden çıkarın ve embriyo CAL'lerini metastatik koloni dağılımı için inceleyin. Embriyoları, kompakt (veya aşırı invaziv) kolonilerin bulunduğu tek tip koloni dağılımı ile tanımlayın.
NOT: Tavuk embriyolarının kültleme işlemi steril değildir, bu nedenle gelecekteki doku kültürü kirlenmesini önlemek için tüm tarama adımları son derece temiz koşullar altında yapılmalıdır. Kontaminasyon oldukça nadirdir ve eldiven ve maske takarak ve hücre enjeksiyonu ve koloni izolasyon işlemleri sırasında sadece steril aletler kullanılarak kolayca önlenebilir. Ortam laboratuvarı sıcaklığına maruziyetlerini azaltmak ve kirlenmeyi önlemek için embriyoların tek tek incelenmesi önerilir. - İlgi çekici metastatik koloniyi bulun. Kompakt bir koloni, CAM dokusunda sınırlı bir alanda bulunan kanser hücrelerinin çoğuna sahip bir koloni olarak tanımlanabilir (hücreler "birbirine kenetlenmiş" görünür). bir invaziv koloni, kanser hücrelerinin CAM dokusuna "saçıldığı" koloni olarak tanımlanabilir (Şekil 3A,B).
NOT: Metastatik koloninin "kompaktlığı" kanser hücre invazyonunun inhibisyonu, kanser hücresi çoğalmasının inhibisyonu veya her ikisi ile açıklanabilir. Tüm senaryolara dikkat edilmeli ve temas kolonileri izole edilmelidir (Şekil 3A,B). Basit bir floresan stereomikroskop, kompakt ve invaziv metastatik koloni fenotipleri arasında ayrım yapmak için kullanılabilir. - Diseksiyon mikroskobu altında, ince toparlamalar kullanarak metastatik ilgi kolonisini içeren CAM dokusunu hafifçe yukarı doğru çekin (Şekil 3C).
- Cerrahi makas kullanarak metastatik koloniyi içeren CAM dokusunu kesin.
- Metastatik koloniyi içeren CAM dokusunu boş, steril 1,5 mL tüpe (buz üzerinde) aktarın ve tüp kapağını kapatın.
NOT: İzole koloniler canlılık kaybı olmadan 3 saate kadar buzda tutulabilir. - Tüm ilgi kolonileri ayrı tüplere toplanana kadar eksizyon prosedürünü tekrarlayın. Hayvan acılarını önlemek için, bir embriyodan 2-3'ten fazla koloniyi çıkarmayın. Embriyoları koloni eksizyondan hemen sonra -20 °C'de (veya onaylanmış başka bir yöntemde) donarak ötenazi yaptırın.
- Cam dokuyu steril 18 kalibrelik bir iğne kullanarak mikrosantrifüj tüpünde hafifçe kıyın. Her koloni için ayrı bir iğne kullanın.
- 100 μL 1x kollajenaz çözeltisi ekleyin ve 37 °C'de 30 dakika kuluçkaya yatırın.
- Ortam sıcaklığında 5 dakika boyunca 300 x g'da hücreleri ve CAM dokusunu aşağı çevirin.
- Kollajenaz çözeltisini epire edin ve hücre ilgi alanı için kullanılan tam medyada hücreleri yeniden kullanın.
NOT: Normalde KOLLAJENAZ tedavisinden sonra CAM dokusu tamamen ayrışmaz ve kanser hücreleri önce CAM doku parçaları içinde çoğalır ve ancak daha sonra doku kültürü çanağı üzerine göç eder. - Ortam sıcaklığında 5 dakika boyunca hücreleri ve CAM dokusunu 300 x g'da tekrar döndürün.
- Hücreleri ve CAM doku parçalarını 1 mL tam ortam artı seçim faktöründe (varsa) yeniden biriktirin, ardından tek 12 kuyu doku kültürü kabına iyi aktarın.
NOT: Tavuk CAM fibroblastları klonal genişlemeyi engelleyen birden fazla pasaj için doku kültüründe devam edebilir. Metastatik kolonileri seçim faktörünün varlığında genişletme yeteneği (yani, kanser hücrelerini floresan hale getirmek için kullanılan bir vektör aynı zamanda bir memeli antibiyotik direnç genini kodlarsa) klonal genişlemeyi büyük ölçüde hızlandırabilir. Uygun antibiyotik konsantrasyonunun kullanıldığından emin olmak için taramadan önce bir öldürme eğrisi deneyi yapılmalıdır. - Önümüzdeki 1-3 hafta boyunca kanser hücrelerini büyüme ve kirlenme açısından günlük olarak izleyin.
- Hücreler konfluenslerin% 70-80'ine ulaştığında, hücreleri daha büyük hacimli bir kültür çanağında aktarır.
NOT: Her klonun en az iki kriyojenik şişesi dondurulunya kadar hücrelerin genişletilmesi önerilir. Büyük miktarlarda doku kültürünü korumak zahmetli ve gereksiz olabilir. - Yeterli kanser hücre numarasına ulaşılır ulaşılmaz sıralamaya veya bir sonraki seçim turuna geçin. Genellikle, kanser hücrelerinin 1 x10 6'ı modern yüksek verimli sıralama teknikleri için yeterlidir.
- Klon reenjeksiyonuna ve koloni kompaktlığının veya kanser hücre-kan damarı temasının görüntülenmesine ve niceliğine devam edin (Şekil 2A). Alternatif olarak, yüksek aktarım hızı sıralamasına geçin veya koloni seçimini yineleyin.
NOT: Yanlış pozitiflerin sayısını azaltmak için en az iki tur seçim önerilir. İki yaklaşım başarıyla iştir. 1) Koloni fenotipini doğrulamak için her klonu genişletin ve ayrı ayrı yeniden yönlendirin. 2) Tüm genişletilmiş klonları her biri 1:1 oranında karıştırın, bir karışım olarak yeniden karıştırın ve seçim döngüsünü tekrarlayın.
6. CAM vaskülat içine floresan etiketli lektinlerin enjeksiyonu.
- Enjekte edilecek damarı tanımlayın. Tümör hücre enjeksiyonu için kullanılan lektin için aynı enjeksiyon bölgesini kullanmak daha kolaydır.
- Floresan lektin stok çözeltisini (5 mg/mL) 50-100x 1x PBS ile seyreltin ve kanser hücresi enjeksiyonu için kullanılan enjeksiyon aparatına yükleyin.
NOT: Kan damarı görselleştirmesi için enjekte edilmesi gereken lectin miktarı (normalde 20-100 μL) mikroskop hassasiyetine bağlıdır ve taramadan önce deneysel olarak belirlenmelidir. - Tümör hücre enjeksiyonu ile aynı tekniği kullanarak lectin enjekte edin (bkz. adımlar 3.6.-3.10.).
- Lectin enjeksiyonundan sonra, embriyoyu 5 dakika boyunca iyileşmek için inkübatöre yerleştirin. Embriyoyu görüntülemeden hemen önce ve aynı anda sadece bir embriyo enjekte edin.
NOT. 12 gün veya daha büyük embriyolar genellikle lektin enjeksiyonlarından iyi bir şekilde iyileşir ve sıralı görüntüleme için ertesi gün tekrar lektin ile yeniden enfekte edilebilir. Genç embriyolar daha hassastır ve kan pıhtılaşması gösterebilir.
7. Kanser hücre-kan damarı temaslarının görselleştirilmesi
- Görüntülemeden önce sıcaklık düzenlemeli mikroskop muhafazasını yaklaşık 6 saat 37 °C olarak ayarlayın. Bu, mikroskop sıcaklığını stabilize edecek ve görüntüleme sırasında XYZ sürüklenmesini en aza indirmeye yardımcı olacaktır.
NOT. Bu deney için özel bir tavuk embriyo görüntüleme odası9,10,11,12,13 kullanılmıştır. Basit bir floresan diseksiyon mikroskobu, kanser hücresi enjeksiyonundan klon seçimine ve klon reenjeksiyonuna ve koloni kompaktlığının değerlendirilmesine kadar tüm adımlar için kullanılabilir. Kanser hücre-kan damarı temaslarının görüntülenmesi ve ölçülmesi için görüntüleme odası ile donatılmış bir konfokal mikroskop gereklidir. 1 saate kadar ısıtma gerekmez ve genellikle embriyolar canlılıklarını etkilemeden en az iki sıralı görüntüleme seansından sağ kurtulurlar. - Gerekli objektif lensin (20x veya 25x suya daldırma objektif lensi önerilir) takıldığından emin olun.
- Kapakla güvenli bir conta oluşturmak için görüntüleme odası kapağının alt kısmına ince bir vakum gresi tabakası uygulayın.
- Bir kapak kapağını yavaşça kapağın içine yerleştirin ve fazla vakum gresini silin.
- Lectin enjekte edilen embriyoyu inkübatörden alın ve gerekirse tartım kabının jantlarını kesin.
- Embriyoyu görüntüleme odasına, kapak altlık doğrudan CAM'ın metastatik ilgi kolonilerinin bulunduğu alana indirilmiş olarak yerleştirin. Kapak kapağı cama temas edene kadar kapağı yavaşça embriyoya küsleyin. Kapağı yerinde sabitlemek için vidaları sıkın, kapağın düz olduğundan ve kapak kapağının CAM'a aşağı doğru baskı yapmamasını sağlayın.
- Kontrol ve deneysel gruplardan (10-20) birkaç (5-10) embriyodan birden fazla rastgele koloninin görüntülerini alın.
NOT. Her alandan rastgele 3D yığınların (1-5um Z-adımlar; 50-100um aralık; 25x) alınması önerilir. - Varsa mikroskop alma yazılımında alan dikişi seçeneğini kullanın. Niceleme için kullanılan görüntüler yayın kalitesi olmayacağından, varsa rezonans tarama gibi hızlı alma modlarını kullanın. 5-10 μm Z-step, 100 μm toplam aralık ile 25x objektif ve 3 x 3 dikiş kullanın. Görüntü her durum için en az 100 hücre (~20 koloni).
8. Kanser hücresi kan damarı temaslarının nicelleştirilmesi
- Gerekli yazılımı kullanarak 3D dosyayı Z yığını olarak açın.
NOT. Kanser hücre-kan damarı temasını ölçmek için yüksek çözünürlüklü görüntüler elde etmek ve analiz etmek için özel yazılımlar kullanılmalıdır. 3D görüntü analizi yapabilen çeşitli yazılım paketleri mevcuttur. Daha fazla bilgi için lütfen Malzeme Tablosu'nu görün. - Görüntü alımı sırasında önemli XY hareketi oluştuysa, ImageJ StackReg eklentisini (http://bigwww.epfl.ch/thevenaz/stackreg) kullanarak Z yığınını hizalayın.
- İlgi çekici hücre (ler)i bulun.
- XYZ görüntüsünü Z yönünde kaydırın ve ilgi hücresi için kanser hücresi kan damarı temasının maksimum uzunluğunu içeren optik bölümü tanımlayın (Şekil 2E).
- "Manuel uzunluk ölçüm fonksiyonu" kullanarak kanser hücre-kan damarı temasını ölçün.
- Ölçümleri istatistiksel analiz için kullanılan veri yazılımı paketine girin.
NOT: Kanser hücrelerinin kan damarlarına bağlanma yeteneği, kanser hücre-kan damarı temaslarının uzunluğu veya belirli kanser hücre klonu (veya her ikisi için) için vaskülatla temas eden hücrenin yüzdesi olarak ölçülebilir. - Bir sonraki şüpheli hücreye geçin.
- Mutant klonlarını (lar) karşılaştıran istatistiksel öneme sahip verileri analiz edin ve veri kümelerini kontrol edin.
9. Koloni kompaktlığı nicelemesi
- 2. adımdakiyle aynı tekniği kullanarak genişletilmiş klondan hücreleri yeniden kopyala.
- Enjeksiyondan beş gün sonra her klon için 10-50 rastgele metastatik koloninin görüntülerini elde edin.
NOT: Metastatik koloni kompaktlığı nicelemesi için yüksek kaliteli görüntüler gerekmez. Monokromatik, stereo mikroskop (10x büyütme) görüntüler yeterlidir. Görüntünün parlaklığına (koloni içindeki hücrelerin çoğu görülmelidir) ve kontrasta (bir veya iki hücre arasındaki fark) dikkat edilmelidir. - Koloni görüntüsünü dijital olarak izole edin (bkz. Şekil 2C,D)ve tek başına koloni kompaktlık nicellik modülünü veya kör puanlama13'ükullanarak koloni kompaktlığı nicelemesine geçin.
- Bir sonraki ilgi alanına geçin.
- Mutant klon (lar) ve kontrol (yani karıştırma shRNA) veri kümelerini karşılaştırarak istatistiksel öneme sahip verileri analiz edin.
Sonuçlar
Kılcal damarlara yerleştirilen hücrelerin çoğunluğu tekli ise ve birbirinden önemli bir farkta (~0.05-0.1 cm) yer alıyorsa kanser hücresi enjeksiyonunun başarılı olduğu düşünülmektedir, böylece koloniler 5-6 günlük kuluçka süresinden sonra üst üste gelmezler(Şekil 3A). Kılcal damarların çoğunda kanser hücrelerinin birikmesi görülebiliyorsa enjeksiyon başarılı olmadı, bunu gösteren embriyolar atılmalıdır (Şekil 2E). Enjekte edilen kanser hücrelerinin önemli bir kısmı enjeksiyondan 24 saat içinde yok oluyor ve bazı embriyolar tüm kanser hücrelerini reddediyor gibi görünüyor. Kanser hücresi sağkalımı yerel yumurta tedarikçisine bağlı olarak değişecektir (yani enjekte edilecek hücre miktarı değişebilir) ve deneye devam etmeden önce en uygun enjeksiyon koşullarının (kanser hücresi konsantrasyonu ve enjeksiyon süresi) belirlenmesini şiddetle öneririz. Hücre konsantrasyonu 0,5 x 106 ila 1,0 x 106 hücre/m aralığında öneriyoruz. Optimal hücre konsantrasyonu ve enjeksiyon süresi elde edildiğinde, gün 5 enjeksiyon sonrası transdüklenmiş hücreler, CAM dokusunda dağınık görünen kanser hücreleri tarafından belirlenen invaziv görünen kolonilerin çoğunluğu ile çok çeşitli koloni fenotipleri üretmelidir (Şekil 3A). "Kompakt" görünen ve komşu kolonilerden yeterince uzakta bulunan metastatik kolonilere dikkat edilmelidir, böyle bir CAM dokusunda tops ve makasla ekslenebilirler (Şekil 3C). İzole pozitif ekran vuruşu (yani kompakt bir koloni), reinjeksiyon üzerine kompakt koloni fenotipini göstermelidir (Şekil 3B). Hücre sağkalımında (veya koloni içindeki hücre çoğalma hızında) bir azalma da gözlenebilir. Bu nedenle, yeterli koloni sayısı elde etmek için bazı pozitif ekran isabetleri için daha yüksek hücre numaralarının enjekte edilmesi gerekebilir. Kanser hücre-kan damarı temaslarının ölçümü için damar duvarı leke parlaklığına (floresan lektin; Şekil 3D,E) ve parlak/kontrastlı vasküler duvar sinyali için uygun miktarda lektin enjekte edilmelidir. Mikroskop-yazılım kalibrasyonu yapıldıktan sonra niceleme adımları sırasında mevcut herhangi bir görüntü analiz yazılımı kullanılabilir.

Şekil 1: Tavuk embriyosu kabuksuz kültüre genel bakış. (A) Kabuksuz kültür için hazırlanmış kapaklı bir tartım kabı. Ok kesilen köşeyi işaret eder. (B) Akış davlumbazında sıra sıra düzenlenmiş tartım yemekleri. (C) Elektrikli döner aletle yumurta kabuğu kesmek. (D) Bir yumurtayı tartım kabına kırmak. (E) Nemlendirilmiş inkübatörde kültürlenen embriyolar. Ölçek çubukları =1 cm (A-D) veya 5 cm (E). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
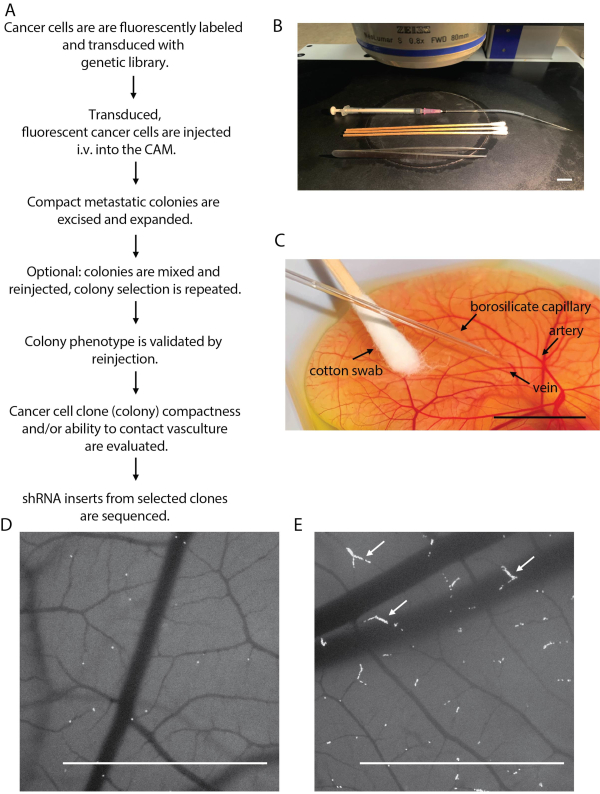
Şekil 2: Kanser hücre enjeksiyonu ve metastatik kolon izolasyonunun ana hatları. (A) Tavuk embriyo tarama platformu adımlarını özetleyen akış çizelgesi. (B) Stereo floresan mikroskop aşamasına kurulan kanser hücresi enjeksiyonu. (C) Kanser hücrelerinin CAM vaskülat içine enjeksiyonu. (D) Enjeksiyondan hemen sonra çekilen başarılı kanser hücresi enjeksiyonu (kabul edilebilir kanser hücresi yoğunluğu) gösteren görüntü. (E) Aşırı enjekte edilmiş embriyo olarak görülen zayıf kanser hücresi enjeksiyonu gösteren görüntü. Kan kılcal damarlarında (beyaz oklar) kanser hücresi birikmesine dikkat edin. Ölçek çubukları = 1 cm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3. Tarama protokolünün farklı adımları için temsili sonuçlar. (A) Heterojen (kütüphane transdüklenmiş kanser hücre hattı HEp3 hücreleri), enjeksiyondan 5 gün sonra oluşan metastatik koloniler. Kırmızı ok, çıkarılması gereken kompakt koloniyi (potansiyel pozitif vuruş) gösterir. (B) Reenjeksiyondan sonra izole edilmiş ekran vuruşlarından birinin (KIF3B) oluşturduğu metastatik koloniler, enjeksiyondan 5 gün sonra. İç parçalar, kesikli karelerden metastatik koloni görüntülerini dijital olarak kestiğini gösterir. Bu, C.I. nicelemesi için kabul edilebilir bir görüntü kalitesidir. Isabet reinjection (KIF3B) için ortalama C.I. değeri gösterilmiştir. (C) İlgi çekici metastatik koloninin CAM dokusundan izolasyonu. (D ) birkontrol kolonisinin temsili optik bölümleri ve (E) kif3B shRNA aşırı ifade kolonisi, her ikisi de kanser hücre-kan damarı temas ölçümlerini gösterir. CAM vaskülat floresan lektin-649 ile etiketlenmiştir. Ölçek çubukları =1 cm (A-C) veya 50 μm (D, E). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada genetik veya ilaç adayı ekranlar gibi önemli uygulamalar için kullanılabilecek hızlı bir floresan mikroskopi tabanlı intravital tarama protokolünü açıklıyoruz. Genetik bir ilgi kütüphanesi ile transdüklenmiş veya bireysel ifade yapıları ile transklüzyona yakalanmış kanser hücreleri, bu civciv CAM modeli kullanılarak ilgi fenotipi olarak hızla taranabilir ve ölçülebilir. Transdüksiyon veya transfection protokolleri kitaplık türüne bağlı olarak önemli ölçüde değiştiğinden, bu yordama dahil değildir. Fenotipik olarak ilgili metastatik koloniler, ilginin ifade yapısını tanımlamak için yüksek verim sıralaması için CAM'den uyarılır, genişletilir ve DNA izole edilir. Genellikle, her genetik kütüphane astar dizileri ve önerilen genomik DNA saflaştırma yöntemleri ile donatılmıştır. En iyi yüksek verimli sıralama sonuçları için yerel tesis yönergelerini kullanmanızı öneririz.
Taramadan önce bir kütüphane ve hücre hattı için en uygun enfeksiyon çokluğunun (M.O.I.) belirlenmesi önerilir. İdeal olarak her hücre (ve dolayısıyla gelecekteki metastatik koloni) sadece bir gen ekspresyon yapısı içermelidir, ancak deneyimlerimize göre her zaman ulaşılabilir değildir. Kütüphane üreticisinin protokolünü takip etmenizi ve mümkün olduğunca 1'e yakın bir başarı elde etmek için çok çeşitli M.O.I.'ı (0.01-5) test etmenizi öneririz. Her metastatik koloni içinde birden çok kitaplık ifade yapılarının varlığı koloni fenotip analizini önemli ölçüde zorlaştırabilir. Ayrıca, deneylerinizde kütüphane üreticisinin sağladığı negatif kontrolü kullanmanızı öneririz (yani, floresan etiketli shRNA ifade vektörü).
Tarama protokolümüz invaziv olmayan floresan kolonilerin seçimine dayanmaktadır; deneylerde kullanılan tüm hücre hatlarının benzer floresan yoğunluğuna sahip olduğundan emin olmak önemlidir. Hücreler (ve metastatik koloniler) arasındaki düzensiz floresan yoğunluğu, istilacılık yerine hücre veya koloni parlaklığı nedeniyle önyargılı bir koloni seçimine neden olabilir.
Mevcut yöntemlerle karşılaştırıldığında, protokolümüz gelişmiş görüntüleme ekipmanına ihtiyaç duymadan intravital ekran döngüsünü tamamlamak için hız, düşük maliyet ve yetenek gibi çeşitli benzersiz avantajlar sağlar12,13,14. Ek olarak, tüm tarama döngüsü hücre enjeksiyonundan sıralama aşamasına kadar 3 ila 6 hafta ile tamamlanabilir. Kanser hücre enjeksiyonu veya metastatik kolon izolasyonu için yüksek çözünürlüklü mikroskop gerekmez, çünkü bu adımlar çoğu araştırmacının kullanabileceği temel floresan stereo mikroskop kullanılarak gerçekleştirilebilir. Son olarak, kabuksuz embriyo kültleme tamamen kendi kendine devam ettiği için karmaşık araştırma hayvan barınmasına veya beslenme programlarına gerek yoktur. Çoğu araştırma kurumu tavuk embriyolarını canlı hayvan olarak kabul etmez ve bu da bu modelle ilişkili maliyet ve belge yükünü önemli ölçüde azaltır.
Bununla birlikte, kabuksuz embriyo modeli ile ilişkili bazı sınırlamalar vardır. İlk olarak, tüm kanser hücresi çizgileri bu modelde verimli bir şekilde çalışmaz. Laboratuvarımızda rutin olarak HT1080 (insan fibrosarkomu), HEp3 (baş ve boyun) ve fare b16 melanom ve 4T1 meme kanseri hücre hatları gibi tavuk CAM vaskülatına enjekte edildiğinde metastatik koloniler oluşturan çeşitli kanser hücre hatları kullanıyoruz. Meme (MDA468), beyin (U87 ve U118) veya yumurtalık (A2780'ler) gibi farklı kanser türlerine sahip diğer hücre hatları, CAM'a enjekte edildiğinde kolayca metastatik koloniler oluşturur ve bu nedenle bu tarama protokolünde de kullanılabilir12,14,15. Ancak, deneyimlerimize göre LnCaP ve PC3 gibi yaygın olarak kullanılan kanser hücresi hatları bu modelde (yayınlanmamış gözlemler) iyi performans göstermemektedir. Diğer bir sınırlama, kanser hücresi kan damarı temaslarının görselleştirilmesi gibi yüksek çözünürlüklü görüntüleme için 100 ila 200 μm görüntüleme aralığına sahip bir konfokal mikroskop gerekli olmasıdır, bu ekipman birçok araştırmacı için mevcut olmayabilir.
Bu protokol, kanser metastaz baskılayıcılarının ve sürücülerinin keşfi için kullanılabilecek hızlı bir intravital tarama platformunu tanımlamaktadır. Bu modelin sağlamlığının ve kullanım kolaylığının onu birçok araştırmacı için önemli bir tarama modeli haline getireceğine inanıyoruz.
Açıklamalar
Açıklayacak bir şey yok.
Teşekkürler
Bu çalışma Kanada Kanser Derneği Araştırma Enstitüsü Grant #702849 tarafından JDL ve KS'ye desteklenmiştir. Dr. Lewis, Alberta Kanser Vakfı tarafından desteklenen Prostat Kanseri Araştırmalarında Frank ve Carla Sojonky Kürsüsü'ne sahiptir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL disposable syringes | BD | BD309659 | |
| 15 mL conical centrifuge tubes. | Corning | CLS430791-500EA | |
| 18 gauge x 1 1/2 BD precision needle | BD | BD305196 | we use 1.2mm x 40mm, it is possible to use shorter needles if preferred |
| 2.5% Trypsin solution | many sources are available | ||
| 4T1 mouse breast cancer | ATCC | CRL-2539 | |
| B16F10 mouse melanoma cell line | ATCC | CRL-6475 | |
| Benchtop centrifuge. | many sources are available | Any TC compatible centrifuge that can be used to spin down the cells is suitable | |
| Circular coverslips, 22 mm. | Fisher Scientific | 12-545-101 | |
| Collagenase | Sigma | C0130-100MG | |
| Confocal microscope | We use Nikon A1r | ||
| cotton swabs | many sources are available | must be sterilized before use | |
| Culture media appropriate for the cell lines used | many sources are available | We grow HT1080, HEp3 and b16 cell lines in DMEM, 10% FBS media | |
| Egg incubator | many sources are available | An exact model that is necessary depends on the scale of the screen. Available sources are MGF Company Inc., Savannah, GA, or Lyon Electric Company Inc., Chula Vista, CA | |
| eppendor tubes , 1.5ml | Sigma | T4816-250EA | |
| Fertilized White Leghorn eggs | any local supplyer | ||
| fine forceps | many sources are available | must be sterilized begfore use | |
| Hemocytometer | Millipore-Sigma | MDH-4N1-50PK | |
| HT1080 human fibrosarcoma cell line | ATCC | CCL-121 | |
| Image analysis software | We use Nikon Elements | ||
| Lectin Lens Culinary Agglutinin (LCA) conjugated with Fluorescein or Rhodamine | Vector Laboratories | RL-1042, FL-1041 | Dilute stock (5mg/ml) 50-100x depending on the microscope sensetivity. Must be a different color from the color of cell line used for screening |
| MDA-MB-468 human breast cancer | ATCC | HTB-132 | |
| PBS (1x) | many sources are available | ||
| Plastic weighting dishes | Simport | CA11006-614 | dimensions are 78x78x25mm; many other sources are available |
| small surgical scissors | many sources are available | must be sterilized before use | |
| Sodium borosilicate glass capillary tubes, outer diameter 1.0 mm, inner diameter 0.58 mm, 10 cm length | Sutter Instrument | BF100-58-10 | |
| Square petri dishes (used as lids for the weighting dishes). | VWR | CA25378-115 | dimensions are 100x100x15mm; many other sources are available |
| Stereo fluorescent microscope | We use Zeiss Lumar v12 | ||
| Tygon R-3603 laboratory tubing | Cole-Parmer | AAC00001 | 1/32 in inner diameter, 3/32 in. outer diameter, 1/32 in. wall thickness |
| U-118 MG human glioblastoma | ATCC | HTB-15 | |
| U-87 MG human glioblastoma | ATCC | HTB-14 | |
| Vertical pipette puller | many sources are available | we use David Kopf Instruments, Tujunga, CA; Model 720 |
Referanslar
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Van't Veer, L. J., et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature. 415 (6871), 530-536 (2002).
- Eccles, S. A., Welch, D. R. Metastasis: recent discoveries and novel treatment strategies. Lancet. 369 (9574), 1742-1757 (2007).
- Weber, G. F. Molecular mechanisms of metastasis. Cancer Letters. 270 (2), 181-190 (2008).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nature Reviews Cancer. 2 (8), 563-572 (2002).
- Pantel, K., Brakenhoff, R. H. Dissecting the metastatic cascade. Nature Reviews Cancer. 4 (6), 448-456 (2004).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Oudin, M. J., et al. Tumor cell-driven extracellular matrix remodeling drives haptotaxis during metastatic progression. Cancer Discovery. 6 (5), 516-531 (2016).
- Leong, H. S., et al. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature Protocols. 5 (8), 1406-1417 (2010).
- Kain, K. H., et al. The chick embryo as an expanding experimental model for cancer and cardiovascular research. Developmental Dynamics : An official Publication of the American Association of Anatomists. 243 (2), 216-228 (2014).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer Cell. 13 (3), 221-234 (2008).
- Palmer, T. D., Lewis, J., Zijlstra, A. Quantitative analysis of cancer metastasis using an avian embryo model. Journal of visualized experiments : JoVE. (51), e2815 (2011).
- Stoletov, K., et al. Quantitative in vivo whole genome motility screen reveals novel therapeutic targets to block cancer metastasis. Nature Communications. 9 (1), 2343 (2018).
- Leong, H. S., et al. Invadopodia are required for cancer cell extravasation and are a therapeutic target for metastasis. Cell Reports. 8 (5), 1558-1570 (2014).
- Willetts, L., Bond, D., Stoletov, K., Lewis, J. D., Ursini-Siegel, J., Beauchemin, N. . The Tumor Microenvironment: Methods and Protocols. , 27-37 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır