Method Article
Descubrimiento de reguladores metastásicos utilizando un modelo de membrana corioalantoica intravital de pollitos rápido y cuantitativo
En este artículo
Resumen
Este es un método eficaz para detectar supresores o impulsores de metástasis del cáncer. Las células, transducidas con una biblioteca de expresión, se inyectan en la vasculatura de la membrana corioalantoica del pollo para formar colonias metastásicas. Las colonias que han disminuido o aumentado la invasividad se extirpan, se expanden, se reinyectan para confirmar su fenotipo y, finalmente, se analizan mediante secuenciación de alto rendimiento.
Resumen
Los avances recientes en la investigación del cáncer han ilustrado la naturaleza altamente compleja de la metástasis del cáncer. Se ha encontrado que múltiples genes o redes de genes están involucrados en la regulación diferencial de los genes en cascada metastásicos del cáncer y los productos genéticos que dependen del tipo de cáncer, el tejido y las características individuales del paciente. Estos representan objetivos potencialmente importantes para la terapéutica genética y los enfoques de medicina personalizada. El desarrollo de plataformas de detección rápida es esencial para la identificación de estas dianas genéticas.
La membrana corioalantoica (CAM) del pollito es una membrana altamente vascularizada y rica en colágeno ubicada debajo de la cáscara del huevo que permite el intercambio de gases en el embrión en desarrollo. Debido a la ubicación y vascularización del CAM, lo desarrollamos como un modelo de metástasis de cáncer humano intravital que permite un xenoinjerto robusto de células cancerosas humanas e imágenes en tiempo real de las interacciones de las células cancerosas con la matriz y la vasculatura ricas en colágeno.
Utilizando este modelo, se diseñó una plataforma de cribado cuantitativo para la identificación de nuevos impulsores o supresores de la metástasis del cáncer. Transducimos un grupo de células cancerosas HEp3 de cabeza y cuello con una biblioteca completa de genes shRNA del genoma humano, luego inyectamos las células, a baja densidad, en la vasculatura CAM. Las células proliferaron y formaron colonias de células tumorales únicas. Las colonias individuales que no pudieron invadir el tejido CAM fueron visibles como un fenotipo de colonia compacta y extirpadas para la identificación del SHRNA transducido presente en las células. Las imágenes de colonias individuales fueron evaluadas por su invasividad. Se realizaron múltiples rondas de selecciones para disminuir la tasa de falsos positivos. Los clones de células cancerosas individuales y aisladas o los clones recién diseñados que expresan genes de interés se sometieron a un ensayo de formación de tumores primarios o a un análisis de cooptación de la vasculatura de células cancerosas. En resumen presentamos una plataforma de cribado rápido que permite la identificación de dianas antitastásicas y el análisis intravital de una cascada dinámica y compleja de eventos.
Introducción
La metástasis es la principal causa de muerte de pacientes con cáncer1,2,3. Las células cancerosas metastásicas utilizan distintas vías de señalización, dependiendo del tipo de cáncer, a lo largo de los cinco pasos de la cascada metastásica: invasión local, intravasación, supervivencia en la circulación, extravasación y expansión de colonias en sitios metastásicos distantes. La comprensión actual de este proceso metastásico sugiere que hay dos pasos de cuello de botella, uno es la invasión direccional de la célula cancerosa desde el tumor primario, y el segundo es el establecimiento de la lesión metastásica del sitio distante4,5,6. Ambos pasos requieren que las células cancerosas interactúen activamente con el colágeno y la vasculatura en los sitios de invasión inicial o formación de lesiones metastásicas a distancia. Por lo tanto, las células cancerosas metastásicas deben ser capaces de adherirse a las células, remodelar las fibras de colágeno e invadir direccionalmente a lo largo de las paredes vasculares7. Los modelos de detección que pueden identificar rápidamente objetivos terapéuticos antimetastásicos para impedir que las células cancerosas completen estos pasos es de la mayor importancia. Los modelos de detección in vitro existentes no imitan completamente el complejo entorno de tejidos vivos. Los modelos de ratón son costosos y requieren mucho tiempo. Por lo tanto, existe una necesidad urgente de plataformas de detección intravital que proporcionen entornos complejos de tejidos vivos y una rápida identificación de objetivos.
En la última década, el embrión de pollo se ha establecido como un modelo robusto y rentable de metástasis de cáncer humano8,9,10,11,12. El tejido de la membrana corioalantoica (CAM) del pollito es delgado y translúcido, lo que lo hace ideal para la obtención de imágenes microscópicas intravitales de los comportamientos celulares y de colonias en tumores primarios y/o sitios metastásicos12. El crecimiento del tumor primario a partir de múltiples líneas celulares de cáncer humano puede iniciarse y hacer metástasis en un lapso de solo varios días después de la microinyección en el tejido CAM. Las células cancerosas se pueden administrar en el tejido CAM de varias maneras, incluyendo por vía intravenosa, intra-CAM o como plantas de colágeno, esta flexibilidad permite al investigador centrarse en etapas específicas de la progresión del cáncer, por ejemplo, formación de lesiones metastásicas, invasión del tumor primario o angiogénesis.
Aquí describimos una plataforma de detección cuantitativa que se puede utilizar para medir la capacidad de las células cancerosas para establecer lesiones metastásicas invasivas. Las células cancerosas que han sido transducidas con una biblioteca de expresión se inyectan por vía intravenosa en la vasculatura CAM a baja densidad. Las colonias metastásicas se forman durante 4-5 días, luego se evalúa la capacidad de invasión y la interacción vasculatura de las colonias resultantes. Las colonias individuales que no logran invadir son extirpadas, propagadas y su fenotipo se confirma en el CAM mediante reinyección y cuantificación de la compacidad de la colonia y los contactos entre células cancerosas y vasos sanguíneos. Los constructos de la biblioteca de expresiones responsables del fenotipo mutante de colonia metastásica única se identifican a partir del ADN genómico de colonias aisladas a través de secuenciación de alto rendimiento. La misma plataforma se puede utilizar además para validar el vínculo causal entre un gen y el fenotipo observado o para realizar estudios mecanicistas en profundidad sobre el fenotipo observado.
Protocolo
Todos los experimentos se realizaron de acuerdo con las regulaciones y directrices del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Alberta. Los embriones aviares no son considerados animales vivos por muchos institutos de investigación y no se requieren protocolos animales. Sin embargo, es una opinión aceptada que los embriones aviares pueden sentir dolor y, por lo tanto, deben ser tratados de la manera más humana posible. Se debe contactar a la autoridad local de investigación con animales antes de comenzar cualquier trabajo de investigación para garantizar que se sigan las regulaciones adecuadas.
1. Cultivo de huevo sin cáscara
- Adquiera huevos de gallina fertilizados del proveedor local. Este experimento utiliza la raza de pollo White Leghorn; sin embargo, también se pueden usar otras razas.
NOTA: Se recomienda adquirir un 10% más de óvulos de los necesarios en caso de que algunos de los embriones se dañen durante el agrietamiento y no se puedan utilizar en este protocolo. - Transfiera el número requerido de huevos a una incubadora de balanceo humidificado al 60%. El resto de los huevos se pueden almacenar hasta dos semanas a 12 °C sin pérdida de viabilidad.
- Incubar los huevos en la incubadora de balancín humidificado durante cuatro días.
NOTA: El día 1 es cuando los huevos se transfieren a la incubadora de balanceo. - Prepare los platos de pesaje y las tapas de plástico para el cultivo de huevos sin cáscara. Corte una de las esquinas de cada uno de los platos de pesaje para permitir un acceso eficiente del aire al embrión(Figura 1A).
- Coloque los platos de pesaje preparados en filas en la campana de flujo. (Figura 1B).
- En un plato de pesaje separado, prepare etanol al 70% para el enjuague del huevo.
- Sumerja brevemente el huevo en etanol al 70%, luego use la herramienta rotativa eléctrica para hacer cuidadosamente cuatro cortes de 2-3 mm paralelos al diámetro latitudinal más grande del huevo(Figura 1C).
- Transfiera el huevo cortado a un plato de pesaje y presione suavemente el huevo contra el fondo del plato hasta que se forme una grieta en la cáscara del huevo (Figura 1D).
- Separe las mitades de la cáscara del huevo dejando que el embrión se deslice en el plato de pesaje. Deseche la cáscara de huevo y cubra el plato de pesaje con una tapa.
- Transferir los embriones a una incubadora humidificada sin balanceo(Figura 1E).
NOTA: Los platos de pesaje que contienen los embriones se colocan en recipientes de plástico separados (12 embriones / recipiente). Esto aumenta la viabilidad embrionaria y permite la organización embrionaria específica del experimento. - Incubar embriones durante 6 días más (hasta los 10 días de edad). Verifique si hay embriones muertos o contaminados diariamente y retírelos de la incubadora.
NOTA: Los embriones pueden estar contaminados por esporas de moho en el aire. La contaminación por moho se manifiesta inicialmente como manchas blancas en la superficie CAM del embrión. Retire los embriones contaminados inmediatamente y limpie la incubadora con etanol al 70% semanalmente para evitar la contaminación. En nuestra experiencia, los niveles de contaminación son muy bajos ~ 1-3%. - Use estos embriones para la inyección de células cancerosas en la mañana del día 10.
2. Preparación de las células cancerosas para inyección
NOTA: La selección de colonias metastásicas se basa en un fenotipo establecido por células cancerosas fluorescentes, derivado de una biblioteca de expresión o vector etiquetado con proteína fluorescente como la proteína fluorescente verde o roja (ver todo el flujo de pantalla en la Figura 2A). No se recomienda utilizar células transfectadas transitoriamente con proteínas fluorescentes o etiquetadas con colorantes fluorescentes permeables a las células debido al rápido desvanecimiento de la señal causado por la proliferación de células cancerosas y la tinción desigual.
- Culta células cancerosas al 60-70% de confluencia en el momento de la inyección. El uso de células cancerosas a niveles más altos de confluencia disminuirá su viabilidad, lo que resultará en una baja eficiencia de la formación de colonias metastásicas. Asegúrese de que las células cancerosas utilizadas estén libres de micoplasma, ya que la contaminación por micoplasma puede conducir a una disminución de la viabilidad del embrión de pollo.
- Enjuague las células dos veces con 1x PBS pH 7.4. Retire el PBS restante, luego agregue tripsina-EDTA al 0,5% e incube a 37 ° C durante 2-5 minutos hasta que todas las células se levanten de la superficie de la placa de cultivo.
- Transfiera la suspensión celular a 15 ml de tubo cónico y células centrífugas a temperatura ambiente a 200 x g durante 5 min.
- Resuspend las células en 10 ml de PBS para centrifugar las células nuevamente como en el paso 2.3, para eliminar la tripsina y otros componentes de los medios de cultivo, como los antibióticos.
NOTA: La presencia de tripsina o componentes de cultivo celular como antibióticos en la suspensión de células cancerosas puede resultar en una disminución de la viabilidad del embrión de pollo. - Aspire cuidadosamente las células sobrenadantes y resuspend con 1 ml de PBS helado.
- Cuente el número de células utilizando un hemocitómetro o cualquier otro equipo de conteo de células disponible.
NOTA: Este protocolo de detección requiere que cada colonia metastásica sea iniciada por una sola célula. Al contar las células, asegúrese de que las células estén completamente tripsinizadas y existan como una suspensión de una sola célula (no hay grupos celulares presentes). - Para la inyección intravenosa (IV) concentra las células a 0,5 x10 6 a 1,0 x 106 células/ml. Use 1x PBS helado para diluir y/o resuspend concentrados de células. Espere que se necesite aproximadamente 1 ml de suspensión de células por cada diez embriones.
NOTA: La concentración necesaria de suspensión celular en suspensión está determinada principalmente por el nivel de experiencia del experimentador. Consulte la siguiente sección para obtener más detalles.
3. Inyección intravenosa de células cancerosas para la formación de colonias metastásicas
NOTA: Siguiendo este protocolo se pueden inyectar hasta un centenar de embriones en un día. Por lo general, se necesita más tiempo para aislar las colonias metastásicas (Paso 5) que para inyectar las células cancerosas y, por lo tanto, se recomienda realizar un experimento inicial para estimar el tiempo necesario para completar todos los pasos. El uso de etiquetas fluorescentes diferenciales de células cancerosas ayuda a reducir el número de animales y el tiempo requerido para cada experimento. Por ejemplo, las células de control se pueden etiquetar con RFP (proteína fluorescente roja), mientras que las células tumorales mutantes se pueden etiquetar alternativamente con GFP (proteína fluorescente verde). En este caso, cada experimento tiene un control incorporado que corrige la variabilidad interembrionaria.
- Ensamble el aparato de inyección como se muestra en la Figura 2B. Primero monte una aguja en la jeringa y luego extienda la aguja de la jeringa con un tubo de 3-5 cm de largo.
- Rompa la punta de la aguja de borosilicato usando las fórceps finas (~ 20-60 μL de ancho).
- Cargue la jeringa con la suspensión de células cancerosas (50-200 μL) e inserte la aguja de borosilicato en el tubo (Figura 2B).
- Inspeccione la aguja de borosilicato en busca de obstrucciones celulares y burbujas de aire. Es fundamental inyectar células como una suspensión de una sola célula para garantizar que cada colonia metastásica sea iniciada por una sola célula.
NOTA: Las células cancerosas tienden a agregarse en PBS dentro de 1-2 h después de la tripsinización y, por lo tanto, deben prepararse inmediatamente antes de la inyección. Si es necesario, las células se pueden resuspendiendo periódicamente usando la jeringa de 1 ml utilizada para las inyecciones (sin la aguja de borosilicato). - Si se observa obstrucción celular dentro del capilar, retire el capilar, vuelva a suspender las células y reemplácelo con un nuevo capilar. Use el émbolo para expulsar cualquier burbuja. Si no se observa obstrucción celular o burbujas, continúe con el siguiente paso.
- Retire la tapa de la cubierta y transfiera el embrión debajo del estereoscopio. Identifique la vena apropiada que se inyectaré en la superficie de CAM. Las venas y arterias forman la intrincada red dentro del tejido CAM(Figura 2C). Las venas se distinguen por el color rojo más brillante porque transportan sangre rica en oxígeno al embrión.
NOTA: Para la manipulación general de embriones, la inyección de células cancerosas y la escisión metastásica de colonias, use un estereomitroscopio fluorescente equipado con objetivos 0.8x y 1.5x y oculares 10x para la visualización. El microscopio menos avanzado también se puede utilizar con éxito para estos procedimientos, dependiendo del nivel de experiencia de los usuarios. Los lectores pueden ponerse en contacto con los autores para obtener recomendaciones más detalladas. - Encuentre la vena ideal para inyectar células que normalmente es solo un poco más ancha (10-20%) que el diámetro de la punta de la aguja de borosilicato y se encuentra a medio camino entre el embrión y la pared del plato de pesaje. En general, es más fácil de inyectar en el punto inmediatamente adyacente a la bifurcación de la vena.
NOTA: La inyección en una vena más grande puede parecer más fácil, pero conducirá a un sangrado excesivo y una disminución de la supervivencia del embrión. - Presione la punta de la aguja contra la pared de los vasos sanguíneos y aplique una presión suave en la misma dirección que el flujo sanguíneo. Si es necesario, use un hisopo de algodón (sostenido en la otra mano) para ayudar a anclar o estabilizar el recipiente que se está inyectando.
- Presione suavemente el émbolo de la jeringa. Uno puede visualizar una inyección exitosa observando una "limpieza" del vaso sanguíneo cuando la suspensión de células cancerosas ingresa al torrente sanguíneo.
- Continúe presionando el émbolo de la jeringa durante 2-10 s hasta que se inyecte el volumen de suspensión deseado en el torrente sanguíneo de la vena. En conjunto, la inyección de un solo embrión puede requerir de 1 a 10 minutos, dependiendo del nivel de experiencia del usuario. Si aparece sangrado excesivo o acumulación de líquido claro en el lugar de la inyección, deseche el embrión.
NOTA: Es fácil "sobreinyectar" un embrión. La consideración general que debe tenerse en cuenta es que las colonias metastásicas no deben tocarse entre sí después de un período de crecimiento de 4-5 días. Idealmente, ~ 5-10% de los capilares terminales de la vena CAM deben tener células inmovilizadas en ellos después de una inyección exitosa(Figura 2D,E). Como se mencionó en el paso 2, se puede utilizar un rango de concentración celular (0.5 x 106 - 1.0 x 106 celdas / ml). Las concentraciones más bajas requerirán un tiempo de inyección más largo, pero disminuirán la obstrucción de la aguja. Las concentraciones más altas requerirán tiempos de inyección más cortos, pero aumentarán la obstrucción de la aguja. Se recomienda probar varias concentraciones para encontrar la que sea más cómoda para un operador. Generalmente, se prefiere una concentración más alta (1.0 x10 6 células/ml) para disminuir el tiempo de inyección. - Retire la aguja de la CAM y aplique suavemente el sitio de inyección con un hisopo de algodón para eliminar la sangre o el exceso de células cancerosas.
- Cubra el embrión en el plato de pesaje con una tapa y devuelva el embrión de pollo inyectado a la incubadora.
- Repita el procedimiento con el siguiente embrión hasta que se inyecten todos los embriones.
4. Mantenimiento embrionario durante el crecimiento metastásico de la colonia
- Inspeccionar visualmente los embriones. Si hay alguno que esté muerto y / o contaminado con bacterias o moho, retírelos de la incubadora, luego deséchelos en autoclave y deséchelos de acuerdo con los procedimientos de eliminación de laboratorio.
NOTA: Se recomienda que los embriones sean inspeccionados cada dos días (días 1, 3, 5 después de la inyección de células cancerosas) para el crecimiento metastásico de colonias. Evite mover los embriones inyectados innecesariamente, ya que puede causar daño embrionario y / o la muerte. - Si las células muestran crecimiento excesivo (colonias metastásicas se superponen entre sí) o distribución desigual dentro del tejido CAM (colonias metastásicas ubicadas en una pequeña subárea de la superficie CAM) retire ese embrión del experimento. Eutanasiar los embriones descartados mediante congelación a -20 °C (u otro método aprobado) inmediatamente después de la retirada del experimento. El número de células metastásicas viables dentro del tejido CAM disminuirá inicialmente (días 1-2) y luego aumentará (días 2-5).
NOTA: Algunos embriones pueden "rechazar" las células cancerosas, es decir, todas las células cancerosas desaparecerán del tejido CAM. Estos embriones deben ser retirados del experimento. Normalmente, las colonias de células cancerosas se pueden ver a través de la tapa transparente debajo del microscopio estéreo fluorescente sin abrir la placa de pesaje. - Asegúrese de que las colonias metastásicas parezcan de forma uniforme (primeros 1-3 días después de la inyección). Identifique colonias metastásicas invasivas o no invasivas en los días 4-5 después de la inyección (ver sección 5 para más detalles).
5. Aislamiento de colonias metastásicas
- En el día 5 después de la inyección, retire los embriones de la incubadora e inspeccione las CAL embrionarias para la distribución metastásica de colonias. Identificar los embriones con una distribución uniforme de colonias en los que están presentes colonias compactas (o excesivamente invasivas).
NOTA: El proceso de cultivo de embriones de pollo no es estéril, por lo tanto, todos los pasos de detección deben realizarse en condiciones altamente limpias para evitar futuras contaminacións por cultivo de tejidos. La contaminación es bastante rara y se puede evitar fácilmente usando guantes y una máscara y usando solo herramientas estériles durante la inyección celular y los procedimientos de aislamiento de colonias. Se recomienda inspeccionar los embriones uno por uno para disminuir su exposición a la temperatura ambiente de laboratorio y evitar la contaminación. - Localice la colonia metastásica de interés. Una colonia compacta se puede describir como una con la mayoría de las células cancerosas ubicadas dentro de un área limitada en el tejido CAM (las células aparecen "agrupadas"). Una colonia invasora se puede describir como una colonia donde las células cancerosas se "dispersan" en el tejido CAM(Figura 3A,B).
NOTA: La "compacidad" de la colonia metastásica puede explicarse por la inhibición de la invasión de células cancerosas, la inhibición de la proliferación de células cancerosas o ambas. Se debe prestar atención a todos los escenarios y las colonias de contacto deben aislarse(Figura 3A,B). Se puede utilizar un estereomitroscopio fluorescente simple para discriminar entre fenotipos de colonias metastásicas compactas e invasivas. - Bajo el microscopio de disección tire suavemente del tejido CAM que contiene la colonia metastásica de interés hacia arriba utilizando fórceps finos (Figura 3C).
- Cortar el tejido CAM que contiene la colonia metastásica con tijeras quirúrgicas.
- Transfiera el tejido CAM que contiene la colonia metastásica a un tubo vacío y estéril de 1,5 ml (sobre hielo) y cierre la tapa del tubo.
NOTA: Las colonias aisladas se pueden mantener en hielo hasta 3 h sin pérdida de viabilidad. - Repita el procedimiento de escisión hasta que todas las colonias de interés se recojan en tubos separados. Para evitar el sufrimiento de los animales, no extirme más de 2-3 colonias de un embrión. Eutanasiar embriones mediante congelación a -20 °C (u otro método aprobado) inmediatamente después de la escisión de la colonia.
- Picar suavemente el tejido CAM en un tubo de microcentrífuga con una aguja estéril calibre 18. Use una aguja separada para cada colonia.
- Añadir 100 μL de solución de 1x colagenasa e incubar durante 30 min a 37 °C.
- Gire hacia abajo las células y el tejido CAM a 300 x g durante 5 minutos a temperatura ambiente.
- Aspirar la solución de colagenasa y resuspend las células en medios completos utilizados para la línea celular de interés.
NOTA: Normalmente, el tejido CAM no se disocia completamente después del tratamiento con colagenasa y las células cancerosas primero proliferarán dentro de las piezas de tejido CAM y solo luego migrarán al plato de cultivo de tejidos. - Girar las células y el tejido CAM de nuevo a 300 x g durante 5 min a temperatura ambiente.
- Resuspend células y piezas de tejido CAM en 1 ml de medio completo más factor de selección (si lo hay), luego transfiera a un solo plato de cultivo de tejido de 12 pozos.
NOTA: Los fibroblastos CAM de pollo pueden persistir en el cultivo de tejidos para múltiples pasajes que inhiben la expansión clonal. La capacidad de expandir las colonias metastásicas en presencia de factor de selección (es decir, si un vector que se utilizó para hacer que las células cancerosas sean fluorescentes también codifica un gen de resistencia a los antibióticos de mamíferos) puede acelerar en gran medida la expansión clonal. Se debe realizar un experimento de curva de muerte antes de la detección para garantizar que se use la concentración adecuada de antibiótico. - Durante las próximas 1-3 semanas, controle las células cancerosas diariamente para ver si hay crecimiento y contaminación.
- Cuando las células alcanzan el 70-80% de la confluencia, las células transfieren las células a una placa de cultivo de mayor volumen.
NOTA: Se recomienda expandir las células hasta que se puedan congelar al menos dos viales criogénicos de cada clon. Mantener grandes cantidades de cultivo de tejidos puede ser laborioso e innecesario. - Proceda a la secuenciación o a la siguiente ronda de selección tan pronto como se alcancen suficientes números de células cancerosas. En general, 1 x 106 de células cancerosas son suficientes para las técnicas modernas de secuenciación de alto rendimiento.
- Proceder a la reinyección del clon y la obtención de imágenes y cuantificación de la compacidad de la colonia o el contacto entre células cancerosas y vasos sanguíneos(Figura 2A). Alternativamente, proceda a la secuenciación de alto rendimiento o repita la selección de colonias.
NOTA: Para disminuir el número de falsos positivos se recomienda al menos dos rondas de selección. Se han empleado con éxito dos enfoques. 1) Expandir cada clon y reinyectar individualmente para confirmar el fenotipo de colonia. 2) Mezcle todos los clones expandidos en una proporción de 1: 1 cada uno, vuelva a inyectar como una mezcla y repita el ciclo de selección.
6. Inyección de lectinas marcadas fluorescentemente en la vasculatura CAM.
- Identifique la vena que se va a inyectar. Es más fácil usar el mismo sitio de inyección para la lectina que se usó para la inyección de células tumorales.
- Diluya la solución madre de lectina fluorescente (5 mg/ml) 50-100x con 1x PBS y cárgándola en el mismo aparato de inyección que se usa para la inyección de células cancerosas.
NOTA: La cantidad de lectina que debe inyectarse (normalmente 20-100 μL) para la visualización de los vasos sanguíneos depende de la sensibilidad del microscopio y debe determinarse experimentalmente antes de la detección. - Inyecte lectina utilizando la misma técnica que para la inyección de células tumorales (ver pasos 3.6.-3.10.).
- Después de la inyección de lectina, coloque el embrión en la incubadora para recuperarse durante 5 minutos. Inyecte solo un embrión a la vez e inmediatamente antes de obtener imágenes del embrión.
NOTA. Los embriones que tienen 12 días o más generalmente se recuperan bien de las inyecciones de lectina y pueden ser reinyectadas con lectina nuevamente al día siguiente para imágenes secuenciales. Los embriones más jóvenes son más sensibles y pueden mostrar coagulación sanguínea.
7. Visualización de los contactos entre células cancerosas y vasos sanguíneos
- Ajuste la carcasa del microscopio con temperatura regulada a 37 °C aproximadamente 6 h antes de la toma de imágenes. Esto estabilizará la temperatura del microscopio y ayudará a minimizar la deriva XYZ durante la toma de imágenes.
NOTA. Para este experimento se utilizó una cámara especializada de imágenes de embrionesde pollo9,10,11, 12, 13. Se puede utilizar un microscopio de disección fluorescente simple para todos los pasos, desde la inyección de células cancerosas hasta la selección de clones y la reinyección de clones, y la evaluación de la compacidad de la colonia. Un microscopio confocal que está equipado con una cámara de imágenes es necesario para la obtención de imágenes y la cuantificación de los contactos entre células cancerosas y vasos sanguíneos. No es necesario calentar hasta 1 h y, en general, los embriones sobreviven al menos dos sesiones secuenciales de imágenes sin impacto en su viabilidad. - Asegúrese de que se ha instalado la lente de objetivo necesaria (se recomienda una lente de objetivo de inmersión en agua de 20x o 25x).
- Aplique una capa delgada de grasa al vacío en la parte inferior de la tapa de la cámara de imágenes para crear un sello seguro con la cubierta.
- Coloque suavemente una funda en la tapa y limpie cualquier exceso de grasa al vacío.
- Saque el embrión inyectado con lectina de la incubadora y corte los bordes del plato de pesaje si es necesario.
- Coloque el embrión en la cámara de imagen con el codamento bajado directamente sobre el área del CAM donde se encuentran las colonias metastásicas de interés. Baje lentamente el párpado sobre el embrión hasta que el cubrecudera entre en contacto con el CAM. Apriete los tornillos para asegurar la tapa en su lugar, asegúrese de que la tapa esté nivelada y que la cubierta no esté ejerciendo ninguna presión hacia abajo sobre el CAM.
- Adquirir imágenes de múltiples colonias aleatorias de grupos control y experimentales (10-20) de varios (5-10) embriones.
NOTA. Se recomienda adquirir pilas 3D aleatorias (1-5um Z-steps; 50-100um range; 25x) de cada campo. - Utilice la opción de costura de campo en el software de adquisición del microscopio si está disponible. Dado que las imágenes utilizadas para la cuantificación no serán de calidad de publicación, utilice modos de adquisición rápida, como el escaneo resonante, si está disponible. Utilice un objetivo de 25x y costuras de 3 x 3 con un paso Z de 5-10 μm, un rango total de 100 μm. Imagen de al menos 100 células (~ 20 colonias) por condición.
8. Cuantificación de los contactos de los vasos sanguíneos de las células cancerosas
- Abra el archivo 3D como una pila Z utilizando el software necesario.
NOTA. Se debe utilizar un software especializado para adquirir y analizar imágenes de alta resolución con el fin de cuantificar el contacto entre células cancerosas y vasos sanguíneos. Varios paquetes de software que son capaces de análisis de imágenes 3D están disponibles. Consulte la Tabla de materiales para obtener más detalles. - Si se produjo un movimiento XY significativo durante la adquisición de la imagen, alinee la pila Z utilizando el complemento ImageJ StackReg (http://bigwww.epfl.ch/thevenaz/stackreg).
- Localice la(s) celda(s) de interés.
- Desplácese por la imagen XYZ en la dirección Z e identifique la sección óptica que contiene la longitud máxima del contacto de los vasos sanguíneos de las células cancerosas para la célula de interés (Figura 2E).
- Mida el contacto entre las células cancerosas y los vasos sanguíneos utilizando la "función de medición manual de longitud".
- Introduzca las mediciones en el paquete de software de datos que se utiliza para el análisis estadístico.
NOTA: La capacidad de las células cancerosas para adherirse a los vasos sanguíneos se puede medir como la longitud de los contactos entre células cancerosas y vasos sanguíneos o el porcentaje de células en contacto con la vasculatura para un clon particular de células cancerosas (o ambos). - Continúe con la siguiente celda de interés.
- Analice los datos para la significación estadística comparando clones mutantes y conjuntos de datos de control.
9. Cuantificación de la compacidad de la colonia
- Vuelva a inyecte las células del clon expandido utilizando la misma técnica que en el paso 2.
- Cinco días después de la inyección adquiere imágenes de 10-50 colonias metastásicas aleatorias para cada clon.
NOTA: No se necesita imágenes de alta calidad para la cuantificación de la compacidad de las colonias metastásicas. Las imágenes monocromáticas de microscopio estereoscópico (aumento de 10x) son suficientes. Se debe prestar atención al brillo de la imagen (se deben ver la mayoría de las células dentro de la colonia) y al contraste (diferencia entre una o dos celdas). - Aislar digitalmente la imagen de la colonia (ver Figura 2C,D)y proceder a la cuantificación de la compacidad de la colonia utilizando el módulo de cuantificación de la compacidad de la colonia independiente o la puntuación ciega13.
- Proceda a la siguiente colonia de interés.
- Analice los datos para la significación estadística comparando los conjuntos de datos de clones mutantes y control (es decir, scramble shRNA).
Resultados
La inyección de células cancerosas se considera exitosa si la mayoría de las células que se alojan en los capilares son únicas y se encuentran en una diferencia significativa entre sí (~ 0.05-0.1 cm) para que las colonias no se superpongan después de 5-6 días de período de incubación(Figura 3A). La inyección no tuvo éxito si se puede ver una acumulación de células cancerosas en la mayoría de los capilares, los embriones que muestran esto deben descartarse(Figura 2E). Un número significativo de células cancerosas inyectadas perecen dentro de las 24 h de la inyección, lo que hace que algunos embriones parezcan rechazar todas las células cancerosas. La supervivencia de las células cancerosas variará según el proveedor local de óvulos (es decir, la cantidad de células a inyectar puede variar) y recomendamos encarecidamente que se determinen las condiciones óptimas de inyección (concentración de células cancerosas versus duración de la inyección) antes de continuar con el experimento. Recomendamos la concentración celular en el rango entre 0.5 x 106 a 1.0 x 106 celdas/m. Cuando se alcanza la concentración celular óptima y la duración de la inyección, el día 5 después de la inyección las células transducidas deben producir una amplia variedad de fenotipos de colonias con la mayoría de las colonias que parecen invasivas según lo determinado por las células cancerosas que aparecen dispersas en el tejido CAM (Figura 3A). Se debe prestar atención a las colonias metastásicas que parecen "compactas" y se encuentran lo suficientemente lejos de las colonias vecinas como para que puedan ser extirpadas con fórceps y tijeras en una pieza de tejido CAM(Figura 3C). Un golpe de pantalla positivo aislado (es decir, una colonia compacta) debe mostrar el fenotipo de colonia compacta tras la reinyección(Figura 3B). También se puede observar una disminución en la supervivencia celular (o tasa de proliferación celular dentro de la colonia). Por lo tanto, es posible que se necesiten inyectar números de células más altos para algunos de los golpes positivos de la pantalla para obtener suficientes números de colonias. Para la medición de los contactos entre células cancerosas y vasos sanguíneos se debe prestar atención al brillo de la mancha de la pared vascular (lectina fluorescente; Figura 3D,E) y se debe inyectar la cantidad adecuada de lectina para la señal de pared vascular brillante / de contraste. Cualquier software de análisis de imágenes disponible se puede utilizar durante los pasos de cuantificación después de que se haya realizado la calibración del software del microscopio.

Figura 1: Descripción general del cultivo sin cáscara del embrión de pollo. (A) Plato de pesaje con tapa preparado para el cultivo sin cáscara. La flecha apunta a la esquina cortada. (B) Platos de pesaje dispuestos en filas en la campana de flujo. (C) Cortar una cáscara de huevo con una herramienta rotativa eléctrica. (D) Romper un huevo en un plato de pesaje. (E) Embriones cultivados en la incubadora humidificada. Barras de escala = 1 cm (A-D) o 5 cm (E). Haga clic aquí para ver una versión más grande de esta figura.
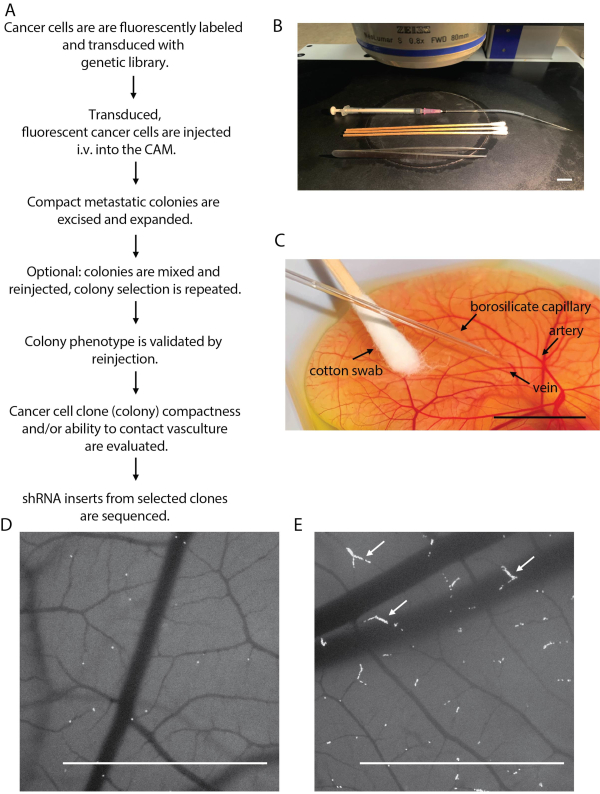
Figura 2: Esquema de la inyección de células cancerosas y el aislamiento metastásico de colonias. (A) Diagrama de flujo que describe los pasos de la plataforma de detección de embriones de pollo. (B) Inyección de células cancerosas configurada en la etapa de microscopio fluorescente estéreo. (C) Inyección de las células cancerosas en la vasculatura CAM. (D) Imagen que muestra la inyección exitosa de células cancerosas (densidad aceptable de células cancerosas), tomada inmediatamente después de la inyección. (E) Imagen que muestra una inyección deficiente de células cancerosas, vista como un embrión sobreinyectado. Tenga en cuenta la acumulación de células cancerosas en los capilares sanguíneos (flechas blancas). Barras de escala = 1 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Resultados representativos para diferentes pasos del protocolo de cribado. (A) Colonias metastásicas formadas por células heterogéneas (células HEp3 de la línea celular de cáncer transducidas por biblioteca), 5 días después de la inyección. La flecha roja muestra una colonia compacta (posible golpe positivo) que debe ser extirpada. (B) Colonias metastásicas formadas por uno de los golpes de pantalla aislados (KIF3B) después de la reinyección, 5 días después de la inyección. Los recuadros muestran imágenes de colonias metastásicas recortadas digitalmente de los cuadrados discontinuos. Esta es una calidad de imagen aceptable para la cuantificación de C.I. Se muestra el valor medio de C.I. para la reinyección por aciertos(KIF3B). (C) Aislamiento de la colonia metastásica de interés del tejido CAM. Secciones ópticas representativas de (D) una colonia de control, y (E) una colonia de sobreexpresión de ARNh KIF3B, ambas mostrando mediciones de contacto entre células cancerosas y vasos sanguíneos. La vasculatura CAM está etiquetada con lectina fluorescente-649. Barras de escala = 1 cm (A-C) o 50 μm (D, E). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí describimos un protocolo de detección intravital basado en microscopía de fluorescencia rápida que se puede utilizar para aplicaciones importantes, como pruebas genéticas o candidatas a fármacos. Las células cancerosas que han sido transducidas con una biblioteca genética de interés o transfectadas con construcciones de expresión individual pueden ser rápidamente examinadas y cuantificadas en cuanto al fenotipo de interés utilizando este modelo CAM de pollitos. Dado que los protocolos de transducción o transfección varían significativamente, dependiendo del tipo de biblioteca, no están incluidos en este procedimiento. Las colonias metastásicas fenotípicamente relevantes se extirpan de la CAM, se expanden y se aíslan el ADN para una secuenciación de alto rendimiento para identificar la construcción de expresión de interés. En general, cada biblioteca genética está equipada con secuencias de cebadores y métodos recomendados de purificación genómica del ADN. Recomendamos utilizar las directrices de las instalaciones locales para obtener los mejores resultados de secuenciación de alto rendimiento.
Se recomienda determinar la multiplicidad óptima de infección (M.O.I.) para una biblioteca y una línea celular antes de la detección. Idealmente, cada célula (y por lo tanto la futura colonia metastásica) debería contener solo una construcción de expresión génica, sin embargo, en nuestra experiencia eso no siempre es alcanzable. Recomendamos seguir el protocolo del fabricante de la biblioteca y probar una amplia gama de M.O.I. (0.01-5) para lograr lo más cerca posible de 1. La presencia de múltiples construcciones de expresión de biblioteca dentro de cada colonia metastásica puede complicar significativamente el análisis del fenotipo de colonia. También recomendamos utilizar el control negativo suministrado por el fabricante de la biblioteca en sus experimentos (es decir, el vector de expresión de shRNA scramble que está marcado fluorescentemente).
Nuestro protocolo de cribado se basa en la selección de colonias fluorescentes no invasivas; es fundamental garantizar que todas las líneas celulares utilizadas en los experimentos tengan una intensidad de fluorescencia similar. La intensidad desigual de la fluorescencia entre las células (y las colonias metastásicas) puede resultar en una selección de colonias sesgada debido al brillo de la célula o colonia en lugar de la invasividad.
En comparación con los métodos existentes, nuestro protocolo proporciona varias ventajas únicas, como la velocidad, el bajo costo y la capacidad de completar el ciclo de pantalla intravital sin necesidad de sofisticados equipos de imágenes12,13,14. Además, todo el ciclo de detección se puede completar dentro de 3 a 6 semanas desde la inyección celular hasta la etapa de secuenciación. No se requiere un microscopio de alta resolución para la inyección de células cancerosas o el aislamiento de colonias metastásicas, ya que estos pasos se pueden realizar utilizando un microscopio estéreo fluorescente básico que está disponible para la mayoría de los investigadores. Finalmente, debido a que el cultivo de embriones sin caparazón es completamente autosostenidos, no hay necesidad de complicados horarios de alojamiento o alimentación de animales de investigación. La mayoría de las instituciones de investigación no consideran que los embriones de pollo sean animales vivos, lo que disminuye significativamente el costo y la carga de documentación asociados con este modelo.
Sin embargo, existen algunas limitaciones asociadas con el modelo de embrión sin caparazón. En primer lugar, no todas las líneas celulares de cáncer funcionan en este modelo de manera eficiente. En nuestro laboratorio utilizamos rutinariamente varias líneas celulares de cáncer, como HT1080 (fibrosarcoma humano), HEp3 (cabeza y cuello) y melanoma b16 de ratón y líneas celulares de cáncer de mama 4T1, que forman colonias metastásicas cuando se inyectan en la vasculatura CAM del pollo. Otras líneas celulares con diferentes tipos de cáncer como el de mama (MDA468), cerebro (U87 y U118) u ovario (A2780s) forman fácilmente colonias metastásicas cuando se inyectan en el CAM y, por lo tanto, también se pueden usar en este protocolo de detección12,14,15. Sin embargo, en nuestra experiencia, las líneas celulares de cáncer de uso común como LnCaP y PC3 no funcionan bien en este modelo (observaciones no publicadas). Otra limitación es que se requiere un microscopio confocal con un rango de imágenes de 100 a 200 μm para imágenes de alta resolución, como la visualización de contactos de vasos sanguíneos de células cancerosas, este equipo puede no estar disponible para muchos investigadores.
En conjunto, este protocolo describe una plataforma de detección intravital rápida que se puede utilizar para el descubrimiento de supresores y conductores de metástasis del cáncer. Creemos firmemente que la robustez y la facilidad de uso de este modelo lo convertirán en un modelo de detección esencial para muchos investigadores.
Divulgaciones
Nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la subvención del Instituto de Investigación de la Sociedad Canadiense del Cáncer #702849 a JDL y KS. El Dr. Lewis ocupa la Cátedra Frank y Carla Sojonky en Investigación del Cáncer de Próstata con el apoyo de la Fundación del Cáncer de Alberta.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL disposable syringes | BD | BD309659 | |
| 15 mL conical centrifuge tubes. | Corning | CLS430791-500EA | |
| 18 gauge x 1 1/2 BD precision needle | BD | BD305196 | we use 1.2mm x 40mm, it is possible to use shorter needles if preferred |
| 2.5% Trypsin solution | many sources are available | ||
| 4T1 mouse breast cancer | ATCC | CRL-2539 | |
| B16F10 mouse melanoma cell line | ATCC | CRL-6475 | |
| Benchtop centrifuge. | many sources are available | Any TC compatible centrifuge that can be used to spin down the cells is suitable | |
| Circular coverslips, 22 mm. | Fisher Scientific | 12-545-101 | |
| Collagenase | Sigma | C0130-100MG | |
| Confocal microscope | We use Nikon A1r | ||
| cotton swabs | many sources are available | must be sterilized before use | |
| Culture media appropriate for the cell lines used | many sources are available | We grow HT1080, HEp3 and b16 cell lines in DMEM, 10% FBS media | |
| Egg incubator | many sources are available | An exact model that is necessary depends on the scale of the screen. Available sources are MGF Company Inc., Savannah, GA, or Lyon Electric Company Inc., Chula Vista, CA | |
| eppendor tubes , 1.5ml | Sigma | T4816-250EA | |
| Fertilized White Leghorn eggs | any local supplyer | ||
| fine forceps | many sources are available | must be sterilized begfore use | |
| Hemocytometer | Millipore-Sigma | MDH-4N1-50PK | |
| HT1080 human fibrosarcoma cell line | ATCC | CCL-121 | |
| Image analysis software | We use Nikon Elements | ||
| Lectin Lens Culinary Agglutinin (LCA) conjugated with Fluorescein or Rhodamine | Vector Laboratories | RL-1042, FL-1041 | Dilute stock (5mg/ml) 50-100x depending on the microscope sensetivity. Must be a different color from the color of cell line used for screening |
| MDA-MB-468 human breast cancer | ATCC | HTB-132 | |
| PBS (1x) | many sources are available | ||
| Plastic weighting dishes | Simport | CA11006-614 | dimensions are 78x78x25mm; many other sources are available |
| small surgical scissors | many sources are available | must be sterilized before use | |
| Sodium borosilicate glass capillary tubes, outer diameter 1.0 mm, inner diameter 0.58 mm, 10 cm length | Sutter Instrument | BF100-58-10 | |
| Square petri dishes (used as lids for the weighting dishes). | VWR | CA25378-115 | dimensions are 100x100x15mm; many other sources are available |
| Stereo fluorescent microscope | We use Zeiss Lumar v12 | ||
| Tygon R-3603 laboratory tubing | Cole-Parmer | AAC00001 | 1/32 in inner diameter, 3/32 in. outer diameter, 1/32 in. wall thickness |
| U-118 MG human glioblastoma | ATCC | HTB-15 | |
| U-87 MG human glioblastoma | ATCC | HTB-14 | |
| Vertical pipette puller | many sources are available | we use David Kopf Instruments, Tujunga, CA; Model 720 |
Referencias
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Van't Veer, L. J., et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature. 415 (6871), 530-536 (2002).
- Eccles, S. A., Welch, D. R. Metastasis: recent discoveries and novel treatment strategies. Lancet. 369 (9574), 1742-1757 (2007).
- Weber, G. F. Molecular mechanisms of metastasis. Cancer Letters. 270 (2), 181-190 (2008).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nature Reviews Cancer. 2 (8), 563-572 (2002).
- Pantel, K., Brakenhoff, R. H. Dissecting the metastatic cascade. Nature Reviews Cancer. 4 (6), 448-456 (2004).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Oudin, M. J., et al. Tumor cell-driven extracellular matrix remodeling drives haptotaxis during metastatic progression. Cancer Discovery. 6 (5), 516-531 (2016).
- Leong, H. S., et al. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature Protocols. 5 (8), 1406-1417 (2010).
- Kain, K. H., et al. The chick embryo as an expanding experimental model for cancer and cardiovascular research. Developmental Dynamics : An official Publication of the American Association of Anatomists. 243 (2), 216-228 (2014).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer Cell. 13 (3), 221-234 (2008).
- Palmer, T. D., Lewis, J., Zijlstra, A. Quantitative analysis of cancer metastasis using an avian embryo model. Journal of visualized experiments : JoVE. (51), e2815 (2011).
- Stoletov, K., et al. Quantitative in vivo whole genome motility screen reveals novel therapeutic targets to block cancer metastasis. Nature Communications. 9 (1), 2343 (2018).
- Leong, H. S., et al. Invadopodia are required for cancer cell extravasation and are a therapeutic target for metastasis. Cell Reports. 8 (5), 1558-1570 (2014).
- Willetts, L., Bond, D., Stoletov, K., Lewis, J. D., Ursini-Siegel, J., Beauchemin, N. . The Tumor Microenvironment: Methods and Protocols. , 27-37 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados