Method Article
신속하고 정량적인 병아리 Chorioallantoic 멤브레인 모델을 사용하여 전이성 레귤레이터의 발견
요약
이것은 암 전이의 억제제 또는 드라이버를 위해 검열하는 효과적인 방법입니다. 발현 라이브러리로 변환된 세포는 전이성 콜로니를 형성하기 위해 닭 초리오알란토아막 혈관에 주입됩니다. 감소 또는 증가 된 침략을 갖는 식민지는 절제, 확장, 자신의 표현형을 확인하기 위해 재주입, 마지막으로, 높은 처리량 시퀀싱을 사용하여 분석.
초록
암 연구에 있는 최근 어드밴스는 암 전이의 매우 복잡한 본질을 보여주었습니다. 다중 유전자 또는 유전자 네트워크는 암 유형, 조직 및 개별 환자 특성에 의존하는 암 전이성 캐스케이드 유전자 및 유전자 제품을 분화 조절하는 데 관여하는 것으로 밝혀졌다. 이들은 유전 치료 및 개인화된 약 접근을 위한 잠재적으로 중요한 표적을 나타냅니다. 급속한 검열 플랫폼의 발달은 이 유전 표적의 확인을 위해 필수적입니다.
병아리 chorioallantoic 막 (CAM)은 발달 배아에서 가스 교환을 허용하는 계란 껍질 아래에 위치한 고도로 혈관, 콜라겐이 풍부한 막입니다. CAM의 위치와 혈관화로 인해, 우리는 콜라겐이 풍부한 매트릭스 및 혈관과 암 세포 상호 작용의 견고한 인간 암 세포 xenografting 및 실시간 이미징을 허용하는 중요한 인간 암 전이 모델로 개발했습니다.
이 모델을 사용하여, 정량적 선별 플랫폼은 새로운 드라이버 또는 암 전이의 억제제의 식별을 위해 설계되었습니다. 우리는 완전한 인간 게놈 shRNA 유전자 라이브러리를 가진 머리와 목 HEp3 암세포의 풀을 변환하고, 그 후, 저밀도에서, CAM 혈관화로 세포를 주입했습니다. 세포는 증식하고 단하나 종양 세포 식민지를 형성했습니다. CAM 조직으로 침입할 수 없었던 개별 식민지는 소형 식민지 표현형으로 보였으며 세포에 존재하는 트랜스포이드 된 shRNA의 식별을 위해 절제되었다. 개별 식민지의 이미지는 그들의 침략에 대 한 평가 되었다. 거짓 긍정의 비율을 줄이기 위해 여러 번의 선택이 수행되었습니다. 관심 있는 유전자를 발현하는 개별, 고립된 암세포 클론 또는 새로 설계된 클론은 1차 종양 형성 분석 또는 암 세포 혈관 학 공동 선택 분석을 받게 되었다. 요약하면 우리는 전이성 방지 대상 식별 및 이벤트의 동적 및 복잡한 계단식 에 대한 인트라비티 분석을 허용하는 신속한 선별 플랫폼을 제시합니다.
서문
전이는 암 환자사망1,2,3의주요 원인입니다. 전이성 암세포는 전이성 캐스케이드의 다섯 단계에 걸쳐 암의 유형에 따라 뚜렷한 신호 경로를 활용합니다: 지역 침략, 인트라바션, 순환의 생존, 사치, 먼 전이성 부위의 식민지 확장. 이러한 전이성 과정의 현재 이해는 2개의 병목 현상 단계가 있다는 것을 건의하고, 하나는 1차 종양으로부터 암세포의 방향 침입이며, 두 번째는 먼 부위 전이성 병변4,5,6의확립이다. 두 단계 모두 암세포가 초기 침입 또는 먼 전이성 병변 형성 부위에서 콜라겐 및 혈관과 적극적으로 상호 작용하도록 요구합니다. 따라서 전이성 암세포는 세포에 부착하고, 콜라겐 섬유를 리모델링하고, 혈관 벽을 따라 방향적으로 침입할 수 있어야 한다7. 암세포가 이러한 단계를 완료하지 못하도록 차단하기 위해 항전정 치료 표적을 신속하게 식별할 수 있는 선별 모델은 가장 중요합니다. 기존 시험관 내 선별 모델은 복잡한 라이브 조직 환경을 완전히 모방하지 않습니다. 마우스 모델은 비용이 많이 들고 시간이 많이 걸립니다. 따라서 복잡한 라이브 조직 환경과 표적의 신속한 식별을 제공하는 인트라베이트 스크리닝 플랫폼에 대한 긴급한 필요성이 있습니다.
지난 10년 이내에 닭배아는 인간암전이8,9,10,11,12의견고하고 비용 효율적인 모델로 확립되었다. 병아리 chorioallantoic 막 (CAM) 조직은 1 차종양 및 / 또는 전이성 부위에서 세포 및 식민지 행동의 중요한 현미경 이미징에 이상적이게 얇고 반투명이다12. 다중 인간 암 세포주로부터의 1 차적인 종양 성장은 CAM 조직으로 마이크로 주입 후에 불과 며칠의 범위 내에서 개시되고 전이될 수 있습니다. 암세포는 여러 가지 방법으로 CAM 조직으로 투여 될 수있다, 정맥을 포함, 내 -CAM 또는 콜라겐 종양으로, 이러한 유연성은 연구원이 암 진행의 특정 단계에 초점을 맞출 수 있습니다, 예를 들어, 전이성 병변 형성, 1 차 종양 또는 혈관 신생에서 침입.
여기서 우리는 침략적인 전이성 병변을 설치하는 암세포의 능력을 측정하는 데 사용될 수 있는 정량적 선별 플랫폼을 기술합니다. 발현 라이브러리로 유도된 암세포는 저밀도에서 CAM 혈관에 정맥내 주입된다. 전이성 식민지는 4-5일 동안 형성되며, 그 후 생성된 식민지의 침략 능력과 혈관 상호작용이 평가된다. 침입에 실패하는 개별 식민지는 절제되고, 전파되고 그들의 표현형은 식민지 소형및 암 세포 혈관 접촉의 재주입 및 정량화에 의해 CAM에서 확인됩니다. 단일 전이성 식민지 돌연변이 표현형을 담당하는 발현 라이브러리 구조는 높은 처리량 시퀀싱을 통해 격리된 식민지 게놈 DNA로부터 식별된다. 동일한 플랫폼은 유전자와 관찰된 표현형 사이의 인과 관계를 검증하거나 관찰된 표현형에 대한 심층적인 기계론적 연구를 수행하기 위해 더 사용될 수 있다.
프로토콜
모든 실험은 앨버타 대학의 기관 동물 관리 및 사용 위원회의 규정 및 지침에 따라 수행되었습니다. 조류 배아는 많은 연구 기관에 의해 살아있는 동물로 간주되지 않으며 동물 프로토콜이 필요하지 않습니다. 그러나 조류 배아가 통증을 느낄 수 있으므로 가능한 한 인도적으로 취급되어야 한다는 것은 수용된 견해입니다. 지역 동물 연구 기관은 적절한 규정을 준수하기 위해 연구 작업을 시작하기 전에 연락해야합니다.
1. 껍질이 없는 달걀 문화
- 현지 제공업체로부터 수정된 닭고기 알을 획득하십시오. 이 실험은 화이트 레그혼 닭 품종을 사용합니다. 그러나 다른 품종도 사용할 수 있습니다.
참고: 일부 배아가 균열 중에 손상되어 이 프로토콜에 사용할 수 없는 경우 필요한 것보다 10% 더 많은 계란을 획득하는 것이 좋습니다. - 필요한 수의 계란을 60% 가습된 흔들 인큐베이터로 옮기. 나머지 계란은 생존가능성을 잃지 않고 12°C에서 최대 2주 동안 보관할 수 있습니다.
- 4 일 동안 가습 흔들 인큐베이터에서 계란을 배양.
참고: 1일은 계란이 흔들리는 인큐베이터로 옮겨지는 때입니다. - 껍질이 없는 달걀 문화를 위해 계량 접시와 플라스틱 뚜껑을 준비합니다. 각 계량 접시의 모서리 중 하나를 잘라 배아에 대한 효율적인 공기 접근을 허용합니다(도1A).
- 유동 후드의 행에 준비 된 계량 요리를 정렬합니다. (그림1B).
- 별도의 계량 접시에 달걀 헹구기 위해 70% 에탄올을 준비합니다.
- 계란을 70% 에탄올에 잠깐 담근 다음 전기 로터리 도구를 사용하여 계란의 가장 큰 latitudinal직경(도 1C)에평행하게 4개의 2-3mm 컷을 신중하게 만듭니다.
- 잘라낸 달걀을 계량 접시에 옮기고 달걀 껍질의 균열이 형성될 때까지 접시 바닥에 달걀을 부드럽게 누릅니다(그림1D).
- 달걀 껍질을 반쪽으로 당겨 배아가 계량 접시에 미끄러지게합니다. 달걀 껍질을 버리고 뚜껑으로 계량 접시를 덮습니다.
- 배아를 가습된 비흔들 인큐베이터(도1E)로이송한다.
참고: 배아가 들어 있는 계량 접시는 별도의 플라스틱 용기(12개의 배아/용기)에 넣습니다. 이것은 태아 생존력을 증가하고 실험 특정 태아 조직을 허용합니다. - 6 일 (10 일까지) 배아를 배양하십시오. 매일 죽거나 오염된 배아를 확인하고 인큐베이터에서 제거하십시오.
참고: 배아는 공중 곰팡이 포자에 의해 오염될 수 있습니다. 곰팡이 오염은 처음에 배아 CAM 표면에 흰색 반점으로 나타납니다. 오염된 배아를 즉시 제거하고 오염을 방지하기 위해 매주 70%에탄올로 인큐베이터를 닦아냅니다. 우리의 경험에서 오염 수준은 매우 낮은 ~ 1-3 %입니다. - 10일 아침에 암세포 주사를 위해 이 배아를 사용하십시오.
2. 주사용 암세포의 준비
참고: 전이성 식민지 선택은 형광암세포에 의해 확립된 표현형을 기반으로 하며, 발현 라이브러리 또는 녹색 또는 적색 형광 단백질과 같은 형광 단백질로 태그된 벡터로부터 유래(도 2A의전체 화면 흐름 참조). 형광 단백질에 과도하게 과도하게 과도하게 연관된 세포를 사용하거나 암세포 증식 및 고르지 않은 얼룩으로 인한 신호의 급속한 퇴색으로 인해 세포 투과성 형광염으로 표지되는 세포를 사용하지 않는 것이 좋습니다.
- 배양 암세포는 주사 시 60-70%의 합류로 한다. 더 높은 수준의 인플루엔자에서 암세포를 사용하면 생존능력이 저하되어 전이성 식민지 형성의 효율성이 낮아집니다. 마이코플라즈마 오염으로 닭배아 생존가능성이 저하될 수 있기 때문에 사용되는 암세포가 마이코플라즈마가 없는지 확인합니다.
- 1x PBS pH 7.4로 두 번 헹구는 세포. 나머지 PBS를 제거한 다음 0.5%의 트립신-EDTA를 추가하고 37°C에서 37°C에서 배양식 표면에서 모든 세포가 들어올릴 때까지 2-5분 동안 배양합니다.
- 셀 서스펜션을 실온에서 15mL 원심관 및 원심분리기 세포로 5분 동안 200 x g로 옮긴다.
- PBS의 10mL에서 세포를 다시 중단하고 2.3단계에서와 같이 세포를 원심분리하여 트립신 및 항생제와 같은 다른 배양 미디어 성분을 제거한다.
참고: 암세포 현탁액에 항생제와 같은 트립신 또는 세포 배양 성분의 존재는 닭배아 생존가능성이 감소될 수 있다. - 조심스럽게 슈퍼 나티를 흡인하고 얼음 차가운 PBS의 1 mL로 세포를 재중단.
- 혈전계 또는 사용 가능한 다른 세포 계수 장비를 사용하여 셀 수를 계산합니다.
참고: 이 선별 프로토콜은 각 전이성 식민지가 단일 셀에 의해 시작되어야 합니다. 세포를 계산할 때 세포가 완전히 트립시화되고 단일 세포 현탁액으로 존재하는지 확인합니다 (세포 덩어리가 존재하지 않습니다). - 정맥 내 (IV) 사출 농축 셀을 0.5 x 106 ~ 1.0 x 106 세포 /mL로. 얼음 차가운 1x PBS를 사용하여 세포 농축액을 희석 및/또는 다시 중단합니다. 10개의 배아마다 약 1mL의 세포 현탁액이 필요할 것으로 예상합니다.
참고: 현탁액에 필요한 세포 현탁액 농도는 주로 실험자 경험의 수준에 의해 결정된다. 자세한 내용은 다음 섹션을 참조하십시오.
3. 전이성 식민지 형성을 위한 암세포의 정맥 주사
참고: 이 프로토콜에 따르면 배아의 백만큼 은 1일 이내에 주입될 수 있습니다. 일반적으로 전이성 식민지(Step 5)를 분리한 다음 암세포를 주입하는 데 시간이 더 걸리므로 모든 단계를 완료하는 데 필요한 시간을 추정하기 위해 초기 실험을 수행하는 것이 좋습니다. 차암 세포 형광 라벨을 사용하면 동물 수와 각 실험에 필요한 시간을 줄이는 데 도움이됩니다. 예를 들어, 대조구는 RFP(적색 형광 단백질)로 표지될 수 있고 돌연변이 종양 세포는 GFP(녹색 형광 단백질)로 대체로 표지될 수 있다. 이 경우, 각 실험은 배아 간 가변성을 교정하는 내장 된 제어를 가지고 있습니다.
- 도 2B에표시된 바와 같이 사출 장치를 조립한다. 먼저 주사기에 바늘을 장착한 다음 3-5cm 길이의 튜브로 주사기 바늘을 확장합니다.
- 미세 한 집게 (~20-60 μL 너비)를 사용하여 보로실리케이트 바늘의 끝을 끊습니다.
- 주사지를 암세포 현탁액(50-200 μL)으로 적재하고튜브(도 2B)에보로실리케이트 바늘을 삽입한다.
- 세포 막힘 및 기포에 대한 보로실리케이트 바늘을 검사합니다. 각 전이성 식민지가 단일 세포에 의해 시작되도록 단일 세포 현탁액으로 세포를 주입하는 것이 중요합니다.
참고: 암세포는 1-2 시간 포스트 트립시화 내의 PBS에서 집계하는 경향이 있으며, 따라서 주사 직전에 준비해야합니다. 필요한 경우, 세포는 주사에 사용되는 1 mL 주사기를 사용하여 주기적으로 재장전 될 수 있습니다 (borosilicate 바늘없이). - 모세관 내에서 세포 막힘이 관찰되면 모세관을 제거하고 세포를 다시 일시 중단하고 새로운 모세관으로 대체하십시오. 플런저를 사용하여 거품을 밀어내보도록 합니다. 셀 막힘이나 거품이 관찰되지 않으면 다음 단계로 진행한다.
- 커버 뚜껑을 제거하고 입체 범위 아래에 배아를 전달합니다. CAM 표면에 주입할 적절한 정맥을 식별합니다. 정맥과 동맥은 CAM 조직 내에서 복잡한 네트워크를 형성(도 2C). 정맥은 산소가 풍부한 혈액을 배아에 전달하기 때문에 밝은 붉은 색으로 구별됩니다.
참고: 일반적인 배아 조작, 암 세포 주입 및 전이성 식민지 절제의 경우 0.8배 및 1.5배 목표와 10배 의 안구를 갖춘 형광성 스테레오현미경을 사용하여 시각화를 위해 사용하십시오. 덜 진보된 현미경은 또한 사용자의 경험 수준에 따라, 이러한 절차에 성공적으로 사용할 수 있습니다. 독자는 작성자에게 문의하여 보다 자세한 권장 사항을 문의할 수 있습니다. - 일반적으로 보로실리케이트 바늘 팁의 직경보다 약간 더 넓은 세포를 주입하는 이상적인 정맥을 찾아내고 배아와 계량 접시 벽 사이에 중간에 위치한다. 일반적으로 정맥 분기에 즉시 인접한 지점에서 주입하는 것이 더 쉽습니다.
참고: 더 큰 정맥으로 주입은 쉽게 나타날 수 있습니다 그러나 과도한 출혈및 감소 된 태아 생존으로 이어질 것입니다. - 혈관 벽에 바늘의 끝을 누르고 혈류와 같은 방향으로 부드러운 압력을 적용합니다. 필요한 경우, 주입되는 선박을 고정하거나 안정화하기 위해 면 봉면 (다른 손으로 보유)을 사용합니다.
- 주사기 플런저를 부드럽게 누르십시오. 하나는 암 세포 현탁액이 혈류에 들어갈 때 혈관의 "청산"을 관찰하여 성공적인 주사를 시각화 할 수 있습니다.
- 원하는 현탁액 부피가 정맥의 혈류로 주입 될 때까지 2-10 s에 대한 주사기 플런저를 계속 우울하게하십시오. 모두 함께 단일 배아의 주사는 사용자의 경험 수준에 따라 1-10 분 이 필요할 수 있습니다. 주사 부위에 과도한 출혈이나 명확한 액체 축적이 나타나면 배아를 폐기하십시오.
참고 : 배아를 "과도하게 주입"하는 것은 쉽습니다. 이상전성 식민지가 4-5일 의 성장 기간 이후에 서로 접촉해서는 안 된다는 점을 염두에 두어야 할 일반적인 고려 사항입니다. 이상적으로 ~5-10%의 말단 CAM 정맥 모세혈관은 성공적인 주사 후 세포가 고정되어야한다(도 2D,E). 2단계에서 언급했듯이, 세포 농도의 범위는 사용될 수 있다(0.5 x 106 - 1.0 x 106 세포/mL). 농도가 낮을수록 주사 시간이 길어지지만 바늘 막힘도 줄어듭니다. 높은 농도 짧은 주입 시간을 필요로 하지만 바늘 막힘을 증가 시킬 것 이다. 작업자에게 가장 편안한 농도를 찾기 위해 여러 농도를 시도하는 것이 좋습니다. 일반적으로, 더 높은 농도(1.0 x 106 세포/mL)는 주입 시간을 감소시키기 위해 바람직하다. - CAM에서 바늘을 제거하고 혈액 이나 과잉 암 세포를 제거 하는 면 봉면으로 주사 사이트를 부드럽게 두드려.
- 계량 접시에 있는 배아를 뚜껑으로 덮고 주입된 닭 배아를 인큐베이터로 되돌려 넣습니다.
- 모든 배아가 주입될 때까지 다음 배아로 절차를 반복하십시오.
4. 전이성 식민지 성장 중 배아 유지
- 배아를 육안으로 검사합니다. 죽은 것이 있거나 박테리아 나 곰팡이로 오염 된 것이있는 경우 인큐베이터에서 제거 한 다음 자동 복제하여 실험실 처리 절차에 따라 폐기하십시오.
참고: 배아는 전이성 식민지 성장을 위해 격일(일 1, 3, 5 항암세포 주입)를 검사하는 것이 좋습니다. 주입된 태아가 배아 손상 및/또는 사망을 유발할 수 있으므로 불필요하게 이동하지 마십시오. - 세포가 과잉 성장(전이성 식민지가 서로 겹치거나) 또는 CAM 조직 내의 고르지 않은 분포(CAM 표면의 작은 하위 영역에 위치한 전이성 콜로니)를 표시하는 경우 실험에서 해당 배아를 제거합니다. 실험에서 제거된 직후 -20°C(또는 다른 승인된 방법)에서 동결하여 버려진 배아를 안락사시다. CAM 조직 내의 실행 가능한 전이성 세포의 수는 처음에 감소 (일 1-2) 다음 증가 (일 2-5).
참고: 일부 배아는 암세포를 "거부"할 수 있으며, 즉 모든 암세포가 CAM 조직에서 사라질 것이다. 이 태아는 실험에서 제거되어야 합니다. 일반적으로, 암세포 식민지는 계량 접시를 열지 않고 형광 스테레오 현미경의 밑에 투명한 뚜껑을 통해 볼 수 있다. - 전이성 식민지가 균일하게 모양으로 나타나는지 확인하십시오 (첫 1-3 일 사후 주입). 일 4-5 사후 주입에서 침략적이거나 비 침습적 전이성 식민지를 식별 (자세한 내용은 섹션 5 참조).
5. 전이성 식민지의 격리
- 5일째에 사후 주사는 인큐베이터에서 배아를 제거하고 전이성 식민지 분포를 위해 배아 CAM을 검사합니다. 컴팩트 (또는 지나치게 침략적인) 식민지가 존재하는 균일 한 식민지 분포를 가진 배아를 확인합니다.
참고: 닭 배아를 배양하는 과정은 멸균되지 않으므로 향후 조직 배양 오염을 피하기 위해 모든 선별 단계를 매우 깨끗한 조건에서 수행해야합니다. 오염은 매우 드물며 장갑과 마스크를 착용하고 세포 주입 및 식민지 격리 절차 동안 멸균 도구만 사용하여 쉽게 피할 수 있습니다. 주변 실험실 온도에 대한 노출을 줄이고 오염을 방지하기 위해 배아를 하나씩 검사하는 것이 좋습니다. - 관심있는 전이성 식민지를 찾습니다. 소형 식민지는 CAM 조직내 제한된 영역 내에 위치한 대부분의 암세포를 가진 것으로 설명될 수 있다(세포는 "함께 뭉쳐"나타납니다). 침습적 식민지는 암세포가 CAM조직(도 3A,B)에서"산란"되는 콜로니콜로 설명될 수 있다.
참고: 전이성 식민지의 "압축성"은 암세포 침입의 억제, 암세포 증식 억제 또는 둘 다에 의해 설명될 수 있다. 주의모든 시나리오에 지불해야하며 접촉 식민지는 격리되어야한다(그림 3A,B). 간단한 형광 성 입체 현미경은 소형 및 침습적 전이성 식민지 표현형을 구별하는 데 사용할 수 있습니다. - 해부 현미경하에서 미세한 집게(도3C)를사용하여 위쪽으로 관심의 전이성 식민지를 포함하는 CAM 조직을 부드럽게 당깁니다.
- 외과 가위를 사용하여 전이성 식민지를 포함하는 CAM 조직을 잘라냅니다.
- 전이성 식민지를 포함하는 CAM 조직을 빈 멸균 1.5 mL 튜브(얼음)로 옮기고 튜브 뚜껑을 닫습니다.
참고: 고립된 식민지는 생존력을 잃지 않고 최대 3시간 동안 얼음 위에 보관할 수 있습니다. - 관심있는 모든 식민지가 별도의 튜브로 수집 될 때까지 절제 절차를 반복하십시오. 동물의 고통을 피하기 위해, 하나의 배아에서 2-3 개 이상의 식민지를 소비하지 마십시오. 식민지 절제 직후 -20°C(또는 다른 승인된 방법)에서 동결하여 배아를 안락사시합니다.
- 멸균 18 게이지 바늘을 사용하여 마이크로 원심 분리기 튜브에서 CAM 조직을 부드럽게 다진다. 각 식민지에 대해 별도의 바늘을 사용하십시오.
- 1x 콜라게나아제 용액 의 100 μL을 추가하고 37 °C에서 30 분 동안 배양하십시오.
- 세포와 CAM 조직을 300 x g에서 주위 온도에서 5 분 동안 회전하십시오.
- 콜라게나아제 용액을 흡인하고 관심 있는 세포주에 사용되는 완전한 매체에서 세포를 재분리합니다.
참고: 일반적으로 CAM 조직은 콜라게나아제 치료 후 완전히 해리되지 않으며 암세포는 먼저 CAM 조직의 조각 내에서 증식하고 나중에 조직 배양 접시로 이동합니다. - 세포와 CAM 조직을 주변 온도에서 5 분 동안 300 x g에서 다시 회전시십시오.
- 전체 미디어 플러스 선택 계수(있는 경우)의 1mL에서 세포 및 CAM 조직 조각을 다시 중단한 다음, 단일 12 개의 잘 조직 배양 접시로 잘 전달하십시오.
참고: 치킨 CAM 섬유아세포는 복제 확장을 억제하는 다중 구절을 위한 조직 배양에서 지속될 수 있습니다. 선발 인자(즉, 암세포를 렌더링하는 데 사용된 벡터가 포유류 항생저항 유전자를 인코딩하는 경우) 전이성 콜로니를 확장하는 능력은 클론 확장을 크게 가속화할 수 있다. 항생의 적당한 농도가 이용되는지 확인하기 위하여 선별전에 사살 곡선 실험이 수행되어야 합니다. - 다음 1-3 주 동안 성장과 오염에 대 한 매일 암 세포를 모니터링.
- 세포가 결합량의 70-80%에 도달하면 더 큰 양문화 접시로 세포를 전달합니다.
참고: 각 클론의 극저온 바이알 2개 이상이 동결될 때까지 세포를 확장하는 것이 좋습니다. 조직 배양을 다량 유지하는 것은 힘들고 불필요할 수 있습니다. - 충분한 암 세포 수에 도달하는 즉시 시퀀싱 또는 다음 선발 라운드로 진행하십시오. 일반적으로 암세포의 1 x106은 현대고처리량 시퀀싱 기술에 충분합니다.
- 콜로니 콤팩트 또는 암 세포 혈관접촉(도 2A)의클론 재주입 및 이미징 및 정량화를 진행한다. 또는 높은 처리량 시퀀싱을 진행하거나 콜로니 선택을 반복한다.
참고: 최소 두 번의 선택 횟수를 줄이려면 선택합니다. 두 가지 접근 방식이 성공적으로 채택되었습니다. 1) 각 클론을 확장하고 개별적으로 재주입하여 식민지 표현형을 확인합니다. 2) 확장된 모든 클론을 각각 1:1 비율로 혼합하고 혼합물로 재주입하고 선택 주기를 반복한다.
6. 형광 태그 렉틴을 CAM 혈관에 주입.
- 주입할 정맥을 식별합니다. 종양 세포 주입에 사용 된 렉틴에 대해 동일한 주사 부위를 사용하는 것이 더 쉽습니다.
- 형광렉틴 재고 용액(5 mg/mL) 50-100x를 1x PBS로 희석하고 암세포 주입에 사용되는 것과 동일한 사출 장치에 적재한다.
참고: 혈관 시각화를 위해 주입해야 하는 렉틴의 양(일반적으로 20-100 μL)은 현미경 민감도에 따라 달라지며 스크리닝 전에 실험적으로 결정되어야 합니다. - 종양 세포 주입과 동일한 기술을 사용하여 렉틴을 주입하십시오(단계 3.6.-3.10을 참조하십시오).
- 렉틴 주입 후 배아를 인큐베이터에 넣고 5 분 동안 회복하십시오. 배아를 이미징하기 직전에 한 번에 한 번의 배아만 주입하십시오.
메모. 12일 이상인 배아는 일반적으로 렉틴 주사로부터 잘 회복되며 순차적 이미징을 위해 다음날 렉틴으로 다시 주사할 수 있다. 더 젊은 태아는 더 민감하고 혈액 응고를 표시할 수 있습니다.
7. 암세포 혈관 접합의 시각화
- 화상 진찰 전에 온도 조절 현미경 인클로저를 대략 6 시간 37 °C로 설정합니다. 이렇게 하면 현미경 온도가 안정되고 이미징 중에 XYZ 드리프트를 최소화할 수 있습니다.
메모. 전문 닭배아 이미징 챔버9,10, 11,12, 13이 실험에 사용되었다. 간단한 형광 해부 현미경은 암 세포 주입에서 클론 선택 및 복제 재주입, 콜로니 컴팩트의 평가에 이르기까지 모든 단계에 사용될 수 있다. 화상 진찰실이 장착된 공초점 현미경은 암 세포 혈관 접촉의 화상 진찰 그리고 정량화를 위해 필요합니다. 가열은 1 h까지 필요하지 않으며 일반적으로 배아는 생존가능성에 영향을 미치지 않고 적어도 두 번의 순차적 이미징 세션에서 살아남습니다. - 필요한 객관적렌즈(20배 또는 25배 물 침지 목적 렌즈 권장)가 설치되었는지 확인합니다.
- 이미징 챔버 뚜껑 의 밑면에 진공 그리스의 얇은 층을 적용하여 커버슬립으로 안전한 씰을 만듭니다.
- 커버슬립을 뚜껑에 부드럽게 놓고 과도한 진공 그리스를 닦아냅니다.
- 배양기에서 주입된 렉틴 주입 된 배아를 꺼내 필요한 경우 계량 접시의 테두리를 자른다.
- 커버슬립이 있는 이미징 챔버에 배아를 위치하여 전이성 콜로니가 위치한 CAM 의 영역으로 직접 내려간다. 커버슬립이 CAM에 닿을 때까지 뚜껑을 천천히 배아위로 낮춥습니다. 나사를 조이서 뚜껑을 고정하고 뚜껑이 수평이 되고 커버슬립이 CAM에 하방 압력을 가하지 않도록 합니다.
- 여러 (5-10) 배아에서 제어 및 실험 그룹 (10-20)에서 여러 무작위 식민지의 이미지를 습득한다.
메모. 각 필드에서 임의 3D 스택(1-5um Z-steps; 50-100um 범위; 25x)을 획득하는 것이 좋습니다. - 사용 가능한 경우 현미경 획득 소프트웨어에서 필드 스티칭 옵션을 사용합니다. 정량화에 사용되는 이미지는 게시 품질이 아니므로 가능한 경우 공진 스캔과 같은 빠른 수집 모드를 사용합니다. 5-10 μm Z 단계, 100 μm 총 범위와 25배 목표 및 3 x 3 스티칭을 사용합니다. 조건당 적어도 100개의 세포(~20개의 식민지)를 이미지합니다.
8. 암세포 혈관 접문의 정량화
- 필요한 소프트웨어를 사용하여 3D 파일을 Z 스택으로 엽니다.
메모. 암 세포-혈관 접촉을 정량화하기 위해 고해상도 이미지를 획득하고 분석하는 전문 소프트웨어를 사용해야 합니다. 3D 이미지 분석을 할 수 있는 여러 소프트웨어 패키지를 사용할 수 있습니다. 자세한 내용은 재료 표를 참조하십시오. - 이미지 수집 중에 상당한 XY 움직임이 발생한 경우 ImageJ StackReg 플러그인(http://bigwww.epfl.ch/thevenaz/stackreg)을 사용하여 Z 스택을 정렬합니다.
- 관심 있는 셀(들)을 찾습니다.
- Z 방향으로 XYZ 영상을 스크롤하고 관심 있는 세포에 대한 암세포 혈관 접촉의 최대 길이를 포함하는 광학 섹션을 식별한다(도2E).
- "수동 길이 측정 기능"을 사용하여 암세포-혈관 접촉을 측정합니다.
- 통계 분석에 사용되는 데이터 소프트웨어 패키지에 측정값을 입력합니다.
참고: 암세포의 혈관 에 부착하는 능력은 특정 암세포 클론(또는 둘 다)에 대한 혈관과 접촉하는 암세포-혈관 접촉의 길이 또는 세포의 백분율로 측정될 수 있다. - 관심있는 다음 셀로 진행합니다.
- 돌연변이 복제본(들) 및 제어 데이터 집합을 비교하는 통계적 유의를 위해 데이터를 분석합니다.
9. 콜로니 컴팩트 정량화
- 2단계와 동일한 기술을 사용하여 확장된 클론으로부터 세포를 재주입한다.
- 5일 사후 주사는 각 클론에 대해 10-50 무작위 전이성 콜로니의 이미지를 수집합니다.
참고: 전이성 콜로니 컴팩트 정량화에는 고품질 이미지가 필요하지 않습니다. 단색, 스테레오 현미경 (10 x 배율) 이미지는 충분합니다. 주의이미지의 밝기(식민지 내의 대부분의 세포가 보아야 합니다) 및 대비(하나 또는 두 개의 세포 간의 차이)에 주의를 기울여야 합니다. - 콜로니 이미지를 디지털방식으로 분리(도 2C,D참조) 독립형 콜로니 콤팩트 정량화 모듈 또는 블라인드 스코어링(13)을사용하여 콜로니 콤팩트 정량화를 진행한다.
- 관심의 다음 식민지로 진행합니다.
- 돌연변이 클론(들) 및 제어(즉, 스크램블 shRNA) 데이터 집합을 비교하는 통계적 유의를 위해 데이터를 분석합니다.
결과
암세포 주사는 모세혈관에 박혀 있는 세포의 대다수가 단일이고 서로(~0.05-0.1cm)의 상당한 차이에 위치하여 5-6일 후 식민지가 인큐베이션기간(그림 3A)이겹치지 않도록 성공하는 것으로 여겨진다. 암세포의 축적이 모세혈관의 대부분에서 볼 수 있다면 주사가 성공하지 못했으며, 이를 나타내는 배아는 폐기되어야한다(도 2E). 주입된 암세포의 상당수는 주사의 24 시간 안에 멸망하는 몇몇 태아가 모든 암세포를 거부하는 것처럼 보입니다. 암세포 생존은 국소 계란 공급 업체에 따라 달라질 수 있으며(즉, 주입되는 세포의 양은 다를 수 있음) 실험을 진행하기 전에 최적의 주사 조건(암세포 농도 대 주사 기간)을 결정하는 것이 좋습니다. 0.5 x 106 ~ 1.0 x 106 셀/m 사이의 범위에서 세포 농도를 권장합니다. 최적의 세포 농도 및 주사 지속 시간이 달성되면, 5일째 사후 주사 변환 세포는 CAM 조직에 흩어져 나타나는 암세포에 의해 결정된 바와 같이 침습적으로 나타나는 대다수의 콜로니 표현형을 생성해야한다(도 3A). 주의는 "컴팩트"나타나는 전이성 식민지에 지불해야하며, 그들은 CAM 조직의 한 조각에 집게와 가위로 절제 될 수있는 이웃 식민지에서 충분히 멀리 위치(그림 3C). 격리된 포지티브 스크린 히트(즉, 컴팩트콜로니)는 재주입 시 소형 콜로니 표현형을 표시해야한다(도 3B). 세포 생존율(또는 식민지 내세포 증식율)의 감소도 관찰될 수 있다. 따라서, 충분한 식민지 숫자를 얻기 위해 양수 화면 안타의 일부에 대해 더 높은 세포 번호를 주입할 필요가 있을 수 있다. 암 세포-혈관 접촉의 측정을 위해 주의 혈관 벽 얼룩 밝기에 지불 되어야한다 (형광 렉틴; 도 3D,E)및 렉틴의 적절한 양은 밝은/대비 혈관 벽 신호에 대해 주입되어야 한다. 현미경 소프트웨어 교정이 수행된 후 가능한 모든 이미지 분석 소프트웨어는 정량화 단계에서 사용할 수 있습니다.

그림 1: 닭 배아 껍질이없는 문화 개요. (A)껍질없는 문화를 위해 준비 된 뚜껑이있는 계량 접시. 화살표는 컷 모서리를 가리킵니다. (B)유동 후드의 행으로 배열 된 계량 접시. (C)전기 로터리 도구로 달걀 껍질을 절단. (D)달걀을 계량 접시에 넣습니다. (E)가습된 인큐베이터에서 배양된 배아. 스케일 바 =1cm(A-D) 또는 5cm(E). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
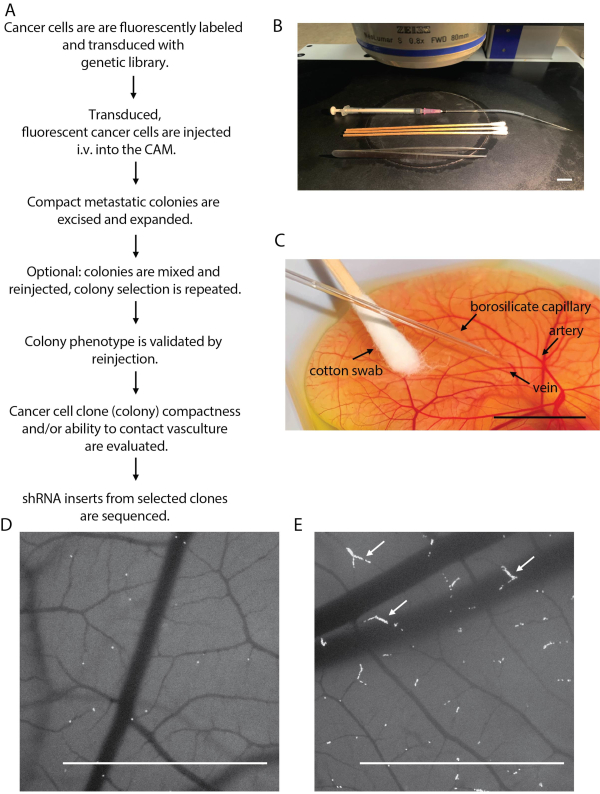
도 2: 암세포 주입 및 전이성 식민지 격리의 개요. (A)닭 배아 선별 플랫폼 단계를 요약한 순서도. (B)스테레오 형광 현미경 단계에 설정된 암세포 주입. (C)암세포를 CAM 혈관으로 주입한다. (D)성공적인 암세포 주입(허용 가능한 암세포 밀도)을 보여주는 이미지, 주사 직후 촬영. (E)암세포 주입이 불량한 것을 보여주는 이미지, 과잉 주사배로 볼 수 있다. 혈액 모세 혈관 (백색 화살)에서 축적되는 암 세포참고. 스케일 바 = 1cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3. 선별 프로토콜의 다른 단계에 대한 대표적인 결과. (A)이종성(라이브러리 트랜스포제암 세포주 HEp3 세포)에 의해 형성된 전이성 콜로니, 5일 사후 주입. 빨간색 화살표는 절제해야 소형 식민지 (잠재적 인 긍정적 인 타격)를 보여줍니다. (B)전이성 콜로니 중 하나에 의해 형성된 격리된 스크린안타(KIF3B)후, 5일 사후 주입. Inset은 대시 된 사각형에서 전이성 콜로니 이미지를 디지털 방식으로 잘라 보여줍니다. 이것은 C.I 정량화에 허용되는 이미지 품질입니다. 적중재(KIF3B)에대한 평균 C.I. 값이 표시됩니다. (C)CAM 조직으로부터 관심의 전이성 식민지의 격리. 대표적인 광학 섹션(D)대조군 식민지,(E) KIF3B shRNA 과잉 발현 식민지, 둘 다 암 세포 혈관 접촉 측정을 보여주는. CAM 혈관은 형광 렉틴-649로 표시됩니다. 스케일 바 =1cm(A-C) 또는 50 μm(D, E). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기서 우리는 유전 또는 약물 후보 스크린과 같은 중요한 응용프로그램에 이용될 수 있는 급속한 형광 현미경 검사법을 기반으로 한 인내 검열 프로토콜을 기술합니다. 관심있는 유전 라이브러리로 변환되거나 개별 발현 구조와 연관된 암세포는 이 병아리 CAM 모델을 사용하여 관심 표현형에 대해 빠르게 선별및 정량화될 수 있다. 변환 또는 트랜스페션 프로토콜은 라이브러리 유형에 따라 크게 다르므로 이 절차에 포함되지 않습니다. Pheno전형 관련 전이성 콜로니는 CAM으로부터 절제되고, 확장되고, DNA가 높은 처리량 시퀀싱을 위해 분리되어 관심 있는 발현 구조를 식별한다. 일반적으로, 각 유전 라이브러리에는 프라이머 서열과 유전체 DNA 정제의 권장 방법이 장착되어 있습니다. 최상의 높은 처리량 시퀀싱 결과를 위해 로컬 시설 지침을 사용하는 것이 좋습니다.
스크리닝 전에 라이브러리 및 세포주에 대한 최적의 감염 복합성(M.O.I.)을 결정하는 것이 좋습니다. 이상적으로 각 세포 (따라서 미래 전이성 식민지)는 항상 달성 할 수없는 우리의 경험에서 하나 만 유전자 발현 구조를 포함해야합니다. 라이브러리 제조업체의 프로토콜을 따르고 가능한 한 1에 가까운 M.O.I. (0.01-5)를 테스트하는 것이 좋습니다. 각 전이성 식민지 내에 여러 라이브러리 식 구문이 존재하여 식민지 표현형 해석을 크게 복잡하게 만들 수 있습니다. 또한 실험에서 부정적인 제어를 제공하는 라이브러리 제조업체를 사용하는 것이 좋습니다(즉, 형광 태그벡터를 표현하는 스크램블 shRNA).
우리의 검열 프로토콜은 비 침습적 형광 식민지의 선택을 기반으로합니다; 실험에 사용된 모든 세포주는 유사한 형광 강도를 가지고 있는지 확인하는 것이 중요합니다. 세포 들 중 고르지 않은 형광 강도 (및 전이성 식민지) 때문에 침습의 세포 또는 식민지 밝기로 인해 편향된 식민지 선택 귀착될 수 있습니다.
기존 방법에 비해 우리의 프로토콜은정교한 이미징 장비(12,13,14)에대한 필요없이 인트라 바이탈 스크린 사이클을 완료하는 속도, 저렴한 비용 및 기능과 같은 몇 가지 독특한 장점을 제공합니다. 또한, 전체 스크리닝 주기는 세포 주입에서 시퀀싱 단계까지 3~6주 동안 완료될 수 있다. 대부분의 연구자가 사용할 수 있는 기본적인 형광 스테레오 현미경을 사용하여 이 단계를 수행할 수 있기 때문에 암 세포 주입 또는 전이성 식민지 격리에는 고해상도 현미경이 필요하지 않습니다. 마지막으로, 껍질이 없는 배아 배양이 완전히 자기 유지되어 복잡한 연구 동물 하우징이나 먹이 주기 일정에 대한 필요가 없습니다. 대부분의 연구 기관은 닭 배아를 살아있는 동물로 간주하지 않으며 이 모델과 관련된 비용과 문서화 부담을 크게 줄입니다.
그러나, 껍질이 없는 배아 모델과 관련된 몇 가지 제한이 있다. 첫째, 모든 암 세포선이 이 모형에서 효율적으로 작동하는 것은 아닙니다. 우리의 실험실에서 우리는 정기적으로 HT1080 (인간 섬유 육종종), HEp3 (머리 및 목) 및 마우스 b16 흑색종 및 4T1 유방암 세포주와 같은 몇몇 암 세포주를 일상적으로 사용하며, 이는 닭 CAM 혈관에 주입 할 때 전이성 식민지를 강력하게 형성합니다. 유방(MDA468), 뇌(U87 및 U118) 또는 난소(A2780s)와 같은 다른 암 유형을 가진 다른 세포주들은 CAM에 주입될 때 전이성 콜로니를 쉽게 형성하므로12,14,15도이 스크리닝 프로토콜에 사용될 수 있다. 그러나, 우리의 경험에서 일반적으로 LnCaP와 PC3와 같은 암 세포주를 사용 이 모형에서 잘 수행하지 않습니다 (공개되지 않은 관측). 또 다른 한계는 암 세포 혈관 접촉의 시각화와 같은 고해상도 이미징을 위해 100 에서 200 μm 이미징 범위를 가진 공초점 현미경이 필요하다는 것입니다, 이 장비는 많은 연구원을 위해 유효하지 않을 수 있습니다.
전부, 이 프로토콜은 암 전이 억제제 및 드라이버의 발견을 위해 이용될 수 있는 급속한 인트라베이티 검열 플랫폼을 기술합니다. 우리는 강력하게이 모델의 견고성과 사용 편의성 특성이 많은 연구자에 대한 필수적인 선별 모델이 될 것이라고 생각합니다.
공개
아무것도 공개할 수 없습니다.
감사의 말
이 작품은 캐나다 암 학회 연구소 그랜트 #702849 JDL및 KS에 의해 지원되었다. 루이스 박사는 알버타 암 재단이 지원하는 전립선암 연구에서 프랭크와 칼라 소존키 의자를 보유하고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL disposable syringes | BD | BD309659 | |
| 15 mL conical centrifuge tubes. | Corning | CLS430791-500EA | |
| 18 gauge x 1 1/2 BD precision needle | BD | BD305196 | we use 1.2mm x 40mm, it is possible to use shorter needles if preferred |
| 2.5% Trypsin solution | many sources are available | ||
| 4T1 mouse breast cancer | ATCC | CRL-2539 | |
| B16F10 mouse melanoma cell line | ATCC | CRL-6475 | |
| Benchtop centrifuge. | many sources are available | Any TC compatible centrifuge that can be used to spin down the cells is suitable | |
| Circular coverslips, 22 mm. | Fisher Scientific | 12-545-101 | |
| Collagenase | Sigma | C0130-100MG | |
| Confocal microscope | We use Nikon A1r | ||
| cotton swabs | many sources are available | must be sterilized before use | |
| Culture media appropriate for the cell lines used | many sources are available | We grow HT1080, HEp3 and b16 cell lines in DMEM, 10% FBS media | |
| Egg incubator | many sources are available | An exact model that is necessary depends on the scale of the screen. Available sources are MGF Company Inc., Savannah, GA, or Lyon Electric Company Inc., Chula Vista, CA | |
| eppendor tubes , 1.5ml | Sigma | T4816-250EA | |
| Fertilized White Leghorn eggs | any local supplyer | ||
| fine forceps | many sources are available | must be sterilized begfore use | |
| Hemocytometer | Millipore-Sigma | MDH-4N1-50PK | |
| HT1080 human fibrosarcoma cell line | ATCC | CCL-121 | |
| Image analysis software | We use Nikon Elements | ||
| Lectin Lens Culinary Agglutinin (LCA) conjugated with Fluorescein or Rhodamine | Vector Laboratories | RL-1042, FL-1041 | Dilute stock (5mg/ml) 50-100x depending on the microscope sensetivity. Must be a different color from the color of cell line used for screening |
| MDA-MB-468 human breast cancer | ATCC | HTB-132 | |
| PBS (1x) | many sources are available | ||
| Plastic weighting dishes | Simport | CA11006-614 | dimensions are 78x78x25mm; many other sources are available |
| small surgical scissors | many sources are available | must be sterilized before use | |
| Sodium borosilicate glass capillary tubes, outer diameter 1.0 mm, inner diameter 0.58 mm, 10 cm length | Sutter Instrument | BF100-58-10 | |
| Square petri dishes (used as lids for the weighting dishes). | VWR | CA25378-115 | dimensions are 100x100x15mm; many other sources are available |
| Stereo fluorescent microscope | We use Zeiss Lumar v12 | ||
| Tygon R-3603 laboratory tubing | Cole-Parmer | AAC00001 | 1/32 in inner diameter, 3/32 in. outer diameter, 1/32 in. wall thickness |
| U-118 MG human glioblastoma | ATCC | HTB-15 | |
| U-87 MG human glioblastoma | ATCC | HTB-14 | |
| Vertical pipette puller | many sources are available | we use David Kopf Instruments, Tujunga, CA; Model 720 |
참고문헌
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Van't Veer, L. J., et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature. 415 (6871), 530-536 (2002).
- Eccles, S. A., Welch, D. R. Metastasis: recent discoveries and novel treatment strategies. Lancet. 369 (9574), 1742-1757 (2007).
- Weber, G. F. Molecular mechanisms of metastasis. Cancer Letters. 270 (2), 181-190 (2008).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nature Reviews Cancer. 2 (8), 563-572 (2002).
- Pantel, K., Brakenhoff, R. H. Dissecting the metastatic cascade. Nature Reviews Cancer. 4 (6), 448-456 (2004).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nature Reviews Cancer. 3 (5), 362-374 (2003).
- Oudin, M. J., et al. Tumor cell-driven extracellular matrix remodeling drives haptotaxis during metastatic progression. Cancer Discovery. 6 (5), 516-531 (2016).
- Leong, H. S., et al. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature Protocols. 5 (8), 1406-1417 (2010).
- Kain, K. H., et al. The chick embryo as an expanding experimental model for cancer and cardiovascular research. Developmental Dynamics : An official Publication of the American Association of Anatomists. 243 (2), 216-228 (2014).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer Cell. 13 (3), 221-234 (2008).
- Palmer, T. D., Lewis, J., Zijlstra, A. Quantitative analysis of cancer metastasis using an avian embryo model. Journal of visualized experiments : JoVE. (51), e2815 (2011).
- Stoletov, K., et al. Quantitative in vivo whole genome motility screen reveals novel therapeutic targets to block cancer metastasis. Nature Communications. 9 (1), 2343 (2018).
- Leong, H. S., et al. Invadopodia are required for cancer cell extravasation and are a therapeutic target for metastasis. Cell Reports. 8 (5), 1558-1570 (2014).
- Willetts, L., Bond, D., Stoletov, K., Lewis, J. D., Ursini-Siegel, J., Beauchemin, N. . The Tumor Microenvironment: Methods and Protocols. , 27-37 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유