Method Article
Karaciğer naklinde iskemi reperfüzyon hasarından kaçınma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, donörlerden alıcılara ex situ normotermik makine perfüzyonu (37 °C) altında adım adım iskemi içermeyen bir karaciğer nakli protokolü sağlamak için bir protokol sunulmaktadır.
Özet
Şu anda, ex situ makine perfüzyonu, donör organlar için geleneksel statik soğuk korumadan (0-4 °C) daha iyi bir koruma yöntemi sağlayan gelişmekte olan bir tekniktir. Tedarik ve korumadan implantasyona kadar makine perfüzyonu kullanılarak organlara sürekli kan temini, iskemi reperfüzyon hasarının tamamen önlenmesini kolaylaştırır ve transplantasyondan önce donör karaciğerlerinin ex situ fonksiyonel değerlendirmesine izin verir. Bu yazıda, hepatik arterden pulsatil perfüzyon ve insan donör karaciğerinden alıcılara portal venin sürekli perfüzyonu için ex situ normotermik makine perfüzyon cihazının kullanıldığı adım adım iskemi içermeyen bir karaciğer nakli protokolü sunuyoruz. Perfüzyon döneminde, karaciğerin metabolik aktivitesini değerlendirmek için perfüzatın biyokimyasal analizi yapılır ve ayrıca yaralanma derecesini değerlendirmek için bir karaciğer biyopsisi yapılır. İskemi içermeyen karaciğer nakli, iskemi-reperfüzyon hasarını önlemek için umut verici bir yöntemdir ve transplantasyon için donör havuzunu potansiyel olarak artırabilir.
Giriş
İskemi reperfüzyon hasarı (IRI) organ transplantasyonunda iyi bilinen ve yaygın bir komplikasyondur. Belirgin immünolojik olmayan olaylar, yüksek organ yetmezliği, yeniden transplantasyon ve alıcı ölümü oranlarıyla ilişkili olarak kötü greft sonuçlarına ve gecikmiş greft fonksiyonuna yol açar1. Organların konvansiyonel soğuk hava deposu (CCS) daha önce metabolizmayı yavaşlatmak için klasik bir yöntem olarak tanımlanmıştı, ancak ilerleyici disfonksiyonu ve hücresel bütünlüğün zarar görmesini önlemede bir etkisi yoktu. Ayrıca, lökosit birikimi, reperfüzyon fazındaki reaktif oksijen metabolitleri tarafından indüklenir. Tüm bu biyolojik süreçler, yağlı karaciğerler ve 65 yaşından büyük donörlerden elde edilenler gibi genişletilmiş kriterli donör (ECD) greftleri kullandığımızda daha da önemli hale gelir. Bu ECD greftleri, özellikle CCS2'den gelenler olmak üzere, hasara ve diğer bazı zararlı etkilere karşı daha savunmasızdır. Donör organları korumak için normotermik ex situ karaciğer makinesi perfüzyonu teknolojisi son birkaç on yılda büyük ilerleme kaydetmiştir ve klinik uygulamada tamamen uygulanabilir3. Donör organlarda sıcak perfüzyon tekniklerinin güvenliği ve canlılığı klinik öncesi çalışmalarda değerlendirilmiş ve bazı çalışma grupları hayvan modellerinde yeni tip perfüzat ve yeniden ısıtma taktikleri tasarlamıştır. Donör karaciğerlerini korumak için bazı klinik sıcak perfüzyon denemeleri Doğu Asya, Avrupa ve Kuzey Amerika'da başlatılmıştır 4,5.
Normomik makine perfüzyonu (NMP), organların sürekli olarak sağlanan oksijen ve besinlerle homeostaz elde edebileceği metabolik olarak aktif bir senaryoyu kolaylaştırır. Greftlerin metabolizması aktive edilir ve perfüzyon sırasında donör organların, perfüze edilen organların biyokimyasal indeksine veya biyopsisine göre alıcılara nakledilmeye uygun olup olmadığına karar verebiliriz. Koruma süresi boyunca mevcut parametreler ayrıca cerrahların greftleri tedavi etmeleri veya ECD greftlerini geri yüklemeleri için bir araç sunar 6,7.
Kırmızı kan hücreleri en sık kullanılan oksijen taşıyıcısıdır. Antibiyotikler, antitrombotik ajanlar ve besinler dahil olmak üzere diğer bazı temel bileşenler de perfüzat8'e dahil edilmiştir. Mevcut uygulamada, bir karaciğer alındıktan sonra, korunur ve 0-4 ° C'lik bir çözelti içinde arka masa hazırlanır. Daha sonra, soğuk karaciğer, değerlendirme ve restorasyon için birkaç saat boyunca önceden hazırlanmış NMP aparatında perfüze edilir. Bununla birlikte, karaciğer NMP'nin başlangıcında ve implantasyondan sonra çift IRI ataklarına maruz kalır, ancak karaciğer NMP işlemi sırasında bir dereceye kadar korunur ve onarılır 9,10. Bu nedenle, süreci yeniden değerlendirmeye ve iki IRI saldırısından kaçınmayı düşünmeye çalıştık. Karaciğere sürekli bir kan akışı sağlandığında IRI'nin önlenebilir olduğunu varsaydık. Bu hipotezi doğrulamak için, geleneksel çift dönüşüm protokolünü bir Liver-Assist cihazı kullanarak kesintisiz bir hepatik arter (HA) ve portal ven (PV) beslemesine değiştirdik. Bu yeni nakil işlemine iskemisiz karaciğer nakli (IFLT) adı verildi. IFLT'nin ilk vakası daha önce yayınlanmış ve organ nakli uzmanlarından büyük ilgi görmüştür11.
Akışın ilgili basınçla kontrol edildiği perfüzyon cihazında pulsatil hepatik arteriyel akış ve sürekli bir PV beslemesi sağlayan iki döner pompa kullanıldı. Sistem basınçla kontrol edilir ve karaciğerden geçen akışın karaciğerdeki dirence göre otomatik olarak ayarlanmasını sağlar. Perfüzatın oksijenasyonu ve CO2 eliminasyonu, iki içi boş fiber membran oksijenatör tarafından düzenlenir. Farklı makine perfüzyon türlerine göre (10 °C ila 37 °C arasında değişen) farklı sıcaklıklar ayarlayabiliriz. Perfüzyon işlemi sırasında gösterge panelindeki gerçek zamanlı basınç, sıcaklık, akış ve direnç indeksini izleyebilir ve kaydedebiliriz. Karaciğer desteği taşınabilir bir cihaz değildir. Bu nedenle, IFLT için kullanılan donörler nakil merkezine transfer edilmelidir.
Bu makale, HA'ya pulsatil perfüzyon sağlamak ve insan donör karaciğer tedarikinden implantasyona kadar PV'nin sürekli perfüzyonunu sürdürmek için bir ex situ NMP aparatının kullanıldığı adım adım bir IFLT protokolü sunmayı amaçladı.
Protokol
Bu protokol, Çin'in Guangzhou kentindeki Sun Yat-sen Üniversitesi Birinci Bağlı Hastanesi'nin etik komitesi tarafından gözden geçirilmiş ve onaylanmıştır. Tüm katılımcılardan bilgilendirilmiş onam alındı. İnsan katılımcıları içeren çalışmalardaki tüm prosedürler, 1964 Helsinki Deklarasyonu'na ve daha sonra yapılan değişiklik veya revizyonlara uygun olarak gerçekleştirilmiştir.
1. Perfüzyon çözeltisinin ve cihazın hazırlanması
NOT: Bu protokole göre NMP için hazırlanan perfüzyon çözeltisinin toplam hacmi, daha önce1 bildirildiği gibi yaklaşık 3.000 mL'dir ve nihai hemoglobin konsantrasyonu 6-10 g / L'dir. Perfüzyon çözeltisinin bileşenleri Tablo 1'de listelenmiştir.
- Perfüzatın bileşenlerini, oksijenatörün üst kısmındaki konektör aracılığıyla yapay karaciğer destek cihazının (Malzeme Tablosu) organ rezervuarına ekleyin ve boru hattındaki tüm kabarcıkları çıkarın.
- Venöz pompayı, ekranda görüntülenen üreticinin talimatlarına göre açın. Arteriyel pompayı da benzer şekilde açın. Cihaz ekranındaki talimatlara göre basıncı boşaltın. Normal sıcaklık mekanik perfüzyonunun tüm süreci sırasında HA basıncını 50–60 mmHg aralığında ve PV basıncını 5–10 mmHg aralığında ayarlamak için Basınç düğmesine tıklayın.
- 400 mL/dk'lık birleşik akış hızındaO2 ve hava karışımı (%30O2) kullanarak oksijenasyona başlayın. Perfüzyon solüsyonunu 37 °C'ye ısıtın.
- Cihaz hazırlandıktan sonra mikrobiyal kültür (8 mL), kan gazı analizi (0.5 mL) ve karaciğer fonksiyon testi (3 mL) için arteriyel perfüzyon hattının T-dal borusundan bir perfüzat çözeltisi örneği alın (pO2, pCO2, pH ve elektrolit normal aralıkta ve 37 ° C'ye yakın sıcaklık) ve buna göre biyokimyasal parametreleri izleyin.
NOT: Perfüzat, laminer akışlı bir ameliyathanede kullanılmadan önce taze olarak hazırlanmalıdır. Gerekirse bikarbonat veya insülin eklenir.
2. İskemisiz donör karaciğer alımı
- Abdominal çapraz insizyonu şu şekilde yapın: sternal çentikten simfiz pubise kadar dikey ve enine, göbek hizasında her iki tarafa yanal olarak. Akciğerin veya kalbin temini gerektiğinde, sternotomi kullanılabilir. Pozlama sağlamak için C şeklinde büyük bir ekartör kullanın.
- Karın iç organlarının ayrıntılı bir incelemesini yapın. Histolojik gözlem ve klinik araştırma için karaciğer biyopsisi örneği alın. Karaciğeri hassas bir teknikle harekete geçirin.
- Safra drenajı için ortak safra kanalına bir kanül yerleştirin ve kistik kanalı bağlayın. Histolojik gözlem ve klinik araştırma için ortak safra kanalının ucundan tam çevreli bir doku örneği (genişlik: 3-5 mm) kesin.
- Çölyak arter (CA), gastroduodenal arter (GDA), splenik arter (SA), inferior vena kava (IVC) ve PV'yi inceleyin. GDA veya SA'ya 8 Fr / 12 Fr arteriyel kanül yerleştirin. CA'dan karaciğer için arteriyel beslemede herhangi bir kesinti olmadığından emin olun.
- 3 cm uzunluğunda bir sağ eksternal iliak ven hasat edin ve bir interpozisyon veni yapmak için PV'nin kısmi blokajı ile damarı uçtan uca bir şekilde PV'ye anastomoz edin.
- Cihazın organ rezervuarına çıkış için infrahepatik inferior vena kavaya (IHIVC) 32-34 Fr kaval kanülü yerleştirin. Cihazın PV perfüzyon hattına düz bir 24 Fr kanül bağlayın ve ardından interpozisyon damarı yoluyla tamamen PV'ye yerleştirin. Suprahepatik inferior vena kava'yı (SHIVC) bloke edin, böylece sağ atriyuma venöz drenajı bloke edin. Arteriyel kanülü Liver Assist cihazının HA perfüzyon hattına bağlayın. Ardından, NMP'yi başlatın ve devreyi yerinde kurun.
- Karaciğeri hasat edin ve sürekli NMP altında organ rezervuarına aktarın. Karaciğer karın boşluğundan çıkarıldıktan hemen sonra, abdominal aort içine önceden yerleştirilmiş kanül aracılığıyla böbrekleri soğuk yıkayın ve böbrekleri geleneksel şekilde temin edin.
NOT: Tedarik sürecinde, ortak hepatik arteri (CHA) tamamen izole edin, sol gastrik arteri (LGA) bağlayın ve CA'yı abdominal aorta izole edin. HA aksesuarı söz konusu olduğunda, NMP başlamadan önce arteri yerinde atlayın.
3. Donör karaciğerin iskemi olmadan korunması
- Karaciğeri perfüzyon cihazına aktarın. Karaciğer organ rezervuarına taşındığında kaval kanülünü hemen çıkarın. Allogreft revaskülarizasyonuna kadar sürekli ex situ NMP karaciğer grefti.
- PV perfüzyon basıncını, 500 mL/dk'dan daha yüksek bir hedef akış hızı ile 6–10 mmHg'ye ayarlayın. HA basıncını 50–60 mmHg'ye ayarlayın ve hedeflenen akış hızı 150 mL/dk'dan daha yüksek. NMP sırasında, perfüzyon parametrelerinin stabil olduğundan emin olun ve basıncı ve akış hızını uygun bir aralıkta izleyin.
- Karaciğer ve kan damarlarındaki gereksiz dokuları çıkarın. SHIVC ve IHIVC'yi sızıntılara karşı incelemek için genel IVC'yi geçici olarak bloke edin. Dehidrasyonu önlemek için kuru yüzeyleri ıslak steril gazlı bezle örtün.
- Safra tüpünü 15 mL'lik bir toplama kabına toplayın. Safranın serbestçe akmasını sağlamak için safra drenajının ağzını karaciğerin altına yerleştirin. Safra üretim miktarını kaydedin ve her 30 dakikada bir biyokimyasal parametreleri izleyin.
- Her 10-20 dakikada bir kan gazı analizi için bir perfüzyon örneği (0,5 mL), her 30 dakikada bir karaciğer fonksiyon testleri (3 mL) alın ve biyokimyasal parametreleri buna göre izleyin.
- Karaciğerin canlılığını, kan gazı analizi ve perfüzatın karaciğer fonksiyon testleri ve daha önce bildirildiği gibi safra biyokimyasal parametreleri ile değerlendirin2.
NOT: Hasta güvenliği için, alıcı cerrahi prosedürlerine başlamadan önce NMP sırasında greft canlılığını onaylayın. Gerekirse vasküler direnci azaltmak için 1 mL papaverin ekleyin.
4. Donör karaciğerin iskemi içermeyen implantasyonu
- Konvansiyonel bir teknik kullanarak alıcının hastalıklı karaciğerini rezeke edin. Donör IHIVC'yi 32-34 Fr kaval kanülü ile yeniden kanüle edin, hastalıklı karaciğeri çıkarın ve SHIVC'yi bir kelepçe ile bloke edin. Daha sonra, donör karaciğeri rezervuardan alıcının karın boşluğuna taşıyın, böylece yerinde bir NMP devresi yeniden kurulabilir.
- Donör SHIVC'yi alıcı muadillerine 3–0 emilmeyen polipropilen sütürler kullanarak bi-kaval veya piggy-back tekniği ile dikin.
- Donör PV ve HA'yı alıcının muadillerine sırasıyla 5-0 ve 7-0 emilmeyen polipropilen sütürler kullanarak uçtan uca bir şekilde dikin. Bu anastomozları allogreftin sürekli NMP'si altında gerçekleştirin, çünkü hem HA hem de PV doğada hem doğal hem de yapay dallar içerir.
- Reperfüzyondan önce karaciğer biyopsi örneğini toplayın. Daha sonra, karaciğer için doğal ikili kan akışını yeniden sağlamak için PV ve HA üzerindeki kelepçeleri serbest bırakın. Aynı zamanda, HA ve PV kanülünün çıkarılmasından sonra NMP'yi durdurun. Daha sonra, karaciğer formu IHIVC kanülü içindeki yaklaşık 200 mL perfüzatı yıkayın. IHIVC kanülünü bloke edin ve SHIVC üzerindeki kelepçeyi serbest bırakın. Anhepatik faz sona erdi. Tekrar mikrobiyal kültür için bir perfüzat örneği (8 mL) alın.
- SA veya GDA'daki kanüllerin çıkarılması ve damarın interpozisyonu. Donör SA veya GDA'yı ve interpozisyon damarını bağlayın. IHIVC'deki kanülü geri çekin ve donörün IHIVC'sini alıcı IHIVC'ye (bi-caval) anastomoz edin veya cerrahi prosedüre göre bağlayın (piggy-back). Safra drenaj kanülünün geri çekilmesinden sonra ortak safra kanalı örneğini tekrar toplayın. Boşaltma tüpü çekildikten sonra vericinin ortak safra kanalını alıcının ortak safra kanalına uçtan uca bir şekilde anastomoz edin.
- Titiz hemostaz işleminden sonra karaciğer biyopsi örneğini tekrar toplayın. Rutin prosedürde karın duvarını kapatın.
NOT: İmplantasyon işlemi sırasında, bükülmeyi veya bükülmeyi önlemek için portalı ve arteriyel kanülü yakından izleyin ve HA ve PV'nin kan beslemesini sağlamak için akış hızı parametrelerini gerçek zamanlı olarak inceleyin. Akış hızının karaciğer için yeterli olduğundan emin olmak için gerektiğinde perfüzyon basıncını hafifçe artırın. SHIVC, PV veya IHIVC'nin anastomozu sırasında, venöz akışın cerrahi sonrası tıkanmasını önlemek için venöz kütüğü mümkün olduğunca kısaltın.
Sonuçlar
Nisan 2018'de, beyin ölümü gerçekleşen 66 yaşındaki bir erkek donör, bu tür donörlerde greft kaybı riskinin yüksek olması nedeniyle yerel nakil merkezleri tarafından dikkate alınmadı. Satın alma sırasında karaciğerin atılmasının nedenleri, ileri yaş ve orta sertlikte makroskopik görünüm, yuvarlak karaciğer kenarları ve suboptimal karaciğer grefti perfüzyonu ile birlikte hipertansiyon, hipertansif kalp hastalığı ve aşağıdaki ilişkili faktörleri içeren majör donör komorbiditeleriydi: hipernatremi (sodyum, 156 mmol/L) ve amin uygulaması ihtiyacı ile hemodinamik instabilite (dopamin, 1.5 μg/kg/dk, noradrenalin, 0.12 μg/kg/dk). İnsan donör karaciğer greftlerinin normemik perfüzyonu, sunulan protokolde tarif edildiği gibi 5 saat boyunca gerçekleştirildi. Karaciğer greftinin kalitesini değerlendirmek için karaciğer perfüzyonunun makroskopik homojenliği değerlendirildi. (Şekil 1A-D). Karaciğerin hemodinamiği de arteriyel ve portal akışlardaki değişiklikler izlenerek incelenmiştir. Perfüzyon sırasında karaciğer greftlerinin stabil hemodinamiği gözlendi (Şekil 2A). Arteriyel perfüzyon sıvısından toplanan perfüzat örneklerinin kan gazı analizi, perfüzyon sıvısındaki oksijenasyon durumunu izlemek için kullanıldı. 400 mL/dk akış hızındaO2 ve hava karışımı (%30O2) ile oksijenasyon, %100'lük sürekliO2 doygunluğu ile sonuçlandı. Şekil 2B , deneyimlerimize göre perfüzyon sıvısının oksijenlenmesini ve ardından karbondioksitin ekstraksiyonunu göstermektedir. Özellikle, perfüzat, tüm perfüzyon işlemi boyunca fizyolojik bir pH'ı korudu. Laktat seviyeleri daha sonra hızla azaldı ve 2.5 saat NMP'de normaldi (Şekil 2C). Toplam bilirubin miktarlarındaki bir artış, NMP sırasında üretilen safranın kalitesinde bir iyileşmeyi temsil etmiştir (Şekil 2D).
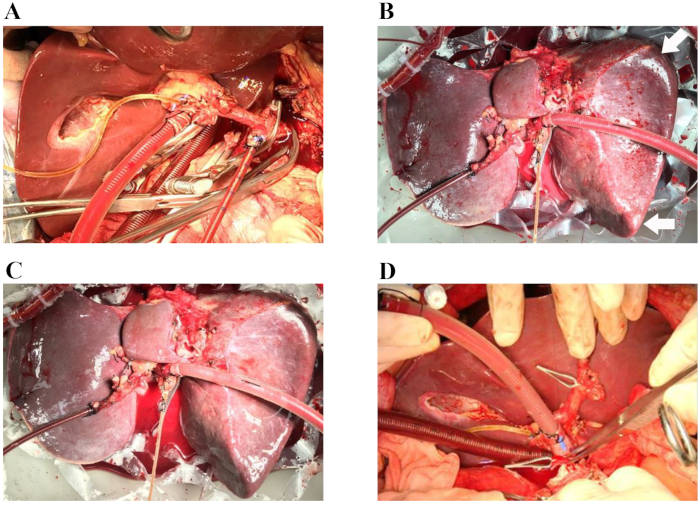
Şekil 1: İskemi içermeyen karaciğer transplantasyonunun temsili prosedürleri. (A) Arteriyel kanül dalak arterine yerleştirilir ve venöz kanül portal ven yamasına yerleştirilir. Safra kanalı silikon biliyer kateter ile kanüle edilir. (B) Normotermik makine perfüzyonunun başlamasından altmış dakika sonra. Oklar: yuvarlak karaciğer kenarları. (C) Normotermik makine perfüzyonunun başlamasından dört saat sonra. (D) Donör karaciğer alıcıya implante edilir (suprahepatik vena kava anastomozu tamamlanır). Ameliyat sırasında, karaciğer için steril nemli bir ortam sağlamak için organ odası şeffaf olmayan bir örtü ile kaplanır (bu resimlerde gösterilmemiştir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
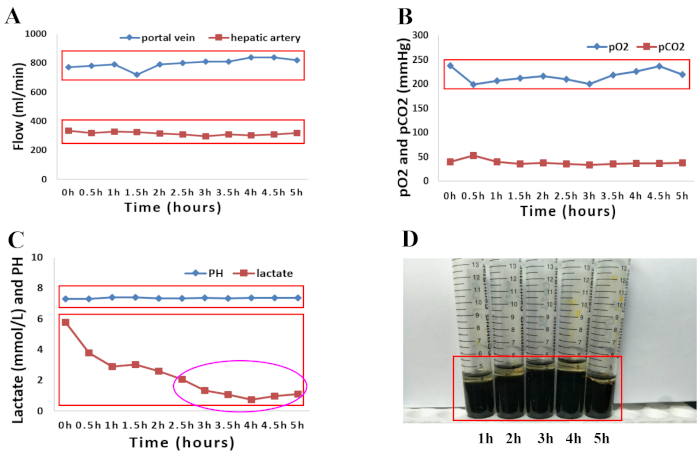
Şekil 2: 5 saatlik normotermik makine perfüzyonu sırasında hem perfüzyon sıvısının hem de safranın perfüzyon parametrelerinin grafiksel sunumu. (A) Arteriyel ve portal akıştaki değişiklikler. (B) 5 saatlik normotermik perfüzyon sırasında oksijenasyon özelliklerinin ve pCO2'nin evrimi. (C) 5 saatlik normotermik perfüzyon sırasında pH ve laktat seviyeleri. (D) Makine perfüzyonu sırasında alınan safra örneklerinde artan bilirubin miktarları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu IFLT tekniği, IRI'den tamamen kaçınmak için kurulmuştur. Bu makale, organ alımından ex situ korumaya ve implantasyona kadar adım adım bir IFLT protokolü sağlar.
NMP'ye dayalı olarak IFLT, tedarik ve sebattan implantasyona kadar greftlere kesintisiz kan ve oksijen kaynağı sağlar. Çok sayıda çalışma, NMP'nin statik soğuk korumaya kıyasla IRI'yi azaltmada, organ canlılığını iyileştirmede ve greft hasarını onarmada önemli avantajlara sahip olduğunu göstermiştir12. Cerrahi tekniklerin yeniliği ve çeşitli organlarda NMP teknolojisinin ilerlemesi sayesinde, iskemi içermeyen organ nakli (IFOT) kavramının tüm katı organ nakillerini kapsaması, organ naklinin erken ve uzun vadeli prognozunu önemli ölçüde iyileştirmesi ve marjinal organların kullanımını en üst düzeye çıkarması beklenmektedir. IFOT teknolojisi şu anda sadece beyin ölümü sonrası bağıştan (DBD) türetilen organ naklinde kullanılmaktadır, ancak aynı zamanda makul damar entübasyonu ve perfüzyon parametreleri seçilerek göreceli canlı organ bağışı (LDOD) nakli için de uygulanabilir. Kardiyak ölüm sonrası bağış (DCD) iki kategoriye ayrılabilir: DCD'nin manipülasyonu (beyin ölümü kriterlerini karşılamayan mekanik ventilasyonu olan hastalarda yaşam desteğinin kasıtlı olarak geri çağrılmasından sonra durduruldu, cDCD) ve daha az ölçüde kontrolsüz DCD (kardiyak arrest sonrası başarısız resüsitasyon, uDCD)12. Organ sıcak iskemi hasarının meydana geldiği uDCD türevi greftlerde, organ toplanmasından önce bölgesel NMP hızlı bir şekilde oluşturulmalıdır. Bu durumda, teknik IRI'yi tamamen önleyemese de, organdaki hasar maksimum düzeyde onarılabilir. Özellikle, cDCD türevi greftler çoğu ülkede yaygın olarak kullanılmaktadır. Bölgesel NMP teknolojisinin desteğiyle, IFOT, daha sonra IRI'nin ortaya çıkmasını önlemek için bu tür bağışlardan elde edilen organ nakillerine de uygulanabilir. Bir DCD organının IRI'si, DBD ve LDOD organlarınınkinden daha şiddetli olduğundan, bu tür bir organ muhtemelen IFOT'tan en fazla fayda sağlayacaktır. Bu nedenle, IFOT, hemen hemen tüm bağış kaynaklarından organ nakli için umut verici bir yöntemdir ve büyük uygulama beklentileri araştırmayı garanti eder.
Bu prosedür sırasında dikkat edilmesi gereken birkaç husus vardır. Tedarik sürecinde, CHA tamamen ayrışır, LGA bağlanır, çölyak gövdesi abdominal aorta serbest bırakılır ve varyant aksesuar HA'nın vücutta yeniden yapılandırılması gerekir.
Makine perfüzyonu kullanılarak yapılan koruma işlemi sırasında, perfüzyon parametrelerinin stabil olması sağlanır ve HA ve PV'nin basıncı ve akış hızı fizyolojik durum aralığında kontrol edilir. İmplantasyon sırasında akışın karaciğeri beslemek için yeterli olmasını sağlamak için perfüzyon basıncı hafifçe arttırılabilir.
Donör karaciğer implantasyonu işlemi için, PV ve HA'nın entübasyonuna dikkat edilmelidir. Arteriyel ve portal kan akışının sağlanmasını sağlamak için akış parametreleri gerçek zamanlı olarak izlenmelidir. Donörden alıcıya SHIVC ve PV anastomoz edildiğinde, gereksiz ve bükülmüş damarlardan kaçınılmalıdır.
Nakil süreci boyunca sürekli bir kan temini ve organ perfüzyonu sırasında perfüzyon sıvısına ek ajanlar ekleme fırsatı, nakilden önce organ kalitesini değerlendirme ve iyileştirme potansiyeli sunar. Bu nedenle, bu yöntem nakil sonuçlarını önemli ölçüde iyileştirebilir ve nakil için mevcut organ sayısını artırabilir.
Açıklamalar
Yazarların beyan etmek için rekabet eden çıkarları yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (81401324 ve 81770410), Guangdong Eyaleti Uluslararası Bilim ve Teknoloji İşbirliği Üssü (Organ Nakli) (2015B050501002), Seçkin Genç Akademisyenler için Guangdong Eyaleti Doğa Bilimleri Fonları (2015A030306025), Guangdong Eyaletinde Üst Düzey Yetenek Eğitimi için Özel Destek Programı (2015TQ01R168), Guangzhou Pearl River Nova Programı (201506010014) ve Gençler için Bilimsel Program tarafından desteklenmiştir. Sun Yat-sen Üniversitesi (16ykpy05), Çin öğretmenleri.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10% calcium gluconate | Hebei Tiancheng Pharmaceutical Co, Ltd | 1S181124101 | 30 mL |
| 25% magnesium sulphate | Hebei Tiancheng Pharmaceutical Co, Ltd | H20033861 | 3 mL |
| 5% sodium bicarbonate | Huiyinbi Group Jiangxi Dongya Pharmaceutical Co, Ltd | H36020283 | The amount depends on the pH |
| Cefoperazone sodium and sulbactam sodium | Pfizer | H20020597 | 1.5 g |
| Compound Amino Acid Injection | Guangdong Litai Pharmaceutical Co., Ltd | H20063797 | 250 mL |
| Crossed-matched leucocyte-depleted washed red cells | Guangzhou Blood Center | H20033739 | 1300 mL |
| Heparin | Chengdu Hepatunn Pharmaceutical Co., Ltd | H51021209 | 37500 U |
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Metronidazole | Shanghai Baxter Healthcare Co., Ltd. | H20003301 | 0.5 g |
| scalp acupuncture | Wuhan W.E.O.Science & Technology Development Co., Ltd | WEO-JX-32B-5.0 0.7*25mm | Bile duct cannula |
| Succinylated gelatinor | B. Braun Medical Suzhou Co., Ltd | H20113119 | 1400 mL |
Referanslar
- Hanidziar, D., Koulmanda, M. Towards cytoprotection in the peritransplant period. Seminars in Immunology. 23 (3), 209-213 (2011).
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion-from mechanism to translation. Nature Medicine. 17 (11), 1391-1401 (2011).
- Ravikumar, R., Leuvenink, H., Friend, P. J. Normothermic liver preservation: a new paradigm. Transplant International. 28 (6), 690-699 (2015).
- Jayant, K., Reccia, I., Shapiro, A. M. J. Normothermic ex-vivo liver perfusion: where do we stand and where to reach. Expert Review of Gastroenterology & Hepatology. 12 (10), 1045-1058 (2018).
- Hessheimer, A. J., Riquelme, F., Fundora-Suarez, Y., Garcia Perez, R., Fondevila, C. Normothermic perfusion and outcomes after liver transplantation. Transplantation Reviews (Orlando, Fla). 33 (4), 200-208 (2019).
- Weissenbacher, A., Vrakas, G., Nasralla, D., Ceresa, C. D. L. The future of organ perfusion and re-conditioning. Transplant International. 32 (6), 586-597 (2019).
- von Horn, C., Minor, T. Modern concepts for the dynamic preservation of the liver and kidneys in the context of transplantation. Pathologe. 40 (3), 292-298 (2019).
- Czigany, Z., et al. Machine perfusion for liver transplantation in the era of marginal organs-New kids on the block. Liver International. 39 (2), 228-249 (2019).
- Wettstein, D., et al. Machine perfusion: new opportunities in abdominal organ transplantation. Orvosi Hetilap. 159 (46), 1882-1890 (2018).
- Lai, Q. R. N., et al. Role of perfusion machines in the setting of clinical liver transplantation: A qualitative systematic review. Clinical Transplantation. 32 (8), 11 (2018).
- He, X., et al. The first case of ischemia-free organ transplantation in humans: A proof of concept. American Journal of Transplantation. 18 (3), 737-744 (2017).
- Jassem, W., et al. Normothermic Machine Perfusion (NMP) inhibits proinflammatory responses in the liver and promotes regeneration. Hepatology. 70 (2), 682-695 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır