Method Article
Avoiding Ischemia Reperfusion Injury in Liver Transplantation(간 이식에서 허혈 재관류 손상 방지)
* 이 저자들은 동등하게 기여했습니다
요약
여기에 제시된 프로토콜은 기증자에서 수혜자에게 인간 간의 현장 정상 보온 기계 관류(37°C) 하에서 허혈이 없는 단계별 간 이식 프로토콜을 제공하는 프로토콜입니다.
초록
현재 현장 기계 관류는 기존의 정적 냉 보존(0–4 °C)보다 기증자 장기에 더 나은 보존 방법을 제공하는 급성장하는 기술입니다. 조달 및 보존에서 이식에 이르기까지 기계 관류를 사용하여 장기에 지속적으로 혈액을 공급하면 허혈, 재관류 손상을 완전히 예방할 수 있으며 이식 전에 기증자 간의 현장 기능 평가를 수행할 수 있습니다. 이 원고에서는 현장 정상 보온선 기계 관류 장치를 사용하여 간 동맥을 통한 박동 관류와 인간 기증자 간에서 수혜자까지 문맥을 지속적으로 관류하는 단계별 허혈 없는 간 이식 프로토콜을 제공합니다. 관류 기간에는 간의 대사 활성을 평가하기 위해 관류액의 생화학적 분석을 수행하고, 손상 정도를 평가하기 위해 간 생검도 수행합니다. 허혈이 없는 간 이식은 허혈-재관류 손상을 피할 수 있는 유망한 방법이며 잠재적으로 이식을 위한 기증자 풀을 증가시킬 수 있습니다.
서문
허혈 재관류 손상(IRI)은 장기 이식에서 잘 알려져 있고 널리 퍼진 합병증입니다. 명백한 비면역학적 사건은 좋지 않은 이식 결과와 이식 기능 지연으로 이어지며, 이는 장기 부전, 재이식 및 수혜자 사망의 높은 비율과 관련이 있습니다1. 기존의 장기 냉장 보관(CCS)은 이전에 신진대사를 늦추는 고전적인 방법으로 확인되었지만 진행성 기능 장애 및 세포 무결성 손상을 예방하는 데 영향을 미치지 않습니다. 또한, 백혈구 축적은 재관류 단계에서 활성 산소 대사 산물에 의해 유도됩니다. 이러한 모든 생물학적 과정은 지방간 및 65세 이상 기증자의 이식편과 같은 확장 기준 기증자(ECD) 이식편을 사용할 때 훨씬 더 관련성이 높아집니다. 이러한 ECD 이식편은 손상 및 기타 해로운 영향, 특히 CCS2의 영향에 더 취약합니다. 기증자의 장기를 보존하기 위한 정상온열 현장 간 기계 관류 기술은 지난 수십 년 동안 큰 발전을 이루었으며 임상 실습에서 전적으로 실현 가능하다3. 기증자 장기에서 온열 관류 기술의 안전성과 실행 가능성은 전임상 연구에서 평가되었으며, 일부 연구 그룹은 동물 모델에서 새로운 유형의 관류액 및 재가온 요법을 설계했습니다. 기증자의 간을 보존하기 위한 온난관류에 대한 일부 임상시험이 동아시아, 유럽 및 북미에서 시작되었다 4,5.
NMP(Normothermic machine perfusion)는 장기가 지속적으로 공급되는 산소와 영양소로 항상성을 달성할 수 있는 대사 활성 시나리오를 촉진합니다. 이식편의 신진대사가 활성화되고, 관류액의 생화학적 지표 또는 관류된 장기의 생검에 따라 기증자 장기가 수혜자에게 이식하기에 적합한지 여부를 관류 중에 판단할 수 있습니다. 보존 기간 동안 사용 가능한 매개변수는 또한 외과의가 이식편을 치료하거나 ECD 이식편을 복원할 수 있는 수단을 제공합니다 6,7.
적혈구는 가장 자주 사용되는 산소 운반체입니다. 항생제, 항혈전제 및 영양소를 포함한 다른 필수 성분도 관류액에 포함됩니다8. 현재의 관행에서는 간을 채취한 후 0-4°C 용액으로 보존하고 백테이블로 준비합니다. 그런 다음 평가 및 복원을 위해 이미 준비된 NMP 장치에 몇 시간 동안 차가운 간을 관류합니다. 그러나 간은 NMP 시작 시와 이식 후에 IRI의 이중 공격을 겪지만, 간은 NMP 과정에서 어느 정도 보호되고 복구됩니다 9,10. 따라서 우리는 프로세스를 재평가하고 두 번의 IRI 공격을 피한 것에 대해 반영하려고 했습니다. 우리는 간에 지속적인 혈액 공급이 제공된다면 IRI를 피할 수 있다는 가설을 세웠다. 이 가설을 검증하기 위해 Liver-Assist 장치를 사용하여 기존의 이중 변환 프로토콜을 중단 없는 간동맥(HA) 및 문맥(PV) 공급으로 변경했습니다. 이 새로운 이식 절차는 허혈 없는 간 이식(IFLT)으로 명명되었습니다. IFLT의 첫 번째 사례는 이전에 발표된 바 있으며 장기 이식 전문가들의 상당한 관심을 끌고 있다11.
맥동성 간 동맥 흐름과 지속적인 PV 공급을 제공하는 두 개의 로터리 펌프가 관련 압력에 의해 흐름이 제어되는 관류 장치에 사용되었습니다. 이 시스템은 압력에 의해 제어되며 간을 통한 흐름이 간의 저항에 따라 자동으로 조정될 수 있도록 합니다. 관류물의 산소화 및 CO2 제거는 두 개의 중공사막 산소공급기에 의해 조절됩니다. 다양한 유형의 기계 관류(10°C에서 37°C까지)에 따라 다른 온도를 설정할 수 있습니다. 관류 과정에서 계기판에서 실시간 압력, 온도, 유량 및 저항 지수를 모니터링하고 기록할 수 있습니다. 간 보조는 운반할 수 있는 장치가 아닙니다. 따라서 IFLT에 사용된 기증자는 이식센터로 이송되어야 합니다.
이 기사는 현장 NMP 장치를 사용하여 HA에 박동 관류를 제공하고 인간 기증자 간 조달에서 이식에 이르기까지 PV의 지속적인 관류를 유지하는 단계별 IFLT 프로토콜을 제공하는 것을 목표로 했습니다.
프로토콜
이 프로토콜은 중국 광저우에 있는 Sun Yat-sen University의 First Affiliated Hospital의 윤리 위원회에서 검토 및 승인되었습니다. 모든 참가자로부터 정보에 입각한 동의를 얻었습니다. 인간 참가자를 대상으로 한 연구의 모든 절차는 1964년 헬싱키 선언과 그 이후의 수정 또는 개정에 따라 수행되었습니다.
1. 관류 용액 및 장치의 준비
참고: 이 프로토콜에 따라 NMP용으로 준비된 관류 용액의 총 부피는 이전에 보고된 바와 같이약 3,000mL이며 1이고 최종 헤모글로빈 농도는 6–10g/L입니다. 관류 용액의 성분은 표 1에 나열되어 있습니다.
- 산소공급기 상단의 커넥터를 통해 인공 간 보조 장치(재료 표)의 장기 저장소에 관류액의 구성 요소를 추가하고 파이프라인에서 모든 기포를 제거합니다.
- 화면에 표시되는 제조업체의 지침에 따라 정맥 펌프를 켭니다. 비슷한 방법으로 동맥 펌프를 켭니다. 장치 화면의 지시에 따라 압력을 Null로 설정합니다. 압력 버튼을 클릭하여 상온 기계적 관류의 전체 과정에서 HA 압력을 50–60mmHg 범위 내에서, PV 압력을 5–10mmHg 범위 내로 설정합니다.
- O2 와 공기 (30 % O2)의 혼합물을 사용하여 400 mL / min의 유속으로 산소화를 시작합니다. 관류 용액을 37 °C로 가열합니다.
- 장치를 프라이밍한 후(pO2, pCO2, pH 및 전해질이 정상 범위 내이고 온도가 37°C에 가까움) 미생물 배양(8mL), 혈액 가스 분석(0.5mL) 및 간 기능 검사(3mL)를 위한 동맥 관류 라인의 T-분기 파이프에서 관류액 용액 샘플을 얻고 그에 따라 생화학적 매개변수를 모니터링합니다.
알림: 관류액은 층류 수술실에서 사용하기 전에 신선하게 준비해야 합니다. 필요한 경우 중탄산염 또는 인슐린을 첨가합니다.
2. 허혈 없는 기증자 간 조달
- 복부 십자 절개 부위는 다음과 같이 실시합니다 : 흉골 노치에서 치골 교감까지 수직으로, 배꼽 수준에서 양쪽 옆구리까지 가로 방향으로 절개합니다. 폐 또는 심장 조달이 필요한 경우 흉골 절개술을 활용할 수 있습니다. 큰 C자형 견인기를 사용하여 노출을 제공하십시오.
- 복부 내장에 대한 자세한 검사를 수행합니다. 조직학적 관찰 및 임상 연구를 위해 간 생검 검체를 채취합니다. 정밀한 기술로 간을 움직이십시오.
- 담즙 배출을 위해 총담관에 캐뉼라를 놓고 낭포성 관을 결찰합니다. 조직학적 관찰 및 임상 연구를 위해 총담관 끝에서 전체 둘레 조직 샘플(너비: 3-5mm)을 자릅니다.
- 체강 동맥(CA), 위십이지장 동맥(GDA), 비장 동맥(SA), 하대정맥(IVC) 및 PV를 절개합니다. 8 Fr/12 Fr 동맥 캐뉼라를 GDA 또는 SA에 삽입합니다. CA에서 간으로 가는 동맥 공급이 중단되지 않는지 확인합니다.
- 3cm 길이의 오른쪽 외부 장골 정맥을 채취하고 삽입 정맥을 만들기 위해 PV를 부분적으로 막은 상태에서 종단 간 방식으로 혈관을 PV에 문합합니다.
- 32–34 Fr caval 캐뉼라를 IHIVC(infrahepatic inferior vena cava)에 배치하여 장치의 장기 저장소로 유출합니다. 직선 24 Fr 캐뉼라를 장치의 PV 관류 라인에 연결한 다음 삽입 정맥을 통해 PV에 완전히 삽입합니다. 간상하대정맥(SHIVC)을 차단하여 우심방으로의 정맥 배액을 차단합니다. 동맥 캐뉼러를 Liver Assist 장치의 HA 관류 라인에 연결합니다. 그런 다음 NMP를 시작하고 현장에서 회로를 설정합니다.
- 간을 적출하여 연속 NMP로 장기 저장소로 옮깁니다. 간을 복강에서 제거한 직후, 복부 대동맥 내의 미리 교체된 캐뉼라를 통해 신장을 냉찜하고 기존 방식으로 신장을 조달합니다.
참고: 조달 과정에서 총간동맥(CHA)을 완전히 분리하고, 좌측 위 동맥(LGA)을 결찰하고, CA를 복부 대동맥으로 분리합니다. 액세서리 HA의 경우 NMP가 시작되기 전에 동맥을 제자리에서 우회합니다.
3. 기증자 간의 허혈 없는 보존
- 간을 관류 장치로 옮깁니다. 간이 장기 저장소로 이동될 때 즉시 캐벌 캐뉼라를 제거하십시오. 지속적인 현장 NMP, 동종 이식편 혈관 재생까지 간 이식편.
- PV 관류 압력을 6–10mmHg로 설정하고 목표 유속을 500mL/분 이상으로 설정합니다. HA 압력을 50–60mmHg로 설정하고 목표 유속을 150mL/분보다 높게 설정합니다. NMP 동안 관류 매개변수가 안정적인지 확인하고 적절한 범위 내에서 압력과 유속을 모니터링합니다.
- 간과 혈관에서 불필요한 조직을 제거합니다. 전체 IVC를 일시적으로 차단하여 SHIVC 및 IHIVC의 누출을 검사합니다. 탈수를 방지하기 위해 젖은 멸균 거즈로 건조한 표면을 덮으십시오.
- 담즙 튜브를 15mL 수집 용기에 수집합니다. 담즙 배출구의 입구를 간 아래에 놓아 담즙이 자유롭게 흘러나올 수 있도록 합니다. 담즙 생성량을 기록하고 30분마다 생화학적 매개변수를 모니터링합니다.
- 10-20분마다 혈액 가스 분석을 위한 관류 샘플(0.5mL)을 확보하고 30분마다 간 기능 검사(3mL)를 실시하고 그에 따라 생화학적 매개변수를 모니터링합니다.
- 혈액 가스 분석 및 관류액의 간 기능 검사, 이전에 보고된 담즙 생화학적 매개변수를 통해 간의 생존 능력을 평가합니다2.
참고: 환자 안전을 위해 수혜자 수술 절차를 시작하기 전에 NMP 중 이식 생존력을 확인하십시오. 필요한 경우 파파베린 1mL를 첨가하여 혈관 저항을 줄입니다.
4. 기증자 간의 허혈 없는 이식
- 기존 기술을 사용하여 이식자의 병든 간을 절제합니다. 기증자 IHIVC를 32-34 Fr caval 캐뉼라로 재환형하고 병든 간을 제거하고 클램프로 SHIVC를 차단합니다. 그런 다음 기증자의 간을 저장고에서 수혜자의 복강으로 이동하여 NMP 제자리(in situ) 회로가 다시 확립될 수 있도록 합니다.
- bi-caval 또는 piggy-back 기법으로 3-0 비흡수성 폴리프로필렌 봉합사를 사용하여 기증자 SHIVC를 수혜자 상대에게 봉합합니다.
- 각각 5-0 및 7-0 비흡수성 폴리프로필렌 봉합사를 사용하여 기증자 PV와 HA를 수혜자의 상대에게 종단 간 방식으로 봉합합니다. HA와 PV는 모두 자연적으로 기본 및 인공 가지를 포함하므로 동종 이식편의 지속적인 NMP에서 이러한 문합을 수행합니다.
- 재관류 전에 간 생검 검체를 수집합니다. 그 후, 간에 대한 기본 이중 혈액 공급을 다시 설정하기 위해 PV 및 HA의 클램프를 해제합니다. 동시에 HA 및 PV 캐뉼라를 제거한 후 NMP를 중지하십시오. 그런 다음 간 형태 IHIVC 캐뉼라 내에서 약 200mL의 관류액을 씻어냅니다. IHIVC 캐뉼라를 차단하고 SHIVC의 클램프를 해제합니다. 무간 단계는 끝났습니다. 미생물 배양을 위해 관류액 샘플(8mL)을 다시 얻습니다.
- SA 또는 GDA에서 캐뉼러를 제거하고 정맥을 삽입합니다. 기증자 SA 또는 GDA 및 삽입 정맥을 결찰합니다. IHIVC에서 캐뉼라를 빼내고 기증자의 IHIVC를 수혜자 IHIVC(bi-caval)에 문합하거나 수술 절차에 따라 결찰(피기백)합니다. 담즙 배출 캐뉼라를 제거한 후 총담관 표본을 다시 수집합니다. 배액관을 뽑은 후 기증자의 총담관을 수혜자의 총담관에 종단 간 방식으로 아나스토모스합니다.
- 꼼꼼한 지혈 후 간 생검 검체를 다시 수집합니다. 일상적인 절차에서 복벽을 닫습니다.
알림: 이식 과정에서 포털과 동맥 캐뉼라를 면밀히 모니터링하여 뒤틀리거나 구부러지지 않도록 하고 실시간으로 유속 매개변수를 면밀히 조사하여 HA 및 PV의 혈액 공급을 보장합니다. 유속이 간에 충분한지 확인하기 위해 필요한 경우 관류 압력을 약간 높입니다. SHIVC, PV 또는 IHIVC를 문합하는 동안 수술 후 정맥 흐름의 막힘을 피하기 위해 정맥 그루터기를 최대한 줄이십시오.
결과
2018년 4월, 뇌사 상태에 빠진 66세 남성 기증자는 이식 손실의 위험이 높기 때문에 지역 이식 센터에서 고려하지 않았습니다. 조달 당시 간을 폐기한 이유는 고령, 중간 정도의 탄력, 둥근 간 가장자리 및 최적이 아닌 간 이식 관류와 함께 고혈압, 고혈압성 심장 질환 및 다음과 같은 관련 요인인 고나트륨혈증(나트륨, 156mmol/L) 및 아민 투여가 필요한 혈역학적 불안정성(도파민, 1.5 μg/kg/min, 노르아드레날린, 0.12 μg/kg/min). 인간 기증자 간 이식편의 정상 관류는 제시된 프로토콜에 설명된 대로 5시간 동안 수행되었습니다. 간 관류의 거시적 균질성을 평가하여 간 이식편의 질을 평가했습니다. (그림 1A–D). 간의 혈역학은 또한 동맥 및 문맥 흐름의 변화를 모니터링하여 연구되었습니다. 관류 중에 간 이식편의 안정적인 혈류역학이 관찰되었습니다(그림 2A). 동맥 관류액에서 채취한 관류액 샘플의 혈액 가스 분석을 사용하여 관류액의 산소화 상태를 모니터링했습니다. 400 mL/분의 유속에서O2 와 공기(30%O2)의 혼합물로 산소화한 결과, 100%의 연속O2 포화가 이루어졌습니다. 그림 2B 는 우리의 경험에서 관류 유체의 산소화와 그에 따른 이산화탄소 추출을 보여줍니다. 특히, 관류액은 전체 관류 과정에서 생리학적 pH를 유지했습니다. 이후 젖산 수치는 급격히 감소하여 NMP 2.5시간에서 정상이었습니다(그림 2C). 총 빌리루빈의 양이 증가하면 NMP 동안 생성되는 담즙의 품질이 향상되었음을 나타냅니다(그림 2D).
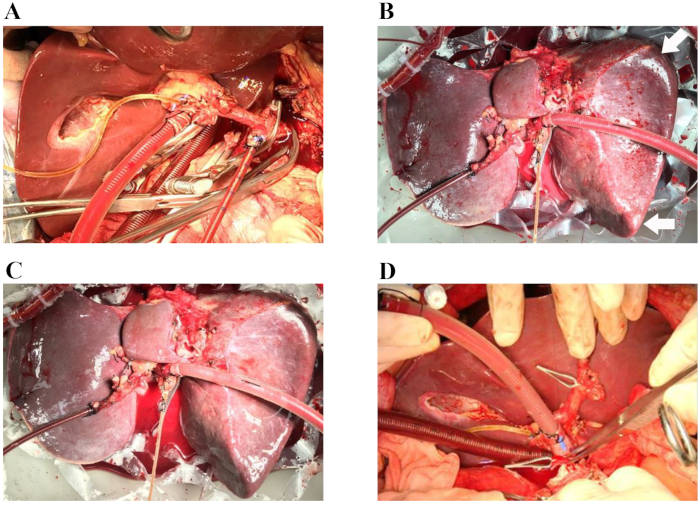
그림 1: 허혈 없는 간 이식의 대표적인 절차. (A) 동맥 캐뉼러는 비장 동맥에 삽입되고 정맥 캐뉼라는 문맥 패치에 삽입됩니다. 담관은 실리콘 담도 카테터로 캐뉼레이션됩니다. (B) 정상온열 기계 관류 시작 후 60분. 화살표 : 둥근 간 가장자리. (C) 정상온열 기계 관류 시작 후 4시간 후. (D) 기증자의 간이 수혜자에게 이식됩니다(상간대정맥 문합이 완료됩니다). 수술 중에는 간을 위한 무균 습한 환경을 유지하기 위해 장기실이 투명하지 않은 덮개로 덮여 있습니다(이 이미지에는 표시되지 않음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
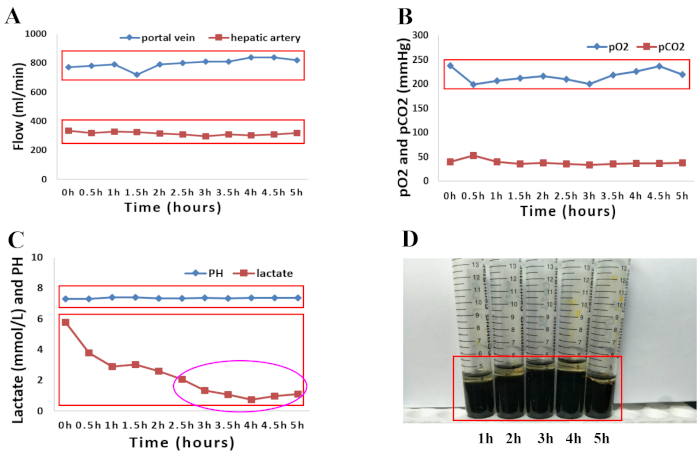
그림 2: 정상온열 기계 관류 5시간 동안 관류액과 담즙 모두의 관류 매개변수를 그래픽으로 표시 한 것.(A) 동맥 및 문맥 흐름의 변화. (B) 정상 난열 관류 5시간 동안 산소화 특성과 pCO2 의 진화. (C) 정상 난열 관류 5시간 동안의 pH 및 젖산 수준. (D) 기계 관류 중 채취한 담즙 샘플에서 빌리루빈의 양 증가. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 IFLT 기술은 IRI를 완전히 피하기 위해 확립되었습니다. 이 기사는 장기 조달, 현장 보존에서 이식에 이르기까지 단계별 IFLT 프로토콜을 제공합니다.
NMP를 기반으로 하는 IFLT는 조달 및 인내에서 이식에 이르기까지 이식편에 혈액과 산소를 중단 없이 공급합니다. 수많은 연구에서 NMP가 정적 냉기 보존에 비해 IRI를 감소시키고, 장기 생존력을 개선하고, 이식편 손상을 복구하는 데 상당한 이점이 있음을 보여주었습니다12. 수술 기술의 혁신과 다양한 장기에서 NMP 기술의 발전을 통해 허혈 없는 장기 이식(IFOT)의 개념이 모든 고형 장기 이식으로 확장되어 장기 이식의 조기 및 장기 예후를 크게 개선하고 가장자리 장기의 사용을 극대화할 것으로 예상됩니다. IFOT 기술은 현재 뇌사후 기증(DBD)에 의한 장기 이식에만 사용되고 있으나, 합리적인 혈관 삽관 및 관류 매개변수를 선택하여 상대생체 장기 기증(LDOD)의 이식에도 적용할 수 있습니다. 심사(DCD) 후 기증은 두 가지 범주로 나눌 수 있다: DCD 조작(뇌사 기준을 충족하지 않는 기계적 환기 환자의 생명 유지 장치를 의도적으로 회수한 후 중단, cDCD)과 조절되지 않는 DCD(심정지 후 소생술 실패, uDCD)12. 장기 온열 허혈 손상이 발생한 uDCD 유래 이식편에서는 장기 적출 전에 국소 NMP를 신속하게 확립해야 합니다. 이 경우, 이 기법이 IRI를 완전히 피할 수는 없지만 장기의 손상은 최대한 복구할 수 있습니다. 특히, cDCD 유래 이식편은 대부분의 국가에서 널리 사용됩니다. 지역 NMP 기술의 지원으로 IFOT는 이러한 기증에서 파생된 장기 이식에도 적용하여 IRI의 후속 발생을 방지할 수 있습니다. DCD 장기의 IRI는 DBD 및 LDOD 장기의 IRI보다 더 심각하기 때문에 이러한 유형의 장기는 IFOT의 이점을 가장 많이 얻을 수 있습니다. 따라서 IFOT는 거의 모든 기증 출처에서 장기 이식을 위한 유망한 방법이며 그 훌륭한 응용 전망은 탐색을 필요로 합니다.
이 절차를 수행하는 동안 알아야 할 몇 가지 측면이 있습니다. 조달 과정에서 CHA는 완전히 해리되고, LGA는 결찰되며, 셀리악 몸통은 복부 대동맥으로 분리되고, 변형 액세서리 HA는 신체에서 재건되어야 합니다.
기계 관류를 사용한 보존 과정에서 관류 매개변수가 안정적으로 보장되고 HA 및 PV의 압력과 유량이 생리적 상태 범위에서 제어됩니다. 관류 압력은 이식 중에 간에 공급하기에 충분한 유량을 보장하기 위해 약간 증가시킬 수 있습니다.
기증자 간 이식 과정에서는 PV와 HA의 삽관에 주의를 기울여야 합니다. 동맥 및 문맥 혈류의 공급을 보장하기 위해 흐름 매개변수를 실시간으로 모니터링해야 합니다. donor-to-recipient SHIVC 및 PV를 문합할 때 중복되고 꼬인 혈관을 피해야 합니다.
이식 과정 전반에 걸쳐 지속적인 혈액 공급과 장기 관류 중 관류액에 추가 제제를 추가할 수 있는 기회는 이식 전에 장기 품질을 평가하고 개선할 수 있는 잠재력을 제공합니다. 따라서 이 방법은 이식 결과를 상당히 개선하고 이식에 사용할 수 있는 장기의 수를 늘릴 수 있습니다.
공개
저자는 선언할 경쟁 이해관계가 없습니다.
감사의 말
본 연구는 중국국가자연과학재단(81401324 및 81770410), 광둥성 과학기술국제협력기지(장기이식)(2015B050501002), 광둥성 저명한 청년학자를 위한 자연과학기금(2015A030306025), 광둥성 고급 인재 양성을 위한 특별 지원 프로그램(2015TQ01R168), 광저우 주강 신성 프로그램(201506010014), 청년 과학 프로그램의 지원을 받았다 중국 Sun Yat-sen University (16ykpy05) 교사.
자료
| Name | Company | Catalog Number | Comments |
| 10% calcium gluconate | Hebei Tiancheng Pharmaceutical Co, Ltd | 1S181124101 | 30 mL |
| 25% magnesium sulphate | Hebei Tiancheng Pharmaceutical Co, Ltd | H20033861 | 3 mL |
| 5% sodium bicarbonate | Huiyinbi Group Jiangxi Dongya Pharmaceutical Co, Ltd | H36020283 | The amount depends on the pH |
| Cefoperazone sodium and sulbactam sodium | Pfizer | H20020597 | 1.5 g |
| Compound Amino Acid Injection | Guangdong Litai Pharmaceutical Co., Ltd | H20063797 | 250 mL |
| Crossed-matched leucocyte-depleted washed red cells | Guangzhou Blood Center | H20033739 | 1300 mL |
| Heparin | Chengdu Hepatunn Pharmaceutical Co., Ltd | H51021209 | 37500 U |
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Metronidazole | Shanghai Baxter Healthcare Co., Ltd. | H20003301 | 0.5 g |
| scalp acupuncture | Wuhan W.E.O.Science & Technology Development Co., Ltd | WEO-JX-32B-5.0 0.7*25mm | Bile duct cannula |
| Succinylated gelatinor | B. Braun Medical Suzhou Co., Ltd | H20113119 | 1400 mL |
참고문헌
- Hanidziar, D., Koulmanda, M. Towards cytoprotection in the peritransplant period. Seminars in Immunology. 23 (3), 209-213 (2011).
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion-from mechanism to translation. Nature Medicine. 17 (11), 1391-1401 (2011).
- Ravikumar, R., Leuvenink, H., Friend, P. J. Normothermic liver preservation: a new paradigm. Transplant International. 28 (6), 690-699 (2015).
- Jayant, K., Reccia, I., Shapiro, A. M. J. Normothermic ex-vivo liver perfusion: where do we stand and where to reach. Expert Review of Gastroenterology & Hepatology. 12 (10), 1045-1058 (2018).
- Hessheimer, A. J., Riquelme, F., Fundora-Suarez, Y., Garcia Perez, R., Fondevila, C. Normothermic perfusion and outcomes after liver transplantation. Transplantation Reviews (Orlando, Fla). 33 (4), 200-208 (2019).
- Weissenbacher, A., Vrakas, G., Nasralla, D., Ceresa, C. D. L. The future of organ perfusion and re-conditioning. Transplant International. 32 (6), 586-597 (2019).
- von Horn, C., Minor, T. Modern concepts for the dynamic preservation of the liver and kidneys in the context of transplantation. Pathologe. 40 (3), 292-298 (2019).
- Czigany, Z., et al. Machine perfusion for liver transplantation in the era of marginal organs-New kids on the block. Liver International. 39 (2), 228-249 (2019).
- Wettstein, D., et al. Machine perfusion: new opportunities in abdominal organ transplantation. Orvosi Hetilap. 159 (46), 1882-1890 (2018).
- Lai, Q. R. N., et al. Role of perfusion machines in the setting of clinical liver transplantation: A qualitative systematic review. Clinical Transplantation. 32 (8), 11 (2018).
- He, X., et al. The first case of ischemia-free organ transplantation in humans: A proof of concept. American Journal of Transplantation. 18 (3), 737-744 (2017).
- Jassem, W., et al. Normothermic Machine Perfusion (NMP) inhibits proinflammatory responses in the liver and promotes regeneration. Hepatology. 70 (2), 682-695 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.