Method Article
肝移植における虚血再灌流障害の回避
* これらの著者は同等に貢献しました
要約
ここで提示されるのは、ドナーからレシピエントへのヒト肝臓のex situ常温機械灌流(37°C)の下で段階的な虚血のない肝移植プロトコルを提供するためのプロトコルです。
要約
現在、ex situマシン灌流は、従来の静的低温保存(0〜4°C)よりも優れたドナー臓器の保存方法を提供する急成長している技術です。調達と保存から移植まで、機械灌流を使用して臓器に継続的に血液を供給することで、虚血再灌流障害の完全な予防が促進され、移植前にドナーの肝臓をその場で機能評価することができます。この原稿では、肝動脈を介した拍動性灌流とヒトドナー肝臓からレシピエントへの門脈の連続灌流にex situ常温機械灌流装置を使用する、段階的な虚血のない肝移植プロトコルを提供します。灌流期には、肝臓の代謝活性を評価するために灌流液の生化学的分析が行われ、損傷の程度を評価するために肝生検も行われます。虚血のない肝移植は、虚血再灌流障害を回避するための有望な方法であり、移植のためのドナープールを増加させる可能性があります。
概要
虚血再灌流障害(IRI)は、臓器移植におけるよく知られた広範な合併症です。明らかな非免疫学的事象は、移植片の転帰不良と移植片機能の遅延につながり、これらは臓器不全、再移植、およびレシピエントの死亡の割合が高いことに関連しています1。従来の臓器の冷蔵保存(CCS)は、代謝を遅らせる古典的な方法として以前に特定されていましたが、進行性の機能障害や細胞の完全性への損傷を防ぐことには影響を与えません。さらに、再灌流期では活性酸素代謝物によって白血球の蓄積が誘導されます。これらの生物学的プロセスはすべて、脂肪肝や65歳以上のドナーからの移植片などの拡張基準ドナー(ECD)移植片を使用すると、さらに関連性が高まります。これらのECDグラフトは、特にCCS2による損傷やその他の有害な影響に対してより脆弱です。ドナー臓器を保存するための常温ex situ肝臓機械灌流の技術は、過去数十年で大きな進歩を遂げており、臨床診療3で完全に実現可能です。ドナー臓器における温灌流技術の安全性と実行可能性は、前臨床試験で評価されており、一部の研究グループは、動物モデルで新しいタイプの灌流と再加温戦術を設計しています。ドナーの肝臓を保存するための温灌流の臨床試験の一部は、東アジア、ヨーロッパ、北米で開始されています4,5。
ノーマザーミックマシン灌流(NMP)は、臓器が継続的に供給される酸素と栄養素で恒常性を達成できる代謝活性シナリオを促進します。移植片の代謝が活性化され、灌流中に、灌流液の生化学的指標や灌流臓器の生検により、ドナー臓器がレシピエントへの移植に適しているかどうかを判断することができます。保存期間中に利用可能なパラメータは、外科医が移植片を治療したり、ECD移植片を修復したりするための手段も提供します6,7。
赤血球は、最も頻繁に使用される酸素キャリアです。抗生物質、抗血栓剤、栄養素などの他のいくつかの必須成分も灌流剤に含まれています8。現在の診療では、肝臓が回収された後、肝臓は保存され、0-4...C溶液でバックテーブルが調製されます。次に、冷たくなった肝臓を、評価と回復のために、すでに準備されたNMP装置で数時間灌流されます。しかし、肝臓はNMPの開始時と移植後にIRIの二重発作を受けますが、肝臓はNMPプロセス中にある程度保護され修復されます9,10。したがって、プロセスを再評価し、2つのIRI攻撃の回避について反省することを試みました。IRIは、肝臓に継続的な血液供給が提供されれば回避できるという仮説を立てました。この仮説を検証するために、従来の二重変換プロトコルを、Liver-Assistデバイスを使用して中断のない肝動脈(HA)および門脈(PV)供給に変更しました。この新しい移植手順は、虚血のない肝移植(IFLT)と名付けられました。IFLTの最初の症例は以前に発表されており、臓器移植の専門家からかなりの注目を集めています11。
脈動性肝動脈の流れと連続的なPV供給を提供する2つのロータリーポンプが、関連する圧力によって流れが制御された灌流装置で使用されました。このシステムは圧力によって制御され、肝臓の抵抗に応じて肝臓を通る流れを自動的に調整することができます。灌流液の酸素化とCO2 の除去は、2つの中空糸膜型人工肺装置によって調節されます。機械の灌流の種類(10°Cから37°Cの範囲)に応じて、さまざまな温度を設定できます。灌流プロセス中に、インストルメントパネルの圧力、温度、流量、抵抗指数をリアルタイムで監視および記録できます。肝臓アシストは持ち運び可能なデバイスではありません。したがって、IFLTに使用されたドナーは移植センターに移送されるべきです。
この記事は、ex situ NMP装置を使用してHAに拍動性灌流を提供し、ヒトドナーの肝臓調達から移植までのPVの連続灌流を維持する段階的なIFLTプロトコルを提供することを目的としています。
プロトコル
このプロトコルは、中国広州にある中山大学第一付属病院の倫理委員会によってレビューされ、承認されました。インフォームドコンセントは、すべての参加者から得られました。ヒトの参加者を対象とした研究におけるすべての手続きは、1964年のヘルシンキ宣言およびその後の改正または改訂に従って実施された。
1.灌流液および装置の調製
注:このプロトコルに従ってNMP用に調製された灌流溶液の総量は、以前に報告されたように約3,000mLであり、1つの最終ヘモグロビン濃度は6〜10g / Lです。灌流溶液の成分を 表1に示します。
- 人工補助人工肝臓補助装置(Table of Materials)の臓器リザーバーに灌流液の成分を、酸素供給器の上部にあるコネクタを介して追加し、パイプラインからすべての気泡を取り除きます。
- 画面に表示されている製造元の指示に従って静脈ポンプをオンにします。同様に、動脈ポンプをオンにします。デバイス画面の指示に従って圧力をヌルします。 圧力 ボタンをクリックして、常温の機械的灌流の全プロセス中に、HA圧力を50〜60 mmHgの範囲内に設定し、PV圧力を5〜10 mmHgの範囲内に設定します。
- O2 と空気 (30% O2) の混合物を使用して、合計 400 mL/分の流量で酸素化を開始します。灌流溶液を37°Cに温めます。
- 微生物培養(8 mL)、血液ガス分析(0.5 mL)、および肝機能検査(3 mL)用の動脈灌流ラインのT分岐パイプから灌流液のサンプルを採取します(pO2、pCO2、pHおよび電解質が正常範囲内、温度が37°C付近)、それに応じて生化学的パラメータを監視します。
注:灌流は、層流手術室で使用する前に新鮮に調製する必要があります。必要に応じて、重炭酸塩またはインスリンを追加します。
2. 虚血フリーのドナー肝臓の調達
- 腹部十字靭帯切開を次のように行います:胸骨のノッチから恥骨結合まで垂直に、臍のレベルで両側に横方向に横方向に。肺や心臓の調達が必要な場合は、胸骨切開術を利用できます。大きなC字型のリトラクターを使用して露出を提供します。
- 腹部内臓の詳細な検査を行います。組織学的観察および臨床研究のために肝生検標本を採取します。精密な技術で肝臓を動員します。
- 総胆管にカニューレを留置して胆汁を排出し、嚢胞管を結紮します。総胆管の端から全周組織サンプル(幅:3〜5 mm)を切除し、組織学的観察と臨床研究を行います。
- 腹腔動脈(CA)、胃十二指腸動脈(GDA)、脾動脈(SA)、下大静脈(IVC)、およびPVを解剖します。8 Fr / 12 Fr動脈カニューレをGDAまたはSAに挿入します。CAからの肝臓への動脈供給が中断されていないことを確認してください。
- 長さ3cmの右外腸骨静脈を採取し、PVを部分的に閉塞させてPVに血管を端から端まで吻合し、介在静脈を作ります。
- 32〜34 Frカバルカニューレを肝下下大静脈(IHIVC)に配置して、デバイスの臓器リザーバーに流出させます。まっすぐな24 FrカニューレをデバイスのPV灌流ラインに接続し、介在静脈を介してPVに完全に挿入します。下大静脈上 (SHIVC) をブロックし、それによって右心房への静脈ドレナージをブロックします。動脈カニューレをLiver AssistデバイスのHA灌流ラインに接続します。次に、NMPを起動し、回路をその場で確立します。
- 肝臓を採取し、連続NMP下で臓器貯留層に移します。肝臓を腹腔から取り出した直後に、腹部大動脈内の交換されたカニューレを介して腎臓をコールドフラッシュし、従来の方法で腎臓を調達します。
注:調達の過程で、総肝動脈(CHA)を完全に分離し、左胃動脈(LGA)を結紮し、CAを腹部大動脈に分離します。アクセサリーHAの場合、NMPが開始する前に動脈をその場でバイパスします。
3. 虚血のないドナー肝臓の保存
- 肝臓を灌流装置に移します。肝臓が臓器リザーバーに移動したらすぐにキャバルカニューレを取り外してください。同種移植片血行再建術まで肝臓移植片を連続ex situ NMP。
- PV灌流圧力を6〜10 mmHgに設定し、目標流量を500 mL/minより高くします。HA圧力を50〜60 mmHgに設定し、目標流量を150 mL/minより高くします。NMP中は、灌流パラメータが安定していることを確認し、適切な範囲内の圧力と流量を監視します。
- 肝臓や血管から余分な組織を取り除きます。IVC全体を一時的にブロックして、SHIVCとIHIVCに漏れがないか調べます。乾燥した表面は、脱水症状を防ぐために濡れた滅菌ガーゼで覆います。
- 胆汁チューブを15mLの収集容器に集めます。胆汁ドレーンの開口部を肝臓の下に置き、胆汁が自由に排出されるようにします。胆汁産生量を記録し、30分ごとに生化学的パラメータを監視します。
- 血液ガス分析用の灌流サンプル(0.5 mL)を10〜20分ごとに、肝機能検査(3 mL)を30分ごとに採取し、それに応じて生化学的パラメータをモニタリングします。
- 血液ガス分析と灌流液の肝機能検査、および以前に報告された胆汁生化学的パラメーターによって、肝臓の生存率を評価します2。
注:患者の安全のために、レシピエントの外科的処置を開始する前に、NMP中にグラフトの生存率を確認してください。必要に応じて、血管抵抗を減らすためにパパベリンを1mL追加します。.
4. 虚血を伴わないドナー肝臓の移植
- レシピエントの病気の肝臓を従来の技術を使用して切除します。ドナーIHIVCを32〜34 Frカバルカニューレに再カニューレし、病気の肝臓を取り除き、クランプでSHIVCをブロックします。次に、ドナーの肝臓をリザーバーからレシピエントの腹腔に移動して、その場のNMP回路を再確立できるようにします。
- ドナーの SHIVC をレシピエントの対応者に縫合するには、3–0 の非吸収性ポリプロピレン縫合糸とバイキャバルまたはピギーバック技術を使用します。
- ドナーのPVとHAを、それぞれ5-0と7-0の非吸収性ポリプロピレン縫合糸を使用して、エンドツーエンドでレシピエントの対応物に縫合します。HAとPVの両方に天然の枝と人工の枝が含まれているため、同種移植片の連続NMP下でこれらの吻合を行います。
- 再灌流前に肝生検標本を採取します。その後、PVとHAのクランプを解除して、肝臓のネイティブデュアル血液供給を再確立します。同時に、HAおよびPVカニューレを取り外した後、NMPを停止します。次に、肝臓のIHIVCカニューレ内の約200mLの灌流液を洗い流します。IHIVCカニューレをブロックし、SHIVCのクランプを解放します。無肝期が終わりました。微生物培養用の灌流液サンプル(8 mL)を再度入手します。
- SAまたはGDAのカニューレを取り外し、静脈を挟みます。ドナーSAまたはGDAと介在静脈を結紮します。IHIVCでカニューレを抜くと、ドナーのIHIVCをレシピエントIHIVCに吻合(バイキャバル)するか、外科的手順に従って結紮(ピギーバック)します。胆汁ドレナージカニューレを抜いた後、総胆管検体を再度採取します。 ドレンナーの総胆管をレシピエントの総胆管に吻合します ドレナーチューブの引き出し後、端から端まで。
- 細心の止血後、肝生検標本を再度収集します。日常的な手順で腹壁を閉じます。
注:移植プロセス中は、ねじれや曲がりを避けるためにポータルと動脈カニューレを綿密に監視し、HAとPVの血液供給を確保するためにリアルタイムで流量パラメータを精査します。必要に応じて灌流圧をわずかに上げて、流量が肝臓に十分であることを確認します。SHIVC、PV、またはIHIVCの吻合中は、術後の静脈流の閉塞を避けるために、静脈断端をできるだけ短くします。
結果
2018年4月、脳死を患った66歳の男性ドナーは、移植片喪失のリスクが高いため、地元の移植センターでは考慮されませんでした。調達時に肝臓を廃棄した理由は、高齢と中程度の硬さ、丸みを帯びた肝臓の縁、最適でない肝臓移植片灌流の巨視的な外観、および高血圧、高血圧性心疾患、および次の関連要因を含む主要なドナー併存疾患でした:高ナトリウム血症(ナトリウム、156 mmol / L)およびアミン投与の必要性を伴う血行動態の不安定性(ドーパミン、 1.5μg/kg/min、ノルアドレナリン、0.12μg/kg/min)。ヒトドナー肝移植片の正常母性灌流を、提示されたプロトコルに記載されているように5時間行った。肝移植片の品質を評価するために、肝灌流の巨視的均質性を評価しました。(図 1A–D)。肝臓の血行動態も、動脈と門脈の流れの変化を監視することによって研究されました。灌流中に肝臓移植片の安定した血行動態が観察されました(図2A)。動脈灌流液から採取した灌流液サンプルの血液ガス分析を用いて、灌流液中の酸素化状態をモニターした。O2 と空気 (30% O2) の混合物を 400 mL/分の流速で酸素化すると、連続 O2 飽和度は 100% になりました。 図2B は、私たちの経験における灌流液の酸素化とその後の二酸化炭素の抽出を示しています。特に、灌流液は全灌流プロセスを通じて生理学的pHを維持しました。その後、乳酸レベルは急速に低下し、NMPの2.5時間で正常でした(図2C)。総ビリルビンの量の増加は、NMP中に産生される胆汁の質の改善を表していました(図2D)。
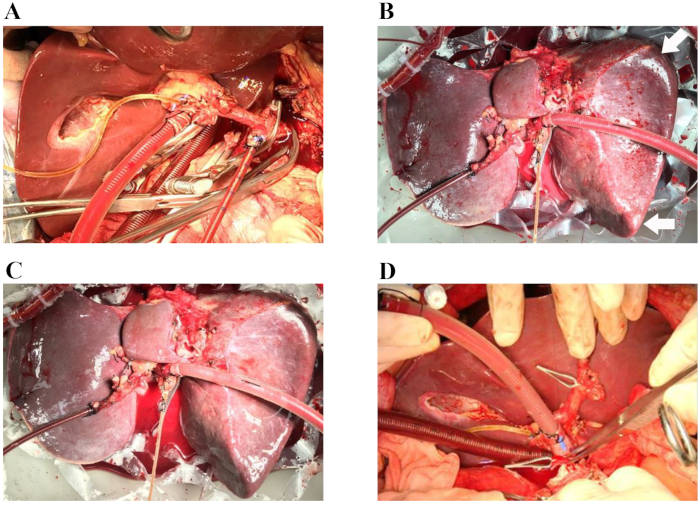
図1:虚血のない肝移植の代表的な手順。 (A)動脈カニューレを脾臓動脈に挿入し、静脈カニューレを門脈パッチに挿入します。胆管はシリコン胆道カテーテルでカニューレされます。(B)正常体温機械灌流の開始から60分後。矢印:丸い肝臓のエッジ。(C)常温機械灌流の開始から4時間後。(D)ドナー肝臓がレシピエントに移植されます(肝上大静脈吻合が完了します)。手術中、臓器室は不透明なカバーで覆われ、肝臓の無菌湿潤環境を維持します(これらの画像には示されていません)。 この図の拡大版を表示するには、ここをクリックしてください。
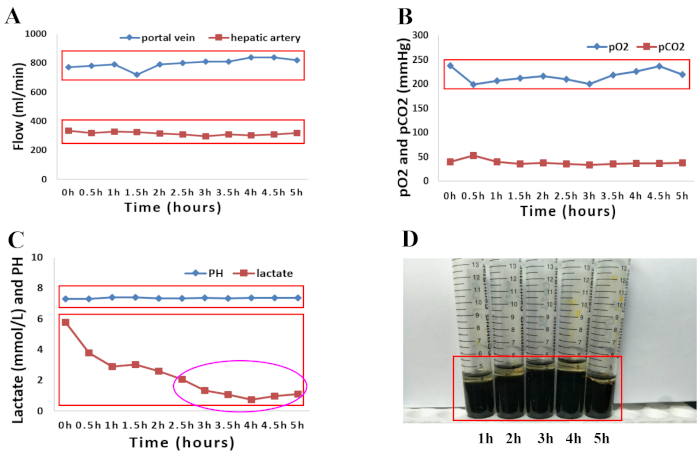
図2:5時間の常温マシン灌流中の灌流液と胆汁の両方の灌流パラメータのグラフ表示。 (A)動脈および門脈の流れの変化。(B)正常体温灌流の5時間中の酸素化特性とpCO2 の進化。(C)5時間の常温灌流中のpHおよび乳酸レベル。(D)機械灌流中に採取された胆汁サンプル中のビリルビンの量の増加。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このIFLT手法は、IRIを完全に回避するために確立されました。この記事では、臓器調達、その場保存から移植までのIFLTプロトコルを段階的に説明します。
NMPに基づき、IFLTは、調達から固執、移植まで、移植片に血液と酸素を途切れることなく供給します。多くの研究により、NMPは、静的な低温保存と比較して、IRIの減少、臓器生存率の改善、および移植片の損傷の修復に大きな利点があることが示されています12。外科技術の革新とさまざまな臓器でのNMP技術の進歩により、虚血のない臓器移植(IFOT)の概念はすべての固形臓器移植に広がり、臓器移植の早期および長期の予後を大幅に改善し、限界臓器の使用を最大化することが期待されています。IFOT技術は現在、脳死後提供(DBD)に由来する臓器移植にのみ使用されていますが、合理的な血管挿管および灌流パラメータを選択することにより、相対生体臓器提供(LDOD)の移植にも適用できます。心臓死後の提供 (DCD) は、DCD の操作 (脳死基準を満たさない人工呼吸器患者の生命維持装置の意図的なリコール後に停止、cDCD) と、制御されていない DCD (心停止後の蘇生の失敗、uDCD) の 2 つのカテゴリに分類できます12。臓器温虚血障害が発生したuDCD由来移植片では、臓器摘出前に局所NMPを迅速に確立する必要があります。この場合、この技術ではIRIを完全に回避することはできませんが、臓器の損傷を最大限に修復することができます。特に、cDCD由来のグラフトはほとんどの国で広く使用されています。地域のNMP技術の支援により、IFOTは、そのような提供から得られる臓器移植にも適用でき、その後のIRIの発生を回避できます。DCD臓器のIRIはDBDおよびLDOD臓器のIRIよりも深刻であるため、このタイプの臓器はIFOTから最も恩恵を受ける可能性があります。したがって、IFOTは、ほとんどすべての寄付元からの臓器移植の有望な方法であり、その大きな応用の見通しは調査が必要です。
この手順では、注意すべき点がいくつかあります。調達プロセスでは、CHAが完全に解離し、LGAが結紮され、腹腔体幹が腹部大動脈に解放され、バリアントアクセサリーHAを体内で再構築する必要があります。
機械灌流を使用した保存プロセスでは、灌流パラメータが安定していることが保証され、HAとPVの圧力と流量が生理学的状態範囲で制御されます。灌流圧力をわずかに上げて、移植中に肝臓に十分な流量を供給することができます。
ドナーの肝臓移植のプロセスでは、PVおよびHAの挿管に注意を払う必要があります。流量パラメータは、動脈血流と門脈血流の供給を確保するために、リアルタイムで監視する必要があります。ドナーからレシピエントへの SHIVC と PV が吻合された場合、冗長でねじれた血管は避けるべきです。
移植プロセス全体を通じて継続的な血液供給を行い、臓器灌流中に灌流液に追加の薬剤を追加する機会を得ることで、移植前に臓器の質を評価し改善できる可能性があります。したがって、この方法は移植結果を大幅に改善し、移植に利用できる臓器の数を増やすことができます。
開示事項
著者は、宣言する競合する利益を持っていません。
謝辞
本研究は、中国国家自然科学基金会(81401324・81770410)、広東省科学技術国際協力基地(臓器移植)(2015B050501002)、広東省自然科学基金(2015A030306025)、広東省高官育成特別支援プログラム(2015TQ01R168)、広州珠江新星プログラム(201506010014)、若手科学プログラムの支援を受けて行われました中国・中山大学(16ykpy05)の教師。
資料
| Name | Company | Catalog Number | Comments |
| 10% calcium gluconate | Hebei Tiancheng Pharmaceutical Co, Ltd | 1S181124101 | 30 mL |
| 25% magnesium sulphate | Hebei Tiancheng Pharmaceutical Co, Ltd | H20033861 | 3 mL |
| 5% sodium bicarbonate | Huiyinbi Group Jiangxi Dongya Pharmaceutical Co, Ltd | H36020283 | The amount depends on the pH |
| Cefoperazone sodium and sulbactam sodium | Pfizer | H20020597 | 1.5 g |
| Compound Amino Acid Injection | Guangdong Litai Pharmaceutical Co., Ltd | H20063797 | 250 mL |
| Crossed-matched leucocyte-depleted washed red cells | Guangzhou Blood Center | H20033739 | 1300 mL |
| Heparin | Chengdu Hepatunn Pharmaceutical Co., Ltd | H51021209 | 37500 U |
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Metronidazole | Shanghai Baxter Healthcare Co., Ltd. | H20003301 | 0.5 g |
| scalp acupuncture | Wuhan W.E.O.Science & Technology Development Co., Ltd | WEO-JX-32B-5.0 0.7*25mm | Bile duct cannula |
| Succinylated gelatinor | B. Braun Medical Suzhou Co., Ltd | H20113119 | 1400 mL |
参考文献
- Hanidziar, D., Koulmanda, M. Towards cytoprotection in the peritransplant period. Seminars in Immunology. 23 (3), 209-213 (2011).
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion-from mechanism to translation. Nature Medicine. 17 (11), 1391-1401 (2011).
- Ravikumar, R., Leuvenink, H., Friend, P. J. Normothermic liver preservation: a new paradigm. Transplant International. 28 (6), 690-699 (2015).
- Jayant, K., Reccia, I., Shapiro, A. M. J. Normothermic ex-vivo liver perfusion: where do we stand and where to reach. Expert Review of Gastroenterology & Hepatology. 12 (10), 1045-1058 (2018).
- Hessheimer, A. J., Riquelme, F., Fundora-Suarez, Y., Garcia Perez, R., Fondevila, C. Normothermic perfusion and outcomes after liver transplantation. Transplantation Reviews (Orlando, Fla). 33 (4), 200-208 (2019).
- Weissenbacher, A., Vrakas, G., Nasralla, D., Ceresa, C. D. L. The future of organ perfusion and re-conditioning. Transplant International. 32 (6), 586-597 (2019).
- von Horn, C., Minor, T. Modern concepts for the dynamic preservation of the liver and kidneys in the context of transplantation. Pathologe. 40 (3), 292-298 (2019).
- Czigany, Z., et al. Machine perfusion for liver transplantation in the era of marginal organs-New kids on the block. Liver International. 39 (2), 228-249 (2019).
- Wettstein, D., et al. Machine perfusion: new opportunities in abdominal organ transplantation. Orvosi Hetilap. 159 (46), 1882-1890 (2018).
- Lai, Q. R. N., et al. Role of perfusion machines in the setting of clinical liver transplantation: A qualitative systematic review. Clinical Transplantation. 32 (8), 11 (2018).
- He, X., et al. The first case of ischemia-free organ transplantation in humans: A proof of concept. American Journal of Transplantation. 18 (3), 737-744 (2017).
- Jassem, W., et al. Normothermic Machine Perfusion (NMP) inhibits proinflammatory responses in the liver and promotes regeneration. Hepatology. 70 (2), 682-695 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved