Method Article
Vermeidung von Ischämie-Reperfusionsschäden bei Lebertransplantationen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Im Folgenden wird ein Protokoll vorgestellt, das ein schrittweises Ischämie-freies Lebertransplantationsprotokoll unter ex situ normothermer maschineller Perfusion (37 °C) von menschlichen Lebern von Spendern auf Empfänger bereitstellt.
Zusammenfassung
Derzeit ist die ex-situ-maschinelle Perfusion eine aufstrebende Technik, die eine bessere Konservierungsmethode für Spenderorgane bietet als die herkömmliche statische Kältekonservierung (0–4 °C). Eine kontinuierliche Blutversorgung der Organe durch maschinelle Perfusion von der Beschaffung über die Konservierung bis zur Implantation ermöglicht die vollständige Prävention von Ischämie-Reperfusionsschäden und ermöglicht eine ex situ funktionelle Beurteilung der Spenderleber vor der Transplantation. In diesem Manuskript stellen wir ein Schritt-für-Schritt-Ischämie-freies Lebertransplantationsprotokoll vor, in dem ein ex situ normothermer Perfusionsapparat für die pulsierende Perfusion durch die Leberarterie und die kontinuierliche Perfusion der Pfortader von der menschlichen Spenderleber zu den Empfängern verwendet wird. In der Perfusionsphase wird eine biochemische Analyse des Perfusats durchgeführt, um die Stoffwechselaktivität der Leber zu beurteilen, und es wird auch eine Leberbiopsie durchgeführt, um den Grad der Verletzung zu beurteilen. Die Ischämie-freie Lebertransplantation ist eine vielversprechende Methode zur Vermeidung von Ischämie-Reperfusionsschäden und kann möglicherweise den Spenderpool für die Transplantation erweitern.
Einleitung
Die Ischämie-Reperfusionsverletzung (IRI) ist eine bekannte und weit verbreitete Komplikation bei Organtransplantationen. Offensichtliche nicht-immunologische Ereignisse führen zu schlechten Transplantatergebnissen und einer verzögerten Transplantatfunktion, die mit dem hohen Anteil an Organversagen, Retransplantation und Tod des Empfängers zusammenhängen1. Die konventionelle Kühllagerung (CCS) von Organen wurde bisher als klassische Methode zur Verlangsamung des Stoffwechsels identifiziert, hat aber keinen Einfluss auf die Verhinderung fortschreitender Funktionsstörungen und Schäden an der zellulären Integrität. Darüber hinaus wird die Leukozytenakkumulation durch reaktive Sauerstoffmetaboliten in der Reperfusionsphase induziert. All diese biologischen Prozesse werden noch relevanter, wenn wir Spendertransplantate mit erweiterten Kriterien (ECD) verwenden, wie z. B. Fettlebern und solche von Spendern, die älter als 65 Jahre sind. Diese ECD-Transplantate sind anfälliger für Schäden und einige andere nachteilige Auswirkungen, insbesondere solche von CCS2. Die Technologie der normothermen ex situ Leberperfusion zur Konservierung von Spenderorganen hat in den letzten Jahrzehnten große Fortschritte gemacht und ist in der klinischen Praxis durchaus umsetzbar3. Die Sicherheit und Durchführbarkeit von Warmperfusionstechniken in Spenderorganen wurde in präklinischen Studien untersucht, und einige Studiengruppen haben neue Arten von Perfusat- und Wiedererwärmungstaktiken in Tiermodellen entwickelt. In Ostasien, Europa und Nordamerika wurden einige klinische Studien zur Warmperfusion zur Konservierung von Spenderlebern durchgeführt 4,5.
Die normothermische maschinelle Perfusion (NMP) ermöglicht ein metabolisch aktives Szenario, in dem Organe mit kontinuierlich bereitgestelltem Sauerstoff und Nährstoffen eine Homöostase erreichen können. Der Stoffwechsel der Transplantate wird aktiviert, und wir können während der Perfusion beurteilen, ob die Spenderorgane für die Transplantation an die Empfänger geeignet sind, und zwar anhand des biochemischen Index des Perfusats oder der Biopsie der durchbluteten Organe. Die während der Konservierungsphase verfügbaren Parameter bieten Chirurgen auch die Möglichkeit, Transplantate zu behandeln oder ECD-Transplantate wiederherzustellen 6,7.
Rote Blutkörperchen sind der am häufigsten verwendete Sauerstoffträger. Einige andere essentielle Inhaltsstoffe, einschließlich Antibiotika, Antithrombotika und Nährstoffe, sind ebenfalls im Perfusatenthalten 8. In der aktuellen Praxis wird eine Leber nach der Entnahme konserviert und in einer 0-4。C-Lösung auf dem Rücktisch hergestellt. Dann wird die kalte Leber mehrere Stunden lang in dem bereits vorbereiteten NMP-Apparat zur Beurteilung und Wiederherstellung perfundiert. Die Leber erleidet jedoch zu Beginn der NMP und nach der Implantation doppelte IRI-Attacken, obwohl die Leber während des NMP-Prozesses bis zu einem gewissen Grad geschützt und repariert wird 9,10. Daher haben wir versucht, den Prozess neu zu bewerten und über die Vermeidung der beiden IRI-Angriffe nachzudenken. Wir stellten die Hypothese auf, dass IRI vermeidbar ist, wenn die Leber kontinuierlich mit Blut versorgt wird. Um diese Hypothese zu verifizieren, haben wir das konventionelle Doppelkonversionsprotokoll in eine ununterbrochene Versorgung der Leberarterie (HA) und der Pfortader (PV) mit einem Liver-Assist-Gerät umgewandelt. Dieses neuartige Transplantationsverfahren wurde als ischämiefreie Lebertransplantation (IFLT) bezeichnet. Der erste Fall von IFLT wurde bereits veröffentlicht und hat bei Organtransplantationsexperten große Aufmerksamkeit erregt11.
In der Perfusionsanlage wurden zwei Rotationspumpen verwendet, die einen pulsierenden hepatischen arteriellen Fluss und eine kontinuierliche PV-Versorgung lieferten, wobei der Fluss durch relevanten Druck gesteuert wurde. Das System wird durch Druck gesteuert und ermöglicht es, den Fluss durch die Leber automatisch an den Widerstand in der Leber anzupassen. Die Sauerstoffversorgung und die CO2 -Eliminierung des Perfusats werden durch zwei Hohlfasermembranoxygenatoren geregelt. Wir können je nach Art der Maschinendurchblutung unterschiedliche Temperaturen einstellen (von 10 °C bis 37 °C). Wir können den Druck-, Temperatur-, Durchfluss- und Widerstandsindex in Echtzeit in der Instrumententafel während des Perfusionsprozesses überwachen und aufzeichnen. Liver Assist ist kein transportables Gerät. Daher sollten die für die IFLT verwendeten Spender in das Transplantationszentrum überwiesen werden.
Dieser Artikel zielte darauf ab, ein Schritt-für-Schritt-IFLT-Protokoll anzubieten, in dem ein Ex-situ-NMP-Gerät verwendet wird, um dem HA eine pulsierende Perfusion zu gewährleisten und die kontinuierliche Perfusion des PV von der Entnahme der menschlichen Spenderleber bis zur Implantation aufrechtzuerhalten.
Protokoll
Dieses Protokoll wurde von der Ethikkommission des First Affiliated Hospital der Sun Yat-sen University, Guangzhou, China, geprüft und genehmigt. Von allen Teilnehmern wurde eine Einverständniserklärung eingeholt. Alle Verfahren in Studien mit menschlichen Teilnehmern wurden in Übereinstimmung mit der Erklärung von Helsinki von 1964 und ihren späteren Änderungen oder Überarbeitungen durchgeführt.
1. Herstellung der Perfusionslösung und des Geräts
HINWEIS: Das Gesamtvolumen der Perfusionslösung, die gemäß diesem Protokoll für die NMP hergestellt wurde, beträgt etwa 3.000 ml, wie zuvor berichtet1, und die endgültige Hämoglobinkonzentration beträgt 6–10 g/l. Die Bestandteile der Perfusionslösung sind in Tabelle 1 aufgeführt.
- Geben Sie die Bestandteile des Perfusats durch den Anschluss an der Oberseite des Oxygenators in das Organreservoir des künstlichen Leberunterstützungssystems (Materialtabelle) und entfernen Sie alle Blasen aus der Rohrleitung.
- Schalten Sie die Venenpumpe gemäß den Anweisungen des Herstellers ein, die auf dem Bildschirm angezeigt werden. Schalten Sie die arterielle Pumpe auf ähnliche Weise ein. Nullen Sie den Druck gemäß den Anweisungen auf dem Gerätebildschirm. Klicken Sie auf die Schaltfläche Druck , um den HA-Druck im Bereich von 50–60 mmHg und den PV-Druck im Bereich von 5–10 mmHg während des gesamten Prozesses der mechanischen Perfusion bei normaler Temperatur einzustellen.
- Beginnen Sie die Sauerstoffversorgung mit einem Gemisch aus O2 und Luft (30 % O2) bei einer kombinierten Durchflussrate von 400 mL/min. Erwärmen Sie die Perfusionslösung auf 37 °C.
- Entnehmen Sie eine Probe der Perfusatlösung aus dem T-Abzweigrohr der arteriellen Perfusionsleitung für die mikrobielle Kultur (8 mL), die Blutgasanalyse (0,5 mL) und den Leberfunktionstest (3 mL), nachdem das Gerät vorbereitet wurde (pO2, pCO2, pH und Elektrolyt im Normalbereich und Temperatur nahe 37 °C) und überwachen Sie die biochemischen Parameter entsprechend.
HINWEIS: Das Perfusat sollte vor der Verwendung in einem Laminar-Flow-Operationssaal frisch zubereitet werden. Bei Bedarf wird Bikarbonat oder Insulin zugesetzt.
2. Ischämiefreie Beschaffung von Spenderleber
- Führen Sie den Schnitt im Bauchkreuz wie folgt durch: vertikal, von der sternalen Kerbe bis zur Symphyse pubis, und quer, lateral zu beiden Flanken auf Höhe des Nabels. Wenn eine Entnahme der Lunge oder des Herzens erforderlich ist, kann eine Sternotomie verwendet werden. Verwenden Sie einen großen C-förmigen Retraktor, um die Belichtung zu gewährleisten.
- Führen Sie eine detaillierte Inspektion der Baucheingeweide durch. Entnehmen Sie eine Leberbiopsieprobe für die histologische Beobachtung und klinische Forschung. Mobilisieren Sie die Leber mit einer Präzisionstechnik.
- Legen Sie eine Kanüle in den gemeinsamen Gallengang für die Gallendrainage und ligieren Sie den Ductus cysticus. Schneiden Sie eine Gewebeprobe über den gesamten Umfang (Breite: 3–5 mm) vom Ende des Gallengangs für die histologische Beobachtung und klinische Forschung.
- Präparieren Sie die Arteria coeliacus (CA), die Arteria gastroduodenalis (GDA), die Milzarterie (SA), die Vena cava inferior (IVC) und die PV. Führen Sie eine arterielle Kanüle 8 Fr/12 Fr in den GDA oder SA ein. Stellen Sie sicher, dass es zu keiner Unterbrechung der arteriellen Versorgung der Leber durch die CA kommt.
- Entnehmen Sie eine 3 cm lange rechte Vena iliaca externa und anastomosieren Sie das Gefäß durchgehend an der PV mit teilweiser Verstopfung der PV, um eine Interpositionsvene herzustellen.
- Platzieren Sie eine Kavalkanüle 32–34 Fr in der infrahepatischen unteren Hohlvene (IHIVC), um in das Organreservoir des Geräts abzufließen. Verbinden Sie eine gerade 24 Fr Kanüle mit der PV-Perfusionsleitung des Gerätes und führen Sie sie dann über die Interpositionsvene vollständig in die PV ein. Blockieren Sie die suprahepatische untere Hohlvene (SHIVC) und blockieren Sie damit den venösen Abfluss zum rechten Vorhof. Verbinden Sie die arterielle Kanüle mit der HA-Perfusionsleitung des Leberunterstützungsgeräts. Starten Sie dann NMP, und richten Sie die Schaltung vor Ort ein.
- Entnahme der Leber und Transfer in das Organreservoir unter kontinuierlicher NMP. Unmittelbar nach der Entnahme der Leber aus der Bauchhöhle spülen Sie die Nieren über die vorgelagerte Kanüle in der Bauchschlagader kalt und versorgen Sie die Nieren auf herkömmliche Weise.
HINWEIS: Isolieren Sie während des Entnahmeprozesses die Arteria hepatica communis (CHA) vollständig, ligieren Sie die linke Magenarterie (LGA) und isolieren Sie die CA zur Bauchaorta. Im Falle der akzessorischen HA ist die Arterie vor Beginn der NMP in situ zu umgehen.
3. Ischämiefreier Erhalt der Spenderleber
- Übertragen Sie die Leber auf das Perfusionsgerät. Entfernen Sie die Kavalkanüle sofort, wenn die Leber in das Organreservoir bewegt wird. Kontinuierliche ex situ NMP des Lebertransplantats bis zur Revaskularisation des Allotransplantats.
- Stellen Sie den PV-Perfusionsdruck auf 6–10 mmHg mit einer angestrebten Flussrate von mehr als 500 mL/min ein. Stellen Sie den HA-Druck auf 50–60 mmHg mit einer angestrebten Durchflussrate von mehr als 150 mL/min ein. Stellen Sie während des NMP sicher, dass die Perfusionsparameter stabil sind, und überwachen Sie den Druck und die Durchflussrate in einem angemessenen Bereich.
- Entfernen Sie überflüssiges Gewebe aus der Leber und den Blutgefäßen. Blockieren Sie vorübergehend die gesamte IVC, um SHIVC und IHIVC auf Lecks zu untersuchen. Decken Sie alle trockenen Oberflächen mit nasser, steriler Gaze ab, um ein Austrocknen zu verhindern.
- Sammeln Sie den Gallenschlauch in einem 15-ml-Auffangbehälter. Platzieren Sie die Öffnung des Gallenabflusses unterhalb der Leber, damit die Galle ungehindert ablaufen kann. Erfassen Sie die Menge der Gallenproduktion und überwachen Sie die biochemischen Parameter alle 30 Minuten.
- Entnehmen Sie alle 10–20 Minuten eine Perfusionsprobe (0,5 mL) für die Blutgasanalyse, alle 30 Minuten Leberfunktionstests (3 mL) und überwachen Sie die biochemischen Parameter entsprechend.
- Beurteilen Sie die Lebensfähigkeit der Leber durch Blutgasanalyse und Leberfunktionstests des Perfusats sowie durch biochemische Parameter der Galle, wie zuvor berichtet2.
HINWEIS: Aus Gründen der Patientensicherheit ist die Lebensfähigkeit des Transplantats während der NMP zu bestätigen, bevor die chirurgischen Eingriffe des Empfängers eingeleitet werden. Fügen Sie bei Bedarf 1 ml Papaverin hinzu, um den Gefäßwiderstand zu verringern.
4. Ischämiefreie Implantation der Spenderleber
- Resezieren Sie die erkrankte Leber des Empfängers mit einer herkömmlichen Technik. Rekanülieren Sie die Spenderkanüle IHIVC a 32–34 Fr, entfernen Sie die erkrankte Leber und blockieren Sie die SHIVC mit einer Klemme. Bewegen Sie dann die Spenderleber aus dem Reservoir in die Bauchhöhle des Empfängers, damit ein NMP-Kreislauf in situ wieder aufgebaut werden kann.
- Vernähen Sie das SHIVC des Spenders mit den Empfängern unter Verwendung von 3-0 nicht resorbierbaren Polypropylen-Nähten mit einer Bikaval- oder Huckepack-Technik.
- Vernähen Sie das Spender-PV und das Spender-HA durchgängig mit den Gegenstücken des Empfängers unter Verwendung von 5-0 bzw. 7-0 nicht resorbierbaren Polypropylen-Nähten. Führen Sie diese Anastomosen unter kontinuierlicher NMP des Allotransplantats durch, da sowohl HA als auch PV sowohl native als auch künstliche Zweige enthalten.
- Entnehmen Sie die Leberbiopsieprobe vor der Reperfusion. Lösen Sie anschließend die Klammern an PV und HA, um die native duale Blutversorgung der Leber wiederherzustellen. Beenden Sie gleichzeitig die NMP nach Entfernung der HA- und PV-Kanüle. Spülen Sie dann etwa 200 ml Perfusat in der Leberform aus der IHIVC-Kanüle aus. Blockieren Sie die IHIVC-Kanüle und lösen Sie die Klemme am SHIVC. Die anhepatische Phase ist vorbei. Entnehmen Sie erneut eine Perfusatprobe (8 ml) für die mikrobielle Kultur.
- Entfernen der Kanülen in der SA oder GDA und Zwischenvene. Lilizieren Sie die Spender-SA oder GDA und interposition der Vene. Ziehen Sie die Kanüle im IHIVC zurück und anastomosieren Sie den IHIVC des Spenders an den Empfänger-IHIVC (bikaval) oder ligieren Sie ihn (Huckepack) je nach chirurgischem Eingriff. Entnehmen Sie die Probe des Gallengangs nach Entnahme der Gallendrainagekanüle erneut. Anastomosieren Sie den Gallengang des Spenders nach Entnahme des Drainageschlauchs durchgehend an den Gallengang des Empfängers.
- Entnehmen Sie die Leberbiopsieprobe nach sorgfältiger Blutstillung erneut. Schließen Sie die Bauchdecke im Routineverfahren.
HINWEIS: Überwachen Sie während des Implantationsprozesses die Portal- und Arterienkanüle genau, um ein Verdrehen oder Verbiegen zu vermeiden, und überprüfen Sie die Flussratenparameter in Echtzeit, um die Blutversorgung von HA und PV sicherzustellen. Erhöhen Sie bei Bedarf den Perfusionsdruck leicht, um sicherzustellen, dass die Flussrate für die Leber ausreichend ist. Während der Anastomose des SHIVC, PV oder IHIVC ist der Venenstumpf so weit wie möglich zu kürzen, um eine postoperative Obstruktion des venösen Flusses zu vermeiden.
Ergebnisse
Im April 2018 wurde ein 66-jähriger männlicher Spender mit Hirntod von den örtlichen Transplantationszentren nicht berücksichtigt, da bei solchen Spendern ein hohes Risiko für einen Transplantatverlust besteht. Die Gründe für die Entsorgung der Leber zum Zeitpunkt der Beschaffung waren höheres Alter und makroskopisches Erscheinungsbild von mäßiger Festigkeit, runde Leberränder und suboptimale Lebertransplantatperfusion sowie wichtige Komorbiditäten bei Spendern, zu denen Bluthochdruck, hypertensive Herzerkrankungen und die folgenden damit verbundenen Faktoren gehörten: Hypernatriämie (Natrium, 156 mmol/L) und hämodynamische Instabilität mit der Notwendigkeit einer Aminverabreichung (Dopamin, 1,5 μg/kg/min, Noradrenalin, 0,12 μg/kg/min). Die normothermische Perfusion der humanen Spenderlebertransplantate wurde für 5 Stunden durchgeführt, wie im vorgestellten Protokoll beschrieben. Die makroskopische Homogenität der Leberperfusion wurde bewertet, um die Qualität des Lebertransplantats zu beurteilen. (Abbildung 1A–D). Die Hämodynamik der Leber wurde ebenfalls untersucht, indem die Veränderungen der arteriellen und portalen Flüsse überwacht wurden. Während der Perfusion wurde eine stabile Hämodynamik der Lebertransplantate beobachtet (Abbildung 2A). Die Blutgasanalyse der Perfusatproben, die aus der arteriellen Perfusionsflüssigkeit entnommen wurden, wurde verwendet, um den Oxygenierungsstatus in der Perfusionsflüssigkeit zu überwachen. Die Sauerstoffanreicherung mit einem Gemisch aus O2 und Luft (30 % O2) bei einer Durchflussrate von 400 mL/min führte zu einer kontinuierlichen O2 -Sättigung von 100 %. Abbildung 2B zeigt nach unseren Erfahrungen die Sauerstoffversorgung der Perfusionsflüssigkeit und die anschließende Extraktion von Kohlendioxid. Bemerkenswert ist, dass das Perfusat während des gesamten Perfusionsprozesses einen physiologischen pH-Wert beibehielt. Die Laktatspiegel sanken anschließend rapide ab und waren nach 2,5 h NMP normal (Abbildung 2C). Ein Anstieg der Mengen an Gesamtbilirubin stellte eine Verbesserung der Qualität der während der NMP produzierten Galle dar (Abbildung 2D).
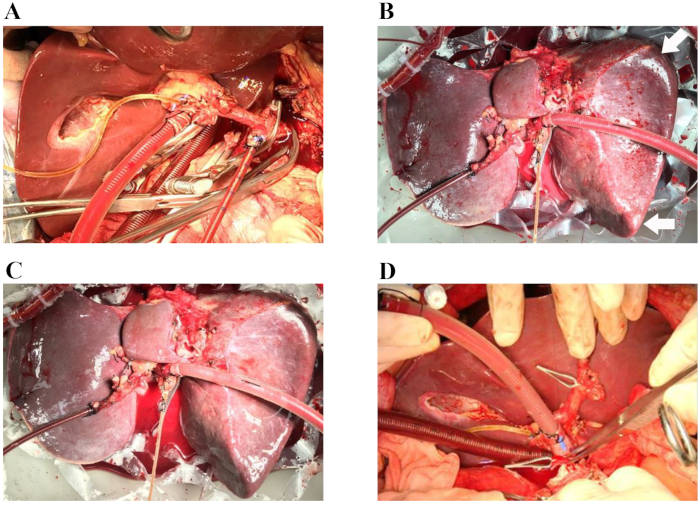
Abbildung 1: Repräsentative Verfahren der ischämiefreien Lebertransplantation. (A) Die arterielle Kanüle wird in die Milzarterie eingeführt, und die Venenkanüle wird in das Pfortaderpflaster eingeführt. Der Gallengang wird mit einem Gallenkatheter aus Silikon kanüliert. (B) Sechzig Minuten nach Beginn der normothermen maschinellen Perfusion. Pfeile: runde Leberränder. (C) Vier Stunden nach Beginn der normothermen maschinellen Perfusion. (D) Die Spenderleber wird in den Empfänger implantiert (die suprahepatische Hohlvenen-Anastomose ist abgeschlossen). Während der Operation wird die Organkammer mit einer undurchsichtigen Abdeckung abgedeckt, um eine sterile feuchte Umgebung für die Leber zu gewährleisten (in diesen Bildern nicht zu sehen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
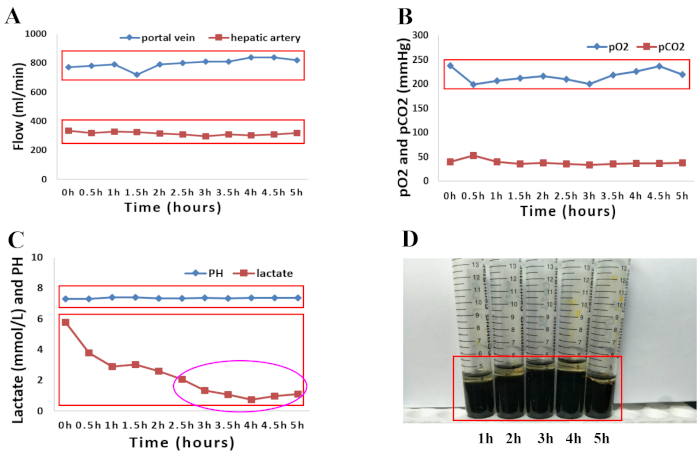
Abbildung 2: Grafische Darstellung der Perfusionsparameter sowohl der Perfusionsflüssigkeit als auch der Galle während einer 5-stündigen normothermen maschinellen Perfusion. (A) Veränderungen des arteriellen und portalen Flusses. (B) Entwicklung der Oxygenierungseigenschaften und des pCO2 während 5 h normothermer Perfusion. (C) pH- und Laktatspiegel während 5 h normothermer Perfusion. (D) Zunehmende Mengen an Bilirubin in Gallenproben, die während der maschinellen Perfusion entnommen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Diese IFLT-Technik wurde eingeführt, um IRI vollständig zu vermeiden. Dieser Artikel bietet ein Schritt-für-Schritt-IFLT-Protokoll von der Organbeschaffung über die Ex-situ-Konservierung bis hin zur Implantation.
Basierend auf NMP sorgt IFLT für eine ununterbrochene Versorgung der Transplantate mit Blut und Sauerstoff von der Beschaffung über die Perseveration bis hin zur Implantation. Zahlreiche Studien haben gezeigt, dass NMP im Vergleich zur statischen Kältekonservierung signifikante Vorteile bei der Reduzierung der IRI, der Verbesserung der Lebensfähigkeit der Organe und der Reparatur von Transplantatschäden hat12. Durch die Innovation der Operationstechniken und die Weiterentwicklung der NMP-Technologie in verschiedenen Organen wird erwartet, dass sich das Konzept der ischämiefreien Organtransplantation (IFOT) auf alle soliden Organtransplantationen ausdehnen wird, wodurch die Früh- und Langzeitprognose der Organtransplantation erheblich verbessert und die Verwendung marginaler Organe maximiert wird. Die IFOT-Technologie wird derzeit nur bei Organtransplantationen aus einer Spende nach Hirntod (DBD) eingesetzt, ist aber auch bei der Transplantation von relativen Lebendorganspenden (LDOD) anwendbar, indem angemessene Parameter für die Gefäßintubation und Perfusion ausgewählt werden. Die Spende nach Herztod (DCD) kann in zwei Kategorien eingeteilt werden: Manipulation der DCD (gestoppt nach absichtlichem Abruf der lebenserhaltenden Maßnahmen bei Patienten mit mechanischer Beatmung, die die Hirntodkriterien nicht erfüllen, cDCD) und in geringerem Maße unkontrollierte DCD (erfolglose Wiederbelebung nach Herzstillstand, uDCD)12. Bei uDCD-abgeleiteten Transplantaten, bei denen eine Schädigung der warmen Organischämie aufgetreten ist, sollte die regionale NMP vor der Organentnahme rasch etabliert werden. In diesem Fall kann die IRI zwar nicht vollständig vermieden werden, aber die Schädigung des Organs kann maximal repariert werden. Bemerkenswert ist, dass cDCD-abgeleitete Transplantate in den meisten Ländern weit verbreitet sind. Mit Unterstützung der regionalen NMP-Technologie kann IFOT auch bei Organtransplantationen aus solchen Spenden angewendet werden, um das spätere Auftreten von IRI zu vermeiden. Da die IRI eines DCD-Organs schwerwiegender ist als die von DBD- und LDOD-Organen, wird dieser Organtyp wahrscheinlich am meisten von der IFOT profitieren. Daher ist IFOT eine vielversprechende Methode für Organtransplantationen aus fast allen Spenderquellen, und ihre großen Anwendungsaussichten verdienen eine Erkundung.
Bei diesem Verfahren sind mehrere Aspekte zu beachten. Während des Entnahmeprozesses wird das CHA vollständig dissoziiert, das LGA wird ligiert, der Zöliakie-Rumpf wird zur Bauchaorta befreit und die Variante des akzessorischen HA muss im Körper rekonstruiert werden.
Während des Konservierungsprozesses mittels maschineller Perfusion wird die Stabilität der Perfusionsparameter sichergestellt und der Druck und die Durchflussrate von HA und PV im physiologischen Zustandsbereich geregelt. Der Perfusionsdruck kann leicht erhöht werden, um sicherzustellen, dass der Fluss ausreicht, um die Leber während der Implantation zu versorgen.
Bei der Implantation der Spenderleber sollte auf die Intubation der PV und HA geachtet werden. Die Flussparameter sollten in Echtzeit überwacht werden, um die Versorgung mit arteriellem und portalem Blutfluss sicherzustellen. Bei der Anastomosierung von Spender-Empfänger-SHIVC und PV sollten redundante und verdrehte Gefäße vermieden werden.
Eine kontinuierliche Blutversorgung während des gesamten Transplantationsprozesses und die Möglichkeit, der Perfusionsflüssigkeit während der Organperfusion zusätzliche Wirkstoffe zuzusetzen, bieten das Potenzial, die Organqualität vor der Transplantation zu beurteilen und zu verbessern. Daher kann diese Methode die Transplantationsergebnisse erheblich verbessern und die Anzahl der für die Transplantation verfügbaren Organe erhöhen.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen zu erklären.
Danksagungen
Diese Studie wurde unterstützt von der National Natural Science Foundation of China (81401324 und 81770410), der Guangdong Provincial International Cooperation Base of Science and Technology (Organtransplantation) (2015B050501002), den Guangdong Provincial Natural Science Funds for Distinguished Young Scholars (2015A030306025), dem Special Support Program for Training High-Level Talent in der Provinz Guangdong (2015TQ01R168), dem Pearl River Nova Program von Guangzhou (201506010014) und dem Scientific Program for Young Lehrer der Sun Yat-sen Universität (16ykpy05), China.
Materialien
| Name | Company | Catalog Number | Comments |
| 10% calcium gluconate | Hebei Tiancheng Pharmaceutical Co, Ltd | 1S181124101 | 30 mL |
| 25% magnesium sulphate | Hebei Tiancheng Pharmaceutical Co, Ltd | H20033861 | 3 mL |
| 5% sodium bicarbonate | Huiyinbi Group Jiangxi Dongya Pharmaceutical Co, Ltd | H36020283 | The amount depends on the pH |
| Cefoperazone sodium and sulbactam sodium | Pfizer | H20020597 | 1.5 g |
| Compound Amino Acid Injection | Guangdong Litai Pharmaceutical Co., Ltd | H20063797 | 250 mL |
| Crossed-matched leucocyte-depleted washed red cells | Guangzhou Blood Center | H20033739 | 1300 mL |
| Heparin | Chengdu Hepatunn Pharmaceutical Co., Ltd | H51021209 | 37500 U |
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Metronidazole | Shanghai Baxter Healthcare Co., Ltd. | H20003301 | 0.5 g |
| scalp acupuncture | Wuhan W.E.O.Science & Technology Development Co., Ltd | WEO-JX-32B-5.0 0.7*25mm | Bile duct cannula |
| Succinylated gelatinor | B. Braun Medical Suzhou Co., Ltd | H20113119 | 1400 mL |
Referenzen
- Hanidziar, D., Koulmanda, M. Towards cytoprotection in the peritransplant period. Seminars in Immunology. 23 (3), 209-213 (2011).
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion-from mechanism to translation. Nature Medicine. 17 (11), 1391-1401 (2011).
- Ravikumar, R., Leuvenink, H., Friend, P. J. Normothermic liver preservation: a new paradigm. Transplant International. 28 (6), 690-699 (2015).
- Jayant, K., Reccia, I., Shapiro, A. M. J. Normothermic ex-vivo liver perfusion: where do we stand and where to reach. Expert Review of Gastroenterology & Hepatology. 12 (10), 1045-1058 (2018).
- Hessheimer, A. J., Riquelme, F., Fundora-Suarez, Y., Garcia Perez, R., Fondevila, C. Normothermic perfusion and outcomes after liver transplantation. Transplantation Reviews (Orlando, Fla). 33 (4), 200-208 (2019).
- Weissenbacher, A., Vrakas, G., Nasralla, D., Ceresa, C. D. L. The future of organ perfusion and re-conditioning. Transplant International. 32 (6), 586-597 (2019).
- von Horn, C., Minor, T. Modern concepts for the dynamic preservation of the liver and kidneys in the context of transplantation. Pathologe. 40 (3), 292-298 (2019).
- Czigany, Z., et al. Machine perfusion for liver transplantation in the era of marginal organs-New kids on the block. Liver International. 39 (2), 228-249 (2019).
- Wettstein, D., et al. Machine perfusion: new opportunities in abdominal organ transplantation. Orvosi Hetilap. 159 (46), 1882-1890 (2018).
- Lai, Q. R. N., et al. Role of perfusion machines in the setting of clinical liver transplantation: A qualitative systematic review. Clinical Transplantation. 32 (8), 11 (2018).
- He, X., et al. The first case of ischemia-free organ transplantation in humans: A proof of concept. American Journal of Transplantation. 18 (3), 737-744 (2017).
- Jassem, W., et al. Normothermic Machine Perfusion (NMP) inhibits proinflammatory responses in the liver and promotes regeneration. Hepatology. 70 (2), 682-695 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten