Method Article
避免肝移植中的缺血再灌注损伤
* 这些作者具有相同的贡献
摘要
这里介绍的方案是在从供体到受体的人肝脏的异位常温机器灌注 (37 °C) 下提供分步无缺血肝移植方案。
摘要
目前,非原位机器灌注是一种新兴技术,与传统的静态冷保存 (0-4 °C) 相比,它为供体器官提供了更好的保存方法。从获取和保存到植入,使用机器灌注向器官持续供血有助于完全预防缺血再灌注损伤,并允许在移植前对供体肝脏进行异位功能评估。在本手稿中,我们提供了一个循序渐进的无缺血肝移植方案,其中非原位常温机器灌注装置用于通过肝动脉的脉冲灌注和门静脉从人类供体肝脏到受体的连续灌注。在灌注期,对灌注液进行生化分析以评估肝脏的代谢活性,并进行肝活检以评估损伤程度。无缺血肝移植是一种很有前途的方法,可以避免缺血再灌注损伤,并可能增加移植的供体库。
引言
缺血再灌注损伤 (IRI) 是器官移植中众所周知且广泛的并发症。明显的非免疫事件导致移植物结局不良和移植物功能延迟,这与器官衰竭、再移植和受者死亡的高比例有关1。器官的常规冷藏 (CCS) 以前被认为是减缓新陈代谢的经典方法,但它对防止进行性功能障碍和细胞完整性损害没有影响。此外,再灌注期的活性氧代谢物诱导白细胞积累。当我们使用扩展标准供体 (ECD) 移植物(例如脂肪肝和 65 岁以上供体的移植物)时,所有这些生物过程变得更加重要。这些 ECD 移植物更容易受到损伤和其他一些有害影响,尤其是来自 CCS2 的移植物。用于保存供体器官的常温非原位肝机灌注技术在过去几十年中取得了长足的进步,并且在临床实践中是完全可行的3。临床前研究评估了温灌注技术在供体器官中的安全性和可行性,一些研究小组在动物模型中设计了新型灌注和复温策略。一些温灌注保存供体肝脏的临床试验已在东亚、欧洲和北美启动4,5。
正常机器灌注 (NMP) 促进了代谢活跃的情况,在这种情况下,器官可以在持续供应的氧气和营养物质下实现体内平衡。移植物的新陈代谢被激活,我们可以在灌注时根据灌注液的生化指标或灌注器官的活检来判断供体器官是否适合移植给受体。保存期间的可用参数也为外科医生提供了一种治疗移植物或恢复 ECD 移植物的方法 6,7。
红细胞是最常用的氧载体。灌注液8 中还包括其他一些基本成分,包括抗生素、抗血栓剂和营养物质。在目前的实践中,取回肝脏后,将其保存并在 0-4。C 溶液中制备后表。然后,将冷肝灌注在已经准备好的 NMP 装置中数小时,以进行评估和恢复。然而,尽管肝脏在 NMP 过程中受到一定程度的保护和修复,但在 NMP 开始时和植入后,肝脏会遭受 IRI 的双重攻击 9,10。因此,我们试图重新评估该过程并反思如何避免两次 IRI 攻击。我们假设如果向肝脏提供持续的血液供应,IRI 是可以避免的。为了验证这一假设,我们将传统的双转换方案更改为使用肝脏辅助装置的不间断肝动脉 (HA) 和门静脉 (PV) 供应。这种新颖的移植手术被命名为无缺血肝移植 (IFLT)。IFLT 的第一例病例之前已经发表,并引起了器官移植专家的极大关注11。
在灌注装置中使用了两个旋转泵,提供肝动脉搏动血流和连续 PV 供应,其中流量由相关压力控制。该系统由压力控制,并允许根据肝脏中的阻力自动调整通过肝脏的流量。灌注液的氧合和 CO2 消除由两个中空纤维膜氧合器调节。我们可以根据不同类型的机器灌注设置不同的温度(范围从 10 °C 到 37 °C)。我们可以在灌注过程中监测和记录仪表板中的实时压力、温度、流量和阻力指数。Liver Assist 不是可移动的设备。因此,用于 IFLT 的供体应转移到移植中心。
本文旨在提供一个循序渐进的 IFLT 方案,其中非原位 NMP 装置用于向 HA 提供脉冲灌注,并维持从人类供体肝脏获取到植入的 PV 的连续灌注。
研究方案
该协议由中国广州中山大学附属第一医院伦理委员会审查和批准。获得所有参与者的知情同意。涉及人类参与者的研究中的所有程序均按照 1964 年赫尔辛基宣言及其后来的修正或修订进行。
1. 灌注液和装置的制备
注:根据该方案制备的 NMP 灌注液的总体积约为 3,000 mL,如前所述1,最终血红蛋白浓度为 6-10 g/L。灌注溶液的组分列于 表 1 中。
- 通过氧合器顶部的连接器将灌注液的成分添加到人工肝脏辅助装置(材料表)的器官储液器中,并去除管道中的所有气泡。
- 根据制造商的说明打开静脉泵,该说明显示在屏幕上。以类似的方式打开动脉泵。根据设备屏幕上的说明将压力归零。单击 压力 按钮,在常温机械灌注的整个过程中,将 HA 压力设置为 50-60 mmHg 范围内,将 PV 压力设置为 5-10 mmHg 范围内。
- 使用 O2 和空气 (30% O2) 的混合物以 400 mL/min 的组合流速开始氧合。将灌注溶液加热至 37 °C。
- 从动脉灌注管的 T 型支管获取灌注液样品,用于微生物培养 (8 mL)、血气分析 (0.5 mL) 和肝功能检查 (3 mL),在设备灌注后(pO2、pCO2、pH 值和电解质在正常范围内,温度接近 37 °C),并相应地监测生化参数。
注:灌注液应在层流手术室中使用前新鲜制备。如有必要,可添加碳酸氢盐或胰岛素。
2. 无缺血获得供体肝脏
- 按如下方式进行腹部交叉切口:垂直,从胸骨切迹到耻骨联合,横向,横向到脐部水平的两侧。当需要获取肺或心脏时,可以使用胸骨切开术。使用大型 C 形牵开器提供曝光。
- 对腹部内脏进行详细检查。采集肝活检标本进行组织学观察和临床研究。用精确的技术动员肝脏。
- 在胆总管中放置一根套管以进行胆汁引流,并结扎胆囊管。从胆总管末端切下全周组织样本(宽度:3-5 毫米),用于组织学观察和临床研究。
- 解剖腹腔动脉 (CA)、胃十二指肠动脉 (GDA)、脾动脉 (SA)、下腔静脉 (IVC) 和 PV。将 8 Fr/12 Fr 动脉插管插入 GDA 或 SA。确保 CA 的肝脏动脉供应没有中断。
- 收获一条 3 cm 长的右髂外静脉,并以端到端的方式将血管与 PV 吻合,部分阻塞 PV 以形成插入静脉。
- 将 32-34 Fr 腔静脉插管放置在肝下腔静脉 (IHIVC) 中,以流出至设备的器官储液器。将一根直的 24 Fr 套管连接到设备的 PV 灌注管,然后通过插入静脉完全插入 PV。阻断肝上下腔静脉 (SHIVC),从而阻断流向右心房的静脉引流。将动脉插管连接到 Liver Assist 装置的 HA 灌注管。然后,启动 NMP,并原位建立电路。
- 收获肝脏并在连续 NMP 下转移到器官储库。从腹腔取出肝脏后,立即通过腹主动脉内的置换套管冷冲洗肾脏,并以常规方式获取肾脏。
注:在采购过程中,完全隔离肝总动脉 (CHA),结扎左胃动脉 (LGA),并将 CA 隔离至腹主动脉。对于附件 HA,在 NMP 开始之前原位旁路动脉。
3. 供体肝脏的无缺血保存
- 将肝脏转移到灌注装置。当肝脏移动到器官储液器时,立即取出腔静脉套管。连续异位 NMP 肝移植物直至同种异体移植物血运重建。
- 将 PV 灌注压力设置为 6–10 mmHg,目标流速高于 500 mL/min。将 HA 压力设置为 50–60 mmHg,目标流速高于 150 mL/min。NMP 过程中,确保灌注参数稳定,并在适当范围内监测压力和流速。
- 从肝脏和血管中去除多余的组织。瞬时阻塞整个 IVC 以检查 SHIVC 和 IHIVC 是否有泄漏。用湿的无菌纱布覆盖任何干燥的表面,以防止脱水。
- 将胆汁管收集到 15 mL 收集容器中。将胆汁引流管的开口放在肝脏下方,让胆汁自由流出。记录胆汁产生量,并每 30 分钟监测一次生化参数。
- 每 10-20 分钟获取一份灌注样本 (0.5 mL) 用于血气分析,每 30 分钟获取一次肝功能检查 (3 mL),并相应地监测生化参数。
- 通过血气分析和灌注液的肝功能测试以及先前报道的胆汁生化参数来评估肝脏的活力2.
注意:为了患者安全,请在受体外科手术开始前确认 NMP 期间的移植物活力。如有必要,添加 1 mL 罂粟碱以减少血管阻力。
4. 供体肝脏无缺血植入
- 使用常规技术切除受者患病的肝脏。将供体 IHIVC 重新插入 32-34 Fr 腔静脉套管,切除患病肝脏并用夹子阻断 SHIVC。然后,将供体肝脏从储液器移动到受体的腹腔,以便可以原位重建 NMP 回路。
- 使用 3-0 不可吸收聚丙烯缝合线和双腔或背负技术将供体 SHIVC 缝合到受体对应物上。
- 分别使用 5-0 和 7-0 不可吸收聚丙烯缝合线,将供体 PV 和 HA 以端到端方式缝合到受体的对应物上。在同种异体移植物的连续 NMP 下进行这些吻合,因为 HA 和 PV 都包含天然和人工分支。
- 再灌注前收集肝活检标本。之后,松开 PV 和 HA 上的夹子,以重新建立肝脏的天然双重血液供应。同时,在移除 HA 和 PV 套管后停止 NMP。然后,从 IHIVC 套管中冲洗出肝脏内约 200 mL 灌注液。阻塞 IHIVC 套管并松开 SHIVC 上的夹子。肝末期结束。再次获取灌注液样品 (8 mL) 用于微生物培养。
- 切除 SA 或 GDA 中的套管,并插入静脉。连接供体 SA 或 GDA 并插入静脉。取出 IHIVC 中的套管,并根据手术程序将供体的 IHIVC 吻合到受体 IHIVC(双腔)或结扎(背负式)。取出胆汁引流管后再次收集胆总管标本。 撤出引流管后,以端到端的方式将供体的胆总管与受体的胆总管吻合。
- 细致止血后再次采集肝活检标本。在常规手术中闭合腹壁。
注意:在植入过程中,密切监测门静脉和动脉插管,避免扭曲或弯曲,并实时检查流速参数,以确保 HA 和 PV 的血液供应。必要时略微增加灌注压,以确保流速足以到达肝脏。在 SHIVC、PV 或 IHIVC 吻合期间,尽可能缩短静脉残端,以避免术后静脉血流阻塞。
结果
2018 年 4 月,当地移植中心未考虑一名 66 岁脑死亡的男性供体,因为此类供体的移植物丢失风险很高。在购买时丢弃肝脏的原因是年龄较大且肉眼外观中等硬度、肝脏边缘圆润和肝移植物灌注不理想,以及主要供体合并症,包括高血压、高血压心脏病和以下相关因素:高钠血症(钠,156 mmol/L)和血流动力学不稳定,需要胺给药(多巴胺, 1.5 μg/kg/min,去甲肾上腺素,0.12 μg/kg/min)。如所提出的方案所述,对人类供体肝移植物进行正常灌注 5 小时。评估肝脏灌注的宏观均匀性以评估肝移植物的质量。(图 1A-D)。还通过监测动脉血流和门静脉血流的变化来研究肝脏的血流动力学。在灌注过程中观察到肝移植物的稳定血流动力学(图 2A)。对从动脉灌注液中采集的灌注液样本进行血气分析,以监测灌注液中的氧合状态。用 O2 和空气 (30% O2) 的混合物以 400 mL/min 的流速进行氧合,导致 O2 连续饱和度为 100%。 图 2B 显示了根据我们的经验,灌注液的氧合和随后的二氧化碳提取。值得注意的是,灌注液在整个灌注过程中保持了生理 pH 值。乳酸水平随后迅速下降,在 NMP 2.5 小时时正常(图 2C)。总胆红素数量的增加代表 NMP 期间产生的胆汁质量的改善(图 2D)。
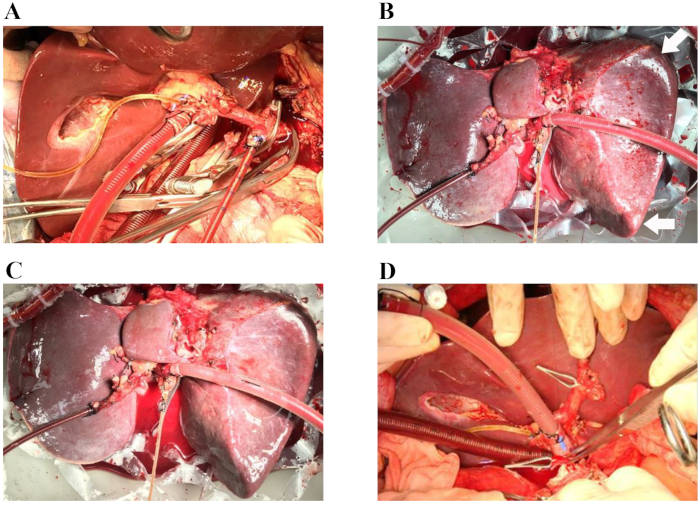
图 1:无缺血肝移植的代表性手术。 (A) 动脉插管插入脾动脉,静脉插管插入门静脉补片。胆管用硅胆管导管插管。(B) 常温机器灌注开始后 60 分钟。箭头:圆形肝脏边缘。(C) 常温机器灌注开始后 4 小时。(D) 将供体肝脏植入受体体内(肝上腔静脉吻合完成)。在手术过程中,器官腔被不透明的盖子覆盖,以保持肝脏无菌潮湿的环境(这些图像中未显示)。 请单击此处查看此图的较大版本。
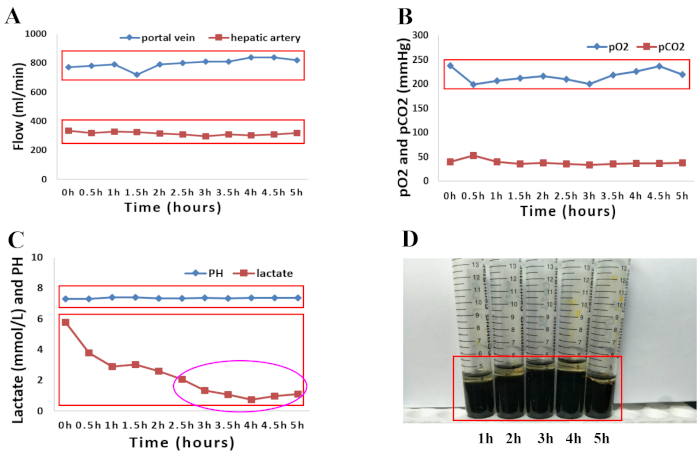
图 2:常温机器灌注 5 h 期间灌注液和胆汁灌注参数的图形表示。 (A) 动脉和门静脉血流的变化。(B) 常温灌注 5 h 期间氧合特性和 pCO2 的演变。(C) 常温灌注 5 h 内的 pH 值和乳酸水平。(D) 机器灌注期间采集的胆汁样本中胆红素的数量增加。 请单击此处查看此图的较大版本。
讨论
这种 IFLT 技术的建立是为了完全避免 IRI。本文提供了从器官获取、异位保存到植入的分步 IFLT 方案。
基于 NMP,IFLT 为移植物提供从采购和坚持到植入的不间断血液和氧气供应。大量研究表明,与静态冷保存相比,NMP 在降低 IRI、提高器官活力和修复移植物损伤方面具有显著优势12。通过手术技术的创新和 NMP 技术在各种器官中的进步,无缺血器官移植 (IFOT) 的概念有望扩展到所有实体器官移植,显着改善器官移植的早期和长期预后,并最大限度地利用边缘器官。IFOT 技术目前仅用于脑死亡 (DBD) 后捐献来源的器官移植,但通过选择合理的血管插管和灌注参数,也适用于亲属活体器官捐献 (LDOD) 的移植。心源性死亡 (DCD) 后捐献可分为两类:DCD作(对于不符合脑死亡标准的机械通气患者,cDCD 在故意召回生命支持后停止)和较小程度的不受控制的 DCD(心脏骤停后复苏不成功,uDCD)12。在发生器官温缺血损伤的 uDCD 衍生移植物中,应在器官摘取前迅速建立区域 NMP。在这种情况下,虽然该技术不能完全避免 IRI,但可以最大限度地修复对器官的损伤。值得注意的是,cDCD 衍生的移植物在大多数国家/地区被广泛使用。在区域 NMP 技术的支持下,IFOT 也可以应用于此类捐献衍生的器官移植,以避免后续 IRI 的发生。由于 DCD 器官的 IRI 比 DBD 和 LDOD 器官更严重,因此这种类型的器官可能会从 IFOT 中受益最大。因此,IFOT 是一种很有前途的器官移植方法,几乎适用于所有捐献来源的器官移植,其巨大的应用前景值得探索。
在此过程中,需要注意几个方面。在采购过程中,CHA 完全解离,LGA 结扎,腹腔干释放到腹主动脉,变异附件 HA 需要在体内重建。
在使用机器灌注的保存过程中,确保灌注参数稳定,HA 和 PV 的压力和流速控制在生理状态范围内。灌注压可以略微增加,以确保在植入过程中流量足以供应肝脏。
对于供体肝植入的过程,应注意 PV 和 HA 的插管。应实时监测血流参数,以确保动脉和门静脉血流的供应。当供体-受体 SHIVC 和 PV 吻合时,应避免多余和扭曲的血管。
在整个移植过程中持续的血液供应以及在器官灌注过程中向灌注液中添加额外药物的机会为在移植前评估和改善器官质量提供了潜力。因此,这种方法可以显着改善移植结果并增加可用于移植的器官数量。
披露声明
作者没有需要声明的竞争利益。
致谢
本研究得到了国家自然科学基金(81401324和81770410)、广东省科技国际合作基地(器官移植)(2015B050501002)、广东省杰出青年科学基金(2015A030306025)、广东省高层次人才培养专项支持计划(2015TQ01R168)、广州市珠江新星计划(201506010014)和青年科学计划项目中山大学教师 (16ykpy05),中国
材料
| Name | Company | Catalog Number | Comments |
| 10% calcium gluconate | Hebei Tiancheng Pharmaceutical Co, Ltd | 1S181124101 | 30 mL |
| 25% magnesium sulphate | Hebei Tiancheng Pharmaceutical Co, Ltd | H20033861 | 3 mL |
| 5% sodium bicarbonate | Huiyinbi Group Jiangxi Dongya Pharmaceutical Co, Ltd | H36020283 | The amount depends on the pH |
| Cefoperazone sodium and sulbactam sodium | Pfizer | H20020597 | 1.5 g |
| Compound Amino Acid Injection | Guangdong Litai Pharmaceutical Co., Ltd | H20063797 | 250 mL |
| Crossed-matched leucocyte-depleted washed red cells | Guangzhou Blood Center | H20033739 | 1300 mL |
| Heparin | Chengdu Hepatunn Pharmaceutical Co., Ltd | H51021209 | 37500 U |
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Metronidazole | Shanghai Baxter Healthcare Co., Ltd. | H20003301 | 0.5 g |
| scalp acupuncture | Wuhan W.E.O.Science & Technology Development Co., Ltd | WEO-JX-32B-5.0 0.7*25mm | Bile duct cannula |
| Succinylated gelatinor | B. Braun Medical Suzhou Co., Ltd | H20113119 | 1400 mL |
参考文献
- Hanidziar, D., Koulmanda, M. Towards cytoprotection in the peritransplant period. Seminars in Immunology. 23 (3), 209-213 (2011).
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion-from mechanism to translation. Nature Medicine. 17 (11), 1391-1401 (2011).
- Ravikumar, R., Leuvenink, H., Friend, P. J. Normothermic liver preservation: a new paradigm. Transplant International. 28 (6), 690-699 (2015).
- Jayant, K., Reccia, I., Shapiro, A. M. J. Normothermic ex-vivo liver perfusion: where do we stand and where to reach. Expert Review of Gastroenterology & Hepatology. 12 (10), 1045-1058 (2018).
- Hessheimer, A. J., Riquelme, F., Fundora-Suarez, Y., Garcia Perez, R., Fondevila, C. Normothermic perfusion and outcomes after liver transplantation. Transplantation Reviews (Orlando, Fla). 33 (4), 200-208 (2019).
- Weissenbacher, A., Vrakas, G., Nasralla, D., Ceresa, C. D. L. The future of organ perfusion and re-conditioning. Transplant International. 32 (6), 586-597 (2019).
- von Horn, C., Minor, T. Modern concepts for the dynamic preservation of the liver and kidneys in the context of transplantation. Pathologe. 40 (3), 292-298 (2019).
- Czigany, Z., et al. Machine perfusion for liver transplantation in the era of marginal organs-New kids on the block. Liver International. 39 (2), 228-249 (2019).
- Wettstein, D., et al. Machine perfusion: new opportunities in abdominal organ transplantation. Orvosi Hetilap. 159 (46), 1882-1890 (2018).
- Lai, Q. R. N., et al. Role of perfusion machines in the setting of clinical liver transplantation: A qualitative systematic review. Clinical Transplantation. 32 (8), 11(2018).
- He, X., et al. The first case of ischemia-free organ transplantation in humans: A proof of concept. American Journal of Transplantation. 18 (3), 737-744 (2017).
- Jassem, W., et al. Normothermic Machine Perfusion (NMP) inhibits proinflammatory responses in the liver and promotes regeneration. Hepatology. 70 (2), Baltimore, Md. 682-695 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。