Method Article
Chick Ciliary Ganglion Nöronların İzolasyon ve Kültür
Bu Makalede
Özet
Chick siliker gangliyonu (CG) parasempatik sinir sisteminin bir parçasıdır. Civciv CG nöronların nöronal kültürlersinir kas etkileşimleri çalışmada etkili hücre modelleri olduğu gösterilmiştir. Biz diseksiyon, dissosilasyon ve civciv embriyolarından CG nöronların in vitro kültür için ayrıntılı bir protokol açıklar.
Özet
Chick siliary gangliyonu (CG) parasempatik sinir sisteminin bir parçasıdır ve gözde mevcut kas dokularının innervasyonu sorumludur. Bu ganglion striated ve düz kas lifleri innerve silikya ve koroidal nöronların homojen bir popülasyon tarafından oluşturulan, sırasıyla. Bu nöronal tiplerin her biri belirli göz yapılarını ve fonksiyonlarını düzenler. Yıllar içinde, civciv silikya gangliyonu nöronal kültürlerkas-sinir sistemi etkileşimleri çalışmada etkili hücre modelleri olduğu gösterilmiştir, hangi kolinerjik sinapslar yoluyla iletişim. Siliary ganglion nöronlar, çoğunluğu, kolinerjik vardır. Bu hücre modeli kolinerjik yanı sıra, çeşitli nöronal türleri oluşturan daha önce kullanılan heterojen hücre modelleri için nispeten yararlı olduğu gösterilmiştir. Anatomik olarak, siliyer ganglion optik sinir arasında lokalize (ON) ve koroid fissür (CF). Burada civciv embriyolarından silyary gangliyon nöronların diseksiyon, dissosilasyon ve in vitro kültürü için ayrıntılı bir prosedür açıklıyoruz. CG nöronların son derece saf ve istikrarlı hücresel kültürleri elde etmek için adım adım protokol sağlayarak sürecin önemli adımlarını vurguluyoruz. Bu kültürler 15 gün boyunca in vitro olarak korunabilir ve bu vesileyle, CG kültürlerin normal gelişimini gösterir. Sonuçlar da bu nöronlar nöro-müsküler kolinerjik sinapslar yoluyla kas lifleri ile etkileşime girebilirsiniz göstermektedir.
Giriş
Siliary ganglion (CG) nöronlar parasempatik sinir sistemine aittir. Bu nöronlar kolinerjik, muskarinik veya nikotinik sinaps lar kurmak mümkün olmak1,2,3. Anatomik olarak, CG optik sinir (ON) ve koroid fissür (CF) arasında gözün arka kısmında bulunan ve erken embriyonik aşamalarında yaklaşık 6000 nöronoluşur1,4. Kültürde ilk hafta, siliary ganglion nöronlar multipolar morfolojisi mevcut. Bir hafta sonra, tek kutuplu bir duruma geçmeye başlarlar, bir neurite uzaması ve akson5'ioluşturması ile. Buna ek olarak, CG nöronların yaklaşık yarısı piliç embriyo gelişiminin 8ve 14 gün arasında, hücre ölümü programlanmış bir süreç yoluyla ölür. Yaklaşık 3000 nöronların siliya ganglion toplam nüfus adabı nöron ların sayısındaki bu azalma6,7,8. In vitro, kas hücreleri ile yetiştirilen CG nöronların sayısında azalma yoktur9 ve CG nöronlar birkaç hafta için kültüre edilebilir1,9.
Siliyer ganglion siliyer nöronlar ve koroidal nöronların homojen bir popülasyon oluşur, Her CG nöronal popülasyonun yarısını temsil eden, göz kas innerve. Bu iki tip nöron yapısal, anatomik ve işlevsel olarak farklıdır. Siliary nöronlar iris ve lens üzerinde triated kas lifleri innerve, gözbebeği kasılması sorumlu olmak. Koroidal nöronlar koroid,1,10,11,,12düz kas innerve .,
Tavuk siliyer ganglion nöronların Kültürler nöromüsküler sinaps ve sinaps oluşumu,1,5,9çalışma için yararlı araçlar olduğu gösterilmiştir. Nöromüsküler sinapslar kolinerjik olduğunu göz önünde bulundurarak13, kolinerjik bir nöronal popülasyon kullanarak – CG nöronlar – önceki hücre modelleri için potansiyel bir alternatif olarak ortaya çıktı14. Bu modeller heterojen nöronal popülasyondan oluşuyordu, bu da sadece küçük bir kısmı kolinerjik. Alternatif olarak, siliyer ganglion nöronlar nispeten hızlı in vitro geliştirmek, ve yaklaşık 15 saat sonra zaten sinaps formu1. CG nöronlar farklı araştırma çalışmaları için yıllar boyunca bir model sistemi olarak kullanılmıştır, izolasyon ve manipülasyon nispeten kolaylığı nedeniyle. Bu uygulamalar optogenetik çalışmalar, sinaps gelişimi, apoptoz ve nöromüsküler etkileşimleriiçerir 14,15.
Biz embriyonik gün 7 (E7) civciv embriyolarından silyary gangliyon nöronların diseksiyon, dissosilasyon ve in vitro kültür için ayrıntılı bir prosedür açıklar. Kolinerjik nöronların son derece saf ve istikrarlı hücresel kültürleri elde etmek için adım adım protokol sağlıyoruz. Ayrıca, özel dikkat gerektiren ve nöronal kültürlerin kalitesini artıracak protokolün önemli adımlarını da vurguluyoruz. Bu kültürler en az 15 gün boyunca in vitro muhafaza edilebilir.
Protokol
1. Reaktiflerin hazırlanması
NOT: Bu işlem için gerekli malzemeler şunlardır: forseps (nº 5 ve nº 55), cerrahi cımbız, diseksiyonu Petri yemekleri (siyah alt), 24 kuyulu tabaklar, plastik Pasteur pipet, ateş cilalı cam Pasteur pipet, 10 mL şırınga, 0.22 μm şırınga filtre.
- Cam kapaklar, forsepsler (nº 5 ve nº 55), cerrahi cımbızlar, Petri kapları (siyah alt), distile H2O, pipetler ve ameliyat malzemesi dahil olmak üzere protokol için gerekli tüm malzemeyi hazırlayın ve sterilize edin.
- 0.1 mg/mL Poli-D-Lizin (PDL) çözeltisi hazırlayın.
- PDL'yi 0,1 M borat tamponu (pH 8.2) ile 1 mg/mL (10x çözelti) konsantrasyonuna yeniden oluşturun.
- Seyreltik 1:10 içinde 166.6 mM borat tampon (pH 8.2) 0.1 mg/mL nihai konsantrasyon elde etmek için.
- 10 μg/mL laminin çözeltisi hazırlayın.
- Seyreltik 1 mg/mL laminin düz nörobazal ortamda 10 μg/mL nihai konsantrasyona kadar.
- Hank'in Dengeli Tuz Çözeltisini (HBSS) Hazırlayın: 5,36 mM KCl, 0,44 mM KH2PO4,137 mM NaCl, 4,16 mM NaHCO3, 0,34 mM Na2HPO4·2H2O, 5 mM glikoz, 1 mM sodyum pirübüvat, 10 mM HEPES tampon, 0,001% kırmızı fenol fenol. pH'ı 7.2'ye ayarlayın.
- %0.1 tripsin çözeltisi hazırlayın.
- 5 mg tripsin 1:250 tozunu 5 mL HBSS'de %0.1 nihai konsantrasyon için çözündürün.
- Tamamen eriyene kadar 4 °C'de bir rulo mikserin içinde yerleştirin.
- 10 mL şırınga ve 0,22 m şırınga filtresi kullanarak filtre uygulayın.
- Siliyer ganglia eksik ortahazırlayın: glutamin olmadan nörobazal orta, 1X B27 (ışığa duyarlı), 10% ısı-inaktive at serumu, 2% ısı inaktive FBS, 12.5 U/mL penisilin / streptomisinin (0.25x) ve 2 mM glutamin. Steril reaktifler kullanın ve steril koşullar altında orta hazırlamak.
- Siliker ganglia komple orta hazırlayın (büyüme faktörleri ile birlikte): eksik orta, eklemek 5 ng/mL GDNF ve 5 ng/mL CNTF.
2. 24 kuyulu plakalar için cam kapak lar hazırlanması
- Asit geçirmez bir kap içine cam kapakları istenilen sayıda yerleştirin ve tüm kapakları batırılmış kadar% 65 nitrik asit ekleyin. 1000 rpm hızda oda sıcaklığında (RT) bir yörünge shaker ve tüplü konteyner yerleştirin.
- Ertesi gün, dikkatle küçük bir rezervuar ve daha fazla kullanım için saklamak nitrik asit aktarın. Nitrik asit yeniden 2-3x kullanılabilir.
- Dikkatle, kalan nitrik asit kaldırmak için kapakları distile H2O ekleyin. 30 dakika ajitasyon yerleştirin, yıkama çözeltisi atın ve bu 5x tekrarlayın.
- Coverlips'i iki kez %75 etanolle durula.
- Tek tek kapakları alüminyum folyo ile kaplı metal bir rafa dikkatlice ayırın ve 50 ºC'de 10-15 dakika veya tamamen kuruyana kadar kuluçkaya yatırın.
NOT: Cam kapakları birbirine yapışacak şekilde otoklavlamayın. - Kapakları UV ışığı altında 10-15 dakika sterilize edin. Nöronal doku kültürü için kapakları steril koruyun.
3. 24 kuyulu plakalar için cam kapaklar kaplama
- Steril bir cızırtıcı kullanarak, 24 kuyulu bir plakanın her kuyunun içine bir kapak kaydırın.
- 0.1 mg/mL PDL 500 μL ekleyin ve bir gecede 37 °C'de kuluçkaya yatırın.
- Ertesi gün, steril distile H2O ile iki kez kapakları durular. Daha sonra, her kapak kaymasına 500 μL distile su ekleyin ve oda sıcaklığında 30 dakika bekletin.
- Suyu atın ve her kuyuya 350 μL 10 g/mL laminin çözeltisi ekleyin.
- 37 °C'lik bir kuluçka makinesine 2 saat yerleştirin.
- Hücre kaplama önce, laminin çözeltisi kaldırmak ve düz nörobazal orta ile iki kez yıkayın.
NOT: Kapak kapaklarının herhangi bir zamanda kurutulmamaması önemlidir. - 300 μL tam orta ekleyin ve kaplama süresine kadar 37 °C ve %5 CO2'de bir kuvözde bırakın. Hücreleri kaplamadan önce, bu ortamı çıkarın.
4. Tavuk embriyosu siliyer gangliyonu kültürü (embriyonik gün 7)
- Silikal gangliyon diseksiyonu (CG)
- Kuvözden yumurtaçıkarın ve% 75 etanol ile sprey.
NOT: Yumurtalar ~16 °C'de saklanır ve 37.7 °C'de 7 gün (veya istenilen embriyonik evre) kuluçkaya yatırılır. Burada kullanılan yumurtalar Ross tavuk türünden. - Bir makas ile yumurta üst kesin ve bir kaşık kullanarak embriyo çıkarmak. Buz gibi HBSS ile bir Petri kabına embriyo yerleştirin ve boyun bölgesinde keserek vücuttan baş ayırın.
NOT: Embriyo yumurtadan çıkarılır çıkarılmaz hücre ölümünden sorumlu proteazlar üretebilir. Hücre ölümünü en aza indirmek için embriyo kabuğun dışında olduğunda kafanın vücuttan hızla ayrılması önemlidir. - Embriyonun başını buz gibi HBSS'de tutun.
- Embriyo başını yukarı tutun ve nº 5 forceps ile civciv gagasında düzeltmek. Daha sonra nº 55 forceps ile, göz çevresindeki deri ince tabaka kaldırmaya başlar.
- Dikkatle göz kaldırmak ve arka kısmına erişmek için döndürün. Civciv başından göz ayırırken, optik sinir kesitli dikkat edin. Bu siliary ganglion yerelleştirmek için yardımcı olacaktır.
- Göz ayrıldıktan sonra, arka tarafı ile tutmak ve kesitli optik sinir ve koroid fissür bitişik siliary ganglion fark. Preganglionik sinir hala siliyer ganglion bağlı olabilir, hangi kimliğini kolaylaştırır.
- Her gözden silier ganglion diseksiyon ve her ganglion etrafında fazla doku kaldırarak çok iyi temiz.
NOT: ~1x106 hücre/mL verim elde etmek için ~70 CG'yi inceleyin. Elde edilen hücre popülasyonunda nöronal olmayan hücreler de bulunduğuna dikkat ediniz. Non-nöronal hücrelerin sayısını azaltmak ve sonuç olarak, nöronal popülasyonun saflığını artırmak için, mümkün olduğunca siliyer gangliyonu temizlemek için çok önemlidir, tüm aşırı doku kaldırarak.
- Kuvözden yumurtaçıkarın ve% 75 etanol ile sprey.
- Sissosiyatasyon ve siliyer gangliyat kültürü
- Steril plastik Pasteur pipetkullanarak 15 mL'lik bir tüpe tüm silikya ganglia'yı toplayın.
NOT: Pipet duvarına ganglia eki en aza indirmek için Pasteur pipet önceden ıslak önemlidir. - Santrifüj 200 x g2 dakika silikya gangliyonu .
- Dikkatlice, pasteur pipet ve daha sonra bir P1000 mikro pipet kullanarak tüm HBSS ortamı nı çıkarın. 1 mL%0.1 tripsin çözeltisi ekleyin ve 37 °C'de 20 dakika boyunca bir su banyosunda ajitasyon olmadan kuluçkaya yatırın.
- 200 x g2 dakika santrifüj .
- Hemen tripsin çözeltisini çıkarın ve 1 mL eksik ortaekleyin.
NOT: Tamamlanmamış ortam hemen tripsin etkisini durduracak serum içerir. - 200 x g 2 dakika santrifüj ve tüm orta kaldırın.
- Tam orta350-500 μL ekleyin.
NOT: Hücreleri ayrıştırmak için gerekli hacim elde edilen siliyer gangliyer sayısına ve dolayısıyla elde edilen pelet boyutuna bağlıdır. ~70 CG için 500 μL orta kullanılması tavsiye edilir. - CG'leri ilk olarak P1000 ve ardından 10-15x'i ateş cilalı cam Pastöre pipet kullanarak 10-15x'i yukarı ve aşağı borularla ayırın. Hücre kaybını en aza indirmek için hava kabarcığı oluşumunu önleyebilirsiniz.
NOT: Hücresel süspansiyonu kaplamaya kadar buzda tutun. - Trypan mavisi solüsyonu ve standart bir Neubauer odası kullanarak hücresel yoğunluğu belirleyin.
- Plaka 1 x 104 hücre/mL 24-iyi plaka her kuyuda tam orta 500 μL hücre süspansiyon uygun hacmi seyrelterek (10 μM 5'-FDU ile desteklenmektedir).
- 37 °C, %5 CO2 kuluçka makinesinde kuluçka hücreleri.
- Steril plastik Pasteur pipetkullanarak 15 mL'lik bir tüpe tüm silikya ganglia'yı toplayın.
5. İmmünositokimya ve siliker nöronların görüntü analizi
- Daha önce açıklandığı gibi bu yazıda sunulan immünostokimya tayini gerçekleştirin16,17.
- Aşağıdaki primer antikorları kullanın: fare monoklonal b-III tubulin (1:1000, T8578), tavuk monoklonal nörofilament M (1:1000, AB5735), fare monoklonal SV2 (1:1000, AB2315387).
- İkincil antikorlar olarak, Alexa Fluor 568-konjuge keçi anti-fare antikor (1:1000, A11031), Alexa Fluor 568-konjuge keçi anti-tavuk antikor (1:1000, A11041), Alexa Fluor 647-konjuge keçi anti-fare antikor (1:10000, A32222).
- Nükleer boyama (P36935) için DAPI ile montaj ortamı kullanarak montaj kapakları.
Sonuçlar
Bu yordam Için tahmini süre sıkıca her belirli bir deney için gerekli verim bağlıdır ve böylece, izole edilmesi gereken siliyer gangliyer sayısına. 1 x 106 hücre/mL tahmini verim için, yaklaşık 70 silikya gangliyonu (35 yumurta) izole edin. Bu sayıda ki gangliyon için diseksiyon işlemi 2-3 saat, toplam işlem için ise toplam 4-5 saat sürer. İzolasyon protokolünün adım adım illüstrasyonu Şekil 1A'dagösterilmiştir. Siliyer ganglion belirlenmesi zor olabilir, özellikle ilk kez bu protokolü gerçekleştirirken. Silikal ganglion optik sinir ve koroid fissür yakın lokalize (Şekil 1B). Diseksiyon işleminin temel adımları Şekil 2'degösterilmiştir. İlk olarak, embriyo yumurta kaldırılır ve buz gibi HBSS yerleştirilir. Kafa vücuttan ayrılır ve bir kez daha, bir diseksiyon Petri kabında buz gibi HBSS yerleştirilir(Şekil 2A-2C). Daha sonra, göz civciv başından çıkarılır ve siliary ganglion izole edilir (Şekil 2D-2H).
Bu protokolle elde edilen kültürler son derece saftır. Ancak, ganglia temizlik ve aşırı doku kaldırma kuvvetle başarı ve kültürün saflığı dikte. Hücreler hızlı gelişir ve genel deney bunu gerektiriyorsa kültürde ilk günlerde zaten kullanılabilir. Yine de, kültürler 15 gün veya daha fazla süreyle korunabilir. Kültürleri 7-8 günden daha uzun süre kullanıyorsanız, kültür ortamının üçte birini her 2-3 günde bir taze ortamla değiştirdiğinden emin olun. 1 gün in vitro sonra, CG nöronlar multipolar morfolojisi göstermektedir. Ancak, neurite uzantısı hızla oluşur, ve bir birincil nöronal ağ zaten 24 saat sonra kurulmuştur. 8 gün in vitro sonra, nöronlar zaten bir unipolar duruma geçti, nöritler biri uzanır ve akson formları nerede. Nöronal ağ gelişimin bu aşamasında çok yoğundur(Şekil 3 ve Şekil 4).
Siliary ganglion nöronlar parasempatik sinir sistemine ait kolinerjik nöronlar vardır. In vivo, Bu nöronlar gözde kas innervasyonu sorumludur. Bu nöronal kültürler çok iyi nöromüsküler sinaps çalışmaları için uygundur. Bunun için, CG nöronlar kas hücrelerinin üstüne kaplanmış olabilir. Civciv pektoral kas kesildi ve geliştirmek ve DIV 4 kadar in vitro maturate izin verildi. CG nöronlar daha sonra kas tabakasının üstüne kaplama ve co-kültür 3 gün daha geliştirmek için izin verildi. Bu noktada, kas lifleri oluşur ve kolayca birden fazla çekirdek (mavi) varlığı ile tespit edilebilir. Sinaptik vezikül glikoprotein 2A (SV2) immünboyama, presinaptik belirteç CG nöronlar aksonlar ve kas lifleri arasında kurulan sinapsvarlığını gösterir(Şekil 5).

Şekil 1: Diseksiyon protokolü ve silyary ganglion şeması. (A) İzolasyon ve kültür protokolü diyagramı. (B) Gözün arka kısmında civciv siliary ganglion lokalizasyonu şeması. Optik sinir, siliker ganglion ve koroid fissür oklarla gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: E7 civciv silikon diseksiyonu. (A) Makas kullanarak yumurtanın üst kesin. (B) Bir kaşıkla yumurta dan embriyo çıkarın ve buz gibi HBSS ile bir diseksiyon Petri kabına yerleştirin. (C) Boyun bölgesini keserek başı vücuttan ayırın. (D) Forcep nº 5 ile tutarak gagasındaki embriyonun başını sabitler. (E) Forcep nº 55 kullanarak hafif bir dönüş le gözü çıkarın. (F) Gözün posterior görünümü. Oklar optik sinir lokalizasyonu gösterir, koroid fissür ve siliyer ganglion. (G) Siliyer ganglion diseksiyon. (H) Kesilmiş silikya ganglion. Fazla doku çıkarılmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Siliary ganglion nöronlar in vitro gelişimi. DIV 1, 3, 8 ve 15'teki CG nöronların faz kontrast görüntüleri. CG nöronlar kaplama olarak, hemen neurite büyüme başlatmak. DIV 15'te aksonal ağ çok yoğundur ve bu aşamada nöritler tamamen dendrit ve aksonlar olarak ayrılır. Faz kontrast görüntüleri plan-Apochromat 20x ph2 hedefi ile konfokal mikroskop kullanılarak elde edildi. Ölçek çubuğu: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: DIV 8'de CG nöronların immünositokimyası. CG nöronlar in vitro 8 gün sonra iyi kurulmuş bir nöronal ağ göstermektedir. Çekirdekler DAPI (mavi) ve aksonlar b-III tubulin (kırmızı) ile boyandı. Floresan görüntüleri plan-Apochromat 20x hedefi olan bir konfokal mikroskop kullanılarak elde edildi. Ölçek çubuğu: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
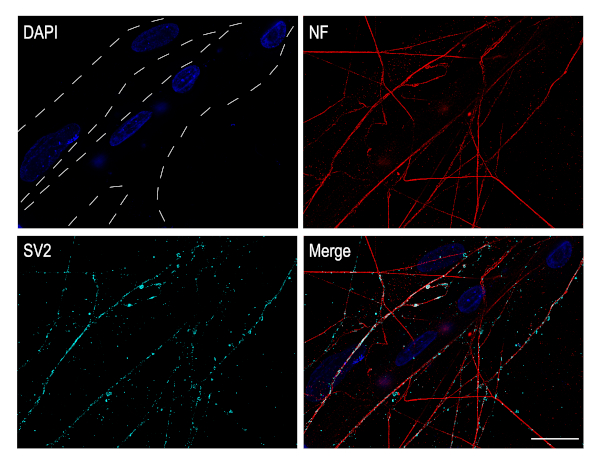
Şekil 5: Kültürlü CG nöronlar kas lifleri ile sinaps kurmak. CG nöronlar-pektoral kas co-kültürlerin immünositokimya görüntüleri. Kesik çizgilerle tanımlanan kas lifleri, DAPI (mavi) ile boyanmış birden fazla çekirdek sunar. Aksonların nörofilament (kırmızı) ve sinaptik veziküller SV2 (siyan) karşı etiketlendi. Görüntüler, plan-Apochromat 63x yağ hedefine sahip bir konfokal mikroskop kullanılarak elde edilebildi. Ölçek çubuğu: 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde CG nöronlarının nasıl hazırlanacağını ve kültürlendirilebildiğini gösterdik. Siliyer ganglion tanımlama ve diseksiyon deneyimsiz kullanıcılar için zor olabilir. Bu nedenle, E7 civciv siliyer gangliyonu verimli bir şekilde diseksiyon, doku ayrıştırmak ve en az 15 gün boyunca muhafaza edilebilir nöronal kültürler hazırlamak için ayrıntılı ve adım adım prosedür salıyoruz. Bu protokol ile elde edilen silyary ganglion nöronlar da kas hücreleri ile co-kültür için uygundur.
Civciv embriyonik gelişiminin farklı gelişim evrelerinde siliyer gangliyer, çalışmanın amacına bağlı olarak hücre modeli olarak kullanılabilir. Ancak, CG nöronların kültürleri için onlar embriyonik gün 7 ve 818arasında civciv embriyo izole olması önerilmektedir. Embriyonik evre E8, CG nöronlar henüz nöronal ölüm süreçleri ve non-nöronal hücrelerin sayısı nöronal hücreler ile nispeten azalır geçmedi18. Bu, titiz bir diseksiyon prosedürü ve çok iyi temizlenmiş gangglia ile birlikte, siliyer ganglion nöronlar son derece saf bir kültür için katkıda bulunacak, olmayan nöronal hücreler tarafından çok az kontaminasyon ile, fibroblastlar veya glial hücreler gibi.
CG nöronların izolasyonsırasında, kritik noktalardan biri dG'nin tanımlanması ve temizlenmesidir. Bu kadar küçük bir yapının diseksiyon, siliyer ganglion gibi, lokalizasyon göz önüne alındığında zor olabilir, ganglion yanı sıra ganglion kendisi boyutunu tanımlamak için yeteneği. Bu gangliyonun diseksiyon sırasında forceps'a bağlanması normaldir. Yüksek kaliteli diseksiyon aletleri başarılı bir diseksiyon için çok önemlidir ve forseps lere ganglia eki en aza indirecektir. GC'nin temizlenmesi nöronal olmayan hücrelerle kontaminasyonu önlemek için önemlidir. Yaklaşık 70 gangliyonu izole etmek için ~ 1x106 hücreleri / mL hücresel yoğunluk elde etmek için gerekli olan, ganglia 5-15x daha fazla sayıda var periferik sinir sisteminin diğer nöronal dokuların aksine3.
Kültürde, tam ortama 5'-FDU eklenmesi GC kültürünün nöronal olmayan hücrelerle kontaminasyonunu azaltır. 5'-FDU hücre çoğalmasını inhibe eden bir anti-mitotik bileşiktir, yani glial hücrelerin ve fibroblastların çoğalmasını. Ortama eklenen 5'-FDU konsantrasyonu S fazında hücre döngüsünü durdurmak için yeterli dir ancak CG nöronların normal gelişimine zararlı değildir3,19,20. 5'-FDU ile tedavi süresi ayarlanabilir. Ancak, CG nöronlar kısa sürede yoğun bir aksonal ağ kurmak bu yana, 5'-FDU kaplama zamanı gibi erken kültüre eklenmelidir.
Bu modelin ana sınırlamalarından biri fizyolojik koşullar altında CG nöronların normal gelişimini temsil değildir. Ovo'da, CG nöronların yaklaşık yarısı civciv embriyo gelişiminin 8ve 14. Kültürde, orta onun hayatta kalma izin nörotrofik faktörler ile takviye edildiğinde CG nöronların sayısında azalma yoktur1,6,14.
Civciv silyary ganglion diseksiyon elde edilen nöronal popülasyon kolinerjik nöronların homojen bir popülasyon, otonom sinir sistemine ait. Bu CG koroid popülasyonda nörotransmitterlerin ekspresyonu hedef odaklı olduğu unutulmamalıdır, hangi co-kültür kullanılan kas türüne bağlı olarak engel olabilir24. Çalışmanın amacı genetik kimlik veya motor nöron kendisi alt tipi ile ilgili ise, o zaman CG nöronlar en uygun nöronal model olmayabilir. Ayrıca, kas liflerinin innervasyonunda motor nöronların özgüllüğü CG nöron co-kültürleri kullanırken başarılı olmayabilir beri, Bu durumda, kas lifleri innervated çarpılabilir25. Ancak, Bu nöronal kültür çeşitli avantajları vardır, sadece korumak ve yumurta kuluçka temel ekipman gerektirir, bu makul ucuz bir prosedürdür ve, daha da önemlisi, nöromüsküler sinaps çalışmaları için mükemmel bir model sağlar1, CG nöronlar nörotransmisyon mekanizmaları omurilik motor nöronlarda meydana gelen olanlara çok benzer beri. Daha önce bu tür çalışmalariçin kullanılan hücre modelleri omurilik duyusal nöronlar vardı12,21,22,23. Ancak, bu co-kültürler nöronların heterojen bir nüfus oluştu, tüm kolinerjik değil ve, böylece, nöronların sadece küçük bir kısmı kas hücreleri ile fonksiyonel temas kurmak başardık1. Bu çalışmada ortaya konan gelişimsel analizin (immünositokimya) yanı sıra elektrofizyoloji ve nöronal sağkalım gibi CG kültürlerinde başka tahliller de yapılabilmektedir.
Bu protokole dayanarak, örneğin belirli mRNA'ların ve proteinlerin hücre altı lokalizasyonunun sinaps oluşumunu ve işlevini nasıl düzenlediği gibi ek bilimsel sorular ele alınabilir. Ayrıca, sinir-kas ko-kültürlerkolayca kurulmuş ve yaralanma yeri nöromüsküler kavşak olduğunda nöromüsküler hastalıkların çalışması için daha fazla kullanılabilir. Nöromüsküler hastalıklar disfonksiyon kas kendisi ile ilişkili olabilir anlamda doğada heterojen, periferik sinirler veya nöromüsküler kavşaklar26. Böylece, bu co-kültürler aracılığıyla sonuçta nöromüsküler hastalıkların gelişimi ve ilerlemesi altında yatan nöromüsküler kavşak değişiklikleri çalışma mümkün olacaktır. Başka bir ilginç olasılık fare trigeminal sistemine bu protokolü adapte etmek olacaktır. Bu nöronlar kolayca erişilebilir, ve gelişimsel desen iyi bilinmektedir27. Fareler genetik manipülasyona elverişli olduğundan ve trigeminal sistem topografik harita oluşumu açısından iyi karakterize olduğundan nöronal gelişimi incelemek için trigeminal tabanlı bir protokol kullanılarak yeni olasılıklar ortaya çıkar.
Açıklamalar
Yazarlar hiçbir rakip çıkarları olduğunu beyan.
Teşekkürler
Bu çalışma, CENTRO-01-0145-FEDER-000008:BrainHealth 2020, CENTRO2020 CENTRO-01-0145-FEDER-000003:pAGE projeleri kapsamında Centro 2020 Bölgesel Operasyonel Programı aracılığıyla Avrupa Bölgesel Kalkınma Fonu (ERDF) tarafından finanse edilerek finanse edilebilmektedir. CENTRO-01-0246-FEDER-00018:MEDISIS ve COMPETE 2020 - FCT üzerinden Rekabet ve Uluslararasılaşma için Operasyonel Program ve Portekiz ulusal fonları - Fundação para a Ciência e a Tecnologia, I.P., uidb/04539/2020 projeleri kapsamında, UIDB/04501/2020, POCI-01-0145-FEDER-022122:PPBI, PTDC/SAU-NEU/104100/2008 ve bireysel hibeLer SFRH/BD/141092/20 118 (M.D.), DL57/2016/CP1448/CT0009 (R.O.C.), SFRH/BD/77789/2011 (J.R.P.) ve Marie Curie Actions tarafından - IRG, 7.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2’-deoxiuridina (5'-FDU) | Merck (Sigma Aldrich) | F0503 | |
| Alexa Fluor 568-conjugated goat anti-chicken antibody | Thermo Fisher Scientific | A11041 | |
| Alexa Fluor 568-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A11031 | |
| Alexa Fluor 647-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A21235 | |
| B27 supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Chicken monoclonal neurofilament M | Merck (Sigma Aldrich) | AB5735 | |
| D-(+)-Glucose monohydrate | VWR | 24371.297 | |
| Fetal Bovine Serum (FBS), qualified, Brazil | Invitrogen (Gibco) | 10270-106 | |
| HEPES, fine white crystals, for molecular biology | Fisher Scientific | 10397023 | |
| Horse Serum, heat inactivated, New Zealand origin | Invitrogen (Gibco) | 26050-070 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| Mouse laminin I | Cultrex (R&D systems) | 3400-010-02 | |
| Mouse monoclonal b-III tubulin | Merck (Sigma Aldrich) | T8578 | |
| Mouse monoclonal SV2 | DSHB | AB2315387 | |
| Multidishes, cell culture treated, BioLite, MW24 (50x) | Thermo Fisher Scientific | 11874235 | |
| Neurobasal medium without glutamine | Invitrogen (Gibco) | 21103-049 | |
| Penicillin/streptomycin (5,000 U/mL) | Invitrogen (Gibco) | 15070-063 | |
| Phenol red, bioreagent, suitable for cell culture | Merck (Sigma Aldrich) | P3532 | |
| Poly-D-Lysine | Merck (Sigma Aldrich) | P7886 | |
| Potassium chloride | Fluka (Honeywell Reaarch Chemicals) | 31248-1KG | |
| Potassium di-hydrogen phosphate (KH2PO4) for analysis, ACS | Panreac Applichem | 131509-1000 | |
| Prolong Gold Antifade mounting medium with DAPI | Invitrogen (Gibco) | P36935 | |
| Puradisc FP 30mm Syringe Filter, Cellulose Acetate, 0.2µm, sterile 50/pk | Fisher Scientific | 10462200 | |
| Recombinant human ciliary neurotrophic factor (CNTF) | Peprotech | 450-13 | |
| Recombinant human glial cell-derived neurotrophic factor (GDNF) | Peprotech | 450-10 | |
| Sodium chloride for analysis, ACS, ISO | Panreac Applichem | 131659-1000 | |
| Sodium dihydrogen phosphate 2-hydrate (Na2HPO4·2H2O), pure, pharma grade | Panreac Applichem | 141677-1000 | |
| Sodium Pyruvate 100 mM (100x) | Thermo Fisher | 11360039 | |
| Syringe without needle, 10 mL | Thermo Fisher | 11587292 | |
| Trypsin 1:250 powder | Invitrogen (Gibco) | 27250-018 |
Referanslar
- Betz, W. The Formation of Synapses between Chick Embryo Skeletal Muscle and Ciliary Ganglia Grown in vitro. Journal of Physiology. 254, 63-73 (1976).
- Fischbach, G. D. Synapse Formation between Dissociated Nerve and Muscle Cells in Low Density Cell Cultures. Developmental Biology. 28, 407-429 (1972).
- Bernstein, B. W. Dissection and Culturing of Chick Ciliary Ganglion Neurons: A System well Suited to Synaptic Study. Methods in Cell Biology. 71, 37-50 (2003).
- Marwitt, R., Pilar, G., Weakly, J. N. Characterization of Two Ganglion Cell Populations in Avian Ciliary Ganglia. Brain Research. 25, 317-334 (1971).
- Role, L. W., Fishbach, G. D. Changes in the Number of Chick Ciliary Ganglion. Neuron Processes with Time in Cell Culture. Journal of Cell Biology. 104, 363-370 (1987).
- Landmesser, L., Pilar, G. Synaptic Transmission and Cell Death During Normal Ganglionic Development. Journal of Physiology. , 737-749 (1974).
- Koszinowski, S., et al. Bid Expression Network Controls Neuronal Cell Fate During Avian Ciliary Ganglion Development. Frontiers in Physiology. 9, 1-10 (2018).
- Landmesser, L., Pilar, G. Synapse Formation During Embryogenesis on Ganglion Cells Lacking a Periphery. Journal of Physiology. 241, 715-736 (1974).
- Nishi, R., Berg, D. K. Dissociated Ciliary Ganglion Neurons in vitro: Survival and Synapse Formation. Proceedings of the National Academy of Sciences of the United States of America. 74, 5171-5175 (1977).
- Nishi, R., Berg, D. K. Two Components from Eye Tissue that Differentially Stimulate the Growth and Development of Ciliary Ganglion Neurons in Cell Culture. Journal of Neuroscience. 1, 505-513 (1981).
- Pilar, G., Vaughan, P. C. Electrophysiological Investigations of the Pigeon iris Neuromuscular Junctions. Comparative Biochemistry and Physiology B. 29, 51-72 (1969).
- Landmesser, L., Pilar, G. Selective Reinnervation of Two Cell Populations in the Adult Pigeon Ciliary Ganglion. Journal of Physiology. , 203-216 (1970).
- Pinto, M. J., Almeida, R. D. Puzzling Out Presynaptic Differentiation. Journal of Neurochemistry. 139, 921-942 (2016).
- Dryer, S. E. Functional Development of the Parasympathetic Neurons of the Avian Ciliary Ganglion: A Classic Model System for the Study of Neuronal Differentiation and Development. Progress in Neurobiology. 43, 281-322 (1994).
- Egawa, R., Yawo, H. Analysis of Neuro-Neuronal Synapses using Embryonic Chick Ciliary Ganglion via Single-Axon Tracing, Electrophysiology, and Optogenetic Techniques. Current Protocols in Neuroscience. 87, 1-22 (2019).
- Pinto, M. J., Pedro, J. R., Costa, R. O., Almeida, R. D. Visualizing K48 Ubiquitination during Presynaptic Formation by Ubiquitination-Induced Fluorescence Complementation (UiFC). Frontiers in Molecular Neuroscience. 9, 1-19 (2016).
- Martins, L. F., et al. Mesenchymal Stem Cells Secretome-Induced Axonal Outgrowth is Mediated by BDNF. Scientific Reports. 7, 1-13 (2017).
- Nishi, R. Autonomic and Sensory Neuron. Methods in Cell Biology. , 249-263 (1996).
- Rojo, J. M., De Ojeda, G., Portolés, P. Inhibitory Mechanisms of 5-fluorodeoxyuridine on Mitogen-induced Blastogenesis of Lymphocytes. International Journal of Immunopharmacology. 6, 61-65 (1984).
- Hui, C. W., Zhang, Y., Herrup, K. Non-Neuronal Cells are Required to Mediate the Effects of Neuroinflammation: Results from a Neuron-Enriched Culture System. PLoS One. 11, 1-17 (2016).
- Crain, S. M., Alfei, L., Peterson, E. R. Neuromuscular Transmission in Cultures of Adult Human and Rodent Skeletal Muscle After Innervation in vitro by Fetal Rodent Spinal Cord. Journal of Neurobiology. 1, 471-489 (1970).
- Kano, M., Shimada, Y. Innervation and Acetylcholine Sensitivity of Skeletal Muscle Cells Differentiated in vitro from Chick Embryo. Journal of Cellular Physiology. 78, 233-242 (1971).
- Robbins, N., Yonezawa, T. Developing Neuromuscular Juctions: First Sings of Chemical Transmission during Formation in Tissue Culture. Science. 80, 395-398 (1971).
- Squire, L. R. . Encyclopedia of Neuroscience. , (2010).
- Hooisma, J., Slaaf, D. W., Meeter, E., Stevens, W. F. The Innervation of Chick Striated Muscle Fibers by the Chick Ciliary Ganglion in Tissue Culture. Brain Research. 85, 79-85 (1975).
- Morrison, B. M. Neuromuscular Diseases. Seminars in Neurology. , 409-418 (2016).
- Davies, A. M. The Trigeminal System: An Advantageous Experimental Model for Studying Neuronal Development. Development. 103, 175-183 (1988).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır