Method Article
Изоляция и культура Чик Ciliary Ganglion нейронов
В этой статье
Резюме
Чик цилиарной ганглии (CG) являются частью парасимпатической нервной системы. Нейронные культуры цыпленка CG нейронов было показано, что эффективные модели клеток в изучении взаимодействия мышц нерва. Мы описываем подробный протокол для вскрытия, диссоциации и культуры in vitro нейронов CG от эмбрионов птенцов.
Аннотация
Чик цилиарной ганглии (CG) являются частью парасимпатической нервной системы и отвечают за иннервацию мышечных тканей, присутствующих в глазу. Этот ганглия состоит из однородной популяции цилиарных и хороидальных нейронов, которые иннервировать полосатые и гладкие мышечные волокна, соответственно. Каждый из этих нейронных типов регулирует определенные структуры глаз и функции. На протяжении многих лет, нейронные культуры цыпленка цилиарных ганглиев было показано, чтобы быть эффективными моделями клеток в изучении мышечно-нервной системы взаимодействий, которые общаются через холинергические синапсы. Ciliary ганглия нейроны, в большинстве, холинергические. Эта модель клеток была показана, чтобы быть полезным сравнительно ранее использовались неоднородные модели клеток, которые состоят из нескольких типов нейронов, кроме холинергических. Анатомически, цилиарный ганглия локализована между зрительным нервом (ON) и трещиной хороида (CF). Здесь мы описываем подробную процедуру вскрытия, диссоциации и культуры in vitro цилиарных ганглиев нейронов из эмбрионов птенцов. Мы предоставляем пошаговый протокол для получения высоко чистых и стабильных клеточных культур нейронов CG, подчеркивая ключевые этапы процесса. Эти культуры могут поддерживаться в пробирке в течение 15 дней, и, таким образом, мы показываем нормальное развитие cg культур. Результаты также показывают, что эти нейроны могут взаимодействовать с мышечными волокнами через нейро-мышечные холинергические синапсы.
Введение
Цилиаровые ганглия (CG) нейроны принадлежат к парасимпатической нервной системы. Эти нейроны холинергические, будучи в состоянии установить muscarinic или никотиновых синапсов1,2,3. Анатомически, CG расположен в задней части глаза между зрительным нервом (ON) и трещины сосудистой системы (CF) и состоит из около 6000 нейронов в ранних эмбриональных стадиях1,4. В течение первой недели в культуре, цилиарные ганглия нейроны представляют многополярную морфологию. Через неделю они начинают переходить в однополярное состояние, при этом один неврит расширяется и образует аксон5. Кроме того, примерно половина нейронов CG умирают между8-м и 14-м днем развития эмбриона цыпленка, через запрограммированный процесс клеточной смерти.th Это снижение числа нейронов приводит к общей популяции цилиарного ганглия около 3000 нейронов6,7,8. В пробирке, нет сокращения числа нейронов CG, когда выросли с мышечными клетками9 и CG нейроны могут быть культивируется в течение нескольких недель1,9.
Цилиарный ганглия состоит из однородной популяции цилиарных нейронов и хороидальных нейронов, каждый из которых представляет половину популяции нейронов в CG, иннервируя мышцы глаза. Эти два типа нейронов структурно, анатомически и функционально отличаются. Ciliary нейроны innervate полосатые мышечные волокна на радужной оболочке глаза и хрусталика, будучи ответственным за сокращение зрачка. Хороидальные нейроны иннервировать гладкую мышцу сосудистой1,10,11,12.
Культуры куриных цилиарных ганглия нейронов было показано, что полезные инструменты для изучения нервно-мышечных синапсов и формирования синапса1,5,9. Учитывая, что нервно-мышечные синапсы являются холинергические13, используя нейронной популяции, которая холинергический - CG нейронов - возникла в качестве потенциальной альтернативы предыдущим моделям клеток14. Эти модели состояли из неоднородной нейронной популяции, в которой лишь небольшая часть является холинергической. Кроме того, цилиарные ганглия нейроны развиваются относительно быстро in vitro, и примерно через 15 часов уже образуют синапсы1. CG нейроны были использованы в качестве модели системы на протяжении многих лет для различных исследований, из-за его относительно легкости изоляции и манипуляции. Эти приложения включают в себя оптогенетические исследования, развитие синапса, апоптоз и нервно-мышечные взаимодействия14,,15.
Мы описываем подробную процедуру вскрытия, диссоциации и культуры in vitro цилиарных ганглиев нейронов из эмбриональных эмбрионов 7 дня (Е7). Мы предоставляем пошаговый протокол для получения высоко чистых и стабильных клеточных культур холинергических нейронов. Мы также выделяем ключевые шаги протокола, которые требуют особого внимания и которые улучшат качество нейронных культур. Эти культуры могут поддерживаться в пробирке, по крайней мере 15 дней.
протокол
1. Подготовка реагентов
ПРИМЕЧАНИЕ: Материалы, необходимые для этой процедуры являются следующие: щипцы (no 5 и Noo 55), хирургические пинцет, рассечение Петри блюда (черное дно), 24-хорошо пластины, пластиковые пастерская пипетки, огонь полированного стекла Пастер пипетки, 10 мл шприц, 0,22 мкм шприц фильтр.
- Подготовка и стерилизация всех материалов, необходимых для протокола, включая стекло крышки, щипцы (No 5 и No 55), хирургические пинцет, Петри блюда (черное дно), дистиллированной H2O, пипетки и материал для хирургии.
- Приготовьте раствор 0,1 мг/мЛ Poly-D-Lysine (PDL).
- Восстановление PDL в буфере 0,1 М бората (рН 8.2) к концентрации 1 мг/мл (10x раствор).
- Разбавить 1:10 в буфере 166,6 мМ бората (рН 8,2) для получения конечной концентрации 0,1 мг/мл.
- Приготовьте 10 мкг/мл ламинин раствора.
- Разбавить 1 мг/мл ламинина в простой нейробазальной среде до конечной концентрации 10 мкг/мл.
- Подготовка сбалансированного раствора соли Хэнка (HBSS): 5.36 mM KCl, 0,44 мМХК 2PO4, 137 мМ NaCl, 4,16 мМ NaHCO3, 0,34 мМ На2HPO42H2O, 5 мМ глюкозы, 1 мМ натрия пируват, 10 мМ HEPES буфер, 0,001% фенол красный. Отрегулируйте рН до 7.2.
- Подготовьте 0,1% трипсин решение.
- Растворите 5 мг трипсина 1:250 порошок в 5 мл HBSS для окончательной концентрации 0,1%.
- Поместите в роликовый миксер при 4 градусах Цельсия до полного растворения.
- Фильтр с помощью шприца 10 мл и фильтра шприца 0,22 м.
- Подготовка цилиарной ганглии неполной среды:нейробазальной среды без глутамина, 1X B27 (фото-чувствительной), 10% тепло-инактивированной сыворотки лошади, 2% теплоинактивированных FBS, 12,5 U /mL пенициллин / стрептомицин (0,25x) и 2 мМ глутамин. Используйте стерильные реагенты и подготовьте среду в стерильных условиях.
- Подготовка цилиарной ганглии полной среды (дополненной факторами роста): к неполной среде, добавьте 5 нг/мЛ GDNF и 5 нг/mL CNTF.
2. Приготовление стеклянных крышков для 24-х пластин
- Поместите нужное количество стеклянных крышков внутри кислотоустойчивого контейнера и добавьте 65% азотной кислоты до тех пор, пока все крышки не будут погружены в воду. Поместите контейнер в орбитальный шейкер и инкубировать на ночь при комнатной температуре (RT) со скоростью 1000 об/мин.
- На следующий день тщательно перенесите азотную кислоту в небольшой резервуар и храните для дальнейшего использования. Азотная кислота может быть повторно использована 2-3x.
- Аккуратно добавьте дистиллированный H2O в крышки, чтобы удалить оставшуюся азотную кислоту. Место в агитации в течение 30 минут, отбросить стиральный раствор и повторить это 5x.
- Промыть крышки с 75% этанола в два раза.
- Тщательно отделить и поместить отдельные крышки в металлическую стойку, покрытую алюминиевой фольгой и инкубировать при 50 oC в течение 10-15 минут или до тех пор, пока полностью высохнет.
ПРИМЕЧАНИЕ: Не автоклав стекла coverslips, как они будут придерживаться друг к другу. - Стерилизовать крышки под ультрафиолетовым светом в течение 10-15 минут. Поддерживать крышки стерильными для культуры нейронных тканей.
3. Покрытие стеклянных крышков для 24-ну пластин
- Используя стерильный пинцет, поместите один покрывало в каждый колодец 24-хорошо пластины.
- Добавьте 500 мл 0,1 мг/мл PDL и инкубировать на ночь при 37 градусов по Цельсию.
- На следующий день, промыть крышки дважды с стерильной дистиллированной H2O. Затем добавьте 500 мл дистиллированной воды в каждый налокотый листок и оставьте на 30 минут при комнатной температуре.
- Отбросьте воду и добавьте 350 мл 10 мкг/мл ламинин раствора в каждом колодце.
- Поместите в инкубатор с 37 градусами по Цельсию на 2 ч.
- Перед клеточным покрытием, удалить раствор ламинина и промыть дважды с простой нейробасальной среды.
ПРИМЕЧАНИЕ: Важно, чтобы крышки не высыхали в любое время. - Добавьте 300 мл полной среды и оставьте в инкубаторе при 37 градусах Цельсия и 5% CO2 до времени покрытия. Перед покрытием клеток, удалить эту среду.
4. Культура цилиарных ганглиев из куриного эмбриона (эмбриональный день 7)
- Вскрытие цилиарных ганглиев (CG)
- Удалить яйца из инкубатора и распылить их с 75% этанола.
ПРИМЕЧАНИЕ: Яйца хранятся при 16 градусах Цельсия перед инкубацией при 37,7 градусов по Цельсию в течение 7 дней (или желаемой эмбриональной стадии). Яйца, используемые здесь, относятся к видам курицы Росса. - Вырезать верхнюю часть яйца с ножницами и вынуть эмбрион с помощью ложки. Поместите эмбрион в чашку Петри с ледяной HBSS и отделить голову от тела путем резки в области шеи.
ПРИМЕЧАНИЕ: Как только эмбрион удаляется из яйцеклетки, он может производить протеазы, которые отвечают за гибель клеток. Важно быстро отделить голову от тела, как только эмбрион находится за пределами оболочки, чтобы свести к минимуму гибель клеток. - Держите голову эмбриона в ледяной HBSS.
- Держите эмбрион голову вверх и исправить его в клюве цыпленка с no 5 щипцами. Затем с No 55 щипцами, начать удалять тонкий слой кожи вокруг глаза.
- Аккуратно удалите глаз и поверните его, чтобы получить доступ к задней части. Отделяя глаз от головы птенца, обратите внимание на оптический нерв, сеченный. Это поможет локализовать цилиарный ганглия.
- Как только глаз отделен, держать его с задней стороной вверх и обратите внимание на цилиарный ганглия, прилегающая к секционированному зрительному нерву и трещине сосудистой системы. Предганглионный нерв все еще может быть прикреплен к цилиарный ганглия, что облегчает его идентификацию.
- Вскрыть цилиарный ганглия от каждого глаза и очистить очень хорошо, удалив избыток ткани вокруг каждого ганглия.
ПРИМЕЧАНИЕ: Чтобы иметь выход в размере 1x106 ячеек/мЛ, вскрыть 70 КГ. Обратите внимание, что полученная популяция клеток содержит негенные клетки. Чтобы уменьшить количество ненегенальных клеток и, как следствие, повысить чистоту нейрональной популяции, очень важно максимально очистить цилиарные ганглии, удалив все лишнее ткани.
- Удалить яйца из инкубатора и распылить их с 75% этанола.
- Диссоциация и культура цилиарной ганглии
- Соберите все цилиарные ганглии в трубку 15 мЛ с помощью стерильной пластиковой пастерской пипетки.
ПРИМЕЧАНИЕ: Важно предварительно промокнуть пастер пипетки, чтобы свести к минимуму крепление ганглиев к стене пипетки. - Центрифуга цилиарных ганглиев в течение 2 минут при 200 х г.
- Осторожно, удалите все средства HBSS с помощью пастер-пипетки, а затем микропиетты P1000. Добавьте 1 мл 0,1% раствора трипсина и инкубировать в течение 20 минут при 37 градусах на водяной бане, без волнения.
- Центрифуга в течение 2 минут при 200 х г.
- Немедленно снимите раствор трипсина и добавьте 1 мл неполной среды.
ПРИМЕЧАНИЕ: Неполная среда содержит сыворотку, которая немедленно остановит эффект трипсина. - Центрифуга в течение 2 минут при 200 х г и удалить все средние.
- Добавьте 350-500 мл полной среды.
ПРИМЕЧАНИЕ: Необходимый объем для разъединить клетки зависит от количества полученных килианых ганглиев и, таким образом, от полученного размера гранул. Для 70 CG рекомендуется использовать 500 мл среднего. - Разъединяют CG путем pipetting вверх и вниз 10-15x сперва используя P1000 последовав за 10-15x используя fire-polished стекло Пастер pipette. Избегайте образования пузырьков воздуха, чтобы свести к минимуму потерю клеток.
ПРИМЕЧАНИЕ: Держите сотовую подвеску на льду до покрытия. - Определите плотность сотовой связи с помощью синего раствора Трипан и стандартной камеры Neubauer.
- Плита 1 х 104 клетки/мл в каждом колодце 24-хорошо пластины путем разбавления соответствующего объема клеточной суспензии в 500 мл полной среды (дополнено 10 м 5'-FDU).
- Инкубировать клетки в 37 кк, 5% CO2 инкубатора.
- Соберите все цилиарные ганглии в трубку 15 мЛ с помощью стерильной пластиковой пастерской пипетки.
5. Иммуноцитохимия и анализ изображений цилиарных нейронов
- Выполните иммуноцитохимию анализа, представленного в этой работе, как описано ранее16,17.
- Используйте следующие первичные антитела: моноклональный б-III тубулин мыши (1:1000, T8578), куриный моноклональный нейрофиламент М (1:1000, AB5735), мышиный моноклональный SV2 (1:10000, AB2315387).
- В качестве вторичных антител, использовать Alexa Fluor 568-конъюгированных коза анти-мышки антитела (1:10000, A11031), Alexa Fluor 568-конъюгированных козы анти-куриные антитела (1:1000, A11041), Alexa Fluor 647-конъюгъюратный коза анти-мышелов антитела (1:1000, A22135).
- Гора крышки с использованием монтажа среды с DAPI, для ядерного окрашивания (P36935).
Результаты
Расчетная продолжительность этой процедуры в строгом времени зависит от урожайности, необходимой для каждого конкретного эксперимента, и, таким образом, от количества цилиарных ганглиев, которые необходимо изолировать. Для предполагаемого выхода 1 х 106 клеток/мЛ, изолировать около 70 цилиарных ганглиев (35 яиц). Для этого количества ганглиев, это займет 2-3 часа для процедуры вскрытия и в общей сложности 4-5 часов для общей процедуры. Пошаговая иллюстрация протокола изоляции показана на рисунке 1A. Идентификация цилиарного ганглия может быть затруднена, особенно при выполнении этого протокола в первый раз. Цилиарный ганглия локализована вблизи зрительного нерва и трещины сосудистой системы(рисунок 1B). Основные этапы процедуры вскрытия показаны на рисунке 2. Во-первых, эмбрион удаляется из яйцеклетки и помещается в ледяной HBSS. Голова отделена от тела и, еще раз, помещена в ледяной HBSS в рассечение Петри блюдо(рисунок 2A-2C). Затем глаз удаляется с головы цыпленка и цилиарный ганглия изолирована(Рисунок 2D-2H).
Культуры, полученные с помощью этого протокола, очень чисты. Однако очистка ганглиев и удаление лишних тканей сильно диктует успех и чистоту культуры. Клетки развиваются быстро и могут быть использованы уже в первые дни в культуре, если общий эксперимент требует этого. Тем не менее, культуры могут быть сохранены в течение 15 дней, или более. При использовании культуры дольше 7-8 дней, убедитесь, что заменить треть среды культуры со свежим средством каждые 2-3 дня. После 1 дня в пробирке, CG нейроны показывают многополярную морфологию. Тем не менее, расширение неврита происходит быстро, и первичная нейронная сеть уже создана после 24 часов. После 8 дней в пробирке, нейроны уже перешли в однополярное состояние, где один из невритов расширяется и образует аксон. Нейронная сеть очень плотная на данном этапе развития(рисунок 3 и рисунок 4).
Ciliary ганглия нейроны холинергических нейронов, которые принадлежат к парасимпатической нервной системы. In vivo, эти нейроны отвечают за иннервацию мышц в глазу. Эти нейронные культуры очень хорошо подходят для изучения нервно-мышечных синапсов. Для этого, CG нейроны могут быть покрыты поверх мышечных клеток. Пыхтя грудной мышцы был вскрыт и позволил развиваться и созревания в пробирке до DIV 4. CG нейроны были затем покрыты на верхней части мышечного слоя и со-культуры позволило развиваться в течение 3 дней. В этот момент, мышечные волокна образуются и могут быть легко идентифицированы по присутствию нескольких ядер (синий). Синаптический пузырьк гликопротеин 2A (SV2) иммуносетенирование, пресинаптический маркер показывает наличие синапсов, которые устанавливаются между CG нейронов аксонов и мышечных волокон (Рисунок 5).

Рисунок 1: Схема протокола вскрытия и цилиарного ганглия. (A) Диаграмма протокола изоляции и культуры. (B) Схема цыпочки цилиарной локализации ганглия в задней части глаза. Оптический нерв, цилиарный ганглия и трещина хороида обозначены стрелками. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 2: Вскрытие E7 цыпленок цилиарный ганглия. (A) Вырезать верхней части яйца с помощью ножниц. (B) Удалите эмбрион из яйца с ложкой и поместите его в рассечение Петри блюдо с ледяной HBSS. (C) Отделите голову от тела, разрезая область шеи. (D) Исправить голову эмбриона в клюве, держа с forcep No 5. (E) Удалите глаз нежным вращением с помощью хап No 55. (F) Задний вид глаза. Стрелки указывают на локализацию зрительного нерва, трещины хороида и цилиарного ганглия. (G) Вскрыть цилиарный ганглия. (H) Всчеречный цилиарный ганглия. Избыток ткани должен быть удален. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 3: Ciliary ганглия нейронов развития в пробирке. Фазы контрастных изображений CG нейронов на DIV 1, 3, 8 и 15. Как CG нейроны покрыты, они сразу же инициировать нейрит нарост. В DIV 15 аксонная сеть очень плотная и на данном этапе нейриты полностью дифференцированы на дендриты и аксоны. Фазовые контрастные изображения были приобретены с помощью конфокального микроскопа с целью план-Апохромат 20x ph2. Масштабная планка: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 4: Иммуноцитохимия нейронов CG на DIV 8. CG нейроны показывают хорошо налаженные нейронной сети после 8 дней в пробирке. Ядра были окрашены DAPI (синий) и аксоны были окрашены b-III тубулина (красный). Флуоресценции изображения были приобретены с помощью конфокального микроскопа с планом-Апохромат 20x цели. Масштабная планка: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
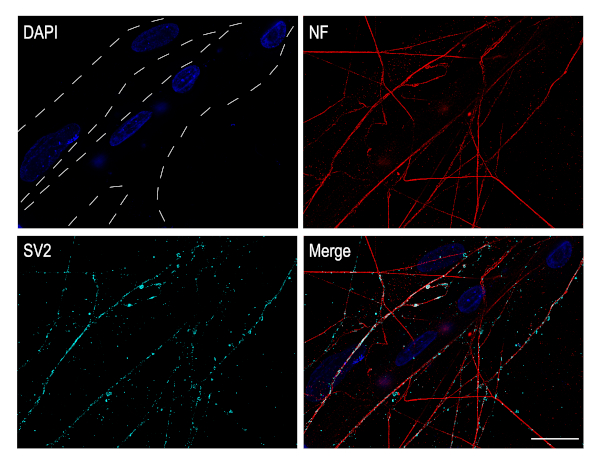
Рисунок 5: Культурные нейроны CG установить синапсы с мышечными волокнами. Иммуноцитохимия изображения CG нейронов-грудной мышцы со-культуры. Мышечные волокна, идентифицированные пунктирными линиями, представляют несколько ядер, которые были запятнаны DAPI (синим цветом). Аксоны были помечены против нейрофиламента (красный) и синаптические пузырьки были помечены против SV2 (циан). Изображения были получены с помощью конфокального микроскопа с планом-Апохромат 63x нефтяной цели. Масштабная планка: 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Обсуждение
В этом протоколе мы продемонстрировали, как подготовить и культуры CG нейронов. Идентификация и вскрытие цилиарского ганглия может быть затруднено для неопытных пользователей. Поэтому мы представляем детальную и пошаговую процедуру, чтобы эффективно вскрыть е7 цыпленка цилиарной ганглии, разъединить ткани и подготовить нейронные культуры, которые могут поддерживаться, по крайней мере 15 дней. Цилиаровые ганглия нейронов, полученных с помощью этого протокола также подходят для совместного культуры с мышечными клетками.
Цилиаровые ганглии на различных стадиях развития эмбрионального развития цыпленка могут быть использованы в качестве клеточной модели, в зависимости от цели исследования. Тем не менее, для культур CG нейронов предлагается, чтобы они были изолированы от эмбриона цыпленка между эмбриональными днями 7 и 818. На эмбриональной стадии E8, CG нейроны еще не претерпели процессов нейронной смерти и количество негенных клеток уменьшается сравнительно с нейронными клетками18. Это, в сочетании с строгой процедурой вскрытия и очень хорошо очищенные ганглии, будет способствовать очень чистой культуры цилиарных нейронов ганглия, с небольшим загрязнением неневральных клеток, таких как фибробласты или глиальные клетки.
Во время изоляции нейронов CG, одним из важнейших точек является идентификация и очистка CG. Вскрытие такой небольшой структуры, как цилиарный ганглия, может быть затруднено, учитывая локализацию, возможность идентифицировать ганглий, а также размер самого ганглия. Это нормально, что ганглии могут прикрепляться к щипцам во время вскрытия. Высококачественные инструменты вскрытия очень важны для успешного вскрытия и сводят к минимуму привязанность ганглиев к щипцам. Очистка GC имеет важное значение для предотвращения загрязнения негеннаальными клетками. Необходимо изолировать около 70 ганглиев, чтобы получить клеточную плотность 1x106 клеток/мЛ, в отличие от других нейрональных тканей периферической нервной системы, которые имеют 5-15x большее количество ганглиев3.
В культуре добавление 5'-FDU к полной среде уменьшает загрязнение культуры GC нене нейрональными клетками. 5'-FDU является антимитическим соединением, которое подавляет пролиферацию клеток, а именно пролиферацию глиальных клеток и фибробластов. Концентрация 5'-FDU добавил к среде достаточно, чтобы остановить клеточный цикл в фазе S, но не наносит ущерба для нормального развития CG нейронов3,19,20. Время лечения с 5'-FDU может быть скорректировано. Однако, так как CG нейроны установить плотную аксональную сеть в течение короткого времени, 5'-FDU должны быть добавлены к культуре уже во время покрытия.
Одним из основных ограничений данной модели является то, что она не является репрезентативной для нормального развития CG нейронов в физиологических условиях. В ово, около половины нейронов CG умирают между8-м и 14-м днем развития эмбриона цыпленка. В культуре, нет снижения числа нейронов CG, когда среда дополняется нейротрофических факторов, которые позволяют его выживания1,6,14.
Нейронная популяция, полученная в результате вскрытия птеняйного цилиарного ганглия, представляет собой однородную популяцию холинергических нейронов, принадлежащих к вегетативной нервной системе. Следует отметить, что выражение нейротрансмиттеров в популяции сосудистой системы CG является целевым, что может быть затруднено в зависимости от типа мышц, используемых в ко-культуры24. Если цель исследования связана с генетической идентичности или подтипа самого моторного нейрона, то CG нейроны не могут быть наиболее подходящей нейронной модели. Кроме того, специфика моторных нейронов в иннервации мышечных волокон не может быть достигнуто при использовании CG нейронов совместно культур, поскольку, в этом случае, мышечные волокна могут быть умножены innervated25. Тем не менее, эта нейронная культура имеет ряд преимуществ, она требует только базового оборудования для поддержания и инкубации яиц, это достаточно недорогая процедура и, что более важно, обеспечивает отличную модель для изучения нервно-мышечных синапсов1, так как CG нейронов нейротрансмиссии механизмов очень похожи на те, которые происходят в спинномозговых нейронов двигателя. Модели клеток, ранее использовавшиеся для этих типов исследований, были сенсорными нейронами из спинного мозга12,,21,,22,,23. Тем не менее, эти со-культуры состояли из неоднородной популяции нейронов, не все холинергические и, таким образом, только небольшая часть нейронов смогли установить функциональные контакты с мышечными клетками1. Помимо анализа развития (иммуноцитохимия), продемонстрированной в этой работе, другие анализы могут быть выполнены в культурах CG, таких как электрофизиология и выживание нейронов.
На основе этого протокола могут быть решены дополнительные научные вопросы, например, как субклеточная локализация конкретных мРНК и белков регулирует образование и функцию синапса. Кроме того, нервно-мышечные со-культуры могут быть легко установлены и в дальнейшем использоваться для изучения нервно-мышечных заболеваний, когда место травмы является нервно-мышечного соединения. Нервно-мышечные заболевания являются неоднородными в природе в том смысле, что дисфункция может быть связана с самой мышцей, периферических нервов или нервно-мышечных соединений26. Таким образом, с помощью этих со-культур можно было бы изучить нервно-мышечные изменения соединения, которые в конечном итоге лежат в основе развития и прогрессирования нервно-мышечных заболеваний. Еще одна интересная возможность состоит в том, чтобы адаптировать этот протокол к системе тройниной мыши. Эти нейроны легко доступны, и их модель развития хорошо известна27. Потому что мыши поддаются генетическим манипуляциям и тройная система хорошо характеризуется с точки зрения топографического формирования карты новые возможности возникают с помощью протокола на основе тройниминальной для изучения развития нейронов.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Эта работа финансировалась Европейским фондом регионального развития (ERDF) в рамках Региональной оперативной программы Centro 2020 в рамках проектов CENTRO-01-0145-FEDER-000008:BrainHealth 2020, CENTRO20 CENTRO-01-0145-FEDER-000003:pAGE, CENTRO-01-0246-FEDER-00018:MEDISIS, и через COMPETE 2020 - Оперативная программа по конкурентоспособности и интернационализации и португальских национальных фондов через FCT - Фонд пара Ci'ncia электронной Текнологии, I.P., в рамках проектов UIDB/04539/2020, UIDB/04501/2020, POCI-01-0145-FEDER-022122:PPBI, PTDC/SAU-NEU/104100/2008, а также индивидуальные гранты SFRH/BD/141092/101092/104100/2008, а также индивидуальные гранты SFRH/BD/141092/1 2018 (M.D.), DL57/2016/CP1448/CT0009 (R.O.C.), SFRH/BD/77789/2011 (J.R.P.) и Мари Кюри Действия - IRG, 7-я Рамочная программа.
Материалы
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2’-deoxiuridina (5'-FDU) | Merck (Sigma Aldrich) | F0503 | |
| Alexa Fluor 568-conjugated goat anti-chicken antibody | Thermo Fisher Scientific | A11041 | |
| Alexa Fluor 568-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A11031 | |
| Alexa Fluor 647-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A21235 | |
| B27 supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Chicken monoclonal neurofilament M | Merck (Sigma Aldrich) | AB5735 | |
| D-(+)-Glucose monohydrate | VWR | 24371.297 | |
| Fetal Bovine Serum (FBS), qualified, Brazil | Invitrogen (Gibco) | 10270-106 | |
| HEPES, fine white crystals, for molecular biology | Fisher Scientific | 10397023 | |
| Horse Serum, heat inactivated, New Zealand origin | Invitrogen (Gibco) | 26050-070 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| Mouse laminin I | Cultrex (R&D systems) | 3400-010-02 | |
| Mouse monoclonal b-III tubulin | Merck (Sigma Aldrich) | T8578 | |
| Mouse monoclonal SV2 | DSHB | AB2315387 | |
| Multidishes, cell culture treated, BioLite, MW24 (50x) | Thermo Fisher Scientific | 11874235 | |
| Neurobasal medium without glutamine | Invitrogen (Gibco) | 21103-049 | |
| Penicillin/streptomycin (5,000 U/mL) | Invitrogen (Gibco) | 15070-063 | |
| Phenol red, bioreagent, suitable for cell culture | Merck (Sigma Aldrich) | P3532 | |
| Poly-D-Lysine | Merck (Sigma Aldrich) | P7886 | |
| Potassium chloride | Fluka (Honeywell Reaarch Chemicals) | 31248-1KG | |
| Potassium di-hydrogen phosphate (KH2PO4) for analysis, ACS | Panreac Applichem | 131509-1000 | |
| Prolong Gold Antifade mounting medium with DAPI | Invitrogen (Gibco) | P36935 | |
| Puradisc FP 30mm Syringe Filter, Cellulose Acetate, 0.2µm, sterile 50/pk | Fisher Scientific | 10462200 | |
| Recombinant human ciliary neurotrophic factor (CNTF) | Peprotech | 450-13 | |
| Recombinant human glial cell-derived neurotrophic factor (GDNF) | Peprotech | 450-10 | |
| Sodium chloride for analysis, ACS, ISO | Panreac Applichem | 131659-1000 | |
| Sodium dihydrogen phosphate 2-hydrate (Na2HPO4·2H2O), pure, pharma grade | Panreac Applichem | 141677-1000 | |
| Sodium Pyruvate 100 mM (100x) | Thermo Fisher | 11360039 | |
| Syringe without needle, 10 mL | Thermo Fisher | 11587292 | |
| Trypsin 1:250 powder | Invitrogen (Gibco) | 27250-018 |
Ссылки
- Betz, W. The Formation of Synapses between Chick Embryo Skeletal Muscle and Ciliary Ganglia Grown in vitro. Journal of Physiology. 254, 63-73 (1976).
- Fischbach, G. D. Synapse Formation between Dissociated Nerve and Muscle Cells in Low Density Cell Cultures. Developmental Biology. 28, 407-429 (1972).
- Bernstein, B. W. Dissection and Culturing of Chick Ciliary Ganglion Neurons: A System well Suited to Synaptic Study. Methods in Cell Biology. 71, 37-50 (2003).
- Marwitt, R., Pilar, G., Weakly, J. N. Characterization of Two Ganglion Cell Populations in Avian Ciliary Ganglia. Brain Research. 25, 317-334 (1971).
- Role, L. W., Fishbach, G. D. Changes in the Number of Chick Ciliary Ganglion. Neuron Processes with Time in Cell Culture. Journal of Cell Biology. 104, 363-370 (1987).
- Landmesser, L., Pilar, G. Synaptic Transmission and Cell Death During Normal Ganglionic Development. Journal of Physiology. , 737-749 (1974).
- Koszinowski, S., et al. Bid Expression Network Controls Neuronal Cell Fate During Avian Ciliary Ganglion Development. Frontiers in Physiology. 9, 1-10 (2018).
- Landmesser, L., Pilar, G. Synapse Formation During Embryogenesis on Ganglion Cells Lacking a Periphery. Journal of Physiology. 241, 715-736 (1974).
- Nishi, R., Berg, D. K. Dissociated Ciliary Ganglion Neurons in vitro: Survival and Synapse Formation. Proceedings of the National Academy of Sciences of the United States of America. 74, 5171-5175 (1977).
- Nishi, R., Berg, D. K. Two Components from Eye Tissue that Differentially Stimulate the Growth and Development of Ciliary Ganglion Neurons in Cell Culture. Journal of Neuroscience. 1, 505-513 (1981).
- Pilar, G., Vaughan, P. C. Electrophysiological Investigations of the Pigeon iris Neuromuscular Junctions. Comparative Biochemistry and Physiology B. 29, 51-72 (1969).
- Landmesser, L., Pilar, G. Selective Reinnervation of Two Cell Populations in the Adult Pigeon Ciliary Ganglion. Journal of Physiology. , 203-216 (1970).
- Pinto, M. J., Almeida, R. D. Puzzling Out Presynaptic Differentiation. Journal of Neurochemistry. 139, 921-942 (2016).
- Dryer, S. E. Functional Development of the Parasympathetic Neurons of the Avian Ciliary Ganglion: A Classic Model System for the Study of Neuronal Differentiation and Development. Progress in Neurobiology. 43, 281-322 (1994).
- Egawa, R., Yawo, H. Analysis of Neuro-Neuronal Synapses using Embryonic Chick Ciliary Ganglion via Single-Axon Tracing, Electrophysiology, and Optogenetic Techniques. Current Protocols in Neuroscience. 87, 1-22 (2019).
- Pinto, M. J., Pedro, J. R., Costa, R. O., Almeida, R. D. Visualizing K48 Ubiquitination during Presynaptic Formation by Ubiquitination-Induced Fluorescence Complementation (UiFC). Frontiers in Molecular Neuroscience. 9, 1-19 (2016).
- Martins, L. F., et al. Mesenchymal Stem Cells Secretome-Induced Axonal Outgrowth is Mediated by BDNF. Scientific Reports. 7, 1-13 (2017).
- Nishi, R. Autonomic and Sensory Neuron. Methods in Cell Biology. , 249-263 (1996).
- Rojo, J. M., De Ojeda, G., Portolés, P. Inhibitory Mechanisms of 5-fluorodeoxyuridine on Mitogen-induced Blastogenesis of Lymphocytes. International Journal of Immunopharmacology. 6, 61-65 (1984).
- Hui, C. W., Zhang, Y., Herrup, K. Non-Neuronal Cells are Required to Mediate the Effects of Neuroinflammation: Results from a Neuron-Enriched Culture System. PLoS One. 11, 1-17 (2016).
- Crain, S. M., Alfei, L., Peterson, E. R. Neuromuscular Transmission in Cultures of Adult Human and Rodent Skeletal Muscle After Innervation in vitro by Fetal Rodent Spinal Cord. Journal of Neurobiology. 1, 471-489 (1970).
- Kano, M., Shimada, Y. Innervation and Acetylcholine Sensitivity of Skeletal Muscle Cells Differentiated in vitro from Chick Embryo. Journal of Cellular Physiology. 78, 233-242 (1971).
- Robbins, N., Yonezawa, T. Developing Neuromuscular Juctions: First Sings of Chemical Transmission during Formation in Tissue Culture. Science. 80, 395-398 (1971).
- Squire, L. R. . Encyclopedia of Neuroscience. , (2010).
- Hooisma, J., Slaaf, D. W., Meeter, E., Stevens, W. F. The Innervation of Chick Striated Muscle Fibers by the Chick Ciliary Ganglion in Tissue Culture. Brain Research. 85, 79-85 (1975).
- Morrison, B. M. Neuromuscular Diseases. Seminars in Neurology. , 409-418 (2016).
- Davies, A. M. The Trigeminal System: An Advantageous Experimental Model for Studying Neuronal Development. Development. 103, 175-183 (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены