Method Article
チラリア性神経節ニューロンの分離と培養
要約
ひよこ毛様体神経節(CG)は副交感神経系の一部である。ひよこCGニューロンの神経細胞培養は、神経筋相互作用の研究において有効な細胞モデルであることが示された。我々は、ひよこ胚からのCGニューロンの解剖、解離およびインビトロ培養のための詳細なプロトコルを記述する。
要約
ひよこ毛様体神経節(CG)は副交感神経系の一部であり、眼に存在する筋肉組織の神経の活性化を担当する。この神経節は、それぞれ、内臓が線状筋線維と平滑筋線維を線状にした毛様体及び脈絡膜ニューロンの均質集団によって構成される。これらの神経細胞タイプのそれぞれは、特定の眼の構造と機能を調節します。長年にわたり、ひよこ毛様体神経節の神経細胞培養は、コリン作動性シナプスを介して通信する筋肉神経系相互作用の研究において有効な細胞モデルであることが示された。毛様神経節ニューロンは、その大部分で、コリン作動性である。この細胞モデルは、コリン作動性以外にも、いくつかの神経細胞型を含む、以前に使用されていた異種細胞モデルに比較的有用であることが示されている。解剖学的に、毛様体神経節は視神経(ON)と脈絡膜裂動(CF)の間に局在する。ここでは、ひよこ胚由来の毛様神経節ニューロンの解剖、解離および体外培養の詳細な手順を説明する。CGニューロンの非常に純粋で安定した細胞培養を得るためにステップバイステップのプロトコルを提供し、プロセスの重要なステップを強調しています。これらの培養は15日間インビトロで維持することができ、この結果、CG培養の正常な発展を示す。結果はまた、これらのニューロンが神経筋コリン作動性シナプスを介して筋線維と相互作用できることを示す。
概要
毛様神経節(CG)ニューロンは副交感神経系に属する。これらのニューロンはコリン作動性であり、ムスカリン性またはニコチン性シナプス11、2、32,3を確立することができる。解剖学的には、CGは視神経(ON)と脈絡膜裂け(CF)との間の眼の後部に位置し、初期胚期11、44の約6000ニューロンからなる。培養の最初の1週間、毛様神経節ニューロンは多極形態を提示する。1週間後、彼らは単極状態に移行し始め、1つの神経突起が延長され、軸索5を形成する。さらに、CGニューロンの約半数は、細胞死のプログラムプロセスを通じて、ひよこ胚の発達の8日目から14日目の間に死ぬ。ニューロン数の減少は,、約3000ニューロン6、7、87の毛様体の総集団をもたらす。68インビトロでは、筋細胞9およびCGニューロンで増殖した場合のCGニューロンの数の減少がなく、数週間1、99のために培養することができる。1
毛様性神経節は、毛様体ニューロンと脈絡膜ニューロンの均質な集団で構成され、それぞれがCGのニューロン集団の半分を表し、眼の筋肉を内在化する。これらの2種類のニューロンは、構造上、解剖学的、機能的に異なっている。毛様体ニューロンは虹彩とレンズ上の線条性筋線維を内側に吐き出し、瞳孔収縮を担当する。脈絡膜ニューロンは、脈絡膜1、10、11、1210,11の平滑筋を内側に入れ、1
鶏毛様神経節ニューロンの培養は、神経筋シナプスおよびシナプス形成11、5、95,9の研究に有用なツールであることが示されている。神経筋シナプスがコリン作動性13であることを考えると、コリン作動性である神経集団を用いて – CGニューロン - 以前の細胞モデル14に代わる潜在的な代替として浮上した。これらのモデルは異種神経集団で構成され、ほんの一部だけがコリン作動性である。あるいは、毛様性神経節ニューロンは、インビトロで比較的速く発達し、約15時間後にすでにシナプス1を形成している。CGニューロンは、比較的容易な分離と操作のために、明確な研究のために長年にわたってモデルシステムとして使用されてきました。これらのアプリケーションには、光遺伝学的研究、シナプスの発達、アポトーシスおよび神経筋相互作用14,15,15が含まれる。
我々は、胚性7日目(E7)のひよこ胚からの毛様神経節ニューロンの解剖、解離およびインビトロ培養のための詳細な手順を説明する。我々は、コリン作動性ニューロンの非常に純粋で安定した細胞培養を得るために、ステップバイステップのプロトコルを提供する。我々はまた、特別な注意を必要とし、神経培養の質を向上させるプロトコルの重要なステップを強調する。これらの培養物は、少なくとも15日間インビトロで維持することができる。
プロトコル
1. 試薬の調製
注:この手順に必要な材料は次のとおりです:鉗子(nº 5およびnº 55)、外科ピンセット、解剖ペトリ皿(黒底)、24ウェルプレート、プラスチックパスツールピペット、火磨ガラスパスツールピペット、10 mLシリンジ、0.22 μmシリンジフィルター。
- ガラスカバーリップ、鉗子(nº 5およびnº 55)、外科ピンセット、ペトリ皿(黒底)、蒸留されたH2O、ピペットおよび外科用材料を含むプロトコルに必要なすべての材料を準備し、殺菌する。
- 0.1 mg/mL ポリ D-リジン (PDL) 溶液を準備します。
- PDLを0.1 Mホウ酸バッファー(pH 8.2)で1 mg/mL(10x溶液)の濃度に再構成します。
- 166.6 mMホウ酸塩バッファー(pH 8.2)で1:10を希釈し、0.1mg/mLの最終濃度を得る。
- 10 μg/mL ラミニン溶液を準備します。
- 1 mg/mLラミニンをプレーンニューロ基底培地で希釈し、最終濃度の10 μg/mLにします。
- ハンクのバランス塩溶液(HBSS)を準備する:5.36 mM KCl、0.44 mM KH2PO 4、137 mM NaCl、4.16 mM NaHCO3、0.34 mM Na2HPO4·2H2O、5 mMグルコース、1 mMナトリウムピルビン酸、10 mM HEPESバッファー、0.01%4pH を 7.2 に調整します。
- 0.1%のトリプシン溶液を準備します。
- 5 mg のトリプシン 1:250 粉末を HBSS の 5 mL に溶解し、最終的な濃度は 0.1% です。
- 完全に溶解するまで4°Cのローラーミキサーに入れる。
- 10 mLのシリンジと0.22 μmのシリンジフィルターを使用したフィルター。
- 毛様神経節不完全培地を調製:グルタミンなしの神経基底培地、1X B27(光感受性)、10%熱不活性化馬血清、2%の熱不活性化FBS、12.5 U/mLペニシリン/ストレプトマイシン(0.25x)および2mMグルタミン。滅菌試薬を使用し、滅菌条件下で培地を調製します。
- 毛様体状神経節完全培地(成長因子を補う):不完全培地に、5 ng /mL GDNFおよび5 ng / mL CNTFを加える。
2.24ウェルプレート用ガラスカバーリップの調製
- 必要な数のガラスカバースリップを酸耐性容器の中に入れ、すべてのカバーリップが水没するまで65%硝酸を加えます。容器を軌道シェーカーに入れ、1000rpmの速度で室温(RT)で一晩インキュベートします。
- 翌日は、硝酸を小さな貯蔵所に慎重に移し、さらに使用するために保管してください。硝酸は2-3倍再利用することができる。
- 慎重に、残りの硝酸を除去するためにカバーリップに蒸留H2Oを加えます。30分間撹拌し、洗浄液を捨てて、この5倍を繰り返します。
- 75%エタノールでカバーリップを2回すすぎます。
- 慎重に分離し、アルミニウム箔で覆われた金属ラックに個々のカバーリップを配置し、50 ºCで10〜15分間、または完全に乾燥するまでインキュベートします。
注:ガラスカバーリップは互いに付着するので、オートクレーブしないでください。 - UV光の下でカバースリップを10〜15分間殺菌します。神経組織培養のためにカバーリップを無菌に保つ。
3. 24ウェルプレート用ガラスカバーリップのコーティング
- 滅菌用のツイーザーを使用して、24ウェルプレートの各ウェルにカバースリップを1つずつ置きます。
- 0.1 mg/mL PDLの500 μLを加え、37°Cで一晩インキュベートします。
- 翌日、滅菌蒸留H2Oでカバーリップを2回すすいでください。その後、各カバースリップに蒸留水500μLを加え、室温で30分間放置します。
- 水を捨て、各ウェルに350 μLの10 μg/mLラミニン溶液を加えます。
- 37°Cインキュベーターに2時間置きます。
- 細胞メッキの前に、ラミニン溶液を取り除き、プレーンな神経基底培地で2回洗浄します。
メモ:カバーリップは、いつでも乾燥しないことが重要です。 - 300 μL の完全な培地を加え、37 °C でインキュベーターに、5% CO2でめっき時間まで放置します。細胞をめっきする前に、この培地を取り除きます。
鶏胚由来毛様神経節の培養(胚7日目)
- 毛様体の解剖 (CG)
- インキュベーターから卵を取り出し、75%エタノールでスプレーします。
注:卵は、37.7°Cで7日間(または所望の胚期)にインキュベートされる前に、〜16°Cで保存されます。ここで使用される卵はロス鶏種からです。 - はさみで卵の上部を切り取り、スプーンで胚を取り出します。氷冷HBSSを備えたペトリ皿に胚を入れ、首の領域で切断することによって頭を体から分離します。
注:胚が卵から取り除かれるとすぐに、細胞死の原因となるプロテアーゼを産生することができます。胚が殻の外に出ると、細胞死を最小限に抑えるために、頭部を体内から急速に分離することが重要です。 - 胚の頭部を氷冷HBSSに入れておいてください。
- 胚の頭を上げて、nº 5鉗子でひよこのくちばしに固定します。その後、nº 55鉗子で、目の周りの皮膚の薄い層を取り除き始めます。
- 目を慎重に取り除き、後部にアクセスするために回転させます。目をひよこの頭から分離している間、視神経が切り離されていることに気づく。これは毛様体の神経節を局地化するのに役立ちます。
- 目が分離されたら、後部側を上にして、切り離された視神経と脈絡膜裂けに隣接する毛様体神経節に気づく。前神経節神経は、まだ毛様様神経節に付着している可能性があり、その識別を容易にする。
- 各眼から毛様体の神経節を解剖し、各神経節の周りの余分な組織を除去することによって非常によくきれいにします。
注:約1x106セル/mLの収率を有するために、〜70個のCDを解剖する。得られた細胞集団には非神経細胞も含まれていることに注意してください。非神経細胞の数を減らすため、そして、結果的に、神経細胞集団の純度を増加させ、毛様体神経節をできるだけきれいにし、余分な組織をすべて除去することが非常に重要である。
- インキュベーターから卵を取り出し、75%エタノールでスプレーします。
- 毛様体核組織の解離と文化
- 滅菌プラスチックパスツールピペットを使用して15 mLチューブにすべての毛様体神経節を収集します。
注:ピペットの壁に神経節の付着を最小限に抑えるために、パスツールピペットを事前に濡らすることが重要です。 - 200 x gで毛様体の神経節を 2 分間遠心分離する .
- 慎重に、パスツールピペットを使用してすべてのHBSS培地を取り出し、次にP1000マイクロピペットを取り出します。0.1%のトリプシン溶液を1 mL加え、撹拌せずに水浴中の37°Cで20分間インキュベートします。
- 200 x gで 2 分間の遠心分離機 .
- すぐにトリプシン溶液を取り除き、不完全な媒体の1 mLを追加します。
注意:不完全な培地には、トリプシンの効果を直ちに停止させる血清が含まれています。 - 200 x gで2分間遠心分離機を使用し、すべての培地を取り出します。
- 完全な媒体の350-500 μLを加える。
注:細胞の解化に必要な量は、得られた毛様神経節の数、したがって、得られたペレットサイズに依存します。〜70 CGの場合は、500 μLの培地を使用することをお勧めします。 - P1000を使用して最初に10-15倍のピペットをピペット化し、次いで火で磨かれたガラスのパスツールピペットを使用して10-15倍を使用して、CDを解約します。気泡の形成を避けて細胞の損失を最小限に抑えます。
注:メッキするまで、細胞懸濁液を氷の上に置いてください。 - トリパンブルー溶液と標準のノイバウアーチャンバーを使用して、細胞密度を決定します。
- プレート1 x 104セル/mLは、完全な培地の500 μLで適切なセル懸濁液の体積を希釈することによって、24ウェルプレートの各ウェルに4セル/mL(10 μM 5'-FDUを補う)です。
- 細胞を37°C、5%CO2インキュベー2ターでインキュベートする。
- 滅菌プラスチックパスツールピペットを使用して15 mLチューブにすべての毛様体神経節を収集します。
5. 毛様体ニューロンの免疫細胞化学と画像解析
- 前述の16,17に従って本論文に示した免疫細胞化学アッセイを17行う。
- 次の一次抗体を使用する:マウスモノクローナルb-IIIチューブリン(1:1000、T8578)、ニワトリモノクローナルニューロフィラメントM(1:1000、AB5735)、マウスモノクローナルSV2(1:1000、AB2315387)。
- 二次抗体として、 Alexa Fluor 568-共役ヤギ抗マウス抗体(1:1000、A11031)、アレクサフルオール568コンジュゲートヤギ抗鶏抗体(1:1000、A11041)、アレクサフルオール647-コンジュゲートヤギ抗マウス抗体(1:1000、A22)を使用してください。
- DAPI付きマウントメディアを使用してカバースリップを取り付け、核染色(P36935)にします。
結果
この手順の推定持続時間は、特定の実験ごとに必要な収量、したがって、分離する必要がある毛様体核節の数に依存します。推定収量が1 x 106細胞/mLの場合、約70個の毛様様神経節(35個の卵)を単離する。この神経節の数については、解剖手順には2〜3時間、総処置には合計4〜5時間かかります。分離プロトコルの手順を示します図1Aを参照してください。毛様体の神経節の同定は、特にこのプロトコルを初めて行う場合には困難である。毛様体神経節は視神経と脈絡膜裂動の近くに局在する(図1B)。解剖手順の主要な手順を図 2に示します。まず、胚を卵から取り出し、氷冷HBSSに入れます。頭部は身体から分離され、再び、解剖ペトリ皿の氷冷HBSSに入れられます(図2A-2C)。そして、目はひよこの頭から取り除かれ、毛様体の神経節が分離される(図2D-2H)。
このプロトコルで得られる文化は非常に純粋です。しかし、神経節を洗浄し、過剰な組織を除去するは、培養の成功と純度を強く左右する。細胞は急速に発達し、全体的な実験が必要な場合は培養の最初の日にすでに使用することができます。それにもかかわらず、培養は15日以上維持することができる。培養物を7~8日以上使用する場合は、2~3日ごとに3分の1の培養培地を新鮮な培地に置き換えてください。1日のインビトロの後、CGニューロンは多極形態を示す。しかし、神経突起の拡張は急速に起こり、24時間後には既に一次神経回路が確立されている。インビトロで8日後、ニューロンはすでに単極状態に移行し、神経突起の1つが伸び、軸索を形成した。この発達段階では、神経細胞ネットワークは非常に密度が高い(図3および図4)。
毛様神経節ニューロンは、副交感神経系に属するコリン作動性ニューロンである。生体内では、これらのニューロンは、眼の筋肉の内在を担う。これらの神経細胞培養は神経筋シナプスの研究に非常に適しています。.このために、CGニューロンは筋肉細胞の上にメッキすることができます。ひよこ大胸筋を解剖し、DIV 4まで体外で発達させ、交配させた。次いで、CGニューロンを筋肉層の上にめっきし、共培養でさらに3日間発達させた。この時点で、筋線維が形成され、複数の核(青色)の存在によって容易に同定することができる。シナプス小胞糖タンパク質2A(SV2)免疫染色、シナプス前マーカーは、CGニューロン軸索と筋線維との間に確立されたシナプスの存在を示す(図5)。

図1:解剖プロトコルと毛様体系神経節のスキーム。(A) 分離と文化プロトコルの図。(B) 眼の後部における毛様毛様神経節の局在のスキーム。視神経、毛様体神経節および脈絡膜裂け目は矢印で示される。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:E7の毛様体毛様神経節の解剖。(A)はさみを使って卵の上を切る。(B)スプーンで卵から胚を取り出し、氷冷HBSSで解剖ペトリ皿に入れます。(C)首の部分を切断して頭部を身体から分離する。(D) くちばしの胚の頭部を固定し、鉗子nº 5で保持する。(E)forcep nº 55を使用して、穏やかな回転で目を取り除きます。(F)眼の後視。矢印は視神経、脈絡膜裂動および毛様神経節の局在を示す。(G)毛様体の神経節を解剖する。(H) 毛様体系神経節を解剖した。過剰な組織を除去する必要があります。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:体外における毛様神経節ニューロンの発達DIV 1、3、8および15におけるCGニューロンの位相コントラスト画像。CGニューロンはメッキされると、すぐに神経突起の成長を開始します。DIV 15では、軸索ネットワークは非常に密度が高く、この段階では神経突起が樹状突起と軸索に完全に分化されています。位相コントラスト画像は、計画-Apochromat 20x ph2目的を有する共焦点顕微鏡を用いて取得した。スケールバー:50 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。

図4: DIV 8におけるCGニューロンの免疫細胞化学.CGニューロンは、インビトロで8日後に確立されたニューロンネットワークを示す。核をDAPI(青)で染色し、軸索をb-IIIチューブリン(赤色)で染色した。蛍光画像は、プラン-アポクロマト20x目的を有する共焦点顕微鏡を用いて取得した。スケールバー:50 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
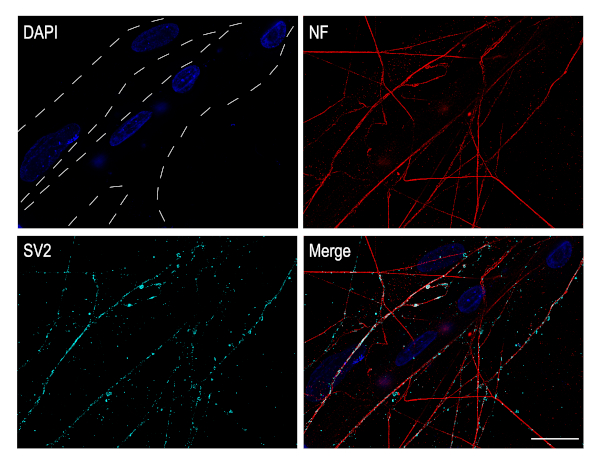
図 5: 培養 CG ニューロンは、筋線維とシナプスを確立します。.CGニューロン-胸筋共培養の免疫細胞化学画像破線で識別される筋線維は、複数の核を有し、DAPI(青色)で染色された。軸索は、神経フィラメント(赤色)に対して標識し、シナプス小胞をSV2(シアン)に対して標識した。画像は、プラン・アポクロマト63x油目的を有する共焦点顕微鏡を使用して取得した。スケールバー:20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルでは、CGニューロンの調製と培養の方法を示した。毛様体の同定と解剖は、経験の浅いユーザーにとって困難な場合があります。そこで、E7のひよこ毛様体神経節を効率的に解剖し、組織を解離し、少なくとも15日間維持できる神経細胞培養を調製するための詳細かつ段階的な手順を提示する。このプロトコルで得られた毛様神経節ニューロンは、筋肉細胞との共培養にも適している。
ひよこ胚発生の異なる発達段階における毛様性神経節は、研究の目的に応じて細胞モデルとして使用することができる。しかし、CGニューロンの培養のために、胚の日7と818の間にひよこ胚から単離することが示唆されている。胚期E8では、CGニューロンはまだ神経死過程を経ておらず、非神経細胞の数は神経細胞18と比較して減少している。これは、厳格な解剖手順と非常によく洗浄された神経節と組み合わせて、線維芽細胞やグリア細胞などの非神経細胞による汚染をほとんど伴う毛様神経節ニューロンの非常に純粋な培養に寄与する。
CGニューロンの単離中に、重要なポイントの1つは、CGの同定とクリーニングです。このような小さな構造の解剖は、毛様体状神経節のように、局在化、ガングリオン自体の大きさだけでなく、神経節を同定する能力を考慮することは困難であり得る。解剖中に神経節が鉗子に付着する可能性があることは正常です。高品質の解剖器は、解剖を成功させるために非常に重要であり、鉗子への神経節の付着を最小限に抑えます。GCを洗浄することは、非神経細胞との汚染を防ぐために重要です。約70個の神経節を単離して、約1x106細胞/mLの細胞密度を得る必要があり、5〜15倍多い神経節3を有する末梢神経系の他の神経組織とは対照的である。
培養では、5'-FDUを完全培地に添加すると、非神経細胞によるGC培養の汚染が減少する。5'-FDUは、細胞増殖、すなわちグリア細胞および線維芽細胞の増殖を阻害する抗有糸分裂性化合物である。培地に加えた5'-FDUの濃度は、S相における細胞周期を停止するのに十分であるが、CGニューロン3、19、2019,20の正常3な発達には有害ではない。5'-FDUによる治療時間は調整可能です。しかし、CGニューロンは短時間で緻密な軸索ネットワークを確立するので、5'-FDUは、早くもめっきの時間に培養物に添加されるべきである。
このモデルの主な制限の1つは、生理学的条件下でCGニューロンの正常な発達を代表していないということです。ovoでは、CGニューロンの約半分がひよこ胚の発達の8日目と14日目の間に死ぬ。培養,では、培地が1、6、14の生存を可能にする神経栄養因子を補充する場合、CG6ニューロンの数の1減少はない。14
ひよこ毛様体神経節の解剖から得られた神経細胞集団は、自律神経系に属するコリン作動性ニューロンの均質集団である。なお、CGの脈絡膜集団における神経伝達物質の発現は標的駆動型であり、これは共培養24で使用される筋肉の種類に応じて妨げられる可能性がある。研究の目的が運動ニューロン自体の遺伝的同一性またはサブタイプに関連している場合、CGニューロンは最良のニューロンモデルではない可能性があります。また、筋線維の神経細胞の内包における特異性は、CGニューロン共培養を用いた場合には達成できない場合があり、この場合、筋線維は、内面的に25を増殖させることができる。しかし、この神経細胞培養は、いくつかの利点を有し、卵を維持およびインキュベートするための基本的な装置のみを必要とし、合理的に安価な手順であり、さらに重要なことに、神経伝達機構は、神経伝達機構が脊髄運動ニューロンに起こるものと非常によく似ているため、神経筋シナプス1の研究のための優れたモデルを提供する。これらのタイプの研究に以前に使用された細胞モデルは、脊髄12、21、22、23,21,22,23からの感覚ニューロンであった。しかし、これらの共培養は、ニューロンの不均一な集団で構成され、全てのコリン作動性ではなく、したがって、ニューロンのごく一部だけが筋肉細胞1との機能的接触を確立することができた。この研究で実証された発達解析(免疫細胞化学)以外にも、他のアッセイは、電気生理学や神経細胞生存などのCG培養で行うことができる。
このプロトコルに基づいて、特定のmRNAおよびタンパク質の細胞内局在化がシナプス形成および機能をどのように調節するかを、追加の科学的な質問に対処することができる。さらに、神経筋共培養は容易に確立でき、傷害部位が神経筋接合部である場合に神経筋疾患を研究するためにさらに使用することができる。神経筋疾患は、機能不全が筋肉自体、末梢神経または神経筋接合部26に関連している可能性があるという意味で、本質的に異質である。したがって、これらの共培養を通じて、最終的に神経筋疾患の発症と進行の根源となる神経筋接合の変化を研究することが可能であろう。もう一つの興味深い可能性は、マウス三叉系にこのプロトコルを適応させることであろう。これらのニューロンは簡単にアクセスでき、その発達パターンはよく知られている27.マウスは遺伝子操作に適しており、三叉系は地形図形成の観点から、三叉系のプロトコルを使用して神経細胞の発達を研究することによって新たな可能性が生じる可能性が高いからです。
開示事項
著者らは、競合する利益はないと宣言している。
謝辞
この研究は、CENTRO-01-0145-FEDER-000008:BrainHealth 2020、CENTRO2020 CENTRO-01-0145-FEDER-000003:pAGEの下でCentro 2020地域運用プログラムを通じて、欧州地域開発基金(ERDF)によって資金提供されました。 CENTRO-01-0246-FEDER-00018:MEDISIS、およびCOMPETE 2020を通じて - FCTを介して競争力と国際化のための運用プログラムとポルトガルの国民資金 - フンダサン・パラ・ア・シエンシア・エ・ア・テクノロジア、I.P.、プロジェクトUIDB/04539/2020、 UIDB/04501/2020, POCI-01-0145-FEDER-022122:PPBI, PTDC/SAU-NEU/104100/2008, 個人助成金 SFRH/BD/141092/20 18 (M.D.)、DL57/2016/CP1448/CT0009(R.O.C.)、SFRH/BD/2011(J.R.P.)、マリー・キュリー・アクションズ - IRG、第7回フレームワーク・プログラム。
資料
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2’-deoxiuridina (5'-FDU) | Merck (Sigma Aldrich) | F0503 | |
| Alexa Fluor 568-conjugated goat anti-chicken antibody | Thermo Fisher Scientific | A11041 | |
| Alexa Fluor 568-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A11031 | |
| Alexa Fluor 647-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A21235 | |
| B27 supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Chicken monoclonal neurofilament M | Merck (Sigma Aldrich) | AB5735 | |
| D-(+)-Glucose monohydrate | VWR | 24371.297 | |
| Fetal Bovine Serum (FBS), qualified, Brazil | Invitrogen (Gibco) | 10270-106 | |
| HEPES, fine white crystals, for molecular biology | Fisher Scientific | 10397023 | |
| Horse Serum, heat inactivated, New Zealand origin | Invitrogen (Gibco) | 26050-070 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| Mouse laminin I | Cultrex (R&D systems) | 3400-010-02 | |
| Mouse monoclonal b-III tubulin | Merck (Sigma Aldrich) | T8578 | |
| Mouse monoclonal SV2 | DSHB | AB2315387 | |
| Multidishes, cell culture treated, BioLite, MW24 (50x) | Thermo Fisher Scientific | 11874235 | |
| Neurobasal medium without glutamine | Invitrogen (Gibco) | 21103-049 | |
| Penicillin/streptomycin (5,000 U/mL) | Invitrogen (Gibco) | 15070-063 | |
| Phenol red, bioreagent, suitable for cell culture | Merck (Sigma Aldrich) | P3532 | |
| Poly-D-Lysine | Merck (Sigma Aldrich) | P7886 | |
| Potassium chloride | Fluka (Honeywell Reaarch Chemicals) | 31248-1KG | |
| Potassium di-hydrogen phosphate (KH2PO4) for analysis, ACS | Panreac Applichem | 131509-1000 | |
| Prolong Gold Antifade mounting medium with DAPI | Invitrogen (Gibco) | P36935 | |
| Puradisc FP 30mm Syringe Filter, Cellulose Acetate, 0.2µm, sterile 50/pk | Fisher Scientific | 10462200 | |
| Recombinant human ciliary neurotrophic factor (CNTF) | Peprotech | 450-13 | |
| Recombinant human glial cell-derived neurotrophic factor (GDNF) | Peprotech | 450-10 | |
| Sodium chloride for analysis, ACS, ISO | Panreac Applichem | 131659-1000 | |
| Sodium dihydrogen phosphate 2-hydrate (Na2HPO4·2H2O), pure, pharma grade | Panreac Applichem | 141677-1000 | |
| Sodium Pyruvate 100 mM (100x) | Thermo Fisher | 11360039 | |
| Syringe without needle, 10 mL | Thermo Fisher | 11587292 | |
| Trypsin 1:250 powder | Invitrogen (Gibco) | 27250-018 |
参考文献
- Betz, W. The Formation of Synapses between Chick Embryo Skeletal Muscle and Ciliary Ganglia Grown in vitro. Journal of Physiology. 254, 63-73 (1976).
- Fischbach, G. D. Synapse Formation between Dissociated Nerve and Muscle Cells in Low Density Cell Cultures. Developmental Biology. 28, 407-429 (1972).
- Bernstein, B. W. Dissection and Culturing of Chick Ciliary Ganglion Neurons: A System well Suited to Synaptic Study. Methods in Cell Biology. 71, 37-50 (2003).
- Marwitt, R., Pilar, G., Weakly, J. N. Characterization of Two Ganglion Cell Populations in Avian Ciliary Ganglia. Brain Research. 25, 317-334 (1971).
- Role, L. W., Fishbach, G. D. Changes in the Number of Chick Ciliary Ganglion. Neuron Processes with Time in Cell Culture. Journal of Cell Biology. 104, 363-370 (1987).
- Landmesser, L., Pilar, G. Synaptic Transmission and Cell Death During Normal Ganglionic Development. Journal of Physiology. , 737-749 (1974).
- Koszinowski, S., et al. Bid Expression Network Controls Neuronal Cell Fate During Avian Ciliary Ganglion Development. Frontiers in Physiology. 9, 1-10 (2018).
- Landmesser, L., Pilar, G. Synapse Formation During Embryogenesis on Ganglion Cells Lacking a Periphery. Journal of Physiology. 241, 715-736 (1974).
- Nishi, R., Berg, D. K. Dissociated Ciliary Ganglion Neurons in vitro: Survival and Synapse Formation. Proceedings of the National Academy of Sciences of the United States of America. 74, 5171-5175 (1977).
- Nishi, R., Berg, D. K. Two Components from Eye Tissue that Differentially Stimulate the Growth and Development of Ciliary Ganglion Neurons in Cell Culture. Journal of Neuroscience. 1, 505-513 (1981).
- Pilar, G., Vaughan, P. C. Electrophysiological Investigations of the Pigeon iris Neuromuscular Junctions. Comparative Biochemistry and Physiology B. 29, 51-72 (1969).
- Landmesser, L., Pilar, G. Selective Reinnervation of Two Cell Populations in the Adult Pigeon Ciliary Ganglion. Journal of Physiology. , 203-216 (1970).
- Pinto, M. J., Almeida, R. D. Puzzling Out Presynaptic Differentiation. Journal of Neurochemistry. 139, 921-942 (2016).
- Dryer, S. E. Functional Development of the Parasympathetic Neurons of the Avian Ciliary Ganglion: A Classic Model System for the Study of Neuronal Differentiation and Development. Progress in Neurobiology. 43, 281-322 (1994).
- Egawa, R., Yawo, H. Analysis of Neuro-Neuronal Synapses using Embryonic Chick Ciliary Ganglion via Single-Axon Tracing, Electrophysiology, and Optogenetic Techniques. Current Protocols in Neuroscience. 87, 1-22 (2019).
- Pinto, M. J., Pedro, J. R., Costa, R. O., Almeida, R. D. Visualizing K48 Ubiquitination during Presynaptic Formation by Ubiquitination-Induced Fluorescence Complementation (UiFC). Frontiers in Molecular Neuroscience. 9, 1-19 (2016).
- Martins, L. F., et al. Mesenchymal Stem Cells Secretome-Induced Axonal Outgrowth is Mediated by BDNF. Scientific Reports. 7, 1-13 (2017).
- Nishi, R. Autonomic and Sensory Neuron. Methods in Cell Biology. , 249-263 (1996).
- Rojo, J. M., De Ojeda, G., Portolés, P. Inhibitory Mechanisms of 5-fluorodeoxyuridine on Mitogen-induced Blastogenesis of Lymphocytes. International Journal of Immunopharmacology. 6, 61-65 (1984).
- Hui, C. W., Zhang, Y., Herrup, K. Non-Neuronal Cells are Required to Mediate the Effects of Neuroinflammation: Results from a Neuron-Enriched Culture System. PLoS One. 11, 1-17 (2016).
- Crain, S. M., Alfei, L., Peterson, E. R. Neuromuscular Transmission in Cultures of Adult Human and Rodent Skeletal Muscle After Innervation in vitro by Fetal Rodent Spinal Cord. Journal of Neurobiology. 1, 471-489 (1970).
- Kano, M., Shimada, Y. Innervation and Acetylcholine Sensitivity of Skeletal Muscle Cells Differentiated in vitro from Chick Embryo. Journal of Cellular Physiology. 78, 233-242 (1971).
- Robbins, N., Yonezawa, T. Developing Neuromuscular Juctions: First Sings of Chemical Transmission during Formation in Tissue Culture. Science. 80, 395-398 (1971).
- Squire, L. R. . Encyclopedia of Neuroscience. , (2010).
- Hooisma, J., Slaaf, D. W., Meeter, E., Stevens, W. F. The Innervation of Chick Striated Muscle Fibers by the Chick Ciliary Ganglion in Tissue Culture. Brain Research. 85, 79-85 (1975).
- Morrison, B. M. Neuromuscular Diseases. Seminars in Neurology. , 409-418 (2016).
- Davies, A. M. The Trigeminal System: An Advantageous Experimental Model for Studying Neuronal Development. Development. 103, 175-183 (1988).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved