Method Article
Isolement et culture des neurones ganglionnaires de Chick
Dans cet article
Résumé
Les ganglions ciliaires de poussin (CG) font partie du système nerveux parasympathique. Les cultures neuronales des neurones de CG de poussin ont été montrées pour être des modèles de cellules efficaces dans l’étude des interactions de muscle nerveux. Nous décrivons un protocole détaillé pour la dissection, la dissociation et la culture in vitro des neurones de CG des embryons de poussin.
Résumé
Les ganglions ciliaires de poussin (CG) font partie du système nerveux parasympathique et sont responsables de l’innervation des tissus musculaires présents dans l’oeil. Ce ganglion est constitué par une population homogène de neurones ciliaires et choroïdes qui innervate les fibres musculaires striées et lisses, respectivement. Chacun de ces types neuronaux régule des structures et des fonctions oculaires spécifiques. Au fil des ans, les cultures neuronales des ganglions ciliaires poussins se sont avérées être des modèles cellulaires efficaces dans l’étude des interactions muscle-nerveux du système, qui communiquent par synapses cholinergiques. Les neurones de ganglion ciliaire sont, dans sa majorité, cholinergiques. Ce modèle cellulaire s’est avéré utile comparativement aux modèles de cellules hétérogènes précédemment utilisés qui comprennent plusieurs types neuronaux, outre cholinergique. Anatomiquement, le ganglion ciliaire est localisé entre le nerf optique (ON) et la fissure choroïde (CF). Ici, nous décrivons une procédure détaillée pour la dissection, la dissociation et la culture in vitro des neurones ganglionnaires ciliaires des embryons de poussin. Nous fournissons un protocole étape par étape afin d’obtenir des cultures cellulaires très pures et stables de neurones CG, mettant en évidence les étapes clés du processus. Ces cultures peuvent être maintenues in vitro pendant 15 jours et, par la présente, nous montrons le développement normal des cultures cg. Les résultats montrent également que ces neurones peuvent interagir avec les fibres musculaires par le biais de synapses cholinergiques neuro-musculaires.
Introduction
Les neurones du ganglion ciliaire (CG) appartiennent au système nerveux parasympathique. Ces neurones sont cholinergiques, étant en mesure d’établir des synapses muscariniques ou nicotiniques1,2,3. Anatomiquement, le CG est situé dans la partie postérieure de l’œil entre le nerf optique (ON) et la fissure choroïde (CF) et se compose d’environ 6000 neurones dans les premiers stades embryonnaires1,4. Pour la première semaine en culture, les neurones ganglionnaires ciliaires présentent une morphologie multipolaire. Après une semaine, ils commencent à la transition vers un état unipolaire, avec une neurite s’étendant et formant l’axon5. En outre, environ la moitié des neurones cg meurent entre le8 e et le14ème jour du développement de l’embryon de poussin, par un processus programmé de la mort cellulaire. Cette diminution du nombre de neurones se traduit par une population totale du ganglion ciliaire d’environ 3000 neurones6,7,8. In vitro, il n’y a pas de réduction du nombre de neurones CG lorsqu’ils sont cultivés avec les cellules musculaires9 et les neurones CG peuvent être cultivés pendant plusieurs semaines1,9.
Le ganglion ciliaire se compose d’une population homogène de neurones ciliaires et de neurones choroïdes, représentant chacun la moitié de la population neuronale dans le CG, instériorisant le muscle de l’œil. Ces deux types de neurones sont structurellement, anatomiquement et fonctionnellement distincts. Les neurones ciliaires innervotent les fibres musculaires striées sur l’iris et la lentille, étant responsables de la contraction de la pupille. Les neurones choroïdes innervate le muscle lisse de la choroïde1,10,11,12.
Les cultures des neurones ganglionnaires ciliaires de poulet se sont avérées des outils utiles pour l’étude des synapses neuromusculaires et de la formation de synapse1,5,9. Considérant que les synapses neuromusculaires sont cholinergiques13, en utilisant une population neuronale qui est cholinergique - neurones CG - émergé comme une alternative potentielle aux modèles cellulaires précédents14. Ces modèles se composaient d’une population neuronale hétérogène, dans laquelle seule une petite partie est cholinergique. Alternativement, les neurones de ganglion ciliaire se développent relativement rapidement invitro, et après environ 15 heures forment déjà des synapses1. Les neurones cg ont été utilisés comme système modèle au fil des ans pour des études de recherche distinctes, en raison de sa facilité relative d’isolement et de manipulation. Ces applications comprennent les études optogénétiques, le développement de la synapse, l’apoptose et les interactions neuromusculaires14,15.
Nous décrivons une procédure détaillée pour la dissection, la dissociation et la culture in vitro des neurones ganglionnaires ciliaires des embryons de poussins du jour embryonnaire 7 (E7). Nous fournissons un protocole étape par étape afin d’obtenir des cultures cellulaires très pures et stables de neurones cholinergiques. Nous soulignons également les étapes clés du protocole qui nécessitent une attention particulière et qui amélioreront la qualité des cultures neuronales. Ces cultures peuvent être maintenues in vitro pendant au moins 15 jours.
Protocole
1. Préparation des réactifs
REMARQUE : Les matériaux nécessaires à cette intervention sont les suivants : forceps (nº 5 et nº 55), pinces à épiler chirurgicales, dissection petri (fond noir), plaques de 24 puits, pipette Pasteur en plastique, pipette Pasteur en verre poli par le feu, seringue de 10 mL, filtre à seringues 0,22 μm.
- Préparer et stériliser tout le matériel nécessaire au protocole, y compris les couvercles en verre, les forceps (nº 5 et nº 55), les pinces chirurgicales, les boîtes de Pétri (fond noir), les h2O distillés, les pipettes et le matériel pour la chirurgie.
- Préparer une solution poly-D-Lysine (PDL) de 0,1 mg/mL.
- Reconstituer le PDL en tampon de borate de 0,1 M (pH 8,2) à une concentration de 1 mg/mL (solution 10x).
- Diluer 1:10 dans 166,6 mM tampon de borate (pH 8.2) pour obtenir une concentration finale de 0,1 mg/mL.
- Préparer une solution de laminine de 10 μg/mL.
- Diluer 1 mg/mL laminine dans le milieu neurobasal plaine à une concentration finale de 10 μg/mL.
- Préparer la solution de sel équilibré de Hank (HBSS) : 5,36 mM KCl, 0,44 mM KH2PO4, 137 mM NaCl, 4,16 mM NaHCO3, 0,34 mM Na2HPO4·2H2O, 5 mM de glucose, 1 mM de pyruvé de sodium, tampon 10 mM HEMES, 0,001% phénol rouge. Ajuster le pH à 7,2.
- Préparer une solution trypsin de 0,1 %.
- Dissoudre 5 mg de trypsin 1:250 poudre dans 5 mL de HBSS pour une concentration finale de 0,1%.
- Placer dans un mélangeur à rouleaux à 4 °C jusqu’à dissolution complète.
- Filtrer à l’aide d’une seringue de 10 mL et d’un filtre à seringues de 0,22 μm.
- Préparer des ganglions ciliaires incomplets :moyen neurobasal sans glutamine, 1X B27 (photosensible), 10% sérum de cheval inactivé thermiquement, 2% FBS inactivé thermiquement, 12,5 Pélicilline/streptomycine U/mL (0,25x) et 2 mM glutamine. Utilisez des réactifs stériles et préparez le milieu dans des conditions stériles.
- Préparer les ganglions ciliaires moyens complets (complétés par des facteurs de croissance) : au milieu incomplet, ajouter 5 ng/mL GDNF et 5 ng/mL CNTF.
2. Préparation de couvercles en verre pour les plaques de 24 puits
- Placez le nombre désiré de couvercles en verre à l’intérieur d’un contenant résistant à l’acide et ajoutez 65 % d’acide nitrique jusqu’à ce que tous les couvercles soient submergés. Placer le récipient dans un shaker orbital et incuber toute la nuit à température ambiante (RT) à une vitesse de 1000 tr/min.
- Le lendemain, transférer soigneusement l’acide nitrique dans un petit réservoir et les stocker pour une utilisation ultérieure. L’acide nitrique peut être réutilisé 2-3x.
- Ajouter soigneusement le H2O distillé aux couvercles pour enlever le reste de l’acide nitrique. Placer dans l’agitation pendant 30 minutes, jeter la solution de lavage et répéter ce 5x.
- Rincer les couvercles avec 75% d’éthanol deux fois.
- Séparer soigneusement et placer les couvercles individuels dans un support métallique recouvert de papier d’aluminium et incuber à 50 ºC pendant 10-15 minutes ou jusqu’à ce qu’ils soient complètement secs.
REMARQUE : Ne pas autoclaver les couvercles en verre car ils colleront les uns aux autres. - Stériliser les couvercles sous la lumière UV pendant 10-15 minutes. Maintenir les couvercles stériles pour la culture des tissus neuronaux.
3. Revêtement de couvercles en verre pour plaques de 24 puits
- À l’aide d’une pince à épiler stérile, placer un couvercle dans chaque puits d’une plaque de 24 puits.
- Ajouter 500 μL de 0,1 mg/mL PDL et incuber toute la nuit à 37 °C.
- Le lendemain, rincer les couvercles deux fois à l’égard du H2O distillé stérile. Ensuite, ajouter 500 μL d’eau distillée à chaque couvercle et laisser reposer 30 minutes à température ambiante.
- Jeter l’eau et ajouter 350 μL de 10 μg/mL de laminine dans chaque puits.
- Placer dans un incubateur de 37 °C pendant 2 h.
- Avant le placage cellulaire, retirer la solution de laminine et laver deux fois à l’eau avec un milieu neurobasal plat.
REMARQUE : Il est important que les couvercles ne sèchent pas à tout moment. - Ajouter 300 μL de milieu complet et laisser dans un incubateur à 37 °C et 5 % de CO2 jusqu’au moment du placage. Avant de plaquer les cellules, retirez ce milieu.
4. Culture des ganglions ciliaires de l’embryon de poulet (jour embryonnaire 7)
- Dissection des ganglions ciliaires (CG)
- Retirer les œufs de l’incubateur et les pulvériser avec 75% d’éthanol.
REMARQUE : Les œufs sont stockés à ~16 °C avant d’être incubés à 37,7 °C pendant 7 jours (ou le stade embryonnaire souhaité). Les œufs utilisés ici proviennent d’espèces de poulets Ross. - Couper le dessus de l’œuf à l’aide d’un ciseaux et retirer l’embryon à l’aide d’une cuillère. Placez l’embryon dans une boîte de Pétri avec le HBSS glacé et séparez la tête du corps en coupant dans la région du cou.
REMARQUE : Dès que l’embryon est retiré de l’ovule, il peut produire des protéases responsables de la mort cellulaire. Il est important de séparer rapidement la tête du corps une fois que l’embryon est à l’extérieur de la coquille pour minimiser la mort cellulaire. - Gardez la tête de l’embryon dans le HBSS glacé.
- Maintenez la tête de l’embryon vers le haut et fixez-la dans le bec du poussin avec nº 5 forceps. Ensuite, avec nº 55 forceps, commencer à enlever la fine couche de peau autour de l’œil.
- Retirez soigneusement l’œil et faites-le pivoter pour accéder à la partie postérieure. Tout en séparant l’œil de la tête du poussin, remarquez le nerf optique étant sectionné. Cela aidera à localiser le ganglion ciliaire.
- Une fois que l’œil est séparé, gardez-le avec le côté postérieur vers le haut et remarquez le ganglion ciliaire adjacent au nerf optique sectionné et à la fissure choroïde. Le nerf préganglionique pourrait encore être attaché au ganglion ciliaire, qui facilite son identification.
- Disséquer le ganglion ciliaire de chaque œil et nettoyer très bien en enlevant l’excès de tissu autour de chaque ganglion.
REMARQUE : Pour avoir un rendement de ~1x106 cellules/mL, disséquez ~70 DG. Veuillez noter que la population cellulaire obtenue contient également des cellules non neuronales. Pour diminuer le nombre de cellules non neuronales et, par conséquent, augmenter la pureté de la population neuronale, il est très important de nettoyer les ganglions ciliaires autant que possible, en enlevant tous les tissus excédentaires.
- Retirer les œufs de l’incubateur et les pulvériser avec 75% d’éthanol.
- Dissociation et culture des ganglions ciliaires
- Recueillir tous les ganglions ciliaires à un tube de 15 mL à l’aide d’une pipette pasteur en plastique stérile.
REMARQUE : Il est important de pré-mouiller la pipette Pasteur pour minimiser l’attachement des ganglions au mur de la pipette. - Centrifuger les ganglions ciliaires pendant 2 minutes à 200 x g.
- Soigneusement, retirez tout le support HBSS à l’aide d’une pipette Pasteur, puis d’une micropipette P1000. Ajouter 1 mL de 0,1% de solution de trypsin et incuber pendant 20 minutes à 37 °C dans un bain d’eau, sans agitation.
- Centrifugeuse pendant 2 minutes à 200 x g.
- Retirez immédiatement la solution trypsin et ajoutez 1 mL de support incomplet.
REMARQUE : Le milieu incomplet contient du sérum qui arrêtera immédiatement l’effet de la trypsie. - Centrifuge pendant 2 minutes à 200 x g et retirez tous les milieux.
- Ajouter 350-500 μL de milieu complet.
REMARQUE : Le volume nécessaire pour dissocier les cellules dépend du nombre de ganglions ciliaires obtenus et, par conséquent, de la taille des granulés obtenus. Pour ~70 CG, il est recommandé d’utiliser 500 μL de milieu. - Dissociez les CG en faisant des pipes de haut en bas 10-15x d’abord à l’aide d’un P1000 suivi de 10-15x à l’aide d’une pipette Pasteur en verre poli par le feu. Évitez la formation de bulles d’air pour minimiser la perte de cellules.
REMARQUE : Gardez la suspension cellulaire sur la glace jusqu’au placage. - Déterminer la densité cellulaire à l’aide d’une solution bleu Trypan et d’une chambre neutre standard.
- Plaque 1 x 104 cellules/mL dans chaque puits de la plaque de 24 puits en diluant le volume approprié de suspension cellulaire dans 500 μL de milieu complet (complété par 10 μM 5'-FDU).
- Incuber les cellules dans un incubateur de CO2 à 37 °C et 5 %.
- Recueillir tous les ganglions ciliaires à un tube de 15 mL à l’aide d’une pipette pasteur en plastique stérile.
5. Immunocytochimie et analyse d’image des neurones ciliaires
- Effectuer l’essai d’immunocytochimie présenté dans cet article tel que décrit précédemment16,17.
- Utilisez les anticorps primaires suivants : souris monoclonale b-III tubuline (1:1000, T8578), poulet monoclonal neurofilament M (1:1000, AB5735), souris monoclonal SV2 (1:1000, AB2315387).
- En tant qu’anticorps secondaires, utilisez l’anticorps anti-souris de chèvre conjugué Alexa Fluor 568 (1:1000, A11031), l’anticorps anti-poulet de chèvre conjugué Alexa Fluor 568 (1:1000, A11041), l’anticorps anti-souris de chèvre alexa fluor 647-conjugué (1:1000, A21235).
- Couvercles de montage utilisant le milieu de montage avec DAPI, pour la coloration nucléaire (P36935).
Résultats
La durée estimée de cette procédure dépend étroitement du rendement nécessaire pour chaque expérience spécifique et, par conséquent, du nombre de ganglions ciliaires qui doivent être isolés. Pour un rendement estimé de 1 x 106 cellules/mL, isoler environ 70 ganglions ciliaires (35 œufs). Pour ce nombre de ganglions, il faudra 2-3 heures pour la procédure de dissection et un total de 4-5 heures pour la procédure totale. Une illustration étape par étape du protocole d’isolement est présentée à la figure 1A. L’identification du ganglion ciliaire peut être difficile, surtout lors de l’exécution de ce protocole pour la première fois. Le ganglion ciliaire est localisé près du nerf optique et de la fissure choroïde (figure 1B). Les étapes clés de la procédure de dissection sont indiquées à la figure 2. Tout d’abord, l’embryon est retiré de l’œuf et placé dans le HBSS glacé. La tête est séparée du corps et, une fois de plus, placée dans le HBSS glacé dans une boîte de Pétri de dissection (Figure 2A-2C). Ensuite, l’œil est retiré de la tête du poussin et le ganglion ciliaire est isolé (Figure 2D-2H).
Les cultures obtenues avec ce protocole sont très pures. Cependant, le nettoyage des ganglions et l’élimination de l’excès de tissu dicte fortement le succès et la pureté de la culture. Les cellules se développent rapidement et peuvent être utilisées déjà dans les premiers jours en culture si l’expérience globale l’exige. Néanmoins, les cultures peuvent être maintenues pendant 15 jours, ou plus. Si vous utilisez les cultures pendant plus de 7-8 jours, assurez-vous de remplacer un tiers du milieu de culture par un milieu frais tous les 2-3 jours. Après 1 jour in vitro, les neurones cg montrent une morphologie multipolaire. Cependant, l’extension de neurite se produit rapidement, et un réseau neuronal primaire est déjà établi après 24 heures. Après 8 jours in vitro, les neurones sont déjà passés à un état unipolaire, où l’une des neurites s’étend et forme l’axone. Le réseau neuronal est très dense à ce stade de développement (figure 3 et figure 4).
Les neurones ganglionnaires ciliaires sont des neurones cholinergiques qui appartiennent au système nerveux parasympathique. In vivo, ces neurones sont responsables de l’innervation musculaire dans l’œil. Ces cultures neuronales sont très bien adaptées à l’étude des synapses neuromusculaires. Pour cela, les neurones CG peuvent être plaqués sur les cellules musculaires. Le muscle pectoral de poussin a été disséqué et a permis de se développer et de mûrir in vitro jusqu’à DIV 4. Les neurones cg ont ensuite été plaqués sur le dessus de la couche musculaire et la co-culture a permis de se développer pendant 3 jours de plus. À ce stade, les fibres musculaires sont formées et peuvent être facilement identifiées par la présence de plusieurs noyaux (bleu). Synaptic vésioprotéine 2A (SV2) immunostaining, un marqueur présynaptique montre la présence de synapses qui sont établies entre les neurones CG axones et les fibres musculaires (Figure 5).

Figure 1 : Schéma du protocole de dissection et du ganglion ciliaire. (A) Diagramme du protocole d’isolement et de culture. (B) Schéma de la localisation de ganglion ciliaire de poussin dans la partie postérieure de l’oeil. Le nerf optique, le ganglion ciliaire et la fissure choroïde sont indiqués par des flèches. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Dissection du ganglion ciliaire de poussin E7. (A) Couper le dessus de l’œuf à l’aide de ciseaux. (B) Retirer l’embryon de l’œuf à l’aide d’une cuillère et le placer dans une boîte de Pétri de dissection avec HBSS glacé. (C) Séparer la tête du corps en coupant dans la région du cou. (D) Fixer la tête de l’embryon dans le bec, tenant avec forcep nº 5. (E) Retirez l’œil par rotation douce à l’aide de forcep nº 55. (F) Vue postérieure de l’œil. Les flèches indiquent la localisation du nerf optique, de la fissure choroïde et du ganglion ciliaire. (G) Disséquer le ganglion ciliaire. (H) ganglion ciliaire disséqué. L’excès de tissu doit être enlevé. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Développement in vitro des neurones ganglionnaires ciliaires. Images de contraste de phase des neurones cg à DIV 1, 3, 8 et 15. Comme les neurones CG sont plaqués, ils initient immédiatement l’excroissance de la neurite. Chez DIV 15, le réseau axonal est très dense et à ce stade les neurites sont complètement différenciées en dendrites et axones. Les images de contraste de phase ont été acquises à l’aide d’un microscope confocal avec un objectif de 20x ph2 plan-Apochromat. Barre d’échelle : 50 μm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Immunocytochimie des neurones cg à DIV 8. Les neurones cg montrent un réseau neuronal bien établi après 8 jours in vitro. Les noyaux étaient tachés de DAPI (bleu) et les axones étaient tachés de tubuline b-III (rouge). Les imageries de fluorescence ont été acquises à l’aide d’un microscope confocal avec un objectif plan-Apochromat 20x. Barre d’échelle : 50 μm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
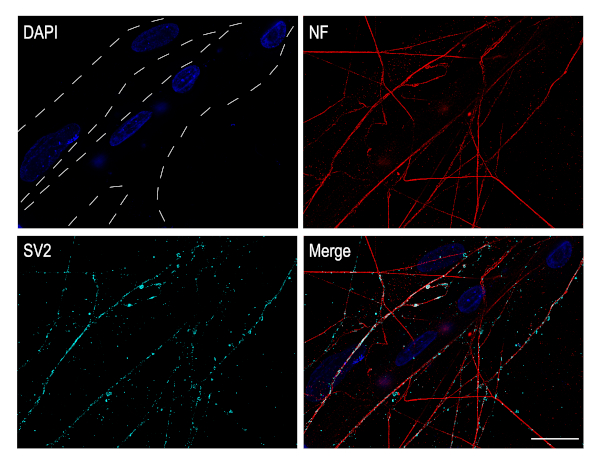
Figure 5 : Les neurones cultivés de CG établissent des synapses avec des fibres de muscle. Images immunocytochimistes des co-cultures musculaires de neurones-pectoraux de CG. Les fibres musculaires identifiées par les lignes pointillées présentent plusieurs noyaux, qui ont été tachés de DAPI (bleu). Les axones ont été étiquetés contre le neurofilament (rouge) et les vésicules synaptiques ont été étiquetées contre SV2 (cyan). Des images ont été acquises à l’aide d’un microscope confocal avec un objectif d’huile plan-Apochromat 63x. Barre d’échelle : 20 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Dans ce protocole, nous avons démontré comment préparer et culturer les neurones CG. L’identification et la dissection du ganglion ciliaire peuvent être difficiles pour les utilisateurs non exexpérienced. Par conséquent, nous présentons une procédure détaillée et étape par étape pour disséquer efficacement E7 ganglions ciliaires poussin, dissocier le tissu et préparer des cultures neuronales qui peuvent être maintenues pendant au moins 15 jours. Les neurones ganglionnaires ciliaires obtenus avec ce protocole sont également appropriés pour la co-culture avec les cellules musculaires.
Les ganglions ciliaires à différents stades de développement du développement embryonnaire des poussins peuvent être utilisés comme modèle cellulaire, selon le but de l’étude. Cependant, pour les cultures de neurones CG, il est suggéré qu’ils soient isolés de l’embryon de poussin entre les jours embryonnaires 7 et 818. Au stade embryonnaire E8, les neurones CG n’ont pas encore subi de processus de mort neuronale et le nombre de cellules non neuronales est réduit comparativement avec les cellules neuronales18. Ceci, en combinaison avec une procédure rigoureuse de dissection et des ganglions très bien nettoyés, contribuera à une culture très pure des neurones ganglionnaires ciliaires, avec peu de contamination par des cellules non neuronales, telles que les fibroblastes ou les cellules gliales.
Pendant l’isolement des neurones cg, l’un des points critiques est l’identification et le nettoyage du CG. La dissection d’une structure aussi petite, comme le ganglion ciliaire, peut être difficile compte tenu de la localisation, de la capacité d’identifier le ganglion ainsi que de la taille du ganglion lui-même. Il est normal que les ganglions puissent s’attacher aux forceps pendant la dissection. Les instruments de dissection de haute qualité sont très importants pour une dissection réussie et minimiseront l’attachement des ganglions aux forceps. Le nettoyage du GC est important pour prévenir la contamination par des cellules non neuronales. Il est nécessaire d’isoler environ 70 ganglions pour obtenir une densité cellulaire de ~1x106 cellules/mL, contrairement à d’autres tissus neuronaux du système nerveux périphérique qui ont un 5-15x plus grand nombre de ganglions3.
En culture, l’ajout de 5'-FDU au milieu complet diminue la contamination de la culture GC avec des cellules non neuronales. 5'-FDU est un composé anti-mitotique qui inhibe la prolifération cellulaire, à savoir la prolifération des cellules gliales et des fibroblastes. La concentration de 5'-FDU ajoutée au milieu est suffisante pour arrêter le cycle cellulaire dans la phase S, mais n’est pas préjudiciable au développement normal des neurones CG3,19,20. Le temps de traitement avec 5'-FDU peut être ajusté. Cependant, puisque les neurones CG établissent un réseau axonal dense dans un court laps de temps, 5'-FDU devrait être ajouté à la culture dès le temps du placage.
Une des principales limites de ce modèle est qu’il n’est pas représentatif du développement normal des neurones cg dans des conditions physiologiques. À ovo, environ la moitié des neurones cg meurent entre le8 e et le14ème jour du développement d’embryons de poussins. En culture, il n’y a pas de diminution du nombre de neurones CG lorsque le milieu est complété par des facteurs neurotrophiques qui permettent sa survie1,6,14.
La population neuronale obtenue à partir de la dissection du ganglion ciliaire poussin est une population homogène de neurones cholinergiques, appartenant au système nerveux autonome. Il convient de noter que l’expression des neurotransmetteurs dans la population de choroïdes de la CG est axée sur la cible, qui pourrait être entravée en fonction du type de muscle utilisé dans la co-culture24. Si le but de l’étude est lié à l’identité génétique ou au sous-type du neurone moteur lui-même, alors les neurones CG pourraient ne pas être le meilleur modèle neuronal approprié. En outre, la spécificité des neurones moteurs dans l’innervation des fibres musculaires ne peut pas être accompli lors de l’utilisation de co-cultures de neurone cg puisque, dans ce cas, les fibres musculaires peuvent être multipliées innervé25. Cependant, cette culture neuronale a plusieurs avantages, il ne nécessite que l’équipement de base pour maintenir et incuber les œufs, c’est une procédure raisonnablement peu coûteuse et, plus important encore, fournit un excellent modèle pour l’étude des synapses neuromusculaires1, puisque les neurones CG mécanismes de neurotransmission sont très similaires à ceux qui se produisent dans les neurones moteurs rachidiens. Les modèles cellulaires précédemment utilisés pour ce type d’études étaient des neurones sensoriels de la moelle épinière12,21,22,23. Cependant, ces co-cultures étaient composées d’une population hétérogène de neurones, pas tous cholinergiques et, par conséquent, seulement une petite partie des neurones ont été en mesure d’établir des contacts fonctionnels avec les cellules musculaires1. Outre l’analyse développementale (immunocytochimie) démontrée dans ce travail, d’autres tests peuvent être effectués dans les cultures cg comme l’électrophysiologie et la survie neuronale.
Sur la base de ce protocole, des questions scientifiques supplémentaires peuvent être abordées, par exemple comment la localisation subcellulaire d’ARNM et de protéines spécifiques régule la formation et la fonction de synapse. En outre, les co-cultures nerveuses peuvent être facilement établies et être utilisées pour étudier les maladies neuromusculaires lorsque le site de la blessure est la jonction neuromusculaire. Les maladies neuromusculaires sont hétérogènes dans la nature dans le sens que le dysfonctionnement pourrait être associé au muscle lui-même, les nerfs périphériques ou les jonctions neuromusculaires26. Ainsi, à travers ces co-cultures, il serait possible d’étudier les altérations neuromusculaires de jonction qui, en fin de compte, sous-tendent le développement et la progression des maladies neuromusculaires. Une autre possibilité intéressante serait d’adapter ce protocole au système trigéminal de souris. Ces neurones sont facilement accessibles, et leur modèle de développement est bien connu27. Parce que les souris sont favorables à la manipulation génétique et le système trigéminal est bien caractérisé en termes de formation de cartes topographiques de nouvelles possibilités apparaissent en utilisant un protocole à base de trigéminale pour étudier le développement neuronal.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Ces travaux ont été financés par le Fonds européen de développement régional (FEDF), par le biais du Programme opérationnel régional Centro 2020 dans le cadre des projets CENTRO-01-0145-FEDER-00008:BrainHealth 2020, CENTRO2020 CENTRO-01-0145-FEDER-000003:pAGE, CENTRO-01-0246-FEDER-00018:MEDISIS, et par le biais de la COMPÉTITION 2020 - Programme opérationnel pour la compétitivité et l’internationalisation et les fonds nationaux portugais via FCT – Fundação para a Ciência e a Tecnologia, I.P., dans le cadre des projets UIDB/04539/2020, UIDB/04501/2020, POCI-01-0145-FEDER-022122:PPBI, PTDC/SAU-NEU/104100/2008, et les subventions individuelles SFRH/BD/141092/2008 2018 (M.D.), DL57/2016/CP1448/CT0009 (R.O.C.), SFRH/BD/77789/2011 (J.R.P.) et par Marie Curie Actions - IRG, 7e programme-cadre.
matériels
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2’-deoxiuridina (5'-FDU) | Merck (Sigma Aldrich) | F0503 | |
| Alexa Fluor 568-conjugated goat anti-chicken antibody | Thermo Fisher Scientific | A11041 | |
| Alexa Fluor 568-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A11031 | |
| Alexa Fluor 647-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A21235 | |
| B27 supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Chicken monoclonal neurofilament M | Merck (Sigma Aldrich) | AB5735 | |
| D-(+)-Glucose monohydrate | VWR | 24371.297 | |
| Fetal Bovine Serum (FBS), qualified, Brazil | Invitrogen (Gibco) | 10270-106 | |
| HEPES, fine white crystals, for molecular biology | Fisher Scientific | 10397023 | |
| Horse Serum, heat inactivated, New Zealand origin | Invitrogen (Gibco) | 26050-070 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| Mouse laminin I | Cultrex (R&D systems) | 3400-010-02 | |
| Mouse monoclonal b-III tubulin | Merck (Sigma Aldrich) | T8578 | |
| Mouse monoclonal SV2 | DSHB | AB2315387 | |
| Multidishes, cell culture treated, BioLite, MW24 (50x) | Thermo Fisher Scientific | 11874235 | |
| Neurobasal medium without glutamine | Invitrogen (Gibco) | 21103-049 | |
| Penicillin/streptomycin (5,000 U/mL) | Invitrogen (Gibco) | 15070-063 | |
| Phenol red, bioreagent, suitable for cell culture | Merck (Sigma Aldrich) | P3532 | |
| Poly-D-Lysine | Merck (Sigma Aldrich) | P7886 | |
| Potassium chloride | Fluka (Honeywell Reaarch Chemicals) | 31248-1KG | |
| Potassium di-hydrogen phosphate (KH2PO4) for analysis, ACS | Panreac Applichem | 131509-1000 | |
| Prolong Gold Antifade mounting medium with DAPI | Invitrogen (Gibco) | P36935 | |
| Puradisc FP 30mm Syringe Filter, Cellulose Acetate, 0.2µm, sterile 50/pk | Fisher Scientific | 10462200 | |
| Recombinant human ciliary neurotrophic factor (CNTF) | Peprotech | 450-13 | |
| Recombinant human glial cell-derived neurotrophic factor (GDNF) | Peprotech | 450-10 | |
| Sodium chloride for analysis, ACS, ISO | Panreac Applichem | 131659-1000 | |
| Sodium dihydrogen phosphate 2-hydrate (Na2HPO4·2H2O), pure, pharma grade | Panreac Applichem | 141677-1000 | |
| Sodium Pyruvate 100 mM (100x) | Thermo Fisher | 11360039 | |
| Syringe without needle, 10 mL | Thermo Fisher | 11587292 | |
| Trypsin 1:250 powder | Invitrogen (Gibco) | 27250-018 |
Références
- Betz, W. The Formation of Synapses between Chick Embryo Skeletal Muscle and Ciliary Ganglia Grown in vitro. Journal of Physiology. 254, 63-73 (1976).
- Fischbach, G. D. Synapse Formation between Dissociated Nerve and Muscle Cells in Low Density Cell Cultures. Developmental Biology. 28, 407-429 (1972).
- Bernstein, B. W. Dissection and Culturing of Chick Ciliary Ganglion Neurons: A System well Suited to Synaptic Study. Methods in Cell Biology. 71, 37-50 (2003).
- Marwitt, R., Pilar, G., Weakly, J. N. Characterization of Two Ganglion Cell Populations in Avian Ciliary Ganglia. Brain Research. 25, 317-334 (1971).
- Role, L. W., Fishbach, G. D. Changes in the Number of Chick Ciliary Ganglion. Neuron Processes with Time in Cell Culture. Journal of Cell Biology. 104, 363-370 (1987).
- Landmesser, L., Pilar, G. Synaptic Transmission and Cell Death During Normal Ganglionic Development. Journal of Physiology. , 737-749 (1974).
- Koszinowski, S., et al. Bid Expression Network Controls Neuronal Cell Fate During Avian Ciliary Ganglion Development. Frontiers in Physiology. 9, 1-10 (2018).
- Landmesser, L., Pilar, G. Synapse Formation During Embryogenesis on Ganglion Cells Lacking a Periphery. Journal of Physiology. 241, 715-736 (1974).
- Nishi, R., Berg, D. K. Dissociated Ciliary Ganglion Neurons in vitro: Survival and Synapse Formation. Proceedings of the National Academy of Sciences of the United States of America. 74, 5171-5175 (1977).
- Nishi, R., Berg, D. K. Two Components from Eye Tissue that Differentially Stimulate the Growth and Development of Ciliary Ganglion Neurons in Cell Culture. Journal of Neuroscience. 1, 505-513 (1981).
- Pilar, G., Vaughan, P. C. Electrophysiological Investigations of the Pigeon iris Neuromuscular Junctions. Comparative Biochemistry and Physiology B. 29, 51-72 (1969).
- Landmesser, L., Pilar, G. Selective Reinnervation of Two Cell Populations in the Adult Pigeon Ciliary Ganglion. Journal of Physiology. , 203-216 (1970).
- Pinto, M. J., Almeida, R. D. Puzzling Out Presynaptic Differentiation. Journal of Neurochemistry. 139, 921-942 (2016).
- Dryer, S. E. Functional Development of the Parasympathetic Neurons of the Avian Ciliary Ganglion: A Classic Model System for the Study of Neuronal Differentiation and Development. Progress in Neurobiology. 43, 281-322 (1994).
- Egawa, R., Yawo, H. Analysis of Neuro-Neuronal Synapses using Embryonic Chick Ciliary Ganglion via Single-Axon Tracing, Electrophysiology, and Optogenetic Techniques. Current Protocols in Neuroscience. 87, 1-22 (2019).
- Pinto, M. J., Pedro, J. R., Costa, R. O., Almeida, R. D. Visualizing K48 Ubiquitination during Presynaptic Formation by Ubiquitination-Induced Fluorescence Complementation (UiFC). Frontiers in Molecular Neuroscience. 9, 1-19 (2016).
- Martins, L. F., et al. Mesenchymal Stem Cells Secretome-Induced Axonal Outgrowth is Mediated by BDNF. Scientific Reports. 7, 1-13 (2017).
- Nishi, R. Autonomic and Sensory Neuron. Methods in Cell Biology. , 249-263 (1996).
- Rojo, J. M., De Ojeda, G., Portolés, P. Inhibitory Mechanisms of 5-fluorodeoxyuridine on Mitogen-induced Blastogenesis of Lymphocytes. International Journal of Immunopharmacology. 6, 61-65 (1984).
- Hui, C. W., Zhang, Y., Herrup, K. Non-Neuronal Cells are Required to Mediate the Effects of Neuroinflammation: Results from a Neuron-Enriched Culture System. PLoS One. 11, 1-17 (2016).
- Crain, S. M., Alfei, L., Peterson, E. R. Neuromuscular Transmission in Cultures of Adult Human and Rodent Skeletal Muscle After Innervation in vitro by Fetal Rodent Spinal Cord. Journal of Neurobiology. 1, 471-489 (1970).
- Kano, M., Shimada, Y. Innervation and Acetylcholine Sensitivity of Skeletal Muscle Cells Differentiated in vitro from Chick Embryo. Journal of Cellular Physiology. 78, 233-242 (1971).
- Robbins, N., Yonezawa, T. Developing Neuromuscular Juctions: First Sings of Chemical Transmission during Formation in Tissue Culture. Science. 80, 395-398 (1971).
- Squire, L. R. . Encyclopedia of Neuroscience. , (2010).
- Hooisma, J., Slaaf, D. W., Meeter, E., Stevens, W. F. The Innervation of Chick Striated Muscle Fibers by the Chick Ciliary Ganglion in Tissue Culture. Brain Research. 85, 79-85 (1975).
- Morrison, B. M. Neuromuscular Diseases. Seminars in Neurology. , 409-418 (2016).
- Davies, A. M. The Trigeminal System: An Advantageous Experimental Model for Studying Neuronal Development. Development. 103, 175-183 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon