Method Article
Isolation und Kultur von Chick Ciliary Ganglion Neurons
In diesem Artikel
Zusammenfassung
Küken-Ziliarganglien (CG) sind Teil des parasympathischen Nervensystems. Neuronale Kulturen von Küken CG Neuronen wurden gezeigt, dass effektive Zellmodelle in der Studie der Nervenmuskel-Interaktionen. Wir beschreiben ein detailliertes Protokoll für die Zerlegung, Dissoziation und In-vitro-Kultur von CG-Neuronen aus Kükenembryonen.
Zusammenfassung
Küken Ziliarganglien (CG) sind Teil des parasympathischen Nervensystems und sind verantwortlich für die Innervation der Muskelgewebe im Auge vorhanden. Dieses Ganglion besteht aus einer homogenen Population von Ziliar- und Aderhautneuronen, die die muskelfasern inneren und glatten Muskelfasern bilden. Jeder dieser neuronalen Typen reguliert spezifische Augenstrukturen und Funktionen. Im Laufe der Jahre zeigten sich neuronale Kulturen der Küken-Ziliarganglien als wirksame Zellmodelle bei der Untersuchung von Muskel-Nerven-System-Wechselwirkungen, die durch cholinerge Synapsen kommunizieren. Ziliarganglien-Neuronen sind in ihrer Mehrheit cholinerge. Dieses Zellmodell hat sich als nützlich für bisher verwendete heterogene Zellmodelle erwiesen, die neben cholinergen verschiedene neuronale Typen umfassen. Anatomisch wird das Ziliarganglien zwischen dem Sehnerv (ON) und der Aderhautspalte (CF) lokalisiert. Hier beschreiben wir ein detailliertes Verfahren für die Zerlegung, Dissoziation und In-vitro-Kultur von Ziliarganglien-Neuronen aus Kükenembryonen. Wir bieten ein Schritt-für-Schritt-Protokoll, um hochreine und stabile Zellkulturen von CG-Neuronen zu erhalten, wobei die wichtigsten Schritte des Prozesses hervorgehoben werden. Diese Kulturen können 15 Tage lang in vitro gepflegt werden und zeigen damit die normale Entwicklung von CG-Kulturen. Die Ergebnisse zeigen auch, dass diese Neuronen mit Muskelfasern durch neuromuskuläre cholinerge Synapsen interagieren können.
Einleitung
Ziliarganglion (CG) Neuronen gehören zum parasympathischen Nervensystem. Diese Neuronen sind cholinerg, in der Lage, muscarinische oder nikotinische Synapsen1,2,3. Anatomisch befindet sich die CG im hinteren Teil des Auges zwischen dem Sehnerv (ON) und der Aderhautspalte (CF) und besteht aus rund 6000 Neuronen in frühen embryonalen Stadien1,4. Für die erste Kulturwoche präsentieren Ziliarganglien-Neuronen eine multipolare Morphologie. Nach einer Woche beginnen sie, in einen unipolaren Zustand überzusteigen, wobei sich ein Neurit ausdehnt und das Axon5bildet. Darüber hinaus stirbt etwa die Hälfte der CG-Neuronen zwischen dem8. und14. Tag der Entwicklung von Kükenembryonen durch einen programmierten Prozess des Zelltodes. Dieser Rückgang der Anzahl der Neuronen führt zu einer Gesamtpopulation des Ziliarganglien von etwa 3000 Neuronen6,7,8. In vitro, Es gibt keine Verringerung der Anzahl der CG Neuronen, wenn mit Muskelzellen9 und CG Neuronen wachsen kann für mehrere Wochen kultiviert werden1,9.
Das Ziliarganglie besteht aus einer homogenen Population von Ziliarneuronen und Aderhautneuronen, die jeweils die Hälfte der neuronalen Population in der CG darstellen und den Muskel des Auges innervieren. Diese beiden Arten von Neuronen sind strukturell, anatomisch und funktionell unterschiedlich. Ziliarneuronen innervate die gestreiften Muskelfasern auf der Iris und Linse, verantwortlich für die Pupillenkontraktion. Aderhautneuronen innervate den glatten Muskel der Aderhaut1,10,11,12.
Kulturen von Hühnerziliar Ganglien Neuronen haben sich als nützliche Werkzeuge für die Untersuchung von neuromuskulären Synapsen und Synapsenbildung1,5,9. Wenn man bedenkt, dass neuromuskuläre Synapsen cholinergesind 13, mit einer neuronalen Population, die cholinergen ist – CG-Neuronen – entstand als mögliche Alternative zu früheren Zellmodellen14. Diese Modelle bestanden in einer heterogenen neuronalen Population, in der nur ein kleiner Teil cholinergisch ist. Alternativ entwickeln sich Ziliarganglien-Neuronen relativ schnell invitro und bilden nach ca. 15 Stunden bereits Synapsen1. CG-Neuronen wurden im Laufe der Jahre als Modellsystem für verschiedene Forschungsstudien verwendet, aufgrund seiner relativ einfachen Isolation und Manipulation. Diese Anwendungen umfassen optogenetische Studien, Synapsenentwicklung, Apoptose und neuromuskuläre Wechselwirkungen14,15.
Wir beschreiben ein detailliertes Verfahren für die Zerlegung, Dissoziation und In-vitro-Kultur von Ziliarganglien-Neuronen aus embryonalen Tag 7 (E7) Kükenembryonen. Wir bieten ein Schritt-für-Schritt-Protokoll, um hochreine und stabile Zellkulturen von cholinergen Neuronen zu erhalten. Wir heben auch die wichtigsten Schritte des Protokolls hervor, die besondere Aufmerksamkeit erfordern und die Qualität der neuronalen Kulturen verbessern werden. Diese Kulturen können in vitro für mindestens 15 Tage aufrechterhalten werden.
Protokoll
1. Herstellung von Reagenzien
HINWEIS: Die für dieses Verfahren notwendigen Materialien sind die folgenden: Zangen (Nr. 5 und Nr. 55), chirurgische Pinzette, Sezieren Petrischalen (schwarzer Boden), 24-Well-Platten, Kunststoff Pasteur Pipette, feuerpolierte Glas Pasteur Pipette, 10 ml Spritze, 0,22 m Spritze Filter.
- Bereiten und sterilisieren Sie alle Materialien, die für das Protokoll benötigt werden, einschließlich Glasabdeckungen, Zangen (Nr. 5 und Nr. 55), chirurgische Pinzette, Petrischalen (schwarzer Boden), destillierte H2O, Pipetten und Material für die Chirurgie.
- Bereiten Sie 0,1 mg/ml Poly-D-Lysin (PDL) Lösung vor.
- PDL im 0,1 M Boratpuffer (pH 8,2) auf eine Konzentration von 1 mg/ml (10x Lösung) rekonstituieren.
- 1:10 in 166,6 mM Boratpuffer (pH 8,2) verdünnen, um eine Endkonzentration von 0,1 mg/ml zu erhalten.
- Bereiten Sie die Lamininlösung mit 10 g/ml vor.
- Verdünnen Sie 1 mg/ml Laminin in einem einfachen neurobasalen Medium auf eine Endkonzentration von 10 g/ml.
- Hank es Balanced Salt Solution (HBSS): 5.36 mM KCl, 0.44 mM KH2PO4, 137 mM NaCl, 4.16 mM NaHCO3, 0.34 mM Na2HPO4'2H2O, 5 mM Glucose, 1 mM Natriumpyruvat, 10 mM HEPES Puffer, 0.001% rot. PH auf 7,2 einstellen.
- Bereiten Sie 0,1% Trypsin-Lösung vor.
- 5 mg Trypsin 1:250 Pulver in 5 ml HBSS für eine Endkonzentration von 0,1% auflösen.
- In einen Walzenmischer bei 4 °C geben, bis er vollständig gelöst ist.
- Filtern Sie mit einer 10 ml Spritze und einem 0,22 m Spritzenfilter.
- Bereiten Ziliarganglien unvollständiges Mediumvor: neurobasales Medium ohne Glutamin, 1X B27 (fotoempfindlich), 10% hitzeinaktiviertes Pferdeserum, 2% hitzeinaktiviertes FBS, 12,5 U/ml Penicillin/Streptomycin (0,25x) und 2 mM Glutamin. Verwenden Sie sterile Reagenzien und bereiten Sie das Medium unter sterilen Bedingungen vor.
- Bereiten Ciliary Ganglia komplettes Medium (ergänzt mit Wachstumsfaktoren): zum unvollständigen Medium, fügen Sie 5 ng/mL GDNF und 5 ng/mL CNTF.
2. Herstellung von Glasabdeckungen für 24-Well-Platten
- Legen Sie die gewünschte Anzahl von Glasabdeckungen in einen säurebeständigen Behälter und fügen Sie 65% Salpetersäure hinzu, bis alle Abdeckungen untergetaucht sind. Den Behälter in einen Orbital-Shaker legen und über Nacht bei Raumtemperatur (RT) bei einer Geschwindigkeit von 1000 Umdrehungen pro Minute inkubieren.
- Am nächsten Tag die Salpetersäure vorsichtig in ein kleines Reservoir überführen und für die weitere Verwendung aufbewahren. Salpetersäure kann 2-3x wiederverwendet werden.
- Fügen Sie die destilliertenH2O vorsichtig zu den Deckellipsen hinzu, um die verbleibende Salpetersäure zu entfernen. 30 Minuten in Rührung geben, die Waschlösung entsorgen und 5x wiederholen.
- Spülen Sie die Deckellipsen zweimal mit 75% Ethanol.
- Trennen und legen Sie einzelne Abdeckungen sorgfältig in ein metallenes Rack, das mit Aluminiumfolie bedeckt ist, und inkubieren Sie bei 50 oC für 10-15 Minuten oder bis zum Trocknen.
HINWEIS: Autoklaven Sie Glasabdeckungen nicht, da sie aneinander kleben. - Sterilisieren Sie die Abdeckungen unter UV-Licht für 10-15 Minuten. Halten Sie Abdeckungen steril für neuronale Gewebekultur.
3. Beschichtung von Glasabdeckungen für 24-Well-Platten
- Mit einer sterilen Pinzette, legen Sie einen Deckelrutsch in jedem Brunnen einer 24-Well-Platte.
- 500 l 0,1 mg/ml PDL hinzufügen und über Nacht bei 37 °C inkubieren.
- Am nächsten Tag die Deckel zweimal mit steril destillierth H2O abspülen. Dann 500 l destilliertes Wasser zu jedem Deckelschlupf hinzufügen und 30 Minuten bei Raumtemperatur lassen.
- Entsorgen Sie das Wasser und fügen Sie in jedem Brunnen 350 l mit 10 g/ml Lamininlösung hinzu.
- In einem 37 °C-Inkubator für 2 h aufstellen.
- Vor der Zellbeschichtung die Lamininlösung entfernen und zweimal mit einem einfachen neurobasalen Medium waschen.
HINWEIS: Es ist wichtig, dass die Abdeckungen zu keinem Zeitpunkt trocknen. - Fügen Sie 300 l des kompletten Mediums hinzu und lassen Sie sie in einem Inkubator bei 37 °C und 5%CO2 bis zur Beschichtungszeit. Entfernen Sie dieses Medium vor dem Beschichten von Zellen.
4. Kultur der Ziliarganglien aus Hühnerembryon (Embryonaltag 7)
- Dissektion von Ziliarganglien (CG)
- Eier aus dem Brutkasten entfernen und mit 75% Ethanol besprühen.
HINWEIS: Eier werden bei 16 °C gelagert, bevor sie 7 Tage lang bei 37,7 °C inkubiert werden (oder das gewünschte embryonale Stadium). Die hier verwendeten Eier stammen von Rosshühnerarten. - Schneiden Sie die Oberseite des Eis mit einer Schere und nehmen Sie den Embryo mit einem Löffel. Legen Sie den Embryo in eine Petrischale mit eiskaltem HBSS und trennen Sie den Kopf vom Körper, indem Sie sie im Nackenbereich schneiden.
HINWEIS: Sobald der Embryo aus dem Ei entfernt wird, kann er Proteasen produzieren, die für den Zelltod verantwortlich sind. Es ist wichtig, den Kopf schnell vom Körper zu trennen, sobald sich der Embryo außerhalb der Schale befindet, um den Zelltod zu minimieren. - Halten Sie den Kopf des Embryos in eiskaltem HBSS.
- Halten Sie den Embryokopf hoch und fixieren Sie ihn im Schnabel des Kükens mit der Nr. 5 Zange. Dann mit nicht 55 Zangen, beginnen, die dünne Schicht der Haut um das Auge zu entfernen.
- Entfernen Sie das Auge vorsichtig und drehen Sie es, um auf das hintere Teil zuzugreifen. Während Sie das Auge vom Kopf des Kükens trennen, bemerken Sie, dass der Sehnerv geschnitten wird. Dies wird helfen, das Zilienganglion zu lokalisieren.
- Sobald das Auge getrennt ist, halten Sie es mit der hinteren Seite nach oben und bemerken Sie das Ziliarganglion neben dem geschnittenen Sehnerv und der Aderhautspalte. Der präganglionische Nerv könnte noch an dem Ziliarganglion befestigt werden, was seine Identifizierung erleichtert.
- Sezieren Sie das Ziliarganglion von jedem Auge und reinigen Sie sehr gut, indem Sie das überschüssige Gewebe um jedes Ganglion entfernen.
ANMERKUNG: Um eine Ausbeute von 1x106 Zellen/ml zu haben, sezieren Sie 70 CGs. Bitte beachten Sie, dass die erhaltene Zellpopulation auch nicht-neuronale Zellen enthält. Um die Anzahl der nicht-neuronalen Zellen zu verringern und folglich die Reinheit der neuronalen Population zu erhöhen, ist es sehr wichtig, die Ziliarganglien so weit wie möglich zu reinigen und dabei das gesamte überschüssige Gewebe zu entfernen.
- Eier aus dem Brutkasten entfernen und mit 75% Ethanol besprühen.
- Dissoziation und Kultur der Ziliarganglien
- Sammeln Sie alle Zilienganglien in einem 15 ml Rohr mit einer sterilen Kunststoff Pasteur Pipette.
HINWEIS: Es ist wichtig, die Pasteur Pipette vorzubefeuchten, um die Befestigung der Ganglien an der Wand der Pipette zu minimieren. - Zentrifugieren Sie die Ziliarganglien für 2 Minuten bei 200 x g.
- Entfernen Sie vorsichtig das gesamte HBSS-Medium mit einer Pasteur-Pipette und anschließend einer P1000-Mikropipette. 1 ml 0,1% Trypsinlösung hinzufügen und 20 Minuten bei 37 °C in einem Wasserbad ohne Rührung inkubieren.
- Zentrifuge für 2 Minuten bei 200 x g.
- Entfernen Sie sofort die Trypsin-Lösung und fügen Sie 1 ml unvollständiges Mediumhinzu.
HINWEIS: Unvollständiges Medium enthält Serum, das sofort die Wirkung von Trypsin stoppt. - Zentrifugieren Sie 2 Minuten bei 200 x g und entfernen Sie alle Medien.
- Fügen Sie 350-500 l des kompletten Mediumshinzu.
HINWEIS: Das notwendige Volumen, um Zellen zu dissoziieren, hängt von der Anzahl der erhaltenen Ziliarganglien und damit von der erhaltenen Pelletgröße ab. Für 70 CG wird empfohlen, 500 L Medium zu verwenden. - Dissoziieren Sie CGs, indem Sie zuerst 10-15x nach oben und unten pfeifen, gefolgt von 10-15x mit einer feuerpolierten Pasteurpipettenrohrette aus Glas. Vermeiden Sie die Bildung von Luftblasen, um den Zellverlust zu minimieren.
HINWEIS: Halten Sie die zelluläre Suspension auf Eis bis zur Beschichtung. - Bestimmen Sie die Zelldichte mit einer Trypan-Blaulösung und einer Standard-Neubauer-Kammer.
- Platte 1 x 104 Zellen/ml in jeder Bohrung der 24-Well-Platte durch Verdünnung des entsprechenden Volumens der Zellsuspension in 500 l komplettem Medium (ergänzt durch 10 'M 5'-FDU).
- Inkubieren Sie Zellen in einem 372 °C, 5% CO2-Inkubator.
- Sammeln Sie alle Zilienganglien in einem 15 ml Rohr mit einer sterilen Kunststoff Pasteur Pipette.
5. Immunzytochemie und Bildanalyse von Ziliarneuronen
- Führen Sie den in diesem Beitrag vorgestellten Immunzytochemie-Test wie zuvor beschrieben16,17durch.
- Verwenden Sie die folgenden primären Antikörper: Maus monoklonales b-III Tubulin (1:1000, T8578), Huhn monoklonales Neurofilament M (1:1000, AB5735), Maus monoklonal SV2 (1:1000, AB2315387).
- Als sekundäre Antikörper verwenden Sie Alexa Fluor 568-konjugierte Ziegenanti-Maus-Antikörper (1:1000, A11031), Alexa Fluor 568-konjugierte Ziege Anti-Hühner-Antikörper (1:1000, A11041), Alexa Fluor 647-konjugierte Ziege Anti-Maus-Antikörper (1:1000, A21235).
- Bedecken mit Montagemedium mit DAPI, für die Kernfärbung (P36935).
Ergebnisse
Die geschätzte Dauer dieses Verfahrens hängt stark von der Ausbeute ab, die für jedes spezifische Experiment benötigt wird, und damit von der Anzahl der Ziliarganglien, die isoliert werden müssen. Bei einem geschätzten Ertrag von 1 x 106 Zellen/ml isolieren Sie etwa 70 Ziliarganglien (35 Eier). Für diese Anzahl von Ganglien, dauert es 2-3 Stunden für die Sezierverfahren und insgesamt 4-5 Stunden für das gesamte Verfahren. Eine schritt für Schritt Darstellung des Isolationsprotokolls ist in Abbildung 1Adargestellt. Die Identifizierung des Ziliarganglions kann schwierig sein, insbesondere wenn dieses Protokoll zum ersten Mal ausgeführt wird. Das Ziliarganglien ist in der Nähe des Sehnervs und der Aderhautspalte lokalisiert (Abbildung 1B). Die wichtigsten Schritte des Seziervorgangs sind in Abbildung 2dargestellt. Zuerst wird der Embryo aus dem Ei entfernt und in eiskalte HBSS gelegt. Der Kopf wird vom Körper getrennt und wieder in eiskalteHBSS in einer sezierenden Petrischale (Abbildung 2A-2C) gelegt. Dann wird das Auge vom Kopf des Kükens entfernt und das Ziliarganglion isoliert (Abbildung 2D-2H).
Die mit diesem Protokoll erhaltenen Kulturen sind hochrein. Die Reinigung der Ganglien und das Entfernen des überschüssigen Gewebes diktieren jedoch stark den Erfolg und die Reinheit der Kultur. Die Zellen entwickeln sich schnell und können bereits in den ersten Tagen in der Kultur eingesetzt werden, wenn das Gesamtexperiment dies erfordert. Dennoch können die Kulturen für 15 Tage oder mehr erhalten werden. Wenn Sie die Kulturen länger als 7-8 Tage verwenden, stellen Sie sicher, dass alle 2-3 Tage ein Drittel des Kulturmediums durch ein frisches Medium ersetzt wird. Nach 1 Tag in vitro zeigen CG-Neuronen eine multipolare Morphologie. Jedoch, Neurit-Erweiterung tritt schnell, und ein primäres neuronales Netzwerk ist bereits nach 24 Stunden etabliert. Nach 8 Tagen in vitro wechselten Neuronen bereits in einen unipolaren Zustand, in dem sich einer der Neuriten ausdehnt und das Axon bildet. Das neuronale Netzwerk ist in diesem Entwicklungsstadium sehr dicht(Abbildung 3 und Abbildung 4).
ZiliarGanglien-Neuronen sind cholinerge Neuronen, die zum parasympathischen Nervensystem gehören. In vivo, Diese Neuronen sind verantwortlich für Muskelinnervation im Auge. Diese neuronalen Kulturen sind sehr gut geeignet für die Untersuchung von neuromuskulären Synapsen. Dazu können CG-Neuronen auf Muskelzellen plattiert werden. Der Brustmuskel des Kükens wurde seziert und durfte sich in vitro bis DIV 4 entwickeln und reifen. CG-Neuronen wurden dann auf die Muskelschicht plattiert und die Co-Kultur erlaubt, für 3 weitere Tage zu entwickeln. Zu diesem Zeitpunkt werden Muskelfasern gebildet und können leicht durch das Vorhandensein mehrerer Kerne (blau) identifiziert werden. Synaptische Vesikelglykoprotein 2A (SV2) Immunostaining, ein präsynaptischer Marker zeigt das Vorhandensein von Synapsen, die zwischen den CG Neuronen Axone und den Muskelfasern etabliert sind (Abbildung 5).

Abbildung 1: Schema des Sezierprotokolls und des Ziliarganglien. (A) Diagramm des Isolations- und Kulturprotokolls. (B) Schema des Kükenciliary Ganglion Lokalisierung im hinteren Teil des Auges. Sehnerv, Ziliarganglion und Aderhautspalte werden durch Pfeile angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Zerlegung von E7 Küken Ziliarganglion. (A) Schneiden Sie die Oberseite des Eis mit einer Schere. (B) Entfernen Sie den Embryo mit einem Löffel aus dem Ei und legen Sie ihn in eine Sezierform Petrischale mit eiskaltem HBSS. (C) Trennen Sie den Kopf vom Körper, indem Sie im Nackenbereich schneiden. (D) Fixieren Sie den Kopf des Embryos im Schnabel und halten Sie mit Forcep Nr. 5. (E) Entfernen Sie das Auge durch sanfte Rotation mit Forcep Nr. 55. (F) Hintere Sicht auf das Auge. Pfeile zeigen die Lokalisation des Sehnervs, der Aderhautspalte und des Ziliarganglienans an. (G) Sezieren Sie das Ziliarganglion. (H) Seziertes Ziliarganglion. Überschüssiges Gewebe sollte entfernt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Entwicklung von Ziliarganglionneuronen in vitro. Phasenkontrastbilder von CG-Neuronen bei DIV 1, 3, 8 und 15. Da CG-Neuronen plattiert werden, initiieren sie sofort das Neuritenwachstum. Bei DIV 15 ist das axonale Netzwerk sehr dicht und in diesem Stadium werden Neuriten vollständig in Dendriten und Axone unterschieden. Phasenkontrastbilder wurden mit einem konfokalen Mikroskop mit einem Plan-Apochromat 20x ph2 Objektiv aufgenommen. Maßstabsleiste: 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Immunzytochemie von CG-Neuronen bei DIV 8. CG-Neuronen zeigen nach 8 Tagen in vitro ein gut etabliertes neuronales Netzwerk. Nuklei wurden mit DAPI (blau) und Axone mit b-III Tubulin (rot) gefärbt. Fluoreszenzbilder wurden mit einem konfokalen Mikroskop mit einem Plan-Apochromat 20x Objektiv aufgenommen. Maßstabsleiste: 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
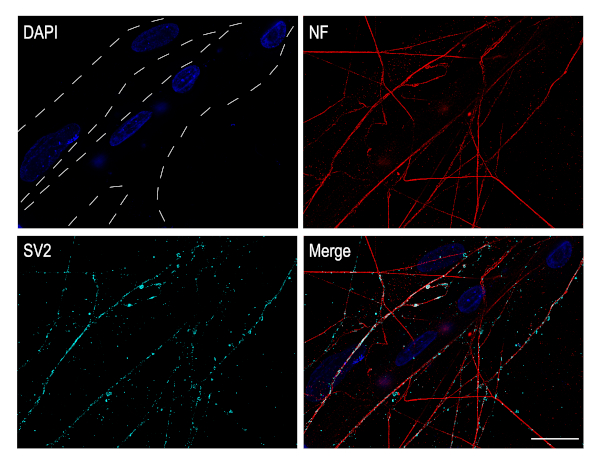
Abbildung 5: Kultivierte CG-Neuronen etablieren Synapsen mit Muskelfasern. Immunzytochemie Bilder von CG Neuronen-Pectoral Muskel-Kokulturen. Muskelfasern, die durch gestrichelte Linien identifiziert werden, zeigen mehrere Kerne, die mit DAPI (blau) gefärbt wurden. Axone wurden gegen Neurofilament (rot) und synaptische Vesikel gegen SV2 (Cyan) gekennzeichnet. Die Bilder wurden mit einem konfokalen Mikroskop mit einem Plan-Apochromat 63x Ölobjektiv aufgenommen. Maßstabsleiste: 20 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Protokoll haben wir gezeigt, wie man CG-Neuronen vorbereitet und kultiviert. Die Identifizierung und Zerlegung des Ziliarganglien kann für unerfahrene Anwender schwierig sein. Daher präsentieren wir ein detailliertes und schrittweises Verfahren, um E7-Küken-Ziliarganglien effizient zu sezieren, das Gewebe zu dissoziieren und neuronale Kulturen vorzubereiten, die mindestens 15 Tage lang aufrechterhalten werden können. Die mit diesem Protokoll erhaltenen Ziliarganglienneuronen eignen sich auch für die Co-Kultur mit Muskelzellen.
Ziliäre Ganglien in verschiedenen Entwicklungsstadien der embryonalen Entwicklung von Küken können je nach Zweck der Studie als Zellmodell verwendet werden. Für Kulturen von CG-Neuronen wird jedoch vermutet, dass sie zwischen den embryonalen Tagen 7 und 818vom Kükenembryon isoliert werden. Im embryonalen Stadium E8 haben CG-Neuronen noch keine neuronalen Todesprozesse durchlaufen und die Anzahl der nicht-neuronalen Zellen wird mit neuronalen Zellen vergleichsweise reduziert18. Dies wird in Kombination mit einem strengen Sezierverfahren und sehr gut gereinigten Ganglien zu einer hochreinen Kultur von Ziliarganglien-Neuronen beitragen, mit wenig Kontamination durch nicht-neuronale Zellen, wie Fibroblasten oder Gliazellen.
Während der Isolierung von CG-Neuronen ist einer der kritischen Punkte die Identifizierung und Reinigung des CG. Die Zerlegung einer so kleinen Struktur, wie das Ziliarganglion, kann schwierig sein, wenn man die Lokalisierung, die Fähigkeit, das Ganglion sowie die Größe des Ganglien selbst zu identifizieren. Es ist normal, dass die Ganglien während der Zerlegung an den Zangen befestigt werden. Hochwertige Sezierinstrumente sind sehr wichtig für eine erfolgreiche Sezierung und minimieren die Befestigung der Ganglien an den Zangen. Die Reinigung des GC ist wichtig, um eine Kontamination mit nicht-neuronalen Zellen zu verhindern. Es ist notwendig, etwa 70 Ganglien zu isolieren, um eine zelluläre Dichte von 1x106 Zellen/ml zu erhalten, im Gegensatz zu anderen neuronalen Geweben des peripheren Nervensystems, die eine 5-15x größere Anzahl von Ganglienhaben 3.
In der Kultur verringert die Zugabe von 5'-FDU zum gesamten Medium die Kontamination der GC-Kultur mit nicht-neuronalen Zellen. 5'-FDU ist eine anti-mitotische Verbindung, die die Zellproliferation hemmt, nämlich die Proliferation von Gliazellen und Fibroblasten. Die Konzentration von 5'-FDU, die dem Medium zugesetzt wird, reicht aus, um den Zellzyklus in der S-Phase zu stoppen, ist aber nicht schädlich für die normale Entwicklung der CG-Neuronen3,19,20. Die Behandlungszeit mit 5'-FDU kann eingestellt werden. Da jedoch CG-Neuronen in kurzer Zeit ein dichtes axonales Netzwerk aufbauen, sollte 5'-FDU bereits zum Zeitpunkt der Beschichtung zur Kultur hinzugefügt werden.
Eine der Haupteinschränkungen dieses Modells ist, dass es nicht repräsentativ für die normale Entwicklung von CG-Neuronen unter physiologischen Bedingungen ist. In ovo sterben etwa die Hälfte der CG-Neuronen zwischen dem8. und14. Tag der Entwicklung von Kükenembryonen. In der Kultur gibt es keine Abnahme der Anzahl der CG-Neuronen, wenn das Medium mit neurotrophen Faktoren ergänzt wird, die sein Überleben erlauben1,6,14.
Die neuronale Population, die aus der Zerlegung des Kükenziliarganglien gewonnen wird, ist eine homogene Population von cholinergen Neuronen, die zum autonomen Nervensystem gehören. Es sollte beachtet werden, dass die Expression von Neurotransmittern in der Aderhautpopulation des CG zielgesteuert ist, was je nach Art des Muskels, der in der Co-Kultur verwendet wird, behindert werden könnte24. Wenn das Ziel der Studie mit der genetischen Identität oder dem Subtyp des motorischen Neurons selbst zusammenhängt, dann sind CG-Neuronen möglicherweise nicht das am besten geeignete neuronale Modell. Auch die Spezifität der motorischen Neuronen in der Innervation von Muskelfasern kann nicht erreicht werden, wenn CG Neuron Kokulturen verwendet werden, da in diesem Fall die Muskelfasern innerviert25multipliziert werden können. Jedoch, Diese neuronale Kultur hat mehrere Vorteile, es erfordert nur grundlegende Ausrüstung, um die Eier zu pflegen und zu bebrüten, es ist ein einigermaßen kostengünstiges Verfahren und, was noch wichtiger ist, bietet ein ausgezeichnetes Modell für die Untersuchung von neuromuskulären Synapsen1, da CG Neuronen Neurotransmission Mechanismen sind sehr ähnlich denen, die in Spinalmotorneuronen auftreten. Die Zellmodelle, die zuvor für diese Art von Studien verwendet wurden, waren sensorische Neuronen aus dem Rückenmark12,21,22,23. Diese Kokulturen setzten sich jedoch aus einer heterogenen Population von Neuronen zusammen, nicht alle cholinergen und somit nur ein kleiner Teil der Neuronen in der Lage, funktionelle Kontakte mit den Muskelzellen zu knüpfen1. Neben der in dieser Arbeit nachgewiesenen Entwicklungsanalyse (Immunzytochemie) können weitere Assays in CG-Kulturen wie Elektrophysiologie und neuronales Überleben durchgeführt werden.
Basierend auf diesem Protokoll können zusätzliche wissenschaftliche Fragen angegangen werden, zum Beispiel, wie subzelluläre Lokalisierung bestimmter mRNAs und Proteine die Synapsenbildung und -funktion regulieren. Darüber hinaus können Nervenmuskel-Kokulturen leicht etabliert werden und weiter verwendet werden, um neuromuskuläre Erkrankungen zu studieren, wenn die Ort der Verletzung die neuromuskuläre Kreuzung ist. Neuromuskuläre Erkrankungen sind heterogen in der Natur in dem Sinne, dass die Dysfunktion mit dem Muskel selbst, den peripheren Nerven oder den neuromuskulären Knoten verbunden sein könnte26. So wäre es durch diese Kokulturen möglich, die neuromuskulären Kreuzungsveränderungen zu untersuchen, die letztlich der Entwicklung und dem Fortschreiten neuromuskulärer Erkrankungen zugrunde liegen. Eine weitere interessante Möglichkeit wäre, dieses Protokoll an das Maus-Trigeminussystem anzupassen. Diese Neuronen sind leicht zugänglich, und ihr Entwicklungsmuster ist bekannt27. Da Mäuse für genetische Manipulationen geeignet sind und das Trigeminussystem durch die topographische Kartenbildung gut charakterisiert ist, ergeben sich neue Möglichkeiten, indem ein trigeminales Protokoll zur Untersuchung der neuronalen Entwicklung verwendet wird.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Danksagungen
Diese Arbeiten wurden aus dem Europäischen Fonds für regionale Entwicklung (EFRE) im Rahmen des regionalen operationellen Programms Centro 2020 im Rahmen der Projekte CENTRO-01-0145-FEDER-000008:BrainHealth 2020, CENTRO2020 CENTRO-01-0145-FEDER-000003:pAGE, finanziert. CENTRO-01-0246-FEDER-00018:MEDISIS, und über das COMPETE 2020 - Operationelles Programm für Wettbewerbsfähigkeit und Internationalisierung und portugiesische nationale Mittel über FCT – Fundaéo para a Ciéncia e a Tecnologia, I.P., im Rahmen der Projekte UIDB/04539/2020, UIDB/04501/2020, POCI-01-0145-FEDER-022122:PPBI, PTDC/SAU-NEU/104100/2008, und die Einzelzuschüsse SFRH/BD/141092/201 8 (M.D.), DL57/2016/CP1448/CT0009 (R.O.C.), SFRH/BD/77789/2011 (J.R.P.) und von Marie Curie Actions - IRG, 7. Rahmenprogramm.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2’-deoxiuridina (5'-FDU) | Merck (Sigma Aldrich) | F0503 | |
| Alexa Fluor 568-conjugated goat anti-chicken antibody | Thermo Fisher Scientific | A11041 | |
| Alexa Fluor 568-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A11031 | |
| Alexa Fluor 647-conjugated goat anti-mouse antibody | Thermo Fisher Scientific | A21235 | |
| B27 supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Chicken monoclonal neurofilament M | Merck (Sigma Aldrich) | AB5735 | |
| D-(+)-Glucose monohydrate | VWR | 24371.297 | |
| Fetal Bovine Serum (FBS), qualified, Brazil | Invitrogen (Gibco) | 10270-106 | |
| HEPES, fine white crystals, for molecular biology | Fisher Scientific | 10397023 | |
| Horse Serum, heat inactivated, New Zealand origin | Invitrogen (Gibco) | 26050-070 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| Mouse laminin I | Cultrex (R&D systems) | 3400-010-02 | |
| Mouse monoclonal b-III tubulin | Merck (Sigma Aldrich) | T8578 | |
| Mouse monoclonal SV2 | DSHB | AB2315387 | |
| Multidishes, cell culture treated, BioLite, MW24 (50x) | Thermo Fisher Scientific | 11874235 | |
| Neurobasal medium without glutamine | Invitrogen (Gibco) | 21103-049 | |
| Penicillin/streptomycin (5,000 U/mL) | Invitrogen (Gibco) | 15070-063 | |
| Phenol red, bioreagent, suitable for cell culture | Merck (Sigma Aldrich) | P3532 | |
| Poly-D-Lysine | Merck (Sigma Aldrich) | P7886 | |
| Potassium chloride | Fluka (Honeywell Reaarch Chemicals) | 31248-1KG | |
| Potassium di-hydrogen phosphate (KH2PO4) for analysis, ACS | Panreac Applichem | 131509-1000 | |
| Prolong Gold Antifade mounting medium with DAPI | Invitrogen (Gibco) | P36935 | |
| Puradisc FP 30mm Syringe Filter, Cellulose Acetate, 0.2µm, sterile 50/pk | Fisher Scientific | 10462200 | |
| Recombinant human ciliary neurotrophic factor (CNTF) | Peprotech | 450-13 | |
| Recombinant human glial cell-derived neurotrophic factor (GDNF) | Peprotech | 450-10 | |
| Sodium chloride for analysis, ACS, ISO | Panreac Applichem | 131659-1000 | |
| Sodium dihydrogen phosphate 2-hydrate (Na2HPO4·2H2O), pure, pharma grade | Panreac Applichem | 141677-1000 | |
| Sodium Pyruvate 100 mM (100x) | Thermo Fisher | 11360039 | |
| Syringe without needle, 10 mL | Thermo Fisher | 11587292 | |
| Trypsin 1:250 powder | Invitrogen (Gibco) | 27250-018 |
Referenzen
- Betz, W. The Formation of Synapses between Chick Embryo Skeletal Muscle and Ciliary Ganglia Grown in vitro. Journal of Physiology. 254, 63-73 (1976).
- Fischbach, G. D. Synapse Formation between Dissociated Nerve and Muscle Cells in Low Density Cell Cultures. Developmental Biology. 28, 407-429 (1972).
- Bernstein, B. W. Dissection and Culturing of Chick Ciliary Ganglion Neurons: A System well Suited to Synaptic Study. Methods in Cell Biology. 71, 37-50 (2003).
- Marwitt, R., Pilar, G., Weakly, J. N. Characterization of Two Ganglion Cell Populations in Avian Ciliary Ganglia. Brain Research. 25, 317-334 (1971).
- Role, L. W., Fishbach, G. D. Changes in the Number of Chick Ciliary Ganglion. Neuron Processes with Time in Cell Culture. Journal of Cell Biology. 104, 363-370 (1987).
- Landmesser, L., Pilar, G. Synaptic Transmission and Cell Death During Normal Ganglionic Development. Journal of Physiology. , 737-749 (1974).
- Koszinowski, S., et al. Bid Expression Network Controls Neuronal Cell Fate During Avian Ciliary Ganglion Development. Frontiers in Physiology. 9, 1-10 (2018).
- Landmesser, L., Pilar, G. Synapse Formation During Embryogenesis on Ganglion Cells Lacking a Periphery. Journal of Physiology. 241, 715-736 (1974).
- Nishi, R., Berg, D. K. Dissociated Ciliary Ganglion Neurons in vitro: Survival and Synapse Formation. Proceedings of the National Academy of Sciences of the United States of America. 74, 5171-5175 (1977).
- Nishi, R., Berg, D. K. Two Components from Eye Tissue that Differentially Stimulate the Growth and Development of Ciliary Ganglion Neurons in Cell Culture. Journal of Neuroscience. 1, 505-513 (1981).
- Pilar, G., Vaughan, P. C. Electrophysiological Investigations of the Pigeon iris Neuromuscular Junctions. Comparative Biochemistry and Physiology B. 29, 51-72 (1969).
- Landmesser, L., Pilar, G. Selective Reinnervation of Two Cell Populations in the Adult Pigeon Ciliary Ganglion. Journal of Physiology. , 203-216 (1970).
- Pinto, M. J., Almeida, R. D. Puzzling Out Presynaptic Differentiation. Journal of Neurochemistry. 139, 921-942 (2016).
- Dryer, S. E. Functional Development of the Parasympathetic Neurons of the Avian Ciliary Ganglion: A Classic Model System for the Study of Neuronal Differentiation and Development. Progress in Neurobiology. 43, 281-322 (1994).
- Egawa, R., Yawo, H. Analysis of Neuro-Neuronal Synapses using Embryonic Chick Ciliary Ganglion via Single-Axon Tracing, Electrophysiology, and Optogenetic Techniques. Current Protocols in Neuroscience. 87, 1-22 (2019).
- Pinto, M. J., Pedro, J. R., Costa, R. O., Almeida, R. D. Visualizing K48 Ubiquitination during Presynaptic Formation by Ubiquitination-Induced Fluorescence Complementation (UiFC). Frontiers in Molecular Neuroscience. 9, 1-19 (2016).
- Martins, L. F., et al. Mesenchymal Stem Cells Secretome-Induced Axonal Outgrowth is Mediated by BDNF. Scientific Reports. 7, 1-13 (2017).
- Nishi, R. Autonomic and Sensory Neuron. Methods in Cell Biology. , 249-263 (1996).
- Rojo, J. M., De Ojeda, G., Portolés, P. Inhibitory Mechanisms of 5-fluorodeoxyuridine on Mitogen-induced Blastogenesis of Lymphocytes. International Journal of Immunopharmacology. 6, 61-65 (1984).
- Hui, C. W., Zhang, Y., Herrup, K. Non-Neuronal Cells are Required to Mediate the Effects of Neuroinflammation: Results from a Neuron-Enriched Culture System. PLoS One. 11, 1-17 (2016).
- Crain, S. M., Alfei, L., Peterson, E. R. Neuromuscular Transmission in Cultures of Adult Human and Rodent Skeletal Muscle After Innervation in vitro by Fetal Rodent Spinal Cord. Journal of Neurobiology. 1, 471-489 (1970).
- Kano, M., Shimada, Y. Innervation and Acetylcholine Sensitivity of Skeletal Muscle Cells Differentiated in vitro from Chick Embryo. Journal of Cellular Physiology. 78, 233-242 (1971).
- Robbins, N., Yonezawa, T. Developing Neuromuscular Juctions: First Sings of Chemical Transmission during Formation in Tissue Culture. Science. 80, 395-398 (1971).
- Squire, L. R. . Encyclopedia of Neuroscience. , (2010).
- Hooisma, J., Slaaf, D. W., Meeter, E., Stevens, W. F. The Innervation of Chick Striated Muscle Fibers by the Chick Ciliary Ganglion in Tissue Culture. Brain Research. 85, 79-85 (1975).
- Morrison, B. M. Neuromuscular Diseases. Seminars in Neurology. , 409-418 (2016).
- Davies, A. M. The Trigeminal System: An Advantageous Experimental Model for Studying Neuronal Development. Development. 103, 175-183 (1988).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten