Method Article
Bir Seride Üç Yerleşik Teknik Uygulayarak Escherichia coli'de Flagella Odaklı Hareketliliği Araştırmak
Bu Makalede
Özet
Birçok bakteri, çevrelerinde gezinmek ve hem bireysel hem de kolektif olarak elverişli çevreyi kolonileştirmek için flagella tahrikli hareketliliği kullanır. Burada, yüzmeye ve kaynayan hareketliliklere katkıda bulunan bileşenleri / yolları tanımlamak için hareketliliği bir seçim aracı olarak kullanan üç yerleşik yöntemin kullanılması gösterilmiştir.
Özet
Hareketlilik birçok bakteri türünün hayatta kalması ve başarısı için çok önemlidir. Sinyal yollarını anlamak, flagellar parçaların işlevini ve montajını aydınlatmak ve hareket kalıplarını incelemek ve anlamak için hareketlilik yararlanmak için birçok metodoloji vardır. Burada bu metodolojilerden üçünün bir kombinasyonunu gösteriyoruz. Yumuşak agardaki hareketlilik en eskidir ve hareketliliğin ikinci bir mutasyonla geri yüklendiği hareketlilik bozulmuş suşlarda fonksiyon kazancı baskılayıcı mutasyonlarını izole etmek için güçlü bir seçim sunar. İlk olarak flagellar motorun döner doğasını göstermek için kullanılan hücre bağlama tekniği, sinyal efektörlerinin motor hızı üzerindeki etkisini ve dönme yönünü değiştirme yeteneğini değerlendirmek için kullanılabilir. "Sınır geçişi" tahlilleri, yüzme bakterisinin topluca sürü olarak hareket etmeye geçiş için astarlanabileceği daha yenidir. Birlikte, bu protokoller hareketlilik makinelerinin bileşenlerini tanımlamak ve yüzme ve kaynaşma farklı fasetlerindeki rollerini karakterize etmek için sistematik ve güçlü bir yaklaşımı temsil eder. Diğer bakteri türlerinde hareketliliği incelemek için kolayca uyarlanabilirler.
Giriş
Bakteriler ekolojik nişlerinde hareket ve dağılım için birçok uzantılar istihdam eder1. Flagella tahrikli hareketlilik bunların en hızlısıdır, çevre sinyallerine yanıt olarak elverişli yerellerin kolonileşmesini teşvik eder ve bazı türlerin patojenik yeteneğine önemli ölçüde katkıda bulunan2,3. Flagellated bakteriler toplu sıvı içinde ayrı ayrı yüzebilir veya yarı katı bir yüzey üzerinde kolektif olarak sürünebilir4. Hücre dışıflagella, dönüş1, 2 ,4,5,6,7,8'e neden olan tork oluşturmak için iyongradyanlarınıngücünden yararlanan membrana gömülü döner motorlara takılır ve tahrik edilir. Motorları sabit tork9'daçalışan E. coli'demotor çıkışı, dönme hızı ve rotorun saat yönünün tersine (CCW) ve saat yönünde (CW) yönler arasında değiştirilmesi açısından kategorize edilebilir. CCW dönüşü, hücreyi ileriye doğru iten tutarlı bir flagellar demetin oluşumunu teşvik ederken (çalıştır), dönme yönünde (CW) geçici bir anahtar, demetin kısmen veya tamamen10'usökmesine ve hücrenin yüzme yönünü yeniden yönlendirmesine (yuvarlanma) neden olur. E. coli genellikle bir saniye koşar ve saniyenin onda biri için yuvarlanır. Rotorun veya 'takla önyargısının' anahtarlama frekansı kemotaksi sinyal sistemi tarafından kontrol edilir, burada transmembran chemoreceptors harici kimyasal sinyalleri algılar ve çekicilere yanıt olarak çalıştırmaları uzatmak veya toksik kimyasallara yanıt olarak bastırmak için fosforelay ile flagellar motora iletir11,12. Yüzme hareketliliği% 0.3 yumuşak agarda test edilir.
Kaynama sırasında bakteriler, bakteri paketlerinin sürekli dönen bir hareketle aktığı yoğun bir kolektif olarak yarı katı bir yüzeyde gezinirken2,13,14,15. E. coli sürüleri, dökme sıvıda yüzen hücreler üzerinde değiştirilmiş kemosentezör fizyoloji (daha düşük yuvarlanma önyargısı), daha yüksek hızlar ve antimikrobiyallere karşı daha yüksek tolerans sergiler16,17. Swarmers, yüzey aktif madde üretimi, hiperflagellasyon ve hücre uzaması2dahil olmak üzere harekete yardımcı olan çok sayıda stratejinin dağıtımında değişir. Swarming bakterilere hem ekolojik hem de klinik ortamlarda rekabet avantajı sunar18,19,20. Kaynayan bakterilerin iki kategorisi vardır: sadece% 0.5-0.8 agar ile katılaşmış medyaya sürülebilen ılıman sürüler ve daha yüksek agar konsantrasyonlarında gezinebilen sağlam sürüler21.
Yüzme hareketliliğini ve düzenlemesini sorgulamak için çeşitli tahliller mevcuttur. Mutasyonlar veya çevresel koşullar nedeniyle bozulduğunda, hareketliliğin kendisi fonksiyon kazancı baskılayıcı mutasyonları tanımlamak için güçlü bir seçim sunar. Bu bastırıcılar, orijinal mutasyonun gerçek geri dönüşleri veya ikinci bir mutasyonun işlevselliği geri yüklediği sözde geri dönüşler olabilir. Bu tür mutantlar tüm genom dizilimi (WGS) ile tanımlanabilir. Tarafsız baskılayıcı seçimine bir alternatif, önyargılı hedefli bir mutajensis stratejisidir (örneğin, PCR mutajensis). Bu metodolojiler genellikle hareketlilik aparatının işlevine veya çevre düzenlemesine ışık tutar. Amaç motor fonksiyonu incelemekse, yumuşak agarda ölçülen vahşi tip hareketliliğin restorasyonu mutlaka vahşi tip motor çıkışının restorasyonunu göstermeyebilir. Hücrelerin tek bir flagellum tarafından cam yüzeye tutturulduğu ve hücre gövdesinin dönüşünün daha sonra izlendiği hücre bağlama tahlili, motor davranışı değerlendirmek için tercih edilen ilk test olabilir. Motor özelliklerini izlemek için artık daha sofistike metodolojiler mevcut olsa da, hareket analizi için gerekli yüksek hızlı kamera kurulumu ve yazılım paketlerinin uygulanması yaygın kullanımlarını sınırlar22,23,24,25. Hücre bağlama tahlili sadece flagellanın yamumasını gerektirir, bu da kısa filamentlerin cam bir slayda bağlanmasına izin verir ve ardından hücre gövdesinin dönüşünü videoya ekler. Kaydedilen motor hızları, hücre gövdesinin flagellum üzerinde uyguladığı yüksek yük nedeniyle bu testte düşük olsa da, bu test yine de kemotaktik yanıtlar26 , 27,28,29hakkında değerli içgörülere katkıda bulunmuştur ve aşağıda tartışıldığı gibi geçerli bir araştırma aracı olmaya devam etmektedir.
Kaynayan hareketlilik araştırmacılar için farklı zorluklar doğurur. fonksiyon kazancı bastırıcıların seçimi sadece bol miktarda yüzey aktif madde üreten ve kolayca sürü13. E. coli gibi yüzey aktif olmayan üreticiler, agar seçimi, medya bileşimi ve ortamın nemi ile ilgili titizdir2,13,14,21. Kaynama koşulları belirlendikten sonra, sınır geçişi tahlil17, bir sürünün yeni / zorlu koşullarda gezinme yeteneğini sorgulamak için yararlı bir metodolojidir. Aşağıda sunulan protokoller E. coliile ilgili olsa da, diğer türlerde uygulama için kolayca uyarlanabilirler.
Protokol
1. Hareketlilik eksikliği olan suşlarda baskılayıcı mutantların izolasyonu
NOT: Hareketlilik kusurunun genel doğasını tanımlamak için bu yöntemi geniş bir 'catch-all' olarak kullanın.
- Yumuşak-agar plaka hazırlığı
NOT: Yumuşak-agar, motility- veya yüzme-agar olarak da adlandırılır, düşük yüzdeli bir agardır (~0.2-0.35% w / v), uzun zamandır kemotaksi31,32'yi test etmek için kullanılır.- 2 L yuvarlak alt şişeye 3 g bacto-agar (%0,3 w/v) ve 20 g LB ekleyin. Şişeye 1 L DDH2O (çift damıtılmış su) ekleyin ve bir karıştırma çubuğu ve manyetik karıştırma plakası kullanarak süspansiyonu eşit şekilde karıştırın.
- 121 °C'de 20 dakika otoklav.
- Yukarıdaki çubuk/ plakayı kullanarak hafif ajitasyonla soğumaya bırakın. Sıcaklık yaklaşık 50 ° C'ye ulaştığında, steril Petri kaplarına (100 mm x 15 mm) 25 mL dökün ve erimiş agarın 16 saat içinde kullanılmak üzere en az 1 saat boyunca kapakla ayarlanabilmesini sağlar.
- Baskılayıcı mutantların kültür hazırlığı, aşılanması ve izolasyonu
NOT: Yumuşak agar ile katılaşmış besin zengini medyanın merkezinde aşılanan E. coli, besinleri yerel olarak tüketerek takip ettikleri bir besin gradyanı oluşturur. Dışa doğru ilerledikçe, bakterilerin yanıt verdiği belirli kemoattantlarla ilişkili tanımlanmış 'halkalar' ortaya çıkar (Şekil 1A). Kemotaksi sistemindeki veya flagella motorunun yapısal bileşenlerindeki kusurlar bu testte performansı tehlikeye atabilir. Genellikle, hareketlilik avantajı olan mutantlar tarama sırasında ortaya çıkar ve halkanın çevresi boyunca tek veya birden fazla noktadan, 'alevlendikleri' yerden ortaya çıktığı görülebilir (Şekil 1C). Yüzme cephesinin en dış kenarının, kavunlanmamış bakire yumuşak agar'a karşı kolayca zıt olduğunu fark edecektir.- Yatay sallama (220 r.p.m.) ile 30 °C'de 5 mL Lennox Suyunda (LB; 10 g/L tripto, 5 g/L maya özü ve 5 g/L NaCl, Malzeme Masası)istenen hareketlilik eksikliği olan suşun geceleme kültürlerini büyütün. Ertesi gün, taze LB'de alt kültür (1:100 seyreltme), üstel faza aynı koşullar altında büyür(OD 600 / 0.6).
- Kültürün 6 μL'sini pipet kullanarak yumuşak bir agar plakasının (1.1) ortasına aşılayın, yüklü steril ucu içeriği hafifçe dışarı çıkarmak için ağar içine itin. 30 °C'ye aktarın ve kuluçkaya yatırın (Şekil 1B), hareketlilik 'parlamaları' belirgin olana kadar, aşılama noktasından veya hareketlilik halkalarının çevresinden, tipik olarak 24-36 saat(Şekil 1C)olarak yayılana kadar.
NOT: Hareketlilik tahlillerinde, karşılaştırma için mutant izolelerinin yanında vahşi tip bir suşu aşılar. Bu vahşi tip suş karakteristik eşmerkezli kemotaktik halkaları gösterecektir (Şekil 1A) ve plakayı 8-10 saat içinde dolduracaktır. - Hücreleri 'parlama' bölgesinden kaldırmak için steril bir tel halka kullanın ve tek kolonileri bir LB sert agar plakasına arındırmak için çizgi kullanın (LB yukarıdaki gibi hazırlanmış, 15 g/L bacto-agar ile katılaştırılmış).
- Steril bir tel halkası kullanarak çizgi plakasından tek kolonileri seçin ve 'saf' bir koloni izolesinin izolasyonu için tek koloniler için çizgi çizerek yeniden arındırın.
- Bastırıcı mutantların onaylanması ve karakterizasyonu
- İzole bastırılmış mutantların hareketliliği geri yüklediğini onaylayın. Yumuşak agar plakaları (1.1) ve kültürleri, vahşi tip ve karşılaştırma için başlangıç 'hareketlilik eksikliği' suşu da dahil olmak üzere ilgi suşları (1.2.1'de olduğu gibi) için hazırlayın.
- Plakaları aşılayın (1.2.2'de olduğu gibi) ve 8-10 saat boyunca 30 °C'de kuluçkaya yatırın.
- En dıştaki halkanın çapını (dairenin kenarı) kaydedin ve hangi izolelerin hareketliliği önemli ölçüde geri yüklediğini belirlemek için karşılaştırın.
NOT: Plakaların deneyin zaman dilimi boyunca fotoğraf edilmesi önerilir. En iyi sonuçlar için, yüzme kolonisinin çapını ölçmek ve sömürgeleştirilmemiş agardan ayırt etmek için daha iyi aydınlatma için bir ışık kaynağının üzerine dijital kamera monte edildiği bir "ışık kovası" cihazı30kullanın. - Denek, WGS'ye gerektiği gibi izole edilerek, vahşi tip fonksiyonu geri getiren mutasyonları pozitif olarak tanımlamak için yeterli 'sıra kapsamı' sağlar.
2. Flagella motor davranışını hücre bağlama ile ölçme
NOT: Normal çalıştırma-takla davranışı (kemotaksi) tehlikeye atılmış gibi göründüğünde bu yöntemi kullanın.
-
Kültür hazırlama ve flagella makaslama
- Adım 1.2.1'de açıklandığı gibi, ilgi gerginliğinin üstel bir faz kültürünü hazırlayın.
- Pellet 10 mL hücre, 10 mL filtre sterilize Motility Buffer (MB) ile yeniden canlandırmadan önce 3 dakika boyunca 2.000 x g'da santrifüjleme ile hücre; 10 mM potasyum fosfat tamponu [0.0935 M K2HPO4, 0.0065 M KH2PO4, pH 7.0], 0.1 mM EDTA [pH 7.0], 10 mM NaCl, 75 mM KCl).
NOT: MB hareketliliğidestekler, ancak bakteri üremeyi desteklemez - Son peletin 1 mL MB olarak yeniden sünülene kadar 2.1.2 adımını iki kez daha yineleyin.
- Hücre süspansiyonu 1 mL şırıngaya aktarın ve sonuna 23G iğne takın. Aynı şırınga/iğne aparatını monte edin ve ikisini her iğne ucuna sıkıca sarılmış 6 inç polietilen boru (iç çapı 0,58 mm) ile birbirine takın.
- Hücre süspansiyonu bir şırıngandan diğerine 50x'e hafifçe geçirerek flagellayı kesin (kırılgandırlar ve kolayca kırılırlar) ve her 10 geçiş arasında 1 dakika duraklama olur.
- Yamulmuş hücreleri 3 dakika boyunca 2.000 x g'da santrifüj edin ve 500 μL MB'lık son hacimde yeniden biriktirin.
-
Slayt hazırlama ve hücre bağlama
- Çift taraflı bantla ayrılmış 3 inç x 1 inç x 1 mm cam mikroskop kaydırağı üzerine 18 mm x 18 mm kapak örtüsü istifleyerek bir hücre sabitleme odası hazırlayın (Şekil S1).
- Haznenin üstüne uygulayarak hazneyi %0,01 (w/v) polilizin çözeltisi ile yıkayın. Çözeltinin hazneden(Şekil S1)çiz çekilmesine yardımcı olmak için alt kenarı (kapak altlığı mikroskop kaydırağıyla yıkama) bir görev silecekine (kağıt mendil) eğin. Daha sonra oda sıcaklığında 10 dakika kuluçkaya yatırın.
- 2.2.2 adımında açıklandığı gibi 40 μL MB ile hazneyi üç kez yıkayın
- Odanın üstüne 40 μL yamluk hücre süspansiyonu ekleyin (yukarıda hazırlanmıştır) ve hücrelerin kapak kapağına takılmasını sağlamak için oda sıcaklığında 10 dakika kuluçkaya yaslayın.
- Eklenmemiş hücreleri çıkarmak için hazneyi 2.2.3'te olduğu gibi 40 μL MB ile hafifçe yıkayın.
-
Hücre dönüşü kaydı ve nicelleştirme
- Bağlı hücrelerle yüklenen mikroskop kaydırağı mikroskop aşamasına aktarın.
- Faz kontrastlı mikroskopi ve 100x hedefi kullanarak, popülasyonu yerinde sabitlenmiş hücreler için tarayın ve tek bir eksende döndürün, yani hücrenin odak içinde ve dışında hareket ettiği bir açıda sunmak yerine sabit bir noktada düzgün dönüşler (Video 1).
- Ticari bir mikroskop ve ilişkili kamera kullanın. İlişkili yazılımı açın, ilgi çekici hücrelerin odakta olduğundan emin olun ve hücre dönüşünü bir dakika (saniyede 10 kare veya daha yüksek) kaydetmek için video alımını tıklayın.
- Video oynatmadan, dakikadaki tam döndürme sayısını ve hücrenin yön değiştirme sayısını (anahtarlama sıklığı) ölçün.
NOT: Dönme hızları ve anahtarlama frekansı gözle ölçülemeyecek kadar hızlı olabilir, bu nedenle yavaş / ince oynatma sunan veya dönme modellerini ölçmek için otomatik bir yazılım sistemi benimseyen video yazılımı kullanılması önerilir33. Bir alternatif, daha hızlı bakterilerin dönüşünü yavaşlatmaya ve çözmeye yardımcı olmak veya düşük kare hızlarına sahip kameralar kullanımda olduğunda telafi etmek için metil selüloz (veya benzeri bir ajan) kullanarak MB'nin viskozitesini artırmak olacaktır. - İlgi popülasyonunun bir temsilini derlemek için biyolojik çoğaltmalarla 2.3.2 adımını yineleyin.
3. Sınır kapısında sürülerin hazırlanması
NOT: Bir mutasyonun veya durumun grup hareketliliği üzerindeki etkisini değerlendirmek için bu yöntemi kullanın. Swarm-agar, yüzdenin genellikle yumuşak agardan daha yüksek olduğu agarı ifade eder. Yumuşak agarda (%0.3), hücreler agarın içinde ayrı ayrı yüzer. Sürü agarında (%0,5 ve üzeri), hücreler yüzeyde bir grup olarak hareket eder. Sürü plakalarının burada ayrıntılı olarak kullanılması gerekirken, yüzme plakaları daha uzun raf ömrüne sahiptir ve birkaç gün kullanılabilir. Kişisel tercihimiz 1-2 gün içinde kullanmaktır.
-
Sürü agar hazırlanması
- 2 L yuvarlak alt şişeye 5 g Eiken agar (%0,5 w/v) ve 20 g LB ekleyin. Şişeye 1 L DDH2O ekleyin ve bir karıştırma çubuğu ve manyetik karıştırma plakası kullanarak süspansiyonu eşit şekilde karıştırın.
- 121 °C'de 20 dakika otoklav.
- Yukarıdaki gibi çubuğu / plakayı kullanarak hava kabarcıklarını önlemek için hafif ajitasyonla soğumaya bırakın. Yaklaşık 50 °C olduğunda, % 0,5'lik son konsantrasyon için filtre sterilize edilmiş glikoz ekleyin.
- Steril Petri kaplarına (100 mm x 15 mm) 25 mL dökün ve oda sıcaklığında en az 14 saat ve en fazla 20 saat ayarlayın. İleride kullanmak üzere saklamayın.
-
Sürü plakalarının aşılanması ve inkübasyonu
- Asgarın üzerine tespit larak orta üssel bir kültürün (1.2'de olduğu gibi hazırlanan) 6 μL'yi aşıla.
- Kapağı 5-10 dakika bekletin ve inoculum agar yüzeyine kuruduğu zaman değiştirin.
- 8 saat boyunca 30 °C'de kuluçkaya yatırın. Agarın kurumasına katkıda bulunacağı ve kaynamayı bozacağı için kapağı çıkararak sürü ilerlemesini inceleme cazibesinden kaçının.
NOT: Kuluçka süresi gerinim fenotipine bağlı olarak değişebilir. Bazı izole mutasyonlar kaynama yeteneğini engelleyebilir ve daha az agar yüzdesi veya daha uzun bir kuluçka süresi gerektirecektir.
-
Sınır geçişi tahlil plakalarının hazırlanması
NOT: Bu tahlil, plastik bir bölmenin (kenarlık) bir yerine iki odacık oluşturduğu modifiye edilmiş bir Petri kabı kullanır (Şekil 2A). Her oda diğer odadan bağımsız olarak hazırlanabilir ve ikisini 'bağlamadan' önce kaynama için farklı koşullar sunar. Deneysel tasarıma bağlı olarak, ilk oda (solda belirtilen) yüzme agarı (%0,3 w/v) veya sürü agar (%0,5 w/v) ile hazırlanabilir, burada bakteriler sınır boyunca sürü agar +/- gerekli herhangi bir takviye veya zorluk (örneğin, antibiyotikler) içeren sağ odaya göç edebilir. Her iki agar üzerindeki göç tipik olarak, orijinal aşılama noktasından en geniş bakteri kolonizasyonu çapı (kenardan kenara) kaydedilerek ölçülür/karşılaştırılır.- Gerekirse 1.1'de açıklandığı gibi yüzme agarı hazırlayın.
- 3.1'de açıklandığı gibi sürü agar hazırlayın.
- Çift bölmeli petri kabının (100 mm x 15 mm) sağ odasına, odalar arasındaki plastik bölücü ile aynı seviyede olan, ancak sola taşmayan noktaya kadar ~30 mL sürü agar (gerekirse istenen takviye ile) dökün (Şekil 2B).
- Agar sertleştikten sonra, sol odayı ~ 30 mL yüzme veya sürü agar ile doldurun, yine plastik bölme ile temas noktasına (Şekil 2C). Ayarlmadan önce, iki tarafı bölmenin tüm uzunluğunu kapsayan ~1 mm yüksekliğinde bir agar köprüsüne bağlamak için agar'ı yavaşça sınır boyunca sürüklemek için steril bir pipet ucu kullanın (Şekil 2D).
- Plakanın oda sıcaklığında (3,1) kurumasını bekleyin.
NOT: Köprü oluşturmanın alternatif bir yöntemi, sol oda agarının kurumasına ve daha sonra iki oda arasında köprü oluşturmak için plastik bölücü boyunca ~100 μL erimiş sürü agarının yavaşça pipetlemesine izin vermektir (3,4). Yüzme (1.2.2) veya sürü (3.2) agar için yukarıda ayrıntılı olarak açıklanmış olarak, 12-16 saat boyunca 30 ° C'de kuluçkaya yatırmadan önce veya sürüler ilgi gerginlikleri arasında karşılaştırmalara izin vermek için sağ oda üzerinde yeterli ilerleme sağlayana kadar sol odadaki plakaları aşılayın.
Sonuçlar
Hareketlilik sinyal molekülü c-di-GMP'nin yüksek seviyeleri tarafından bozulan bir E. coli suşundaki sözde geri dönüşlerin izolasyonu, laboratuvarımızdan yapılan son çalışmalarda ayrıntılı olarak açıklanmıştır34. Bu suş (JP1442) iki mutasyon barındırır:Δ yhjH ve ΔycgR. YhjH, E. coli'dec-di-GMP'yi düşüren en aktif fosfodiesterazdır. YhjH'nin yokluğu c-di-GMP seviyelerinin yükselmesine ve hareketliliğin inhibisyona yol açar. YcgR bir c-di-GMP efektörüdür. C-di-GMP ile karmaşık olan YcgR, önce CCW motor dönüşünü teşvik etmek ve daha sonra motor hızını azaltmak için flagellar rotora bağlanır. Hücre bağlama ve boncuk tahlilleri, çift mutantta motor davranışın normale döndüğünü gösterdi, ancak yumuşak agardaki hareketlilik34. Bu nedenle, çift mutanttaki sözde geri dönüşlü fişekleri izole etmek için protokolün1. WGS (HiSeq 4000 platformu, PE 2 x 150 kurulum34)tarafından rssB'yeeşlenen mutasyonların çoğu, normalde ClpXP proteazını bozulma için σS'yi hedeflemeye yönlendiren bir yanıt düzenleyici / adaptör proteini kodlar34. Vahşi tipe yakın hareketlilik gösteren bu revertantlardan biri (AW405, Şekil 1A,D'yikarşılaştırın), protokol bölümünün 2. ve 3.
Protokol bölümünün 2. ΔyhjH, beklendiği gibi, dakikada daha az dönüş ve vahşi tipe kıyasla daha düşük bir CW önyargısı gösterdi (Şekil 3). Hem ΔyhjH ΔycgR çift mutant hem de bastırıcısı, önceki çalışmada yukarıdaki girişte ayrıntılı olarak açıklanan daha yüksek çözünürlüklü 'boncuk' testini kullanarak önceki bir analiz tarafından desteklenen gözlemler olan vahşi tipe benzer motor davranış gösterdi34.
Protokol bölümünün 3. Sonuçlar, her iki türün de aynı zamanda sınıra ulaştığını göstermektedir (veriler gösterilmez), aynı aşılama noktasından benzer kaynama oranlarını gösterir. Bununla birlikte, sürünün sağa (antibiyotik) odasının çaprazlanması marjinaldi, ancak vahşi tip için 20 μg / mL kanamycin'deki bastırıcıdan sürekli olarak daha büyüktü (Şekil 4). İki suş arasındaki fark 40 μg/mL kanamycin'de daha belirgindi. Birlikte, bu veriler rssB'de yumuşak agar plakalarında hareketliliği geri getiren mutasyonların (Şekil 1D), kaynama sırasında baskılayıcı suşun antibiyotik direncini olumsuz yönde etkilediğini göstermektedir (Şekil 4).
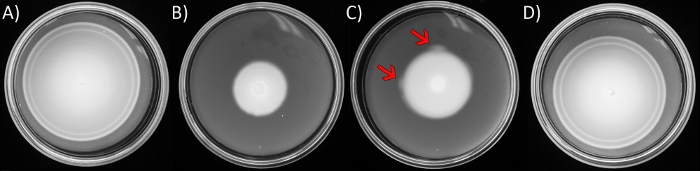
Şekil 1: Yumuşak-agar hareketlilik tahlilleri ve bastırıcı fişeklerin ortaya çıkması.
Plakalar LB içerir 0.3 % w /v agar ile katılaştırılmış. E. coli suşları her plakanın ortasına aşılandı ve 16 h. ( A ) Vahşi tip E. coli (AW405) için inkübe edilen C hariç, 8 saat boyunca 30 °C'de inkübe edildi. (B) Hareketlilik eksikliği varyantı ∆yhjH ∆ycgR (JP1442). (C) B'de olduğu gibi, daha uzun kuluçka süreleri hariç. Oklar, genişleyen yüzme kolonisinin çevre halkaslarında ortaya çıkan daha hızlı hareket eden 'işaret fişeklerine' işaret eder. (D) C'deki bir parlamadan yalıtılmış bir bastırıcı.
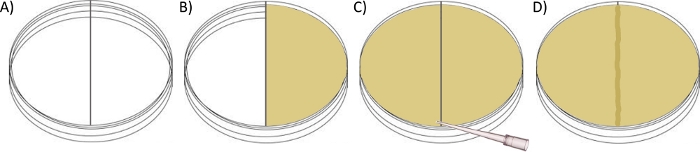
Şekil 2: Sınır geçiş plakası tahlili kurmak için şematik.
(A) Plastik bölücü ile seviyeye kadar bölünmüş bir petri kabının sağ odasına ~30 mL sürü agar (istenen antibiyotikle) dökün ve kapak kapalı olarak ayarlanın. (B) Sol odayı ~ 30 mL yüzme veya sürü agar ile plastik bölücünün üst kısmıyla temas noktasına kadar doldurun. (C) Erimiş sürü agarını sınır boyunca hafifçe sürüklemek için steril bir pipet ucu kullanın, böylece iki tarafı ~1 mm yüksekliğinde bir agar köprüsü ile bağlayın ve kapağı kapalı olarak ayarlayın. (D) Sol odayı istenen suşla aşılamadan ve 30 °C'de kuluçkaya yatırmadan önce plakanın gece boyunca oda sıcaklığında daha fazla kurumasını bekleyin.
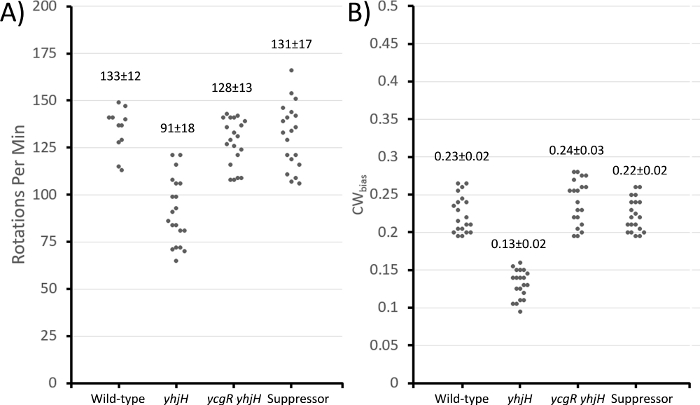
Şekil 3: Hücre bağlama tekniği ile ölçülen çeşitli suşların motor özellikleri.
Vahşi tip (AW405), ∆yhjH (VN133), ∆ycgR ∆yhjH (JP1442) ve bastırıcısı (JP1836) bağlamadan önce LB'de 30 °C ila orta üssel fazda yetiştirildi. (A) Dakikadaki dönüşler (tamamlanan 360° dönüşler) ve (B) CWsapmaları (zaman motorlarının fraksiyonu CW yönünde döner). Ortalamanın standart sapması (±). Her suşta 60 sn boyunca 20 bağlı hücre gözlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
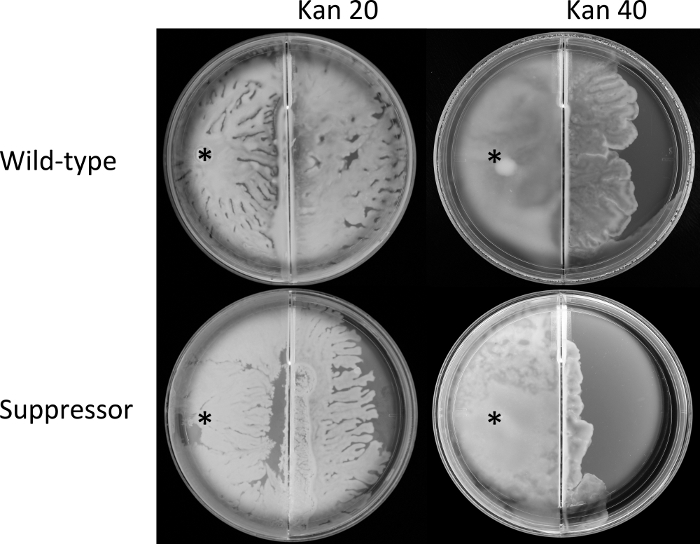
Şekil 4: Sınır geçiş tahlilleri.
Vahşi tip E. coli (AW405) ve bastırıcı mutant (JP1836) orta üstel faz kültürleri, sürü ortamı içeren bölünmüş plakanın sol bölmesinde belirtilen konumda (*) aşılandı ve 30 °C'de inkübe edildi. Benzer zamanlarda sınıra ulaştılar. Plakalar 6 saat daha inkübe edildi, bu sırada sürü sağ odaya geçti ve bu sırada ortam kanamycin ile desteklendi (Kan; sayılar μg / mL'yi gösteriyor). Plakalar, her biri üç taraflı olarak gerçekleştirilen üç biyolojik kopyayı temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Hücre bağlama için bir oda slaydı hazırlanması. (A) Fazlalığı kesmek için jilet kullanarak daha önce (B) iki parça çift taraflı bant yatırın. (C) Yapıştırıcıyı bir kapakçık yapıştırmadan önce(D)ortaya çıkarmak için üst katmanı soyun ve yavaşça pozisyona bastırın ([ ile gösterilir), aşağıdaki kapak ve bant arasındaki arayüzün dışına tüm havanın itilmesini sağlayın. (E) Yük örneği (burada DNA yükleme boyası ile gösterilmiştir [%30 v/v gliserol, 0.25% w /v bromophenol mavisi ve % 0.25 w/v ksilen siyanol] görselleştirmeye yardımcı olmak için eklendi) oluşturulan kanalın üst kısmına (ok) ve(F) temiz, doku görev mendiline angling, doku kanaldaki sıvıyı (oku) emerken ve içinden çekerken çözeltiyi hazneden çekmeye yardımcı olmak için silin. Bu rakamı indirmek için lütfen tıklayınız.
Video 1: Bağlı E. coli hücrelerinin dönüşü. Bu videoyu indirmek için lütfen tıklayınız.
Video 2: 60x büyütme altında çekilen aktif bir E. coli sürüsü, hareketli cephenin kenarının arkasında karakteristik dönen hareketini gösterir. Bu videoyu indirmek için lütfen tıklayınız.
Tartışmalar
Baskılayıcı mutasyonların izolasyonu ve karakterizasyonu, kemotaksi sistemi 35,36,37'nin ve motor makinelerinin kendisinin38,39,40'ıntemel bileşenlerinin tanımlanmasına başarıyla katkıda bulunmuştur. Protokol 1'i kullanırken, hareketlilik kaybını telafi edebilecek büyük bir olası mutasyon spektrumunun izolasyonu sağlamak için birden fazla bağımsız çoğaltma eklemek önemlidir. Kültürü bir nokta yerine bir çizgide çizgileyerek bakteri sayısını artırmak, baskılayıcı üretme olasılığını artırabilir41. Aynı mutasyonun izolasyonu (DNA dizilimi ile belirlendiği gibi) birçok kez orijinalliğine olan güveni arttırır. WGS genomdaki diğer mutasyonların varlığını her zaman ortaya çıkacaktır. Bu nedenle, tanımlanan mutasyonu (mümkünse) orijinal hareketlilik eksikliği olan arka plana geri aktararak sonuçları doğrulamak önemlidir. Bastırıcı mutant yaklaşımı, işlevi ikincil bir mutasyon yoluyla geri yüklemeye dayanır, bu nedenle bu yöntemin bir sınırlaması, kritik bir yapısal gen silinirse, yani tüm yolu veya yapıyı destekleyen bir gen, tazminat kapsamı olmayabilir. Eski bir yöntem olmasına rağmen, son çalışmamız34 bakteriyel hareketliliğine katkıda bulunan yeni yolların aydınlatılmasında devam eden faydasını göstermektedir.
Motor çıkışının nicelleştirilmesi için, hücre bağlama yaklaşımı, kamera ataşmanı olan sadece bir mikroskop gerektiren evrensel olarak erişilebilir bir araç olmaya devam eder. Hücre bağlama, Salmonella42, Pseudomonas43 , Streptococcus44ve Rhodobacter33dahil olmak üzere çeşitli bakteri türlerinde zaten kullanılmıştır. Protokolün başarısı büyük ölçüde hücrelerin düzgün yamyamlığı ve bağlanmasına bağlı. Çok agresif bir şekilde yamuma veya kesmeler arasındaki duraklamayı atlama (2.1.5), filamentlerin tutarsız veya eksik yamaçlarını teşvik etme eğilimindedir, bu da hareketli olmayan hücrelerin veya hücrelerin çarpık bir eksene bağlı hale getirilmesine neden olur. Bu protokolün kalıcı ilgisi, birçok araştırma grubu (bizimki dahil) tarafından daha yüksek çözünürlüklü boncuk testinin benimsenmesine rağmen devam etmektedir. Boncuk testinin birincil sınırlaması, boncukların ilgi çekici bakterilerin filamentine yapışmasının gereklilığından gelir. Bu teknik, E. coli'de yapışma45'ikolaylaştıran 'yapışkan' bir flagellin alelesi tanımlayan çalışmalardan büyük ölçüde yararlanmıştır. Yapışkan varyant, hücre bağlama testinde de üstündür. Böyle bir varyant, bayraklı bakterilerin çoğu için henüz mevcut değildir. Durum, birden fazla flagellin proteini46ve Vibrio sp. durumunda, ayrıca membranöz bir kılıfa sahip olan bazı organizmalarla daha da karmaşıktır47. Hücre bağlama, türe özgü bir anti-flagellin antikor veya tasarlanmış bir epitop etiketine karşı antikor kullanılarak da yapılabilir.
Bakteriler sıvı bir ortama girdikten hemen sonra yüzebilirken, bu, hücrelerin ilk olarak kaynayan bir duruma getirilmesi gereken kaynama için doğru değildir. Yüzey teması, hücrelerin kaynama48 , 49,50,51'i başlatması için gerekli olan fizyolojik bir değişikliği tetikler ve bu da bir gecikme evresi ve yüksek hücre yoğunluğu birikmesine neden olur. Fizyolojik değişiklikler arasında E. coli16'dakikemotaksi sisteminin yeniden şekillendirülmesinde ve diğer bakteriler için hücre uzaması ve/veya hiperflagellasyon gibi adaptasyonlar13, 14,21bulunur. Kaynama başlatmak için gereken fizyolojik değişiklikler göz önüne alındığında, sadece yoğunluğu artırmak için planktonik hücre kültürlerini yoğunlaştırarak ve / veya hücre bölünmesini engelleyen antibiyotikler kullanarak hücre uzamasını teşvik ederek, yüksek yoğunluklu veya artan hücre uzunluğu gibi kaynamaların seçilmiş yüzlerini taklit etmeye çalışan çalışmalar hakkında ibret verici bir not alıyoruz52,53. Hücre uzamasını bir işaretleyici olarak kullanıyorsak, planktonik hücrelere kıyasla, Salmonella veya E. coli54'tekiswarmer hücrelerinin ortalama uzunluğunda sadece marjinal bir artış olduğuna dikkat ediyoruz. Sürü tahlillerini kurmak yüzme testlerinden daha zordur. Değişkenler, medyayı katılaştırmak için kullanılan agarın ticari kaynağını içerir (özel Eiken agar E. coli'dekaynama için gereklidir , daha standart Difco agar ise diğer tüm bakteriler için kaynamayı destekler), zengin ve minimal ortam kullanımı(E. coli ve Salmonella glikoz takviyesi gerektirir) ve en kritik ortam nemi2,13,14,21. Bunlardan en uygun nemi korumak en sinir bozucu olabilir. [Tercih edilen bir organizmada(Pseudomonas aeruginosa)kaynama için mükemmel, metodik, optimizasyon Morales-Soto ve iş arkadaşları tarafından gösterilmiştir55.] Sürü ortamı, kaynamaları teşvik etmek için yeterince nemli olmalı, ancak aktif kaynama ile kolayca karıştırılabilecek pasif yayılmaya / kaymaya izin vermek için yeterince nemli olmamalıdır56. Bu nedenle, sürülerin bu kolektif hareketlilikle ilişkili farklı hareket kalıplarını doğrulamak için mikroskop altında kontrol edilmesi önemlidir (Video 2). Sıcaklık, kaynayan testleri optimize etmek için de önemli bir husustur. Daha yüksek sıcaklıklar, örneğin 37 °C, plakaları 30 °C'den daha erken kurur. Nem kontrollü bir inkübatör kullanmak (%~70-80), iç bina sıcaklıklarını ve nemi etkileyebilecek mevsimsel değişiklikler de dahil olmak üzere bu sorunları azaltmaya yardımcı olabilir. Başarıyla kurulduktan sonra, protokol 3, artan bakterilerin en ilginç yönlerinden birini araştırmak için güçlü bir yol sağlar, antibiyotiklere karşı yüksek direnç17. Burada açıklanan tüm protokoller, flagella aracılı hareketliliğini belirten ve kontrol eden yolları tanımlamak için yeni organizmalara uygulanabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri gm118085 ve kısmen Robert Welch Vakfı (R.M.H.'ye F-1811 hibesi) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Bacto Dehydrated Agar | Fisher Scientific | DF0140-15-4 | |
| EDTA Disodium Salt, Dihydrate | Fisher Scientific | 02-002-786 | |
| Eiken agar | Eiken Chemical Co. Japan | E-MJ00 | Essential for E. coli swarming |
| Glucose D (+) | Fisher Scientific | 410955000 | |
| LB (Lennox) Broth | Fisher Scientific | BP1427-500 | |
| Poly-L-lysine Solution (0.1%) | Sigma-Aldrich | P8920 | |
| Potassium chloride (KCl) | Fisher Scientific | 18-605-496 | |
| Potassium Phosphate monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Potassium Phosphate dibasic (K2HPO4) | Fisher Scientific | BP363-500 | |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | |
| Materials and Equipment | |||
| CellSense microscope imaging software (V. 1.6) | Olympus | Or equivalent software for microscope used | |
| Electron Microscopy Sciences Scotch 666 Doube Sided Tape | Fisher | 50-285-28 | |
| Frosted microscope slides 3x1x1mm | Fisher | 12-550-343 | |
| Olympus BX53 microscope | Olympus | BX53 | Any upright or inverted phase microscope can be used |
| Petri dishes (100 mm diameter) | Fisher Scientific | FB0875712 | For soft-agar assays |
| Polyethylene Nebulizer Capillary Tubing (0.58mm x 99mm 3.0m) | Perkin Elmer | 9908265 | |
| Round Petri Dish with 2 Compartments | VWR | 89200-944 | For border-crossing assays |
| Safety Hypodermic Needles (23G) | Fisher Scientific | 14-826A | |
| Sterile Syringe - 1 mL | Fisher scientific | 14-955-450 | |
| Task/Tissue wipes | Fisher scientific | 06-666 | Or equivalent single use tissue wipes |
| VWR micro cover-glass 18x18mm | VWR | 48366205 | |
| XM10 camera | Olympus | XM10 | Or equivalent microscope camera |
Referanslar
- Jarrell, K. F., McBride, M. J. The surprisingly diverse ways that prokaryotes move. Nature Reviews in Microbiology. 6 (6), 466-476 (2008).
- Harshey, R. M. Bacterial motility on a surface: many ways to a common goal. Annual Reviews Microbiology. 57, 249-273 (2003).
- Duan, Q., Zhou, M., Zhu, L., Zhu, G. Flagella and bacterial pathogenicity. Journal of Basic Microbiology. 53 (1), 1-8 (2013).
- Nakamura, S., Minamino, T. Flagella-Driven Motility of Bacteria. Biomolecules. 9 (7), (2019).
- Haiko, J., Westerlund-Wikstrom, B. The role of the bacterial flagellum in adhesion and virulence. Biology (Basel). 2 (4), 1242-1267 (2013).
- Berg, H. C. . E. coli in Motion. 1 edn. , (2004).
- Berg, H. C. The rotary motor of bacterial flagella. Annual Review of Biochemistry. 72, 19-54 (2003).
- Xing, J., Bai, F., Berry, R., Oster, G. Torque-speed relationship of the bacterial flagellar motor. Proceedings of the National Academy of Sciences U. S. A. 103 (5), 1260-1265 (2006).
- Chen, X., Berg, H. C. Torque-speed relationship of the flagellar rotary motor of Escherichia coli. Biophysics Journal. 78 (2), 1036-1041 (2000).
- Turner, L., Ryu, W. S., Berg, H. C. Real-time imaging of fluorescent flagellar filaments. Journal of Bacteriology. 182 (10), 2793-2801 (2000).
- Brown, M. T., Delalez, N. J., Armitage, J. P. Protein dynamics and mechanisms controlling the rotational behaviour of the bacterial flagellar motor. Current Opinion in Microbiology. 14 (6), 734-740 (2011).
- Parkinson, J. S., Hazelbauer, G. L., Falke, J. J. Signaling and sensory adaptation in Escherichia coli chemoreceptors: 2015 update. Trends in Microbiology. 23 (5), 257-266 (2015).
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews Microbiology. 8 (9), 634-644 (2010).
- Harshey, R. M., Partridge, J. D. Shelter in a Swarm. Journal of Molecular Biology. 427 (23), 3683-3694 (2015).
- Ariel, G., et al. Swarming bacteria migrate by Levy Walk. Nature Communications. 6, 8396 (2015).
- Partridge, J. D., Nhu, N. T. Q., Dufour, Y. S., Harshey, R. M. Escherichia coli Remodels the Chemotaxis Pathway for Swarming. mBio. 10 (2), (2019).
- Butler, M. T., Wang, Q., Harshey, R. M. Cell density and mobility protect swarming bacteria against antibiotics. Proceedings of the National Academy of Science U. S. A. 107 (8), 3776-3781 (2010).
- Mobley, H. L., Belas, R. Swarming and pathogenicity of Proteus mirabilis in the urinary tract. Trends in Microbiology. 3 (7), 280-284 (1995).
- Burall, L. S., et al. Proteus mirabilis genes that contribute to pathogenesis of urinary tract infection: identification of 25 signature-tagged mutants attenuated at least 100-fold. Infections and Immunity. 72 (5), 2922-2938 (2004).
- Mazzantini, D., et al. FlhF Is Required for Swarming Motility and Full Pathogenicity of Bacillus cereus. Frontiers in Microbiology. 7, 1644 (2016).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. Journal of Bacteriology. 195 (5), 909-918 (2013).
- Yuan, J., Berg, H. C. Resurrection of the flagellar rotary motor near zero load. Proceedings of the National Academy of Science U. S. A. 105 (4), 1182-1185 (2008).
- Yuan, J., Fahrner, K. A., Berg, H. C. Switching of the bacterial flagellar motor near zero load. Journal of Molecular Biology. 390 (3), 394-400 (2009).
- Terasawa, S., et al. Coordinated reversal of flagellar motors on a single Escherichia coli cell. Biophysics Journal. 100 (9), 2193-2200 (2011).
- Nord, A. L., Sowa, Y., Steel, B. C., Lo, C. J., Berry, R. M. Speed of the bacterial flagellar motor near zero load depends on the number of stator units. Proceedings of the National Academy of Science. 114 (44), 11603-11608 (2017).
- Block, S. M., Segall, J. E., Berg, H. C. Adaptation kinetics in bacterial chemotaxis. J Bacteriol. 154 (1), 312-323 (1983).
- Segall, J. E., Block, S. M., Berg, H. C. Temporal comparisons in bacterial chemotaxis. Proceedings of the National Academy of Science U. S. A. 83 (23), 8987-8991 (1986).
- Wolfe, A. J., Conley, M. P., Kramer, T. J., Berg, H. C. Reconstitution of signaling in bacterial chemotaxis. Journal of Bacteriology. 169 (5), 1878-1885 (1987).
- Blair, D. F., Berg, H. C. Restoration of torque in defective flagellar motors. Science. 242 (4886), 1678-1681 (1988).
- Parkinson, J. S. A "bucket of light" for viewing bacterial colonies in soft agar. Methods Enzymol. 423, 432-435 (2007).
- Adler, J. Chemotaxis in bacteria. Science. 153 (3737), 708-716 (1966).
- Wolfe, A. J., Berg, H. C. Migration of bacteria in semisolid agar. Proceedings of the National Academy of Science U. S. A. 86 (18), 6973-6977 (1989).
- Kojadinovic, M., Sirinelli, A., Wadhams, G. H., Armitage, J. P. New motion analysis system for characterization of the chemosensory response kinetics of Rhodobacter sphaeroides under different growth conditions. Applied and Environmental Microbiology. 77 (12), 4082-4088 (2011).
- Nieto, V., et al. Under Elevated c-di-GMP in Escherichia coli, YcgR Alters Flagellar Motor Bias and Speed Sequentially, with Additional Negative Control of the Flagellar Regulon via the Adaptor Protein RssB. Journal of Bacteriology. 202 (1), (2019).
- Parkinson, J. S., Parker, S. R., Talbert, P. B., Houts, S. E. Interactions between chemotaxis genes and flagellar genes in Escherichia coli. Journal of Bacteriology. 155 (1), 265-274 (1983).
- Roman, S. J., Meyers, M., Volz, K., Matsumura, P. A chemotactic signaling surface on CheY defined by suppressors of flagellar switch mutations. Journal of Bacteriology. 174 (19), 6247-6255 (1992).
- Sanna, M. G., Simon, M. I. Isolation and in vitro characterization of CheZ suppressors for the Escherichia coli chemotactic response regulator mutant CheYN23D. Journal of Biological Chemistry. 271 (13), 7357-7361 (1996).
- Sockett, H., Yamaguchi, S., Kihara, M., Irikura, V. M., Macnab, R. M. Molecular analysis of the flagellar switch protein FliM of Salmonella typhimurium. Journal of Bacteriology. 174 (3), 793-806 (1992).
- Irikura, V. M., Kihara, M., Yamaguchi, S., Sockett, H., Macnab, R. M. Salmonella typhimurium fliG and fliN mutations causing defects in assembly, rotation, and switching of the flagellar motor. Journal of Bacteriology. 175 (3), 802-810 (1993).
- Ishida, T., et al. Sodium-powered stators of the bacterial flagellar motor can generate torque in the presence of phenamil with mutations near the peptidoglycan-binding region. Molecular Microbiology. 111 (6), 1689-1699 (2019).
- Barker, C. S., Meshcheryakova, I. V., Kostyukova, A. S., Samatey, F. A. FliO regulation of FliP in the formation of the Salmonella enterica flagellum. PLoS Genetics. 6 (9), 1001143 (2010).
- Paul, K., Nieto, V., Carlquist, W. C., Blair, D. F., Harshey, R. M. The c-di-GMP binding protein YcgR controls flagellar motor direction and speed to affect chemotaxis by a "backstop brake" mechanism. Molecular Cell. 38 (1), 128-139 (2010).
- Qian, C., Wong, C. C., Swarup, S., Chiam, K. H. Bacterial tethering analysis reveals a "run-reverse-turn" mechanism for Pseudomonas species motility. Applied and Environmental Microbiology. 79 (15), 4734-4743 (2013).
- Manson, M. D., Tedesco, P. M., Berg, H. C. Energetics of flagellar rotation in bacteria. Journal of Molecular Biology. 138 (3), 541-561 (1980).
- Kuwajima, G. Construction of a minimum-size functional flagellin of Escherichia coli. Journal of Bacteriology. 170 (7), 3305-3309 (1988).
- Kuhn, M. J., et al. Spatial arrangement of several flagellins within bacterial flagella improves motility in different environments. Nature Communication. 9 (1), 5369 (2018).
- Hranitzky, K. W., Mulholland, A., Larson, A. D., Eubanks, E. R., Hart, L. T. Characterization of a flagellar sheath protein of Vibrio cholerae. Infections and Immun. 27 (2), 597-603 (1980).
- Wang, Q., Frye, J. G., McClelland, M., Harshey, R. M. Gene expression patterns during swarming in Salmonella typhimurium: genes specific to surface growth and putative new motility and pathogenicity genes. Molecular Microbiology. 52 (1), 169-187 (2004).
- Gode-Potratz, C. J., Kustusch, R. J., Breheny, P. J., Weiss, D. S., McCarter, L. L. Surface sensing in Vibrio parahaemolyticus triggers a programme of gene expression that promotes colonization and virulence. Molecular Microbiology. 79 (1), 240-263 (2011).
- McCarter, L., Silverman, M. Surface-induced swarmer cell differentiation of Vibrio parahaemolyticus. Molecular Microbiology. 4 (7), 1057-1062 (1990).
- Pearson, M. M., Rasko, D. A., Smith, S. N., Mobley, H. L. Transcriptome of swarming Proteus mirabilis. Infections and Immunity. 78 (6), 2834-2845 (2010).
- Swiecicki, J. M., Sliusarenko, O., Weibel, D. B. From swimming to swarming: Escherichia coli cell motility in two-dimensions. Integrative Biology (Cambridge). 5 (12), 1490-1494 (2013).
- Colin, R., Drescher, K., Sourjik, V. Chemotactic behaviour of Escherichia coli at high cell density. Nature Communication. 10 (1), 5329 (2019).
- Partridge, J. D., Harshey, R. M. More than motility: Salmonella flagella contribute to overriding friction and facilitating colony hydration during swarming. Journal Bacteriology. 195 (5), 919-929 (2013).
- Morales-Soto, N., et al. Preparation, imaging, and quantification of bacterial surface motility assays. Journal Visualized Experiment. (98), e52338 (2015).
- Chawla, R., Ford, K. M., Lele, P. P. Torque, but not FliL, regulates mechanosensitive flagellar motor-function. Science Reports. 7 (1), 5565 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır