Method Article
التحقيق في حركية Flagella يحركها في الإشريكية القولونية من خلال تطبيق ثلاث تقنيات راسخة في سلسلة
In This Article
Summary
تستخدم العديد من البكتيريا الحركة التي تحركها flagella للتنقل في بيئتها واستعمار المناطق المحيطة المواتية على حد سواء بشكل فردي وجماعي. يتضح هنا هو استخدام ثلاث طرق راسخة تستغل الحركة كأداة اختيار لتحديد المكونات / المسارات المساهمة في السباحة والحركة.
Abstract
الحركة أمر بالغ الأهمية لبقاء ونجاح العديد من الأنواع البكتيرية. توجد العديد من المنهجيات لاستغلال الحركة لفهم مسارات الإشارات ، لتوضيح وظيفة وتجميع أجزاء flagellar ، ودراسة وفهم أنماط الحركة. هنا نبين مجموعة من ثلاث من هذه المنهجيات. الحركة في أجار لينة هو الأقدم، وتقدم مجموعة قوية لعزل الطفرات القامع كسب الوظيفة في سلالات حركية ضعف، حيث يتم استعادة الحركة من خلال طفرة ثانية. ويمكن استخدام تقنية ربط الخلايا، التي استخدمت لأول مرة لإثبات الطبيعة الدوارة لمحرك flagellar، لتقييم تأثير تأثيرات الإشارات على سرعة المحرك وقدرته على تبديل الاتجاه الدوراني. أما المقايسة "العابرة للحدود" فهي أحدث عهدا، حيث يمكن تجهيز بكتيريا السباحة للانتقال إلى التحرك الجماعي كسرب. وتمثل هذه البروتوكولات مجتمعة نهجا منهجيا وقويا لتحديد مكونات آلية الحركة، وتوصيف دورها في مختلف جوانب السباحة والازحراب. ويمكن تكييفها بسهولة لدراسة الحركة في الأنواع البكتيرية الأخرى.
Introduction
البكتيريا تستخدم العديد من الزوائد للحركة والتشتت في منافذها الإيكولوجية1. حركية Flagella يحركها هو أسرع من هذه، وتعزيز استعمار محلى مواتية استجابة للإشارات البيئية، والمساهمة بشكل كبير في القدرة المسببة للأمراض من بعض الأنواع2،3. يمكن للبكتيريا flagellated السباحة بشكل فردي في السائل السائبة، أو سرب كمجموعة على سطح شبه صلب4. يلتصق flagella خارج الخلية بمحركات دوارة مضمنة في الغشاء ويقودها ، والتي تسخر قوة تدرجات الأيونات لتوليد عزم الدوران الذي يسبب الدوران1،2،4،5،6،7،8. في الإشريكية القولونية، التي تعمل محركاتها بعزم دوران ثابت9، يمكن تصنيف إخراج المحرك من حيث سرعة الدوران وتبديل الدوار بين اتجاه عكس اتجاه عقارب الساعة (CCW) واتجاه عقارب الساعة (CW). يعزز دوران اتفاقية الأسلحة التقليدية تشكيل حزمة flagellar متماسكة تدفع الخلية إلى الأمام (تشغيل) ، في حين أن التبديل العابر في اتجاه الدوران (CW) يتسبب في تفكيك الحزمة إما جزئيا أو كليا10، والخلية لإعادة توجيه اتجاه السباحة (تعثر). E. القولونية تشغيل عادة لثانية واحدة وتعثر لمدة عشر من الثانية. يتم التحكم في تبديل تردد الدوار أو "التحيز المتعثر" من خلال نظام الإشارات chemotaxis ، حيث تكتشف مستقبلات الشيمورسيبتس العابرةmembrane الإشارات الكيميائية الخارجية وتنقلها عبر الفوسفوريلاي إلى محرك flagellar لتمديد الأشواط استجابة للمجذبات ، أو قمعها استجابة للمواد الكيميائية السامة11،12. يتم فحص حركة السباحة في أجار ناعم بنسبة 0.3٪.
أثناء يحتشدون، البكتيريا التنقل على سطح شبه صلب كمجموعة كثيفة، حيث حزم من البكتيريا تيار في حركة الدوامةالمستمرة 2،13،14،15. E. أسراب القولونية المعرض تغيير علم وظائف الأعضاء chemosensory (انخفاض التحيز تعثر), سرعات أعلى, وارتفاع التسامح مع مضادات الميكروبات على الخلايا السباحة في السائل السائب16,17. أسراب تختلف في نشرها لعدد كبير من الاستراتيجيات التي تساعد على الحركة، بما في ذلك إنتاج السطحي، فرط التضخم، وإطالة الخلية2. يحتشدون يقدم البكتيريا ميزة تنافسية في كل من الإيكولوجية والإعداداتالسريرية 18،19،20. هناك فئتان من البكتيريا يحتشدون: أسراب المعتدلة، والتي يمكن أن سرب فقط على وسائل الإعلام توطدت مع 0.5-0.8٪ أجار، وأسراب قوية، والتي يمكن التنقل عبر تركيزات أجار أعلى21.
توجد مجموعة متنوعة من المقايسات لاستجواب حركة السباحة وتنظيمها. عندما تضعفها الطفرات أو الظروف البيئية ، فإن الحركة نفسها تقدم مجموعة قوية لتحديد طفرات القامع لكسب الوظيفة. يمكن أن تكون هذه القامعات عودة حقيقية للطفرة الأصلية ، أو العودة الزائفة ، حيث تستعيد الطفرة الثانية الوظائف. ويمكن تحديد هذه المسوخ من خلال تسلسل الجينوم كله (WGS). البديل لاختيار القامع غير المتحيز هو استراتيجية الطفرات المستهدفة المتحيزة (على سبيل المثال ، تولد الطفرات PCR). وغالبا ما تسلط هذه المنهجيات الضوء على وظيفة جهاز الحركة أو تنظيمه البيئي. إذا كان الهدف هو دراسة الوظيفة الحركية ، فإن استعادة الحركة البرية كما تقاس بالنعومة قد لا تشير بالضرورة إلى استعادة إخراج المحرك البري. يمكن أن يكون المقايسة التي تربط الخلايا، والتي يتم فيها ربط الخلايا بسطح زجاجي بواسطة علم واحد ويتم رصد دوران جسم الخلية لاحقا، هي المقايسة الأولية للاختيار لتقييم السلوك الحركي. على الرغم من أن أكثر منهجيات متطورة متاحة الآن لرصد خصائص المحرك، المطلوبة عالية السرعة الكاميرا انشاء وتطبيق حزم البرمجيات لتحليل الحركة تحد من استخدامها على نطاق واسع22،23،24،25. يتطلب الفحص ربط الخلية فقط أن يتم قص flagella ، مما يسمح بتعلق خيوط قصيرة إلى شريحة زجاجية ، تليها تسجيل فيديو دوران جسم الخلية. على الرغم من أن السرعات الحركية المسجلة منخفضة في هذا المقايسة بسبب الحمل العالي الذي يمارسه جسم الخلية على flagellum ، إلا أن هذا الفحص ساهم مع ذلك في رؤى قيمة في الاستجابات الكيميائية26و27و28و29، ولا يزال أداة تحقيق صالحة كما هو موضح أدناه.
تشكل الحركة المحتشدة مجموعة مختلفة من التحديات للباحثين. اختيار القامع كسب وظيفة يعمل فقط في أسراب التي تنتج السطحي وفيرة وسرب بسهولة13. السطحية غير المنتجين مثل كولاي هي fastidious فيما يتعلق باختيار أجار، وتكوين وسائل الإعلام والرطوبة للبيئة2،13،14،21. وبمجرد تهيئة الظروف المحتشدة، فإن المقايسة17 لعبور الحدود هي منهجية مفيدة لاستجواب قدرة سرب على التنقل في ظروف جديدة/قاسية. على الرغم من أن البروتوكولات المعروضة أدناه تتعلق بالإشريكية القولونية، إلا أنه يمكن تكييفها بسهولة للتطبيق في الأنواع الأخرى.
Protocol
1. عزل المسوخ القامع في سلالات نقص الحركة
ملاحظة: استخدم هذا الأسلوب ك "catch-all" واسعة لتحديد الطبيعة العامة للعيب الحركة.
- إعداد لوحة لينة أجار
ملاحظة: لينة أجار، ويشار إليها أيضا باسم الحركة- أو السباحة أجار، هو agar نسبة منخفضة (~0.2-0.35٪ ث /v)، وتستخدم منذ فترة طويلة لاحصاء chemotaxis31،32.- إضافة 3 غرام من باكتو أغار (0.3٪ ث / v) و 20 غرام من LB إلى قارورة أسفل جولة 2 L. إضافة 1 لتر من DDH2O (الماء المقطر المزدوج) إلى القارورة وخلط بالتساوي تعليق باستخدام قضيب اثارة ولوحة التحريك المغناطيسي.
- أوتوكلاف لمدة 20 دقيقة عند 121 درجة مئوية.
- السماح لتبرد مع التحريض لطيف باستخدام قضيب / لوحة على النحو الوارد أعلاه. عندما تصل درجة الحرارة إلى حوالي 50 درجة مئوية، صب 25 مل في أطباق بيتري العقيمة (100 مم × 15 ملم)، والسماح للأجار المنصهر لضبط مع غطاء في مكان لمدة 1 ساعة على الأقل، للاستخدام في غضون 16 ساعة.
- إعداد الثقافة والتلقيح وعزل المسوخ القامعة
ملاحظة: E. القولونية تلقيح في وسط وسائل الإعلام الغنية بالمغذيات تتوطد مع أجار لينة تستهلك المواد الغذائية محليا، وخلق التدرج المغذيات التي يتبعونها. كما أنها تتحرك إلى الخارج، تعريف 'حلقات' تظهر(الشكل 1A)،والتي ترتبط الكيميائي محددة التراكتات البكتيريا تستجيب ل. يمكن أن العيوب في نظام chemotaxis أو المكونات الهيكلية للمحرك flagella المساس بالأداء في هذا المقايسة. في كثير من الأحيان ، تنشأ المسوخ ذات ميزة الحركة أثناء الفحص ، ويمكن رؤيتها تخرج من نقطة واحدة أو من نقاط متعددة على طول محيط الحلبة ، من حيث "توهج"(الشكل 1C). وسوف يلاحظ المرء أن الحافة الخارجية من جبهة السباحة يتناقض بسهولة ضد أجار الناعمة العذراء غير المنقوطة.- تنمو الثقافات بين عشية وضحاها من سلالة الحركة الناقصة المطلوبة في 5 مل من مرق لينوكس (LB; 10 غرام / لتر تريبتوني, 5 غرام / لتر استخراج الخميرة, و 5 غرام / لتر NaCl, جدول المواد) في 30 درجة مئوية مع اهتزاز أفقي (220 r.p.m.). في اليوم التالي، والثقافة الفرعية (1:100 التخفيف) في LB الطازجة، وتنمو في ظل نفس الظروف إلى مرحلة الأسي (OD600 من 0.6).
- تلقيح 6 ميكرولتر من الثقافة في وسط لوحة لينة أجار (1.1) باستخدام ماصة، ودفع طرف عقيم محملة في أجار لطرد بلطف محتويات. نقل إلى 30 درجة مئوية واحتضان (الشكل 1B)، حتى حركية 'مشاعل' واضحة، المنبثقة من نقطة التطعيم أو محيط حلقات الحركة، وعادة في 24-36 ح (الشكل 1C).
ملاحظة: في المقايسات الحركة، تلقيح سلالة من النوع البري جنبا إلى جنب مع عزل متحولة للمقارنة. هذه السلالة البرية من نوع سوف تظهر حلقات chemotactic متحدة المركز مميزة (الشكل 1A) وملء لوحة في غضون 8-10 ساعة. - استخدام حلقة سلكية معقمة لرفع الخلايا من منطقة "مضيئة" وشرائط لتنقية مستعمرات واحدة على لوحة أجار الصلب LB (LB أعدت على النحو الوارد أعلاه، توطدت مع 15 غرام / لتر bacto-أغار).
- اختيار مستعمرات واحدة من لوحة خط باستخدام حلقة سلك عقيم وإعادة تنقية عن طريق streaking لمستعمرات واحدة لضمان عزل مستعمرة "نقية".
- تأكيد وتوصيف المسوخ القامعة
- تأكد من أن متحولة القامع المعزولة (ق) قد استعادت الحركة. إعداد لوحات لينة أجار (1.1)، والثقافات لسلالات من الاهتمام (كما هو الحال في 1.2.1)، بما في ذلك البرية من نوع وبدء 'الحركة ناقصة' سلالة للمقارنة.
- تلقيح الصفائح (كما في 1.2.2) واحتضان في 30 درجة مئوية لمدة 8-10 ساعة.
- تسجيل قطر الحلقة الخارجية (حافة الدائرة) ومقارنة لتحديد أي من العزلات قد استعادت إلى حد كبير الحركة.
ملاحظة: يوصى بتصوير اللوحات طوال الدورة الزمنية للتجربة. للحصول على أفضل النتائج، استخدم جهاز "دلو الضوء"30، حيث يتم تركيب كاميرا رقمية فوق مصدر ضوء لتحسين الإضاءة لقياس قطر مستعمرة السباحة وتمييزها عن أجار غير المكتونة. - يتم التحقق من عزل الموضوع إلى WGS كما هو مطلوب ، مما يسمح ب "تغطية تسلسلية" كافية لتحديد الطفرات التي أعادت وظيفة النوع البري بشكل إيجابي.
2. تحديد السلوك الحركي flagella عن طريق الربط الخلية
ملاحظة: استخدم هذا الأسلوب عندما يظهر سلوك التشغيل-tumble العادي (chemotaxis) للخطر.
-
إعداد الثقافة والقص flagella
- إعداد ثقافة المرحلة الأسية لسلالة الاهتمام كما هو موضح في الخطوة 1.2.1.
- بيليه 10 مل من الخلايا عن طريق الطرد المركزي في 2000 × ز لمدة 3 دقائق قبل إعادة تعليق في 10 مل من العازلة حركية مرشح معقمة (MB; 10 م ص البوتاسيوم الفوسفات العازلة [0.0935 M K2HPO4، 0.0065 M KH2PO4، درجة الحموضة 7.0] ، 0.1 mM EDTA [درجة الحموضة 7.0] ، 10 MM NaCl ، 75 mM KCl).
ملاحظة: MB يدعم الحركة، ولكن لا يدعم النمو البكتيري - كرر الخطوة 2.1.2 مرتين أخريين قبل إعادة تعليق بيليه النهائي في 1 مل من ميغابايت.
- نقل تعليق الخلية إلى حقنة 1 مل وإرفاق إبرة 23G حتى النهاية. تجميع جهاز حقنة / إبرة متطابقة وإرفاق اثنين معا عن طريق 6 بوصات من أنابيب البولي ايثيلين (القطر الداخلي من 0.58 ملم) مغمد بإحكام على كل طرف إبرة.
- القص flagella (فهي هشة وكسر بسهولة) عن طريق تمرير بلطف تعليق الخلية ذهابا وإيابا من حقنة واحدة إلى أخرى 50x، مع توقف 1 دقيقة بين كل 10 يمر.
- الطرد المركزي الخلايا المقص في 2000 س ز لمدة 3 دقائق وإعادة الإنفاق في حجم نهائي قدره 500 ميكرولتر من ميغابايت.
-
إعداد الشرائح وربط الخلايا
- إعداد غرفة تثبيت الخلية عن طريق التراص 18 ملم × 18 مم coverslip على 3 بوصة × 1 بوصة × 1 مم الزجاج مجهر الشريحة، مفصولة شريط على الوجهين(الشكل S1).
- اغسل الغرفة بحل بولي ليسين بنسبة 0.01٪ (ث/v) من خلال تطبيقها على الجزء العلوي من الغرفة. إمالة الحافة السفلية (تدفق الأغطية مع شريحة المجهر) على ممسحة مهمة (ورقة الأنسجة) للمساعدة في رسم الحل من خلال الغرفة(الشكل S1). ثم احتضان في درجة حرارة الغرفة لمدة 10 دقيقة.
- غسل الغرفة ثلاث مرات مع 40 ميكرولتر من ميغابايت باستخدام كما هو موضح في الخطوة 2.2.2
- أضف 40 ميكرولتر من تعليق الخلية المقص (المعد أعلاه) إلى أعلى الغرفة واحتضنه في درجة حرارة الغرفة لمدة 10 دقائق للسماح للخلايا بالتعلق بالزلاقة.
- قم بتدفق الغرفة برفق مع 40 ميكرولتر من ميغابايت كما هو الحال في 2.2.3 لإزالة الخلايا غير المرتبطة.
-
تسجيل دوران الخلية وتحديد كميتها
- نقل الشريحة المجهر محملة الخلايا المربوطة إلى مرحلة المجهر.
- باستخدام المجهر على النقيض من المرحلة وهدف 100x ، مسح السكان للخلايا التي يتم إصلاحها في مكانها ، وتناوب على محور واحد ، أي تناوب سلس على نقطة ثابتة بدلا من تقديم في زاوية حيث تتحرك الخلية داخل وخارج التركيز(فيديو 1).
- استخدام المجهر التجاري والكاميرا المرتبطة بها. افتح البرنامج المرتبط، وتأكد من أن الخلايا ذات الاهتمام هي في التركيز وانقر فوق الحصول على الفيديو لتسجيل دوران الخلية لمدة دقيقة واحدة (بمعدل 10 إطارات في الثانية أو أعلى).
- من تشغيل الفيديو، قم بتحديد عدد الدورانات الكاملة في الدقيقة وعدد المرات التي تغير الخلية اتجاهها (تبديل التردد).
ملاحظة: قد تكون سرعات الدوران وتردد التبديل سريعين جدا لقياسها بالعين لذلك يوصى باستخدام برامج الفيديو التي توفر تشغيلا بطيءا / دقيقا ، أو تعتمد نظاما برمجيا آليا لتحديد أنماطالدوران 33. والبديل هو زيادة لزوجة ميغابايت باستخدام السليلوز الميثيل (أو وكيل مماثل) للمساعدة في إبطاء وحل دوران البكتيريا أسرع أو تعويض عندما الكاميرات مع انخفاض framerates قيد الاستخدام. - كرر الخطوة 2.3.2 مع التكرارات البيولوجية لتجميع تمثيل السكان من الفائدة.
3. إعداد أسراب في عملية فحص عبور الحدود
ملاحظة: استخدم هذه الطريقة لتقييم تأثير طفرة أو حالة على الحركة الجماعية. سرب أغار يشير إلى أجار حيث النسبة المئوية عادة ما تكون أعلى من تلك الناعمة أجار. في أجار لينة (0.3٪)، تسبح الخلايا بشكل فردي داخل أجار. في سرب أجار (0.5٪ وما فوق)، تتحرك الخلايا كمجموعة على السطح. في حين يجب استخدام لوحات سرب كما هو مفصل هنا، لوحات السباحة لها عمر أطول الرف، ويمكن استخدامها لعدة أيام. تفضيلنا الشخصي هو استخدام في 1-2 أيام.
-
إعداد سرب أجار
- إضافة 5 غرام من إيكن أغار (0.5٪ ث / v) و 20 غرام من LB إلى قارورة أسفل جولة 2 L. إضافة 1 لتر من DDH2O إلى القارورة وخلط بالتساوي تعليق باستخدام قضيب اثارة ولوحة التحريك المغناطيسي.
- أوتوكلاف لمدة 20 دقيقة عند 121 درجة مئوية.
- السماح لتبرد مع التحريض لطيف لتجنب أي فقاعات الهواء باستخدام قضيب / لوحة على النحو الوارد أعلاه. عند حوالي 50 درجة مئوية، أضف الجلوكوز المعقم للفلتر لتركيز نهائي قدره 0.5٪.
- صب 25 مل في أطباق بيتري العقيمة (100 ملم × 15 ملم) والسماح لتعيين في درجة حرارة الغرفة لمدة 14 ساعة على الأقل وليس أكثر من 20 ساعة. لا تخزن للاستخدام في المستقبل.
-
تلقيح واحتضان لوحات سرب
- تلقيح 6 ميكرولتر من ثقافة منتصف الأسي (أعدت كما هو الحال في 1.2) عن طريق اكتشاف على رأس أجار.
- اترك الغطاء لمدة 5-10 دقائق واستبدله عندما يجف ال inoculum إلى سطح أجار.
- حضانة عند 30 درجة مئوية لمدة 8 ساعة. تجنب إغراء لفحص التقدم سرب عن طريق إزالة الغطاء، وهذا سوف يسهم في تجفيف أجار وضعف يحتشدون.
ملاحظة: قد يختلف وقت الحضانة حسب النمط الظاهري للإجهاد. قد تعوق بعض الطفرات المعزولة القدرة على الاحتشاد وستتطلب نسبة أقل من أجار أو فترة حضانة أطول.
-
إعداد لوحات المقايسة لعبور الحدود
ملاحظة: يستخدم هذا المقايسة طبق Petri معدل، حيث يقوم قسمة بلاستيكية (حدود) بإنشاء حجرتين، بدلا من غرفة واحدة(الشكل 2A). يمكن إعداد كل غرفة بشكل مستقل عن الأخرى ، مما يوفر ظروفا مختلفة للحشد ، قبل "ربط" الاثنين. اعتمادا على التصميم التجريبي، يمكن إعداد الغرفة الأولى (المعينة إلى اليسار) إما مع أجار السباحة (0.3٪ ث / v) أو سرب أجار (0.5٪ ث / الخامس) من حيث يمكن للبكتيريا الهجرة عبر الحدود إلى الغرفة اليمنى التي تحتوي على سرب أجار +/- أي ملحق المطلوبة أو التحدي (على سبيل المثال، المضادات الحيوية). عادة ما يتم قياس الهجرة على أي من أجار / مقارنة عن طريق تسجيل أوسع قطر من الاستعمار البكتيري (من الحافة إلى الحافة) من النقطة الأصلية للتلقيح.- إعداد أجار السباحة كما هو موضح في 1.1 إذا لزم الأمر.
- إعداد سرب أجار كما هو موضح في 3.1.
- صب ~ 30 مل من أجار سرب (مع مكملات المطلوب إذا لزم الأمر) في الغرفة اليمنى من طبق بيتري مزدوجة المقصورة (100 ملم × 15 ملم)، لدرجة أنه هو مستوى مع مقسم البلاستيك بين الغرف، ولكن لا تفيض في اليسار(الشكل 2B).
- بعد أن تصلب أجار، وملء الغرفة اليسرى مع ~ 30 مل من السباحة أو سرب أجار، مرة أخرى إلى نقطة الاتصال مع الفجوة البلاستيكية(الشكل 2C). قبل أن يحدد، استخدم طرف ماصة معقمة لسحب بلطف أجار عبر الحدود لربط الجانبين مع جسر أجار طويل القامة ~ 1 ملم الذي يمتد على طول الفجوة(الشكل 2D).
- السماح للطبق لتجف في درجة حرارة الغرفة (3.1).
ملاحظة: طريقة بديلة لإنشاء جسر هو السماح للغار الغرفة اليسرى لتجف ثم ماصة ببطء ~ 100 ميكرولتر من أجار سرب المنصهر على طول المقسم البلاستيك لسد الغرفتين (3.4). تلقيح لوحات على الغرفة اليسرى كما هو مفصل أعلاه للسباحة (1.2.2) أو سرب (3.2) أجار، قبل احتضان في 30 درجة مئوية لمدة 12-16 ساعة، أو حتى أسراب حققت تقدما كافيا على الغرفة اليمنى للسماح بإجراء مقارنات بين سلالات الاهتمام.
النتائج
تم تفصيل عزل الرجعيات الزائفة في سلالة الإشريكية القولونية التي تضعف حركتها بسبب المستويات العالية من جزيء الإشارات c-di-GMP ، في العمل الأخير من مختبرنا34. هذه السلالة (JP1442) تؤوي اثنين من الطفرات:Δ yhjH وΔ ycgR. YhjH هو فوسفوديستراز الأكثر نشاطا أن يحط ج دي GMP في الإشريكية القولونية. غياب YhjH يؤدي إلى ارتفاع مستويات ج دي GMP وتثبيط الحركة. YcgR هو تأثير c-di-GMP. في مجمع مع ج دي GMP، YcgR يربط إلى الدوار flagellar للحث أولا دوران السيارات CCW وانخفاض سرعة المحرك في وقت لاحق. وأظهرت الربط الخلية واقتراز حبة أن السلوك الحركي عاد إلى طبيعته في متحولة مزدوجة، ولكن الحركة في أجار لينة لم34. لذلك، قمنا بنشر الخطوة 1 من البروتوكول لعزل المشاعل الزائفة في متحولة مزدوجة(الشكل 1C). غالبية الطفرات التي تم تعيينها من قبل WGS (HiSeq 4000 منصة، PE 2 × 150 الإعداد34)إلى rssB، الذي رموز لبروتين منظم الاستجابة / محول الذي يوجه عادة protease ClpXP لاستهداف σS لتدهور34. واحدة من هذه الرجعات، التي أظهرت الحركة على مقربة من نوع البرية (AW405، مقارنة الشكل 1A، D)،واستخدمت لتوليد نتائج تمثيلية للخطوة 2 و 3 من قسم البروتوكول، وذلك باستخدام ضوابط على حد سواء الأم متحولة مزدوجة (الشكل 1B) وسلالة من نوع البرية isogenic (الشكل 1A).
بالنسبة للخطوة 2 من قسم البروتوكول، تم تحليل التقاطات الفيديو لحساب الدورانات في الدقيقة (كل دوران كامل بزاوية 360 درجة)، ووزنالتعبئة التحيز (جزء الوقت الذي تدور فيه المحركات في اتجاه CW، أو التحيز المتعثر). وأظهرتΔ yhjH تناوب أقل في الدقيقة الواحدة وانخفاض التحيز CW بالمقارنة مع نوع البرية، كما هو متوقع(الشكل 3). كل منΔ yhjH Δ YcgR متحولة مزدوجة والمثبط لها أظهرت سلوكا محركا مماثلا لنوع البرية، والملاحظات التي يدعمها تحليل سابق باستخدام أعلى دقة 'حبة' المقايسة مفصلة في مقدمة أعلاه في العمل السابق34.
بالنسبة للخطوة 3 من قسم البروتوكول ، تم استخدام المقايسة العابرة للحدود(الشكل 2)لمقارنة قدرات النوع البري وعزل القامع ، أولا إلى سرب ، ثم للتحرك عبر الحدود وسرب على أغار تكملها kanamycin. وتبين النتائج أن كلا الضغطين وصلا إلى الحدود في وقت مماثل (البيانات غير مبينة) مما يشير إلى معدلات مماثلة من الازدهاق من نقطة تلقيح متطابقة. ومع ذلك ، عبر أكثر من سرب إلى اليمين (المضادات الحيوية) الغرفة هامشيا ، ولكن باستمرار أكبر لنوع البرية من القامع في 20 ميكروغرام / مل kanamycin(الشكل 4). وكان الفرق بين السلالات اثنين أكثر وضوحا في 40 ميكروغرام / مل kanamycin. معا، تشير هذه البيانات إلى أن الطفرات في rssB التي استعادت الحركة على لوحات لينة أجار (الشكل 1D)، تؤثر سلبا على مقاومة المضادات الحيوية من سلالة القامع أثناء يحتشدون(الشكل 4).
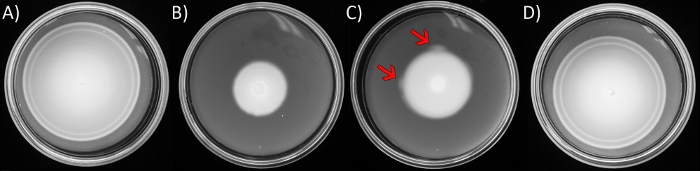
الشكل 1: المقايسات الحركية الناعمة أغار وظهور مشاعل القامع.
لوحات تحتوي على LB صلبة مع 0.3 ٪ ث / الخامس أجار. تم تلقيح سلالات الإشريكية القولونية في وسط كل طبق واحتضانها عند درجة حرارة 30 درجة مئوية لمدة 8 ساعة، باستثناء C، التي تم احتضانها لمدة 16 ساعة (A) الإشريكية القولونية البرية من النوع (AW405). (ب)متغير نقص الحركة ∆yhjH ∆ycgR (JP1442). (ج)كما هو الحال في B، باستثناء فترات حضانة أطول. تشير الأسهم إلى "مشاعل" أسرع تحركا تظهر عند الحلقة الطرفية لمستعمرة السباحة الآخذة في التوسع. (D) القامع معزولة عن مضيئة في C. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
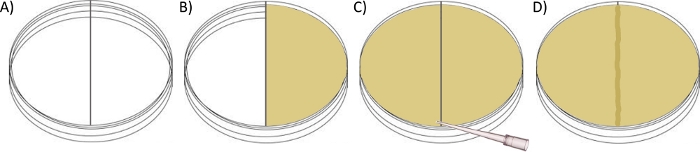
الشكل 2: تخطيطي لإعداد مقايسة لوحة عبور الحدود.
(أ) صب ~ 30 مل من أجار سرب (مع المضادات الحيوية المطلوبة) في الغرفة اليمنى من طبق بتري مقسمة حتى مستوى مع المقسم البلاستيك والسماح لتعيين مع غطاء مغلق. (ب) ملء الغرفة اليسرى مع ~ 30 مل من السباحة أو سرب أجار إلى نقطة الاتصال مع الجزء العلوي من المقسم البلاستيك. (ج) استخدام طرف ماصة معقمة لسحب بلطف أجار سرب المنصهرة عبر الحدود، وبالتالي ربط الجانبين مع جسر أجار طويل القامة ~ 1 ملم والسماح لتعيين مع غطاء مغلق. (د)السماح للوح لتجف أكثر في درجة حرارة الغرفة بين عشية وضحاها قبل تلقيح الغرفة اليسرى مع السلالة المطلوبة، واحتضان في 30 درجة مئوية.
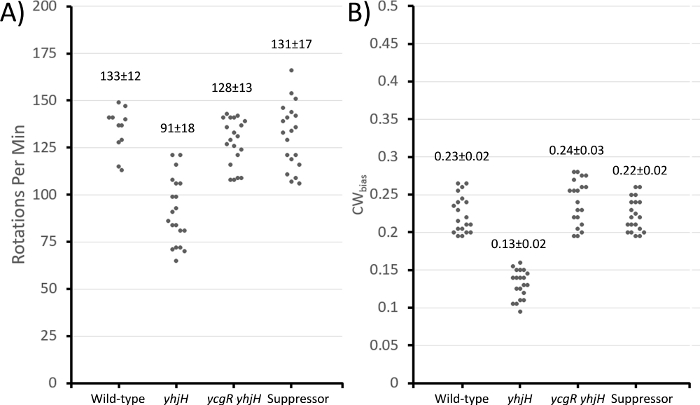
الشكل 3: خصائص المحرك من سلالات مختلفة كما تقاس تقنية الربط الخلية.
نوع البرية (AW405)، ∆yhjH (VN133)، ∆ycgR ∆yhjH (JP1442)، ونما القامع (JP1836) في LB في 30 درجة مئوية إلى منتصف المرحلة الأسية قبل الربط. (أ)دوران في الدقيقة (الانتهاء من 360 درجة يتحول)، و (ب)التحيز CW (جزء من الوقت المحركات تدوير في اتجاه CW). الانحراف المعياري للمؤس (±). لوحظ وجود 20 خلية مربوطة لمدة 60 ثانية في كل سلالة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
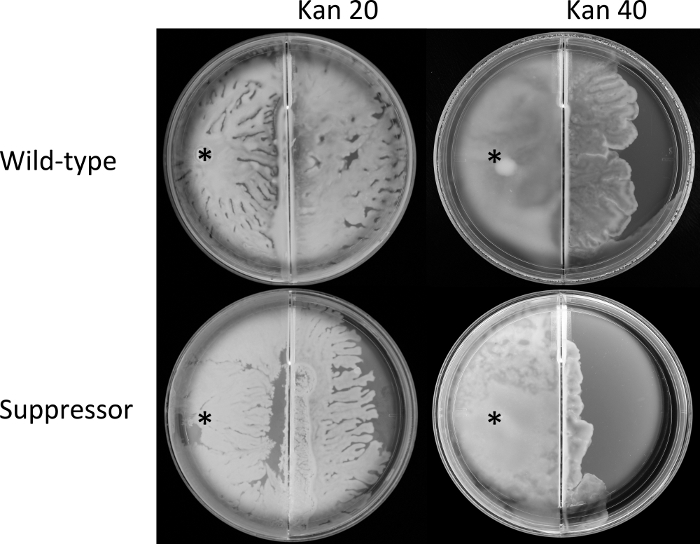
الشكل 4: عمليات الفحص عبر الحدود.
تم تلقيح ثقافات المرحلة المتوسطة الأسية من الإشريكية القولونية البرية (AW405) والمسخ المثبط (JP1836) في الموضع المشار إليه (*) في المقصورة اليسرى من اللوحة المقسمة التي تحتوي على وسائط سرب ، وتم احتضانها عند 30 درجة مئوية. ووصلوا إلى الحدود في أوقات مماثلة. تم احتضان اللوحات لمدة 6 ساعة أخرى ، عبر خلالها السرب إلى الغرفة اليمنى ، حيث تم استكمال الوسائط بالكاناميسين (كان ؛ تشير الأرقام إلى ميكروغرام / مل). لوحات تمثل ثلاث نسخ بيولوجية كل منها نفذت في ثلاثة نسخ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: إعداد شريحة غرفة لربط الخلية. (أ) وضع قطعتين من الشريط على الوجهين قبل (ب) باستخدام شفرة حلاقة لتقليم بعيدا الزائدة. (ج) قشر بعيدا الطبقة العليا لفضح لاصقة قبل (D) لصق غطاء والضغط عليه بلطف في الموقف (المشار إليها من قبل [ ) ، وضمان دفع كل الهواء للخروج من واجهة بين coverslip والشريط أدناه. (E) عينة تحميل (يظهر هنا مع صبغة تحميل الحمض النووي [30٪ v/v جلسيرول, 0.25٪ ث / v بروموفينول الأزرق، و 0.25٪ ث / v xylene سيانول] إضافة إلى التصور المعونة) في الجزء العلوي من القناة التي تم إنشاؤها (السهم) في حين (F) الصيد على تنظيف، ومسح مهمة الأنسجة للمساعدة في رسم الحل من خلال الغرفة كما يمتص النسيج السائل (السهم) في القناة ويوجه من خلال. يرجى الضغط هنا لتحميل هذا الرقم.
فيديو 1: دوران خلايا الإشريكية القولونية المربوطة. الرجاء الضغط هنا لتحميل هذا الفيديو.
فيديو 2: سرب الإشريكية القولونية النشط الذي تم تصويره تحت تكبير 60x ، مما يدل على حركته المميزة الدوامة خلف حافة الجبهة المتحركة. الرجاء الضغط هنا لتحميل هذا الفيديو.
Discussion
وقد ساهم عزل وتوصيف الطفرات القامعة بنجاح في تحديد المكونات الرئيسية لنظام chemotaxis35،36،37، وكذلك الآلات الحركية نفسها38،39،40. 11- ومن المهم، أثناء استخدام البروتوكول 1، إدراج نسخ متماثلة مستقلة متعددة لضمان عزل طيف كبير من الطفرات المحتملة التي يمكن أن تعوض عن فقدان الحركة. زيادة عدد البكتيريا عن طريق streaking الثقافة في خط بدلا من بقعة، يمكن أن تحسن احتمالات توليد القامعات41. عزل نفس الطفرة (كما يحددها تسلسل الحمض النووي) عدة مرات يزيد من الثقة في صحتها. وسوف تكشف WGS دائما عن وجود طفرات أخرى في الجينوم. ولذلك من المهم التحقق من النتائج عن طريق تحويل (حيثما أمكن) الطفرة المحددة مرة أخرى إلى الخلفية الأصلية التي تعاني من نقص الحركة. إن نهج القامع المتحول متجذر في استعادة الوظيفة من خلال طفرة ثانوية ، لذلك فإن أحد قيود هذه الطريقة هو أنه إذا تم حذف جين هيكلي حرج ، أي جين يدعم المسار أو الهيكل بأكمله ، فقد لا يكون هناك مجال للتعويض. على الرغم من كونها طريقة قديمة ، فإن عملنا الأخير34 يوضح فائدته المستمرة في توضيح المسارات الجديدة التي تساهم في الحركة البكتيرية.
بالنسبة للقياس الكمي للناتج الحركي، يبقى نهج ربط الخلايا أداة يمكن الوصول إليها عالميا وتتطلب مجهرا فقط مزودا بمرفق كاميرا. وقد تم بالفعل استخدام ربط الخلايا في عدد متنوع من الأنواع البكتيرية بما في ذلك السالمونيلا42، Pseudomonas43، المكورات العقدية44، ورودوباكتر33. ويتوقف نجاح البروتوكول إلى حد كبير على القص السليم وتعلق الخلايا. القص بقوة كبيرة جدا أو حذف وقفة بين المقصات (2.1.5) يميل إلى تعزيز القص غير متناسقة أو غير مكتملة من خيوط، مما أدى إلى خلايا غير متحركة أو الخلايا المربوطة على محور منحرف. ولا تزال الأهمية الدائمة لهذا البروتوكول قائمة، على الرغم من اعتماد العديد من مجموعات البحوث (بما في ذلك مجموعتنا) لمقاايسة الخرز ذات القرار الأعلى. يأتي القيد الأساسي لمقايسة الخرز من الحاجة إلى التزام الخرز بخيوط البكتيريا ذات الاهتمام. وقد استفادت هذه التقنية إلى حد كبير من الدراسات في القولونية E. التي حددت أليل flagellin 'لزجة', مما يسهل الالتزام45. البديل لزجة متفوقة أيضا في المقايسة ربط الخلية. هذا البديل غير متوفر حتى الآن لغالبية البكتيريا ذات اللوهن. الوضع أكثر تعقيدا مع بعض الكائنات الحية تمتلك بروتينات متعددة flagellin46، وفي حالة Vibrio sp.، تمتلك أيضا غمد47. كما يمكن إجراء ربط الخلايا باستخدام الأجسام المضادة للراية الخاصة بالأنواع أو الأجسام المضادة لعلامة epitope المهندسة.
في حين أن البكتيريا يمكن أن تسبح مباشرة عند إدخالها في وسط سائل ، فإن هذا لا ينطبق على الازدهاب ، حيث يجب إعداد الخلايا لأول مرة في حالة يحتشدون. الاتصال السطحي يؤدي إلى تغيير الفسيولوجية المطلوبة للخلايا لبدء يحتشدون48,49,50,51, مما أدى إلى مرحلة تأخر وتراكم كثافة الخلايا العالية. وتشمل التغيرات الفسيولوجية إعادة عرض نظام chemotaxis في E. coli16، والتكيفات مثل استطالة الخلية و / أو فرط التضخم للبكتيريا الأخرى13،14،21. وبالنظر إلى التغيرات الفسيولوجية المطلوبة لبدء يحتشدون، ونحن ضرب مذكرة تحذيرية حول الدراسات التي حاولت تقليد جوانب مختارة من يحتشدون - مثل الكثافة العالية أو زيادة طول الخلية - ببساطة عن طريق تركيز ثقافات الخلايا العوالق لزيادة الكثافة، و / أو تحفيز استطالة الخلية باستخدام المضادات الحيوية التي تمنع انقسام الخلية52،53. إذا كان استخدام استطالة الخلية كعلامة، ونحن نحذر أيضا أنه بالمقارنة مع الخلايا العوالق، هناك زيادة هامشية فقط في متوسط طول خلايا سربر في السالمونيلا أو E. القولونية54. من الصعب إثبات فحوصات السرب من فحوصات السباحة. وتشمل المتغيرات المصدر التجاري للأجار المستخدمة لترسيخ وسائل الإعلام (خاصة ايكن أجار ضروري لحشد في القولونية E.، في حين أن أكثر القياسية Difco أجار يدعم يحتشدون لجميع البكتيريا الأخرى) ، واستخدام وسائل الإعلام الغنية مقابل الحد الأدنى(E. القولونية والسالمونيلا تتطلبمكملاتالجلوكوز) ، والرطوبة المحيطة الأكثر حرجا 2،13،14،21. من هذه، والحفاظ على الرطوبة المثلى يمكن أن يكون الأكثر إحباطا. [ممتازة ومنهجية ، والتحسين لحشد في كائن حي من اختيار (Pseudomonas aeruginosa)وقد ثبت موراليس سوتو وزملاء العمل55.] يجب أن تكون وسائل الإعلام سرب رطبة بما فيه الكفاية لتعزيز يحتشدون ولكن ليس رطبة بحيث تسمح للانتشار السلبي / انزلاق، والتي يمكن أن يكون مخطئا بسهولة لحشد نشط56. لذلك من الأهمية بمكان أن يتم فحص أسراب تحت المجهر لتأكيد أنماط متميزة من الحركة المرتبطة بهذه الحركة الجماعية(فيديو 2). درجة الحرارة هي أيضا اعتبار مهم لتحسين المقايسة يحتشدون. ارتفاع درجات الحرارة، على سبيل المثال 37 درجة مئوية، سوف تجف لوحات في وقت أقرب مما كانت عليه في 30 درجة مئوية. يمكن أن يساعد استخدام حاضنة مع التحكم في الرطوبة (~70-80٪) في التخفيف من هذه المشكلات، بما في ذلك التغيرات الموسمية التي يمكن أن تؤثر على درجات حرارة المباني الداخلية والرطوبة. بمجرد تأسيسها بنجاح ، يوفر البروتوكول 3 طريقة قوية للتحقيق في أحد الجوانب الأكثر إثارة للاهتمام من البكتيريا المحتشدة ، والمقاومة المرتفعة للمضادات الحيوية17. يمكن تطبيق جميع البروتوكولات الموصوفة هنا على الكائنات الحية الجديدة لتحديد المسارات التي تحدد وتتحكم في الحركة بوساطة flagella.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد دعم هذا العمل منحة المعاهد الوطنية للصحة GM118085، وجزؤا من مؤسسة روبرت ويلش (منحة F-1811 إلى R.M.H.).
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Bacto Dehydrated Agar | Fisher Scientific | DF0140-15-4 | |
| EDTA Disodium Salt, Dihydrate | Fisher Scientific | 02-002-786 | |
| Eiken agar | Eiken Chemical Co. Japan | E-MJ00 | Essential for E. coli swarming |
| Glucose D (+) | Fisher Scientific | 410955000 | |
| LB (Lennox) Broth | Fisher Scientific | BP1427-500 | |
| Poly-L-lysine Solution (0.1%) | Sigma-Aldrich | P8920 | |
| Potassium chloride (KCl) | Fisher Scientific | 18-605-496 | |
| Potassium Phosphate monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Potassium Phosphate dibasic (K2HPO4) | Fisher Scientific | BP363-500 | |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | |
| Materials and Equipment | |||
| CellSense microscope imaging software (V. 1.6) | Olympus | Or equivalent software for microscope used | |
| Electron Microscopy Sciences Scotch 666 Doube Sided Tape | Fisher | 50-285-28 | |
| Frosted microscope slides 3x1x1mm | Fisher | 12-550-343 | |
| Olympus BX53 microscope | Olympus | BX53 | Any upright or inverted phase microscope can be used |
| Petri dishes (100 mm diameter) | Fisher Scientific | FB0875712 | For soft-agar assays |
| Polyethylene Nebulizer Capillary Tubing (0.58mm x 99mm 3.0m) | Perkin Elmer | 9908265 | |
| Round Petri Dish with 2 Compartments | VWR | 89200-944 | For border-crossing assays |
| Safety Hypodermic Needles (23G) | Fisher Scientific | 14-826A | |
| Sterile Syringe - 1 mL | Fisher scientific | 14-955-450 | |
| Task/Tissue wipes | Fisher scientific | 06-666 | Or equivalent single use tissue wipes |
| VWR micro cover-glass 18x18mm | VWR | 48366205 | |
| XM10 camera | Olympus | XM10 | Or equivalent microscope camera |
References
- Jarrell, K. F., McBride, M. J. The surprisingly diverse ways that prokaryotes move. Nature Reviews in Microbiology. 6 (6), 466-476 (2008).
- Harshey, R. M. Bacterial motility on a surface: many ways to a common goal. Annual Reviews Microbiology. 57, 249-273 (2003).
- Duan, Q., Zhou, M., Zhu, L., Zhu, G. Flagella and bacterial pathogenicity. Journal of Basic Microbiology. 53 (1), 1-8 (2013).
- Nakamura, S., Minamino, T. Flagella-Driven Motility of Bacteria. Biomolecules. 9 (7), (2019).
- Haiko, J., Westerlund-Wikstrom, B. The role of the bacterial flagellum in adhesion and virulence. Biology (Basel). 2 (4), 1242-1267 (2013).
- Berg, H. C. . E. coli in Motion. 1 edn. , (2004).
- Berg, H. C. The rotary motor of bacterial flagella. Annual Review of Biochemistry. 72, 19-54 (2003).
- Xing, J., Bai, F., Berry, R., Oster, G. Torque-speed relationship of the bacterial flagellar motor. Proceedings of the National Academy of Sciences U. S. A. 103 (5), 1260-1265 (2006).
- Chen, X., Berg, H. C. Torque-speed relationship of the flagellar rotary motor of Escherichia coli. Biophysics Journal. 78 (2), 1036-1041 (2000).
- Turner, L., Ryu, W. S., Berg, H. C. Real-time imaging of fluorescent flagellar filaments. Journal of Bacteriology. 182 (10), 2793-2801 (2000).
- Brown, M. T., Delalez, N. J., Armitage, J. P. Protein dynamics and mechanisms controlling the rotational behaviour of the bacterial flagellar motor. Current Opinion in Microbiology. 14 (6), 734-740 (2011).
- Parkinson, J. S., Hazelbauer, G. L., Falke, J. J. Signaling and sensory adaptation in Escherichia coli chemoreceptors: 2015 update. Trends in Microbiology. 23 (5), 257-266 (2015).
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews Microbiology. 8 (9), 634-644 (2010).
- Harshey, R. M., Partridge, J. D. Shelter in a Swarm. Journal of Molecular Biology. 427 (23), 3683-3694 (2015).
- Ariel, G., et al. Swarming bacteria migrate by Levy Walk. Nature Communications. 6, 8396 (2015).
- Partridge, J. D., Nhu, N. T. Q., Dufour, Y. S., Harshey, R. M. Escherichia coli Remodels the Chemotaxis Pathway for Swarming. mBio. 10 (2), (2019).
- Butler, M. T., Wang, Q., Harshey, R. M. Cell density and mobility protect swarming bacteria against antibiotics. Proceedings of the National Academy of Science U. S. A. 107 (8), 3776-3781 (2010).
- Mobley, H. L., Belas, R. Swarming and pathogenicity of Proteus mirabilis in the urinary tract. Trends in Microbiology. 3 (7), 280-284 (1995).
- Burall, L. S., et al. Proteus mirabilis genes that contribute to pathogenesis of urinary tract infection: identification of 25 signature-tagged mutants attenuated at least 100-fold. Infections and Immunity. 72 (5), 2922-2938 (2004).
- Mazzantini, D., et al. FlhF Is Required for Swarming Motility and Full Pathogenicity of Bacillus cereus. Frontiers in Microbiology. 7, 1644 (2016).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. Journal of Bacteriology. 195 (5), 909-918 (2013).
- Yuan, J., Berg, H. C. Resurrection of the flagellar rotary motor near zero load. Proceedings of the National Academy of Science U. S. A. 105 (4), 1182-1185 (2008).
- Yuan, J., Fahrner, K. A., Berg, H. C. Switching of the bacterial flagellar motor near zero load. Journal of Molecular Biology. 390 (3), 394-400 (2009).
- Terasawa, S., et al. Coordinated reversal of flagellar motors on a single Escherichia coli cell. Biophysics Journal. 100 (9), 2193-2200 (2011).
- Nord, A. L., Sowa, Y., Steel, B. C., Lo, C. J., Berry, R. M. Speed of the bacterial flagellar motor near zero load depends on the number of stator units. Proceedings of the National Academy of Science. 114 (44), 11603-11608 (2017).
- Block, S. M., Segall, J. E., Berg, H. C. Adaptation kinetics in bacterial chemotaxis. J Bacteriol. 154 (1), 312-323 (1983).
- Segall, J. E., Block, S. M., Berg, H. C. Temporal comparisons in bacterial chemotaxis. Proceedings of the National Academy of Science U. S. A. 83 (23), 8987-8991 (1986).
- Wolfe, A. J., Conley, M. P., Kramer, T. J., Berg, H. C. Reconstitution of signaling in bacterial chemotaxis. Journal of Bacteriology. 169 (5), 1878-1885 (1987).
- Blair, D. F., Berg, H. C. Restoration of torque in defective flagellar motors. Science. 242 (4886), 1678-1681 (1988).
- Parkinson, J. S. A "bucket of light" for viewing bacterial colonies in soft agar. Methods Enzymol. 423, 432-435 (2007).
- Adler, J. Chemotaxis in bacteria. Science. 153 (3737), 708-716 (1966).
- Wolfe, A. J., Berg, H. C. Migration of bacteria in semisolid agar. Proceedings of the National Academy of Science U. S. A. 86 (18), 6973-6977 (1989).
- Kojadinovic, M., Sirinelli, A., Wadhams, G. H., Armitage, J. P. New motion analysis system for characterization of the chemosensory response kinetics of Rhodobacter sphaeroides under different growth conditions. Applied and Environmental Microbiology. 77 (12), 4082-4088 (2011).
- Nieto, V., et al. Under Elevated c-di-GMP in Escherichia coli, YcgR Alters Flagellar Motor Bias and Speed Sequentially, with Additional Negative Control of the Flagellar Regulon via the Adaptor Protein RssB. Journal of Bacteriology. 202 (1), (2019).
- Parkinson, J. S., Parker, S. R., Talbert, P. B., Houts, S. E. Interactions between chemotaxis genes and flagellar genes in Escherichia coli. Journal of Bacteriology. 155 (1), 265-274 (1983).
- Roman, S. J., Meyers, M., Volz, K., Matsumura, P. A chemotactic signaling surface on CheY defined by suppressors of flagellar switch mutations. Journal of Bacteriology. 174 (19), 6247-6255 (1992).
- Sanna, M. G., Simon, M. I. Isolation and in vitro characterization of CheZ suppressors for the Escherichia coli chemotactic response regulator mutant CheYN23D. Journal of Biological Chemistry. 271 (13), 7357-7361 (1996).
- Sockett, H., Yamaguchi, S., Kihara, M., Irikura, V. M., Macnab, R. M. Molecular analysis of the flagellar switch protein FliM of Salmonella typhimurium. Journal of Bacteriology. 174 (3), 793-806 (1992).
- Irikura, V. M., Kihara, M., Yamaguchi, S., Sockett, H., Macnab, R. M. Salmonella typhimurium fliG and fliN mutations causing defects in assembly, rotation, and switching of the flagellar motor. Journal of Bacteriology. 175 (3), 802-810 (1993).
- Ishida, T., et al. Sodium-powered stators of the bacterial flagellar motor can generate torque in the presence of phenamil with mutations near the peptidoglycan-binding region. Molecular Microbiology. 111 (6), 1689-1699 (2019).
- Barker, C. S., Meshcheryakova, I. V., Kostyukova, A. S., Samatey, F. A. FliO regulation of FliP in the formation of the Salmonella enterica flagellum. PLoS Genetics. 6 (9), 1001143 (2010).
- Paul, K., Nieto, V., Carlquist, W. C., Blair, D. F., Harshey, R. M. The c-di-GMP binding protein YcgR controls flagellar motor direction and speed to affect chemotaxis by a "backstop brake" mechanism. Molecular Cell. 38 (1), 128-139 (2010).
- Qian, C., Wong, C. C., Swarup, S., Chiam, K. H. Bacterial tethering analysis reveals a "run-reverse-turn" mechanism for Pseudomonas species motility. Applied and Environmental Microbiology. 79 (15), 4734-4743 (2013).
- Manson, M. D., Tedesco, P. M., Berg, H. C. Energetics of flagellar rotation in bacteria. Journal of Molecular Biology. 138 (3), 541-561 (1980).
- Kuwajima, G. Construction of a minimum-size functional flagellin of Escherichia coli. Journal of Bacteriology. 170 (7), 3305-3309 (1988).
- Kuhn, M. J., et al. Spatial arrangement of several flagellins within bacterial flagella improves motility in different environments. Nature Communication. 9 (1), 5369 (2018).
- Hranitzky, K. W., Mulholland, A., Larson, A. D., Eubanks, E. R., Hart, L. T. Characterization of a flagellar sheath protein of Vibrio cholerae. Infections and Immun. 27 (2), 597-603 (1980).
- Wang, Q., Frye, J. G., McClelland, M., Harshey, R. M. Gene expression patterns during swarming in Salmonella typhimurium: genes specific to surface growth and putative new motility and pathogenicity genes. Molecular Microbiology. 52 (1), 169-187 (2004).
- Gode-Potratz, C. J., Kustusch, R. J., Breheny, P. J., Weiss, D. S., McCarter, L. L. Surface sensing in Vibrio parahaemolyticus triggers a programme of gene expression that promotes colonization and virulence. Molecular Microbiology. 79 (1), 240-263 (2011).
- McCarter, L., Silverman, M. Surface-induced swarmer cell differentiation of Vibrio parahaemolyticus. Molecular Microbiology. 4 (7), 1057-1062 (1990).
- Pearson, M. M., Rasko, D. A., Smith, S. N., Mobley, H. L. Transcriptome of swarming Proteus mirabilis. Infections and Immunity. 78 (6), 2834-2845 (2010).
- Swiecicki, J. M., Sliusarenko, O., Weibel, D. B. From swimming to swarming: Escherichia coli cell motility in two-dimensions. Integrative Biology (Cambridge). 5 (12), 1490-1494 (2013).
- Colin, R., Drescher, K., Sourjik, V. Chemotactic behaviour of Escherichia coli at high cell density. Nature Communication. 10 (1), 5329 (2019).
- Partridge, J. D., Harshey, R. M. More than motility: Salmonella flagella contribute to overriding friction and facilitating colony hydration during swarming. Journal Bacteriology. 195 (5), 919-929 (2013).
- Morales-Soto, N., et al. Preparation, imaging, and quantification of bacterial surface motility assays. Journal Visualized Experiment. (98), e52338 (2015).
- Chawla, R., Ford, K. M., Lele, P. P. Torque, but not FliL, regulates mechanosensitive flagellar motor-function. Science Reports. 7 (1), 5565 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved