Method Article
シリーズで3つの確立された技術を適用することにより 、大腸菌 におけるフラゲラ駆動運動性の調査
要約
多くの細菌は、彼らの環境をナビゲートし、個々と集団の両方として有利な環境を植民地化するために、フラゲラ駆動の運動性を使用しています。ここでは、水泳や群れの運動に寄与する成分/経路を特定するための選択ツールとして運動性を利用する3つの確立された方法の使用を実証しています。
要約
運動性は、多くの細菌種の生存と成功に不可欠です。運動性を利用して信号経路を理解し、フラネラ部の機能と組み立てを解明し、運動パターンを調べ、理解するために多くの方法論が存在する。ここでは、これらの方法の3つの組み合わせを示します。柔らかい寒天の運動性は最も古く、運動性障害のある株の機能利得抑制性突然変異を分離するための強力な選択を提供し、運動性は第2の突然変異によって回復する。細胞テザリング技術は、最初に、フラグラーモータの回転性を実証するために使用され、モータ速度および回転方向を切り替える能力に対するシグナルエフェクタの影響を評価するために使用することができる。「国境を越える」アッセイは、水泳細菌が群れとして集団的に移動する準備ができる、より最近のものです。これらのプロトコルは、運動機械の構成要素を特定し、水泳や群れの異なる側面におけるその役割を特徴付けるための体系的かつ強力なアプローチを表しています。それらは他の細菌種の運動性を研究するために容易に合わせることができる。
概要
細菌は、その生態学的ニッチに移動と分散のための多くの付属物を採用しています1.これらの中で最も速いのが、環境信号に応答して好ましいロケールの植民地化を促進し、いくつかの種2,3の病原性能力に大きく寄与する。バネラ菌は、バルク液体で個別に泳ぐか、半固体表面4の上に集団として群がることができます。細胞外のフラグラは膜に埋め込まれた回転モーターによって取り付けられて駆動され、イオン勾配の力を利用して回転1、2、4、5、6、7、8を引き起こすトルクを発生させる。モーターが一定のトルク9で動く大腸菌では、モーター出力は回転速度と回転子の反時計回り(CCW)方向と時計回り(CW)方向の切り替えの観点から分類することができる。CCW回転は、セルを前方に推進するコヒーレント・フラネラ・バンドルの形成を促進し(CW)、一時的な回転方向スイッチ(CW)を行うと、バンドルは部分的または完全に10個を分解し、細胞は泳方向(タンブル)を再び向きにします。大腸菌は通常1秒間走り、10分の1秒は転倒する。ロータまたは「タンブルバイアス」のスイッチング周波数は、化学運動体信号システムによって制御され、膜貫通化学受容体は外部の化学信号を検出し、リンベレーを介してフラゲラモーターに伝達し、誘引物質に応答してランを延長するか、または有毒化学物質11、12に応答してそれらを抑制する。水泳運動は0.3%柔らかい寒天でアッセイされます。
群れの間、細菌は半固体表面を密な集団として移動し、連続渦巻き運動2、13、14、15の中で細菌のパックが流れる。大腸菌群は、変化した化学感覚生理学(低タンブルバイアス)、より高速、およびバルク液体16、17で泳ぐ細胞に対する抗菌性に対する耐性の高さを示す。スウォーマーは、界面活性剤の生産、ハイパーフラフェレーション、細胞伸長2を含む、運動を助ける多くの戦略の展開において異なる。群れは、細菌に生態学的および臨床的な設定18、19、20の両方で競争上の優位性を提供しています。群れの細菌には、0.5-0.8%寒天で固められた媒体でのみ群がることができる温帯スウォーマーと、より高い寒天濃度21を横切ってナビゲートできる堅牢なスウォーマーの2つのカテゴリーがあります。
水泳の運動性とその規制を尋問するために様々なアッセイが存在します。突然変異や環境条件によって障害を受けた場合、運動性自体は、機能の得るサプレッサー突然変異を同定するための強力な選択を提供する。これらのサプレッサーは、元の突然変異の本物の復帰剤、または第2の突然変異が機能を回復する疑似戻し物である可能性があります。このような変異体は全ゲノムシーケンシング(WGS)によって同定することができる。非バイアスサプレッサー選択の代替は、偏った標的突然変異誘発戦略(例えば、PCR変異生成)である。これらの方法論は、多くの場合、運動装置の機能または環境調節に光を当てる。モータ機能を研究することが目標である場合、軟寒天で測定された野生型運動性の回復は、必ずしも野生型モーター出力の回復を示すものではない。細胞テザリングアッセイは、細胞が単一の旗臼によってガラス表面に結合され、その後、細胞体の回転が監視される、運動行動を評価するための最初のアッセイであり得る。モーターの特性を監視するためにより高度な方法論が利用可能になりましたが、モーション分析のためのソフトウェアパッケージの必要な高速カメラのセットアップと適用は、その広範な使用を制限します22,23,24,25.細胞テザリングアッセイは、フラゲラをせき止めることだけを必要とし、短いフィラメントをガラススライドに取り付けることができ、続いて細胞体の回転をビデオ撮影する。このアッセイでは、細胞体がフラゲラムにかかる負荷が高いため、記録されたモータ速度は低いが、このアッセイは、化学戦術応答26、27、28、29に関する貴重な洞察に寄与しており、以下で説明するように有効な調査ツールのままである。
群れの運動性は、研究者にとって異なる課題をもたらします。機能向上抑制剤の選択は、豊富な界面活性剤を生成し、容易に13を群がって生じるスウォーマーでのみ機能する。大腸菌のような界面活性剤非生産者は、寒天、培地組成及び環境2、13、14、21の湿度の選択に対して潔癖性である。群れの状態が確立されると、国境を越えるアッセイ17は、群れが新しい/過酷な条件をナビゲートする能力を尋問するのに有用な方法論です。以下に示すプロトコルは大腸菌に関連していますが、他の種での適用に容易に適応することができます。
プロトコル
1. 運動不足株におけるサプレッサー変異体の分離
注: この方法を広範な「キャッチオール」として使用して、運動性欠陥の一般的な性質を特定してください。
- ソフト寒天プレートの準備
注:軟寒天は、運動性または水泳寒天とも呼ばれ、低パーセンテージ寒天(〜0.2-0.35%w/v)であり、長い間気胸31,32をアッセイするために使用される。- 2 Lラウンドボトムフラスコにバクト寒天(0.3%w/v)とLB20gを加えます。フラスコに1LのddH2O(二重蒸留水)を加え、攪拌棒と磁気攪拌板を使用して懸濁液を均等に混合します。
- 121 °Cで20分間オートクレーブ。
- 上記のようにロッド/プレートを使用して穏やかな攪拌で冷却することができます。温度が約50°Cに達したら、滅菌ペトリ皿(100mm x 15mm)に25mLを注ぎ、溶融寒天を16時間以内に蓋を少なくとも1時間所定の位置にセットします。
- 培養製剤、接種、およびサプレッサー変異体の単離
注:柔らかい寒天で固まった栄養豊富な培地の中心に接種された 大腸菌 は、栄養素を局所的に消費し、彼らが従う栄養勾配を作り出します。彼らが外側に移動すると、定義された「リング」が現れ(図1A)、これは細菌が反応する特定の化学誘引物質に関連している。このアッセイでは、気化システムまたは構造成分の欠陥が性能を損なう可能性があります。多くの場合、運動性優位を有する変異体はスクリーニング中に生じ、環の周囲に沿った単一または複数の点から出現し、そこから「フレア」アウト(図1C)を見ることができる。一つは、水泳の前線の最も外側の端は、植民地化されていない処女柔らかい寒天と対比容易に気づくでしょう。- レノックスブロスの5 mLで所望の運動欠乏株の一晩培養を成長させます (LB; 10 g/L トリプトン, 5 g/L酵母エキス, 5 g/L NaCl, 材料表) 水平振幅を有する 30 °Cで (220 r.p..m.).翌日、亜培養(1:100希釈)を新鮮なLBで、同じ条件下で指数相(OD600 0.6)に成長する。
- 培養液の6μLをピペットを用いて柔らかい寒天プレート(1.1)の中央に接種し、ロードされた無菌チップを寒天に押し込んで内容物を静かに排出します。30°Cに移し、インキュベート(図1B)、運動性'フレア'が明らかになるまで、運動環の接種点または周辺から発せられる、典型的には24〜36時間(図1C)。
注:運動性アッセイでは、変異体分離物と一緒に野生型株を接種して比較します。この野生型株は特徴的な同心円式化学式の環(図1A)を示し、8-10時間内にプレートを充填します。 - 滅菌ワイヤーループを使用して「フレア」領域から細胞を持ち上げ、ストリークして単一コロニーをLB硬寒天プレート(上記のように調製したLB、15 g/Lバクト寒天で固化)に精製します。
- 滅菌ワイヤーループを使用してストリークプレートから単一のコロニーを選び、「純粋な」コロニー分離を確実にするために単一のコロニーのためにストリークすることによって再精製します。
- サプレッサー変異体の確認と特性評価
- 分離されたサプレッサー変異体が運動性を回復したことを確認する。軟寒天プレート(1.1)、および野生型と比較のための開始「運動不足」株を含む、関心のある株(1.2.1のように)のための培養を準備します。
- プレート(1.2.2のように)を接種し、30°Cで8〜10時間インキュベートします。
- 最も外側のリング(円の縁)の直径を記録し、どの分離株が運動性を実質的に回復させているかを確立するために比較する。
メモ:実験の時間を通してプレートを撮影することをお勧めします。最良の結果を得るためには、デジタルカメラを光源の上に取り付けて、泳ぐコロニーの直径を測定し、非植民地化された寒天と区別する「光のバケツ」装置30を使用する。 - 被験者は必要に応じてWGSに隔離し、野生型の機能を回復した突然変異を肯定的に同定するのに十分な「シーケンスカバレッジ」を可能にする。
2. 細胞テザリングによるフラゲラ運動の挙動を定量化する
注: 通常のランタンブル動作(chemotaxis)が危険にさらされていると思われる場合は、この方法を使用します。
-
培養準備とフラゲラせん断
- ステップ 1.2.1 で説明したように、対象株の指数位相培養を準備します。
- ペレット 10 mL の細胞は、フィルター滅菌された運動バッファー (MB; 10 mM リン酸カリウムバッファー [0.0935 M K2HPO4,0.0065 M KH2PO4,pH 7.0] , 0.1 mM EDTA [pH 7.0] , 10 mM NaCl, 75 mM KCl.
注:MBは 運動性を サポートしていますが、細菌の増殖をサポートしていません - ステップ 2.1.2 を 2 回繰り返してから、最終ペレットを 1 mL の MB で再懸濁します。
- 細胞懸濁液を1mLのシリンジに移し、23G針を最後に取り付けます。同一の注射器/針装置を組み立て、各針先にしっかりと覆ったポリエチレンチューブ(0.58mmの内径)の6インチを介して2つを一緒に取り付けます。
- 1つのシリンジから他の50倍に細胞懸濁液をゆっくりと前後に渡し、10パスごとに1分の休止を行うことによって、フラゲラ(壊れやすく、簡単に壊れる)を剪断します。
- 2,000 x g で 3 分間の皮を遠心し、500 μL の最終体積で再中断します。
-
スライド調製および細胞テザリング
- 18 mm x 18 mm のカバースリップを 3 インチ x 1 インチ x 1 mm ガラス顕微鏡スライド上に積み重ねて、両面テープで区切ってセル固定チャンバーを準備します (図 S1)。
- チャンバーの上部に塗布することで、0.01%(w/v)ポリリジン溶液でチャンバを洗い流します。下端(顕微鏡スライドでカバースリップをフラッシュ)をタスクワイパー(ティッシュペーパー)に傾け、チャンバー(図S1)を通して溶液を引き出すのに役立ちます。その後、室温で10分間インキュベートします。
- ステップ2.2.2で説明したように使用して、40 μLのMBでチャンバーを3回洗浄します。
- チャンバーの上部に40μLの皮分セル懸濁液(上記を用意)を加え、室温で10分間インキュベートし、細胞をカバースリップに取り付けることができます。
- 2.2.3のように40 μLのMBでチャンバーを静かに洗い流し、未接続の細胞を取り除きます。
-
細胞回転記録と定量
- つながれた細胞を積んだ顕微鏡のスライドを顕微鏡の段階に移す。
- 位相対面顕微鏡と100xの目的を用いて、所定の位置に固定された細胞の母集団をスキャンし、単一軸上で回転する、すなわち、細胞が焦点の出入りする角度で提示するのではなく、固定点で滑らかな回転を行う(ビデオ1)。
- 市販の顕微鏡と関連するカメラを使用してください。関連するソフトウェアを開き、対象のセルがフォーカスされていることを確認し、 ビデオ取得 をクリックしてセルの回転を1分間記録します(10フレーム/秒以上)。
- ビデオ再生から、1 分あたりの完全な回転数と、セルの方向 (スイッチング周波数) の変化回数を数値化します。
注:回転速度とスイッチング周波数は目で測定するには速すぎる可能性があるため、低速/細かい再生を提供するビデオソフトウェアを使用するか、自動ソフトウェアシステムを採用して回転パターン33を定量化することをお勧めします。代替手段としては、メチルセルロース(または同様の薬剤)を使用してMBの粘度を上げ、より速い細菌の回転を遅くして解決したり、フレームレートの低いカメラが使用中の場合に補償したりすることです。 - 生物学的複製でステップ2.3.2を繰り返し、対象の集団の表現をまとめます。
3. 国境を越えるアッセイにおける群れの準備
注: この方法は、グループ運動性に対する突然変異または条件の影響を評価するために使用します。群寒天とは、一般的に、割合が柔寒天よりも高い寒天を指します。柔らかい寒天(0.3%)では、細胞は寒天の中で個別に泳ぎます。群寒天(0.5%以上)では、細胞は表面上のグループとして移動します。群れプレートはここで詳細に使用する必要がありますが、スイムプレートは貯蔵寿命が長く、数日間使用することができます。私たちの個人的な好みは、1-2日で使用することにあります。
-
群寒天の準備
- 2 Lラウンドボトムフラスコにエイケン寒天5g(0.5%w/v)とLB20gを加えます。フラスコに1LのddH2Oを加え、攪拌棒と磁気攪拌板を使用して懸濁液を均等に混合します。
- 121 °Cで20分間オートクレーブ。
- 上記のようにロッド/プレートを使用して気泡を避けるために穏やかな攪拌で冷却することができます。約50°Cの場合、フィルター滅菌されたグルコースを加え、最終濃度の0.5%を得ます。
- 滅菌ペトリ皿(100ミリメートルx 15ミリメートル)に25 mLを注ぎ、少なくとも14時間と20時間以下の室温で設定することができます。今後の使用のために保管しないでください。
-
群板の接種とインキュベーション
- 寒天の上にスポッティングして、中指数培養物(1.2のように調製)の6μLを接種します。
- 蓋を5~10分間は切り、接種物が寒天表面に乾燥したら交換してください。
- 30°Cで8時間インキュベートする。これは寒天の乾燥に寄与し、群れを損なうため、蓋を取り除くことによって群れの進行状況を検査する誘惑を避けてください。
注:インキュベーション時間は、歪み表現型によって異なる場合があります。いくつかの孤立した突然変異は、群れの能力を妨げる可能性があり、寒天の減少率またはインキュベーションのより長い期間を必要とします。
-
国境通過アッセイプレートの準備
注:このアッセイは、プラスチック製の分割(境界)が1つではなく2つのチャンバーを作成する修正されたペトリ皿を利用しています(図2A)。各チャンバーは、2つを「接続」する前に、群れのための異なる条件を提供し、他の独立して準備することができます。実験計画に応じて、第1室(左指定)は、スイム寒天(0.3%w/v)または群寒天(0.5%w/v)のいずれかで調製することができ、そこから細菌は境界を越えて群れの寒天を含む右の部屋に移動することができます+/-必要なサプリメントまたは挑戦(例えば、抗生物質)。いずれの寒天の移動も、通常、接種の元の点から細菌コロニー形成(エッジからエッジ)の最も広い直径を記録することによって測定/比較される。- 必要に応じて、1.1 に記載されているように、スイム寒天を準備します。
- 3.1 で説明したように、群れの寒天を準備します。
- 〜30 mLの群れ寒天(必要に応じて必要な補充)を、二重コンパートメントペトリ皿(100mm x 15 mm)の右室に注ぎ、チャンバー間のプラスチック仕切りでレベルが高いが、左側にあふれていないところまで(図2B)。
- 寒天が固まった後、左室を泳ぐか、または群れの寒天の30mLで満たし、再びプラスチックの分裂と接触するところまで(図2C)。設定する前に、滅菌ピペットチップを使用して、境界線上で寒天をそっとドラッグして、両側を、分割の全長にまたがる約1mmの高さの寒天橋と接続します(図2D)。
- プレートを室温(3.1)で乾燥させます。
注:ブリッジを作成する別の方法は、左チャンバー寒天を乾燥させ、2つのチャンバー(3.4)を橋渡しするためにプラスチック製の仕切りに沿って溶融群寒天のピペット〜100 μLをゆっくりと可能にすることです(3.4)。泳ぐ(1.2.2)または群れ(3.2)寒天のために上記の詳述通り、12-16時間、または群れが右のチャンバー上で十分に進行するまで、左のチャンバーのプレートを接種して、関心のある株の比較を可能にします。
結果
高レベルのシグナル伝達分子c-di-GMPによって運動性が損なわれる大腸菌株における擬似復帰物質の単離は、我々の研究室34からの最近の研究で詳述された。この株(JP1442)は、ΔyhjHとΔycgRの2つの突然変異を抱えた。YhjHは、大腸菌のc-di-GMPを分解する最も活性なホスホジエステラーゼである。YhjHの不在は、上昇したc-di-GMPレベルと運動性の阻害につながります.YcgRはc-di-GMPエフェクターです。C-di-GMPとの複合体では、YcgRは最初にCCWモータ回転を誘導し、その後モータ速度を低下させるために、フラゲラローターに結合する。細胞テザリングおよびビーズアッセイは、二重変異体において運動行動が正常に戻ることを示したが、軟寒天では運動性は34ではなかった。そこで、プロトコルのステップ1を展開して、二重変異体内の疑似復帰フレアを分離しました(図1C)。WGS(HiSeq 4000プラットフォーム、PE 2 x 150セットアップ34)によってマッピングされた突然変異の大部分はrssBに、これは通常ClpXPプロテアーゼに分解34の標的σ Sを指示する応答調節因子/アダプタータンパク質をコードする。野生型に近い運動性を示すこれらの復帰剤の1つ(AW405、図1A,Dを比較)は、その二重変異親(図1B)と等元性野生型株の両方を制御として使用して、プロトコルセクションのステップ2および3の代表的な結果を生成するために使用された(図1A)。
プロトコルセクションのステップ 2 では、ビデオ キャプチャを分析して 1 分あたりの回転数 (360° 回転) と CWバイアス(時間モーターが CW 方向に回転する割合、またはタンブル バイアス) を計算しました。ΔyjHは、予想通り、野生型に比べて1分あたりの回転数が少なく、CWバイアスが低かった(図3)。ΔyhH ΔycgR二重変異体及びそのサプレッサーはいずれも、野生型と同様の運動挙動を示し、前作34の導入で詳述した高解像度の「ビーズ」アッセイを用いた以前の分析で支持された観察を行った。
プロトコルセクションのステップ3では、境界交差アッセイ(図2)を用いて、野生型とサプレッサー分離の能力を比較し、まず群れ、次に国境を越えてカナマイシンを補う寒天に群がった。結果は、両方の株が同じ接種点からの群れの同様の速度を示す同様の時間(データは示されていない)で境界に達したことを示しています。しかし、右側の群れのクロスオーバー(抗生物質)チャンバーはわずかであったが、20μg/mLカナマイシンのサプレッサーよりも野生型では一貫して大きい(図4)。2つの株の違いは、40 μg/mLカナマイシンでより顕著であった。これらのデータを合わせると、軟寒天プレートの運動性を回復したrssBの突然変異(図1D)が、群れの間にサプレッサー株の抗生物質耐性に悪影響を及ぼすことを示唆している(図4)。
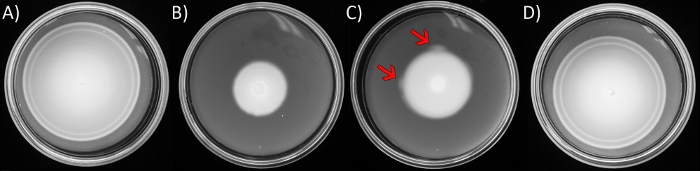
図1:軟寒天運動性アッセイとサプレッサーフレアの出現。
プレートは、寒天の0.3%で固化したLBを含んでいます。 大腸菌 株は、各プレートの中央に接種し、16時間(A)野生型大 腸菌 (AW405)のためにインキュベートされたCを除いて、8時間30°Cでインキュベートした。(B)yhjH ∆ycgR (JP1442) ∆運動量欠損変種。(C)Bのように、長いインキュベーション時間を除く。矢印は、拡大するスイムコロニーの周辺リングに出現するより速く動く「フレア」を指しています。(D) C. フレアから分離されたサプレッサーは 、ここをクリックして、この図の大きなバージョンを表示してください。
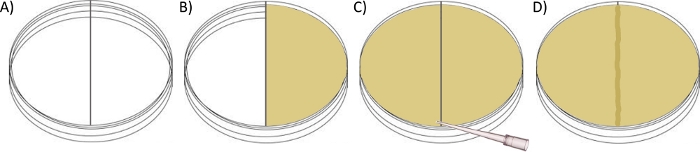
図2:国境通過プレートアッセイを設定するための回路図。
(A)プラスチック仕切りのあるレベルになるまで、分割されたシャーレの右側のチャンバーに〜30mLの群れ寒天(所望の抗生物質を含む)を注ぎ、蓋を閉じてセットすることを許可する。(B)プラスチック仕切りの上部と接触点まで泳ぐか、または群れの寒天の〜30 mLで左の部屋を埋めます。(C)滅菌ピペットチップを使用して、溶融した群れの寒天を国境を越えてそっとドラッグし、2つの側面を〜1mmの高さの寒天橋で接続し、蓋を閉じて設定することができます。(D) プレートが望ましい歪みを持って左チャンバーを接種する前に室温でさらに一晩乾かされるようにし、30°Cでインキュベートしてください。
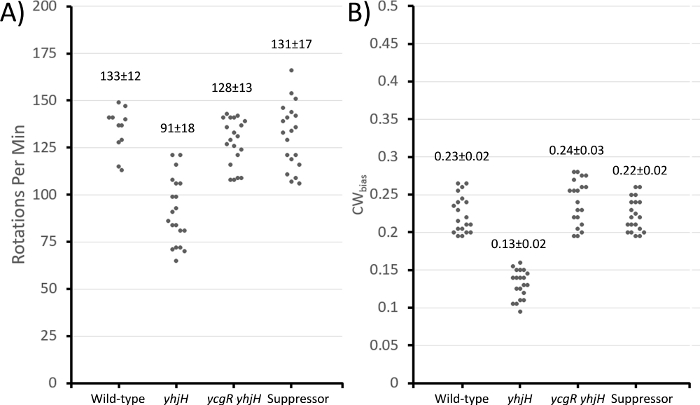
図3:細胞テザリング技術により測定される各種株の運動特性。
野生型(AW405)、∆yhjH(VN133)、∆ycgR∆yhjH(JP1442)、およびそのサプレッサー(JP1836)は、テザリング前に30°Cから中指数相までLBで成長した。 (A)1分あたりの回転(完了した360°回転)、および(B)CWバイアス(時間モータの一部がCW方向に回転する)。平均の標準偏差 (±)。各株において20個のつながれた細胞が60秒間観察された。この図の大きなバージョンを表示するには、ここをクリックしてください。
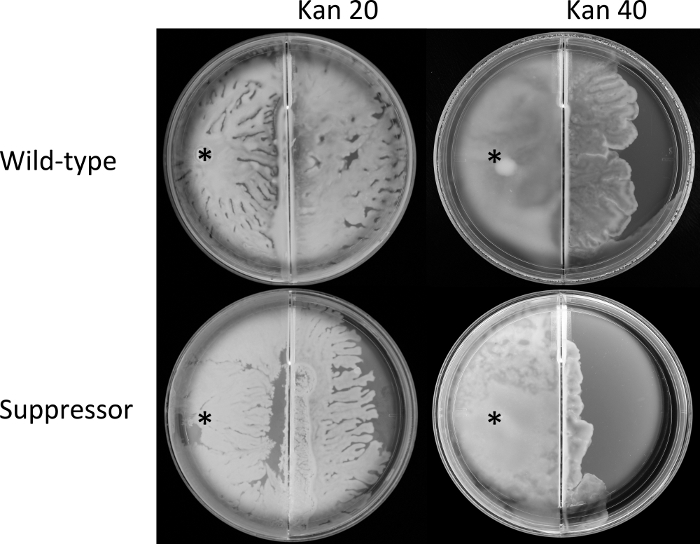
図4:国境通過アッセイ。
野生型 大腸菌 (AW405)およびサプレッサー変異体(JP1836)の中指数相培養は、群れの培地を含む分割プレートの左区画の示された位置(*)で接種し、30°Cでインキュベートした。 彼らは同等の時に国境に達した。プレートはさらに6時間インキュベートされ、その間に群れが右のチャンバーに渡り、メディアにカナマイシンが補充された(Kan;数字はμg/mLを示す)。プレートは、それぞれ三重で行われる3つの生物学的複製を代表する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
補足図1:細胞テザリング用チャンバースライドの調製(A)2枚の両面テープを置いてから、カミソリの刃を使って余分なものを切り取ります。(C)上部層を剥がして、カバースリップを貼り付ける前に接着剤を露出させ、それを穏やかに押し込んで位置に([])、すべての空気がカバースリップと下のテープの間の界面から押し出されることを確認する。(E)負荷サンプル(DNAローディング染料[30%対/vグリセロール、0.25%w/vブロモフェノールブルー、0.25%w/vキシレンシアノール]を追加して可視化を支援する)を作成したチャネル(矢印)の上部に絞り込み、組織タスクはチャンバーを通して溶液を引き出す(チャネルを通して液体を吸い込む)こちらをダウンロードしてください。
ビデオ1:つながれた大腸菌細胞の回転。こちらをクリックして、このビデオをダウンロードしてください。
ビデオ2:60倍の拡大の下で撮影されたアクティブな大腸菌群は、移動する前部の端の後ろにその特徴的な渦巻き運動を示す。こちらをクリックして、このビデオをダウンロードしてください。
ディスカッション
サプレッサー突然変異の分離と特徴付けは、気化システム35、36、37、ならびにモータ機器自体38、39、40の主要成分の同定に成功した。プロトコル1を使用している間、運動性の喪失を補うことができる突然変異の大きなスペクトルの分離を確実にするために、複数の独立した複製を含める必要があります。スポットではなくラインで培養物をストリークさせることにより菌の数を増やすことで、サプレッサ41を生成する確率を向上させることができる。同じ突然変異の単離(DNAシーケンシングによって決定される)を複数回、その真正性に対する信頼度を高めます。WGSは、常にゲノム内の他の突然変異の存在を明らかにする。したがって、同定された突然変異を元の運動不足の背景に戻すことによって、結果を検証することが重要です。サプレッサー変異アプローチは、二次突然変異を通じて機能を回復することに根ざしているので、この方法の制限は、重要な構造遺伝子が削除された場合、すなわち、経路または構造全体を支えるものである場合、補償の範囲がないかもしれないということである。古い方法であるにもかかわらず、私たちの最近の研究34は、細菌の運動性に寄与する新しい経路の解明におけるその継続的な有用性を示している。
モーター出力の定量化のために、細胞テザリングアプローチは、カメラの取り付けと顕微鏡だけを必要とする普遍的にアクセス可能なツールのままです。細胞テザリングはサルモネラ菌42、シュードモナス43、レンサ球菌44、及びロドバクター33を含む細菌種の多様な数で既に使用されている。プロトコルの成功は、主に細胞の適切な剪断と愛着に依存しています。せん断が強すぎたり、せん断間の一時停止を省略したり(2.1.5)、フィラメントの一貫性のない、または不完全なせん断を促進する傾向があり、歪んだ軸に結合された非モタイル細胞または細胞が生じる。多くの研究グループ(私たちも含む)による高解像度ビーズアッセイの採用にもかかわらず、このプロトコルの永続的な関連性は残っています。ビーズアッセイの主な制限は、ビーズが目的の細菌のフィラメントに付着する必要性から来る。この技術は、付着を容易にする「粘着性」のフラゲリンアレルを同定した大腸菌の研究から大きな恩恵を受けており、これは45.粘着性の変種は細胞テザリングのアッセイでまた優秀である。このような変異体は、フラグゼレト細菌の大部分にはまだ利用できません。状況はさらに複雑であり、複数のフラゲリンタンパク質46を保有する生物の一部と、ビブリオsp.の場合、膜鞘47も有する。細胞テザリングは、種特異的抗フラネリン抗体または抗体を使用して、操作されたエピトープタグを使用して行うこともできます。
細菌は液体培地への導入時にすぐに泳ぐことができますが、これは細胞が最初に群れの状態にプライミングされなければならない群れには当てはまりません。表面接触は、細胞が群れを開始するために必要な生理学的変化を引き起こし、48、49、50、51、ラグフェーズおよび高い細胞密度の蓄積をもたらす。生理学的変化は、大腸菌16における走化系のリモデリング、および他の細菌13、14、21に対する細胞伸長および/または過旗揚げなどの適応を含む。群れを開始するために必要な生理学的変化を考えると、我々は、高密度または細胞長の増加などの群れの選択されたファセットを模倣しようとした研究について、単にプランクトニック細胞培養物を濃縮して密度を高め、細胞分裂52、53を阻害する抗生物質を使用して細胞伸長を誘発する研究について注意書き留めた。細胞伸長をマーカーとして用いた場合、プランクトニック細胞と比較して、サルモネラ菌または大腸菌54におけるスウォーマー細胞の平均長さのわずかな増加しかある点にも注意する。群れのアッセイは、水泳アッセイよりも確立するのが難しいです。変数には、メディアを固化するために使用される寒天の商業的供給源(特別なEiken寒天は大腸菌の群れに不可欠であるのに対し、より標準的なDifco寒天は他のすべての細菌の群れをサポートしている)、リッチな対最小の媒体の使用(大腸菌とサルモネラ菌はグルコース補充を必要とする)、および最も重要な周囲湿度2、13、14、21が含まれる。これらの中で、最適な湿度を維持することが最もイライラする可能性があります。[選択した生物の群れのための優れた、組織的な最適化(緑膿菌)はモラレス・ソトと同僚55によって実証された。群れのメディアは、群れを促進するのに十分に湿っている必要がありますが、受動的な広がり/スライドを可能にするほど湿っていない必要があります。したがって、この集団運動に関連する動きの明確なパターンを確認するために、群れを顕微鏡でチェックすることが重要です(ビデオ2)。温度は、群れのアッセイを最適化するための重要な考慮事項でもあります。より高い温度、例えば37°Cは、30°Cよりも早くプレートを乾燥させます。 湿度制御(〜70~80%)を備えたインキュベーターを使用すると、内部の建物の温度や湿度に影響を与える季節変化を含むこれらの問題を軽減するのに役立ちます。プロトコル3は、一度正常に確立されると、群れの細菌の最も興味深い側面の1つ、抗生物質17に対する耐性の上昇を調査するための強力な方法を提供します。ここで説明するすべてのプロトコルは、新しい生物に適用して、flagella媒介運動を指定および制御する経路を同定することができる。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、国立衛生研究所助成金GM118085とロバート・ウェルチ財団(R.M.H.にF-1811を付与)によって部分的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Bacto Dehydrated Agar | Fisher Scientific | DF0140-15-4 | |
| EDTA Disodium Salt, Dihydrate | Fisher Scientific | 02-002-786 | |
| Eiken agar | Eiken Chemical Co. Japan | E-MJ00 | Essential for E. coli swarming |
| Glucose D (+) | Fisher Scientific | 410955000 | |
| LB (Lennox) Broth | Fisher Scientific | BP1427-500 | |
| Poly-L-lysine Solution (0.1%) | Sigma-Aldrich | P8920 | |
| Potassium chloride (KCl) | Fisher Scientific | 18-605-496 | |
| Potassium Phosphate monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Potassium Phosphate dibasic (K2HPO4) | Fisher Scientific | BP363-500 | |
| Sodium chloride (NaCl) | Fisher Scientific | S271-500 | |
| Materials and Equipment | |||
| CellSense microscope imaging software (V. 1.6) | Olympus | Or equivalent software for microscope used | |
| Electron Microscopy Sciences Scotch 666 Doube Sided Tape | Fisher | 50-285-28 | |
| Frosted microscope slides 3x1x1mm | Fisher | 12-550-343 | |
| Olympus BX53 microscope | Olympus | BX53 | Any upright or inverted phase microscope can be used |
| Petri dishes (100 mm diameter) | Fisher Scientific | FB0875712 | For soft-agar assays |
| Polyethylene Nebulizer Capillary Tubing (0.58mm x 99mm 3.0m) | Perkin Elmer | 9908265 | |
| Round Petri Dish with 2 Compartments | VWR | 89200-944 | For border-crossing assays |
| Safety Hypodermic Needles (23G) | Fisher Scientific | 14-826A | |
| Sterile Syringe - 1 mL | Fisher scientific | 14-955-450 | |
| Task/Tissue wipes | Fisher scientific | 06-666 | Or equivalent single use tissue wipes |
| VWR micro cover-glass 18x18mm | VWR | 48366205 | |
| XM10 camera | Olympus | XM10 | Or equivalent microscope camera |
参考文献
- Jarrell, K. F., McBride, M. J. The surprisingly diverse ways that prokaryotes move. Nature Reviews in Microbiology. 6 (6), 466-476 (2008).
- Harshey, R. M. Bacterial motility on a surface: many ways to a common goal. Annual Reviews Microbiology. 57, 249-273 (2003).
- Duan, Q., Zhou, M., Zhu, L., Zhu, G. Flagella and bacterial pathogenicity. Journal of Basic Microbiology. 53 (1), 1-8 (2013).
- Nakamura, S., Minamino, T. Flagella-Driven Motility of Bacteria. Biomolecules. 9 (7), (2019).
- Haiko, J., Westerlund-Wikstrom, B. The role of the bacterial flagellum in adhesion and virulence. Biology (Basel). 2 (4), 1242-1267 (2013).
- Berg, H. C. . E. coli in Motion. 1 edn. , (2004).
- Berg, H. C. The rotary motor of bacterial flagella. Annual Review of Biochemistry. 72, 19-54 (2003).
- Xing, J., Bai, F., Berry, R., Oster, G. Torque-speed relationship of the bacterial flagellar motor. Proceedings of the National Academy of Sciences U. S. A. 103 (5), 1260-1265 (2006).
- Chen, X., Berg, H. C. Torque-speed relationship of the flagellar rotary motor of Escherichia coli. Biophysics Journal. 78 (2), 1036-1041 (2000).
- Turner, L., Ryu, W. S., Berg, H. C. Real-time imaging of fluorescent flagellar filaments. Journal of Bacteriology. 182 (10), 2793-2801 (2000).
- Brown, M. T., Delalez, N. J., Armitage, J. P. Protein dynamics and mechanisms controlling the rotational behaviour of the bacterial flagellar motor. Current Opinion in Microbiology. 14 (6), 734-740 (2011).
- Parkinson, J. S., Hazelbauer, G. L., Falke, J. J. Signaling and sensory adaptation in Escherichia coli chemoreceptors: 2015 update. Trends in Microbiology. 23 (5), 257-266 (2015).
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews Microbiology. 8 (9), 634-644 (2010).
- Harshey, R. M., Partridge, J. D. Shelter in a Swarm. Journal of Molecular Biology. 427 (23), 3683-3694 (2015).
- Ariel, G., et al. Swarming bacteria migrate by Levy Walk. Nature Communications. 6, 8396 (2015).
- Partridge, J. D., Nhu, N. T. Q., Dufour, Y. S., Harshey, R. M. Escherichia coli Remodels the Chemotaxis Pathway for Swarming. mBio. 10 (2), (2019).
- Butler, M. T., Wang, Q., Harshey, R. M. Cell density and mobility protect swarming bacteria against antibiotics. Proceedings of the National Academy of Science U. S. A. 107 (8), 3776-3781 (2010).
- Mobley, H. L., Belas, R. Swarming and pathogenicity of Proteus mirabilis in the urinary tract. Trends in Microbiology. 3 (7), 280-284 (1995).
- Burall, L. S., et al. Proteus mirabilis genes that contribute to pathogenesis of urinary tract infection: identification of 25 signature-tagged mutants attenuated at least 100-fold. Infections and Immunity. 72 (5), 2922-2938 (2004).
- Mazzantini, D., et al. FlhF Is Required for Swarming Motility and Full Pathogenicity of Bacillus cereus. Frontiers in Microbiology. 7, 1644 (2016).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. Journal of Bacteriology. 195 (5), 909-918 (2013).
- Yuan, J., Berg, H. C. Resurrection of the flagellar rotary motor near zero load. Proceedings of the National Academy of Science U. S. A. 105 (4), 1182-1185 (2008).
- Yuan, J., Fahrner, K. A., Berg, H. C. Switching of the bacterial flagellar motor near zero load. Journal of Molecular Biology. 390 (3), 394-400 (2009).
- Terasawa, S., et al. Coordinated reversal of flagellar motors on a single Escherichia coli cell. Biophysics Journal. 100 (9), 2193-2200 (2011).
- Nord, A. L., Sowa, Y., Steel, B. C., Lo, C. J., Berry, R. M. Speed of the bacterial flagellar motor near zero load depends on the number of stator units. Proceedings of the National Academy of Science. 114 (44), 11603-11608 (2017).
- Block, S. M., Segall, J. E., Berg, H. C. Adaptation kinetics in bacterial chemotaxis. J Bacteriol. 154 (1), 312-323 (1983).
- Segall, J. E., Block, S. M., Berg, H. C. Temporal comparisons in bacterial chemotaxis. Proceedings of the National Academy of Science U. S. A. 83 (23), 8987-8991 (1986).
- Wolfe, A. J., Conley, M. P., Kramer, T. J., Berg, H. C. Reconstitution of signaling in bacterial chemotaxis. Journal of Bacteriology. 169 (5), 1878-1885 (1987).
- Blair, D. F., Berg, H. C. Restoration of torque in defective flagellar motors. Science. 242 (4886), 1678-1681 (1988).
- Parkinson, J. S. A "bucket of light" for viewing bacterial colonies in soft agar. Methods Enzymol. 423, 432-435 (2007).
- Adler, J. Chemotaxis in bacteria. Science. 153 (3737), 708-716 (1966).
- Wolfe, A. J., Berg, H. C. Migration of bacteria in semisolid agar. Proceedings of the National Academy of Science U. S. A. 86 (18), 6973-6977 (1989).
- Kojadinovic, M., Sirinelli, A., Wadhams, G. H., Armitage, J. P. New motion analysis system for characterization of the chemosensory response kinetics of Rhodobacter sphaeroides under different growth conditions. Applied and Environmental Microbiology. 77 (12), 4082-4088 (2011).
- Nieto, V., et al. Under Elevated c-di-GMP in Escherichia coli, YcgR Alters Flagellar Motor Bias and Speed Sequentially, with Additional Negative Control of the Flagellar Regulon via the Adaptor Protein RssB. Journal of Bacteriology. 202 (1), (2019).
- Parkinson, J. S., Parker, S. R., Talbert, P. B., Houts, S. E. Interactions between chemotaxis genes and flagellar genes in Escherichia coli. Journal of Bacteriology. 155 (1), 265-274 (1983).
- Roman, S. J., Meyers, M., Volz, K., Matsumura, P. A chemotactic signaling surface on CheY defined by suppressors of flagellar switch mutations. Journal of Bacteriology. 174 (19), 6247-6255 (1992).
- Sanna, M. G., Simon, M. I. Isolation and in vitro characterization of CheZ suppressors for the Escherichia coli chemotactic response regulator mutant CheYN23D. Journal of Biological Chemistry. 271 (13), 7357-7361 (1996).
- Sockett, H., Yamaguchi, S., Kihara, M., Irikura, V. M., Macnab, R. M. Molecular analysis of the flagellar switch protein FliM of Salmonella typhimurium. Journal of Bacteriology. 174 (3), 793-806 (1992).
- Irikura, V. M., Kihara, M., Yamaguchi, S., Sockett, H., Macnab, R. M. Salmonella typhimurium fliG and fliN mutations causing defects in assembly, rotation, and switching of the flagellar motor. Journal of Bacteriology. 175 (3), 802-810 (1993).
- Ishida, T., et al. Sodium-powered stators of the bacterial flagellar motor can generate torque in the presence of phenamil with mutations near the peptidoglycan-binding region. Molecular Microbiology. 111 (6), 1689-1699 (2019).
- Barker, C. S., Meshcheryakova, I. V., Kostyukova, A. S., Samatey, F. A. FliO regulation of FliP in the formation of the Salmonella enterica flagellum. PLoS Genetics. 6 (9), 1001143 (2010).
- Paul, K., Nieto, V., Carlquist, W. C., Blair, D. F., Harshey, R. M. The c-di-GMP binding protein YcgR controls flagellar motor direction and speed to affect chemotaxis by a "backstop brake" mechanism. Molecular Cell. 38 (1), 128-139 (2010).
- Qian, C., Wong, C. C., Swarup, S., Chiam, K. H. Bacterial tethering analysis reveals a "run-reverse-turn" mechanism for Pseudomonas species motility. Applied and Environmental Microbiology. 79 (15), 4734-4743 (2013).
- Manson, M. D., Tedesco, P. M., Berg, H. C. Energetics of flagellar rotation in bacteria. Journal of Molecular Biology. 138 (3), 541-561 (1980).
- Kuwajima, G. Construction of a minimum-size functional flagellin of Escherichia coli. Journal of Bacteriology. 170 (7), 3305-3309 (1988).
- Kuhn, M. J., et al. Spatial arrangement of several flagellins within bacterial flagella improves motility in different environments. Nature Communication. 9 (1), 5369 (2018).
- Hranitzky, K. W., Mulholland, A., Larson, A. D., Eubanks, E. R., Hart, L. T. Characterization of a flagellar sheath protein of Vibrio cholerae. Infections and Immun. 27 (2), 597-603 (1980).
- Wang, Q., Frye, J. G., McClelland, M., Harshey, R. M. Gene expression patterns during swarming in Salmonella typhimurium: genes specific to surface growth and putative new motility and pathogenicity genes. Molecular Microbiology. 52 (1), 169-187 (2004).
- Gode-Potratz, C. J., Kustusch, R. J., Breheny, P. J., Weiss, D. S., McCarter, L. L. Surface sensing in Vibrio parahaemolyticus triggers a programme of gene expression that promotes colonization and virulence. Molecular Microbiology. 79 (1), 240-263 (2011).
- McCarter, L., Silverman, M. Surface-induced swarmer cell differentiation of Vibrio parahaemolyticus. Molecular Microbiology. 4 (7), 1057-1062 (1990).
- Pearson, M. M., Rasko, D. A., Smith, S. N., Mobley, H. L. Transcriptome of swarming Proteus mirabilis. Infections and Immunity. 78 (6), 2834-2845 (2010).
- Swiecicki, J. M., Sliusarenko, O., Weibel, D. B. From swimming to swarming: Escherichia coli cell motility in two-dimensions. Integrative Biology (Cambridge). 5 (12), 1490-1494 (2013).
- Colin, R., Drescher, K., Sourjik, V. Chemotactic behaviour of Escherichia coli at high cell density. Nature Communication. 10 (1), 5329 (2019).
- Partridge, J. D., Harshey, R. M. More than motility: Salmonella flagella contribute to overriding friction and facilitating colony hydration during swarming. Journal Bacteriology. 195 (5), 919-929 (2013).
- Morales-Soto, N., et al. Preparation, imaging, and quantification of bacterial surface motility assays. Journal Visualized Experiment. (98), e52338 (2015).
- Chawla, R., Ford, K. M., Lele, P. P. Torque, but not FliL, regulates mechanosensitive flagellar motor-function. Science Reports. 7 (1), 5565 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved