Method Article
Peptit Biyosintetik Enzimleri Araştırmak için Hidrojen-Döteryum Değişim Kütle Spektrometresi (HDX-MS) Platformu
Bu Makalede
Özet
Lanthipeptide sentezleri peptit doğal ürünlerin biyosentezi sırasında katalizör multistep reaksiyonları. Burada, lanteptid sentezlerinin konformasyonel dinamiklerini ve peptit doğal ürün biyosentezinde yer alan diğer benzer enzimleri incelemek için bunların kullanılabileceği sürekli, aşağıdan yukarıya, hidrojen-döteryum değişim kütle spektrometresi (HDX-MS) iş akışını açıklıyoruz.
Özet
Hidrojen-döteryum değişim kütle spektrometresi (HDX-MS), enzim konformasyon değişikliklerinin ve enzim-substrat etkileşimlerinin biyofiziksel karakterizasyonu için güçlü bir yöntemdir. HDX-MS, birçok faydası arasında sadece az miktarda malzeme tüketir, enzim/substrat etiketlemesine gerek kalmadan yakın yerel koşullar altında gerçekleştirilebilir ve büyük enzimler ve multiprotein kompleksleri için bile enzim konformasyonsal dinamikleri−hakkında mekansal olarak çözülmüş bilgiler sağlayabilir. Yöntem, ilgi çekici enzimin D2O'da hazırlanan tampona seyreltilmesiyle başlatılır. Bu, peptit bağı amidlerinde (N-H) protiyumun döteryum (N-D) ile değişimini tetikler. İstenilen değişim zaman noktalarında reaksiyon aliquotları söndürülür, enzim peptitlere proteoliz edilir, peptitler ultra performanslı sıvı kromatografisi (UPLC) ile ayrılır ve her peptitin kütleslerindeki değişim (hidrojenin döteryum ile değişimi nedeniyle) MS tarafından kaydedilir. Her peptit tarafından döteryum alımı miktarı, bu peptitin yerel hidrojen yapıştırma ortamına bağlıdır. Enzim değişim döteryumunun çok dinamik bölgelerinde çok hızlı bir şekilde bulunan peptitler bulunurken, iyi sıralanmış bölgelerden elde edilen peptitler çok daha yavaş bir değişime uğrar. Bu şekilde, HDX oranı lokal enzim konformasyon dinamiklerini rapor eder. Farklı ligandların varlığında döteryum alma seviyelerine pertürbasyonlar daha sonra ligand bağlama alanlarını haritalamak, allosterik ağları tanımlamak ve enzim fonksiyonundaki konformasyonel dinamiklerin rolünü anlamak için kullanılabilir. Burada, lanteptid adı verilen bir tür peptit doğal ürünün biyosentezini daha iyi anlamak için HDX-MS'i nasıl kullandığımızı gösteriyoruz. Lanthipeptides, geleneksel yapısal biyoloji yaklaşımlarıyla incelenmesi zor olan büyük, çok işlevli, konformasyonel dinamik enzimler tarafından çeviri sonrası değiştirilen genetik olarak kodlanmış peptitlerdir. HDX-MS, bu tür enzimlerin mekanistik özelliklerini araştırmak için ideal ve uyarlanabilir bir platform sağlar.
Giriş
Proteinler, femtosaniye ölçeğindeki bağ titreşiminden, birçok saniye içinde meydana gelebilecek tüm protein etki alanlarının yeniden düzenlenmesine kadar zaman ölçeklerinde farklı konformasyonları örnekleyen yapısal olarak dinamik moleküllerdir1. Bu konformasyonsal dalgalanmalar genellikle enzim/protein fonksiyonunun kritik yönleridir. Örneğin, ligand bağlamanın neden olduğu konformasyonel değişiklikler, kataliz için gerekli aktif saha kalıntılarını düzenleyerek, sıralı kinetik mekanizmalarda substrat bağlama bölgelerini tanımlayarak, reaktif ara maddeleri ortamdan koruyarak veya allosterik ağlar aracılığıyla enzim fonksiyonunu modüle ederek enzim fonksiyonunu modüle etmek için genellikle kritik öneme sahiptir. Son çalışmalar ayrıca, konformasyonel dinamiklerin evrim boyunca korunabileceğini ve korunmuş moleküler hareketlere pertürbasyonların substrat özgüllüğündeki değişiklikler ve yeni enzim fonksiyonlarının ortaya çıkması ile ilişkili olabileceğini göstermiştir2,3.
Son yıllarda, hidrojen-döteryum değişim kütle spektrometresi (HDX-MS), protein konformasyonel manzaraların ligand bağlama veya mutajensis 4 ,5,6,7gibi pertürbasyonlara nasıl tepki verdiğini araştırmak için güçlü bir teknik olarak hızla ortaya çıkmıştır. Tipik bir HDX-MS deneyinde (Şekil 1), D2O'da hazırlanan tampona bir ilgi proteini yerleştirilir, bu da çözücü değiştirilebilir protonların döter ile değiştirilmesini tetikler. Peptit bağlarının amid moiety'nin değişim oranı, pH'a, yerel amino asit dizisine ve amide8'inyerel yapısal ortamına bağlıdır. Hidrojen yapıştırma etkileşimleri yapan amidler (α-helices ve β yapraklarında bulunanlar gibi) proteinin toplu çözücüye maruz kalan yapılandırılmamış bölgelerindeki ortalardan daha yavaş değiş tokuş eder. Bu nedenle, döteryum alımının kapsamı enzimin yapısının bir yansımasıdır. Konformasyonsal olarak dinamik olan veya ligand bağlanması üzerine yapısal geçişler geçiren enzimlerin ölçülebilir bir HDX yanıtı vermesinin beklenebilir olması beklenir.
Yapılandırılmış bir amidin yavaş döviz kurunun mekanistik temeli Şekil 2 5,8,9'da gösterilmiştir. HDX'e tabi tutulabilmesi için, yapılandırılmış bölgenin öncelikle, hdx değişimini belirli bir asit / baz kimyasal mekanizma ile katalİze eden çözücü moleküllerinin değiştirilebilir amide erişebilmesi için geçici olarak açılmış bir uygunluğu örneklemesi gerekir. Sonuçta, kimyasal döviz kurunun(kkimyası)göreli büyüklükleri ve katlama ve yeniden katlama oranları (kaçık ve kkapanış) deneyde ölçülen HDX oranını belirler5,8. Bu basit kinetik modelden, döteryum alımının kapsamının alttaki konformasyonsal dinamikleri yansıtacağı açıktır (kaçık ve kkapanışıile tanımlandığı gibi). Çoğu HDX-MS deneyi, değişim reaksiyonunu takiben, ilgi proteininin peptitlere sindirildiği ve her peptit tarafından döteryum alımının kütle7'debir artış olarak ölçüldüğü aşağıdan yukarıya bir iş akışında gerçekleştirilir. Bu şekilde, HDX-MS, pertürbasyonların enzim konformasyonel dinamiklerin peptitlerin yerel mekansal ölçeğinde eşlenmesine izin verir ve araştırmacının pertürbasyonun ilgi enziminin farklı bölgelerindeki dinamikleri nasıl değiştirdiğini değerlendirmesini sağlar.
HDX-MS yaklaşımının protein yapısal dinamiklerini aydınlatıcı avantajları çoktur. İlk olarak, yöntem küçük miktarlarda yerli proteinle veya kuaterner yapıya sahip sistemlerde protein kompleksleri üzerindegerçekleştirilebilir 10. Aşağıdan yukarıya HDX-MS iş akışı, ilgi protein dizisini kapsayan yeterli sayıda güvenle tanımlanmış peptit sağladığı sürece, testte kullanılan enzim preparatının yüksek orandasaflaştırılması11,12, için bile gerekli değildir. Ayrıca, HDX-MS, tek moleküllü floresan çalışmalarında kullanılacağı gibi bölgeye özgü protein etiketlemesine gerek kalmadan yakın yerel koşullar altında konformasyonsal dinamikler hakkında bilgi sağlayabilir13ve araştırılabilen protein veya protein kompleksinin boyut sınırı yoktur (nükleer manyetik rezonans [NMR] spektroskopisi gibi yaklaşımları zorlaştırır)7,14. Son olarak, X-ışını kristalografisi 15 , 16,17,18ile incelenmesi zor olan özünde düzensiz proteinleri incelemek için zaman çözümlenmiş HDX-MS yöntemleri kullanılabilir. HDX-MS'in ana sınırlaması, verilerin düşük yapısal çözünürlükte olmasıdır. HDX-MS verileri, konformasyonsal dinamiklerin nerede değiştiğine işaret etmek ve birleştirilmiş konformasyon değişikliklerini ortaya çıkarmak için yararlıdır, ancak genellikle gözlemlenen değişimi yönlendiren hassas moleküler mekanizma hakkında çok fazla bilgi sağlamaz. Elektron yakalama ayrışma yöntemlerinin protein HDX-MS verileriyle kombinasyonundaki son gelişmeler, değişim alanlarının tek amino asit kalıntıları19ile eşlenmesi için umut vaat etmektedir, ancak HDX-MS verileri tarafından iletilen yapısal modellere netlik sağlamak için biyokimyasal ve yapısal çalışmaların takip edilmesi hala sıklıkla gereklidir.
Aşağıda, hdx-ms test geliştirilmesi için ayrıntılı bir protokol20. Aşağıda sunulan numune hazırlama protokolleri genellikle sulu tamponlarda iyi çözünürlük gösteren herhangi bir protein için geçerli olmalıdır. Proteinler için deterjan veya fosfolipidler21, 22, 23, 24varlığında test edilmesi gerekenden daha özel numune hazırlama yöntemleri ve HDX-MS iş akışları mevcuttur. HDX-MS veri toplama için enstrümantal ayarlar, sıvı kromatografi sistemine bağlı olarak yüksek çözünürlüklü dörtlü uçuş süresi kütle spektrometresi için açıklanmıştır. Benzer karmaşıklık ve çözünürlük verileri, piyasada bulunan bir dizi sıvı kromatografi-kütle spektrometresi (LC-MS) sisteminden herhangi birinde toplanabilir. Ticari olarak kullanılabilen bir yazılım paketi kullanılarak veri işlemenin önemli yönleri de sağlanır. Ayrıca, daha geniş HDX-MS topluluğu12tarafından yapılan önerilerle tutarlı veri toplama ve analiz kılavuzları sunuyoruz. Açıklanan protokol, bir antimikrobiyal peptit doğal ürününün multistep olgunlaşmasını katalize eden bir lantiipeptid sentezi olan HalM2'nin dinamik yapısal özelliklerini incelemek için kullanılır20. HDX-MS'in alt tabaka bağlama sitelerini ve önceki karakterizasyondan kaçan allosterik özellikleri ortaya çıkarmak için nasıl kullanılabileceğini gösteriyoruz. Protein HDX-MS ile ilgili diğer birkaç protokol son yıllarda yayınlanmıştır25,26. Mevcut çalışma ile birlikte, bu önceki katkılar okuyucuya deneysel tasarımda biraz esneklik sağlamalıdır.
Protokol
1. Kısırlaştırılmış reaktiflerin ve enzim stok çözeltilerinin hazırlanması
- HDX reaksiyonları için gerekli reaktifleri (tamponlar, tuzlar, substratlar, ligandlar vb.) D 2 O'da (%99,9 atom fraksiyonu D)100−200xkonsantre stok çözeltileri olarak hazırlayın. En az 50 mL tampon stok çözeltisi hazırlayın.
NOT: HalM2'nin karakterizasyonu için aşağıdaki çözümler hazırlanmıştır: 500 mM MgCl2, 100 mM tris (2-karboksitetil)fosfin (TCEP), 750 mM ATP (HEPES tamponunda), 800 mM HEPES pD 7.1, 500 μM HalA2 ve 500 mM AMPPNP. - Stok çözeltilerini kuruluk için dondurun ve lyophilize edin.
- D2O'da yeniden çözün ve değiştirilebilir protonların çoğunu mümkün olduğunca döteronlarla değiştirmek için en az bir ek süre tekrarlayın.
- Döterlenmiş HEPES tampon stoğunun pD'sini konsantre NaOD/DCl ile istenen değere ayarlayın, aşağıdaki ilişkiyi göz önünde bulundurarak27:
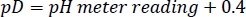
NOT: Amide HDX oranı, çözeltinin pL'sine (pL = pH veya pD)5bağlıdır. Deneyler arasında hafif pL sürüklenmesini önlemek için farklı arabellek stoğu çözümlerinin hazırlanması, depolanmasını ve aynı şekilde kullanılması gerekir. - 300 μL HDX test için gereken her reaktifin miktarını hesaplayın ve -80 °C'de tek kullanımlık aliquots olarak saklayın.
- Santrifüj filtre(Malzeme Masası)veya eşdeğer bir cihaz kullanarak protiated enzim depolama tamponunda konsantre bir enzim stok çözeltisi (~100−200 μM) hazırlayın.
NOT: Tam tampon ve santrifüj filtre moleküler ağırlık kesme, ilginin proteinine / enzimine bağlı olacaktır. HalM2, 50 mM HEPES, pH 7.5, 100 mM KCl ve% 10 gliserolde depolanır. Konsantre enzimi hazırlamak için 10 kDa filtre kullanıldı. - Enzimi tek kullanımlık porsiyonlara aliquotlayın ve -80 °C'de saklayın.
NOT: Bu bir durma noktası olabilir. Bölüm 1'de açıklanan tüm stok çözümleri HDX reaksiyonlarından önce hazırlanabilir. -80 °C'de saklanırsa, çoğu enzim / kısırlaştırılmış stok çözeltisi aylarca stabil olacaktır.
2. HDX söndürme hacminin kalibrasyonu
- Bölüm 1'de hazırlanan döterlenmiş reaktifleri ve konsantre enzim stoklarını kullanarak D2O'da 300 μL HDX reaksiyon hazırlayın.
- 1−5 μM'lik son bir enzim konsantrasyonu kullanın.
- En az 50−100 mM'lik son bir döterlenmiş HEPES tampon konsantrasyonu kullanın.
- İstenilen enzim aktivitesini/işlevini korumak için diğer bileşenlerin konsantrasyonlarının yeterli olduğundan emin olun.
- 1 L HDX söndürme çözeltisi hazırlayın (100 mM fosfat, 0,8 M guanidin-HCl, pH 1,9). Hem 50 mL porsiyonlarda (uzun süreli stoklar için) hem de 1 mL porsiyonlarda (tek kullanımlık aliquotlar için) dondurun ve saklayın.
NOT: Söndürme tamponunun tam bileşimi, aşağıdan yukarıya HDX-MS iş akışının proteoliz adımında kullanılan enzime bağlı olacaktır (adım 3.3.3). Burada verilen söndürme tamponu, HDX-MS için en sık kullanılan proteaz olan pepsin ile uyumludur. Farklı bir proteaz kullanılıyorsa, arabellek uyumluluğunu sağlamak için proteaz tedarikçisine danışın. - Söndürülen HDX reaksiyon karışımının son pL'sini 2,3 pH metre okuma değerine ayarlamak için gereken söndürme tamponunun hacmini kalibre edin.
NOT: Peptidin N-H bağının çözücü H/D döviz kuru, hem asit hem de baz katalize maruz kalan pH'a bağımlı bir işlemdir. Minimum döviz kuru pH 2.5 değerinde gerçekleşir (50:50 H 2 O:D 2 O karışımı için pH metre okuma =2.3). Böylece, 2,5'e yakın nihai bir pL değeri, aşağıdan yukarıya LC-MS analizi sırasında meydana gelen hidrojen geri değişimini en aza indirecek ve böylece peptitlerdeki döteryum etiketini koruyacaktır.- HDX reaksiyon karışımının 50 μL'lik kısmını adım 2.1'den 50 μL'lik söndürme tamponu ile karıştırın ve söndürülen karışımın pL'sini bir mikro uç elektrotla ölçün.
- Son pH ölçüm cihazı okumasını 2,3 değerine ayarlamak için gerektiğinde söndürme çözeltisinin hacmini artırın.
- Uygun söndürme hacmi belirlendikten sonra, sabit miktarda söndürme tamponu eklendiğiniz zaman tutarlı bir son pL elde edildiğinden emin olmak için HDX reaksiyonundan (adım 2.1) taze 50 μL aliquots kullanarak söndürme işlemini birkaç kez tekrarlayın.
3. Referans örneklerinin hazırlanması ve aşağıdan yukarıya LC-MS iş akışının optimizasyonu
- 0,5 mL tüplerde triplikatla ilgili ilgi proteini için döterlenmemiş referans örnekleri hazırlayın. Reaksiyonların H 2 O'da da hazırlanan reaktif stok çözeltileri kullanılarak H 2 O'da hazırlanması dışında, son reaksiyon karışımı koşullarının otantik HDX reaksiyonlarında (adım2.1)kullanılanlarla aynı olduğundan emin olun.
- Son pH'ı 2,5'e ayarlamak için uygun söndürme arabelleği hacmini ekleyerek örnekleri adım 2,3'teki gibi söndür. Numuneleri sıvı nitrojende flaşla dondurun ve analize hazır olana kadar -80 °C'de saklayın.
- Aşağıdan yukarıya LC-MS iş akışı kullanarak protiated enzim referans örneklerini analiz edin.
NOT: Bu adımları gerçekleştirmeden önce, veri toplama için kullanılacak LC-MS sistemi uygun şekilde kalibre edilmeli ve kullanıma hazır olmalıdır. Numuneler arasındaki geri değişim farklılıklarını en aza indirmek için aşağıdan yukarıya LC-MS iş akışındaki tüm adımların zamanlaması ve sıcaklığı titizlikle kontrol edilmelidir. Bu protokolde kullanılan MS araçları ile (Malzeme Masası Ve Destekleyici Bilgiler), adımların çoğu enstrüman yazılımı üzerinden kontrol edilebilir. Kesin çoğaltmaların toplanmasını sağlamak için, iş akışındaki adımların mümkün olduğunca çoğunu otomatikleştirmeniz önerilir.- Tek bir enzim referans örneğini (adım 3.2'de olduğu gibi hazırlanmış) dondurucudan çıkarın ve bir su banyosunda 1 dakika boyunca 37 °C'de çözün.
- Numuneyi dondurucudan çıkardıktan ve çözdükten tam 2 dakika sonra, söndürülen referans örneğinin 40 μL'lik bir kısmını pepsin (asit kararlı bir proteaz) ile işlevsel hale getirilmiş sabit bir faz içeren ultra performanslı bir sıvı kromatografisi (UPLC) sütununa (2,1 x 30 mm, 300 Å, 5 μM) enjekte edin.
- Çözücü olarak H 2 O'da (pH = 2,5) %0,1 formik asit kullanarak numuneyi 15 °C'de3dakika boyunca 100 μL/dk akış hızında sindirin.
- Pepsin sütunundan geri değişimi en aza indirmek için 0,4 °C'de tutulan bir C18 tuzak sütununa akarken peptik peptitleri toplayın.
- Tuzdan arındırı geçen peptik peptitleri tuzak kolonundan, peptik peptitlerin ayrılması için 0,4 °C'de tutulan ve çalıştırılmış bir C18 analitik sütununa (1 mm x 100 mm, 1,7 μM, 130 Å) geçirin.
NOT: Adım 3.3.3−3.3.5, HDX-MS veri toplama için kullanılan belirli LC-MS sistemleri tarafından otomatiklenebilir. Alternatif olarak, bu adımlar bağımsız olarak gerçekleştirilebilir, her adımın zamanlamasının ve sıcaklığının sürekli olarak düşük bir geri değişim elde etmek için dikkatlice kontrol edilmesi gerektiğini unutmayın. - C18 sütununu asetonitril/su/%0,1 formik asit çözücü sistemi ile elute edin. Peptik peptitlerdeki döteryum etiketinin ayrılmasını en üst düzeye çıkarmak ve korumak için LC gradyanını ilgi proteini için optimize edin.
NOT: Degrade elution ayrıntıları Destek Bilgileri 'nde verilmiştir. - Peptik sindirimi elektrospray iyonizasyon (ESI) kütle spektrometresine tabi edin.
NOT: Destekleyici Bilgilerde sağlanan kaynak koşullar, çoğu peptik peptit için yeterli iyonizasyon sağlayacaktır.- MS cihazında iyonize olduktan sonra, yöntemin en yüksek kapasitesini artırmak için tampon gazı olarak azot kullanarak bir gaz fazı iyon hareketlilik ayrımı gerçekleştirin.
- İyon hareketliliği ayrımını takiben, peptik peptit öncül iyonlarını, düşük çarpışma enerjisinin (4 V) ve yüksek çarpışma enerjisinin (21−40 V) alternatif döngülerini içeren bir MSE iş akışına tabi edin.
NOT: Alternatif düşük ve yüksek çarpışma enerjisi rejimleri, MSMS verileriyle (yüksek çarpışma enerjisi) aynı anda MS verilerinin (düşük çarpışma enerjisi) toplanmasına izin verir. Bu da öncül iyonların kendi parça iyonlarıyla zaman korelasyonuna izin verir. Bu korelasyon, bölüm 4'te açıklanan kendinden emin peptit tanımlaması için gereklidir. - En az 20.000 çözüm gücüne sahip bir kütle analizörü kullanarak peptit öncüsü ve parça iyonlarını tespit edin.
- Veri toplama ile eş zamanlı olarak, [Glu-1]-fibrinopeptide B (GluFib) harici standardı için MS verilerini alın.
NOT: Adım 3.3.7'de açıklanan MS iş akışına MSE protokolü denir. Aşağıdan yukarıya HDX-MS için uygun bir MSE protokolü için tam araçsal ayarlar Destek Bilgileri 'nde verilmiştir.
- LC-MS verilerinin kalitesini değerlendirin.
NOT: Yukarıda açıklanan protokolü ve Destekleyici Bilgiler 'de sağlanan araçsal ayarları kullanarak,referans örnekleri yaklaşık 1 x 108maksimum sinyal yoğunluğuna sahip toplam iyon kromatogram üretmelidir. 3−9 dk(Şekil3A−C)arasında birçok peptik peptit olmalıdır. - Pepsin ve analitik C18 sütunlarını temizlemek için 40 μL boş numune (%0,1 formik asit) enjekte edin.
NOT: Genel olarak 2−3 boşluk yeterli olmalıdır. - Üç taraflı referans protein örneklerinin her biri için 3.3.1−3.3.9 adımlarını yineleyin.
4. Referans verilerinin işlenmesi ve peptit listesinin tanımlanması
- Ham MSE verilerini (adım 3.3.7) proteomik yazılımı (Malzeme Tablosu) kullanarak analiz edin. Proteomik yazılımı kullanarak Kitaplıklar | Protein Dizisi Veri Bankaları, ilgi çekici proteinin amino asit dizisini ithal ederek protein veritabanını tanımlamak için.
NOT: Bu adımın amacı, ilgi proteininden elde edilen peptik peptitler için referans MS verilerini aramak ve herhangi bir putatif peptit tanımlamasını doğrulamak için MSMS verilerini (MS verileriyle eşzamanlı olarak elde edilen) kullanmaktır. - İlgi protein dizisine bir isim verin. Protein dizisini içe aktarın (FASTA formatında). Yazılım, LC-MS verilerini aramak için kullanılacak peptitlerin bir listesini oluşturmak için veritabanı proteininin siliko sindirimini gerçekleştirecektir.
- İşleme parametrelerini tanımlayın (Kitaplık menüsünün altında bulunur). Veri toplama türü olarak Electrospray MSE'yi seçin. Şarj için Kilit Kütlesi 2 alanına, [Glu-1]-fibrinopeptide B (GluFib) 2+ iyon için m/z için 785.8426 girin ve bitir'i tıklatın.
- İş Akışı parametrelerini tanımlayın (Kitaplık menüsünün altında bulunur).
- Arama türü için Electrospray MSE'yi seçin. İş Akışı | altında Veritabanı Arama Sorgusu başlığında, Databank alanında 4.2 adımında oluşturulan veritabanı proteinini seçin.
- Birincil Özet Reaktifini spesifik olmayan olarak değiştirin ve Carbamidomethyl C 'yitıklatırken Ctrl düğmesini basılı tutarak Sabit Değiştirici Reaktif alanını temizleyin.
- Seçenekler |'ne geçerek çıktı dizinini belirtme otomasyon kurulum | Kimlik E. Apex 3D ve Peptid 3D Output ve Ion Accounting Output kutularını işaretleyin ve istediğiniz dizini belirtin.
- Başvuru örneği verilerini işleyin.
- Proteomik platform çalışma alanının sol araç çubuğunda, Microtiter Plate'e sağ tıklayarak yeni bir plaka oluşturun. Mikrotiter plakadaki üç kuyuyu vurgulayın (bölüm 3'te toplanan her referans numune için bir tane). Bir kuyuya sol tıklayın, basılı tutun ve üç kuyuya sürükleyin.
- Sağ tıklatın ve ham veri ekle 'yiseçin. Görüntülenen pencerede, bölüm 3'teki üç başvuru dosyasını içeren dizine gidin ve bunları aynı anda seçin.
- İleri'ye tıklayın ve adım 4.3'te tanımlanan işleme parametrelerini seçin. İleri'ye tıklayın ve 4.4 adımında tanımlanan iş akışı parametrelerini seçin. Sonra bitiş'e tıklayın.
- Ham veriler, işleme parametreleri ve iş akışı parametreleri plakadaki her kuyuya atandıktan sonra kuyular mavi görünecektir. Kuyuları seçin, sağ tıklayın ve en son ham verileri işle'yi seçin. Verilerin işlenmesini izlemek için pencerenin sağ alt köşesine tıklayın. Çalıştıracak iş yok iletisi göründüğünde, işlem tamamen tamamlanır.
- Veri işleme tamamlandıktan sonra plakadaki kuyular yeşile dönecektir. Kuyulara sağ tıklayın ve iş akışı sonuçlarını görüntüle'yi seçin. Her başvuru veri dosyası için ayrı bir pencere açılır.
- Referans örnek verilerdeki MS sinyallerinin çoğunluğunun, ilgi çekici proteinin in-siliko sindiriminden tahmin edilen peptitlerle başarıyla eşleştirildiklerinden emin olmak için verileri inceleyin. Eşleşen peptitler çıkış spektrumunda mavi renklendirilecektir (Şekil 4). Tamam filtresine çift tıklayın ve yüzde kapsamının %99'dan büyük olup olmadığını kontrol edin.
NOT: İşlendikten sonra, veri çıktısı 4.5 adımda belirtilen dizine dosya uzantısı(raw_data_file_name_IA_final_peptide) ile otomatik olarak kaydedilir. - Ek eşikleme için proteomik yazılım çıktısını HDX işleme yazılımına(Malzeme Tablosu) aktarın.
- HDX işleme yazılımı penceresinin sol köşesindeki Veriler'e tıklayın. PLGS sonuçlarını içe aktar'a tıklayın ve ekle simgesine tıklayın. Uygun dizine geçerek 4.9.
- İleri'ye tıklayın ve aşağıdaki parametreleri belirtin: 2 ≥ en az ardışık iyon, kütle hatası = 5 ppm ve dosya eşiği = 3. Bitişüzerine tıklayın.
- Eşik parametrelerinden memnun olduktan sonra HDX projesini kaydedin. Tüm HDX verileri analiz ve görüntüleme için bu projeye aktarılacaktır.
NOT: Bir sonraki bölümde açıklanan döteryum değişim örneklerinin aynı LC-MS iş akışıyla işlenmesi gerekir. Bu nedenle, HDX testlerine (bölüm 5) geçmeden önce, örnek hazırlama (bölüm 2), aşağıdan yukarıya LC-MS iş akışı (bölüm 3) ve veri işleme iş akışlarının (bölüm 4) hedef proteinin istenen tekrarlanabilirliğini ve sıra kapsamını sağladığından emin olun. Kapsama alanını iyileştirmek için bu işlemlerden herhangi birinin değiştirilmesi gerekiyorsa, adım 2.1'e geri dönülmesi, üç taraflı olarak yeni referans örnekleri hazırlanması ve her peptitin tekrar üretilebilmesini ve algılanabilmesini sağlamak için 2−4 bölümlerinin (protokolde gerekli ayarlamaları yaparken) tekrarlanması önerilir.
5. HDX reaksiyonlarının yürütülmesi
- HDX reaksiyonları için çalışma alanını hazırlayın.
- Ön aliquot söndürme tamponu düzgün etiketlenmiş 0,5 mL tüplere ayırın. Analiz edilecek her zaman noktası, her kopya ve her biyokimyasal durum için farklı bir tüp hazırlayın. HDX reaksiyonunun 50 μL'lik bir kısmının son pH metre okumasını 2,3 değerine ayarlamak için gereken adım 2,2'den uygun söndürme tamponunu kullanın.
- Tüm söndürme tamponunu tüpün altına aktarmak için 0,5 mL küvetleri kısaca santrifüj edin. Tüpleri buza yerleştirin.
- Küçük bir Dewar'ı sıvı nitrojenle doldurun ve çalışma alanına bitişik tutun.
- HDX reaksiyonlarını hazırlayın. İstenilen değişim zaman noktası sayısını toplamak için yeterli reaksiyon hacmi olduğundan emin olun (istenen her zaman noktası için bir 50 μL aliquot). Zaman ölçeğinde 3−4 büyüklük sırasına göre en az 4−5 zaman puanı toplayın (örneğin, 15 s, 60 s, 300 s [5 dk], 1.800 s [30 dk] ve 14.400 s [4 h] söndürme süreleri çoğu enzim için değişim dinamiklerinin yeterli kapsamını sağlar).
- D2O'daki 1.1 adımından tüm kısırlaştırılmış bileşenleri (eksi enzim) önceden karıştırın.
- İncelenecek her biyokimyasal durum için (serbest enzim, enzim + ligand, enzim + inhibitör, vb.), HDX reaksiyonlarını en azından üç taraflı olarak hazırlayın.
- Reaksiyon karışımlarını enzimin eklenmesinden önce 25 °C'de sıcaklık kontrollü bir su banyosunda 10 dakika kuluçkaya yatırın.
NOT: Enzim, HDX testine protium eklenmesini en aza indirmek için konsantre bir stok çözeltisi (~100−200 μM, adım 1.6) olarak hazırlanmalıdır. - Enzimi 1−5 μM'lik son konsantrasyona ekledikten sonra zamanlayıcıyı başlatın. Enzimin numuneye eşit olarak dağıtıldığından emin olmak için çözeltiyi 200 μL pipet kullanarak dikkatlice ve hızlı bir şekilde karıştırın.
- İstenilen değişim zaman noktalarında, HDX reaksiyonundan 50 μL aliquot çıkarın ve 0,5 mL'lik bir tüpte önceden aliquoted, buz gibi söndürme tamponu ile hızlı ve eşit bir şekilde karıştırın.
NOT: Tüm numunelerde istenen 2,3'lük son söndürme pL'sine hızlı bir şekilde ulaşılabilmesi için karıştırma hacimleri ve karıştırma prosedürü mümkün olduğunca hassas ve tekrarlanabilir olmalıdır. Söndürme tamponu buzun soğuk tutulması, enzimin denatürasyonu üzerine geri değişimi en aza indirmeye yardımcı olacaktır. - HDX örneğini söndürdkten hemen sonra, tüpü kaplayın ve sıvı nitrojende flaş dondurun.
- Tüm tahliller tamamlanana kadar zaman puanlarını toplamaya devam edin, ardından numuneleri depolama için -80 °C dondurucuya aktarın.
NOT: Bu bir durma noktası olabilir. Tüm HDX zaman noktalarını topladıktan sonra, numuneler LC-MS analizine hazır olana kadar -80 °C'de saklanabilir. İdeal olarak, aynı gün tüm biyokimyasal ilgi durumları için üç taraflı HDX reaksiyonları yapılmalıdır. En azından, belirli bir biyokimyasal durum için tüm çoğaltma HDX reaksiyonları aynı gün paralel olarak çalıştırılmalıdır.
- Söndürülen tüm HDX zaman noktalarını topladıktan sonra, örnekleri 3.3 adımında açıklandığı gibi geliştirilmiş optimize edilmiş aşağıdan yukarıya LC-MS iş akışına tabi edin. Herhangi bir peptidin en az düzeyde olmasını sağlamak için HDX örneklerini numuneler arasında uygun sayıda boşlukla rastgele bir sırayla enjekte edin.
NOT: HDX verilerinin MSE modunda toplanması gerekmez. Bu nedenle, yüksek çarpışma enerjisi segmenti (adım 3.3.7.2) MS görev döngüsünden çıkarılmalıdır. Bu, adım 3.3'te açıklanan iş akışında yapılan tek değişiklik olmalıdır. - HDX verilerinin kalitesini toplanırken değerlendirin.
- Döterlenmemiş referans örneklerinin toplam iyon kromatogramında bulunan kromatografik tepelerin, kısırlaştırılmış örneklerde aynı tutma zamanında göründüğünden emin olun (Şekil 3D−F'deolduğu gibi).
- Referans ve döterlenmiş örneklerden belirli zaman aralıklarında toplanan kütle spektrumlarının döterasyon için kanıt gösterdiğinden emin olun (yani, bireysel peptitlerin izotopik zarfında, kısırlaştırılmış örneklerde daha yüksek m/z değerlerine geçiş [Şekil 6]).
6. HDX verilerinin işlenmesi
- Veri | tıklayarak HDX verilerini 4.11 adımında oluşturulan HDX projesine aktarın Üst araç çubuğundaki MS Dosyaları.
- Analizle ilgili biyokimyasal durumları (örneğin, serbest enzim, enzim + ligand vb.) ve döteryum maruz kalma sürelerini tanımlamak için gerektiğinde Yeni Durum ve Yeni Maruz Kalma'ya tıklayın.
- Analiz edilecek HDX veri dosyalarını seçmek için New Raw'a tıklayın. İçe aktarılan her ham veri dosyasına uygun değişim sürelerini ve biyokimyasal durumu atayın.
NOT: Veriler toplu olarak veya hepsi aynı anda içe aktarılabilir ve işlenebilir. Projeye veri eklemek, daha önce bu proje içinde gerçekleştirilen herhangi bir çözümlemeyi geri almaz.
- Veri dosyaları eklendikten sonra, veri işlemeye başlamak için Son'u tıklatın. Kısa bir gecikmeden sonra, yazılım devam etmeden önce kullanıcının verileri kaydetmek isteyip istemediğini soracaktır. Evet 'itıklatın.
NOT: İlk işlem, kaç numunenin analiz edildiğine, son peptit listesinde kaç peptit olduğuna (adım 4.10), kromatografik pencerenin boyutuna ve spektral edinim sıklığına bağlı olarak birkaç saat kadar sürebilir. - İsterseniz, iyon arama parametrelerini değiştirmek için Yapılandırma menüsündeki işleme parametrelerini değiştirin. Belirli bir projedeki tüm veriler için aynı iyon arama parametrelerini kullandığından emin olun.
7. HDX verilerinin analizi ve görselleştirilmesi
NOT: Ham verilerin ilk işlenmesi tamamlandıktan sonra (adım 6.2), HDX işleme yazılımı, analiz edilen ham veri dosyalarının her birinde peptit listesinden peptitler (adım 4.10'da oluşturulur) bulacaktır. Listedeki bir peptit için izotop dağılımı ham bir veri dosyasında bulunduğunda, HDX işleme yazılımı her izotopun bir "çubuk" ile temsil ettiğini (Şekil 6C−E'deolduğu gibi). Belirli bir peptit için çubukların göreli yoğunlukları daha sonra referans spektruma göre döteryum alımını hesaplamak için kullanılır. HDX işleme yazılımı çoğu peptide uygun şekilde "çubuklar" atama konusunda takdire şayan bir iş çıkarırken, döteryum alma değerlerinin önemli ölçüde manuel kürasyonu hala gerekli olacaktır.
- Peptit döteryum alma değerlerinin analizi
- Peptit listesindeki ilk peptidi seçin ve Görünümler menüsünden yığılmış spektral grafiği açın. Döteryum değişim süresinin işlevi olarak seçilen peptidin kütle spektrumunu görmek için yığılmış spektrum grafiği penceresinde yukarı ve aşağı kaydırın(Şekil 7D,E).
- Verilerde uygun izotop dağılımının bulunduğundan ve her izotop tepe noktasının atandığından emin olmak için fare tıklamalarını kullanarak çubukları gerektiği gibi atayın ve atamayı bırakın (atanan çubuklar mavi görünecektir). Yığılmış spektral çizimdeki spektrumlardan herhangi birine tıklamak (Şekil 7D,E) kullanıcının etkin veri görüntüleyici penceresinde çubuk atamasına /atamasını engellemesine izin verecektir (Şekil 7C).
- Yığılmış spektral çizim penceresinin üst kısmındaki şarj durumunu değiştirerek her bir ücret durumu için çubuk atamalarını kontrol edin.
- Her biyokimyasal ilgi durumu için 7.1.1−7.1.3 adımlarını yineleyin. Biyokimyasal durum, yığılmış spektral arsa penceresinin üst kısmında da ikame edilebilir. En doğru döteryum alma farkı ölçümleri için, çubukların her biyokimyasal durum için aynı yük durumları kümesi için atandığından emin olun.
- Peptit listesindeki her peptit için 7.1.1−7.1.4 adımlarını yineleyin.
- Kapsama haritasını kullanarak peptit döteryum alım değerlerinin standart sapması kontrol edin.
- İlgiilen proteinin amino asit dizisi boyunca eşlenen peptit listesindeki her peptidi görüntüleyen Görünümler menüsünden kapsama haritasına erişin (Şekil 8C). Peptitleri göreli standart sapmaya (Da birimleri) göre renklendirin.
- Haritada yüksek göreli standart sapmaya sahip aykırı peptitler için görsel olarak arama. Yığılmış spektral arsaları (Şekil 8B) ve veri görüntüleyici penceresini ( Şekil8A) hedef peptitle doldurmak için kapsama haritasındaki aykırı peptitlere tıklayın.
- Yığılmış spektral arsayı kullanarak, aykırı peptitin tüm şarj durumlarının ve tüm zaman noktalarının uygun şekilde çubuklar atadığını dikkatlice kontrol edin.
NOT: Çoğu zaman, büyük standart sapmalara sahip peptitler (>0.3 Da), yazılım tarafından uygun şekilde atanmamış izotopik tepelere sahiptir (Şekil 8B'debelirtildiği gibi). Eksik çubukların atanması genellikle peptitin göreli standart sapmasının <0.3 Da'ya düşürülmesini sağlar. - Göreli standart sapma 0,3 Da'nın altına düşürülemiyorsa peptidi listeden gizleyin.
- HDX fark verilerini, ilgi çekici proteinin yapısal bir modeline eşlemek için iki biyokimyasal durum arasında dışa aktarın.
- Kapsam haritasındaki ilgi farkını görüntüleyin. Fark verilerini bir .csv dosyasına dışa vermek için kapsam haritasına sağ tıklayın. Veri |'ne geçerek durum verilerini (.csv biçimde) verme Ana araç çubuğunda Durum Verilerini Dışarı Aktar.
NOT: Destek Bilgileri 'nde fark verilerinin ve durum veri dosyalarının uygun biçimlendirmesisağlanır. - Fark verilerini, durum verilerini ve ilgi proteininin pdb dosyasını Deuteros28'e içe aktarın. %99 güven aralığını seçin, toplamı etkinleştir 'iseçin ve verileri işleyin.
NOT: Deuteros'un çalıştırılması için MATLAB'ın bilgisayara yüklenmesi gerekir. Deuteros, her peptit için alım verilerinin standart sapmasını hesaplamak için veri kümesindeki çoğaltma ölçümlerini kullanır. Bu standart sapma, çizimlerde görüntülenecek önemli değişim için güven aralığını tanımlamak için kullanılacaktır. - PyMOL Seçenekleri'nin altında dışa aktarma alım | PyMOL yazılımını kullanarak ilgi proteininin pdb yapısına önemli değişim farkı olan bölgeleri haritalamak için bir Pymol komut dosyası oluşturmak için dışa aktarma.
NOT: Bu protokolde açıklanan iş akışını kullanarak, belirli bir peptit için tek bir zaman noktasında önemli döteryum alma farkı için %99 güven aralığı genellikle 0,3−0,5 Da'dır. Tüm değişim zaman noktalarında özetlenen fark için %99 güven aralığı genellikle 0,7−1,0 Da'dır.
- Kapsam haritasındaki ilgi farkını görüntüleyin. Fark verilerini bir .csv dosyasına dışa vermek için kapsam haritasına sağ tıklayın. Veri |'ne geçerek durum verilerini (.csv biçimde) verme Ana araç çubuğunda Durum Verilerini Dışarı Aktar.
Sonuçlar
Proteolitik sindirimin kalitesini ve her örnek enjeksiyon kümesi için iş akışının tekrarlanabilirliğini değerlendirmek gerekir. Bu nedenle, HDX-MS tahlillerini yapmadan önce, ilgi çekici proteinin proteolizi, ters faz sıvı kromatografisi ve gaz fazı iyon hareketliliği kullanılarak peptitlerin ayrılması ve MS kullanılarak peptitlerin tespiti için etkili koşulların oluşturulması esastır. Bu amaçla öncelikle ilgi çekici proteine yönelik referans örnekleri (döteryum yokluğunda toplanır) araştırılmalıdır (bölüm 3). Şekil 3A−C'deki kromatografik veriler, HalM2 lantipeptid sentezinin üç referans örneği için toplam iyon kromatogramlarını (TİC) göstermektedir. TIC, kütle spektral taramasına dahil edilen tüm m/z değerlerinde tüm iyon sayımlarının toplamında zamana bağlı değişikliktir. 3 ila 8 dakika arasındaki TIR'ların daha yakından görünümleri Şekil 3D−F'degösterilmiştir. Şekil 3G−I'de gösterilen kütle spektrumları, her TIC'nin küçük bir zaman aralığında (5,0 ila 5,1 dk) tüm kütle spektrumlarının bir özetini temsil eder. Şekil 3'teaşağıdaki özelliklere özellikle dikkat edilmelidir.
İlk olarak, gradyanın sonundaki 9,3 dakikaya yakın büyük tepe, HalM2(Şekil 3A−C)parçalarının eksik sindirilmiş (ve dolayısıyla daha fazla hidrofobik) parçalarını temsil eder. HalM2 konsantrasyonu azaltılarak sindirim daha verimli hale getirilebilir, ancak bu peptit sinyal yoğunluğunu ve sinyal:gürültü oranını azaltacaktır. Pepsin sütunu ile temas süresi (3 dk'dan, protokol adım 3.3.3) artırılarak sindirim daha verimli hale getirilebilir. Ancak, artan temas süresi daha fazla geri değişime neden olacaktır. Sonuç olarak, istenen sıra kapsamını, sinyal yoğunluğunu ve döteryum tutmasını sağlamak için bu parametrelerin ilgi proteini için dengelenmiş olması gerekir. İkinci olarak, TIC profillerinin şekli ve yoğunluğu benzer olmalıdır (Şekil 3D−F'deolduğu gibi). Bu, HalM2'nin proteolitik sindiriminin tekrarlanabilir olduğunu ve her üç referans numunesinde de benzer verimlilikte olduğunu göstermektedir. Beklenti, döteryumla değiş tokuş edilen bir numunenin benzer bir sindiriminin, benzer tutma sürelerine sahip aynı peptit kümesini üretmesidir. Üçüncü olarak, belirli bir zaman aralığındaki kütle spektrumları da benzer olmalıdır (Şekil 3G−I). Kromatografik ayrımın 5.0−5.1 dakikalık zaman aralığında toplam kütle spektrumunun hızlı bir görsel karşılaştırması, her örnekteki kütle spektral sinyallerinin gerçekten çok benzer olduğunu ve her örnekte benzer peptitlerin bulunduğuna ve C18 sütunundan benzer zamanlarda kaçtığına dair güven sağladığını göstermektedir. Kromatogram boyunca diğer zaman aralıklarında benzer bir hızlı görsel inceleme yapılmalıdır.
Referans örneklerin LC-MS verilerindeki benzerlik görsel olarak doğrulandıktan sonra, proteomik yazılım, MS verilerinde ilgi çekici proteinin amino asit dizisinden elde edilen peptitleri aramak için kullanılır. Protokol adımları 4.2−4.4'te açıklandığı gibi protein dizisi databank (ilgi proteininin amino asit dizisi), işleme ve iş akışı parametreleri tanımlandıktan sonra, her bir referans örneği, ilgi proteininden elde edilen tahmini peptitlerle eşleşen peptik peptitleri tespit etmek için işlenir. Dağlanmamış bir HalM2 referans örneği için proteomik yazılım çıktısının bir örneği Şekil 4'te gösterilmiştir. Aşağıdaki özelliklere özellikle dikkat edilmelidir. İlk olarak, işleme ve iş akışı parametrelerinde tanımlanan değerlere göre ilgi proteini içindeki belirli bir peptitle eşleşen herhangi bir MS sinyali alt spektrumda mavi renklendirilir. Bir referans örneği "başarıyla" işlenirse, sinyallerin çoğu mavi görünür (Şekil 4'tekiveriler için olduğu gibi). Ayrıca, sol üst panelde, "Tamam Filtresi"nin yeşil onay işaretine değiştirilmesini sağlayın. Bu yapıldığında, sağ üst panelin üst çubuğundaki istatistikler (Şekil 4'temavi ile vurgulanır) yalnızca yüksek güven puanı veren peptitleri yansıtacaktır. Bu peptitler düşük ppm kütle doğruluğu, çoklu parça iyonları ve parça ve üst iyon tutma süreleri arasında iyi korelasyon sergiler ve kendinden emin tanımlamalar olarak kabul edilir. Gösterilen HalM2 referans örneği için, HalM2 dizisinin% 99.6'sını kapsayan yüksek puanlı 1.421 peptit tespit edildi. Protokol bölüm 3'te açıklanan aşağıdan yukarıya LC-MS iş akışı kullanılarak çoğu protein için %100'e yakın sıra kapsamına ulaşılabilir olmalıdır. Ayrıca, her peptit için ek yararlı istatistikler, kütle hatası, öncül tutma süresi, parça sayısı (ürün iyonları), parça iyonlarının ada göre tam listesi ve iyon hareketliliği sürüklenme süresi dahil olmak üzere sağ üst panelde tablolanır. Bu bilgi, her zaman en güvenli şekilde tanımlanan peptitlere odaklanılması gereken sonuçların yorumlanması için yararlıdır.
Son peptit listesi, HDX işleme yazılımında ek eşikleme ile belirlenmelidir. Peptit listesini oluşturmak için referans verileri analiz edildikten sonra (protokol bölüm 4), çıktı ek eşikleme için HDX işleme yazılımına içe aktarılmalıdır. Çıktı dosyaları, protokol adım 4.5'te tanımlandığı gibi "..._IA_final_peptide.csv" dosya uzantısıyla bir dizinde depolanacaktır. Çıktıyı HDX işleme yazılımına yükledikten sonra, peptitlerin tam listesi "peptit önizleme" panelinde (Şekil 5) gösterilecek ve peptit sayısı, sıra kapsamı ve artıklık pencerenin sağ alt köşesinde görüntülenecektir. Ek eşik uygulandıkça bu değerler gerçek zamanlı olarak değişecektir. İleri'yi tıklattıktan sonra, eşik değerleri belirtilen alanlarda ayarlanabilir. En kritik filtreler, tüm peptitlerin üç referans örneğinin her birinde bulunmasını gerektiren "dosya eşiği"dir. <10 ppm değerine ayarlanması gereken "maksimum MH+ hatası (ppm)" ve MSE iş akışının MSMS (yani yüksek çarpışma enerjisi) aşamasında (protokol adımı 3.3.7.2) peptitin en az iki ardışık parça iyonları oluşturmasını gerektiren "minimum ardışık ürünler".
HDX-MS testinin en önemli teknik sınırlaması, döteryum ile değiştirilen numuneler söndürülür söndürülmez (protiated tampon ile) ortaya çıkan protium için döteryumun geri değişimidir. İş akışının proteaz sindirimi ve LC-MS bölümleri sırasında geri değişim devam eder. Geri değişim kaçınılmazdır, ancak tüm söndürme sonrası adımların pH'ı, sıcaklığı ve zamanlaması protokolde açıklandığı gibi dikkatlice kontrol edilirse, döteryum etiketinin% 60−70'i korunabilir. Bu nedenle, test gelişiminin erken aşamalarında peptitlerin çoğunun döteryum koruduğunu kontrol etmek önemlidir. Bu, kısırlaştırılmış bir örneğin ham verilerini bir referans örneğininkiyle karşılaştırarak hızlı bir şekilde elde edilebilir. Referans örneklerinin tekrarlanabilirliğini sağlamak için yapıldığı gibi (Şekil 3), döteryumla değiş tokuş edilen ve dağlanmamış referans örneklerinin TİC'lerini karşılaştırarak profillerin şekillerinin birbirine benzemesini sağlar. Ayrıca, kütle spektrumunu her iki örnekte de aynı kromatografik zaman aralığında toplar. Döteryum değişimli numunedeki peptitlerin çoğu, izotopik dağılımlarında daha yüksek m/z değerlerine doğru belirgin kaymalar sergilemelidir (Şekil 6'daolduğu gibi). Bu veriler, döteryum etiketinin önemli bir kısmının asit söndürme, pepsin sindirimi ve LC-MS veri toplama boyunca korunduğunu göstermektedir.
İş akışının yeterli döteryum tutma sağladığını doğruladıktan sonra, döteryum alımının ölçülmesi gerekir. Böylece, döteryumla değiştirilen numunelerin ham verileri HDX işleme yazılımına aktarılır. Referans örneklerini ve kesinleşmiş peptit listesini kullanan HDX işleme yazılımı, ham veri dosyalarının her birinde peptit listesindeki peptitleri bulacak ve izotopik zirvelerin her birine "çubuklar" atayacaktır. Şekil 7'degösterilen HalM2 temsili verilerinde, başarıyla atanan çubuklar tüm spektrumlarda mavi renktedir. Çubuklar atandıktan sonra, izotopik dağılım için centroid m/z değeri yazılım tarafından belirlenecek ve döteröryum alımını döterlenmemiş referans örneğine göre hesaplamak için kullanılacaktır. Her peptit için döteryum değişim değeri manuel olarak kontrol edilmelidir. Şekil 7'de, şu anda seçili olan peptit (HIDKLTVGL, HalM2 kalıntılarını 110−118'e yayılan) ana veri görüntüleyicinin sol panelinde gösterilmiştir (Şekil 7A). Diğer paneller bu peptitle ilişkili HDX verilerini gösterir. Peptit listesindeki herhangi bir peptide tıklamak, diğer panelleri bu peptitten HDX verileriyle dolduracaktır. Şekil 7B, peptit 110−118 için döteryum alma arazilerini göstermektedir. Bu veri kümesi dört değişim zaman noktası içerir: 0,5, 5, 30 ve 240 dk (üç taraflı olarak toplanır). Değişim verileri iki biyokimyasal durum için toplandı: amppnp ve substrat peptid HalA2 (mavi) için karmaşık serbest HalM2 enzimi (kırmızı) ve HalM2 enzimi. Tüm zaman dilimi boyunca peptit 110−118'e olan önemli döteryum alımı farkını ve çoğaltma ölçümlerinin yüksek hassasiyetini not edin (hata çubukları Şekil 7B'dekiçizimde gösterilmiştir). Genel olarak, çoğu peptit için alım ölçümünde benzer hassasiyet elde edilecek ve bu protokolde sunulan iş akışının tekrarlanabilirliğinin altını çizecektir. Ligand bağlaması üzerine (Şekil 7B'demavi eğri), HalM2'nin 110−118 bölgesindeki peptit bağı, görünüşe göre döteryum değişiminden önemli bir korumadan geçer ve bu da 110−118 bölgesindeki amino asitlerin ligand bağlanması üzerine daha sıkı bir şekilde yapılandırılıyor olduğunu göstermektedir. Bu bölgenin sonraki mutajenisi öncü peptide bağlanmada bir rol olduğunu gösterdi, HalA220. Şekil 7'de ayrıca HalM2 durumu (Şekil 7D) ve HalM2:AMPPNP:HalA2 durumu (Şekil 7E) için yığılmış spektral arsalar gösterilmiştir. Bu arsalarda değişim süresi alttan üste doğru artar. Döteryum değişiminde peptit 110−118'in daha uzun zaman noktalarında kitlesel artışı görsel incelemeden belirgindir. Peptit 110−118'in HalM2 durumunda(Şekil 7D)tam liganded durumundan daha fazla döteryum kaptığı da açıktır (Şekil 7E). Gerekirse, Şekil 7D veya Şekil 7E 'deki alt pilotlardan herhangi birine tıklamak, kullanıcının ana veri görüntüleyicideki çubukların atamasını manuel olarak değiştirmesine izin verecektir (Şekil 7C). Çubuk atama/atamadan sonra, HDX işleme yazılımı döteryum alma değerlerini yeniden hesaplar ve tüm çizimler gerçek zamanlı olarak güncellenir. Benzer şekilde, B panelinde tek tek veri noktalarına tıklanınca, el ile çubuk ataması için C panelinde veri görüntüleyici doldurulur.
Her peptit için çubuklar atandıktan ve tüm biyokimyasal durumlar için değişim zaman noktası atandıktan sonra, ölçülen alım değerlerinin standart sapması kontrol edilmelidir. Bu kapsama haritası ve yığılmış spektral arsa ile gerçekleştirmek en kolayıdır (Şekil 8). Kapsam haritasında (Şekil 8C), ilgi durumunu ve değişim zamanını seçin, ardından göreli alım standardı sapması seçin. Kapsama haritasındaki peptitler, ölçülen döteryum alma değerindeki standart sapmaya göre renklendirilecektir. Bu şekilde, izotop çubuğu yanlış atamaları olan peptitleri görsel olarak tanımlamak çok kolay olacaktır. Kapsama haritasındaki aykırı peptide (yüksek standart sapma ile) tıklamak, ana veri görüntüleyiciyi ve yığılmış spektrum grafiğini aykırı peptitten HDX verileriyle dolduracaktır. Her zaman noktası ve şarj durumu için çubuk atamaları daha sonra ölçülen alım değerini düzeltmek için gerektiği gibi değiştirilebilir. Yine, HDX işleme yazılımı, çubuk atamaları değiştikçe tüm veri ekranlarını gerçek zamanlı olarak güncelleyecektir.
HDX veri kümesini tamamen küratörlüğünü yaptıktan sonra, veri yorumlamadan önce her peptit için döteryum alma farkı ölçümünün önemi göz önünde bulundurulmalıdır. Engen ve iş arkadaşları tarafından açıklanan bir yaklaşım kullanarak29, yukarıdaki protokol 20'de açıklanan iş akışını kullanarak HalM2 proteini için ortalama 0,1 ±0,1Da alım değeri tahmin ettik. Bu değer, benzer aşağıdan yukarıya, sürekli değişim HDX iş akışları29,30için başkaları tarafından bildirilen hatalarla tutarlıdır. Son zamanlarda, Politis ve iş arkadaşları, HDX veri setlerindeki önemli alım farklılıklarını hızla belirlemek için yararlı bir açık kaynak aracı olan (MATLAB'da uygulanan) Deuteros'u geliştirdi28. Deuteros için temsili giriş dosyaları ("State_Data_for_Deuteros" ve "Difference_Data_for_Deuteros") Destekleyici Bilgiler'e dahildir. Doğrudan bu protokolde açıklanan HDX işleme yazılımından(Malzeme Tablosu)dışa aktarılırsa, fark ve durum veri dosyaları Deuteros tarafından dosya okumak için uygun biçime sahip olacaktır. HDX verileri farklı bir LC-MS sisteminde oluşturulursa, Destekleyici Bilgiler'de sağlananlara benzeyen veri dosyalarının manuel olarak oluşturulması gerekir.
Dueteros çalışma alanı Şekil 9'da gösterilmiştir. Veriler Deuteros'a alındıktan sonra, kullanıcı istenen güven sınırını seçer (>%98 önerilir) ve İçeri Aktar ve Hesapla 'yı tıklatır. Düzleştirilmiş veri eşlemi için, veri türü için kapsama alanını ve renk ölçeği için mutlak'ı seçin. Çizim 'itıklatın. Orman çizimleri için, veri türü, istenen güven filtresi olarak ikili filtreyi seçin ve toplamı etkinleştirin. Arsatıklanında, Deuteros amino asit dizisindeki konumlarının ve döteryum alım değerlerinin bir işlevi olarak her değişim zaman noktasındaki tüm peptitleri çizecektir. Önemli bir değişim gösteren peptitler, hesaplanan farka göre peptitin sırasıyla az ya da çok döteryum alıp almadığına bağlı olarak kırmızı veya mavi renklendirilecektir. Her çizimde bildirilen önem değeri (Şekil9'da çizilen verilerde 0,39 ile 0,72 Da arasında değişen) veri kümesinde bulunan çoğaltma ölçümlerinden belirlenen her peptit için ölçülen alım farklılıklarının standart sapmalarından hesaplanır. Güven aralıkları, her bir çizimde kesikli çubuklar olarak gösterilir. Etkinleştirilirse, "Toplam" her peptit için her zaman noktasında ölçülen alım farkını ekler. Son olarak, ilgi proteininin üç boyutlu yapısına ilişkin alım verilerinin görselleştirilmesi için PyMOL seçenekleri altında ihracat alımını seçin, ardından dışa aktarın. Deuteros, ilgi çekici proteinin açık pdb dosyasını içeren PyMOL çalışma alanına sürüklenebilen ve bırakılabilen bir PyMOL komut dosyası oluşturacaktır.
Bu protokolde sunulan HDX-MS iş akışı, genetik olarak kodlanmış bir peptit (HalA2)20üzerine bir dizi çeviri sonrası modifikasyonu katalizleyen bir enzimin (HalM2) biyokimyasal özelliklerini karakterize etmek için kullanılmıştır. Şekil 10'da,HalA2 öncül peptidinin HalM2:AMP-PNP kompleksine bağlanması için temsili HDX-MS sonuçları gösterilmiştir. Panel A, rengin [HalM2:AMPPNP] biyokimyasal durumu ile [HalM2:AMPPNP:HalA2] durumu arasındaki göreli alım farkını gösterdiği HalM2 kapsama haritasını gösterir. Deuteros, bu alım farklılıklarını HalM2 enziminin bir homoloji modeline eşlemek için kullanılmıştır (Şekil 10B,C). Kırmızı renkli peptitler, HalA2 bağlaması üzerine döteryum alımında bir azalma olduğunu gösterir, bu da HalM2'nin bu bölgelerinin doğrudan öncü peptidin bağlanmasında rol alabileceğini düşündürmektedir. Bu hipotezi araştırmak için I-III bölgeleri mutasyona uğradı ve varyant enzimlerin kinetik özellikleri araştırıldı. Bölge I ve III'teki mutasyonlar, HalA2 peptit bağlayıcı benzeşiminde önemli pertürbasyonlara yol açarak, HalM2'nin bu bölgelerinin ya doğrudan peptit substratı ile etkileşime girdiğini ya da HalA2 bağlamasını sağlayan yapılar oluşturması gerektiğini düşündürmektedir. Buna karşılık, BÖLGE II'nin mutasyonunun HalA2 bağlayıcı benzeşimi üzerinde hiçbir etkisi yoktu, ancak bu mutant neredeyse katalitik aktiviteden yoksundu. Bu bulgunun bir açıklaması, HalA2 bağlaması sırasında gözlenen bölge II'nin organizasyonunun enzimi aktive eden konformasyonsal bir değişikliği tetiklemesidir. Bu çalışmadan önce, HalM2-HalA2 bağlama modu veya sistemdeki katalitik olarak ilgili konformasyon değişiklikleri hakkında hiçbir bilgi bulunmadığı belirtilmelidir, çünkü öncelikle hem HalM2 hem de HalA2'nin büyük boyutu ve esnek doğası yapısal çalışmaların önüne geçti. Bu nedenle, HalM2 lantepeptid sentezi üzerindeki bu temsili veriler, HDX-MS'in yüksek çözünürlüklü yapısal verilerin yokluğunda bile yapısal olarak dinamik enzim sistemlerinin işlevsel olarak ilgili bölgelerini hızlı bir şekilde bulmak için nasıl kullanılabileceğini göstermektedir.
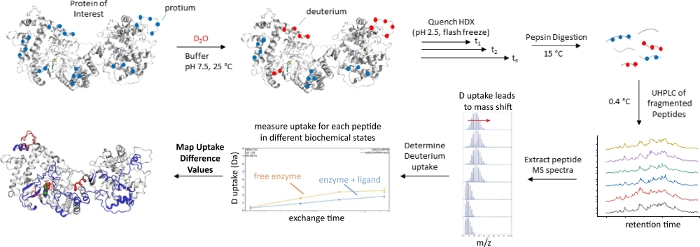
Şekil 1: Sürekli bir değişim, aşağıdan yukarıya HDX-MS iş akışı. Ayrıntılar için metne bakın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: HDX oranı protein konformasyon dinamiklerine(kaçık ve kkapanış)ve N-D bağları için protein omurgasındaki N-H bağlarının kimyasal değişiminin pH'a bağlı oranına bağlıdır (kkimya). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Üç taraflı HalM2 referans örnekleri için temsili LC-MS verileri. Her panelin sağ üst köşesindeki sayı, toplam iyon sayılarını temsil eder. Her satır farklı bir başvuru örneği için verileri gösterir. İlk sütun (A−C) toplam iyon kromatogramlarını (IC' ler) gösterir. 9,3 dakikadaki büyük tepe, büyük, sindirilmemiş peptitleri temsil eder. Orta sütun (D−F) TİC'lerin 3 ila 8 dakika arasında daha yakından görünümünü gösterir. Tüm kromatogramdaki her referans örneğinde peptit sinyallerinin benzer bir temel karışımını gösteren profillerin şekillerinin iyi bir şekilde aynı olduğunu unutmayın. Üçüncü sütun (G−I) kromatografik çalışmanın 5.0 ve 5.1 dakika arasında kaydedilen tüm kütle spektrası toplanarak oluşturulan her referans örnek için kütle spektrumunu gösterir. Bu verilerin görsel incelemesi, her örnekte aynı peptitlerin çoğunun tespit edildiğini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
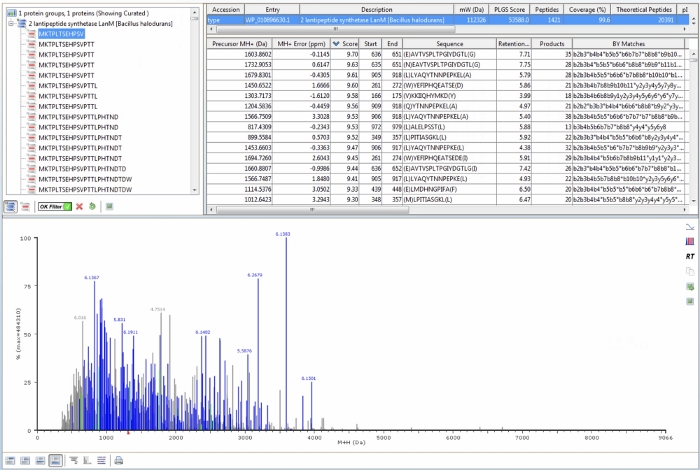
Şekil 4: HalM2 referans örneği için temsili proteomik yazılım çıktısı. Sol üst panel, MS verilerinde tespit edilen HalM2 türevi peptik peptitlerin tam listesini gösterir. "Tamam Filtresi"nin yeşil onay işaretini gösterdiğini unutmayın. Bu, verileri güven puanına göre filtreler ve düşük güven peptit tanımlamalarını kaldırır. Sağ panelin üst çubuğu (mavi ile vurgulanır), yüksek puanlı peptit kümesi için kümülatif istatistikler gösterir. En önemli istatistikler tespit edilen peptit sayısı (bu durumda 1.421) ve sıra kapsamıdır (bu durumda% 99.6). Her peptit için ek istatistikler de sağ üst panelde gösterilir. Bu veri tablosundaki her sütun sıralanabilir. Alt panel, tahmin edilen HalM2 türevi peptik peptitle eşleşen tüm MS sinyallerini gösterir. MS sinyallerinin çoğunun atandığını ve mavi renkli olduğunu unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: HDX işleme yazılımında ek eşik. Üç HalM2 referans örneğinin her biri için proteomik yazılım çıktısı HDX işleme yazılımına (sol panel) aktarılır. Veri alındıktan sonra ek eşik oluşturma gerçekleştirilir (sağ panel). "Minimum ardışık ürünler" alanı, peptitteki bitişik peptit bağlarının bölünmesiyle oluşturulan parça iyonlarını ifade eder. "Minimum MH+ hatası" parametresi, kullanıcının kabul edilebilir kütle doğruluğunu tanımlamasına izin verir ve "dosya eşiği", kullanıcının peptitleri yalnızca üç referans dosyasında da algılanan peptitlerle kısıtlamasına izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Bir HalM2 referans örneği (kırmızı) ve bir HalM2 örneği için temsili veriler 5 dakika boyunca D2O tamponunda inkübe edilir (yeşil). Her iki örnek de protokol bölüm 3'te açıklanan aşağıdan yukarıya LC-MS iş akışına tabi tutuldu. Sol sütun, 6,0−6,1 dakikalık zaman aralığı boyunca toplanmış kütle spektrumunu gösterir. Üç sağ sütun, döterlenmiş numunedeki (yeşil, üst) daha yüksek m/z değerlerine geçişin peptit sinyallerinin çoğu için açık olduğu aynı kütle spektrumunun daha yakın görünümlerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: HDX işleme yazılımındaki çalışma alanının ekran görüntüsü. (A) HalM2 referans örneklerinin proteomik yazılımla analizinden elde edilen HalM2 türevi peptitlerin listesi (Şekil 3) ve hdx işleme yazılımında sonraki eşik (Şekil 4). Şu anda seçilen peptit (HIDKLTVGL, HalM2 kalıntılarını 110−118'e yayılan) mavi ile vurgulanmıştır. (B) İki biyokimyasal ilgi durumları için döteryum alma eğrileri (değişim süresinin bir fonksiyonu olarak) : serbest HalM2 enzimi ve AMPPNP'ye bağlı HalM2 enzimi ve öncü lantipeptid, HalA2. (C) Aktif olarak seçilen numunenin kütle spektrumu (bu durumda, kısırlaştırılmamış HalM2 referans örneklerinden biri). C panelinde bulunan mavi çubuklar, ilk veri işleme sırasında HDX işleme yazılımı tarafından uygun şekilde atanmamışsa, gerektiğinde manuel olarak atanabilir/atanamaz. (D,E) HalM2 durumu (D) ve HalM2:AMPPNP:HalA2 durumu (E) için yığılmış spektral arsalar. Döteryum alımındaki zamana bağlı artış, iki biyokimyasal durum arasındaki alım farkı gibi kolayca görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: Ölçülen alım değerlerinde standart sapmanın en aza indirilmesi. HDX işleme yazılımındaki (panel C) kapsama haritası, ölçülen döteryum alma değerlerinde büyük standart sapmalara sahip peptitleri hızlı bir şekilde tanımlamak için uygun bir araç sağlar. Bu varsayımsal durumda, 110−118 kalıntılarını kapsayan HalM2 türevi peptit için izotop tepelerinden bazıları (mavi çubuklar) 5 dakikalık değişim zaman noktaları (B panelinde gri çubuklar) için atanmamıştır. Bu, 5 dakikalık değişim zaman noktası için ölçülen döteryum alma değerinde büyük bir standart sapmaya yol açtır. Büyük standart sapma, kapsama haritasındaki (panel C) 110−118 peptidin mavi renginden ve alım grafiğindeki (panel A) veri noktası saçılımından ve büyük hata çubuğundan kolayca açıktır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 9: Deuteros çalışma alanı. Bu örnekte, ALMA farkı değerleri HDX işleme yazılımında HalM2:AMPPNP:HalA2 durumunun döteryum alımı HalM2:AMPPNP durumundan çıkarılarak hesaplanmıştır. Karşılaştırmanın amacı, peptit (HalA2) bağlamasının HalM2:AMPPNP kompleksinin yapısal dinamiklerini nasıl değiştirdiğini görselleştirmekti. Veri kümesi 4 değişim zaman noktası (0,5, 5, 30 ve 240 dk) içeriyordu. Her değişim zaman noktasındaki her peptit için alım farkı Woods arazilerinde gösterilmiştir. Woods arazilerindeki renkli peptitler, veri kümesinde bulunan çoğaltma ölçümlerinin standart sapması ve Deuteros'ta seçilen kullanıcı tanımlı güven sınırları ile tanımlandığı gibi, önemli bir alım farkı gösteren peptitleri gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
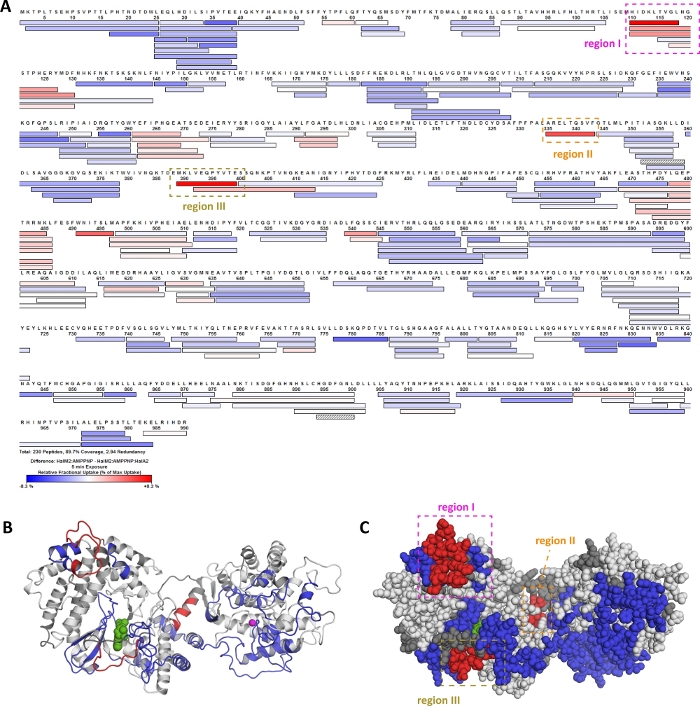
Şekil 10: HDX-MS verileri lanteptid sintetaz HalM2'de peptit bağlama ve allosterik aktivasyonun fonksiyonel analizine rehberlik eder. HalA2 öncü peptidinin HalM2 lantieptid sintetazine bağlanması üzerine döteryum alımı değişimi araştırılmıştır. 5 dakikalık bir değişim reaksiyonundan sonra her peptit için alım farkı çizilir (A). Bu çizim HDX işleme yazılımında oluşturulmuştu. Peptitler renkli kırmızı ve mavi, HalA2 peptidi varlığında sırasıyla daha az ve daha fazla döteryum alımına uğrar. Bu HDX "sıcak noktalar" bir HalM2 homoloji modeline(B,C)eşlenir. Deuteros'ta önemli değişim farklılıkları yaşayan peptitlerin tanımlanması belirlendi. Fark değerlerini homoloji modeline eşlemek için kullanılan PyMOL komut dosyası Deuteros'ta oluşturuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde sunulan HDX-MS iş akışı, proteinlerdeki yapısal dinamik elemanların mekansal dağılımını haritalamak ve bu dinamiklerin pertürbasyona (ligand bağlama, enzim mutagenezi vb.) yanıt olarak nasıl değiştiğini araştırmak için son derece sağlam bir platform sağlar. HDX-MS, konformasyonsal dinamikleri araştırmak için yaygın olarak kullanılan diğer yapısal biyoloji yaklaşımlarına göre birkaç farklı avantaja sahiptir. En önemlisi, sadece az miktarda proteine ihtiyaç vardır. Burada açıklanan iş akışını kullanarak, 1 μM proteinden oluşan 1 mL'lik bir örnek, her biri 5 değişim zaman noktası içeren üç taraflı HDX reaksiyonları için yeterli malzeme sağlar. Ayrıca, ilgi proteininde neredeyse hiçbir boyut sınırı yoktur ve protein kompleksleri HDX-MS yaklaşımına eşit derecede uygundur. Boyut sınırı sadece peptik peptitlerin kromatografik olarak ve m/z ve iyon hareketliliği boyutlarında çözülebildiği ölçüde kısıtlanır. Bu nedenle, birçok protein/protein kompleksi için HDX-MS protein-protein etkileşim arayüzleri, ligand bağlama bölgeleri, konformasyonsal dinamikler ve allosterik ağlar hakkında değerli bilgiler sağlayacaktır. Son olarak, HDX reaksiyonu, endojen aktivitenin korunmasını sağlamaya yardımcı olması gereken proteinin sına özgü etiketlemesine / mühendisliğine gerek kalmadan nazik, neredeyse yerel koşullar altında gerçekleştirilir. Yaklaşımın ana sınırlaması (ilgi proteini üzerinde sağladığı mekanistik bilgiler açısından) peptit seviyesi HDX verilerinin doğası gereği düşük mekansal çözünürlüğe sahip olmasıdır. Bu nedenle, veriler ikincil yapıda bir değişikliğin meydana geldiğini çıkarmak için yeterlidir, ancak yapısal pertürbasyonun mekanistik etkileri, tam olarak yorumlamak için daha yüksek çözünürlük (örneğin, NMR, cryoEM veya X-ray kristali) yapılar, hesaplama çalışmaları ve / veya biyokimyasal çalışmalar gerektirir.
Sonuçların tekrarlanabilirliğini ve güvenilirliğini sağlamak için, protokolün birkaç kritik yönü akılda tutulmalıdır. İlk olarak, HDX reaksiyon sırasında döteryum değişiminin boyutu ve çalışma ve analiz sırasında geri değişimin boyutu pH, zaman ve sıcaklığa bağlıdır. Bu nedenle, tamponların, HDX reaksiyonlarının ve LC-MS yöntemlerinin hazırlanmasına yönelik prosedürler, veri kümeleri arasında bu fiziksel parametrelerdeki varyasyonu en aza indirmek için mümkün olduğunca sistematik olmalıdır. Mümkün olduğunda, karşılaştırılacak biyokimyasal durumlar için HDX reaksiyonları aynı gün aynı araştırmacı tarafından yapılmalı ve bu örnekler için LC-MS verileri aynı çözücü grubu ile ardışık günlerde toplanmalıdır. Zamanla, pepsin sindiriminin verimliliği de azalacaktır, bu nedenle nispeten dar bir zaman penceresinde sindirilecek ve analiz edilecek numuneler için en uygun olanıdır−özellikle pepsin sütunu diğer birçok örnek türünü sindirmek için kullanılıyorsa. Pepsin sütununun sindirim verimliliğini standart bir protein kullanarak periyodik olarak kontrol etmek iyi bir uygulamadır. Bunu başarmak için, aynı hedef peptit kümesinin benzer yoğunluklarda algılanmasını sağlamak için yeni sindirilen örneklerin eski örneklerle karşılaştırılabileceği özel bir HDX işleme yazılımı projesi kurulabilir.
Bu protokolde sunulan iş akışının birçok enzim/protein sistemi için yeterli veri sağlaması gerekirken, optimizasyonun birkaç potansiyel noktası vardır. İlk olarak, HDX reaksiyonunun zaman ölçeği, daha hızlı / daha yavaş dinamikleri yakalamak için değiştirilebilir. En önemlisi, birçok enzim birkaç saniye içinde tamamen değiştirilecek son derece dinamik elementler içerecektir. Bu son derece dinamik unsurlar ilgi çekiciyse, önceden sabit durum için yöntemler, sürekli değişim HDX-MS literatürde bildirilmiştir31. İkinci olarak, LC yöntemi koşulları sindirim verimliliğini (sonuçta sıra kapsamını belirler) ve döteryum tutmasını (sonuçta yöntemin hassasiyetini belirleyen) değiştirmek için kolayca değiştirilebilir. Pepsin sindiriminin süresi ve sıcaklığı göz önüne alındığında, daha yavaş akış hızları ve daha yüksek sıcaklık proteinin daha kapsamlı sindirimini sağlayacaktır. HDX testinde protein konsantrasyonu, sinyal yoğunluğu çok düşükse arttırılabilir veya pepsin sindirimi çok verimsizse azaltılabilir. Analitik C18 sütunundaki peptik peptitleri ayırmak için kullanılan asetonitril gradyan göz önüne alındığında, daha hızlı bir gradyan döteryum etiketini koruyacaktır, ancak sindirilen reaksiyon karışımında bulunan peptik peptitlerin kromatografik çözünürlüğü pahasına. Sindirimde daha az peptik peptit bulunan daha küçük proteinler (~200 amino asit) için daha hızlı bir LC gradyanı uygulamak daha kolay olabilir. HalM2 (~1.000 amino asit) gibi daha büyük proteinler için, karışımdaki daha fazla sayıda peptit tarafından üretilen ek spektral karmaşıklığı çözmek için daha uzun bir gradyana ihtiyaç vardır. Bu ikinci senaryoda, bir gaz fazı iyon hareketliliği ayrımının dahil edilmesi, analizin en yüksek kapasitesini önemli ölçüde artırmaya yardımcı olabilir. İyon hareket kabiliyeti ayrımının dahil edilmesi, gürültü oranına biraz daha düşük bir sinyal maliyetiyle gelir. Son olarak, HDX örnekleri için MS verilerinin MSE modunda toplanmasına gerek olmadığı belirtilmelidir. MSE görev döngüsünün MSMS kısmı (yani, yüksek çarpışma enerjisi segmenti, adım 3.3.7.2) sadece peptit listesini tanımlamak için referans örnekleri için gereklidir (protokol bölüm 4). Bu nedenle, HDX örnekleri sinyal:gürültü oranını artırmak için yalnızca MS modunda analiz edilmelidir.
Bu protokolde açıklanan iş akışı düzgün çalışıyorsa, tam değişim peptitleri%60−%70'lik göreceli bir döteryum alma değeri göstermelidir. Döteryum alımının bundan önemli ölçüde daha düşük olduğu tespit edilirse (solvent maruz kalmış, korunmasız bir peptit için), en olası açıklama, çalışma/analizin bir kısmı sırasında numunenin pH'ının değiştiğidir. Bu senaryoda, HDX testinin pH'ını ve söndürülen reaksiyon aliquot'u dikkatle izlemek için bir mikrotip elektrot kullanılmalıdır. LC-MS çözücülerin pH'ı da kontrol edilmelidir. Bu sorunun oluşumunu en aza indirmek için, test için gerekli olan tüm tamponların ve reaktiflerin konsantre stok çözümlerinin hazırlanması ve saklanması şiddetle tavsiye edilir (protokol bölüm 1'de belirtildiği gibi).
Son yıllarda HDX-MS, protein yapısal dinamiklerini araştırmak için güçlü bir analitik araç olarak ortaya çıkmıştır. HDX deneyleri için tasarlanmış ve optimize edilmiş ticari olarak mevcut LC-MS sistemlerinin geliştirilmesi (bu çalışmada kullanılan ve malzemelerde listelenen sistem gibi) güçlü yazılım paketleriyle birleştiğinde, HDX-MS yaklaşımını birçok akademik ve endüstriyel laboratuvara genişletmiş ve 15 yıl önce bir zamanlar niş bir teknik olan şeyi daha kullanıcı dostu bir analitik platforma dönüştürmüştür. Mekansal çözünürlükteki sınırlamalara rağmen, HDX-MS protein hareketleri üzerinde yüksek nicel ve tekrarlanabilir ölçümler sağlar ve diğer yaklaşımlarla araştırılması zor olan konformasyonsal dinamik enzimleri incelemek için idealdir. Bu özellikleri nedeniyle HDX-MS, biyoloji ve tıbbın birçok temel alanında ilgisi olan düzensiz ve dinamik protein sistemlerinin yapısal biyolojisinde önemli bir niş doldurmaktadır. Bu nedenle, HDX-MS analizlerinin yakın gelecekte yapısal biyoloğun cephaneliğinde önemli bir araç olarak kalması beklenmektedir.
Açıklamalar
Açıklayacak bir şeyimiz yok.
Teşekkürler
Bu çalışma Kanada Doğa Bilimleri ve Mühendisliği Araştırma Konseyi, Fonds de Recherche du Quebec Nature et Technologie, Kanada İnovasyon Vakfı ve McGill Üniversitesi başlangıç fonları tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| [glu-1]-fibrinopeptide B (Glu-Fib) | BioBasic | NA | |
| 0.5 mL Amicon Ultracel 10k centrifugal filtration device (Millipore) | Milipore Sigma | UFC501096 | |
| acetonitrile | Fisher | A955-1 | |
| AMP-PNP | SIGMA | A2647-25MG | |
| ATP | SIGMA | a2383-5G | |
| D2O | ALDRICH | 435767-100G | |
| formic acid | Thermo Fisher | 28905 | |
| guanidine-HCl | VWR | 97063-764 | |
| HEPES | Fisher | BP310-1 | |
| Magnesium chloride | SiGMA-Aldrich | 63068-250G | |
| Potassium chloride | BioBasic | PB0440 | |
| potassium phosphate | BioBasic | PB0445 | |
| TCEP Hydrochloride | TRC Canada | T012500 | peptide was synthesized upon request |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| software | |||
| Deuteros | Andy M C Lau, et al | version 1.08 | |
| DynamX | Waters | version 3.0 | |
| MassLynx | Waters | version 4.1 | |
| Protein Lynx Global Server (PLGS) | Waters | version 3.0.3 | |
| PyMOL | Schrödinger | version 2.2.2 | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Instrument and equipment | |||
| ACQUITY UPLC BEH C18 analytical Column | Waters | 186002346 | |
| ACQUITY UPLC BEH C8 VanGuard Pre-column | Waters | 186003978 | |
| ACQUITY UPLC M-Class HDX System | Waters | ||
| HDX Manager | Waters | ||
| microtip pH electrode | Thermo Fisher | 13-620-291 | |
| Waters Enzymate BEH column or Pepsin solumn | Waters | 186007233 | |
| Waters Synapt G2-Si | Waters |
Referanslar
- Karplus, M., McCammon, J. A. Molecular dynamics simulations of biomolecules. Nature Structural & Molecular Biology. 9 (9), 646-652 (2002).
- Campbell, E., et al. The role of protein dynamics in the evolution of new enzyme function. Nature Chemical Biology. 12 (11), 944-950 (2016).
- Tokuriki, N., Tawfik, D. S. Protein dynamism and evolvability. Science. 324 (5924), 203-207 (2009).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass Spectrometry Reviews. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chemical Society Reviews. 40 (3), 1224(2011).
- Katta, V., Chait, B. T. Conformational changes in proteins probed by hydrogen-exchange electrospray-ionization mass spectrometry. Rapid Communications in Mass Spectrometry. 5 (4), 214(1991).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Science. 2 (4), 522(1993).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Xiao, K., et al. Revealing the architecture of protein complexes by an orthogonal approach combining HDXMS, CXMS, and disulfide trapping. Nature Protocols. 13 (6), 1403-1428 (2018).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Masson, G. R., et al. Recommendations for performing, interpreting and reporting hydrogen deuterium exchange mass spectrometry (HDX-MS) experiments. Nature Methods. 16 (7), 595-602 (2019).
- Liu, J., et al. An Efficient Site-Specific Method for Irreversible Covalent Labeling of Proteins with a Fluorophore. Scientific Reports. 5, 16883(2015).
- Marion, D., et al. Overcoming the overlap problem in the assignment of proton NMR spectra of larger proteins by use of three-dimensional heteronuclear proton-nitrogen-15 Hartmann-Hahn-multiple quantum coherence and nuclear Overhauser-multiple quantum coherence spectroscopy: application to interleukin 1.beta. Biochemistry. 28 (15), 6150-6156 (1989).
- Balasubramaniam, D., Komives, E. A. Hydrogen-exchange mass spectrometry for the study of intrinsic disorder in proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1834 (6), 1202-1209 (2013).
- Goswami, D., et al. Time window expansion for HDX analysis of an intrinsically disordered protein. Journal of the American Society for Mass Spectrometry. 24 (10), 1584-1592 (2013).
- Keppel, T. R., Howard, B. A., Weis, D. D. Mapping Unstructured Regions and Synergistic Folding in Intrinsically Disordered Proteins with Amide H/D Exchange Mass Spectrometry. Biochemistry. 50 (40), 8722-8732 (2011).
- Mitchell, J. L., et al. Functional Characterization and Conformational Analysis of the Herpesvirus saimiri Tip-C484 Protein. Journal of Molecular Biology. 366 (4), 1282-1293 (2007).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Hydrogen/deuterium exchange mass spectrometry with top-down electron capture dissociation for characterizing structural transitions of a 17 kDa protein. Journal of the American Chemical Society. 131 (35), 12801-12808 (2009).
- Habibi, Y., Uggowitzer, K. A., Issak, H., Thibodeaux, C. J. Insights into the Dynamic Structural Properties of a Lanthipeptide Synthetase using Hydrogen-Deuterium Exchange Mass Spectrometry. Journal of the American Chemical Society. 141 (37), 14661-14672 (2019).
- Hebling, C. M., et al. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Analytical Chemistry. 82 (13), 5415-5419 (2010).
- Duc, N. M., et al. Effective application of bicelles for conformational analysis of G protein-coupled receptors by hydrogen/deuterium exchange mass spectrometry. Journal of the American Society for Mass Spectrometry. 26 (5), 808-817 (2015).
- Canul-Tec, J. C., et al. Structure and allosteric inhibition of excitatory amino acid transporter 1. Nature. 544 (7651), 446-451 (2017).
- Reading, E., et al. Interrogating Membrane Protein Conformational Dynamics within Native Lipid Compositions. Angewandte Chemie International Edition. 56 (49), 15654-15657 (2017).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. Journal of Visualized Experiments. (81), e50839(2013).
- Lento, C., et al. Time-resolved ElectroSpray Ionization Hydrogen-deuterium Exchange Mass Spectrometry for Studying Protein Structure and Dynamics. Journal of Visualized Experiments. (122), e55464(2017).
- Schowen, K. B., Schowen, R. L. Solvent isotope effects on enzyme systems. Methods in Enzymology. 87, 551-606 (1982).
- Lau, A. M. C., Ahdash, Z., Martens, C., Politis, A. Deuteros: software for rapid analysis and visualization of data from differential hydrogen deuterium exchange-mass spectrometry. Bioinformatics. 35 (7), 3171-3173 (2019).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. Journal of Pharmaceutical Sciences. 100 (6), 2071(2011).
- Burkitt, W., O'Connor, G. Assessment of the repeatability and reproducibility of hydrogen/deuterium exchange mass spectrometry measurements. Rapid Communications in Mass Spectrometry. 22 (23), 3893-3901 (2008).
- Rob, T., Gill, P. K., Golemi-Kotra, D., Wilson, D. J. An electrospray ms-coupled microfluidic device for sub-second hydrogen/deuterium exchange pulse-labelling reveals allosteric effects in enzyme inhibition. Lab on a Chip. 13, 2528-2532 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır