Method Article
펩타이드 생합성 효소를 조사하기 위한 수소-신투륨 교환 질량 분광법(HDX-MS) 플랫폼
요약
Lanthipeptide 는 펩타이드 천연 제품의 생합성 중에 다단계 반응을 촉매합니다. 여기서, 우리는 펩타이드 천연 제품 생합성에 관여하는 다른 유사한 효소뿐만 아니라 란티페타이드 신디사이저의 형성 역학을 연구하기 위해 사용될 수 있는 연속, 상향식, 수소 중수소 교환 질량 분석법(HDX-MS) 워크플로우를 설명합니다.
초록
수소-황량제 교환 질량 분석법(HDX-MS)은 효소 형태 변화와 효소 기질 상호작용의 생체물리학적 특성화를 위한 강력한 방법입니다. HDX-MS는 소량의 물질만 소비하며, 효소/기질 라벨링 없이 근동 조건하에서 수행할 수 있으며, 큰 효소 및 다단백 복합체에서도 효소 형성 역학에 대한 공간적으로 해결된 정보를 제공할 수 있습니다. 이 방법은D2O에서 제조된 완충제로 관심 있는 효소의 희석에 의해 개시된다. 이것은 중수소 (N-D)를 가진 펩티드 본드 아마이네스 (N-H)에서 프로티움의 교환을 트리거합니다. 원하는 교환 시점에서, 반응 알리쿼트가 담금질되고, 효소는 펩티드로 프로테오리제화되고, 펩타이드는 초고성능 액체 크로마토그래피(UPLC)에 의해 분리되고, 각 펩타이드의 질량의 변화(중수소용 수소의 교환로 인해)는 MS에 의해 기록된다. 각 펩티드에 의한 중수소 섭취량의 양은 해당 펩티드의 국소 수소 결합 환경에 크게 의존한다. 펩타이드는 효소 교환 중음류의 매우 역동적인 부위에 매우 빠르게 존재하는 반면, 잘 정렬된 지역에서 유래된 펩타이드는 훨씬 더 느리게 교환을 받는다. 이러한 방식으로, HDX 속도 로컬 효소 형성 역학에 대 한 보고서. 다른 리간드가 있는 중수소 섭취량 수준에 대한 혼란은 리간드 결합 부위를 매핑하고, 알로스터 네트워크를 식별하고, 효소 기능에서 형성 역학의 역할을 이해하는 데 사용될 수 있다. 여기에서, 우리는 우리가 더 나은 lanthipeptides에게 불린 펩티드 천연 제품의 모형의 생합성을 이해하기 위하여 HDX-MS를 이용한 방법을 보여줍니다. Lanthipeptides는 전통적인 구조 생물학 접근으로 공부하기 어려운 크고 다기능, 형태역학적 효소에 의해 번역 후 변형되는 유전자 로코딩된 펩티드입니다. HDX-MS는 이러한 유형의 효소의 기계적인 특성을 조사하기 위한 이상적이고 적응력이 뛰어난 플랫폼을 제공합니다.
서문
단백질은 펨토초 규모의 결합 진동에서부터 여러 초 동안 발생할 수 있는 전체 단백질 도메인의 재배열에 이르기까지 시간 척도에 따라 다른 적합성을 샘플링하는 구조적으로 역동적인분자입니다. 이러한 형태 적 변동은 종종 효소 / 단백질 기능의 중요한 측면입니다. 예를 들어, 리간드 결합에 의해 유도된 형태 변화는 촉매에 필요한 활성 부위 잔류물을 구성하거나, 순차적 운동 메커니즘에서 기판 결합 부위를 정의하거나, 환경에서 반응성 중간체를 차폐하거나, 알로스티아 네트워크를 통해 효소 기능을 조절함으로써 효소 기능을 조절하는 데 매우 중요합니다. 최근 연구에 따르면 형태 역학은 진화 전반에 걸쳐 보존될 수 있으며 분자 운동을 보존하는 혼란은 기판 특이성의 변화와 새로운 효소 기능2,3의출현과 상관관계가 있을 수 있음을 보여주었다.
최근 몇 년 동안 수소-중수소 교환 질량 분광법(HDX-MS)은 단백질 형성 경관이 리간드 결합 또는 돌연변이 발생4,5,6,7과같은 동요에 어떻게 반응하는지 조사하는 강력한 기술로 급속히부상하고 있다. 전형적인 HDX-MS실험(도 1)에서관심 있는 단백질은 D2O로 제조된 완충제에 배치되어, 이는 신테리아를 가진 용매 교환 성수기의 교체를 유발한다. 펩티드 결합의 아미드 모이티의 교환 속도는 pH, 국소 아미노산 서열 및 아미드8의국소 구조 환경에 크게 의존한다. 수소 결합 상호 작용에 종사하는 아미드 (예 : α-헬릭 및 β 시트에 존재하는 것과 같은)은 대량 용매에 노출되는 단백질의 구조화되지 않은 영역에서 아미드보다 더 느리게 교환됩니다. 따라서, 중수소 섭취의 정도는 효소의 구조를 반영한다. 형태역학적 이거나 리간드 결합 시 구조적 전이를 겪는 효소는 측정 가능한 HDX 응답을 얻을 것으로 예상됩니다.
구조화된 아마이드의 느린 환율에 대한 기계론적 기초는 도 25,8,9로도시된다. HDX를 받기 위해서는, 구조화된 영역은 먼저 전개된 형성을 일시적으로 샘플링해야 하며, 이러한 용매 분자는 특정 산/염기 화학 메커니즘을 통해 HDX 교환을 촉매하는, 교환 가능한 아미드에 접근할 수 있다. 궁극적으로,화학환율(kchem)과접이식 및 재접이식 비율(kopen 및 kclose)의상대적 크기는 실험5,8에서측정된 HDX 속도를 결정한다. 이 간단한 운동 모델에서, 중수소 섭취량의 정도는 기본 형태 역학을 반영할 것이 분명하다 (k열기 및 k닫기에의해 정의). 대부분의 HDX-MS 실험은 상향식 워크플로우에서 수행되며, 교환 반응에 따라 관심 있는 단백질이 펩타이드로 소화되고 각 펩티드에 의한 중수소 흡수량은 질량7의증가로 측정된다. 이러한 방식으로, HDX-MS는 효소 형성 역학에 대한 교란을 펩티드의 로컬 공간 척도에 매핑할 수 있게 하여, 연구자가 동요가 관심 있는 효소의 다른 영역에서 역학을 어떻게 변화시키는지 평가할 수 있게 합니다.
단백질 구조 역학을 해명하기 위한 HDX-MS 접근법의 장점은 다양합니다. 먼저, 이 방법은 사분위구조(10)를가진 시스템에서 소량의 토종 단백질 또는 단백질 복합체로 수행될 수 있다. 분석에서 사용되는 효소 제제는11,12,상향식 HDX-MS 워크플로우가 단백질 서열을 커버하는 충분한 수의 자신있게 확인된 펩티드를 제공하는 한, 고도로 정제될 필요가 없다. 더욱이, HDX-MS는 단일 분자 형광연구에서사용되는 바와 같이 현장별 단백질 라벨링필요 없이 근사 조건하에서 형성 역학에 대한 정보를 제공할 수 있으며, 조사할 수 있는 단백질 또는 단백질 복합체에 대한 크기 제한은 없다(핵자기 공명[NMR] 분광법 도전과 같은 접근법을 만드는)7,14. 마지막으로, 시간 해결된 HDX-MS 방법은 X선결정학15,16,17,18로공부하기 어려운 본질적으로 무질서한 단백질을 연구하기 위하여 이용될 수 있다. HDX-MS의 주요 제한사항은 데이터가 낮은 구조적 해상도라는 것입니다. HDX-MS 데이터는 형태 역학이 변화하는 곳을 가리키고 결합된 형태 변화를 드러내는 데 유용하지만 관찰된 변화를 유도하는 정확한 분자 메커니즘에 대한 많은 통찰력을 제공하지는 않습니다. 단백질 HDX-MS 데이터와 전자 포획 해리 방법의 조합에 있는 최근 발전은 단 하나 아미노산 잔류물19에교환 사이트를 매핑하는 약속을 보여주었습니다, 그러나 후속 생화확적인 및 구조 적인 연구는 아직도 HDX-MS 데이터에 의해 전달된 구조 모형에 명확성을 제공하기 위하여 수시로 필요합니다.
아래, HDX-MS 분석기의 개발을 위한 자세한 프로토콜이20을제시한다. 아래에 제시된 견본 준비 프로토콜은 수성 완충제에 있는 좋은 용해도를 전시하는 어떤 단백질든지 일반적으로 적용되어야 합니다. 세제 또는 인지질(21,22,23,24)의존재에서 분석될 필요가 없는 것보다 더 전문적인 시료 제조 방법및HDX-MS 워크플로우를 단백질에 사용할 수있다. HDX-MS 데이터 수집을 위한 기악 설정은 액체 크로마토그래피 시스템에 결합된 고해상도 쿼드러폴 비행 시간 질량 분광계에 대해 설명됩니다. 유사한 복잡성 과 해상도의 데이터는 상업적으로 이용 가능한 다수의 액체 크로마토그래피 질량 분석법(LC-MS) 시스템에서 수집될 수 있습니다. 시판되는 소프트웨어 패키지를 사용하여 데이터 처리의 주요 측면도 제공됩니다. 또한 광범위한 HDX-MS 커뮤니티12의권장 사항과 일치하는 데이터 수집 및 분석에 대한 지침을 제시합니다. 기재된 프로토콜은 항균 펩티드천연물(20)의다단계 성숙을 촉매하는 란티펩타이드 합성물인 HalM2의 동적 구조적 특성을 연구하는 데 사용된다. 우리는 HDX-MS가 기판 바인딩 사이트와 이전 특성을 벗어난 알로스터 속성을 공개하는 데 어떻게 사용할 수 있는지 보여줍니다. 단백질 HDX-MS에 대한 몇몇 그밖 프로토콜은 최근25,26에서간행되었습니다. 현재 작업과 함께 이러한 초기 기여는 독자에게 실험 설계에 약간의 유연성을 제공해야 합니다.
프로토콜
1. 중음 시약 및 효소 스톡 솔루션 준비
- D2O(99.9% 원자 분수 D)의 100-200x 농축 재고 솔루션으로 HDX 반응(완충제, 염, 기판, 리간드 등 포함)에 필요한 시약을 준비합니다. 버퍼 스톡 솔루션의 최소 50mL를 준비합니다.
참고: HalM2의 특성화를 위해 500m MgCl2,100mM tris (2-carboxyethyl)인 포스핀 (TCEP), 750 mM ATP (HEPES 버퍼), 800 mM HEPES pD 7.1, 500 μM HalA2, 500 mMM MMM MP2 및 50mMMMMMMMMMP를 준비했습니다. - 건조에 대한 재고 솔루션을 동결하고 lyophilize합니다.
- D2O에서재용해, 가능한 한 교환 가능한 양성자를 가능한 한 많이 교체하기 위해 적어도 하나의 추가 시간을 반복한다.
- 유의한 HEPES 버퍼 스톡의 pD를 농축 된 NaOD / DCl로 원하는 값으로 조정하여 다음 관계(27)를염두에 두고 :
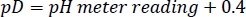
참고: 아마이드 HDX 속도는 솔루션(pL = pH 또는 pD)5의pL에 크게 의존한다. 실험 간에 약간의 pL 드리프트를 피하기 위해 버퍼 스톡 솔루션의 다양한 배치를 동일한 방식으로 준비, 저장 및 사용해야 합니다. - 300 μL HDX 분석에 필요한 각 시약의 양을 계산하고 -80 °C에서 일회용 알리쿼트로 저장합니다.
- 원심필터(재료표)또는 이와 동등한 장치를 사용하여 유동 효소 저장 버퍼에 농축 효소 스톡 솔루션(~100-200 μM)을 준비한다.
참고: 정확한 완충제 와 원심 필터 분자량 차단은 관심있는 단백질 / 효소에 따라 달라집니다. HalM2는 50m HEPES, pH 7.5, 100 mM KCl 및 10% 글리세롤에 저장됩니다. 10 kDa 필터는 농축 효소를 준비하는 데 사용되었다. - 효소를 일회용 부분으로 알리쿼트하고 -80°C에 보관합니다.
참고: 이것은 정지 지점이 될 수 있습니다. 제1항에 기재된 모든 스톡 솔루션은 HDX 반응에 앞서 제조될 수 있다. -80°C에 저장하면 대부분의 효소/중음 스톡 용액이 수개월 동안 안정될 것입니다.
2. HDX 담금질 볼륨의 보정
- 1항에 제조된 중진 시약 및 농축 효소 재고를 사용하여 D2O에서300 μL HDX 반응을 준비한다.
- 1-5 μM의 최종 효소 농도를 사용합니다.
- 최소 50-100 mM의 최종 유족 HEPES 버퍼 농도를 사용하십시오.
- 다른 성분의 농도가 원하는 효소 활성/기능을 유지하기에 충분하도록 보장합니다.
- HDX 담금질 용액 1L(100mM 인산염, 0.8M 구니딘-HCl, pH 1.9)를 준비한다. 동결 및 50 mL 부분 (장기 재고) 및 1 mL 부분 (일회용 알리 쿼트)에 저장합니다.
참고: 담금질 버퍼의 정확한 조성물은 상향식 HDX-MS 워크플로우의 프로테오리시스 단계에서 사용되는 효소에 따라 달라집니다(단계 3.3.3). 여기에 주어진 담금질 버퍼는 HDX-MS에 가장 일반적으로 사용되는 프로테아인 펩신과 호환됩니다. 다른 프로테아제가 사용되는 경우 프로테아제 공급업체에 문의하여 버퍼 호환성을 확인하십시오. - 담금질된 HDX 반응 혼합물의 최종 pL을 2.3의 pH 미터 판독값으로 조정하는 데 필요한 담금질 버퍼의 부피를 보정합니다.
참고: 펩타이드 아마이드 N-H 본드의 용매 H/D 환율은 산및 염기 촉매의 적용을 받는 pH 의존성 공정이다. 최소 환율은 pH 2.5(pH 미터 판독 = 50:50 H2O:D2O 혼합물의 경우 2.3)의 값으로 발생합니다. 따라서, 2.5 에 가까운 최종 pL 값은 상향식 LC-MS 분석 중에 발생하는 수소 백 교환을 최소화하여 펩타이드 내의 중수소 라벨을 보존한다.- HDX 반응 혼합물의 50 μL을 담금질 버퍼 50 μL과 2.1 단계에서 혼합하고 마이크로팁 전극으로 담금질 혼합물의 pL을 측정합니다.
- 최종 pH 미터 판독값을 2.3값으로 조정하는 데 필요한 대로 담금질 용액의 양을 늘립니다.
- 적절한 담금질 부피가 결정되면, HDX 반응(단계 2.1)의 신선한 50 μL 알리쿼트를 사용하여 담금질 공정을 여러 번 반복하여 고정수량의 담금질 버퍼를 첨가하면 일관된 최종 pL를 달성하게 한다.
3. 기준 샘플 의 준비 및 상향식 LC-MS 워크플로우의 최적화
- 0.5 mL 튜브에서 삼중화물에 대한 관심있는 단백질에 대한 뚜기되지 않은 기준 샘플을 준비하십시오. 최종 반응 혼합물 조건이H2O에서 제조된 시약 스톡 솔루션을 사용하여H2O에서반응이 제조되는 것을 제외하고는 본격적인 HDX 반응(step 2.1)에 사용되는 것과 동일한지 확인합니다.
- 최종 pH를 2.5로 조정하기 위해 담금질 버퍼의 적절한 부피를 추가하여 2.3 단계에서와 같이 샘플을 담금질한다. 플래시는 액체 질소에 샘플을 동결하고 분석을 위해 준비 될 때까지 -80 ° C에 저장합니다.
- 상향식 LC-MS 워크플로우를 사용하여 비례 효소 기준 샘플을 분석합니다.
참고: 이러한 단계를 실행하기 전에 데이터 수집에 사용할 LC-MS 시스템을 적절하게 보정하고 사용할 준비가 되어 있어야 합니다. 샘플 간의 백 교환의 차이를 최소화하기 위해 상향식 LC-MS 워크플로우의 모든 단계의 타이밍과 온도를 엄격하게 제어해야 합니다. 이 프로토콜에 사용되는 MS 계측을 사용하여 (재료 테이블 그리고 정보 지원), 대부분의 단계는 계측기 소프트웨어를 통해 제어 할 수 있습니다. 정밀 복제의 컬렉션을 보장하기 위해 워크플로의 많은 단계를 가능한 한 자동화하는 것이 좋습니다.- 냉동고에서 개별 효소 기준 샘플(3.2단계에서와 같이 제조됨)을 제거하고 수조에서 1분 동안 37°C에서 해동하십시오.
- 냉동고에서 샘플을 제거하고 해동한 후 정확히 2분 만에 담금질 된 기준 샘플의 40 μL 부분을 초음파 형 크롬 토그래피 (UPLC) 컬럼 (2.1 x 30mm, 300 Å, 5 μM)에 주입하여 펩신 (산 안정 프로테아제)으로 기능화 된 고정 위상을 함유합니다.
- 시료를 100 μL/min의 유량으로 15°C에서 3분 동안 소화하여H2O(pH= 2.5)에서 0.1%의 포산(pH = 2.5)을 용매로 사용한다.
- 펩신 컬럼에서 0.4°C로 유지되는 C18 트랩 컬럼으로 펩티드 펩티드를 수집하여 백 교환을 최소화합니다.
- 트랩 컬럼에서 C18 분석 컬럼(1mm x 100mm, 1.7 μM, 130 Å)으로 탈염 펩티드를 전달하여 펩티드의 분리를 위해 0.4°C로 작동한다.
참고: 단계 3.3.3-3.3.5 HDX-MS 데이터 수집에 사용되는 특정 LC-MS 시스템에 의해 자동화될 수 있습니다. 또는 이러한 단계는 독립적으로 수행될 수 있으며, 각 단계의 타이밍과 온도를 일관되게 낮은 재생을 달성하기 위해 신중하게 제어해야 한다는 점을 명심하십시오. - 아세토닐릴/물/0.1% 포믹산 용매 시스템으로 C18 컬럼을 엘테. 펩티드 펩티드에서 중테리움 라벨의 분리를 극대화하고 보존하기 위해 관심 있는 단백질에 대한 LC 그라데이션을 최적화합니다.
참고: 그라데이션 용출 세부 정보는 지원 정보에제공됩니다. - 펩틱 소화를 전기스프레이 이온화(ESI) 질량 분광법에 적용한다.
참고: 지원 정보에 제공된 소스 조건은 대부분의 펩티드에 대한 충분한 이온화를 제공합니다.- MS 기기에서 이온화되면 질소를 완충 가스로 사용하여 가스 상 이온 이동성 분리를 수행하여 방법의 피크 용량을 향상시킵니다.
- 이온 이동성 분리에 따라, 저충돌 에너지(4V)와 높은 충돌 에너지(21-40 V)의 교대주기를 포함하는 MSE 워크플로우로 펩틱 펩티드 전구체 이온을 적용한다.
참고: 저충돌 에너지 와 높은 충돌 에너지 체제를 번갈아 가며 MSMS 데이터(높은 충돌 에너지)와 동시에 MS 데이터(낮은 충돌 에너지)를 수집할 수 있습니다. 이것은 차례로, 그들의 각각의 단편 이온과 전구체 이온의 시간 상관관계를 허용합니다. 이 상관 관계는 섹션 4에 기술된 자신감 있는 펩티드 식별을 위해 필수적입니다. - 적어도 20,000의 해결 전력을 가진 질량 분석기를 사용하여 펩티드 전구체 및 단편 이온을 검출한다.
- 데이터 수집과 동시에 [Glu-1]-피브리노펩타이드 B(GluFib) 외부 표준에 대한 MS 데이터를 획득합니다.
참고: 3.3.7 단계에서 설명된 MS 워크플로를 MSE 프로토콜이라고 합니다. 상향식 HDX-MS에 적합한 MSE 프로토콜에 대한 전체 기악 설정은 지원 정보에제공됩니다.
- LC-MS 데이터의 품질을 평가합니다.
참고: 위에서 설명한 프로토콜과 지원 정보에제공된 기악 설정을 사용하여 참조 샘플은 최대 신호 강도가 약 1 x 108인총 이온 크로마토그램을 생성해야 합니다. 3-9 분(그림 3A−C)사이에용례 하는 많은 펩 틱 펩 티 드 해야 합니다. - 40 μL의 빈 시료(물 내0.1% 포믹산)를 주입하여 펩신 과 분석 C18 컬럼을 세척합니다.
참고 : 일반적으로, 2-3 공백은 충분해야한다. - 각 삼중항 기준 단백질 샘플에 대해 3.3.1-3.3.9단계를 반복한다.
4. 기준 데이터 처리 및 펩티드 목록 정의
- 프로테오믹스소프트웨어(재료표)를사용하여 원시 MSE 데이터(3.3.7단계)를 분석합니다. 프로테오믹스 소프트웨어를 사용하여 라이브러리 | 단백질 서열 데이터뱅크는 관심 있는 단백질의 아미노산 서열을 수입하여 단백질 데이터베이스를 정의한다.
참고: 이 단계의 목표는 관심 있는 단백질에서 유래된 펩티드에 대한 참조 MS 데이터를 검색하고 MSMS 데이터(MS 데이터와 동시에 획득)를 사용하여 모든 putative 펩티드 식별을 검증하는 것입니다. - 관심의 단백질 순서에 이름을 지정합니다. 단백질 서열을 가져옵니다(FASTA 형식으로). 이 소프트웨어는 LC-MS 데이터를 검색하는 데 사용되는 펩타이드 목록을 생성하기 위해 데이터베이스 단백질의 실리코 소화를 수행합니다.
- 처리 매개 변수를 정의합니다(라이브러리 메뉴 아래에 있음). 데이터 수집 유형으로 일렉트로스프레이 MSE를 선택합니다. 충전 2 필드에 대한 잠금 질량에서, 입력 785.8426 m / z에 대한 2+ 이온 [Glu-1]-피브리노 펩타이드 B (글루피브) 및 클릭 마무리.
- 워크플로 매개 변수를 정의합니다(라이브러리 메뉴 아래에 있음).
- 검색 유형에 대해 전기 스프레이 MSE를 선택합니다. 워크플로 | 데이터베이스 검색 쿼리 제목은 Databank 필드에서 4.2 단계에서 생성된 데이터베이스 단백질을 선택합니다.
- 기본 다이제스트 시약을 비특이적으로 변경하고 Carbamidomethyl C를클릭하는 동안 Ctrl 버튼을 눌러 고정 수정자 시약 필드를 지웁니다.
- 옵션으로 이동하여 출력 디렉터리 지정| 자동화 설정 | 아이덴티티 E. 에이펙스 3D 및 펩타이드 3D 출력 및 이온 회계 출력에 대한 상자를 확인하고 원하는 디렉토리를 지정합니다.
- 참조 샘플 데이터를 처리합니다.
- 프로테오믹스 플랫폼 작업 공간의 왼쪽 도구 바에 미세 분류판을마우스 오른쪽 클릭하여 새 플레이트를 만듭니다. 마이크로티터 플레이트에서 3개의 우물을 강조표시합니다(섹션 3에서 수집된 각 참조 샘플에 대해 하나씩). 한 우물에서 클릭하고 길게 누고 세 개의 우물로 드래그합니다.
- 마우스 오른쪽 단추를 클릭하고 원시 데이터 추가를 선택합니다. 표시되는 창에서 섹션 3의 세 참조 파일이 포함된 디렉터리로 이동하여 동시에 선택합니다.
- 다음을 클릭하고 4.3 단계에서 정의된 처리 매개 변수를 선택합니다. 다음을 클릭하고 4.4 단계에서 정의된 워크플로 매개 변수를 선택합니다. 그런 다음 마무리를 클릭합니다.
- 원시 데이터, 처리 매개 변수 및 워크플로 매개 변수가 플레이트의 각 우물에 할당되면 우물이 파란색으로 표시됩니다. 우물을 선택하고 마우스 오른쪽 단추로 클릭하고 최신 원시 데이터를 선택합니다. 창의 오른쪽 하단 모서리를 클릭하여 데이터 처리를 추적합니다. 실행할 작업이 없는 메시지가 나타나면 처리가 완전히 완료됩니다.
- 데이터 처리가 완료되면 플레이트의 우물이 녹색으로 바뀝니다. 우물을 마우스 오른쪽 버튼으로 클릭하고 워크플로 결과를 봅니다. 각 참조 데이터 파일에 대해 별도의 창이 열립니다.
- 기준 샘플 데이터에서 대부분의 MS 신호가 관심 있는 단백질의 실리코 소화에서 예측된 펩티드에 성공적으로 매핑되었는지 확인하기 위해 데이터를 검사합니다. 일치 펩타이드는 출력스펙트럼(도 4)에서파란색으로 칠하게 됩니다. OK 필터를 두 번 클릭하고 백분율 커버리지가 99 %보다 큰지 확인합니다.
참고: 처리 시 4.5단계에 지정된 디렉터리에서 파일확장(raw_data_file_name_IA_final_peptide)을 사용하여 데이터 출력이 자동으로 저장됩니다. - 추가 임계값을 위해 프로테오믹스 소프트웨어 출력을 HDX 처리소프트웨어(재료 표)로가져옵니다.
- HDX 처리 소프트웨어 창의 왼쪽 모서리에 있는 데이터를 클릭합니다. PLGS 가져오기 결과를 클릭하고 추가 아이콘을 클릭합니다. 적절한 디렉터리로 이동하여 4.9 단계에서 처리된 데이터 파일을 선택합니다.
- 다음을 클릭하고 다음 매개 변수를 지정합니다: 최소 연속 이온 ≥ 2, 질량 오류 = 5 ppm 및 파일 임계값 = 3. 마무리를클릭합니다.
- 임계값 매개 변수에 만족하면 HDX 프로젝트를 저장하십시오. 모든 HDX 데이터는 분석 및 표시를 위해 이 프로젝트로 가져옵니다.
참고: 다음 섹션에서 설명된 중테리움 교환 샘플은 동일한 LC-MS 워크플로우로 처리해야 합니다. 따라서 HDX 분석(섹션 5)을 진행하기 전에 샘플 준비(섹션 2), 상향식 LC-MS 워크플로우(섹션 3) 및 데이터 처리 워크플로우(섹션 4)가 대상 단백질의 원하는 재현성 및 서열 커버리지를 제공하는지 확인합니다. 이러한 공정 중 어느 것이 적용 범위를 개선하기 위해 변경되어야 하는 경우, 각 펩타이드가 재현적으로 생성되고 검출될 수 있도록 2.1단계로 돌아가 서식하여 신선한 기준 샘플을 준비하고 섹션 2-4를 반복하는 것이 좋습니다.
5. HDX 반응 수행
- HDX 반응을 위한 작업 공간을 준비합니다.
- 사전 알리쿼트 담금질 버퍼를 제대로 라벨이 부착된 0.5mL 튜브로 합니다. 매 시점, 모든 복제 및 모든 생화학 상태를 분석할 때마다 다른 튜브를 준비합니다. HDX 반응의 50 μL 부분의 최종 pH 미터 판독값을 2.3값으로 조정하는 데 필요한 2.2단계에서 담금질 버퍼의 적절한 부피를 사용한다.
- 0.5mL 욕조를 간략하게 원심분리하여 모든 담금질 버퍼를 튜브 바닥으로 옮겨냅니다. 튜브를 얼음 위에 놓습니다.
- 액체 질소로 작은 드와르를 채우고 작업 공간에 인접하게 하십시오.
- HDX 반응을 준비합니다. 원하는 교환 시간 포인트(원하는 각 시간 지점에 대해 50 μL 알리코 1개)를 수집하기에 충분한 반응 부피가 있는지 확인합니다. 시간 척도의 3-4 주문(예: 15s, 60 s, 300 s [5분], 1,800 s [30분], 14,400s [4h]의 3-4 주문 이상의 4-5 시간 포인트를 수집하여 대부분의 효소에 대한 교환 역학의 적절한 커버리지를 제공합니다.).
- D2O에서 1.1 단계에서 모든 중음 성분(마이너스 효소)을 미리 혼합합니다.
- 검사할 각 생화학 상태(무료 효소, 효소 + 리간드, 효소 + 억제제 등)에 대해 적어도 삼중항에 HDX 반응을 준비한다.
- 효소를 첨가하기 전에 10분 동안 25°C에서 온도 조절 수조에서 반응 혼합물을 배양한다.
참고: 효소는 HDX 분석법에 프로티움을 첨가하는 것을 최소화하기 위해 농축 주식 용액(~100-200 μM, 1.6단계)으로 제조되어야 한다. - 1-5 μM의 최종 농도에 효소를 추가하면 타이머를 시작합니다. 200 μL 파이펫을 사용하여 용액을 신중하고 빠르게 혼합하여 효소가 샘플에 고르게 분포되도록 합니다.
- 원하는 교환 시점에서 HDX 반응에서 50 μL 알리쿼트를 제거하고 0.5mL 튜브의 사전 알리인용 얼음 냉간 담금 버퍼와 빠르고 균등하게 혼합합니다.
참고: 혼합 볼륨 및 혼합 절차는 모든 샘플에서 원하는 최종 담금질 pL을 신속하게 달성하려면 가능한 한 정확하고 재현가능해야 합니다. 담금질 버퍼 얼음 을 차갑게 유지하면 효소의 데마튜레이션시 교환을 최소화하는 데 도움이 됩니다. - HDX 샘플을 담금질한 직후 튜브를 캡하고 액체 질소로 플래시 동결하십시오.
- 모든 애표가 완료될 때까지 시간 점을 계속 수집한 다음 샘플을 -80°C 냉동고로 이송하여 보관합니다.
참고: 이것은 정지 지점이 될 수 있습니다. 모든 HDX 시간 점을 수집한 후, 샘플은 LC-MS 분석을 위해 준비될 때까지 -80°C로 저장할 수 있습니다. 이상적으로, 트리플리케이트 HDX 반응은 같은 날에 관심의 모든 생화확적인 상태에 대해 수행되어야 합니다. 최소한, 주어진 생화학 상태에 대한 모든 복제 HDX 반응은 같은 날에 병렬로 실행되어야한다.
- 담금질된 HDX 시간 지점을 모두 수집한 후, 3.3단계에서 설명된 바와 같이 최적화된 상향식 LC-MS 워크플로우에 샘플을 적용한다. 모든 펩티드가 이월하는 것을 보장하기 위해 샘플 사이에 적절한 수의 공백으로 HDX 샘플을 무작위 순서로 주입하십시오.
참고: HDX 데이터는 MSE 모드에서 수집할 필요가 없습니다. 따라서, 높은 충돌 에너지 세그먼트(단계 3.3.7.2)는 MS 듀티 사이클에서 제거되어야 한다. 3.3 단계에서 설명된 워크플로를 변경하는 것만이 가능합니다. - 수집되는 HDX 데이터의 품질을 평가합니다.
- 미성수 기준 샘플의 총 이온 크로마토그램에 존재하는 크로마토그래픽 피크가 유정된 샘플에서 동일한 보존 시간에 나타나는지 확인합니다(그림 3D−F에서와같이).
- 참조 및 중음 시료에서 특정 시간 간격에 걸쳐 합산된 질량 스펙트럼이 중증도에 대한 증거를 보여 주는지 확인합니다(즉, 개별 펩타이드의 동위원소 봉투의 변화는 유정된 샘플의 높은 m/z 값으로 의전환[도6]).
6. HDX 데이터 처리
- 데이터를 클릭하여 4.11 단계에서 생성된 HDX 프로젝트로 HDX 데이터를 가져오세요| 상단 도구 모음에 있는 MS 파일입니다.
- 분석에 관한 생화학 상태(예: 무료 효소, 효소 + 리간드 등)와 중수소 노출 시간을 정의하는 데 필요한 새로운 상태 및 신규 노출을 클릭합니다.
- 새 원시를 클릭하여 분석할 HDX 데이터 파일을 선택합니다. 가져오는 각 원시 데이터 파일에 적절한 교환 시간 및 생화학 상태를 할당합니다.
참고: 데이터를 일괄 처리하거나 한 번에 가져올 수 있습니다. 프로젝트에 데이터를 추가하면 해당 프로젝트 내에서 이전에 수행된 분석을 실행 취소하지 않습니다.
- 데이터 파일이 추가되면 마무리를 클릭하여 데이터 처리를 시작합니다. 잠시 지연 후 소프트웨어는 사용자가 계속하기 전에 데이터를 저장하려는지 묻습니다. 예.
참고: 초기 처리는 분석되는 시료 수, 최종 펩타이드 목록(Step 4.10), 크로마토그래피 창의 크기 및 스펙트럼 획득 빈도에 얼마나 많은 펩타이드가 있는지에 따라 최대 몇 시간이 걸릴 수 있습니다. - 원하는 경우 구성 메뉴의 처리 매개 변수를 변경하여 이온 검색 매개 변수를 변경합니다. 지정된 프로젝트의 모든 데이터에 대해 동일한 ion 검색 매개 변수를 사용해야 합니다.
7. HDX 데이터의 분석 및 시각화
참고: 원시 데이터의 초기 처리가 완료되면(단계 6.2), HDX 처리 소프트웨어는 분석된 각 원시 데이터 파일에서 펩타이드 목록(4.10 단계에서 생성됨)에서 펩티드를 위치하게 됩니다. 목록에서 펩타이드에 대한 동위원소 분포가 원시 데이터 파일에 있으면 HDX 처리 소프트웨어는 각 동위원소에 "스틱"(그림 6C−E)을나타냅니다. 주어진 펩티드에 대한 스틱의 상대적 강도는 다음 기준 스펙트럼에 비해 중음 궤적 upup을 계산하는 데 사용됩니다. HDX 처리 소프트웨어는 대부분의 펩타이드에 "스틱"을 적절히 할당하는 훌륭한 작업을 수행하지만, 중수소 섭취량 값의 중요한 수동 큐레이션은 여전히 필요합니다.
- 펩타이드 중수소 섭취 값 분석
- 펩티드 목록에서 첫 번째 펩타이드를 선택하고 뷰 메뉴에서 누적된 스펙트럼 플롯을 엽니다. 누적된 스펙트럼 플롯 창에서 위아래로 스크롤하여 선택한 펩타이드에 대한 질량 스펙트럼을 중수소 교환시간(그림 7D,E)의함수로 확인합니다.
- 적절한 동위원소 분포가 데이터에 위치하고 각 동위원소 피크가 할당되었는지 확인하기 위해 마우스 클릭을 사용하여 필요에 따라 스틱을 할당하고 서명취소합니다(할당된 스틱이 파란색으로 나타납니다). 누적된 스펙트럼플롯(그림 7D,E)에서스펙트럼 중 어느 것을 클릭하면 사용자가 활성 데이터 뷰어 창(그림7C)에스틱을 할당/취소할 수 있습니다.
- 누적된 스펙트럼 플롯 창 의 맨 위에 있는 충전 상태를 전환하여 각 충전 상태에 대한 스틱 할당을 확인합니다.
- 반복 단계 7.1.1-7.1.3 관심의 각 생화학 상태에 대 한. 생화학 상태는 또한 쌓인 스펙트럼 플롯 창의 상단에 비틀수 있습니다. 가장 정확한 중수소 섭취 차이 측정을 위해 각 생화학 상태에 대해 동일한 충전 상태에 스틱이 할당되었는지 확인하십시오.
- 펩티드 리스트의 각 펩타이드에 대해 7.1.1-7.1.4단계를 반복한다.
- 커버리지 맵을 사용하여 펩타이드 중테륨 섭취 값의 표준 편차를 확인합니다.
- 관심 있는 단백질의 아미노산 서열을 따라 매핑된 펩티드 리스트에 각 펩티드를 표시하는 뷰 메뉴에서 커버리지 맵에 액세스한다(도8C). 상대표준 편차에 따라 펩티드에 색을 더한다(Da의 단위).
- 상대성 표준 편차가 높은 이상치 펩타이드에 대한 맵을 시각적으로 검색합니다. 커버리지 맵에서 이상치 펩티드를 클릭하여 적층 스펙트럼 플롯(도8B)및 데이터 뷰어창(도 8A)을대상 펩티드와 채웁니다.
- 누적 된 스펙트럼 플롯을 사용하여, 신중하게 모든 충전 상태와 이상치 펩티드의 모든 시간 포인트가 적절하게 스틱을 할당한 것을 확인합니다.
참고: 가장 자주, 큰 표준 편차를 가진 펩티드 (>0.3 Da)는 소프트웨어에 의해 스틱을 적절히 할당하지 않은 등도 피크가 있습니다 (그림 8B에표시된 대로). 누락된 스틱을 할당하면 일반적으로 펩타이드의 상대적인 표준 편차가 <0.3 Da로 감소될 수 있게 된다. - 상대표준 편차를 0.3Da 미만으로 줄일 수 없는 경우 목록에서 펩티드를 숨깁니다.
- 관심 있는 단백질의 구조 모델에 매핑을 위한 두 생화학 상태 간의 HDX 차이 데이터를 내보냅니다.
- 커버리지 맵에 관심 있는 차이를 표시합니다. 적용 범위 맵을 마우스 오른쪽 으로 클릭하여 차이점 데이터를 .csv 파일로 내보냅니다. 데이터 | 탐색하여 상태 데이터(.csv 형식으로) 내보냅니다. 주 도구 표시줄에서 상태 데이터를 내보냅니다.
참고: 차이 데이터 및 상태 데이터 파일의 적절한 서식이 지원 정보에제공됩니다. - 차이 데이터, 상태 데이터 및 관심 있는 단백질의 pdb 파일을Deuteros(28)로가져옵니다. 99% 신뢰 구간을 선택하고, 활성화 합계를선택하고, 데이터를 처리합니다.
참고: MATLAB은 듀테로스를 실행하려면 PC에 설치해야 합니다. Deuteros는 데이터 세트의 복제 측정을 사용하여 각 펩타이드에 대한 섭취 데이터의 표준 편차를 계산합니다. 이 표준 편차는 플롯에 표시되는 중요한 교환에 대한 신뢰 도면 간격을 정의하는 데 사용됩니다. - PyMOL 옵션에서 수출 | 선택 PyMOL 스크립트를 생성하여 PyMOL 소프트웨어를 사용하여 관심 있는 단백질의 pdb 구조에 상당한 교환 차이영역을 매핑합니다.
참고: 본 프로토콜에 설명된 워크플로우를 사용하여, 단일 시점에서 주어진 펩타이드에 대한 상당한 중수소 섭취 차이에 대한 99% 신뢰 구간은 일반적으로 0.3-0.5 Da이다. 모든 교환 시간 포인트에 대해 합산된 차이에 대한 99% 신뢰 구간은 일반적으로 0.7-1.0 Da입니다.
- 커버리지 맵에 관심 있는 차이를 표시합니다. 적용 범위 맵을 마우스 오른쪽 으로 클릭하여 차이점 데이터를 .csv 파일로 내보냅니다. 데이터 | 탐색하여 상태 데이터(.csv 형식으로) 내보냅니다. 주 도구 표시줄에서 상태 데이터를 내보냅니다.
결과
각 샘플 주사 세트에 대한 보철 소화의 품질과 워크플로우의 재현성을 평가할 필요가 있습니다. 따라서, HDX-MS 애사를 수행하기 전에, 관심 있는 단백질의 프로테오리시스에 대한 효과적인 조건을 확립하고, 역상 액체 크로마토그래피 및 가스상 이온 이동성을 이용한 펩티드의 분리를 위해, MS를 이용한 펩타이드검출을 위한 것이 필수적이다. 이를 위해 관심 있는 단백질에 대한 기준 샘플(중수소부재시 채취)을 먼저 조사해야 한다(섹션 3). 도 3A−C의 크로마토그래피 데이터는 HalM2 lanthipeptide synthetase의 3개의 기준 샘플에 대한 총 이온 크로마토그램(TiCs)을 보여줍니다. TIC는 질량 스펙트럼 검사에 포함된 모든 m/z 값에서 모든 이온 카운트의 합계에 따라 시간 종속변경입니다. 3분에서8분 사이의 TiC의 더 자세히 보기는 그림 3D−F에표시됩니다. 그림 3G--I에 표시된 질량 스펙트럼은 각 TIC의 작은 시간 간격(5.0에서 5.1 분)에 걸쳐 모든 질량 스펙트럼의 합계를 나타냅니다. 특히 도 3의다음 기능에주의해야 한다.
첫째, 그라데이션 의 끝에 9.3 분 근처의 큰 피크는 HalM2(그림 3A−C)의불완전하게 소화된 (따라서, 크고 더 소수성) 조각을 나타낸다. 소화는 HalM2 농도를 줄임으로써 보다 효율적으로 이루어질 수 있지만 펩타이드 신호 강도와 신호:잡음 비가 감소합니다. 소화는 또한 펩신 컬럼을 가진 접촉 시간(3분, 프로토콜 단계 3.3.3)을 증가시킴으로써 보다 효율적으로 이루어질 수 있었다. 그러나 접촉 시간이 증가하면 더 많은 백 교환이 발생합니다. 궁극적으로, 이러한 파라미터는 원하는 서열 커버리지, 신호 강도 및 중음부 보존을 제공하기 위해 관심 있는 단백질에 대해 균형을 이루어야 한다. 둘째, TIC 프로파일의 모양과 강도는 비슷해야 합니다(그림 3D−F와같이). 이는 HalM2의 프로테오분해성 소화가 재현가능하며 세 가지 기준 샘플 모두에 유사한 효율임을 시사합니다. 기대는 중수소 교환 샘플의 유사한 소화가 유사한 보존 시간을 가진 펩티드의 동일한 세트를 생성한다는 것입니다. 셋째, 주어진 시간 간격에 대한 질량 스펙트럼도 유사해야한다(그림 3G−I). 크로마토그래피 분리의 5.0-5.1 분 시간 간격을 통해 합산 질량 스펙트럼의 빠른 시각적 비교는 각 샘플의 질량 스펙트럼 신호가 실제로 매우 유사하다는 것을 보여 주며, 각 샘플에 유사한 펩티드가 존재하고 C18 열과 비슷한 시기에 용례하고 있다는 확신을 제공합니다. 크로마토그램을 가로질러 다른 시간 간격에 걸쳐 유사한 빠른 육안 검사를 수행해야 합니다.
기준 샘플의 LC-MS 데이터에서 유사성을 시각적으로 확인한 후, 프로테오믹스 소프트웨어는 관심 있는 단백질의 아미노산 서열으로부터 유래된 펩티드에 대한 MS 데이터를 검색하는 데 사용된다. 단백질 서열 데이터뱅크(관심 있는 단백질의 아미노산 서열)를 정의한 후, 프로토콜 단계 4.2-4.4에 기재된 바와 같은 처리 및 워크플로 매개변수는, 각 개별 기준 샘플은 관심있는 단백질로부터 유래된 펩타이드와 일치하는 펩티드를 검출하기 위해 처리된다. 단정되지 않은 HalM2 참조 샘플에 대한 프로테오믹스 소프트웨어 출력의 예가 도 4에도시된다. 특히 주의는 다음 기능에 지불해야합니다. 첫째, 처리 및 워크플로 파라미터에 정의된 값에 따라 관심 있는 단백질 내의 특정 펩티드와 일치하는 임의의 MS 신호는 하단 스펙트럼에서 파란색으로 칠하게 된다. 참조 샘플이 "성공적으로" 처리되면 대부분의 신호가 파란색으로 표시됩니다(그림 4의데이터에 대한 경우와 마찬가지로). 또한 왼쪽 상단 패널에서는 "OK 필터"가 녹색 체크표시로 전환되었는지 확인합니다. 이 작업이 완료되면 오른쪽 상단 패널의 상단 막대(그림 4에서파란색으로 강조 표시)의 통계는 높은 신뢰도 점수를 주는 펩티드만 반영합니다. 이러한 펩타이드는 낮은 ppm 질량 정확도, 다중 단편 이온 및 단편과 부모 이온 보존 시간 사이의 좋은 상관 관계를 나타내며, 자신감 있는 식별으로 간주됩니다. 도시된 HalM2 기준 샘플의 경우, 1,421개의 펩타이드가 높은 점수로 검출되었으며, HalM2 서열의 99.6%를 커버하였다. 프로토콜 섹션 3에 설명된 상향식 LC-MS 워크플로우를 사용하여 대부분의 단백질에 대해 거의 100% 서열 커버리지를 달성할 수 있어야 합니다. 더욱이, 모든 펩타이드에 대한 추가 유용한 통계는 질량 오차, 전구체 보존 시간, 단편(제품 이온), 이름별 단편 이온의 전체 목록 및 이온 이동성 드리프트 시간을 포함하여 오른쪽 상단 패널에 표로 매시된다. 이 정보는 항상 가장 자신있게 식별 된 펩티드에 초점을 맞추어야 하는 결과의 해석에 유용합니다.
최종 펩티드 목록은 HDX 처리 소프트웨어의 추가 임계값에 의해 결정되어야 합니다. 펩티드 목록(프로토콜 섹션 4)을 생성하기 위해 기준 데이터를 분석한 후, 출력은 추가 임계값을 위해 HDX 처리 소프트웨어로 가져와야 한다. 출력 파일은 파일 확장 "..._IA_final_peptide.csv"와 프로토콜 단계 4.5에 정의된 디렉터리에 저장됩니다. 출력을 HDX 처리 소프트웨어에 업로드하면 펩타이드의 전체 목록이 "펩타이드 프리뷰"패널(그림 5)에표시되며, 펩타이드, 서열 커버리지 및 중복성은 창의 오른쪽 하단 모서리에 표시됩니다. 이러한 값은 추가 임계값이 적용되면 실시간으로 변경됩니다. 다음을클릭한 후 표시된 필드에서 임계값값을 설정할 수 있습니다. 가장 중요한 필터는 모든 펩타이드가 세 개의 기준 샘플 각각에 위치하도록 요구하는 "파일 임계값", 값으로 설정해야 하는 "최대 MH+ 오류(ppm)", MSMS(즉, 고충돌 에너지) 단계 동안 펩타이드가 최소 2개의 연속 단편 이온을 생성해야 하는 "최소 연속 제품"입니다.
HDX-MS 분석의 가장 중요한 기술적 한계는 중수소 교환 샘플이 담금질되는 즉시 발생하는 프로티움에 대한 중테리움의 백 교환입니다 (protiated 버퍼). 워크플로의 프로테아제 소화 및 LC-MS 부분 동안 백 교환이 계속됩니다. 백 교환은 불가피하지만, 모든 후 담금질 단계의 pH, 온도 및 타이밍이 프로토콜에 설명된 대로 주의 깊게 제어되는 경우, 중음술 라벨의 60%-70%를 유지할 수 있다. 이러한 이유로, 대부분의 펩티드가 중음류를 유지하고 있다는 분석 개발의 초기 단계에서 확인하는 것이 필수적이다. 이는 중음시 샘플의 원시 데이터를 참조 샘플의 원시 데이터와 비교하여 신속하게 달성할 수 있습니다. 기준샘플(그림 3)의재현성을 보장하기 위해 수행된 것처럼, 중테리움 교환 및 미성정 기준 샘플의 TiC를 비교하여 프로파일의 모양이 서로 닮도록 합니다. 또한 두 샘플모두에서 동일한 크로마토그래피 시간 간격을 통해 질량 스펙트럼을 합산합니다. 중수소 교환 시료의 대부분의 펩타이드는 높은 m/z 값(그림 6에서와같이)으로 향하는 동위원소 분포의 명백한 변화를 나타내야 한다. 이 데이터는 중테리움 라벨의 상당 부분이 산 담금질, 펩신 소화 및 LC-MS 데이터 수집 의 과정 전반에 걸쳐 유지되고 있음을 나타냅니다.
워크플로우가 충분한 중음부 보존을 제공하고 있는지 확인한 후, 중음절 섭취량을 정량화해야 합니다. 따라서, 중수소 교환 샘플에 대한 원시 데이터는 HDX 처리 소프트웨어로 가져옵니다. 기준 샘플및 최종 펩타이드 목록을 사용하여, HDX 처리 소프트웨어는 각 원시 데이터 파일의 펩타이드 목록에서 펩티드를 찾아각동위원소 봉우리각각에 "스틱"을 할당합니다. 도 7에표시된 HalM2의 대표 데이터에서 성공적으로 할당된 스틱은 모든 스펙트럼에서 파란색으로 표시됩니다. 스틱을 할당한 후, 동위원소 분포에 대한 센트로이드 m/z 값은 소프트웨어에 의해 결정되고 미지정 기준 샘플에 비해 중음절 섭취량을 계산하는 데 사용됩니다. 각 펩타이드에 대한 중수소 교환 값은 수동으로 확인되어야 합니다. 도 7에서,현재 선택된 펩티드(HIDKLTVGL, HalM2 잔기 110-118)는 주 데이터 뷰어(도7A)의왼쪽 패널에 도시된다. 다른 패널은 이 펩티드와 관련된 HDX 데이터를 보여줍니다. 펩티드 목록에 있는 펩티드를 클릭하면 다른 패널을 해당 펩타이드의 HDX 데이터로 채웁니다. 도 7B는 펩타이드 110-118에 대한 중수소 업테이크 플롯을 나타낸다. 이 데이터 집합에는 0.5, 5, 30 및 240분(triplicate에서 수집)의 4개의 교환 시간 포인트가 포함되어 있습니다. 교환 데이터는 두 생화학 상태에 대해 수집되었다: 무료 HalM2 효소 (빨간색) 및 AMPPNP와 기질 펩티드 HalA2 (파란색)에 복합 할M2 효소. 전체 시간 과정 및 복제 측정의 높은 정밀도에 걸쳐 펩티드 110-118에 상당한 중테리움 섭취 차이를 유의하십시오(오류 막대는 도 7B의플롯에 표시됨). 일반적으로, 대부분의 펩타이드에 대해 섭취량 측정에서 유사한 정밀도가 얻어지며, 이 프로토콜에 제시된 워크플로우의 재현성을 강조한다. 리간드 결합(도 7B의블루 커브)에 따라, 할M2의 110-118 영역에서 펩타이드 본드 아마이드는 분명히 중수소 교환으로부터 상당한 보호를 받고 있으며, 이는 110-118 영역의 아미노산이 리간드 결합 시 보다 안정적으로 구조화되고 있음을 시사한다. 이 영역의 후속 돌연변이 발생은 전구체 펩티드, HalA220에결합하는 역할을 나타냈다. 도 7에서도 도시된 할M2상태(도 7D)와HalM2:AMPPNP:HalA2 상태(도7E)에대한 누적 스펙트럼 플롯이 있다. 이러한 플롯에서 교환 시간은 아래에서 맨 위로 증가합니다. 더 긴 시간 지점에서 중수소 교환 시 펩타이드 110-118의 질량 증가는 육안으로 검사에서 분명하게 드러난다. 또한 펩타이드 110-118이 완전히 리간드 된상태(도 7E)보다HalM2 상태(도7D)에서더 많은 중테리움을 섭취한다는 것이 분명하다. 필요한 경우 그림 7D 또는 도 7E의하위 플롯을 클릭하면 사용자가 주 데이터 뷰어(그림7C)에서스틱 할당을 수동으로 수정할 수 있습니다. 스틱 할당/할당 취소 시 HDX 처리 소프트웨어는 중수소 섭취량 값을 다시 계산하며 모든 플롯이 실시간으로 업데이트됩니다. 마찬가지로 패널 B의 개별 데이터 점을 클릭하면 수동 스틱 할당을 위해 패널 C의 데이터 뷰어가 채워집니다.
모든 생화학 적 상태에 대해 각 펩티드 및 교환 시점에 스틱이 할당 된 후 측정 된 섭취량 값의 표준 편차를 확인해야합니다. 이것은 커버리지 맵과 누적 스펙트럼 플롯(그림 8)으로수행하는 것이 가장 쉽습니다. 커버리지맵(그림 8C)에서관심 상태 및 교환 시간을 선택한 다음 상대적 섭취 표준 편차를 선택합니다. 커버리지 맵의 펩타이드는 측정된 중수소 섭취량 값의 표준 편차에 따라 착색됩니다. 이러한 방식으로 동위원소 스틱 잘못 할당이 있는 펩티드를 시각적으로 식별하는 것은 매우 쉬울 것입니다. 커버리지 맵에서 이상값 펩타이드(높은 표준 편차)를 클릭하면 주 데이터 뷰어와 누적된 스펙트럼 플롯을 이상치 펩타이드의 HDX 데이터로 채웁니다. 그런 다음 각 시간 지점 및 충전 상태에 대한 스틱 할당을 필요에 따라 수정하여 측정된 섭취량 값을 수정할 수 있습니다. 다시 말하지만, HDX 처리 소프트웨어는 스틱 할당이 변경됨에 따라 모든 데이터 디스플레이를 실시간으로 업데이트합니다.
HDX 데이터 세트를 완전히 큐레이팅한 후, 각 펩타이드에 대한 중테리움 의 차액 측정의 중요성은 데이터 해석 전에 고려해야 합니다. Engen 및동급자(29)가기술한 접근법을 사용하여, 상기프로토콜(20)에기재된 워크플로우를 이용하여 HalM2 단백질에 대해 평균 0.1± 0.1Da의 평균 섭취량 값을 추정했다. 이 값은 유사한 상향식, 연속 교환 HDX 워크플로우29,30에대해 다른 사용자가 보고한 오류와 일치합니다. 최근, Politis와 동료들은 HDX 데이터 세트28에서상당한 상승 차이를 신속하게 결정하기 위한 유용한 오픈 소스 도구(MATLAB에서 구현)인 Deuteros를 개발했습니다. Deuteros("State_Data_for_Deuteros"및 "Difference_Data_for_Deuteros")의 대표 입력 파일이 지원 정보에포함됩니다. 이프로토콜(자료표)에설명된 HDX 처리 소프트웨어에서 직접 내보낸 경우, 차이 및 상태 데이터 파일은 Deuteros의 파일 판독에 적합한 형식을 갖습니다. 다른 LC-MS 시스템에서 HDX 데이터가 생성되는 경우 지원 정보에 제공된 것과 유사한 데이터 파일을 수동으로 구성해야 합니다.
듀테로스 작업 영역은 그림 9에표시됩니다. 데이터가 Deuteros로 가져온 후 사용자는 원하는 신뢰도 제한(권장)을 선택하고 가져오기 및 계산을클릭합니다. 병합된 데이터 맵의 경우 데이터 형식에 대한 적용 범위와 색상 배율에 대한 절대 범위를 선택합니다. 플롯을 클릭합니다. 목재 플롯의 경우 바이너리 필터를 데이터 유형으로 선택하고 원하는 신뢰도 필터를 사용하여 합계를 활성화합니다. 플롯을클릭하면, Deuteros는 아미노산 서열및 그들의 중수소 uptake 값에 있는 그들의 위치의 함수로 각 교환 시점에 있는 모든 펩티드를 플롯합니다. 상당한 교환을 나타내는 펩타이드는 펩타이드가 각각 더 많거나 적은 중음액을 차지하는지 여부에 따라 적색 또는 파란색으로 착색됩니다. 각 플롯에 보고된 유의값(도 9에플롯된 데이터에서 0.39에서 0.72 Da까지)은 데이터 세트 내에 존재하는 복제 측정에서 결정된 모든 펩티드에 대해 측정된 섭취량 차이의 표준 편차로부터 계산된다. 신뢰 간격은 각 개별 플롯에 걸쳐 파선 막대로 표시됩니다. 활성화된 경우"Sum"은 모든 펩타이드에 대해 각 시점에서 측정된 섭취량 차이를 추가합니다. 마지막으로, 관심 있는 단백질의 3차원 구조에 대한 섭취 데이터의 시각화를 위해 PyMOL 옵션에 따라 내보내기 섭취량을 선택한 다음 내보내기를 내다보세요. Deuteros는 관심 있는 단백질의 열린 pdb 파일을 포함하는 PyMOL 작업 공간으로 드래그하고 떨어뜨릴 수 있는 PyMOL 스크립트를 생성합니다.
본 프로토콜에 제시된 HDX-MS 워크플로우는 유전자 인코딩 펩티드(HalA2)20에일련의 번역 후 변형을 촉매하는 효소(HalM2)의 생화학적 특성을 특성화하는 데 사용되었다. 도 10에서,대표적인 HDX-MS 결과는 HalM2:AMP-PNP 복합체에 할A2 전구체 펩타이드의 결합을 위해 도시된다. 패널 A는 할M2 커버리지 맵을 나타내며, 여기서 색상은 [HalM2:AMPPNP] 생화학 상태와 [HalM2:AMPPNP:HalA2] 상태 사이의 상대적 상승 차이를 나타낸다. Deuteros는 HalM2 효소(도 10B, C)의상동성 모델에 이러한 섭취 차이를 매핑하는 데 사용되었다. 빨간색으로 착색된 펩타이드는 HalA2 결합시 중수소 섭취량의 감소를 나타내며, HalM2의 이러한 영역이 전구체 펩타이드의 결합에 직접 관여할 수 있음을 시사한다. 이 가설을 조사하기 위하여는, 지역 I-III는 돌연변이되고 변이체 효소의 운동 특성을 조사되었습니다. 지역 I와 III의 돌연변이는 모두 HalA2 펩타이드 결합 친화성에서 상당한 혼란을 일으켰으며, HalM2의 이러한 영역이 펩티드 기판과 직접 상호 작용하거나 HalA2 결합을 가능하게 하는 구조를 형성하도록 요구된다는 것을 시사한다. 대조적으로, 지역 II의 돌연변이는 HalA2 결합 친화성에 아무영향 도무지 없었습니다, 그러나 이 돌연변이는 촉매 활동이 거의 결여되었습니다. 이 발견에 대한 한 가지 설명은 HalA2 바인딩시 관찰된 지역 II의 조직이 효소를 활성화시키는 형성 적 변화를 유발한다는 것입니다. 이 연구 이전에는 HalM2-HalA2 바인딩 모드 또는 시스템의 촉매 관련 구성 변경에 대한 정보가 제공되지 않았으며, 주로 HalM2와 HalA2의 큰 크기와 유연한 특성이 구조적 연구를 배제했기 때문입니다. 따라서, HalM2 lanthipeptide synthetase에 이러한 대표적인 데이터는 HDX-MS가 고해상도 구조 데이터가 없는 경우에도 구조적으로 동적 효소 시스템의 기능적으로 관련된 영역을 신속하게 찾는 데 어떻게 사용될 수 있는지를 보여줍니다.
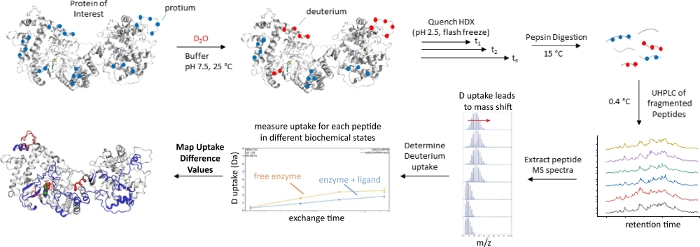
그림 1: 연속 교환, 상향식 HDX-MS 워크플로우. 자세한 내용은 텍스트를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: HDX 비율은 N-D결합(kchem)에대한 단백질 백본에서 N-H 결합의 단백질 형성역학(kopen 및 kclose)과pH 의존환율에 따라 달라집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 삼중항 HalM2 참조 샘플에 대한 대표 LC-MS 데이터. 각 패널의 오른쪽 상단 모서리에 있는 숫자는 총 이온 수를 나타냅니다. 각 행은 다른 참조 샘플에 대한 데이터를 표시합니다. 첫 번째컬럼(A−C)은총 이온 크로마토그램(TiC)을 나타낸다. 9.3분의 큰 피크는 소화되지 않은 크고 소화되지 않은 펩티드를 나타냅니다. 중간열(D−F)은3분에서 8분 사이에 TiC를 더 자세히 볼 수 있습니다. 전체 크로마토그램에 걸쳐 각 기준 샘플에서 펩티드 신호의 유사한 기본 혼합물을 나타내는 프로파일의 모양의 좋은 동의에 유의하십시오. 세 번째컬럼(G−I)은크로마토그래피 런의 시간점 5.0과 5.1분 사이에 기록된 모든 질량 스펙트럼을 합산하여 생성된 각 기준 샘플에 대한 질량 스펙트럼을 나타낸다. 이 데이터의 육안으로 검사하면 각 샘플에서 동일한 펩티드의 대부분이 검출되고 있음을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
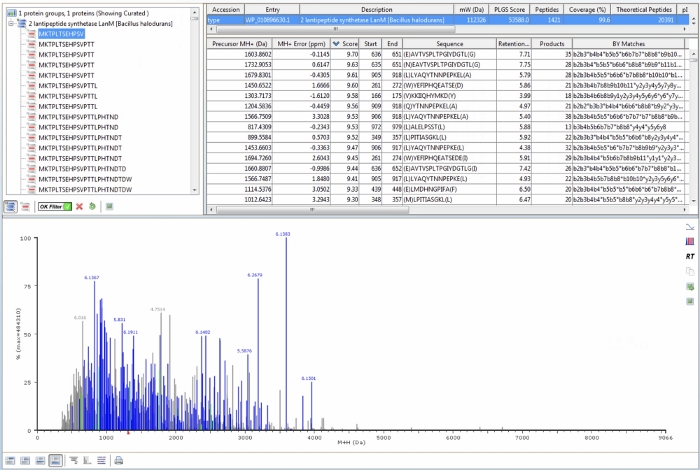
그림 4: HalM2 참조 샘플에 대한 대표적인 프로테오믹스 소프트웨어 출력입니다. 왼쪽 상단 패널은 MS 데이터에서 검출된 HalM2 유래 펩틱 펩타이드의 전체 목록을 보여줍니다. "OK 필터"에는 녹색 체크표시가 표시됩니다. 이것은 신뢰 점수에 따라 데이터를 필터링하고 낮은 신뢰의 펩티드 식별을 제거합니다. 오른쪽 패널의 상단 막대(파란색으로 강조 표시)는 높은 점수를 가진 펩타이드 세트에 대한 누적 통계를 보여줍니다. 가장 중요한 통계는 검출된 펩타이드의 수(이 경우 1,421)와 서열 커버리지(이 경우 99.6%)이다. 모든 펩티드에 대한 추가 통계는 오른쪽 상단 패널에도 표시됩니다. 이 데이터 테이블의 각 열은 정렬할 수 있습니다. 하단 패널은 예측된 HalM2 유래 펩티드와 일치하는 모든 MS 신호를 보여줍니다. 대부분의 MS 신호가 할당되어 파란색으로 지정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: HDX 처리 소프트웨어의 추가 임계값입니다. 3개의 HalM2 참조 샘플 각각에 대한 프로테오믹스 소프트웨어 출력은 HDX 처리 소프트웨어(왼쪽 패널)로 가져옵니다. 데이터를 가져온 후 추가 임계값이 수행됩니다(오른쪽 패널). 상기 "최소 연속 제품" 필드는 펩타이드내 인접한 펩타이드 결합의 분열에 의해 생성된 단편 이온을 말한다. "최소 MH+ 오류" 매개 변수를 사용하면 사용자가 허용 가능한 질량 정확도를 정의할 수 있으며"파일 임계값"을 사용하면 세 참조 파일 에서 모두 감지된 펩타이드만 펩티드만으로 펩티드를 제한할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: HalM2 참조 샘플(빨간색) 및 D2O 버퍼에서 5분(녹색)으로 배양된 HalM2 샘플의 대표적인 데이터입니다. 두 샘플 모두 프로토콜 섹션 3에 설명된 상향식 LC-MS 워크플로우를 실시하였다. 왼쪽 열은 6.0-6.1 분 시간 창에 걸쳐 합산 질량 스펙트럼을 보여줍니다. 세 개의 오른쪽 컬럼은 동일한 질량 스펙트럼의 더 가까운 뷰를 보여 주며, 유정 된 샘플 (녹색, 상단)에서 더 높은 m/z 값으로의 전환은 대부분의 펩티드 신호에 대해 명백합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: HDX 처리 소프트웨어의 작업 영역 스크린샷입니다. (A)HDX 프로세싱 소프트웨어(도3)와후속 임계값을 가진 HalM2 기준 샘플의 분석으로부터 얻은 HalM2 유래 펩타이드목록(도 4). 현재 선택된 펩타이드(HIDKLTVGL, HalM2 잔기 110-118)는 파란색으로 강조 표시됩니다. (B)중수소 는 두 생화학 적 상태에 대한 (교환 시간의 함수로서) 관심의 두 생화학 상태에 대한 곡선 : 무료 HalM2 효소, 및 AMPPNP 및 전구체 란티펩티드, HalA2에 바인딩 할M2 효소. (C)적극적으로 선택된 샘플의 질량 스펙트럼(이 경우, 단호되지 않은 HalM2 기준 샘플 중 하나). 패널 C의 파란색 스틱은 초기 데이터 처리 중에 HDX 처리 소프트웨어에 의해 제대로 할당되지 않은 경우 필요에 따라 수동으로 할당/할당취소할 수 있습니다. (D,E) HalM2상태(D)와HalM2:AMPPNP:HalA2상태(E)에대한 누적 스펙트럼 플롯. 중수소 섭취량의 시간 의존적 증가는 두 생화학 국가 간의 섭취 차이와 마찬가지로 쉽게 볼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 측정된 섭취량 값에서 표준 편차를 최소화합니다. HDX 처리 소프트웨어(패널 C)의 커버리지 맵은 측정된 중수소 섭취 값에서 큰 표준 편차로 펩티드를 신속하게 식별할 수 있는 편리한 수단을 제공합니다. 이러한 가상의 경우, 잔류물 110-118에 스며이는 HalM2 유래 펩타이드에 대한 동위원소 봉우리(blue sticks)의 일부는 5분 교환 시간 포인트(패널 B의 회색 스틱)에 대해 할당되지 않는다. 이는 5분 교환 시간 지점에 대해 측정된 중수소 섭취량 값에서 큰 표준 편차로 이어집니다. 큰 표준 편차는 커버리지 맵(panel C)에서 110-118 펩타이드의 청색과 데이터 포인트 산란 및 큰 오차 막대로부터 쉽게 명백하다(패널 A). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 9: 신테로스 작업 공간. 이 예에서, 흡입차값은 HalM2:AMPPNP:HalA2 상태의 중수소 섭취량을 HalM2:AMPPNP 상태의 중수소 섭취량을 빼서 HDX 처리 소프트웨어에서 계산되었다. 비교의 목표는 펩티드 (HalA2) 결합이 HalM2:AMPPNP 복합체의 구조적 역학을 어떻게 변화시켰는지 시각화하는 것이었습니다. 데이터 세트에는 4개의 교환 시간 포인트(0.5, 5, 30 분 및 240분)가 포함되어 있습니다. 각 교환 시점의 모든 펩타이드에 대한 섭취 차이는 우즈 플롯에 설명되어 있습니다. 우즈 플롯의 유색 펩타이드는 데이터 세트에 존재하는 복제 측정의 표준 편차에 의해 정의된 바와 같이, 유의한 섭취 차이를 나타내는 펩티드를 나타내며, Deuteros에서 선택된 사용자 정의 신뢰도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
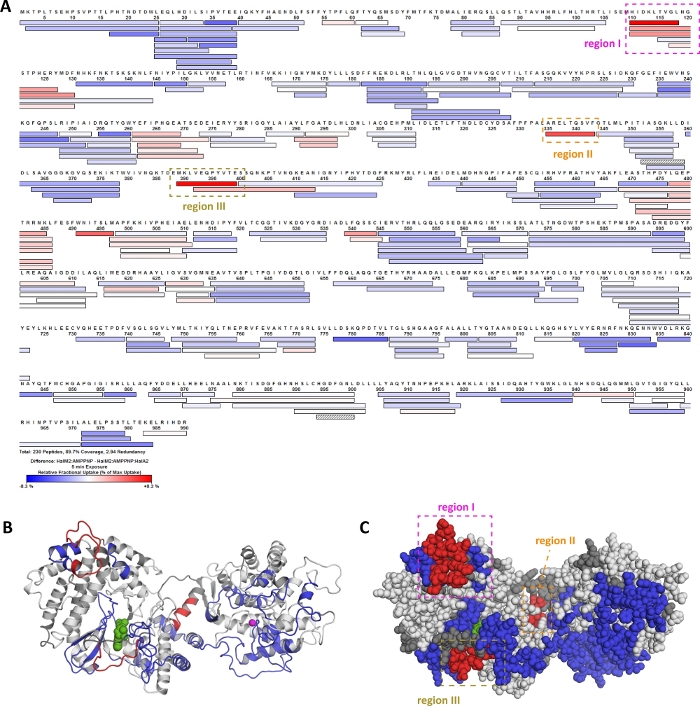
도 10: HDX-MS 데이터는 란티피타이드 synthetase HalM2에서 펩타이드 결합 및 알로스터 활성화의 기능적 분석을 안내한다. 할M2 란티펩타이드 시냅타아제에 대한 할A2 전구체 펩타이드의 결합시 중수소 상승변화가 조사되었다. 5분 교환 반응 후 각 펩티드에 대한섭취 차이는 플롯된다(A). 이 플롯은 HDX 처리 소프트웨어에서 생성되었습니다. 적색과 파란색으로 칠해진 펩타이드는 할A2 펩타이드의 존재속에서 각각 점점 더 중수소 섭취량을 겪습니다. 이러한 HDX "핫스팟"은 HalM2 호모로지모델(B, C)에매핑됩니다. 유의한 교환 차이를 겪고 있는 펩타이드의 식별은 Deuteros에서 결정되었다. 차이점 값을 모톨로지 모델에 매핑하는 데 사용되는 PyMOL 스크립트는 Deuteros에서 생성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜에 제시된 HDX-MS 워크플로우는 단백질의 구조적으로 역동적인 요소의 공간 분포를 매핑하고 이러한 역학이 변투(리간드 결합, 효소 돌연변이 발생 등)에 대한 응답으로 어떻게 변화하는지 조사하기 위한 매우 견고한 플랫폼을 제공합니다. HDX-MS는 일반적으로 형성 역학을 조사하는 데 사용되는 다른 구조 생물학 접근 방식에 비해 몇 가지 뚜렷한 이점을 보유하고 있습니다. 특히 소량의 단백질만 필요합니다. 본 명세서에 기재된 워크플로우를 사용하여, 1 μM 단백질의 1mL 샘플은 5개의 교환 시간 점을 포함하는 각각의 삼중 화질 HDX 반응에 충분한 물질을 제공한다. 더욱이, 관심있는 단백질에 대한 크기 제한은 거의 없으며, 단백질 복합체는 HDX-MS 접근법에 동등하게 순종한다. 크기 제한은 펩틱 펩티드가 크로마토그래피로 해결할 수 있는 범위와 m/z 및 이온 이동성 치수에 의해서만 제한됩니다. 따라서 많은 단백질/단백질 복합체의 경우 HDX-MS는 단백질-단백질 상호 작용 인터페이스, 리간 드니스트 사이트, 형태 역학 및 알로스터릭 네트워크에 대한 귀중한 정보를 제공할 것입니다. 마지막으로, HDX 반응은 내인성 활동이 보존되는 것을 확인하는 데 도움이 될 것입니다 단백질의 사이트 특정 라벨링 / 엔지니어링에 대한 필요없이 부드러운, 거의 네이티브 조건하에서 수행됩니다. 접근법의 주요 제한사항(관심 있는 단백질에 제공하는 기계성 정보의 관점에서)은 펩타이드 레벨 HDX 데이터가 본질적으로 낮은 공간 해상도라는 것이다. 따라서, 데이터는 이차 구조의 변화가 일어나고 있음을 추론하기에 충분하지만, 구조적 교란의 기계적 영향은 구조, 계산 연구 및/또는 생화학 적 연구를 완전히 해석하기 위해 더 높은 해상도(예를 들어, NMR, 극저온, 또는 X선 결정)를 필요로 한다.
결과의 재현성과 신뢰성을 보장하기 위해 프로토콜의 몇 가지 중요한 측면을 염두에 두어야 합니다. 첫째, HDX 반응 중 중 중수소 교환의 범위와 작업 및 분석 중 백 교환의 정도는 pH, 시간 및 온도에 크게 의존한다. 따라서 버퍼, HDX 반응 및 LC-MS 방법의 제조 절차는 데이터 집합 전반에 걸쳐 이러한 물리적 매개 변수의 변동을 최소화하기 위해 가능한 한 체계적으로 이루어져야 합니다. 가능하면, 비교될 생화학 국가에 대한 HDX 반응은 같은 날에 동일한 연구원에 의해 수행되어야하며, 이러한 샘플에 대한 LC-MS 데이터는 동일한 용매 배치로 연속일 동안 수집되어야합니다. 시간이 지남에 따라 펩신 소화의 효율도 감소하므로 상대적으로 좁은 기간 내에 소화되고 분석되는 것과 비교되는 시료에 최적입니다-특히 펩신 컬럼이 다른 많은 유형의 샘플을 소화하는 데 사용되는 경우. 표준 단백질을 사용하여 펩신 컬럼의 소화 효율을 주기적으로 확인하는 것이 좋습니다. 이를 위해 새로 소화된 샘플을 이전 샘플과 비교하여 동일한 표적 펩타이드 집합이 유사한 강도로 검출되는 경우 전용 HDX 처리 소프트웨어 프로젝트를 설정할 수 있습니다.
이 프로토콜에 제시된 워크플로우는 많은 효소/단백질 시스템에 적합한 데이터를 제공해야 하지만, 몇 가지 잠재적인 최적화 지점이 있습니다. 첫째, HDX 반응의 시간 척도를 수정하여 더 빠르고 느린 역학을 캡처할 수 있습니다. 특히, 많은 효소는 몇 초 안에 완전히 교환되는 매우 역동적인 원소를 포함합니다. 이러한 매우 역동적인 요소가 관심 있는 경우, 사전 정상 상태, 연속 교환 HDX-MS에 대한 방법이문헌(31)에보고되었다. 둘째, LC 방법 조건은 소화 효율(궁극적으로 시퀀스 커버리지를 결정하는) 및 중수소 보존(궁극적으로 방법의 감도를 결정하는)을 변경하도록 쉽게 변경할 수 있다. 펩신 소화의 지속 시간 및 온도를 고려하여, 느린 유량과 높은 온도는 단백질의 더 철저한 소화를 선호합니다. HDX 분석의 단백질 농도는 신호 강도가 너무 낮거나 펩신 소화가 너무 비효율적인 경우 감소될 경우 증가할 수 있다. 분석 C18 컬럼상에 펩틱 펩티드를 분리하는 데 사용되는 아세토닐 그라데이션을 고려할 때, 더 빠른 그라데이션은 중수소 라벨을 보존하지만 소화된 반응 혼합물에 존재하는 펩티드의 크로마토그래피 분해를 희생한다. 더 적은 펩티드가 소화에 존재하는 더 작은 단백질(~200아미노산)의 경우, 더 빠른 LC 그라데이션을 구현하기가 더 쉬울 수 있다. HalM2(~1,000개의 아미노산)와 같은 더 큰 단백질의 경우, 혼합물에서 더 많은 수의 펩티드에 의해 생성된 추가 스펙트럼 복잡성을 해결하기 위해 더 긴 그라데이션이 필요하다. 이 후자의 시나리오에서는 가스 상 이온 이동성 분리를 포함하면 분석의 피크 용량을 크게 향상시킬 수 있습니다. 이온 이동성 분리의 포함은 소음 비율에 대한 신호가 약간 감소하는 비용으로 제공됩니다. 마지막으로 HDX 샘플에 대한 MS 데이터를 MSE 모드에서 수집할 필요가 없다는 점에 유의해야 합니다. MSE 듀티 사이클의 MSMS 부분(즉, 고충돌 에너지 세그먼트, 단계 3.3.7.2)은 펩티드 목록(프로토콜 섹션 4)을 정의하기 위해 기준 샘플에대해서만 요구된다. 따라서, HDX 샘플은 신호:잡음 비율을 증가시키기 위해 MS 전용 모드에서 분석되어야 한다.
이 프로토콜에 설명된 워크플로우가 제대로 작동하는 경우, 완전히 교환 된 펩타이드는 60%-70 %의 상대 중수소 섭취 값을 나타내야한다. 중수소 섭취량이 이것보다 실질적으로 낮은 것으로 판명되면(용매 노출, 보호되지 않은 펩타이드의 경우), 가장 가능성이 높은 설명은 시료의 pH가 작업/분석의 일부 동안 변화하고 있다는 것입니다. 이 시나리오에서는, 마이크로팁 전극을 사용하여 HDX 분석기의 pH와 담금질 반응 알리쿼트의 pH를 주의 깊게 모니터링해야 한다. LC-MS 용매의 pH도 확인해야 합니다. 이 문제의 발생을 최소화하기 위해 분석에 필요한 모든 버퍼 및 시약의 집중 된 재고 솔루션을 준비하고 저장하는 것이 좋습니다 (프로토콜 섹션 1에 설명된 대로).
최근 몇 년 동안, HDX-MS는 단백질 구조 역학을 조사하는 강력한 분석 도구로 부상했다. HDX 실험에 설계 및 최적화된 상용 LC-MS 시스템의 개발(예: 이 연구에 사용되고 재료에 나열된 시스템)과 강력한 소프트웨어 패키지와 결합하여 HDX-MS 접근 방식을 많은 학술 및 산업 실험실로 확장했으며, 15년 전 틈새 기술이었던 것을 보다 사용자 친화적인 분석 플랫폼으로 탈바꿈시켰습니다. 공간 적 해상도의 한계에도 불구하고 HDX-MS는 단백질 모션에 대한 정량적이고 재현 가능한 측정을 제공하며 다른 접근법으로 조사하기 어려운 구형 동적 효소를 연구하는 데 이상적입니다. 이러한 특성 때문에 HDX-MS는 생물학 및 의학의 많은 근본적인 영역에서 관련성이 있는 무질서하고 역동적인 단백질 시스템의 구조 생물학에서 필수적인 틈새 시장을 채웁니다. 따라서 HDX-MS 분석은 당분간 구조 생물학자의 무기고에서 중요한 도구로 남아 있을 것으로 예상됩니다.
공개
우리는 공개 할 것이 없습니다.
감사의 말
이 작품은 캐나다 자연 과학 및 공학 연구 위원회, 퐁드 드 레체슈 뒤 퀘벡 자연 에 테크놀로지, 혁신을위한 캐나다 재단, 맥길 대학 창업 기금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| [glu-1]-fibrinopeptide B (Glu-Fib) | BioBasic | NA | |
| 0.5 mL Amicon Ultracel 10k centrifugal filtration device (Millipore) | Milipore Sigma | UFC501096 | |
| acetonitrile | Fisher | A955-1 | |
| AMP-PNP | SIGMA | A2647-25MG | |
| ATP | SIGMA | a2383-5G | |
| D2O | ALDRICH | 435767-100G | |
| formic acid | Thermo Fisher | 28905 | |
| guanidine-HCl | VWR | 97063-764 | |
| HEPES | Fisher | BP310-1 | |
| Magnesium chloride | SiGMA-Aldrich | 63068-250G | |
| Potassium chloride | BioBasic | PB0440 | |
| potassium phosphate | BioBasic | PB0445 | |
| TCEP Hydrochloride | TRC Canada | T012500 | peptide was synthesized upon request |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| software | |||
| Deuteros | Andy M C Lau, et al | version 1.08 | |
| DynamX | Waters | version 3.0 | |
| MassLynx | Waters | version 4.1 | |
| Protein Lynx Global Server (PLGS) | Waters | version 3.0.3 | |
| PyMOL | Schrödinger | version 2.2.2 | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Instrument and equipment | |||
| ACQUITY UPLC BEH C18 analytical Column | Waters | 186002346 | |
| ACQUITY UPLC BEH C8 VanGuard Pre-column | Waters | 186003978 | |
| ACQUITY UPLC M-Class HDX System | Waters | ||
| HDX Manager | Waters | ||
| microtip pH electrode | Thermo Fisher | 13-620-291 | |
| Waters Enzymate BEH column or Pepsin solumn | Waters | 186007233 | |
| Waters Synapt G2-Si | Waters |
참고문헌
- Karplus, M., McCammon, J. A. Molecular dynamics simulations of biomolecules. Nature Structural & Molecular Biology. 9 (9), 646-652 (2002).
- Campbell, E., et al. The role of protein dynamics in the evolution of new enzyme function. Nature Chemical Biology. 12 (11), 944-950 (2016).
- Tokuriki, N., Tawfik, D. S. Protein dynamism and evolvability. Science. 324 (5924), 203-207 (2009).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass Spectrometry Reviews. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chemical Society Reviews. 40 (3), 1224(2011).
- Katta, V., Chait, B. T. Conformational changes in proteins probed by hydrogen-exchange electrospray-ionization mass spectrometry. Rapid Communications in Mass Spectrometry. 5 (4), 214(1991).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Science. 2 (4), 522(1993).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Xiao, K., et al. Revealing the architecture of protein complexes by an orthogonal approach combining HDXMS, CXMS, and disulfide trapping. Nature Protocols. 13 (6), 1403-1428 (2018).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Masson, G. R., et al. Recommendations for performing, interpreting and reporting hydrogen deuterium exchange mass spectrometry (HDX-MS) experiments. Nature Methods. 16 (7), 595-602 (2019).
- Liu, J., et al. An Efficient Site-Specific Method for Irreversible Covalent Labeling of Proteins with a Fluorophore. Scientific Reports. 5, 16883(2015).
- Marion, D., et al. Overcoming the overlap problem in the assignment of proton NMR spectra of larger proteins by use of three-dimensional heteronuclear proton-nitrogen-15 Hartmann-Hahn-multiple quantum coherence and nuclear Overhauser-multiple quantum coherence spectroscopy: application to interleukin 1.beta. Biochemistry. 28 (15), 6150-6156 (1989).
- Balasubramaniam, D., Komives, E. A. Hydrogen-exchange mass spectrometry for the study of intrinsic disorder in proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1834 (6), 1202-1209 (2013).
- Goswami, D., et al. Time window expansion for HDX analysis of an intrinsically disordered protein. Journal of the American Society for Mass Spectrometry. 24 (10), 1584-1592 (2013).
- Keppel, T. R., Howard, B. A., Weis, D. D. Mapping Unstructured Regions and Synergistic Folding in Intrinsically Disordered Proteins with Amide H/D Exchange Mass Spectrometry. Biochemistry. 50 (40), 8722-8732 (2011).
- Mitchell, J. L., et al. Functional Characterization and Conformational Analysis of the Herpesvirus saimiri Tip-C484 Protein. Journal of Molecular Biology. 366 (4), 1282-1293 (2007).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Hydrogen/deuterium exchange mass spectrometry with top-down electron capture dissociation for characterizing structural transitions of a 17 kDa protein. Journal of the American Chemical Society. 131 (35), 12801-12808 (2009).
- Habibi, Y., Uggowitzer, K. A., Issak, H., Thibodeaux, C. J. Insights into the Dynamic Structural Properties of a Lanthipeptide Synthetase using Hydrogen-Deuterium Exchange Mass Spectrometry. Journal of the American Chemical Society. 141 (37), 14661-14672 (2019).
- Hebling, C. M., et al. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Analytical Chemistry. 82 (13), 5415-5419 (2010).
- Duc, N. M., et al. Effective application of bicelles for conformational analysis of G protein-coupled receptors by hydrogen/deuterium exchange mass spectrometry. Journal of the American Society for Mass Spectrometry. 26 (5), 808-817 (2015).
- Canul-Tec, J. C., et al. Structure and allosteric inhibition of excitatory amino acid transporter 1. Nature. 544 (7651), 446-451 (2017).
- Reading, E., et al. Interrogating Membrane Protein Conformational Dynamics within Native Lipid Compositions. Angewandte Chemie International Edition. 56 (49), 15654-15657 (2017).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. Journal of Visualized Experiments. (81), e50839(2013).
- Lento, C., et al. Time-resolved ElectroSpray Ionization Hydrogen-deuterium Exchange Mass Spectrometry for Studying Protein Structure and Dynamics. Journal of Visualized Experiments. (122), e55464(2017).
- Schowen, K. B., Schowen, R. L. Solvent isotope effects on enzyme systems. Methods in Enzymology. 87, 551-606 (1982).
- Lau, A. M. C., Ahdash, Z., Martens, C., Politis, A. Deuteros: software for rapid analysis and visualization of data from differential hydrogen deuterium exchange-mass spectrometry. Bioinformatics. 35 (7), 3171-3173 (2019).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. Journal of Pharmaceutical Sciences. 100 (6), 2071(2011).
- Burkitt, W., O'Connor, G. Assessment of the repeatability and reproducibility of hydrogen/deuterium exchange mass spectrometry measurements. Rapid Communications in Mass Spectrometry. 22 (23), 3893-3901 (2008).
- Rob, T., Gill, P. K., Golemi-Kotra, D., Wilson, D. J. An electrospray ms-coupled microfluidic device for sub-second hydrogen/deuterium exchange pulse-labelling reveals allosteric effects in enzyme inhibition. Lab on a Chip. 13, 2528-2532 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유