Method Article
Una piattaforma di spettrometria di massa a scambio idrogeno-deuterio (HDX-MS) per lo studio degli enzimi biosintetici peptidici
In questo articolo
Riepilogo
Le sintetasi lanthipeptide catalizzano reazioni multistep durante la biosintesi dei prodotti naturali peptidici. Qui descriviamo un flusso di lavoro continuo, dal basso verso l'alto, di spettrometria di massa a scambio idrogeno-deuterio (HDX-MS) che può essere utilizzato per studiare la dinamica conformazionale delle sintetasi lantaipeptide, così come altri enzimi simili coinvolti nella biosintesi del prodotto naturale peptidico.
Abstract
La spettrometria di massa a scambio idrogeno-deuterio (HDX-MS) è un metodo potente per la caratterizzazione biofisica dei cambiamenti conformazionali enzimatici e delle interazioni enzima-substrato. Tra i suoi numerosi benefici, HDX-MS consuma solo piccole quantità di materiale, può essere eseguito in condizioni quasi native senza la necessità di etichettatura enzima/substrato, e può fornire informazioni risolte spazialmente sulla dinamica enzimatica conformazionale, anche per grandi enzimi e complessi multiproteina. Il metodo è iniziato dalla diluizione dell'enzima di interesse in tampone preparato in D2O. Ciò innesca lo scambio di prozio in ammidi di legame peptidico (N-H) con deuterio (N-D). Nei punti di tempo di scambio desiderati, le aliquote di reazione vengono spente, l'enzima viene proteoliizzato in peptidi, i peptidi sono separati dalla cromatografia liquida ad alte prestazioni (UPLC), e il cambiamento di massa di ogni peptide (a causa dello scambio di idrogeno con deuterio) è registrato da MS. La quantità di assorbimento del deuterio da parte di ogni peptide dipende fortemente dall'ambiente locale di legame idrogeno di quel peptide. I peptidi presenti in regioni molto dinamiche del deuterio di scambio enzimatico molto rapidamente, mentre i peptidi derivati da regioni ben ordinate subiscono uno scambio molto più lento. In questo modo, il tasso HDX riporta la dinamica conformazionale enzimatica locale. Le perturbazioni ai livelli di assorbimento del deuterio in presenza di diversi ligandi possono quindi essere utilizzate per mappare i siti di legame dei ligandi, identificare le reti allosteriche e comprendere il ruolo della dinamica conformazionale nella funzione enzimatica. Qui, illustriamo come abbiamo usato HDX-MS per comprendere meglio la biosintesi di un tipo di prodotti naturali peptidici chiamati lanthipeptides. I lanthipeptidi sono peptidi geneticamente codificati che vengono modificati post-traslazionemente da grandi enzimi multifunzionali, conformazionali dinamici che sono difficili da studiare con i tradizionali approcci di biologia strutturale. HDX-MS fornisce una piattaforma ideale e adattabile per studiare le proprietà meccaniche di questi tipi di enzimi.
Introduzione
Le proteine sono molecole strutturalmente dinamiche che campionano diverse conformazioni su scale di tempo che vanno dalla vibrazione del legame su scala femtoseconda ai riarrangiamenti di interi domini proteici che possono verificarsiper molti secondi 1. Queste fluttuazioni conformazionali sono spesso aspetti critici della funzione enzimatica/proteica. Ad esempio, i cambiamenti conformazionali indotti dal legame del ligando sono spesso di fondamentale importanza per modulare la funzione enzimatica, sia organizzando i residui attivi del sito necessari per la catalisi, definendo siti di legame del substrato in meccanismi cinetici sequenziali, proteggendo gli intermedi reattivi dall'ambiente, sia modulando la funzione enzimatica attraverso reti allosteriche. Recenti studi hanno anche dimostrato che la dinamica conformazionale può essere conservata durante l'evoluzione e che le perturbazioni ai moti molecolari conservati possono essere correlate con i cambiamenti nella specificità del substrato e l'emergere di nuove funzionienzimatici 2,3.
Negli ultimi anni, la spettrometria di massa a scambio idrogeno-deuterio (HDX-MS) è rapidamente emersa come una potente tecnica per sondare come i paesaggi conformazionali proteici rispondono a perturbazioni come il legame del ligando o la mutagenesi4,5,6,7. In un tipico esperimento HDX-MS (Figura 1), una proteina di interesse viene messa in tampone preparata in D2O, che innesca la sostituzione di protoni scambiabili con solventi con deuteria. Il tasso di scambio della moietà ammide dei legami peptidici dipende fortemente dal pH, dalla sequenza amminoacidica locale e dall'ambiente strutturale locale dell'ammide8. Le ammidi impegnate nelle interazioni di legame idrogeno (come quelle presenti in α-eliche e β fogli) si scambiano più lentamente delle ammidi nelle regioni non strutturate della proteina che sono esposte al solvente sfuso. Pertanto, l'estensione dell'assorbimento del deuterio è un riflesso della struttura dell'enzima. Ci si aspetta che enzimi conformi alla dinamica, o che subiscono transizioni strutturali al legame del ligando, producano una risposta HDX misurabile.
La base meccanicistica per il lento tasso di cambio di un'ammide strutturata è illustrata nella figura 25,8,9. Per sottoporsi all'HDX, la regione strutturata deve prima campionare transitoriamente una conformazione dispiegata, in modo che le molecole di solvente che catalizzano lo scambio di HDX attraverso uno specifico meccanismo acido/base chimica abbiano accesso all'ammide scambiabile. In definitiva, le grandezze relative del tasso di cambio chimico (kchem) e i tassi di piegatura e ripiegamento (kaperto e kvicino) determinano il tasso di HDX misuratonell'esperimento 5,8. Da questo semplice modello cinetico, è chiaro che l'estensione dell'assorbimento del deuterio rifletterà la dinamica conformazionale sottostante (come definita da kopen e kclose). La maggior parte degli esperimenti HDX-MS viene eseguita in un flusso di lavoro dal basso verso l'alto in cui, a seguito della reazione di scambio, la proteina di interesse viene digerita in peptidi e l'assorbimento del deuterio da parte di ciascun peptide viene misurato come un aumento dellamassa 7. In questo modo, HDX-MS consente di mappare le perturbazioni alla dinamica enzimatica conformazionale sulla scala spaziale locale dei peptidi, consentendo al ricercatore di valutare come la perturbazione alteri la dinamica in diverse regioni dell'enzima di interesse.
I vantaggi dell'approccio HDX-MS per chiarire la dinamica strutturale delle proteine sono numerosi. In primo luogo, il metodo può essere eseguito con piccole quantità di proteine native o su complessi proteici in sistemi con struttura quaternaria10. Non è nemmeno necessario che il preparato enzimatico utilizzato nel saggio sia altamente purificato11,12, purché il flusso di lavoro HDX-MS dal basso verso l'alto fornisca un numero sufficiente di peptidi identificati con sicurezza che coprono la sequenza proteica di interesse. Inoltre, HDX-MS può fornire informazioni sulla dinamica conformazionale in condizioni quasi native senza la necessità di etichettatura proteica site-specific come sarebbe utilizzata negli studi di fluorescenza a singolamolecola 13e non esiste un limite di dimensione al complesso proteico o proteico che può essere studiato (il che rende impegnativi approcci come la spettroscopia di risonanza magnetica nucleare [NMR])7,14. Infine, i metodi HDX-MS risolti nel tempo possono essere utilizzati per studiare proteine intrinsecamente disordinate, che sono difficili da studiare con la cristallografia a raggi X15,16,17,18. La limitazione principale di HDX-MS è che i dati sono a bassa risoluzione strutturale. I dati HDX-MS sono utili per indicare dove la dinamica conformazionale sta cambiando e per rivelare cambiamenti conformazionali accoppiati, ma spesso non forniscono molte informazioni sul preciso meccanismo molecolare che guida il cambiamento osservato. Recenti progressi nella combinazione di metodi di dissociazione da cattura elettronica con dati proteina HDX-MS hanno mostrato promesse per la mappatura dei siti di scambio a singoli residui di amminoacidi19, ma gli studi biochimici e strutturali di follow-up sono ancora spesso necessari per fornire chiarezza ai modelli strutturali inoltrato dai dati HDX-MS.
Di seguito viene presentato un protocollo dettagliato per lo sviluppo di un test HDX-MS20. I protocolli di preparazione del campione presentati di seguito dovrebbero essere generalmente applicabili a qualsiasi proteina che mostri una buona solubilità in tamponi acquosi. Metodi di preparazione dei campioni più specializzati e flussi di lavoro HDX-MS sono disponibili per le proteine di quanto sia necessario saggiare in presenza di detergente o fosfolipidi21,22,23,24. Le impostazioni strumentali per la raccolta dei dati HDX-MS sono descritte per uno spettrometro di massa quadrupolo ad alta risoluzione accoppiato al sistema di cromatografia liquida. Dati di complessità e risoluzione simili potrebbero essere raccolti su uno qualsiasi dei numerosi sistemi di cromatografia liquida-spettrometria di massa (LC-MS) disponibili in commercio. Vengono inoltre forniti aspetti chiave del trattamento dei dati utilizzando un pacchetto software disponibile in commercio. Presentiamo anche linee guida per la raccolta e l'analisi dei dati coerenti con le raccomandazioni formulate dalla più ampia comunità HDX-MS12. Il protocollo descritto viene utilizzato per studiare le proprietà strutturali dinamiche di HalM2, una sintetasi lanthipeptide che catalizza la maturazione multistep di un prodotto naturale peptide antimicrobico20. Illustriamo come HDX-MS può essere utilizzato per rivelare siti di legame del substrato e proprietà allosteriche che sono sfuggite alla caratterizzazione precedente. Diversi altri protocolli sulle proteine HDX-MS sono stati pubblicati negli ultimi anni25,26. Insieme al presente lavoro, questi contributi precedenti dovrebbero fornire al lettore una certa flessibilità nella progettazione sperimentale.
Protocollo
1. Preparazione di reagenti deuterati e soluzioni per stock enzimatici
- Preparare i reagenti necessari per le reazioni HDX (inclusi eventuali tamponi, sali, substrati, ligandi, ecc.) come soluzioni di stock concentrato 100−200x in D2O (frazione atomica 99,9% D). Preparare almeno 50 mL di soluzione di scorta stabilizzatrice.
NOTA: Per la caratterizzazione di HalM2, sono state preparate le seguenti soluzioni: 500 mM MgCl2, 100 mM tris(2-carbossietile)fosfina (TCEP), 750 mM ATP (nel buffer HEPES), 800 mM HEPES pD 7.1, 500 μM HalA2 e 500 mM AMPPNP. - Congelare e liofilizzare le soluzioni stock alla secchezza.
- Ri-dissolvenza in D2O, e ripetere il ciclo di liofilizzazione almeno un tempo in più per sostituire il maggior numero possibile di protoni scambiabili con deuteroni.
- Regolare il pD della scorta stabilizzatrice HEPES deuterata al valore desiderato con NaOD/DCl concentrato, tenendo presente la seguente relazione27:
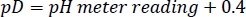
NOTA: Il tasso di ammide HDX dipende fortemente dal pL della soluzione (pL = pH o pD)5. Diversi lotti di soluzioni di scorta stabilizzatrice devono essere preparati, immagazzinati e utilizzati in modo identico per evitare una leggera deriva pL tra gli esperimenti. - Calcolare la quantità di ogni reagente necessaria per un saggio HDX da 300 μL e conservare come aliquote ad uso singolo a -80 °C.
- Preparare una soluzione concentrata di stock enzimatico (~100−200 μM) in tampone di stoccaggio enzimatico protiato utilizzando un filtro centrifugo(Tabella dei materiali)o un dispositivo equivalente.
NOTA: L'esatto tampone e il taglio del peso molecolare del filtro centrifugo dipenderanno dalla proteina /enzima di interesse. HalM2 è conservato in HEPES da 50 mM, pH 7,5, 100 mM KCl e 10% glicerolo. Per preparare l'enzima concentrato sono stati utilizzati filtri da 10 kDa. - Aliquota l'enzima in porzioni monoutilizzazioni e conservare a -80 °C.
NOTA: questo può essere un punto di arresto. Tutte le soluzioni stock descritte nella sezione 1 possono essere preparate prima delle reazioni HDX. Se conservato a -80 °C, la maggior parte degli enzimi/soluzioni di stock deuterato sarà stabile per molti mesi.
2. Calibrazione del volume di tempra HDX
- Preparare una reazione HDX da 300 μL in D2O utilizzando i reagenti deuterati e le scorte enzimatiche concentrate preparate nella sezione 1.
- Utilizzare una concentrazione enzimatica finale di 1−5 μM.
- Utilizzare una concentrazione finale di tampone HEPES deuterato di almeno 50−100 mM.
- Assicurarsi che le concentrazioni di altri componenti siano sufficienti per mantenere l'attività/funzione enzimatica desiderata.
- Preparare 1 L di soluzione di tempra HDX (fosfato da 100 mM, 0,8 M guanidina-HCl, pH 1,9). Congelare e conservare sia in porzioni da 50 mL (per stock a lungo termine) che in porzioni da 1 mL (per aliquote monoutilizzi).
NOTA: La composizione esatta del buffer di tempra dipenderà dall'enzima utilizzato nella fase di proteolisi del flusso di lavoro HDX-MS dal basso verso l'alto (passaggio 3.3.3). Il buffer di tempra qui fornito è compatibile con la pepsina, la proteasi più comunemente usata per HDX-MS. Se viene utilizzata una proteasi diversa, verificare con il fornitore di proteasi per garantire la compatibilità del buffer. - Calibrare il volume del buffer di tempra necessario per regolare il pL finale della miscela di reazione HDX spenta su un valore di lettura del misuratore di pH pari a 2,3.
NOTA: Il tasso di cambio H/D del solvente ammide N-H è un processo dipendente dal pH soggetto sia alla catalisi acida che a quella di base. Il tasso di cambio minimo si verifica ad un valore di pH 2,5 (lettura pH metro = 2,3 per una miscela 50:50 H2O:D2O). Pertanto, un valore finale di pL vicino a 2,5 ridurrà al minimo lo scambio di ritorno dell'idrogeno che si verifica durante l'analisi LC-MS dal basso verso l'alto, preservando così l'etichetta del deuterio nei peptidi.- Mescolare 50 μL della miscela di reazione HDX dal passo 2.1 con 50 μL di tampone di tempra e misurare il pL della miscela temprato con un elettrodo microtip.
- Aumentare il volume della soluzione di tempra in base alle esigenze per regolare la lettura finale del misuratore di pH su un valore di 2,3.
- Una volta determinato il volume di tempra appropriato, ripetere più volte il processo di tempra utilizzando aliquote fresche da 50 μL dalla reazione HDX (fase 2.1) per assicurarsi che un pL finale coerente sia raggiunto dopo l'aggiunta di una quantità fissa di tampone di tempra.
3. Preparazione di campioni di riferimento e ottimizzazione del flusso di lavoro LC-MS dal basso verso l'alto
- Preparare campioni di riferimento non deuterati per la proteina di interesse per il triplicato in tubi da 0,5 ml. Assicurarsi che le condizioni della miscela di reazione finale siano identiche a quelle utilizzate nelle reazioni HDX autentiche (fase 2.1), tranne per il fatto che le reazioni sono preparate in H2O utilizzando soluzioni di materiale reagente preparate anche in H2O.
- Spegnere i campioni come nel passaggio 2.3 aggiungendo il volume appropriato di tampone di tempra per regolare il pH finale a 2,5. Flash congelare i campioni in azoto liquido e conservare a -80 °C fino a quando non sono pronti per l'analisi.
- Analizzare i campioni di riferimento enzimatici protiati utilizzando un flusso di lavoro LC-MS dal basso verso l'alto.
NOTA: Prima di eseguire questi passaggi, il sistema LC-MS da utilizzare per l'acquisizione dei dati deve essere calibrato correttamente e pronto per l'uso. La tempistica e la temperatura di tutti i passaggi del flusso di lavoro LC-MS dal basso verso l'alto devono essere rigorosamente controllate al fine di ridurre al minimo le differenze nello scambio posteriore tra campioni. Con la strumentazione MS utilizzata in questo protocollo (Tavola dei materiali e Informazioni di supporto), la maggior parte dei passaggi può essere controllata attraverso il software dello strumento. Per garantire la raccolta di repliche precise, si consiglia di automatizzare il maggior numero possibile di passaggi nel flusso di lavoro.- Rimuovere un singolo campione di riferimento enzimatico (preparato come al passaggio 3.2) dal congelatore e scongelare a 37 °C per 1 minuto in un bagno d'acqua.
- Esattamente 2 minuti dopo aver rimosso il campione dal congelatore e scongelato, iniettare una porzione di 40 μL del campione di riferimento temprato in una colonna di cromatografia liquida ad alte prestazioni (UPLC) (2,1 x 30 mm, 300 Å, 5 μM) contenente una fase stazionaria funzionalizzata con pepsina (una proteasi acido-stabile).
- Digerire il campione ad una portata di 100 μL/min per 3 min a 15 °C utilizzando lo 0,1% di acido formico in H2O (pH = 2,5) come solvente.
- Raccogliere i peptidi peptici mentre eludono dalla colonna di pepsina su una colonna trappola C18 tenuta a 0,4 °C per ridurre al minimo lo scambio posteriore.
- Passare i peptidi peptici dissalati dalla colonna trappola a una colonna analitica C18 (1 mm x 100 mm, 1,7 μM, 130 Å) tenuta e operata a 0,4 °C per la separazione dei peptidi peptici.
NOTA: I passaggi 3.3.3−3.3.5 possono essere automatizzati da alcuni sistemi LC-MS utilizzati per l'acquisizione di dati HDX-MS. In alternativa, questi passaggi possono essere eseguiti in modo indipendente, tenendo presente che la tempistica e la temperatura di ogni passaggio devono essere attentamente controllate per ottenere uno scambio di schiena costantemente basso. - Elute la colonna C18 con un sistema di solvente acido formico acetonitrile/acqua/0,1%. Ottimizzare il gradiente LC per la proteina di interesse al fine di massimizzare la separazione e preservare l'etichetta del deuterio nei peptidi peptici.
NOTA: i dettagli sull'eluizione del gradiente sono disponibili nelle informazioni di supporto. - Sottoseminare il digest peptico alla spettrometria di massa di ionizzazione elettrospray (ESI).
NOTA: Le condizioni di origine fornite nelle informazioni di supporto forniranno una ionizzazione sufficiente per la maggior parte dei peptidi peptici.- Una volta ionizzato nello strumento MS, eseguire una separazione della mobilità ionica in fase gassosa utilizzando l'azoto come gas tampone per migliorare la capacità di picco del metodo.
- Dopo la separazione della mobilità ionica, sottosostire gli ioni precursori pepticipeptidici ad un flusso di lavoro MS E che comporta cicli alternati di bassa energia di collisione (4 V) e alta energia di collisione (21−40 V).
NOTA: I regimi alternati di energia a bassa e alta collisione consentono la raccolta di dati MS (bassa energia di collisione) contemporaneamente ai dati MSMS (alta energia di collisione). Questo, a sua volta, consente la correlazione del tempo degli ioni precursori con i rispettivi ioni frammentare. Questa correlazione è essenziale per un'identificazione peptidica sicura descritta nella sezione 4. - Rilevare il precursore peptidico e gli ioni di frammento utilizzando un analizzatore di massa con un potere di risoluzione di almeno 20.000.
- In contemporanea con l'acquisizione dei dati, acquisire i dati MS per uno standard esterno [Glu-1]-fibrinopeptide B (GluFib).
NOTA: il flusso di lavoro MS descritto nel passaggio 3.3.7 viene definito protocollo MSE. Le impostazioni strumentali complete per un protocollo MSE adatto per HDX-MS dal basso verso l'alto sono fornite nelle informazioni di supporto.
- Valutare la qualità dei dati LC-MS.
NOTA: Utilizzando il protocollo sopra descritto e le impostazioni strumentali fornite nelle informazioni di supporto, i campioni di riferimento devono produrre un cromatogramma ionici totale con un'intensità massima del segnale di circa 1 x 108. Dovrebbero esserci molti peptidi peptici che eluicolano tra 3−9 min(Figura 3A−C). - Iniettare 40 μL di campioni vuoti (0,1% di acido formico in acqua) per pulire la pepsina e le colonne analitiche C18.
NOTA: In generale, 2−3 spazi vuoti dovrebbero essere sufficienti. - Ripetere i passaggi 3.3.1−3.3.9 per ciascuno dei campioni di proteine di riferimento triplicati.
4. Elaborazione dei dati di riferimento e definizione di un elenco peptidico
- Analizzare i dati MSE grezzi (passaggio 3.3.7) utilizzando il software di proteomica (Table of Materials). Utilizzando il software di proteomica, passare a Librerie | Protein Sequence Databanks per definire il database proteico importando la sequenza di amminoacidi della proteina di interesse.
NOTA: L'obiettivo di questo passaggio è quello di cercare i dati MS di riferimento per i peptidi peptici derivati dalla proteina di interesse e di utilizzare i dati MSMS (acquisiti contemporaneamente ai dati MS) per convalidare eventuali identificazioni peptidiche putative. - Dare un nome alla sequenza proteica di interesse. Importare la sequenza proteica (in formato FASTA). Il software eseguirà una digestione in silico della proteina del database per generare un elenco di peptidi che verranno utilizzati per cercare i dati LC-MS.
- Definite i parametri di elaborazione (trovati nel menu Libreria). Selezionare Electrospray MSE come tipo di acquisizione dati. Nel campo Massa di blocco per carica 2 immettere 785.8426 per m/z per lo ione 2+ di [Glu-1]-fibrinopeptide B (GluFib) e fare clic su fine.
- Definire i parametri del flusso di lavoro (che si trovano nel menu Libreria).
- Selezionare Electrospray MSE per il tipo di ricerca. In Workflow | Intestazione Query di ricerca database, selezionare la proteina del database creata nel passaggio 4.2 nel campo Banca dati.
- Impostare Reagente digest primario su non specifico e deselezionare il campo Reagente modificatore fisso tenendo premuto ctrl mentre si fa clic su Carbamidomethyl C.
- Specificare la directory di output passando alle opzioni | configurazione dell'automazione | Identità E. Selezionare le caselle relative all'output 3D 3D e peptidico e all'output contabile ionio Apex e specificare la directory desiderata.
- Elaborare i dati di esempio di riferimento.
- Sulla barra degli strumenti sinistra dello spazio di lavoro della piattaforma proteomica, creare una nuova piastra facendo clic con il pulsante destro del mouse su Microtiter Plate. Evidenziare tre pozzi nella piastra del microtitoro (uno per ogni campione di riferimento raccolto nella sezione 3). Fare clic a sinistra in un pozzo, tenere premuto e trascinare su tre pozzi.
- Fare clic con il pulsante destro del mouse e scegliere Aggiungi dati non elaborati. Nella finestra visualizzata passare alla directory contenente i tre file di riferimento della sezione 3 e selezionarli contemporaneamente.
- Fare clic su avanti e scegliere i parametri di elaborazione definiti nel passaggio 4.3. Fare clic su Avanti e selezionare i parametri del flusso di lavoro definiti nel passaggio 4.4. Quindi clicca su fine.
- Una volta che i dati grezzi, i parametri di elaborazione e i parametri del flusso di lavoro sono stati assegnati a ciascun pozzo sulla piastra, i pozzi appariranno blu. Selezionare i pozzi, fare clic con il pulsante destro del mouse e selezionare i dati grezzi più recenti del processo. Fare clic nell'angolo inferiore destro della finestra per tenere traccia dell'elaborazione dei dati. Una volta visualizzato il messaggio Nessun processo da eseguire, l'elaborazione viene eseguita completamente.
- Al termine dell'elaborazione dei dati, i pozzi nella piastra diverranno verdi. Fare clic con il pulsante destro del mouse sui pozzi e scegliere Visualizza risultati flusso di lavoro. Si aprirà una finestra separata per ogni file di dati di riferimento.
- Ispezionare i dati per assicurarsi che la maggior parte dei segnali MS nei dati del campione di riferimento siano stati mappati con successo ai peptidi previsti dalla digestione in silico della proteina di interesse. I peptidi abbinati saranno colorati di blu nello spettro di uscita (Figura 4). Fare doppio clic sul filtro OK e verificare che la copertura percentuale sia maggiore del 99%.
NOTA: al momento dell'elaborazione, l'output dei dati verrà salvato automaticamentecon l'estensione delfile (raw_data_file_name _IA_final_peptide) nella directory specificata nel passaggio 4.5. - Importare l'uscita software proteomica nel software di elaborazione HDX (Table of Materials) per una maggiore soglia.
- Fare clic su Dati nell'angolo sinistro della finestra del software di elaborazione HDX. Fare clic su importa risultati PLGS e fare clic sull'icona aggiungi. Scegliere i file di dati elaborati dal passaggio 4.9 passando alla directory appropriata.
- Fare clic su Avanti e specificare i seguenti parametri: ioni consecutivi minimi ≥ 2, errore di massa = 5 ppm e soglia file = 3. Clicca al termine.
- Una volta soddisfatti i parametri di soglia, salvare il progetto HDX. Tutti i dati HDX verranno importati in questo progetto per l'analisi e la visualizzazione.
NOTA: il deuterio scambiato campioni descritti nella sezione successiva dovrà essere elaborato con un flusso di lavoro LC-MS identico. Pertanto, prima di procedere con i test HDX (sezione 5), assicurarsi che la preparazione del campione (sezione 2), il flusso di lavoro LC-MS dal basso verso l'alto (sezione 3) e i flussi di lavoro di elaborazione dei dati (sezione 4) forniscano la riproducibilità e la copertura sequenziale desiderate della proteina target. Se uno di questi processi deve essere modificato per migliorare la copertura, si consiglia di tornare al passaggio 2.1, preparare nuovi campioni di riferimento in triplice copia e ripetere le sezioni 2−4 (mentre si apporta le modifiche necessarie al protocollo) per garantire che ogni peptide possa essere generato e rilevato in modo riproducibile.
5. Conduzione di reazioni HDX
- Preparare lo spazio di lavoro per le reazioni HDX.
- Tampone di tempra pre-aliquota in tubi da 0,5 ml correttamente etichettati. Preparare un tubo diverso per ogni punto di tempo, ogni replica e ogni stato biochimico da analizzare. Utilizzare il volume appropriato di tampone di tempra del passaggio 2.2 necessario per regolare la lettura finale del misuratore di pH di una porzione di 50 μL della reazione HDX a un valore di 2,3.
- Centrifugare brevemente le vasche da 0,5 ml per trasferire tutto il tampone di tempra sul fondo del tubo. Metti i tubi sul ghiaccio.
- Riempire un piccolo Dewar con azoto liquido e tenerlo adiacente allo spazio di lavoro.
- Preparare le reazioni HDX. Assicurarsi che vi sia un volume di reazione sufficiente per raccogliere il numero desiderato di punti di tempo di scambio (un'aliquota di 50 μL per ogni punto di tempo desiderato). Raccogliere almeno 4−5 punti di tempo su 3−4 ordini di grandezza in scala di tempo (ad esempio, tempi di tempra di 15 s, 60 s, 300 s [5 min], 1.800 s [30 min] e 14.400 s [4 h] forniscono un'adeguata copertura delle dinamiche di scambio per la maggior parte degli enzimi).
- Pre-mescolare tutti i componenti deuterati (meno enzima) dal passo 1.1 in D2O.
- Per ogni stato biochimico da esaminare (enzima libero, enzima + ligando, enzima + inibitore, ecc.), preparare le reazioni HDX in almeno triplicato.
- Incubare le miscele di reazione in un bagno d'acqua a temperatura controllata a 25 °C per 10 minuti prima dell'aggiunta dell'enzima.
NOTA: L'enzima deve essere preparato come soluzione stock concentrata (~100−200 μM, passo 1.6) in modo da ridurre al minimo l'aggiunta di prozio nel saggio HDX. - Dopo aver aggiunto l'enzima ad una concentrazione finale di 1−5 μM, avviare il timer. Mescolare con cura e rapidità la soluzione utilizzando una pipetta da 200 μL per garantire che l'enzima sia distribuito uniformemente nel campione.
- Nei punti di tempo di scambio desiderati, rimuovere le aliquote di 50 μL dalla reazione HDX e mescolare rapidamente e uniformemente con il tampone di tempra ghiacciato pre-aliquotato in un tubo da 0,5 ml.
NOTA: I volumi di miscelazione e la procedura di miscelazione devono essere il più precisi e riproducibili possibile per garantire che il pL finale di tempra desiderato di 2,3 sia raggiunto rapidamente in tutti i campioni. Mantenere freddo il ghiaccio tampone di tempra aiuterà a ridurre al minimo lo scambio posteriore dopo la denaturazione dell'enzima. - Immediatamente dopo aver spento il campione HDX, limitare il tubo e congelare il flash nell'azoto liquido.
- Continuare a raccogliere i punti di tempo fino al completamento di tutti i test, quindi trasferire i campioni nel congelatore -80 °C per la conservazione.
NOTA: questo può essere un punto di arresto. Dopo aver raccolto tutti i punti di tempo HDX, i campioni possono essere conservati a -80 °C fino a quando non sono pronti per l'analisi LC-MS. Idealmente, le reazioni HDX triplicate devono essere eseguite per tutti gli stati biochimici di interesse lo stesso giorno. Come minimo, tutte le reazioni HDX replicate per un dato stato biochimico dovrebbero essere eseguite in parallelo lo stesso giorno.
- Dopo aver raccolto tutti i punti di tempo HDX spenti, sottosostire i campioni al flusso di lavoro LC-MS ottimizzato dal basso verso l'alto sviluppato come descritto nel passaggio 3.3. Iniettare campioni HDX in ordine casuale con un numero appropriato di spazi vuoti tra i campioni per garantire che qualsiasi riporto peptidico sia minimo.
NOTA: i dati HDX non devono essere raccolti in modalità MSE. Pertanto, il segmento dell'energia ad alta collisione (fase 3.3.7.2) dovrebbe essere rimosso dal ciclo di servizio ms. Questa dovrebbe essere l'unica modifica apportate al flusso di lavoro descritto nel passaggio 3.3. - Valutare la qualità dei dati HDX durante la raccolta.
- Assicurarsi che i picchi cromatografici presenti nel cromatogramma ionico totale dei campioni di riferimento non deuterati appaiano contemporaneamente nel tempo di ritenzione nei campioni deuterati (come nella figura 3D−F).
- Assicurarsi che gli spettri di massa sommati su intervalli di tempo specifici da campioni di riferimento e deuterati mostrino prove di deuterazione (cioè uno spostamento dell'involucro isotopico dei singoli peptidi a valori m/z più elevati nei campioni deuterati [Figura 6]).
6. Elaborazione dei dati HDX
- Importare i dati HDX nel progetto HDX creato nel passaggio 4.11 facendo clic su Data | FILE MS nella barra degli strumenti superiore.
- Fare clic su Nuovo Stato e Nuova Esposizione in base alle esigenze per definire gli stati biochimici (ad esempio, enzima libero, enzima + ligando, ecc.) e i tempi di esposizione al deuterio, rispettivamente, pertinenti all'analisi.
- Fare clic su Nuovo raw per selezionare i file di dati HDX da analizzare. Assegnare i tempi di scambio e lo stato biochimico appropriati a ogni file di dati non elaborati importato.
NOTA: I dati possono essere importati ed elaborati in batch o tutti in una volta. L'aggiunta di dati al progetto non annulla alcuna analisi eseguita in precedenza all'interno di tale progetto.
- Una volta aggiunti i file di dati, fare clic su Fine per iniziare l'elaborazione dei dati. Dopo un breve ritardo, il software chiederà se l'utente desidera salvare i dati prima di continuare. Fare clic su sì.
NOTA: L'elaborazione iniziale può richiedere fino a diverse ore a seconda del numero di campioni analizzati, del numero di peptidi nell'elenco peptidico finale (passaggio 4.10), delle dimensioni della finestra cromatografica e della frequenza di acquisizione spettrale. - Se lo si desidera, modificare i parametri di elaborazione nel menu Configurazione per modificare i parametri di ricerca degli ioni. Assicurarsi di utilizzare gli stessi parametri di ricerca ioni per tutti i dati in un determinato progetto.
7. Analisi e visualizzazione dei dati HDX
NOTA: Una volta completata l'elaborazione iniziale dei dati grezzi (fase 6.2), il software di elaborazione HDX avrà individuato peptidi dall'elenco peptidico (generato nel passaggio 4.10) in ciascuno dei file di dati grezzi analizzati. Una volta che la distribuzione isotopica per un peptide nell'elenco si trova in un file di dati grezzo, il software di elaborazione HDX rappresenta ogni isotopo con un "bastone" (come nella figura 6C−E). Le intensità relative dei bastoncini per un dato peptide vengono quindi utilizzate per calcolare l'assorbimento del deuterio rispetto agli spettri di riferimento. Mentre il software di elaborazione HDX fa un lavoro ammirevole nell'assegnare correttamente i "bastoncini" alla maggior parte dei peptidi, sarà comunque necessaria una significativa cura manuale dei valori di assorbimento del deuterio.
- Analisi dei valori di assorbimento del deuterio peptidico
- Selezionate il primo peptide nell'elenco peptidico e aprite il plottaggio spettrale impilato dal menu Viste (Views). Scorrere verso l'alto e verso il basso nella finestra del plottaggio degli spettri impilati per vedere gli spettri di massa per il peptide selezionato in funzione del tempo di scambio del deuterio (Figura 7D,E).
- Assegnare e annullare l'assegnazione dei bastoncini in base alle esigenze utilizzando i clic del mouse per assicurarsi che la corretta distribuzione isotopica sia stata localizzata nei dati e che ogni picco isotopico sia stato assegnato (i bastoncini assegnati appariranno blu). Facendo clic su uno qualsiasi degli spettri nel tracciato spettrale in pila (Figura 7D,E) sarà possibile assegnare/annullare l'assegnazione di bastoncini nella finestra del visualizzatore dati attivo (Figura 7C).
- Controllare le assegnazioni del bastone per ogni stato di carica attivando lo stato di carica nella parte superiore della finestra del tracciato spettrale impilato.
- Ripetere i passaggi 7.1.1−7.1.3 per ogni stato biochimico di interesse. Lo stato biochimico può anche essere disattivato nella parte superiore della finestra del tracciato spettrale impilato. Per le misurazioni più accurate della differenza di assorbimento del deuterio, assicurarsi che i bastoncini siano assegnati per lo stesso insieme di stati di carica per ogni stato biochimico.
- Ripetere i passaggi 7.1.1−7.1.4 per ogni peptide nella lista dei peptidi.
- Controllare la deviazione standard dei valori di assorbimento del deuterio peptidico utilizzando la mappa di copertura.
- Accedere alla mappa di copertura dal menu Viste, che visualizza ogni peptide nell'elenco peptidico mappato lungo la sequenza di amminoacidi della proteina di interesse (Figura 8C). Colorare i peptidi in base alla deviazione standard relativa (unità di Da).
- Cerca visivamente nella mappa peptidi anomali con deviazione standard relativa elevata. Fare clic sui peptidi anomali nella mappa di copertura per popolare i grafici spettrali impilati (Figura 8B) e la finestra del visualizzatore di dati (Figura 8A) con il peptide di destinazione.
- Utilizzando il grafico spettrale impilato, controllare attentamente che tutti gli stati di carica e tutti i punti di tempo del peptide outlier abbiano assegnato in modo appropriato bastoncini.
NOTA: Molto spesso, i peptidi con grandi deviazioni standard (>0.3 Da) hanno picchi isotopici che non sono stati assegnati in modo appropriato dai bastoncini dal software (come indicato nella figura 8B). L'assegnazione di eventuali bastoncini mancanti consentirà generalmente di ridurre la deviazione standard relativa di un peptide a <0,3 Da. - Nascondere il peptide dall'elenco se la deviazione standard relativa non può essere ridotta a meno di 0,3 Da.
- Esportare i dati sulla differenza HDX tra due stati biochimici per la mappatura su un modello strutturale della proteina di interesse.
- Visualizzare la differenza di interesse nella mappa di copertura. Fare clic con il pulsante destro del mouse sulla mappa di copertura per esportare i dati delle differenze in .csv file. Esportare i dati sullo stato (.csv formato) passando a Dati | Esportare i dati sullo stato nella barra degli strumenti principale.
NOTA: la formattazione appropriata dei dati delle differenze e dei file di dati sullo stato viene fornita in Informazioni di supporto. - Importare i dati di differenza, i dati sullo stato e il file pdb della proteina di interesse in Deuteros28. Scegliere l'intervallo di confidenza del 99%, selezionare Abilita sommaed elaborare i dati.
NOTA: MATLAB deve essere installato sul PC per eseguire Deuteros. Deuteros utilizzerà le misurazioni replicate nel set di dati per calcolare la deviazione standard dei dati di assorbimento per ogni peptide. Questa deviazione standard verrà utilizzata per definire l'intervallo di confidenza per uno scambio significativo, che verrà visualizzato sui grafici. - In Opzioni PyMOL selezionare Esporta adozione | esportare per generare uno script Pymol per mappare regioni di significativa differenza di scambio sulla struttura pdb della proteina di interesse utilizzando il software PyMOL.
NOTA: Utilizzando il flusso di lavoro descritto in questo protocollo, l'intervallo di confidenza del 99% per una differenza significativa di assorbimento del deuterio per un dato peptide in un singolo punto di tempo è in genere 0,3−0,5 Da. L'intervallo di confidenza del 99% per la differenza sommata su tutti i punti di tempo di scambio è in genere 0,7−1,0 Da.
- Visualizzare la differenza di interesse nella mappa di copertura. Fare clic con il pulsante destro del mouse sulla mappa di copertura per esportare i dati delle differenze in .csv file. Esportare i dati sullo stato (.csv formato) passando a Dati | Esportare i dati sullo stato nella barra degli strumenti principale.
Risultati
È necessario valutare la qualità della digestione proteolitica e la riproducibilità del flusso di lavoro per ogni serie di iniezioni di campioni. Pertanto, prima di eseguire test HDX-MS, è essenziale stabilire condizioni efficaci per la proteolisi della proteina di interesse, per la separazione dei peptidi utilizzando la cromatografia liquida in fase inversa e la mobilità ionica in fase gassosa e per il rilevamento di peptidi che utilizzano la SM. A tal fine, i campioni di riferimento per la proteina di interesse (raccolti in assenza di deuterio) devono essere studiati per primi (sezione 3). I dati cromatografici della figura 3A−C mostrano i cromatogrammi ionici totali (BIC) per tre campioni di riferimento della lanthipeptide synthetasi HalM2. Il TIC è la variazione dipendente dal tempo nella somma di tutti i conteggi degli ioni a tutti i valori m/z inclusi nella scansione spettrale di massa. Viste più ravvicinate dei TEC tra 3 e 8 minuti sono mostrate nella figura 3D−F. Gli spettri di massa mostrati nella Figura 3G−I rappresentano una sommatoria di tutti gli spettri di massa in un piccolo intervallo di tempo (da 5,0 a 5,1 min) di ogni TIC. Particolare attenzione dovrebbe essere prestata alle seguenti caratteristiche nella figura 3.
In primo luogo, il grande picco vicino a 9,3 minuti alla fine del gradiente rappresenta frammenti incompletamente digeriti (e quindi grandi e più idrofobi) di HalM2(Figura 3A−C). La digestione potrebbe essere resa più efficiente riducendo la concentrazione di HalM2, ma questo ridurrà l'intensità del segnale peptidico e il rapporto segnale/rumore. La digestione potrebbe anche essere resa più efficiente aumentando il tempo di contatto (da 3 minuti, passo del protocollo 3.3.3) con la colonna di pepsina. Tuttavia, l'aumento del tempo di contatto comporterà un maggiore scambio di ritorno. In definitiva, questi parametri devono essere bilanciati per la proteina di interesse al fine di fornire la copertura della sequenza desiderata, l'intensità del segnale e la ritenzione di deuterio. In secondo luogo, la forma e l'intensità dei profili TIC dovrebbero essere simili (come nella figura 3D−F). Ciò suggerisce che la digestione proteolitica di HalM2 è riproducibile ed è di efficienza simile in tutti e tre i campioni di riferimento. L'aspettativa è che una digestione simile di un campione scambiato con deuterio produca lo stesso set di peptidi con tempi di ritenzione simili. In terzo luogo, anche gli spettri di massa in un dato intervallo di tempo dovrebbero essere simili (Figura 3G−I). Un rapido confronto visivo degli spettri di massa sommati nell'intervallo di tempo di 5,0−5,1 minuti della separazione cromatografica mostra che i segnali spettrali di massa in ogni campione sono effettivamente molto simili, fornendo la certezza che peptidi simili siano presenti in ogni campione e si eluiranno in momenti simili dalla colonna C18. Un'ispezione visiva rapida simile deve essere eseguita su altri intervalli di tempo attraverso il cromatogramma.
Dopo aver verificato visivamente la somiglianza nei dati LC-MS dei campioni di riferimento, il software di proteomica viene utilizzato per cercare nei dati MS peptidi derivati dalla sequenza amminoacidica della proteina di interesse. Dopo aver definito la banca dati della sequenza proteica (la sequenza amminoacidica della proteina di interesse), l'elaborazione e i parametri del flusso di lavoro descritti nei passaggi del protocollo 4.2−4.4, ogni singolo campione di riferimento viene elaborato per rilevare peptidi peptici che corrispondono ai peptidi previsti derivati dalla proteina di interesse. Un esempio dell'output software proteomica per un esempio di riferimento HalM2 non castrato è illustrato nella figura 4. Particolare attenzione dovrebbe essere prestata alle seguenti caratteristiche. In primo luogo, qualsiasi segnale MS che viene abbinato a un peptide specifico all'interno della proteina di interesse in base ai valori definiti nei parametri di elaborazione e flusso di lavoro sarà colorato di blu nello spettro inferiore. Se un campione di riferimento viene elaborato "correttamente", la maggior parte dei segnali apparirà blu (come nel caso dei dati nella figura 4). Inoltre, nel pannello in alto a sinistra, assicurarsi che il "filtro OK" sia disattivato sul segno di spunta verde. Al termine, le statistiche nella barra superiore del pannello in alto a destra (evidenziate in blu nella figura 4) rifletteranno solo quei peptidi che danno punteggi di confidenza elevati. Questi peptidi mostrano una bassa precisione di massa ppm, ioni di frammenti multipli e una buona correlazione tra i tempi di ritenzione di frammenti e ioni genitori, e sono considerati identificazioni sicure. Per il campione di riferimento HalM2 mostrato, sono stati rilevati 1.421 peptidi con punteggi elevati, che coprono il 99,6% della sequenza HalM2. Quasi il 100% di copertura della sequenza dovrebbe essere raggiungibile per la maggior parte delle proteine utilizzando il flusso di lavoro LC-MS dal basso verso l'alto descritto nella sezione 3 del protocollo. Inoltre, ulteriori statistiche utili per ogni peptide sono tabulate nel pannello in alto a destra, tra cui l'errore di massa, il tempo di ritenzione precursore, il numero di frammenti (ioni prodotto), l'elenco completo degli ioni di frammento per nome e il tempo di deriva della mobilità ionico. Queste informazioni sono utili per l'interpretazione dei risultati, che dovrebbero sempre essere focalizzati sui peptidi identificati con maggiore sicurezza.
L'elenco finale dei peptidi dovrebbe essere determinato da una soglia aggiuntiva nel software di elaborazione HDX. Dopo aver analizzato i dati di riferimento per generare l'elenco peptidico (sezione 4 del protocollo), l'output deve essere importato nel software di elaborazione HDX per una soglia aggiuntiva. I file di output verranno memorizzati in una directory come definito nel passaggio 4.5 del protocollo con l'estensione di file "..._IA_final_peptide.csv". Dopo aver caricato l'output nel software di elaborazione HDX , l'elenco completo dei peptidi verrà visualizzato nel pannello "anteprima peptidica" (Figura 5) e il numero di peptidi, copertura della sequenza e ridondanza verrà visualizzato nell'angolo in basso a destra della finestra. Questi valori cambieranno in tempo reale con l'applicazione di soglie aggiuntive. Dopo aver fatto clicsu avanti , è possibile impostare valori soglia nei campi indicati. I filtri più critici sono la "soglia del file" che richiede che tutti i peptidi si trovino in ciascuno dei tre campioni di riferimento, l'"errore MH+ massimo (ppm)" che deve essere impostato su un valore <10 ppm e "prodotti consecutivi minimi", che richiede al peptide di generare almeno due ioni di frammento consecutivi durante la fase MSMS (cioè l'alta energia di collisione) del flusso di lavoro MSE (fase del protocollo 3.3.7.2).
La limitazione tecnica più significativa del saggio HDX-MS è lo scambio posteriore di deuterio con prozio che si verifica non appena i campioni scambiati con deuterio vengono spenti (con buffer protiato). Lo scambio indietro continua durante la digestione della proteasi e le parti LC-MS del flusso di lavoro. Lo scambio posteriore è inevitabile, ma se il pH, la temperatura e la tempistica di tutti i passaggi post-tempra sono attentamente controllati come descritto nel protocollo, il 60%−70% dell'etichetta del deuterio può essere mantenuto. Per questo motivo, è essenziale verificare durante le prime fasi dello sviluppo del saggio che la maggior parte dei peptidi mantenga il deuterio. Ciò può essere ottenuto rapidamente confrontando i dati grezzi di un campione deuterato con quello di un campione di riferimento. Come è stato fatto per garantire la riproducibilità dei campioni di riferimento (figura 3), confrontare i TC dei campioni di riferimento scambiati con deuterio e non deuterio, assicurando che le forme dei profili si assomiglino l'una all'altra. Inoltre, sommare gli spettri di massa sullo stesso intervallo di tempo cromatografico in entrambi i campioni. La maggior parte dei peptidi nel campione di deuterio scambiato dovrebbe presentare evidenti spostamenti nelle loro distribuzioni isotopiche verso valori m/z più elevati (come nella figura 6). Questi dati indicano che una frazione sostanziale dell'etichetta del deuterio viene mantenuta nel corso della tempra acida, della digestione della pepsina e della raccolta dei dati LC-MS.
Dopo aver verificato che il flusso di lavoro fornisca una sufficiente ritenzione di deuterio, è necessario quantificare l'assorbimento del deuterio. Pertanto, i dati grezzi per campioni scambiati con deuterio vengono importati nel software di elaborazione HDX. Utilizzando i campioni di riferimento e l'elenco dei peptidi finalizzati, il software di elaborazione HDX localizzerà i peptidi dall'elenco peptidico in ciascuno dei file di dati grezzi e assegnerà "bastoncini" a ciascuno dei picchi isotopici. Nei dati rappresentativi per HalM2 mostrati nella figura 7, i bastoncini assegnati correttamente sono colorati di blu in tutti gli spettri. Dopo aver assegnato le bastoni, il valore centroide m/z per la distribuzione isotopica sarà determinato dal software e utilizzato per calcolare l'assorbimento del deuterio rispetto al campione di riferimento non deuterato. Il valore di scambio del deuterio per ogni peptide deve essere controllato manualmente. Nella figura 7, il peptide attualmente selezionato (HIDKLTVGL, che copre i residui di HalM2 110−118) è mostrato nel pannello sinistro del visualizzatore dati principale (Figura 7A). Gli altri pannelli mostrano i dati HDX associati a questo peptide. Facendo clic su qualsiasi peptide nell'elenco peptidico si popolano gli altri pannelli con i dati HDX di quel peptide. La figura 7B mostra le particelle di assorbimento del deuterio per il peptide 110−118. Questo set di dati contiene quattro punti di tempo di scambio: 0,5, 5, 30 e 240 minuti (raccolti in triplice copia). Sono stati raccolti dati di scambio per due stati biochimici: l'enzima HalM2 libero (rosso) e l'enzima HalM2 complesso ad AMPPNP e il suo substrato peptide HalA2 (blu). Si noti la significativa differenza di assorbimento del deuterio nel peptide 110−118 durante l'intero corso del tempo e l'alta precisione delle misurazioni di replicazione (le barre di errore sono mostrate sulla trama nella figura 7B). In generale, una precisione simile nella misurazione dell'assorbimento sarà ottenuta per la maggior parte dei peptidi, sottoscindo la riproducibilità del flusso di lavoro presentato in questo protocollo. Sul legame del ligando (curva blu nella Figura 7B), le ammidi del legame peptidico nella regione 110−118 di HalM2 apparentemente subiscono una protezione significativa dallo scambio di deuterio, suggerendo che gli amminoacidi nella regione 110−118 stanno diventando più strutturati in modo più stabile sul legame del ligando. La successiva mutagenesi di questa regione ha indicato un ruolo nel legame con il peptide precursore, HalA220. Nella figura 7 sono riportati anche i grafici spettrali impilati per lo stato HalM2 ( Figura7D) e lo stato HalM2:AMPPNP:HalA2 (Figura 7E). In questi grafici, il tempo di scambio aumenta dal basso verso l'alto. L'aumento di massa del peptide 110−118 allo scambio di deuterio in punti di tempo più lunghi è evidente dall'ispezione visiva. È anche evidente che il peptide 110−118 riprende più deuterio nello stato di HalM2 (Figura 7D) che nello stato completamente ligando (Figura 7E). Se necessario, facendo clic su una delle sottotramazioni della figura 7D o della figura 7E, l'utente può modificare manualmente l'assegnazione dei bastoncini nel visualizzatore dati principale (Figura 7C). Al momento dell'assegnazione/annullamento dell'assegnazione del bastone, il software di elaborazione HDX ricalcola i valori di assorbimento del deuterio e tutti i grafici verranno aggiornati in tempo reale. Allo stesso modo, facendo clic sui singoli punti dati nel pannello B si popolare il visualizzatore di dati nel pannello C per l'assegnazione manuale della lecca.
Dopo che i bastoncini sono stati assegnati per ogni peptide e il punto di tempo di scambio per tutti gli stati biochimici, la deviazione standard dei valori di assorbimento misurati deve essere controllata. Questo è più facile da eseguire con la mappa di copertura e il grafico spettrale impilato (Figura 8). Nella mappa di copertura (Figura 8C), selezionare lo stato e il tempo di scambio degli interessi, quindi selezionare la deviazione standard relativa di assorbimento. I peptidi nella mappa di copertura saranno colorati in base alla deviazione standard nel valore di assorbimento del deuterio misurato. In questo modo, sarà molto facile identificare visivamente i peptidi che hanno incarichi sbagliati del bastone isotopico. Facendo clic sul peptide outlier (con deviazione standard elevata) nella mappa di copertura si popolare il visualizzatore di dati principale e il grafico degli spettri impilati con i dati HDX del peptide outlier. Le assegnazioni del bastone per ogni punto di tempo e stato di carica possono quindi essere modificate in base alle esigenze per correggere il valore di assorbimento misurato. Ancora una volta, il software di elaborazione HDX aggiornerà tutti i display dei dati in tempo reale man mano che le assegnazioni della levetta vengono modificate.
Dopo aver curato completamente il set di dati HDX, il significato della misurazione della differenza di assorbimento del deuterio per ogni peptide deve essere considerato prima dell'interpretazione dei dati. Utilizzando un approccio descritto da Engen e colleghi29, abbiamo stimato un valore medio di assorbimento di 0,1 ± 0,1 Da per la proteina HalM2 utilizzando il flusso di lavoro descritto nel protocollo20 precedente. Questo valore è coerente con gli errori segnalati da altri per flussi di lavoro HDX a scambio continuo e dal basso versol'alto simili 29,30. Recentemente, Politis e colleghi hanno sviluppato Deuteros, un utile strumento open source (implementato in MATLAB) per determinare rapidamente significative differenze di assorbimento nei set di dati HDX28. I file di input rappresentativi per Deuteros ("State_Data_for_Deuteros" e "Difference_Data_for_Deuteros") sono inclusi nelle informazioni di supporto. Se esportati direttamente dal software di elaborazione HDX descritto in questo protocollo (Table of Materials), i file di dati di differenza e stato avranno il formato appropriato per la lettura dei file da parte di Deuteros. Se i dati HDX vengono generati su un sistema LC-MS diverso, i file di dati simili a quelli forniti nelle informazioni di supporto dovranno essere costruiti manualmente.
L'area di lavoro Dueteros è illustrata nella figura 9. Una volta importati i dati in Deuteros, l'utente seleziona il limite di confidenza desiderato (>98% consigliato) e fa clic su Importa e calcola. Per il mapping dei dati appiattito, selezionare la copertura per il tipo di dati e l'assoluto per la scala dei colori. Fare clic su plottaggio. Per i tracciati boschi, selezionate il filtro binario come tipo di dati, il filtro di confidenza desiderato e attivate la somma. Facendo clic sulla trama, Deuteros traccia tutti i peptidi ad ogni punto di tempo di scambio in funzione della loro posizione nella sequenza di amminoacidi e dei loro valori di assorbimento del deuterio. I peptidi che mostrano uno scambio significativo saranno colorati sia di rosso che di blu, a seconda che il peptide prenda più o meno deuterio, rispettivamente, a seconda della differenza calcolata. Il valore di significatività riportato in ciascun grafico (che va da 0,39 a 0,72 Da nei dati tracciati nella figura 9) è calcolato in base alle deviazioni standard delle differenze di assorbimento misurate per ogni peptide determinate dalle misurazioni replicate presenti all'interno del set di dati. Gli intervalli di confidenza vengono visualizzati come barre tratteggiate in ogni singolo plottaggio. Se abilitato, la "Somma" aggiunge semplicemente la differenza di assorbimento misurata in ogni punto di tempo per ogni peptide. Infine, per la visualizzazione dei dati di assorbimento sulla struttura tridimensionale della proteina di interesse, selezionare l'assorbimento delle esportazioni sotto le opzioni PyMOL, quindi esportare. Deuteros genererà uno script PyMOL che può essere trascinato e rilasciato nell'area di lavoro PyMOL contenente il file pdb aperto della proteina di interesse.
Il flusso di lavoro HDX-MS presentato in questo protocollo è stato utilizzato per caratterizzare le proprietà biochimiche di un enzima (HalM2) che catalizza una serie di modifiche post-tras tras trasdizionali su un peptide geneticamente codificato (HalA2)20. Nella figura 10, vengono mostrati risultati HDX-MS rappresentativi per l'associazione del peptide precursore HalA2 al complesso HalM2:AMP-PNP. Il pannello A mostra la mappa di copertura HalM2, in cui il colore indica la differenza relativa di assorbimento tra lo stato biochimico [HalM2:AMPPNP] e lo stato [HalM2:AMPPNP:HalA2]. Deuteros è stato usato per mappare queste differenze di assorbimento su un modello di omologia dell'enzima HalM2 (Figura 10B,C). I peptidi di colore rosso indicano una diminuzione dell'assorbimento del deuterio sul legame di HalA2, suggerendo che queste regioni di HalM2 possano essere coinvolte direttamente nel legame del peptide precursore. Per studiare questa ipotesi, le regioni I-III sono state mutate e le proprietà cinetiche degli enzimi variante sono state studiate. Mutazioni nella regione I e III hanno entrambi portato a perturbazioni significative nell'affinità di legame peptidico HalA2, suggerendo che queste regioni di HalM2 interagiscono direttamente con il substrato peptidico, o sono necessarie per formare strutture che consentano il legame di HalA2. Al contrario, la mutazione della regione II non ebbe alcun effetto sull'affinità di legame HalA2, ma questo mutante era quasi privo di attività catalitica. Una spiegazione di questa scoperta è che l'organizzazione della regione II osservata sul legame HalA2 innesca un cambiamento conformazionale che attiva l'enzima. Va notato che prima di questo studio non erano disponibili informazioni sulla modalità di legame HalM2-HalA2 o sui cambiamenti conformazionali cataliticamente rilevanti nel sistema, principalmente perché le grandi dimensioni e la natura flessibile di HalM2 e HalA2 hanno precluso studi strutturali. Pertanto, questi dati rappresentativi sulla lanthipeptide synthetasi HalM2 illustrano come l'HDX-MS possa essere utilizzato per localizzare rapidamente regioni funzionalmente rilevanti di sistemi enzimatici strutturalmente dinamici, anche in assenza di dati strutturali ad alta risoluzione.
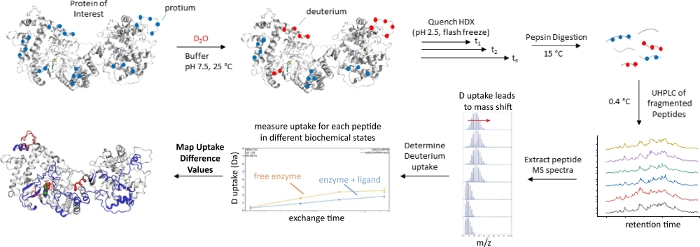
Figura 1: Uno scambio continuo, flusso di lavoro HDX-MS dal basso verso l'alto. Vedi il testo per i dettagli. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Il tasso di HDX dipende dalla dinamica conformazionale delle proteine (kaperto e kvicino) e dal tasso di scambio chimico dipendente dal pH dei legami N-H nella spina dorsale proteica per i legami N-D (kchem). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Dati rappresentativi LC-MS per i campioni di riferimento HalM2 triplicati. Il numero nell'angolo in alto a destra di ogni pannello rappresenta il conteggio totale degli ioni. Ogni riga mostra i dati per un esempio di riferimento diverso. La prima colonna (A−C) mostra i cromatogrammi ionici totali (BIC). Il grande picco a 9,3 minuti rappresenta peptidi grandi e non digeriti. La colonna centrale (D−F) mostra una visione più ravvicinata dei TEC tra 3 e 8 minuti. Si noti il buon accordo delle forme dei profili, che indica una miscela sottostante simile di segnali peptidici in ogni campione di riferimento attraverso l'intero cromatogramma. La terza colonna (G−I) mostra gli spettri di massa per ogni campione di riferimento generato sommando tutti gli spettri di massa registrati tra il punto di tempo 5.0 e 5.1 min della corsa cromatografica. L'ispezione visiva di questi dati indica che molti degli stessi peptidi vengono rilevati in ogni campione. Clicca qui per visualizzare una versione più grande di questa figura.
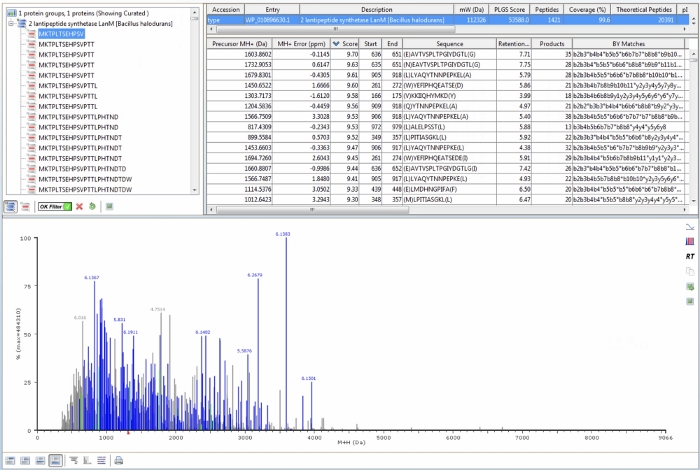
Figura 4: Uscita software di proteomica rappresentativa per un campione di riferimento HalM2. Il pannello in alto a sinistra mostra l'elenco completo dei peptidi peptici derivati da HalM2 rilevati nei dati MS. Si noti che il "Filtro OK" mostra il segno di spunta verde. Questo filtra i dati in base al punteggio di confidenza e rimuove le identificazioni peptidiche a bassa confidenza. La barra superiore del pannello di destra (evidenziata in blu) mostra statistiche cumulative per l'insieme di peptidi con punteggi elevati. Le statistiche più importanti sono il numero di peptidi rilevati (in questo caso 1.421) e la copertura della sequenza (in questo caso il 99,6%). Statistiche aggiuntive per ogni peptide sono mostrate anche nel pannello in alto a destra. Ogni colonna di questa tabella dati è ordinabile. Il pannello inferiore mostra tutti i segnali MS che sono stati abbinati a un peptide peptico derivato da HalM2 previsto. Si noti che la maggior parte dei segnali MS sono stati assegnati e sono colorati di blu. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Soglia aggiuntiva nel software di elaborazione HDX. L'uscita software proteomica per ciascuno dei tre campioni di riferimento HalM2 viene importata nel software di elaborazione HDX (pannello sinistro). Dopo l'importazione dei dati, viene eseguita una soglia aggiuntiva (pannello di destra). Il campo "prodotti minimi consecutivi" si riferisce agli ioni frammentazione generati dalla scissione di legami peptidici adiacenti nel peptide. Il parametro "minimum MH+ error" consente all'utente di definire l'accuratezza di massa accettabile e la "soglia del file" consente all'utente di limitare i peptidi solo a quei peptidi rilevati in tutti e tre i file di riferimento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Dati rappresentativi per un campione di riferimento HalM2 (rosso) e un campione HalM2 incubato in tampone D2O per 5 min (verde). Entrambi gli esempi sono stati sottoposti al flusso di lavoro LC-MS dal basso verso l'alto descritto nella sezione 3 del protocollo. La colonna di sinistra mostra gli spettri di massa sommati sulla finestra di tempo di 6,0−6,1 minuti. Le tre colonne a destra mostrano viste più ravvicinate degli stessi spettri di massa, dove il passaggio a valori m/z più alti nel campione deuterato (verde, in alto) è ovvio per la maggior parte dei segnali peptidici. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Screenshot dell'area di lavoro nel software di elaborazione HDX. (A) L'elenco dei peptidi derivati da HalM2 ottenuti dall'analisi di campioni di riferimento HalM2 con il software di proteomica (Figura 3) e la successiva soglia nel software di elaborazione HDX (Figura 4). Il peptide attualmente selezionato (HIDKLTVGL, che copre i residui di HalM2 110−118) è evidenziato in blu. (B) Le curve di assorbimento del deuterio (in funzione del tempo di scambio) per i due stati biochimici di interesse: l'enzima HalM2 libero, e l'enzima HalM2 legato all'AMPPNP e il precursore lanthipeptide, HalA2. (C) Spettro di massa del campione selezionato attivamente (in questo caso, uno dei campioni di riferimento HalM2 non castrato). I bastoncini blu nel pannello C possono essere assegnati/non assegnati manualmente se necessario se non sono stati assegnati correttamente dal software di elaborazione HDX durante l'elaborazione iniziale dei dati. (D,E) Grafici spettrali in pila per lo stato HalM2 (D) e lo stato HalM2:AMPPNP:HalA2 (E). L'aumento dipendente dal tempo nell'assorbimento del deuterio è facilmente visibile, così come la differenza di assorbimento tra i due stati biochimici. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Riduzione al minimo della deviazione standard nei valori di assorbimento misurati. La mappa di copertura nel software di elaborazione HDX (pannello C) fornisce un mezzo conveniente per identificare rapidamente peptidi con grandi deviazioni standard nei loro valori di assorbimento del deuterio misurati. In questo caso ipotetico, alcuni dei picchi isotopici (bastoncini blu) per i residui di spanning peptidici derivati da HalM2 110−118 non sono assegnati per i 5 minuti di tempo di scambio (i bastoncini grigi nel pannello B). Ciò sta portando ad una grande deviazione standard nel valore di assorbimento del deuterio misurato per il tempo di cambio di 5 minuti. La grande deviazione standard è facilmente ovvia dal colore blu del peptide 110−118 nella mappa di copertura (pannello C) e dalla dispersione del punto dati e dalla grande barra di errore nel grafico di assorbimento (pannello A). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 9: Area di lavoro Deuteros. In questo esempio, i valori della differenza di assorbimento sono stati calcolati nel software di elaborazione HDX sottraendo l'assorbimento del deuterio dello stato HalM2:AMPPNP:HalA2 da quello dello stato HalM2:AMPPNP. L'obiettivo del confronto era quello di visualizzare come il legame peptidico (HalA2) alterò la dinamica strutturale del complesso HalM2:AMPPNP. Il set di dati conteneva 4 punti di tempo di scambio (0,5, 5, 30 e 240 minuti). La differenza di assorbimento per ogni peptide ad ogni punto di tempo di scambio è illustrata nelle trame di Woods. I peptidi colorati nei grafici di Woods indicano peptidi che mostrano una significativa differenza di assorbimento, come definito dalla deviazione standard delle misurazioni replicate presenti nel set di dati e dai limiti di confidenza definiti dall'utente selezionati in Deuteros. Clicca qui per visualizzare una versione più grande di questa figura.
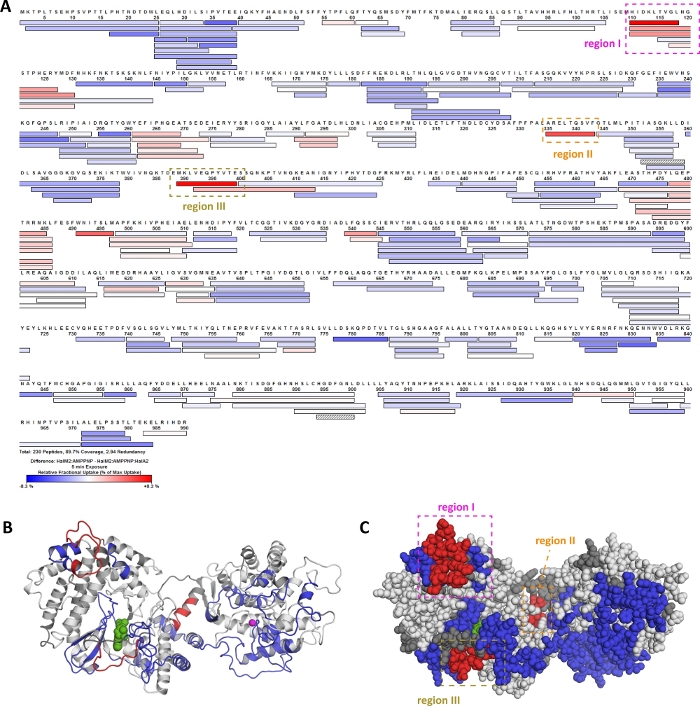
Figura 10: I dati HDX-MS guidano l'analisi funzionale dell'associazione peptidica e dell'attivazione allosterica nella lanthipeptide synthetasi HalM2. È stato studiato il cambiamento di assorbimento del deuterio al legame del peptide precursore halA2 alla lanthipeptide synthetasi HalM2. Viene tracciata la differenza di assorbimento per ogni peptide dopo una reazione di scambio di 5 minuti (A). Questo grafico è stato generato nel software di elaborazione HDX. I peptidi di colore rosso e blu subiscono rispettivamente sempre più assorbimento di deuterio, in presenza del peptide HalA2. Questi "hot spot" HDX sono mappati su un modello di omologia HalM2(B,C). L'identificazione dei peptidi sottoposti a notevoli differenze di scambio è stata determinata in Deuteros. Lo script PyMOL utilizzato per mappare i valori di differenza sul modello di omologia è stato generato in Deuteros. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il flusso di lavoro HDX-MS presentato in questo protocollo fornisce una piattaforma straordinariamente robusta per mappare la distribuzione spaziale di elementi strutturalmente dinamici nelle proteine e per indagare come queste dinamiche cambiano in risposta alla perturbazione (legame del ligando, mutagenesi enzimatica, ecc.). L'HDX-MS presenta diversi vantaggi distinti rispetto ad altri approcci di biologia strutturale che sono comunemente usati per studiare la dinamica conformazionale. In particolare, sono necessarie solo piccole quantità di proteine. Utilizzando il flusso di lavoro descritto nel presente documento, un campione di 1 mL di 1 μM di proteine fornisce materiale sufficiente per le reazioni HDX triplicate ciascuna contenente 5 punti di tempo di scambio. Inoltre, non esiste praticamente alcun limite di dimensione alla proteina di interesse, e i complessi proteici sono ugualmente suscettibili all'approccio HDX-MS. Il limite di dimensione è limitato solo dalla misura in cui i peptidi peptici possono essere risolti cromatograficamente e nelle dimensioni di mobilità m/z e ionica. Pertanto, per molti complessi proteine/proteine, HDX-MS fornirà preziose informazioni sulle interfacce di interazione proteina-proteina, sui siti di legame dei ligandi, sulle dinamiche conformazionali e sulle reti allosteriche. Infine, la reazione HDX viene eseguita in condizioni delicate e quasi native senza la necessità di etichettatura / ingegneria site-specific della proteina, che dovrebbe aiutare a garantire che l'attività endogena sia preservata. La principale limitazione dell'approccio (in termini di informazioni meccaniche che fornisce sulla proteina di interesse) è che i dati HDX di livello peptidico sono di risoluzione spaziale intrinsecamente bassa. Pertanto, i dati sono sufficienti per dedurre che si sta verificando un cambiamento nella struttura secondaria, ma gli impatti meccanicistici della perturbazione strutturale richiedono strutture a risoluzione più elevata (ad esempio, NMR, crioEM o cristallo a raggi X), studi di calcolo e / o studi biochimici per interpretare completamente.
Al fine di garantire la riproducibilità e l'affidabilità dei risultati, è necessario tenere presenti diversi aspetti critici del protocollo. In primo luogo, l'entità dello scambio di deuterio durante la reazione HDX e l'entità dello scambio di schiena durante il work-up e l'analisi dipendono fortemente dal pH, dal tempo e dalla temperatura. Pertanto, le procedure per la preparazione di buffer, reazioni HDX e metodi LC-MS devono essere il più sistematiche possibile per ridurre al minimo la variazione di questi parametri fisici tra i set di dati. Ove possibile, le reazioni HDX per gli stati biochimici da confrontare devono essere eseguite dallo stesso ricercatore lo stesso giorno e i dati LC-MS per questi campioni devono essere raccolti per giorni consecutivi con lo stesso lotto di solvente. Nel corso del tempo, anche l'efficienza della digestione della pepsina diminuirà, quindi è ottimale per i campioni che verranno confrontati per essere digeriti e analizzati entro un lasso di tempo relativamente ristretto, specialmente se la colonna di pepsina viene utilizzata per digerire molti altri tipi di campioni. È buona norma controllare periodicamente l'efficienza di digestione della colonna di pepsina utilizzando una proteina standard. Per raggiungere questo obiettivo, è possibile impostare un progetto software dedicato all'elaborazione HDX in cui i campioni appena digeriti possono essere confrontati con campioni meno vecchi per garantire che lo stesso set di peptidi bersaglio venga rilevato con intensità simili.
Mentre il flusso di lavoro presentato in questo protocollo dovrebbe fornire dati adeguati per molti sistemi enzimatici / proteici, ci sono diversi potenziali punti di ottimizzazione. Innanzitutto, la scala di tempo della reazione HDX può essere modificata per catturare dinamiche più veloci / più lente. In particolare, molti enzimi conterranno elementi altamente dinamici che si scambiano completamente in pochi secondi. Se questi elementi estremamente dinamici sono di interesse, i metodi per lo stato pre-stazionario, lo scambio continuo HDX-MS sono stati riportati nellaletteratura 31. In secondo luogo, le condizioni del metodo LC possono essere prontamente modificate per alterare l'efficienza della digestione (che alla fine determina la copertura della sequenza) e la ritenzione di deuterio (che alla fine determina la sensibilità del metodo). Considerando la durata e la temperatura della digestione della pepsina, portate più lente e temperature più elevate favoriranno una digestione più approfondita della proteina. La concentrazione proteica nel saggio HDX può anche essere aumentata se l'intensità del segnale è troppo bassa o diminuita se la digestione della pepsina è troppo inefficiente. Considerando il gradiente di acetonitrile utilizzato per separare i peptidi peptici sulla colonna analitica C18, un gradiente più veloce conserverà l'etichetta del deuterio, ma a scapito della risoluzione cromatografica dei peptidi peptici presenti nella miscela di reazione digerita. Per le proteine più piccole (~200 amminoacidi) in cui sono presenti meno peptidi peptici nel digest, un gradiente LC più veloce può essere più facile da implementare. Per proteine più grandi come HalM2 (~1.000 amminoacidi), è necessario un gradiente più lungo per risolvere l'ulteriore complessità spettrale generata dal maggior numero di peptidi nella miscela. In quest'ultimo scenario, l'inclusione di una separazione della mobilità ionica in fase gassosa può contribuire a migliorare drasticamente la capacità di picco dell'analisi. L'inclusione della separazione della mobilità ioniale ha un costo di un rapporto segnale/rumore leggermente ridotto. Infine, va notato che i dati MS per i campioni HDX non devono essere raccolti in modalità MSE. La parte MSMS del duty cycle MSE (cioè il segmento dell'energia ad alta collisione, fase 3.3.7.2) è richiesta solo per i campioni di riferimento al fine di definire l'elenco dei peptidi (sezione 4 del protocollo). Pertanto, i campioni HDX devono essere analizzati in modalità solo MS per aumentare il rapporto segnale/rumore.
Se il flusso di lavoro descritto in questo protocollo funziona correttamente, i peptidi a scambio completo dovrebbero presentare un valore relativo di assorbimento del deuterio del 60%−70%. Se l'assorbimento del deuterio è sostanzialmente inferiore a questo (per un peptide esposto a solvente e non protetto), la spiegazione più probabile è che il pH del campione sta cambiando durante una parte del workup/analisi. In questo scenario, un elettrodo microtip deve essere utilizzato per monitorare attentamente il pH del saggio HDX e dell'aliquota di reazione temprato. Anche il pH dei solventi LC-MS deve essere controllato. Per ridurre al minimo il verificarsi di questo problema, si consiglia vivamente di preparare e immagazzinare soluzioni stock concentrate di tutti i buffer e reagenti necessari per il saggio (come descritto nella sezione 1 del protocollo).
Negli ultimi anni, l'HDX-MS è emerso come un potente strumento analitico per indagare le dinamiche strutturali delle proteine. Lo sviluppo di sistemi LC-MS disponibili in commercio progettati e ottimizzati per esperimenti HDX (come il sistema utilizzato in questo studio ed elencato nei materiali) insieme a potenti pacchetti software, ha esteso l'approccio HDX-MS in molti laboratori accademici e industriali e ha trasformato quella che una volta era una tecnica di nicchia 15 anni fa in una piattaforma analitica più intuitiva. Nonostante i limiti della risoluzione spaziale, HDX-MS fornisce misurazioni altamente quantitative e riproducibili sui movimenti proteici ed è ideale per studiare enzimi conformativi dinamici che sono difficili da studiare con altri approcci. A causa di queste caratteristiche, l'HDX-MS riempie una nicchia essenziale nella biologia strutturale dei sistemi proteici disordinati e dinamici che hanno rilevanza in molte aree fondamentali della biologia e della medicina. Di conseguenza, si prevede che le analisi HDX-MS rimarranno uno strumento importante nell'arsenale del biologo strutturale per il prossimo futuro.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Natural Sciences and Engineering Research Council of Canada, dal Fonds de Recherche du Quebec Nature et Technologie, dalla Canadian Foundation for Innovation e dai fondi di start-up della McGill University.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| [glu-1]-fibrinopeptide B (Glu-Fib) | BioBasic | NA | |
| 0.5 mL Amicon Ultracel 10k centrifugal filtration device (Millipore) | Milipore Sigma | UFC501096 | |
| acetonitrile | Fisher | A955-1 | |
| AMP-PNP | SIGMA | A2647-25MG | |
| ATP | SIGMA | a2383-5G | |
| D2O | ALDRICH | 435767-100G | |
| formic acid | Thermo Fisher | 28905 | |
| guanidine-HCl | VWR | 97063-764 | |
| HEPES | Fisher | BP310-1 | |
| Magnesium chloride | SiGMA-Aldrich | 63068-250G | |
| Potassium chloride | BioBasic | PB0440 | |
| potassium phosphate | BioBasic | PB0445 | |
| TCEP Hydrochloride | TRC Canada | T012500 | peptide was synthesized upon request |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| software | |||
| Deuteros | Andy M C Lau, et al | version 1.08 | |
| DynamX | Waters | version 3.0 | |
| MassLynx | Waters | version 4.1 | |
| Protein Lynx Global Server (PLGS) | Waters | version 3.0.3 | |
| PyMOL | Schrödinger | version 2.2.2 | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Instrument and equipment | |||
| ACQUITY UPLC BEH C18 analytical Column | Waters | 186002346 | |
| ACQUITY UPLC BEH C8 VanGuard Pre-column | Waters | 186003978 | |
| ACQUITY UPLC M-Class HDX System | Waters | ||
| HDX Manager | Waters | ||
| microtip pH electrode | Thermo Fisher | 13-620-291 | |
| Waters Enzymate BEH column or Pepsin solumn | Waters | 186007233 | |
| Waters Synapt G2-Si | Waters |
Riferimenti
- Karplus, M., McCammon, J. A. Molecular dynamics simulations of biomolecules. Nature Structural & Molecular Biology. 9 (9), 646-652 (2002).
- Campbell, E., et al. The role of protein dynamics in the evolution of new enzyme function. Nature Chemical Biology. 12 (11), 944-950 (2016).
- Tokuriki, N., Tawfik, D. S. Protein dynamism and evolvability. Science. 324 (5924), 203-207 (2009).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass Spectrometry Reviews. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chemical Society Reviews. 40 (3), 1224(2011).
- Katta, V., Chait, B. T. Conformational changes in proteins probed by hydrogen-exchange electrospray-ionization mass spectrometry. Rapid Communications in Mass Spectrometry. 5 (4), 214(1991).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Science. 2 (4), 522(1993).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Xiao, K., et al. Revealing the architecture of protein complexes by an orthogonal approach combining HDXMS, CXMS, and disulfide trapping. Nature Protocols. 13 (6), 1403-1428 (2018).
- Smith, D. L., Deng, Y., Zhang, Z. Probing the non-covalent structure of proteins by amide hydrogen exchange and mass spectrometry. Journal of Mass Spectrometry. 32 (2), 135-146 (1997).
- Masson, G. R., et al. Recommendations for performing, interpreting and reporting hydrogen deuterium exchange mass spectrometry (HDX-MS) experiments. Nature Methods. 16 (7), 595-602 (2019).
- Liu, J., et al. An Efficient Site-Specific Method for Irreversible Covalent Labeling of Proteins with a Fluorophore. Scientific Reports. 5, 16883(2015).
- Marion, D., et al. Overcoming the overlap problem in the assignment of proton NMR spectra of larger proteins by use of three-dimensional heteronuclear proton-nitrogen-15 Hartmann-Hahn-multiple quantum coherence and nuclear Overhauser-multiple quantum coherence spectroscopy: application to interleukin 1.beta. Biochemistry. 28 (15), 6150-6156 (1989).
- Balasubramaniam, D., Komives, E. A. Hydrogen-exchange mass spectrometry for the study of intrinsic disorder in proteins. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1834 (6), 1202-1209 (2013).
- Goswami, D., et al. Time window expansion for HDX analysis of an intrinsically disordered protein. Journal of the American Society for Mass Spectrometry. 24 (10), 1584-1592 (2013).
- Keppel, T. R., Howard, B. A., Weis, D. D. Mapping Unstructured Regions and Synergistic Folding in Intrinsically Disordered Proteins with Amide H/D Exchange Mass Spectrometry. Biochemistry. 50 (40), 8722-8732 (2011).
- Mitchell, J. L., et al. Functional Characterization and Conformational Analysis of the Herpesvirus saimiri Tip-C484 Protein. Journal of Molecular Biology. 366 (4), 1282-1293 (2007).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Hydrogen/deuterium exchange mass spectrometry with top-down electron capture dissociation for characterizing structural transitions of a 17 kDa protein. Journal of the American Chemical Society. 131 (35), 12801-12808 (2009).
- Habibi, Y., Uggowitzer, K. A., Issak, H., Thibodeaux, C. J. Insights into the Dynamic Structural Properties of a Lanthipeptide Synthetase using Hydrogen-Deuterium Exchange Mass Spectrometry. Journal of the American Chemical Society. 141 (37), 14661-14672 (2019).
- Hebling, C. M., et al. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Analytical Chemistry. 82 (13), 5415-5419 (2010).
- Duc, N. M., et al. Effective application of bicelles for conformational analysis of G protein-coupled receptors by hydrogen/deuterium exchange mass spectrometry. Journal of the American Society for Mass Spectrometry. 26 (5), 808-817 (2015).
- Canul-Tec, J. C., et al. Structure and allosteric inhibition of excitatory amino acid transporter 1. Nature. 544 (7651), 446-451 (2017).
- Reading, E., et al. Interrogating Membrane Protein Conformational Dynamics within Native Lipid Compositions. Angewandte Chemie International Edition. 56 (49), 15654-15657 (2017).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. Journal of Visualized Experiments. (81), e50839(2013).
- Lento, C., et al. Time-resolved ElectroSpray Ionization Hydrogen-deuterium Exchange Mass Spectrometry for Studying Protein Structure and Dynamics. Journal of Visualized Experiments. (122), e55464(2017).
- Schowen, K. B., Schowen, R. L. Solvent isotope effects on enzyme systems. Methods in Enzymology. 87, 551-606 (1982).
- Lau, A. M. C., Ahdash, Z., Martens, C., Politis, A. Deuteros: software for rapid analysis and visualization of data from differential hydrogen deuterium exchange-mass spectrometry. Bioinformatics. 35 (7), 3171-3173 (2019).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. Journal of Pharmaceutical Sciences. 100 (6), 2071(2011).
- Burkitt, W., O'Connor, G. Assessment of the repeatability and reproducibility of hydrogen/deuterium exchange mass spectrometry measurements. Rapid Communications in Mass Spectrometry. 22 (23), 3893-3901 (2008).
- Rob, T., Gill, P. K., Golemi-Kotra, D., Wilson, D. J. An electrospray ms-coupled microfluidic device for sub-second hydrogen/deuterium exchange pulse-labelling reveals allosteric effects in enzyme inhibition. Lab on a Chip. 13, 2528-2532 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon