Method Article
Brainbow ve Time-lapse Konfokal Görüntüleme kullanarak Yaşayan Zebrabalıklarında Gelişen Beyni Görselleştirme
Bu Makalede
Özet
In vivo görüntüleme sinir sistemi gelişiminin altında yatan hücresel mekanizmaları araştırmak için kullanılabilecek güçlü bir araçtır. Burada, gelişmekte olan zebra balığı sinir sistemi içinde çok renkli Brainbow etiketli çok sayıda hücreyi gerçek zamanlı olarak görselleştirmek için zaman atlamalı konfokal mikroskopiyi kullanma tekniğini açıklıyoruz.
Özet
Omurgalı sinir sisteminin gelişimi karmaşık hücresel davranışlar ve etkileşimlerin hassas bir koordinasyon gerektirir. Vivo görüntüleme tekniklerinde yüksek çözünürlüklü kullanımı, canlı organizmada bu süreçlere açık bir pencere açabilir. Örneğin, hücreleri ve bunların dölleri sinir sistemi formları olarak gerçek zamanlı olarak takip edilebilir bölme. Son yıllarda, çok renkli tekniklerde teknik gelişmeler araştırılabilir soru türlerini genişletti. Çok renkli Brainbow yaklaşımı sadece hücreler gibi ayırt etmek için değil, aynı zamanda her bir ata hücresi türetmek ilgili hücrelerin birden fazla farklı klonları renk kodu için kullanılabilir. Bu, geliştirme sırasında birçok farklı klonların ve davranışlarının aynı anda çok katlı bir soy analizine olanak tanır. Burada, gelişmekte olan zebra balığı sinir sistemi içinde çok renkli Brainbow etiketli çok sayıda hücreyi gerçek zamanlı olarak görselleştirmek için zaman atlamalı konfokal mikroskopiyi kullanma tekniğini açıklıyoruz. Bu, özellikle geleneksel promotör odaklı renkleri kullanarak farklı bir şekilde etiketlemesi zor olan hücreler arasındaki hücresel etkileşimleri takip etmek için yararlıdır. Yaklaşımımız aynı anda birden fazla farklı klon lar arasındaki soy ilişkilerini izlemek için kullanılabilir. Bu teknik kullanılarak oluşturulan büyük veri kümeleri, genetik veya farmakolojik manipülasyonlar arasında nicel olarak karşılaştırılabilen zengin bilgiler sağlar. Sonuçta oluşturulan sonuçlar sinir sisteminin nasıl geliştiği hakkında sistematik sorulara cevap yardımcı olabilir.
Giriş
Gelişimin ilk aşamalarında, özel leştirilmiş progenitor hücrelerinin havuzları proliferatif bölgelerde tekrar tekrar bölünür ve farklı kız hücreleri dizileri üretir. Bu gelişim döneminde doğan hücreler daha sonra farklılaşır ve yeni doğan organları oluşturmak için seyahat ederler. Sinir sisteminde radyal glia gibi atalar ventriküler bölgelerde olgunlaşmamış nöronlara yol açar. Nöronlar ventriküllerden uzaklaşır ve olgunlaşırken, genişleyen doku sonunda beynin son derece karmaşık yapılarını oluşturur1,2,3,4,5,6. Atalarının bölünmesi ve farklılaşma ve nöronların göç arasındaki koordinasyon nihai boyut, şekil belirleyecek ve böylece beynin fonksiyonu, doğrudan davranış etkileyen7,8,9,10. Bu süreçler üzerinde sıkı kontrol açıkça normal beyin gelişimi için çok önemli olmakla birlikte, bu dinamikleri düzenleyen küresel mekanizmalar iyi anlaşılamamıştır. Burada bir hücresel çözünürlükte sinir sistemi gelişimini incelemek için bir araç tarif, araştırmacılar Brainbow ile gelişmekte olan zebrabalığı beyninde progenitor hücreleri ve nöronlar in vivo görselleştirmek ve zaman atlamalı konfokal mikroskopi ile zaman içinde davranışlarını izlemek için izin11. Yaklaşım aynı zamanda gelişmekte olan embriyonun diğer bölümlerini görselleştirmek için adapte edilebilir.
Gelişmekte olan zebra balığı beynindeki hücreleri gözlemlemek ve ayırt etmek için Brainbow hücre etiketlemetekniğini 11'euyarladık. Brainbow, bir hücre popülasyonunu etiketlemek için üç farklı floresan proteinin (FP) rastgele belirlenmiş, birleştirici ekspresyonu kullanır. Brainbow ekspresyonu için varsayılan ifade kırmızı FP dTomato iken, enzim Cre rekombinaz ile rekombinasyon mCerulean (siyan floresan protein, CFP) veya sarı floresan protein (YFP)12,13ifadesi ile sonuçlanır . Bir hücrede ifade edilen her FP'nin birleşik miktarı, hücreye benzersiz bir renk verir ve komşu hücrelerden net görsel ayrım sağlar. Ayrıca, bir ata hücresi bölündüğünde, her kız hücre renk kodlu klonlar üreten ve araştırmacılar hücre soy 11 ,,14izlemek için izin, kendi ana hücreden renk devralacak.11 Başlangıçta farelerde nöronal devreleri analiz etmek için kullanılırken12, Brainbow beri model organizmaların geniş bir yelpazede ifade edilmiştir, zebrabalığı da dahil olmak üzere15.
Tekniğimiz, yaşayan zebra balıklarında zaman içinde birden fazla renk kodlu klonları doğrudan görüntülemek için önceki çok renkli etiketleme ve görüntüleme yöntemlerine dayanmaktadır. Embriyo lar gibi optik şeffaflık nedeniyle, zebra balıkları görüntüleme deneyleri için uygundur16, ve önceki çalışmalarda sinir sistemi11, 15,,17,18,19,20,21,22,23,15,25, çeşitli dokuları incelemek için zebrabalığı Brainbow kullandık24 26,27. Canlı organizmanın doğrudan görüntü yeteneği, onların hızlı eski rahim gelişimi ile birlikte, zebra balığı omurgalı gelişimi değerli bir model yapmak. Memeli beyninin aksine, zebra balığı hindbrain tüm proliferatif bölge endojen çevre6bozulmadan görüntüleme için hazırdır. Bu deneylerin in vitro veya sabit doku preparatları yerine canlı organizmada yapılmasını sağlar. Sabit görüntüleme deneylerinin aksine, in vivo çalışmalar uzunlamasına bir tasarıma olanak sağlayarak desenler için analiz edilebilen saatler süren veriler üreterek nispeten nadir olayları gözlemleme olasılığını artırır. İlgi çekici olayların hızına ve uzunluğuna bağlı olarak, araştırmacılar kısa (1-2 saat) veya uzun (~16 saate kadar) hızlandırılmış görüntüleme deneyleri yapmayı seçebilirler. Zebrabalığı ısı şok organizatörü 70 (hsp70, hsp) kullanılarak, Brainbow ekspresyonu zamansal olarak kontrol edilebilir28,29. Ayrıca, bu organizatör tarafından indüklenen mozaik ifade de etiketleme ve birçok klonlar11izleme için uygundur.
Canlı beyindeki birden fazla klonu görsel olarak tanımlayabilme yeteneği bu yöntemin bir avantajıdır. Sinir sisteminin gelişiminde klonların rolünü araştıran önemli önceki çalışmalar, tek bir ata hücresi ve onun atasını tek bir FP veya diğer kolayca görselleştirilmiş protein kullanarak etiketlemek için retroviral vektörler kullanılmıştır. Bu tür etiketleme araştırmacılar zaman içinde tek bir klon gözlemlemek için izin verir, in vitro veya in vivo2,30,,31,32,33,34,35,36,37,38. Brainbow'un farklı renkleri, bir klondaki hücrelerin davranışını izleme yöntemlerinin aksine, araştırmacıların klonlar arasındaki dinamikleri gözlemlemelerine olanak tanır. Ayrıca, beyindeki birçok klonları etiketlemek için Brainbow kullanılarak, klonal davranışla ilgili ek veriler tek bir klonu11etiketleyen tekniklere göre toplanır. Daha da önemlisi, burada açıklanan yaklaşımlar farklı genetik veya farmakolojik manipülasyonlar18uğramıştır balıklar arasında gelişimsel karşılaştırmalar oluşturmak için genişletilebilir. Genel olarak, bu avantajlar, omurgalı sinir sisteminin gelişimini araştıran araştırmacılar için ideal olan Brainbow ifade eden zebra balığının vivo konfokal görüntülemesinde zaman atlamalı hale getirilmektedir, özellikle de klonların rolüyle ilgilenenler.
Protokol
Hayvan denekleri ile ilgili prosedürler Lewis & Clark Koleji'ndeki Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. Zebrabalığı Embriyolarının Mikroenjeksiyonu
- Mikroenjeksiyonlar39,40gerçekleştirmeden önce öğleden sonra seks ayrılmış çiftleme tankları vahşi tip, yetişkin zebra balığı kurmak.
- Mikroenjeksiyonların olduğu sabah DNA çözeltisini hazırlayın. Seyreltik hsp:Zebrabow11 plazmid DNA 0.1 mM KCl ~10 ng/μL konsantrasyonu, birlikte 2.5% fenol kırmızı ve 3.75U Cre rekombingaz enzim.
- 45 dk içinde tek hücreli zebrabalığı embriyolarına DNA çözeltisi mikroenjeksiyonları yapmak39,41. Bu çözeltinin yaklaşık 4,2 nL'sini her embriyoya enjekte edin, bu da ~42 pg plazmid DNA'sına eşdeğerdir.
NOT: Tg(ubi:Zebrabow)15 ve Tg(neurod:Zebrabow)18gibi transgenik, Brainbow ifade eden zebra balığı hattı çiftleşirse mikroenjeksiyon adımı atlanabilir. Araştırmacıların kopya numarasını ve etiketleme yoğunluğunu titre etmesine olanak sağladığı için mikroenjeksiyonların yapılması avantajlı olabilir. Ayrıca, belirli bir gen ürününü etiketleyen veya işleyen ikinci bir DNA yapısı istenirse Brainbow' un yanına enjekte edilebilir (örn. Brainbow18'i tamamlayan uzak kırmızı floresan protein). - E3 orta39 petri kaplarda enjekte embriyolar korumak 28 °C kuvöz 24 saat.
2. Brainbow İfadesi İndüklemek için Isı Şoku
NOT: Plazmid DNA enjekte veya transgen ifade ifade hsp70 organizatörü kullanarak ifade kullanmıyorsa, ısı şoku adımı atlanabilir ve sağlıklı embriyolar hemen fenilthiourea transfer edilmelidir (PTU) 24 saat sonrası döllenme (hpf).
- 24 hpf'de, enjekte edilen embriyo grubundan ölü ve deforme olmuş embriyoları itlaf edin. Daha sonra, sağlıklı embriyoları 20'ye kadar embriyo/tüp içeren 50 mL'lik bir tüpe aktarın.
- Tüpleri 10 mL E3 ile doldurun. Her tüpün üzerine bir kapak yerleştirin, ancak sıkıca kapatmayın.
- 50 mL tüpleriçeren tüp rafını 37 °C'lik bir su banyosuna dik olarak yerleştirin. Banyodaki su seviyesinin tüplerdeki E3 seviyesinden daha yüksek olduğundan emin olun ve 80 ila 90 dk bekletin.
- Su banyosundan embriyolarla birlikte tüp rafını çıkarın ve 28 °C'lik kuluçka makinesine dik olarak dönün. E3'ün soğuması için 1 saate kadar bekleyin ve embriyoların yavaş yavaş ısıya yeniden alışmalarına izin verin. Daha sonra embriyoların E3'teki 0.2 mM PTU'luk Petri yemeklerine aktarılması, embriyoların pigmentasyonunu önlemek için kuvözde ısındı.
DİkKAT: PTU, özenle ele alınması ve uygun şekilde bertaraf edilmesi gereken toksik bir kimyasaldır. Eldiven giymesi önerilmektedir.
3. Brainbow İfadesi Için Embriyo Ların Taranması
- Isı şokundan sonra 2 ila 4 saat, cfp veya YFP ekspresyonu için standart floresan diseksiyonu mikroskobu altında embriyoları inceleyin, bu da başarılı Brainbow rekombinasyonunu gösterir (dTomato'nın varsayılan ekspresyonundan).
NOT: Birden fazla floresan filtre seçeneği varsa, CFP için tarama iyi yeniden birleştirilmiş balık tanımlamak için en verimli yoldur. CFP ve YFP filtreleri mevcut değilse, YFP spektral profillerindeki çakışma nedeniyle yeşil floresan protein (GFP) filtreleri altında da dim olarak görselleştirilebilir. - Boyunca sağlam FP ifadesine sahip embriyoları seçin ve PTU ile ayrı bir tabağa aktarın. Görüntü embriyolar 1 gün sonrası döllenme (dpf; 28 hpf veya daha sonra) veya PTU ve görüntü 2 veya 3 dpf embriyoları korumak.
4. In Vivo Görüntüleme için Montaj Embriyolar
-
Deney gününden önce, görüntüleme odasını ve embriyo manipülasyon aracını hazırlayın.
- 60 mm Petri kabının ortasına plastik bir halkayı dikkatlice yapıştırarak görüntüleme odasını hazırlayın.
- İsteğe bağlı olarak, montaj sırasında çanak ve yönlendirmek embriyolar içinde embriyotaşımak için özel yapılmış bir embriyo manipülatör hazırlamak. Bir ~ 4 uzunluğunda kesilmiş bir ahşap pamuk lu bez sopa sonuna naylon olta (~ ~ 1 / 2 içinde, ~ 6 lb) küçük bir uzunlukta supergluing tarafından manipülatör inşa.
- Gerekirse (yani, 2 dpf veya daha erken görüntüleme), embriyolar bir diseksiyon mikroskobu altında şırınga lar kullanılarak dechorionate monte önce.
-
Zebra balığı embriyolarını anestezik.
- 60 mm'lik Petri kabını E3 ile yarıya doldurun ve ~0,2 mM'lik son konsantrasyona 4 mg/mL MS-222 Tricaine-S'den 5-6 damla ekleyin. Karıştırmak için girdap.
DİkKAT: Tricaine özenle ele alınmalıdır ve uygun şekilde bertaraf edilmelidir. - Embriyoların PTU'dan tricaine solüsyonuna aktarılması, mümkün olduğunca az PTU transferi olmasını sağlar. Balık refleksleri 1-2 dakika sonra sona ermelidir iken, zaman atlamalı görüntüleme deneyleri için ayrıntılı anestezi sağlamak için 10 dakika kadar trikotin embriyolar bırakın.
- Embriyoların düzgün bir şekilde anestezi yediğini doğrulayın. Embriyo manipülatör ile yavaşça embriyo kuyrukları dokunarak ürkme refleks değerlendirmek. Bir refleks hareketi gözlenirse, mümkün olduğunca embriyolar ve karıştırmak için girdap kadar çanak için tricaine ek bir damla ekleyin. Bir diseksiyon kapsamı altında embriyo kalp hızı gözlemleyin. Anormal yavaş ise, tricaine konsantrasyonu azaltmak için çanak E3 ek damla ekleyin.
- 60 mm'lik Petri kabını E3 ile yarıya doldurun ve ~0,2 mM'lik son konsantrasyona 4 mg/mL MS-222 Tricaine-S'den 5-6 damla ekleyin. Karıştırmak için girdap.
-
Agarose'da anestezili embriyolar dağılın.
- Balıkları görüntüleme odası içindeki plastik halkanın merkezine aktarın ve ince uçlu transfer pipetini kullanarak mümkün olduğunca fazla E3'ü çıkarın.
- Temiz bir transfer pipeti kullanarak, 42 °C'de saklanan E3'te %1,0 az erimiş agarose (LMA) ile balıkların üzerini kapatın ve tüm plastik halkayı ince bir agarose tabakası ile doldurun. Embriyoları yavaşça pipet ucuna çekmek ve hava kabarcıkları çıkarmadan agarose içine geri çekmek için bir transfer pipet kullanın.
- Agarose sertleşmeden önce, hızlı bir şekilde uygun balık yönlendirmek için bir embriyo manipülatör kullanın. Dik bir mikroskopla görüntülenme varsa, embriyoları mümkün olduğunca agarose üst yüzeyine yakın konumlandırın. Embriyoları görüntüleme odasının altına paralel olarak kuyruk düz olarak yerleştirin.
NOT: Arka beyin görüntüleme için, embriyolar bir dorsal veya sagital görünümde konumlandırılmış olabilir. Agarose hala sıvı iken embriyoların başları lavabo değil emin olmak için dikkatli olunmalıdır. Diğer oryantasyonlar görüntüleme için diğer gelişmekte olan dokuları hedeflemek için uygun olabilir. Ters mikroskoplar için, montaj farklı, genellikle bir cam dipli Petri kabın altına yakın balık konumlandırma yapılabilir.
- Agarose sertleşmek için bekleyin, sonra E3 ile görüntüleme odası doldurun. Görüntüleme boyunca buharlaşmayı hesaba katmak için mümkün olduğunca çok E3 ekleyin.
5. Zebrabalığı Hindbrain Geliştirme Zaman Atlamalı Konfokal Görüntüleme
-
Görüntüleme için hazırlık için konfokal mikroskobun üzerine görüntüleme odasıyerleştirin.
- Konfokal mikroskobun üzerine balık ve E3 ile görüntüleme odası yerleştirin.
- Yüksek sayısal diyafram açıklığına ve 20x su daldırma hedefi (1,0 NA) gibi uzun çalışma mesafesine sahip bir hedef seçin.
- İlgi çeken hücre türü(ler)in uygun şekilde yoğun ve parlak etiketleen bir bölge bulun.
NOT: Uzun görüntüleme seansları sırasında sıcaklık ve nemi düzenlemek için mikroskop üzerindeki sıcaklık kontrollü bir aşama/cihaz da kullanılabilir. Bu buharlaşmayı azaltabilir.
-
Brainbow görüntüleme için edinme parametrelerini ayarlayın.
- Her FP kanalInı sırayla görüntüleyin. Ticari bir yazılım (örneğin, Zen yazılımı) kullanıyorsanız, bu üç "parça" hazırlanarak yapılır. 458 nm ve YFP 514 nm CFP heyecanlandırmak için bir Argon lazer kullanın. DTomato heyecanlandırmak için bir DPSS 561 nm lazer kullanın. CFP için 463-509 nm, YFP için 519-555 nm ve dTomato için 566-691 nm arasında emisyon toplayın.
- Ekrandaki ekran için CFP'yi mavi, YFP'yi sarı ve dTomato kırmızı olarak kodlayın.
NOT: Bu ayarlar, konfokal mikroskopta hangi lazer hatlarının ve diğer özelliklerin mevcut olduğuna bağlı olarak değişir. Görüntüleme hızını artırmak için, CFP ve dTomato kanalları kayda değer bir kanama olmadan aynı anda görüntülenebilir. Uzak kırmızı FP gibi ayrı bir FP de görüntüleniyorsa, bu durum YFP ile sırayla veya aynı anda görüntülenebilir. - Genel görüntüleme parametrelerini en az 1024 x 1024 çözünürlüğe sahip ve ortalama iki kez 16 bit görüntü alacak şekilde ayarlayın. Yakınlaştırmayı, ilginin bölgeye ve hücre türüne bağlı olarak ayarlayın (örneğin, 20 x hedefiyle arka beyin görüntüleme için zum 1.0-2.5 arasında değişir). Zaman içinde balık büyüme sağlamak için görüş alanını en üst düzeye çıkarın.
- Bir parçayı aynı anda görüntülemek (ve fotobeyaztmayı önlemek için diğer lazerleri kapatmak), her FP için satın alma ayarlarını ayrı ayrı optimize edin (örn. lazer gücü, iğne deliği boyutu, fotoçarpan tüp kazancı, vb.).
- Görüntüye Z-yığın aralığını seçin.
NOT: Uzun görüntüleme seansları için (>2 saat), balığın görüntüleme boyunca büyümeye devam edeceği göz önünde bulundurulur, böylece hem XY alanı hem de Z-yığın aralığı bunun için ekstra oda ile hesap vermelidir. Eğer arka beyin görüntüleme, görüntüleme döneminde doku rostrally hareket etmek için alanda boşluk içerir. Z boyutundaki büyüme için alanın da dahil edilmesi gerekir. Balığın sagittal veya dorsal görünüm için konumlandırılmış olup olmadığını, ilgi alanının yaklaşık 10-20 m üzerinde görüntüye ekleyin.
-
Hızlandırılmış görüntüleme için parametreler ayarlayın.
- Bir zaman aralığı seçin. Aralık uzunluğu 10-30 dakika arasında değişen gelişmekte olan arka beyinde mitotik ve apoptotik olayları izlemek için. Aralık uzunluğu, ilgi olaylarının hızına ve tek bir Z yığınını yakalamak için gereken toplam süreye bağlı olarak değişir.
- Görüntüleme oturumunun uzunluğunu seçin. Hızlandırılmış görüntüleme seansları genellikle bir gecede gerçekleşir ve en az 16 saat sürebilir.
-
Deneyi çalıştırın.
NOT: Balık, görüntülemeden hemen sonra ötenazi yedirilebilir veya şırıngalar kullanılarak agarose'dan dikkatlice kesilebilir ve iyileşmek için E3'e geri döndürülebilir. Daha sonra kurtarılan balıklar daha sonraki bir zaman noktasında tekrar görüntülenebilir, ancak hücre konumu ve derinliği genel büyüme nedeniyle bu dönemde değişecektir.
6. Hızlandırılmış Dosya Yönetimi
-
Görüntü dosyasını çözümleme yazılımına aktarın.
- Zen yazılımını kullanıyorsanız, görüntü edinimi tamamlandıktan sonra dosyayı .czi biçiminde kaydedin. Ham verileri Fiji42 ve/veya diğer yazılımlarla uyumlu bir biçimde kaydettiğinden emin olun.
- BioFormats Importer kullanarak Fiji yazılımına aktarın.
NOT: Hızlandırılmış dosyalar büyük olacaktır ve çözümleme için açılması için önemli miktarda zaman ve bellek gerektirebilir. Bu nedenle, nasıl kaydedilir ve açılır stratejik olmak yararlıdır. Bu göz tarafından ilgi olayları aramak için daha kolay açılabilir daha düşük kaliteli bir sürümünü kaydetmek için yararlı olabilir.
- Fiji kullanıyorsanız, zaman atlamalı dosyaların daha küçük, daha yönetilebilir alt kümelerini oluşturun. Resim' i tıklatarak zamana göre (örneğin, tam Z yığınını ilk anda görüntüleme) veya derinliğe göre (örn. her zaman noktasında ilk 50 Z bölümünü görüntüleme) alt kümeler oluşturun | Yığınlar| Araçlar| Alt Yığın olun.
7. Brainbow Görüntülerinin Nicel Klonal Renk Analizi
- Fiji'deki ilgi hücreleri için ortalama kırmızı, yeşil ve mavi (RGB) yoğunluk değerlerini ölçün.
NOT: Bu talimatlar Fiji görüntü analizi için özeldir. Ancak, araştırmacılar alternatif bir yazılım programında ortalama RGB yoğunluk değerleri elde etmeyi tercih edebilirler.- Görüntünün kenarlarında siyah boşluk olmaması için dosyanın doğru kırpılmış olduğundan emin olun. Siyah uzay, analiz için gereken minimum yoğunluk ölçümlerini yapay olarak düşürür. Dosyanın kırpılması gerekiyorsa, Dikdörtgen Seçim Düğmesi'ni seçin ve tüm siyah boşluk hariç olmak üzere görüş alanının etrafına ilgi alanı (YG) çizin. Resim| Kırpma.
- Ölçüm aracını ortalama, minimum ve maksimum gri değer ölçümleri alacak şekilde ayarlayın. Analiz Et' i tıklatın | Ölçümleri ayarlayın. Min & Max Gray Value ve Ortalama Gri Değeri için onay kutularının her ikisinin de seçildiğinden emin olun.
- Fiji'deki ham veri dosyalarını veya subsetted Z-yığınlarını görüntülemede, klonal renk çözümlemesi için ilgi çekici hücreleri bulun. Arka beyinde, putatif klonlar görsel olarak ortak tonlarının yanı sıra radyal yönelimleri ile de tanımlanabilir. Başka bir rengin komşu hücreleriyle yakın temas halinde olan ve bu nedenle çözülmesi zor olan hücreleri seçmeyin. Onların tonunu ölçmek zor olabilir.
- Z-scrollbarkullanarak ilgi hücresinin merkezi Z-düzlemini bulun. Oval Seçim Düğmesine sağ tıklayın ve Eliptik Seçim Düğmesiniseçin. Diğer seçim araçları farklı hücre türleri için uygun olacaktır. Hücre gövdesinin merkezi ~2/3'ünün etrafına eliptik bir yatırım getirisi çizin.
- C kaydırma çubuğunukullanarak kırmızı (dTomato) kanalını seçin. Analyze| Ölçün. Yeşil (YFP) ve mavi (CFP) kanalları için aynı yatırım getirisi ve odak düzlemi ile tekrarlayın ve tüm ortalama yoğunluk değerlerini kaydedin.
- İlgi hücresindeki eliptik Yatırım Getirisi'ni kaldırmak için görüntünün herhangi bir yerine tıklayın.
- Normalleştirme için arka plan düzeylerini ölçmek için C-scrollbar'ı kullanın ve kırmızı (dTomato) kanalını seçin. Analyze| Ölçün. Yeşil (YFP) ve mavi (CFP) kanalları için aynı odak düzlemi ile tekrarlayın ve tüm minimum yoğunluk değerlerini kaydedin.
- İlgi hücreleri için göreli RGB kanal ağırlıklarını hesaplayın.
NOT: Bu yoğunluk değerlerinden göreli RGB kanal ağırlıklarının hesaplanması Microsoft Excel veya R43gibi çeşitli yazılım programlarında gerçekleştirilebilir.- O kanal ve odak düzlemindeki tüm alandan en az yoğunluğu çıkararak her kanal için hücre Yatırım Getirisi'nin ortalama yoğunluk ölçümlerini normalleştirin.
- Hücrenin toplam normalleştirilmiş RGB yoğunluğunu bulmak için her kanaldan normalleştirilmiş ortalama RGB yoğunluk değerlerini toplamı.
- Her kanalın göreli kanal ağırlığını, o kanalın normalleştirilmiş ortalama yoğunluğudeğerini toplam normalleştirilmiş RGB yoğunluğuna bölerek hesaplayın.
- R43,44için Üçüncül paketi kullanarak üçüncü çizer çizimler olarak göreceli RGB kanal ağırlıkları görüntüleyin. Üçüncül çizimler, benzer renklerin 3B RGB alanında kümelemesini görselleştirmek için yararlıdır.
- Hücre renkleri arasındaki farkı ölçmek için renk yayma katsayısını hesaplayın.
- Aşağıdaki denklemi kullanarak 3B RGB alanında iki renk arasındaki Öklid uzaklığı hesaplayın:
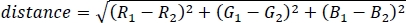
R, G ve B'nin 7,2 olarak hesaplanan göreli RGB kanal ağırlıkları olduğu yer. - Anlama kolaylığı için, 0 ile 1 arasında bir renk yayma katsayısı elde etmek için renkler arasındaki maksimum mesafe olan √2'ye bölerek renk mesafesini normalleştirin, 0 tam olarak aynı rengi gösterir ve 1 tamamen farklı renkleri gösterir (örn. saf kırmızı ve saf mavi).
- Aşağıdaki denklemi kullanarak 3B RGB alanında iki renk arasındaki Öklid uzaklığı hesaplayın:
Sonuçlar
Bu bölümde, burada açıklanan in vivo çok renkli hızlandırılmış görüntüleme yaklaşımı kullanılarak elde edilebilen sonuçlara örnekler gösterilmektedir. Gelişmekte olan zebra balığıhindbrain14 proliferatif ventriküler zonlarında hücrelerin Brainbow renk kodlu klonları göstermek(Şekil 1).
Tipik olarak, Brainbow etiketli hücreler belirli bir radyal lif boyunca düzenlendiğinde, göreceli RGB kanal ağırlıkları olarak ölçülebilen aynı rengi(Şekil 1D)paylaştılar (Şekil 1E). Bu, bu radyal grupların bölünen hücrelerin klonları olduğunu ve benzer renklerinin, zebra balığı, fare ve civciv14,15'te daha önceki çalışmalarda gözlendiği gibi, klonsal ilişkili olarak tanımlamak için kullanılabileceğini göstermektedir. Brainbow etiketleme yoğunluğu nispeten seyrek olduğunda, bu renk kodlama açıkça görselleştirmek ve yaşayan omurgalı beynin proliferatif bölgelerde birçok farklı radyal klonları izlemek için kullanılabilir.
Nicel renk analizi, kız hücrelerinin anne (ata) hücresi(Şekil 1F)ile aynı rengi ifade ettiğini, ancak komşu radyal hücre kümelerinin birbirinden ayırt edilebildiği ni göstermiştir11 (Şekil 1E). Bu, ilgili hücrelerin çok sayıda klonları aynı anda vivo saat içinde takip edilebilir anlamına gelir(Şekil 2),bir multipleks soy analizi ve karşılaştırma için izin. 2 dpf'de klonlarda renk ekspresyonunun ve daha sonra tekrar 3 dpf 'de renk ekspresyonunun ölçülmesi(Şekil 2A-B)Brainbow ekspresyonunun da 2-3 gün in vivo11'dennispeten sabit kaldığını göstermiştir. Böylece tek tek hücreler gelişim sırasında nispeten uzun süreler boyunca gerçek zamanlı olarak tanımlanabilir ve izlenebilir.
Hızlandırılmış görüntüleme, hücre döngüsünün incelenmesine izin veren 1-2 dpf(Şekil 2C–F)11arasındaki dönemde interkinetik nükleer göç ve hücre bölünmesi geçiren çok sayıda hücre yi saptamaktaydı. 30 dk'lık bir zaman atlamalı aralık kullanarak, hücre bölünmesi sırasında her zaman mitotik figürü yakalayamadık. Bu hücre bölünmesi atanan zaman akadar 30 dakika potansiyel bir hata tanıttı. Ayrıca, bazı klonların iki ata hücresi içerdiğini gözlemledik (örneğin, Şekil 2F). Bu kısıtlamalar içinde, hücre döngüsünün uzunluğu ölçülebilir. Zaman içinde tek tek Brainbow etiketli ataları izleyerek, zebra balığı1,45,46'dakiönceki ölçümlerle karşılaştırılabilir, ortalama hücre döngüsü olan 8,4 ± 1,5 saat olarak hesapladık. Ayrıca, Brainbow zaman atlamalı görüntüleme tekniğini kullanarak, membran blebbing ve hücre parçalanması47,,48gibi apoptoz ile ilişkili stereotipik morfolojik değişiklikler geçiren tek tek hücreleri gözlemleyebildik (Şekil 3)11.
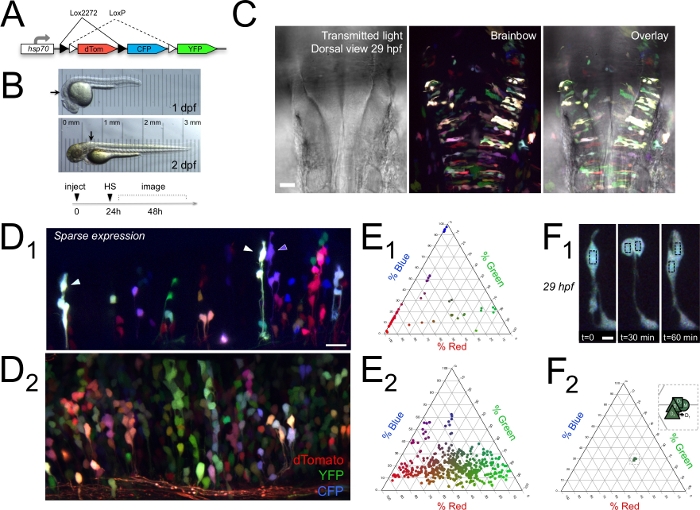
Şekil 1: Brainbow, gelişmekte olan zebra balığı arka beyninde klonsal olarak bölünen hücreler kümelerini etiketletir. (A) HSP şeması:Zebrabow (Brainbow) DNA geçici renk kodu klonlar ifade. (B) In vivo 1 ve 2 dpf'de gelişen zebra balığının ışık görüntülerini iletilir; oklar görüntüleme için hedeflenen genel arka beyin bölgesini gösterir. Embriyoların translucency her balık altında yerleştirilen bir mikrometre ile gösterilmiştir. Tek hücreli aşamada enjeksiyonları gösteren deneysel zaman çizelgesi, 24 hpf'de ısı şoku (HS) ve 1-3 dpf'den görüntüleme. (C) Brainbow etiketli 29 hpf zebra balığının sırt görünümü. İletilen ışık kanalı, 165 μm'yi temsil eden Brainbow etiketli klonların maksimum yoğunluklu projeksiyonu ile kaplanmış arka beyin ve ventrikül morfolojisini gösterdi. Rostral kalktı. (D) Arka beyinde in vivo Brainbow ekspresyonu, seyrek etiketli 41 μm'yi temsil eden maksimum yoğunluk projeksiyonlarında gösterilmiştir 51 hpf zebra balığı (D1), ve 63.5 hpf zebrabalığında 81 μm (D2). Her iki panelde de dorsal yukarı, rostral soldadır. (E) D1 ve D2'deki hücrelerin rengi, karşılık gelen üçer parsellerde göreli kanal ağırlıkları olarak ölçüldü (n = 54 hücre E1; 461 hücre E2). (F) Hücre bölünmesini takiben kız hücrelerinde hücre rengi nispeten sabit kalmıştır. 29 hpf Brainbow etiketli zebra balığının arka beyninde in vivo mitotik olayları gösteren bir dizi zaman puanı 1 saat(F1, maksimum yoğunluk projeksiyonları, 30 μm derinlik). F1'dekikara kutularda gösterilen anne ve kız hücrelerinin rengi, F2'dekiüçüncüplanda göreceli kanal ağırlıkları olarak temsil edilir. Inset, sıkıca kümelenmiş hücre renklerini göstermek için aynı çizimin yakınlaştırılmasını gösterir (M annedir; D1 ve D2 30 dk/kare ve 60 dk/üçgen) kız çocuklarıdır. Ölçek çubukları = 30 μm (C), 20 μm (D1), 16 μm (D2), ve 5 μm (F1). C, D ve F'de dTomato kırmızı, YFP yeşil ve CFP mavi olarak kodlanır. Görüntüler Brockway ve ark.11izni ile yeniden basıldı . Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İnterkinetik nükleer göç ve bölme geçiren hücrelerin birden fazla komşu klonları ayırt Brainbow renk kodlama ile birlikte vivo görüntüleme de zaman atlamalı. (A) 2 dpf (55 hpf; A1) ve 3 dpf (71 hpf; A2); sırasıyla 62 μm ve 47 μm'yi temsil eden maksimum yoğunluk projeksiyonları. Her zaman noktasında üç renk kodlu radyal küme ok başları ile tanımlanır. (B) A1 ve A2'deki tüm Brainbow etiketli hücrelerin rengi, B 1ve B2 'deki (n = 106 hücre, 119 hücre) ilgili üçüncül çizimlerdeki göreli kanal ağırlıkları olarak ölçüldü. (C) Zebrabalığı arka beyni 35 hpf'de Brainbow ile etiketlenmiştir (maksimum yoğunluklu projeksiyon 24 μm gösterir); kesik li beyaz kutu ile gösterilen inset, C'den arka beyinde 30 dk aralıklarla alınan zaman noktalarının D. (D) Serisinde gösterilen ilk kez noktadır. >9.5 saat bir süre gösterilir. Etiketli hücreler interkinetik nükleer göç egirdi; beyaz ok uçları apikal yüzeyde bir hücre gösterir. Hücre soma larının apikal yüzeyde yuvarlanması ve klon sayısındaki artış (örn. 5,5 saat ve sonra 8 saat kırmızı hücre) mitotik bir olay olarak kabul edildi. (E) Zebra balığının 30.5 hpf'de arka beyninin dorsolateral görünümü, beyaz kesikli ve noktalı çizginin başın yaklaşık sınırını gösterdiği Brainbow ile etiketlenir ve beyaz kesikli kutu f. (F) E'den arka beyinde 30 dk aralıklarla alınan zaman noktalarının ilk zaman noktasında gösterilen inset'i gösterir. 1.5 saat boyunca, beyaz ok başları tarafından belirtilen iki mavi hücre apikal yüzeye hareket ve mitoz geçiren görülebilir, iki ata hücreleri içeren bir klon düşündüren. Ölçek çubuğu = 20 μm (A), 25 μm (C) ve 20 μm (F). A-D'de dorsal yukarı, rostral soldadır. E ve F'de rostral soldadır. Tüm görüntülerde dTomato kırmızı, YFP yeşil ve CFP mavi olarak kodlanır. Görüntüler Brockway ve ark.11izni ile yeniden basıldı . Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Zaman atlamalı Brainbow görüntüleme ventriküler zondaki hücrelerin in vivo hücre ölümü geçiren gösterir. (A) Zebrabalığı arka beyni 31 hpf'de Brainbow ile etiketlenmiştir (maksimum yoğunluklu projeksiyon 36 μm'yi temsil eder). Beyaz kesikli kutu, B. (B) A'da arka beyni 30 dk aralıklarla gösteren zaman noktalarının ilk zaman noktasında gösterilen inset'i gösterir. İlk panelde beyaz ok ucu sonraki panellerde gösterildiği gibi apoptoz yapıldı bir lavanta hücre gösterir, apoptotik organların kademeli açıklık takip hücre parçalanması ile gösterilir. Komşu etiketli hücreler boyunca sağlıklı göründü. Dorsal yukarı ve rostral solda. Ölçek çubuğu = 20 μm (B). Tüm görüntülerde dTomato kırmızı, YFP yeşil ve CFP mavi olarak kodlanır. Görüntüler Brockway ve ark.11izni ile yeniden basıldı . Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, gelişmekte olan zebra balığı arka beyninde progenitor hücreleri ve nöronların klonlarını görselleştirmek ve Brainbow ve zaman atlamalı konfokal mikroskopi11kullanarak in vivo onları takip etmek için bir yöntem açıklar. Bu protokolün in vitro veya ex vivo çalışmalara kıyasla en büyük avantajı, omurgalı beyninin proliferatif bölgesini zaman içinde doğal ortamında doğrudan gözlemleyebilme yeteneğidir. Bu teknik retroviral vektörler kullanarak tek bir klon etiketli önceki çalışmalar üzerine inşa edilmiştir. Buna karşılık, hspkullanımı :Zebrabow aynı anda birçok klonlar renk kodları inşa, multipleks soy izleme ve klonlar arasında dinamikleri bir odak sağlayan11. Bu protokol, diğer sistemlerde veya hücre türlerinde geliştirmeye odaklanacak şekilde değiştirilebilir. Örneğin, farklı Brainbow yapıları zebra balığı embriyolarında ifade edilebilir. Hspzebrabalığı hsp70 organizatörü kullanımı :Zebrabow Nöral atalar ve nöronlar 11 de dahil olmak üzere ısı şoku aşağıdaki hücre türlerinin çeşitli mozaik etiketleme neden olacak11, ve gen ekspresyonu üzerinde araştırmacılar zamansal kontrol sağlar29. Diğer organizatörler açıkça bu şekilde hücre soyundan çizgi olmayabilir ise ısı şok organizatörü kullanımı sürekli renk kodlu klonlar etiketleri unutulmamalıdır. Klonal kimlik ilgi çekici bir faktör olmadığında, belirli hücre türlerini etiketlemek için diğer organizatörleri kullanan yapılar kullanılabilir. Örneğin, nöroD organizatörü olgunlaşmamış nöronlar etiketlemek için kullanılabilir18,49. Ayrıca, yerine mikroenjeksiyonlar gerçekleştirmek, araştırmacılar transgenik Brainbow zebra balığı kullanmayı seçebilirsiniz, Tg gibi çizgiler de dahil olmak üzere (ubi:Zebrabow)15 ve Tg (nörod:Zebrabow)18. Bu durumda, Tg(hsp:Crea134)15gibi Cre rekombinaz ifade çizgileri haçlar, toplanan ve benzer bir şekilde muhafaza enjekte edilmemiş embriyolar üretmek. Bu protokol balıkları 1-3 dpf arasında görüntülemek için tasarlanırken, gelişimsel nörogenezin50'ninana dönemine denk gelecek şekilde zebra balığı ilginin gelişim evresine bağlı olarak daha uzun süre muhafaza edilebilir. Ancak, 24 hpf önce Brainbow ifade neden ısı şoku embriyolar için daha zararlı olabilir51. Yaşve ilgi dokusuna bağlı olarak, hedeflenen dokunun doğru yönlendirilmesi için farklı montaj stratejileri uygun olacaktır.
Özellikle protokolde değişiklikler yapılıyorsa, sorun giderme gerektirebilecek birkaç adım vardır. Dna konsantrasyonu, bolus boyutu enjekte edilen ve embriyo başına teslim edilen toplam DNA miktarı, Brainbow ekspresyonu loş veya seyrek ise veya embriyolar sağlıklı görünmüyorsa ayarlanabilir. Ayrıca, istenilen ifade elde edilmezse ısı şoku adımının uzunluğu ve zamanlaması değiştirilebilir. Görüntülemede kullanılan edinme parametreleri, mevcut lazer çizgileri ve filtrelerin yanı sıra ifade, montaj ve istenen analiz türüparlaklığına bağlı olarak değişir. Ayrıca, zaman atlamalı parametreler, ilgi olaylarının hızına ve tek bir Z yığını elde etmek için gereken zamana bağlı olarak ayarlanmalıdır. Protokoldeki en kritik adımlardan biri balığın agarose'a uygun şekilde monte edilmesidir: balığın açısı uygun değilse veya balık çok fazla agarose ile kaplıysa, optimal görüntüleme mümkün olmayacaktır. Bu tekniğin optimizasyonu biraz pratik alabilir. Ayrıca, konfokal mikroskop üzerinde FP ifadesini görüntülemeden önce montajın uygun olup olmadığını belirlemek zor olabileceğinden, görüntülemeden önce birden fazla balık monte etmek genellikle yararlıdır. Bir diğer kritik adım da görüntülenecek belirli balıkların taranması ve seçilmesidir. Mikroenjeksiyonlar, parlaklık, etiketleme yoğunluğu ve Brainbow kopya numarası gerçekleştiriyorsa balıklar arasında önemli ölçüde farklılık gösterebilir. Loş etiketleme, aşırı yoğun etiketleme veya az renkle sonuçlanan düşük kopya numarası ile balıklarda çekilen görüntüleri analiz etmek daha zor olabilir.
Bu protokol ile 16 saat11'ekadar yaşayan zebra balıklarını sürekli olarak görüntüleyebildik. Bu süre görüntüleme odasından E3 buharlaşma ile sınırlı olabilir, görüntüleme düzleminden balık büyüme, ölüm veya balık hareketi, ya da konfokal mikroskop zaman kullanıcı kısıtlamaları. Buharlaşma, mikroskop aşamasında ısı kontrollü bir aksesuar ın kullanılmasıyla azaltılabilir. Bu yaklaşım kullanılarak oluşturulan 5D veri kümelerinin önemli sabit disk alanı (örneğin, bir gecede zaman atlamalı için ~100 GB'a kadar) ve analiz etmek için yeterli bilgi işlem gücü gerektiren büyük dosyalar olma eğiliminde olduğu unutulmamalıdır.
Bu protokol, araştırmacılara, gelişmekte olan zebra balığı beynindeki nöral atalar ve kız nöronlar popülasyonu içinde renk kodlu klonları görselleştirmeleri ve zaman içinde dinamiklerini izlemeleri için rehberlik eder. Olası genişlemelerden biri, brainbow hızlandırılmış görüntülemeile uzak kırmızı FP etiketlemesinin kombinasyonudur ve gelişimdeki belirli genlerin rollerini değerlendirmek için18. Bu şekilde, manipüle edilmiş genleri ifade eden klonlar farklı bir renkte görüntülenebilir, zaman içinde izlenebilir ve Brainbow etiketli, manipüle edilmemiş komşu klonlara kıyasla. In vivo çok renkli görüntüleme sinir sistemi formları ve fonksiyonları hakkında önemli mekanik sorulara cevap vermek için kullanılabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Y. A. Pan, J. Livet ve Z. Tobias'a teknik ve entelektüel katkıları için teşekkür ederiz. Bu çalışma Ulusal Bilim Vakfı (Ödül 1553764) ve M.J. Murdock Charitable Trust tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL transfer pipette (fine tip) | Globe Scientific, Inc. | 134020 | |
| 1-phenyl-2-thiourea (PTU) | Alfa Aesar | L06690 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| 50 mL conical tubes | Corning | 352070 | For heat shocking embryos |
| 6 lb nylon fishing line | SecureLine | NMT250 | For making embryo manipulators |
| 7.5 mL transfer pipet | Globe Scientific, Inc. | 135010 | |
| CaCl2 | Sigma | C3881 | For E3 |
| Cotton swabs | Puritan | 867-WC NO GLUE | For making embryo manipulators |
| Cre recombinase | New England Biolabs | M0298M | |
| Digital dry bath | Genemate | 490016-616 | Used to store LMA at 42 °C |
| Epifluorescence dissection scope | |||
| Glass capillary tubes | World Precision Instruments | TW100F-4 | |
| Incubator | Forma Scientific | 3158 | To maintain embryos at 28 °C |
| Injection plate molds | Adaptive Science Tools | TU-1 | |
| Isotemp water bath | Fisher Scientific | 2320 | For heat shocking embryos |
| KCl | AMRESCO | 0395 | For E3 and for DNA solution for injections |
| Laser-scanning confocal microscope | Zeiss | LSM710 | |
| LE agarose | Genemate | E3120 | To create agarose injection plates |
| Low-melt agarose (LMA) | AMRESCO | J234 | |
| Mating tanks | Aquaneering, Inc. | ZHCT100 | |
| Methylene blue | Sigma | M9140 | For E3 |
| MgSO4 | Sigma | 9397 | For E3 |
| Micromanipulator | World Precision Instruments | M3301 | |
| Micropipette Puller | Sutter Instrument Co. | P-97 | |
| MS-222 Tricaine-S | Western Chemical, Inc. | Stock made at 4 mg/mL in reverse osmosis (RO) water, then added dropwise to E3 to final concentration of 0.2 mM to anesthetize embryos | |
| NaCl | J.T. Baker | 4058-01 | For E3 |
| Petri dishes (90 mm, 60 mm) | Genesee Scientific | 32-107G | To house embryos and create imaging chamber (60 mm) |
| Phenol red | Sigma | P0290 | |
| Soft stitch ring markers | Clover Needlecraft, Inc. | 354 | For creating imaging chamber with Petri dish |
| Super glue (Ultra gel control) | Loctite | 1363589 | For making embryo manipulators |
| Syringe needles | Beckton Dickinson | BD329412 | For dechorionating embryos |
Referanslar
- Lyons, D. A., Guy, A. T., Clarke, J. D. W. Monitoring neural progenitor fate through multiple rounds of division in an intact vertebrate brain. Development. 130, 3427-3436 (2003).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Florio, M., Huttner, W. B. Neural progenitors, neurogenesis and the evolution of the neocortex. Development. 141, 2182-2194 (2014).
- Mcconnell, S. K. Constructing the Cerebral Cortex: Neurogenesis and Fate Determination Review. Neuron. 15, 761-768 (1995).
- Schmidt, R., Strähle, U., Scholpp, S. Neurogenesis in zebrafish - from embryo to adult. Neural Development. 8, 3(2013).
- Chenn, A., Walsh, C. Regulation of Cerebral Cortical Size by Control of Cell Cycle Exit in Neural Precursors. Science. 297 (5580), 365-369 (2002).
- Lui, J. H., Hansen, D. V., Kriegstein, A. R. Development and Evolution of the Human Neocortex. Cell. 146 (1), 18-36 (2011).
- Nonaka-Kinoshita, M., et al. Regulation of cerebral cortex size and folding by expansion of basal progenitors. The EMBO Journal. 32, 1817-1828 (2013).
- Homem, C. C. F., Repic, M., Knoblich, J. A. Proliferation control in neural stem and progenitor cells. Nature Reviews Neuroscience. 16 (11), 647-659 (2015).
- Brockway, N. L., et al. Multicolor lineage tracing using in vivo time-lapse imaging reveals coordinated death of clonally related cells in the developing vertebrate brain. Developmental Biology. 453 (2), 130-140 (2019).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2015).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140, 2835-2846 (2013).
- Ko, S. K., Chen, X., Yoon, J., Shin, I. Zebrafish as a good vertebrate model for molecular imaging using fluorescent probes. Chemical Society Reviews. 40, 2120(2011).
- Kesavan, G., Hammer, J., Hans, S., Brand, M. Targeted knock-in of CreERT2 in zebrafish using CRISPR/Cas9. Cell and Tissue Research. 372, 41-50 (2018).
- Cook, Z. T., et al. Combining near-infrared fluorescence with Brainbow to visualize expression of specific genes within a multicolor context. Molecular Biology of the Cell. 30 (4), 491-505 (2019).
- Kuwata, M., Nikaido, M., Hatta, K. Local heat-shock mediated multi-color labeling visualizing behaviors of enteric neural crest cells associated with division and neurogenesis in zebrafish gut. Developmental Dynamics. 248, 437-448 (2019).
- Kinkhabwala, A., et al. A structural and functional ground plan for neurons in the hindbrain of zebrafish. Proceedings of the National Academy of Sciences. 108 (3), 1164-1169 (2011).
- Heap, L. A., Goh, C. C., Kassahn, K. S., Scott, E. K. Cerebellar Output in Zebrafish: An Analysis of Spatial Patterns and Topography in Eurydendroid Cell Projections. Frontiers in Neural Circuits. 7, 53(2013).
- Robles, E., Filosa, A., Baier, H. Precise Lamination of Retinal Axons Generates Multiple Parallel Input Pathways in the Tectum. The Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Dirian, L., et al. Spatial Regionalization and Heterochrony in the Formation of Adult Pallial Neural Stem Cells. Developmental Cell. 30, 123-136 (2014).
- Chen, X. A., et al. Behavioral/Cognitive QRFP and Its Receptors Regulate Locomotor Activity and Sleep in Zebrafish. The Journal of Neuroscience. 36 (6), 1823-1840 (2016).
- Albadri, S., De Santis, F., Di Donato, V., Del Bene, F. CRISPR/Cas9-Mediated Knockin and Knockout in Zebrafish. Genome Editing in Neurosciences. Jaenisch, R., Zhang, F., Gage, F. , Springer. Cham, Switzerland. 41-49 (2017).
- Furlan, G., et al. Life-Long Neurogenic Activity of Individual Neural Stem Cells and Continuous Growth Establish an Outside-In Architecture in the Teleost Pallium. Current Biology. 27, 3288-3301 (2017).
- Herget, U., Arturo Gutierrez-Triana, J., Salazar Thula, O., Knerr, B., Ryu, S. Single-cell reconstruction of oxytocinergic neurons reveals separate hypophysiotropic and encephalotropic subtypes in larval zebrafish Brainbow-guided morphology of oxytocinergic cells. eNeuro. 4 (1), (2017).
- Halloran, M. C., et al. Laser-targeted gene expression. Development. 127, 1953-1960 (2000).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50, 401-406 (2008).
- Luskin, M. B., Pearlman, A. L., Sanes, J. R. Cell lineage in the cerebral cortex of the mouse studied in vivo and in vitro with a Recombinant Retrovirus. Neuron. 1 (8), 635-647 (1988).
- Price, J., Thurlow, L. Cell lineage in the rat cerebral cortex: a study using retroviral-mediated gene transfer. Development. 104, 473-482 (1988).
- Walsh, C., Cepko, C. L. Widespread dispersion of neuronal clones across functional regions of the cerebral cortex. Science. 255 (5043), 434-441 (1992).
- Walsh, C., Cepko, C. L. Clonal dispersion in proliferative layers of developing cerebral cortex. Nature. 362 (6421), 632-635 (1993).
- Cai, L., Hayes, N. L., Nowakowski, R. S. Synchrony of Clonal Cell Proliferation and Contiguity of Clonally Related Cells: Production of Mosaicism in the Ventricular Zone of Developing Mouse Neocortex. The Journal of Neuroscience. 17 (6), 2088-2100 (1997).
- Reznikov, K., Acklin, S. E., Van Der Kooy, D. Clonal Heterogeneity in the Early Embryonic Rodent Cortical Germinal Zone and the Separation of Subventricular From Ventricular Zone Lineages. Developmental Dynamics. 210, 328-343 (1997).
- Qian, X., Goderie, S., Shen, Q., Stern, J., Temple, S. Intrinsic programs of patterned cell lineages in isolated vertebrate CNS ventricular zone cells. Development. 125, 3143-3152 (1998).
- McCarthy, M., Turnbull, D. H., Walsh, C. A., Fishell, G. Telencephalic Neural Progenitors Appear to Be Restricted to Regional and Glial Fates before the Onset of Neurogenesis. The Journal of Neuroscience. 21 (17), 6772-6781 (2001).
- Yu, Y. C., Bultje, R. S., Wang, X., Shi, S. H. Specific synapses develop preferentially among sister excitatory neurons in the neocortex. Nature. 458 (7237), 501-504 (2009).
- Nusslein-Volhard, C., Dahm, R. Zebrafish. , Oxford University Press. Oxford, UK. (2002).
- Nasiadka, A., Clark, M. D. Zebrafish Breeding in the Laboratory Environment. ILAR Journal. 53 (2), 161-168 (2012).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. Journal of Visualized Experiments. 25, e1115(2009).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- R Core Team. R: A language and environment for statistical computing. , (2017).
- Smith, M. R. Ternary: an R package to generate ternary plots. , (2017).
- Baye, L. M., Link, B. A. Development/Plasticity/Repair Interkinetic Nuclear Migration and the Selection of Neurogenic Cell Divisions during Vertebrate Retinogenesis. The Journal of Neuroscience. 27 (38), 10143-10152 (2007).
- Leung, L., Klopper, A. V., Grill, S. W., Harris, W. A., Norden, C. Apical migration of nuclei during G2 is a prerequisite for all nuclear motion in zebrafish neuroepithelia. Development. 139, 2635(2012).
- Kerr, J. F. R., Wyllie, A. H., Curriet, A. R. Apoptosis: A Basic Biological Phenomenon with Wide-ranging Implications in Tissue Kinetics. British Journal of Cancer. 26, 239(1972).
- Cole, L. K., Ross, L. S. Apoptosis in the Developing Zebrafish Embryo. Developmental Biology. 240, 123-142 (2001).
- Liao, J., He, J., Yan, T., Korzh, V., Gong, Z. A Class of NeuroD-Related Basic Helix-Loop-Helix Transcription Factors Expressed in Developing Central Nervous System in Zebrafish. DNA and Cell Biology. 18 (4), 333-344 (1999).
- Trevarrow, B., Marks, D. L., Kimmel, C. B. Organization of hindbrain segments in the zebrafish embryo. Neuron. 4 (5), 669-679 (1990).
- Yabu, T., Todoriki, S., Yamashita, M. Stress-induced apoptosis by heat shock, UV and gamma-ray irradiation in zebrafish embryos detected by increased caspase activity and whole-mount TUNEL staining. Fisheries Science. 67, 333-340 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır