Method Article
Визуализация развивающегося мозга в жизни зебрафиш с помощью Brainbow и замедленного Confocal imaging
В этой статье
Резюме
In vivo изображение является мощным инструментом, который может быть использован для исследования клеточных механизмов, лежащих в основе развития нервной системы. Здесь мы описываем метод использования замедленной конфокальной микроскопии для визуализации большого количества многоцветных Brainbow-маркированных клеток в режиме реального времени в развивающейся нервной системе зебры.
Аннотация
Развитие позвоночной нервной системы требует точной координации сложного клеточного поведения и взаимодействий. Использование методов визуализации с высоким разрешением vivo может обеспечить четкое окно в эти процессы в живом организме. Например, за делением клеток и их потомством можно следовать в режиме реального времени по мере образования нервной системы. В последние годы технические достижения в области многоцветных методов расширили типы вопросов, которые могут быть исследованы. Многоцветный подход Brainbow может быть использован не только для различения между подобными клетками, но и для цветового кода нескольких различных клонов родственных клеток, каждый из которых происходит из одной клетки-прародителя. Это позволяет мультиплекс линии анализа многих различных клонов и их поведения одновременно во время разработки. Здесь мы описываем метод использования замедленной конфокальной микроскопии для визуализации большого количества многоцветных Brainbow-маркированных клеток в реальном времени в развивающейся нервной системе зебры. Это особенно полезно для следующих клеточных взаимодействий между клетками, которые трудно обозначить дифференциально с помощью традиционных промоутер-управляемых цветов. Наш подход может быть использован для отслеживания отношений линии между несколькими различными клонами одновременно. Большие наборы данных, генерируемые с помощью этого метода, предоставляют богатую информацию, которую можно количественно сравнить с генетическими или фармакологическими манипуляциями. В конечном счете полученные результаты могут помочь ответить на систематические вопросы о том, как развивается нервная система.
Введение
На ранних стадиях развития пулы специализированных клеток-прародителей делятся повторно в пролиферативных зонах, производя различные массивы дочерческих клеток. Клетки, рожденные в течение этого периода развития, затем дифференцируются и путешествуют, чтобы сформировать зарождающиеся органы. В нервной системе, прародители, такие как радиальная глия привести к незрелых нейронов в желудочковых зонах. По мере того как нейроны мигрируют от желудочков и созревают, расширяющаяся ткань в конечном итоге образует очень сложные структуры мозга1,,2,,33,44,6,. Координация между декорациями и дифференциации и миграции нейронов будет определять возможный размер, форму, и, следовательно, функции мозга, непосредственно влияющих на поведение7,8,9,10. Хотя жесткий контроль над этими процессами, безусловно, имеет решающее значение для нормального развития мозга, глобальные механизмы, которые регулируют эти динамики, не очень хорошо изучены. Здесь мы описываем инструмент для изучения развития нервной системы в клеточном разрешении, что позволяет исследователям визуализировать клетки-прародителя и нейроны in vivo в развивающемся мозге зебры с Brainbow и отслеживать их поведение с течением времени с помощью замедленной конфокальной микроскопии11. Этот подход также может быть адаптирован для визуализации других частей развивающегося эмбриона.
Чтобы наблюдать и различать среди клеток в развивающемся мозге зебры, мы адаптировали метод маркировки клеток Brainbow11. Brainbow использует случайно определенные, комбинаторные выражения трех различных флуоресцентных белков (FPs) для обозначения популяции клеток. В то время как выражение мракли иэкспрессии по умолчанию для экспрессии Brainbow является красным FP dTomato, рекомбинация фермента Cre recombinase приводит к экспрессии мцерулеана (циановый флуоресцентный белок, CFP) или желтый флуоресцентный белок (YFP)12,13. Совокупное количество каждого FP, выраженное в ячейке, придает ему уникальный оттенок, позволяющий четко ею визуальное различие с соседними клетками. Кроме того, когда клетка-прародитель делится, каждая клетка дочери унаследует цвет от своей материнской клетки, производя цветные клоны и позволяя исследователям отслеживать линию клеток11,14. Хотя первоначально используется для анализа нейронных схем у мышей12, Brainbow с тех пор было выражено в широком спектре типовых организмов, в том числе зебрафиш15.
Наша техника основывается на предыдущих методах многоцветной маркировки и визуализации, чтобы непосредственно изображения нескольких цветовых клонов с течением времени в живых зебры. Из-за их оптической прозрачности, как эмбрионы, зебра хорошо подходит для визуализации экспериментов16, и предыдущие исследования использовали Brainbow в зебры для изучения различных тканей, в том числе нервной системы11,15,17,18,19,20,21,22,23,24,25, 26,27. Способность непосредственно к изображению в живой организм, наряду с их быстрым развитием экс-утробы, делают зебры ценной моделью развития позвоночных. В отличие от мозга млекопитающих, вся пролиферативная зона заднего мозга зебры легко доступна для визуализации без нарушения его эндогенной среды6. Это позволяет проводить эксперименты в живом организме, а не в экстракорпорированных или стационарных препаратах тканей. В отличие от экспериментов с фиксированной визуализацией, исследования in vivo позволяют продольную конструкцию, производя многочасовые данные, которые могут быть проанализированы на модели, тем самым увеличивая вероятность наблюдения относительно редких событий. В зависимости от скорости и длины событий, представляющих интерес, исследователи могут выбрать для выполнения коротких (1-2 ч) или длинные (до 16 ч) эксперименты по визуализации по времени. С помощью зебры теплового шока промоутер 70 (hsp70, hsp), Brainbow выражение может быть временно контролируется28,29. Кроме того, мозаика выражение индуцированных этот промоутер хорошо подходит для маркировки и отслеживания многих клонов11.
Способность визуально идентифицировать несколько клонов в живом мозге является преимуществом этого метода. Важные предыдущие исследования, которые исследовали роль клонов в развитии нервной системы использовали ретровирусные векторы для обозначения одной клетки-прародителя и ее потомства с помощью одного FP или другого легко визуализированного белка. Такая маркировка позволяет исследователям наблюдать один клон с течением времени, либо in vitro или in vivo22,30,,31,,32,,33,,34,,35,,36,,37,,38. В отличие от методов отслеживания поведения клеток в пределах одного клона, различные цвета Brainbow позволяют исследователям наблюдать динамику среди клонов. Кроме того, с помощью Brainbow для обозначения многих клонов в головном мозге, дополнительные данные о клональном поведении собираются по отношению к методам, которые маркировать один клон11. Важно отметить, что описанные здесь подходы могут быть расширены для создания сравнения развития между рыбами, которые подверглись различным генетическим или фармакологическим манипуляциям18. В целом, эти преимущества делают промежуток времени в vivo confocal изображения Brainbow-выражения зебры идеально подходит для исследователей, исследующих развитие позвоночной нервной системы, особенно тех, кто заинтересован в роли клонов.
протокол
Процедуры, касающиеся животных, были одобрены Институциональным комитетом по уходу за животными и использованию (IACUC) в Колледже Льюиса и Кларка.
1. Микроинъекция эмбрионов зебрафиш
- Настройка дикого типа, взрослых зебры в секс-сегрегированных спаривания танков во второй половине дня до выполнения микроинъекций39,40.
- Подготовьте раствор ДНК утром микроинъекций. Разбавить hsp:Зебрабоу11 плазмид ДНК в концентрации 10 нг / Л в 0,1 мМ KCl, наряду с 2,5% фенола красного и 3,75U Cre recombinase фермента.
- Выполните микроинъекции раствора ДНК в одноклеточные эмбрионы зебры в течение 45 минут после оплодотворения39,41. Впрысните примерно 4,2 нл этого раствора в каждый эмбрион, что эквивалентно 42 пг плазмидной ДНК.
ПРИМЕЧАНИЕ: Микроинъекция шаг может быть опущен, если трансгенные, Brainbow-выражения зебры линии спариваются вместо, таких, как Tg (ubi:Зебрабоу)15 и Tg (нейрод: Зебрабоу)18. Выполнение микроинъекций может быть выгодным, поскольку это позволяет исследователям титрать номер копии и плотность маркировки. Кроме того, вторая конструкция ДНК, которая теги или манипулирует конкретный продукт гена могут быть введены наряду Brainbow при желании (например, далеко-красный флуоресцентный белок, который дополняет Brainbow18). - Поддержание инъекционных эмбрионов в чашках Петри средней39 в инкубаторе 28 градусов по Цельсию в течение 24 ч.
2. Теплошок, чтобы вызвать выражение Brainbow
ПРИМЕЧАНИЕ: Если плазмид ДНК вводили или трансген выразил не использует hsp70 промоутер для привода выражение, шаг теплового шока может быть пропущен, и здоровые эмбрионы должны быть немедленно переданы фенилтиурии (PTU) на 24 ч после оплодотворения (hpf).
- На 24 л.с., отбирать мертвые и деформированные эмбрионы из группы инъекционных эмбрионов. Затем перенесите здоровые эмбрионы в трубку 50 мл с до 20 эмбрионами/трубкой.
- Заполните трубки 10 мл E3. Поместите крышку поверх каждой трубки, но не плотно закрывайте.
- Поместите трубку стойку, содержащую 50 мл труб вертикально в 37 градусов по Цельсию водяной бане. Убедитесь, что уровень воды в ванне выше уровня E3 в трубах и оставить их на 80 до 90 мин.
- Снимите стойку трубки с эмбрионами из водяной ванны и вернитесь в инкубатор 28 градусов в вертикальном положении. Дайте E3 остыть до 1 ч, а эмбрионы постепенно переобезождениваются к температуре. Затем перенесите эмбрионы в петри блюда 0,2 мМ ПТУ в E3, разогретые в инкубаторе для предотвращения пигментации эмбрионов.
ПРЕДЕКТО: ПТУ является токсичным химическим веществом, которое должно быть обработано с осторожностью и утилизироватьнадлежащим образом. Ношение перчаток предлагается.
3. Скрининг эмбрионов для экспрессии brainbow
- При температуре 2-4 ч после теплового шока исследуете эмбрионы под стандартным флуоресценцией для выражения CFP или YFP, что указывает на успешную рекомбинацию Brainbow (от выражения по умолчанию dTomato).
ПРИМЕЧАНИЕ: При наличии нескольких вариантов флуоресценции скрининг для CFP является наиболее эффективным способом выявления хорошо рекомбинированных рыб. Если фильтры CFP и YFP отсутствуют, YFP также может быть смутно визуализирован под зелеными флуоресцентными фильтрами белка (GFP) из-за перекрытия в их спектральных профилях. - Выберите эмбрионы с надежной экспрессией FP во всем и перенесите в отдельное блюдо с PTU. Изображение эмбрионов на 1 день после оплодотворения (dpf; 28 л.с. или более поздно) или поддерживать эмбрионы в ПТУ и изображение на 2 или 3 dpf.
4. Монтаж эмбрионов для In Vivo изображений
-
Перед днем эксперимента подготовьте камеру изображения и инструмент манипуляции эмбрионами.
- Подготовьте камеру изображения, тщательно supergluing пластиковое кольцо в центре 60 мм Чашка Петри.
- Дополнительно, подготовить пользовательские эмбриона манипулятор для перемещения эмбрионов в блюдо и ориентировать эмбрионы во время монтажа. Постройте манипулятор, суперклеить небольшую длину нейлоновой лески (No 1/2 дюйма, 6 фунтов) до конца деревянной ватной тампон палкой, которая была разрезана до 4 фунтов в длину.
- При необходимости (т.е. визуализация при 2 dpf или ранее), перед монтажом эмбрионов дехорионат с помощью шприцев под микроскопом вскрытия.
-
Анестезия эмбрионов зебры.
- Заполните блюдо Петри на полпути с E3 и добавьте 5-6 капель 4 мг/мл MS-222 Tricaine-S до конечной концентрации 0,2 мм. Вихрь для смешивания.
ПРЕДЕКТО: Трикан должен быть обработан с осторожностью и утилизировать надлежащим образом. - Перенос эмбрионов из ПТУ в трикаин-раствор, обеспечивая как можно меньше ПТУ. В то время как рыбные рефлексы должны прекратиться после 1-2 мин, оставьте эмбрионы в трикаине на срок до 10 мин, чтобы обеспечить тщательную анестезию для экспериментов по визуализации замедленного времени.
- Подтвердите, что эмбрионы должным образом обезотаны. Оцените рефлекс испуга, нежно коснувшись хвостов эмбриона с помощью эмманитора эмбриона. Если наблюдается рефлекторное движение, добавьте дополнительную каплю трикаина в блюдо как можно дальше от эмбрионов и закружите, чтобы перемешать. Наблюдайте за частотой сердечных приступов эмбриона в рамках вскрытия. Если это аномально медленно, добавить дополнительные капли E3 в блюдо, чтобы уменьшить концентрацию трикаина.
- Заполните блюдо Петри на полпути с E3 и добавьте 5-6 капель 4 мг/мл MS-222 Tricaine-S до конечной концентрации 0,2 мм. Вихрь для смешивания.
-
Гора анестезируемых эмбрионов в агарозе.
- Перенесите рыбу в центр пластикового кольца в камере изображения и удалите как можно больше излишков E3 с помощью тонкой наконечником передачи пипетки.
- Используя чистую передачу пипетки, накройте рыбу 1,0% низкорасплавленной агарозой (LMA) в E3, хранящейся при температуре 42 градусов по Цельсию, и заполните все пластиковое кольцо тонким слоем агарозы. Используйте передачу пипетки, чтобы аккуратно тянуть эмбрионы в кончик пипетки и обратно в агарозу без введения пузырьков воздуха.
- Прежде чем агароза затвердеет, быстро используйте эмапулитор эмбриона, чтобы сориентировать рыбу соответствующим образом. Если изображение с вертикально микроскопом, положение эмбрионов как можно ближе к верхней поверхности агарозы, как это возможно. Расположите эмбрионы параллельно нижней части камеры изображения с хвостом прямо.
ПРИМЕЧАНИЕ: Для визуализации заднего мозга эмбрионы могут быть расположены в предсталом или сагитальном виде. Следует позаботиться о том, чтобы головы эмбрионов не тонули, пока агароза все еще жидкая. Другие ориентации могут быть уместны для ориентации других развивающихся тканей для визуализации. Для перевернутых микроскопов, монтаж будет сделано по-разному, как правило, позиционирование рыбы близко к нижней части стеклянного дна Чашка Петри.
- Подождите, пока агароз затвердеет, а затем заполнить камеру изображения с E3. Добавьте как можно больше E3, чтобы учесть испарение в ходе визуализации.
5. Временной промежуток Confocal Изображений развития зебрафиш Hindbrain
-
Поместите камеру изображения на конфокальный микроскоп в рамках подготовки к визуализации.
- Поместите камеру изображения с рыбой и E3 на конфокальный микроскоп.
- Выберите цель с высокой численной диафрагмой и большим рабочим расстоянием, например, цель погружения в воду в 20 раз (1.0 NA).
- Найдите область с соответствующей плотной и яркой маркировкой типов клеток (ы) интересующего.
ПРИМЕЧАНИЕ: Температура контролируемой стадии / аппарата на микроскопе также может быть использован для регулирования температуры и влажности во время длительных сеансов изображения. Это может уменьшить испарение.
-
Настройка параметров приобретения для визуализации Brainbow.
- Изображение каждого канала FP последовательно. При использовании коммерческого программного обеспечения (например, программное обеспечение Дзэн), это делается путем подготовки трех "треков". Используйте аргонный лазер, чтобы возбудить CFP на 458 нм и YFP на 514 нм. Используйте лазер DPSS 561 нм, чтобы возбудить dTomato. Сбор выбросов между 463-509 нм для CFP, 519-555 нм для YFP, и 566-691 нм для dTomato.
- Для экранного отображения код CFP как синий, YFP как желтый, и dTomato как красный.
ПРИМЕЧАНИЕ: Эти настройки будут варьироваться в зависимости от того, какие лазерные линии и другие функции доступны на конфокальный микроскоп. Чтобы увеличить скорость визуализации, каналы CFP и dTomato могут быть отображаны одновременно без заметного кровотечения через. Если также образуется отдельный FP, например, ультракрасный FP, это может быть изображено последовательно или одновременно с YFP. - Навязайте общие параметры изображения, чтобы сделать 16-битные изображения с разрешением не менее 1024 x 1024 и в среднем в два раза. Отрегулируйте зум в зависимости от области и типа ячейки (т.е. для изображения заднего мозга с целью 20x, зум будет варьироваться от 1,0 до 2,5). Максимальное поле зрения, чтобы обеспечить рост рыбы с течением времени.
- Просмотр одного трека за один раз (и выключения других лазеров для предотвращения фотоотбелевания), оптимизировать настройки приобретения для каждого FP индивидуально (например, лазерная мощность, размер пинхола, прирост трубки фотомультипликатора и т.д.).
- Выберите диапазон стеков для изображения.
ПРИМЕЧАНИЕ: Для длительных сеансов визуализации (Nogt;2 h), примите во внимание, что рыба будет продолжать расти на протяжении всего курса изображения, таким образом, как поле XY, так и диапазон стеков должны учитывать это с дополнительным пространством. Если изображение заднего мозга, включают пространство в поле для ткани двигаться ростоцельно в период визуализации. Пространство также должно быть включено для роста в измерении К. Включите в изображение примерно 10-20 мкм выше области интереса, будь то рыба расположена для sagittal или дорсальный вид.
-
Настройка параметров для визуализации замедленного времени.
- Выберите временной интервал. Длина интервала колеблется от 10 до 30 минут для отслеживания митотических и апоптотических событий в развивающемся заднем мозге. Длина интервала будет варьироваться в зависимости от скорости событий, представляющих интерес, и общего времени, необходимого для захвата одного стека.
- Выберите продолжительность сеанса визуализации. Сеансы визуализации замедленного времени обычно происходят в одночасье и могут длиться не менее 16 ч.
-
Выполнить эксперимент.
ПРИМЕЧАНИЕ: Рыба может быть усыплена сразу же после изображения или тщательно вскрыты из агарозы с помощью шприцев и вернулся к E3, чтобы восстановиться. Восстановленные рыбы могут быть изображены снова на более позднем этапе времени, хотя положение клеток и глубина будет меняться в течение этого периода из-за общего роста.
6. Управление файлами замедленного управления
-
Импортфайл изображения в программное обеспечение анализа.
- При использовании программного обеспечения Дзэн сохраните файл в формате .czi после завершения приобретения изображения. Убедитесь в том, чтобы сохранить необработанные данные в формате, совместимом с Фиджи42 и / или другого программного обеспечения.
- Импорт в Фиджи программного обеспечения с помощью BioFormats Importer.
ПРИМЕЧАНИЕ: Файлы с покадровой успеваемое время будут большими и могут потребовать значительного количества времени и памяти для открытия для анализа. Таким образом, полезно быть стратегическим в том, как они сохраняются и открываются. Это может быть полезно, чтобы сохранить более низкого качества версии, которые могут быть открыты более легко для поиска событий, представляющих интерес на глаз.
- При использовании Фиджи создавайте меньшие и управляемые подмножества файлов замедленного времени. Генерировать подмножества либо по времени (например, просмотр полного стека в первой точке времени), либо по глубине (например, просмотр первых 50 секций в каждой временной точке) нажав изображение Стеки Инструменты Сделать Substack.
7. Количественный анализ цвета цвета Brainbow изображений
- Измерьте значения интенсивности среднего красного, зеленого и синего (RGB) для заинтересованных клеток фиджи.
ПРИМЕЧАНИЕ: Эти инструкции специфичны для анализа изображений на Фиджи. Тем не менее, исследователи могут предпочесть получить средние значения интенсивности RGB в альтернативной программе программного обеспечения.- Убедитесь, что файл правильно обрезан, так что нет черного пространства по краям изображения. Черное пространство искусственно снизит минимальные измерения интенсивности, необходимые для анализа. Если файл действительно нуждается в обрезании, выберите кнопку выбора rectangle и нарисуйте область интереса (ROI) вокруг поля зрения, исключая все черное пространство. Нажмите изображение(ru) Урожай.
- Установите инструмент измерения, чтобы взять среднее, минимальное и максимальное измерение серого значения. Нажмите Анализ(ru) Набор измерений. Убедитесь, что флажки для Мин и Макс Серый Значение и среднее значение серого оба выбраны.
- Просмотр необработанных файлов данных или подмножество стеков на Фиджи, найти ячейки, представляющие интерес для клонального анализа цвета. В заднем мозге, ориентировочным клонов можно визуально определить их общий оттенок, а также их радиальной ориентации. Не выбирайте ячейки, которые находятся в тесном контакте с, и, таким образом, трудно решить с соседними клетками другого цвета. Это может быть трудно количественно их оттенок.
- Найдите центральную плоскость ячейки интереса, используя панель свитков. Нажмите правой кнопкой Овального выбора и выберите эллиптический отбор кнопки. Другие инструменты отбора будут подходящими для различных типов клеток. Нарисуйте эллиптической рентабельности инвестиций вокруг центрального тела клетки.
- Используя C-scrollbar,выберите красный (dTomato) канал. Возьмите измерение средней интенсивности для этого канала, выбрав Анализ(ru) Мера. Повторите с той же рентабельностью инвестиций и фокусной плоскости для зеленых (YFP) и синих (CFP) каналов и сохранить все значения средней интенсивности.
- Нажмите в любом месте на изображении, чтобы удалить эллиптической рентабельности инвестиций в ячейке интереса.
- Для измерения фоновых уровней для нормализации используйте C-scrollbar и выберите красный (dTomato) канал. Возьмите измерения минимальной интенсивности для всего поля в этом канале, выбрав Анализ(ru) Мера. Повторите с той же фокусной плоскости для зеленых (YFP) и синих (CFP) каналов и сохранить все минимальные значения интенсивности.
- Рассчитайте относительные весы канала RGB для интересных ячеек.
ПРИМЕЧАНИЕ: Вычисление относительных весов канала RGB из этих значений интенсивности может быть выполнено в различных программ, таких как Microsoft Excel или R43.- Нормализовать измерение средней интенсивности рентабельности работы клеток для каждого канала путем вычитания минимальной интенсивности со всего поля в этом канале и фокусной плоскости.
- Сумма нормализованных значений интенсивности RGB от каждого канала, чтобы найти общую нормализованную интенсивность RGB для ячейки.
- Рассчитайте относительный вес канала для каждого канала, разделив нормализованное среднее значение интенсивности для этого канала на общую нормализованную интенсивность RGB.
- Отображение относительных весов канала RGB как тернари участки с помощью пакета Ternary для R43,44. Ternary участки полезны для визуализации кластеризации аналогичных цветов в 3D Пространстве RGB.
- Рассчитайте коэффициент распространения цвета, чтобы количественно определить разницу между цветами клеток.
- Рассчитайте евклидовое расстояние между двумя цветами в пространстве 3D RGB, используя следующее уравнение:
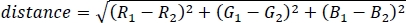
где R, G и B являются относительными весами канала RGB, рассчитанными в 7.2. - Для удобства понимания, нормализовать цветовое расстояние, разделив на 2 евро, максимально возможное расстояние между цветами, чтобы получить коэффициент распространения цвета между 0 и 1, где 0 указывает точно такой же цвет и 1 указывает на совершенно разные цвета (например, чисто красный и чисто синий).
- Рассчитайте евклидовое расстояние между двумя цветами в пространстве 3D RGB, используя следующее уравнение:
Результаты
В этом разделе иллюстрируются примеры результатов, которые можно получить с помощью описанного здесь многоцветного подхода in vivo. Мы показываем, что Brainbow цветные клоны клеток в пролиферативной желудочковой зоне развивающихся зебры задний мозг14 (Рисунок 1).
Как правило, когда Brainbow помечены клетки были расположены вдоль конкретного радиального волокна, они разделяют тот же цвет(рисунок 1D), которые могут быть количественно, как относительные веса канала RGB (Рисунок 1E). Это говорит о том, что эти радиальные группы были клонами деления клеток и что их аналогичный цвет может быть использован для идентификации их как клонально связанных, как это наблюдалось в предыдущих исследованиях в зебры, мыши, и цыпленок14,15. Когда плотность маркировки Brainbow относительно разреженная, это цветовое кодирование может быть использовано для четкой визуализации и отслеживания многих различных клонов радиальных в пролиферативных регионах живого позвоночных мозга.
Количественный анализ цвета показал, что дочерние клетки выразили тот же цвет, что и их мать (прародитель) клетка(рисунок 1F), но что соседние радиальные кластеры клеток можно отличить друг от друга11 (Рисунок 1E). Это означает, что за многочисленными клонами родственных клеток можно следить одновременно в течение часов in vivo(рисунок 2),что позволяет проводить анализ и сравнение мультиплексной линии. Количественная оценка выражения цвета в клонах на 2 dpf, а затем снова на 3 dpf(Рисунок 2A-B) показал, что выражение Brainbow также остается относительно постоянным от 2-3 дней in vivo11. Таким образом, отдельные клетки могут быть идентифицированы и отслежены в режиме реального времени в течение относительно длительных периодов времени во время разработки.
Time-lapse изображений показали многочисленные клетки, проходящие межкинетической ядерной миграции и деления клеток в период от 1-2 dpf(Рисунок 2C-F)11, что позволяет изучение клеточного цикла. Используя интервал замедленного времени в 30 минут, мы не всегда фиксировать митотическую фигуру во время деления клеток. Это ввело потенциальную ошибку до 30 мин к назначенному времени деления ячейки. Кроме того, мы наблюдали некоторые клоны, как представляется, содержат две клетки-прародителя (например, рисунок 2F). В рамках этих ограничений можно измерить длину клеточного цикла. Путем отслеживания отдельных Brainbow помечены прародителей с течением времени мы вычислили средний цикл клеток 8,4 и 1,5 ч, сопоставимые с предыдущими измерениями в зебрафиш1,45,46. Кроме того, используя метод визуализации времени Brainbow, мы также смогли наблюдать отдельные клетки, подвергающиеся стереотипным морфологическим изменениям, связанным с апоптозом(рисунок 3)11, такие как мембранное блевирование и фрагментация клеток47,48.
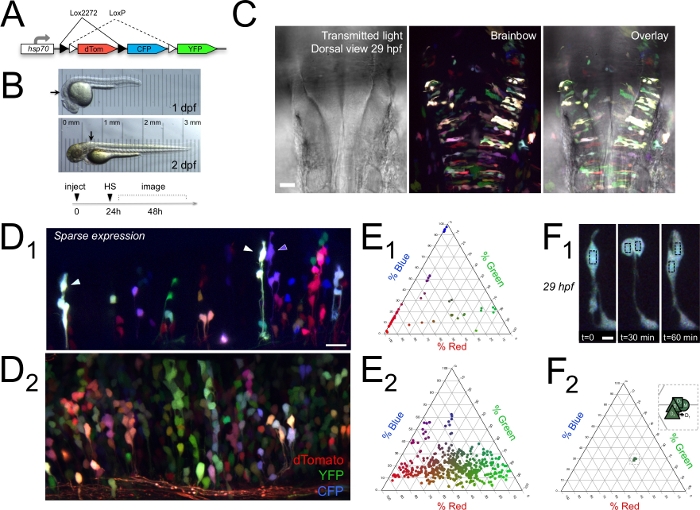
Рисунок 1: Brainbow помечены клонально связанных кластеров деления клеток в развивающихся задней мозг зебры. (A) Схема hsp:Зебрабоу (Brainbow) ДНК преходяще выражается в цветкоде клонов. (B) In vivo передает световые изображения развивающихся зебры на 1 и 2 dpf; стрелки указывают на общую область заднего мозга, предназначенную для визуализации. Прозрачность эмбрионов демонстрируется микрометром, расположенным под каждой рыбой. Экспериментальная шкала времени, показывающая инъекции на одноклеточной стадии, тепловой шок (HS) на уровне 24 л.с., и изображение от 1-3 dpf. (C) Дорсальный вид 29 л.с. зебрафиш задний мозг помечены Brainbow. Передаваемый световой канал показал морфологию заднего мозга и желудочка, наложенных с максимальной интенсивностью проекции клонов с оборальной меткой Brainbow, представляющих 165 мкм. Рострал встал. (D) In vivo Brainbow выражение в заднем мозге, показано в максимальной интенсивности прогнозов, представляющих 41 мкм в редко помечены 51 л.с. зебры (D1), и 81 мкм в 63,5 л.с. зебры (D2). В обеих панелях, дорсаль вверх и rostral находится влево. (E) Цвет клеток в D1 и D2 был количественно, как относительный вес канала в соответствующих ternary участков (n No 54 клетки E1; 461 клетки E2). (F)Цвет клетки остал относительно постоянн в клетках дочи следуя за разделением клетки. Серия временных точек, показывающих в ивио митотические события в заднем мозге 29 л.с. Brainbow-маркированных зебры более 1 ч(F1, максимальная интенсивность прогнозов, 30 мкм глубины). Цвет клеток матери и дочери, указанный черными ящиками в F1,представлен как относительный вес канала в тернаривном сюжете в F2. Всет показывает зум того же сюжета, чтобы показать плотно кластерные цвета ячеек (M является матерью; D1 и D2 - дочери на 30 мин/квадратах и 60 мин/треугольниках). Шкала баров 30 мкм (C), 20 мкм (D1), 16 мкм (D2), и 5 мкм (F1). В C, D и F dTomato кодируется как красный, YFP кодируется как зеленый, а CFP — как синий. Изображения перепечатаны с разрешения Brockway et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Time-lapse in vivo изображений в сочетании с Brainbow цветового кодирования отличается несколько соседних клонов клеток, проходящих межкинетической ядерной миграции и деления. (A) Цветные радиальные кластеры, помеченные задним мозгом одной рыбы, выражающей Brainbow на 2 dpf (55 л.с.; a 1) и 3 dpf (71 л.с.; а2); максимальная интенсивность прогнозов, представляющих 62 мкм и 47 мкм соответственно. Три цветных радиальных кластера идентифицируются с наконечниками стрел в каждой временной точке. (B) Цвет всех Brainbow-маркированных клеток в A1 и A2 был количественно оценен как относительный вес канала в соответствующих участках ternary в B1 и B2 (n - 106 ячеек, 119 ячеек). (C) Зебрафиш задний мозг на 35 л.с. помечены Brainbow (максимальная интенсивность проекции, показывающие 24 мкм); Вставка, указанная с пунктирной белой коробкой, является первой точкой времени, отображаемый в D. (D) Серия временных точек, взятых с интервалом 30 минут в заднем мозге от C. Показан период в размере 9,5 ч. Помеченные клетки подверглись межкинетической ядерной миграции; белые наконечники стрел указывают на ячейку на апкальной поверхности. Округление клеточной сомы на аптической поверхности и соответствующее увеличение числа клонов (например, красная клетка на 5,5 ч и затем 8 ч) считалось митотическим событием. (E) Дорсолатеральный вид заднего мозга зебры на 30,5 л.с. помечены Brainbow, где белый пунктирной и пунктирной линии показывает приблизительную границу головы, и белый пунктирной коробке указывает на вставку показано в первой точке времени F. (F) Серия временных точек, принятых на 30 минут интервалы в задний мозг от E. В течение 1,5 ч, две синие клетки, указанные белыми наконечниками стрел, можно было наблюдать, двигаясь к апикальной поверхности и подвергаясь митозам, предполагая клон, содержащий две клетки-прародителя. Шкала бар 20 мкм (A), 25 мкм (C), и 20 мкм (F). В A-D, дорсальный вверх и rostral влево. В E и F, ростраль находится слева. На всех изображениях dTomato кодируется как красный, YFP кодируется как зеленый, а CFP закодирован как синий. Изображения перепечатаны с разрешения Brockway et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Time-lapse Brainbow изображений показывает клетки в желудочковой зоне проходят гибель клеток в vivo. (A) Зебрафиш задний мозг на 31 л.с. помечены Brainbow (максимальная интенсивность проекции, представляющие 36 мкм). Белый пунктирный ящик указывает на вставку, показанную в первой точке времени в B. (B) Серия временных точек, показывающих задний мозг в 30 минутах. Белая наконечник стрелки в первой панели показывает лавандовую клетку, которая подверглась апоптозу, как показано в последующих панелях, о чем свидетельствует фрагментация клеток с последующим постепенным очисткой апоптотических тел. Соседние помеченные клетки казались здоровыми во всем. Дорсал вверх и рострал слева. Шкала бар 20 мкм (B). На всех изображениях dTomato кодируется как красный, YFP кодируется как зеленый, а CFP закодирован как синий. Изображения перепечатаны с разрешения Brockway et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Этот протокол описывает метод визуализации клонов клеток-прародителей и нейронов в развивающихся задней мозг зебры и следовать за ними in vivo с помощью Brainbow и замедленной конфокальной микроскопии11. Основным преимуществом этого протокола по сравнению с исследованиями in vitro или ex vivo является способность непосредственно наблюдать за пролиферативной зоной мозга позвоночных в его естественной среде с течением времени. Этот метод основан на предыдущих исследованиях, которые помечены одного клона с использованием ретровирусных векторов. В отличие от этого, использование hsp:Зебрабоу построить цветовые коды многих клонов одновременно, что позволяет мультиплекс линии отслеживания и акцент на динамику среди клонов11. Этот протокол может быть изменен, чтобы сосредоточиться на развитии в других системах или типах клеток. Например, различные конструкции Brainbow могут быть выражены в эмбрионах зебры. Использование зебрафиш hsp70 промоутер в hsp: Зебрабоу приведет к мозаике маркировки различных типов клеток после теплового шока, в том числе нейронных прародителей и нейронов11, и дает исследователям височное управление над экспрессией генов29. Следует отметить, что использование теплового шока промоутер последовательно этикетки цветовых клонов, в то время как другие промоутеры не могут четко разграничивать линию клеток таким образом. Когда клональная идентичность не является фактором интереса, конструкции, используя другие промоутеры могут быть использованы для обозначения конкретных типов клеток. Например, нейро-промоутер может быть использован для обозначения незрелых нейронов18,,49. Кроме того, вместо выполнения микроинъекций, исследователи могут выбрать для использования трансгенных Brainbow зебры, в том числе линий, таких как Tg (ubi:Зебрабоу)15 и Tg (нейрод: Зебрабоу)18. В этом случае, пересекает к линиям, выражающим рекомбиназы Cre, такие как Tg (hsp:Crea134)15, производят неинъекционные эмбрионы, которые собираются и поддерживаются аналогичным образом. Хотя этот протокол предназначен для изображения рыбы между 1-3 dpf, для того, чтобы совпасть с основным периодом развития нейрогенеза50, зебрафиш может поддерживаться дольше в зависимости от стадии развития интереса. Тем не менее, тепловой шок, чтобы вызвать выражение Brainbow до 24 л.с. может быть более пагубным для эмбрионов51. В зависимости от возраста и ткани, представляющие интерес, различные стратегии монтажа будет уместно иметь целевые ткани ориентированы правильно.
Существует ряд шагов, которые могут потребовать устранения неполадок, в частности, если в протокол вносятся изменения. Концентрация ДНК, размер болуса вводили, и общее количество ДНК доставлены на эмбрион может быть скорректирована, если выражение Brainbow тусклый или редкий или если эмбрионы не кажутся здоровыми. Кроме того, длина и время шага теплового удара могут быть изменены, если желаемое выражение не будет достигнуто. Параметры приобретения, используемые в визуализации, будут варьироваться в зависимости от доступных лазерных линий и фильтров, а также яркости экспрессии, монтажа и желаемого типа анализа. Кроме того, параметры замедленного времени должны быть скорректированы в зависимости от скорости событий, представляющих интерес, и времени, необходимого для приобретения одного стека. Одним из наиболее важных шагов в протоколе является соответствующее монтаж рыбы в агарозе: если угол рыбы неуместен или если рыба покрыта слишком большим количеством агарозы, оптимальная визуализация невозможна. Оптимизация этого метода может занять некоторую практику. Кроме того, часто полезно монтировать несколько рыб до изображения, как это может быть трудно установить, является ли монтаж является целесообразным перед просмотром FP выражение на конфокальный микроскоп себя. Дополнительным важным шагом является скрининг и отбор конкретных рыб, которые будут изображены. При выполнении микроинъекций, яркость, плотность маркировки, и Brainbow номер копии могут значительно различаться среди рыб. Изображения, сделанные в рыбе с тусклой маркировкой, чрезмерно плотной маркировкой или низким числом копий, в результате чего несколько цветов могут быть более трудными для анализа.
С помощью этого протокола, мы смогли непрерывно изображение жизни зебры до 16 ч11. Этот промежуток времени может быть ограничен e3 испарения из камеры изображения, рост рыбы из плоскости изображения, смерть или движение рыбы, или пользовательские ограничения на конфокальный микроскоп времени. Испарение может быть уменьшено за счет использования контролируемого температурой аксессуара на стадии микроскопа. Следует отметить, что наборы 5D-данных, генерируемые с помощью этого подхода, как правило, являются большими файлами, которые требуют значительного пространства на жестком диске (например, до 100 ГБ за одну ночь замедленного промежутки) и адекватной вычислительной мощности для анализа.
Этот протокол направляет исследователей для визуализации цветовых клонов в популяции нейронных потомков и дочерних нейронов в развивающемся мозге зебры и отслеживать их динамику с течением времени. Одним из возможных расширений является сочетание Brainbow промежуток изображения с далеко-красный FP пометки для оценки роли конкретных генов в развитии18. Таким образом, клоны, выражающие манипулируемые гены, могут быть визуализированы в определенном цвете, отслеживаются с течением времени, и по сравнению с Brainbow-помечены, не-манипулировать соседних клонов. In vivo многоцветная визуализация может быть использована для решения важных механистических вопросов о том, как формируется и функционирует нервная система.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Я. А. Пана, Дж. Ливета и З. Тобиаса за технический и интеллектуальный вклад. Эта работа была поддержана Национальным научным фондом (Премия 1553764) и Благотворительным фондом М.Д. Мердока.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL transfer pipette (fine tip) | Globe Scientific, Inc. | 134020 | |
| 1-phenyl-2-thiourea (PTU) | Alfa Aesar | L06690 | Diluted to 0.2 mM in E3 to prevent embryo pigmentation |
| 50 mL conical tubes | Corning | 352070 | For heat shocking embryos |
| 6 lb nylon fishing line | SecureLine | NMT250 | For making embryo manipulators |
| 7.5 mL transfer pipet | Globe Scientific, Inc. | 135010 | |
| CaCl2 | Sigma | C3881 | For E3 |
| Cotton swabs | Puritan | 867-WC NO GLUE | For making embryo manipulators |
| Cre recombinase | New England Biolabs | M0298M | |
| Digital dry bath | Genemate | 490016-616 | Used to store LMA at 42 °C |
| Epifluorescence dissection scope | |||
| Glass capillary tubes | World Precision Instruments | TW100F-4 | |
| Incubator | Forma Scientific | 3158 | To maintain embryos at 28 °C |
| Injection plate molds | Adaptive Science Tools | TU-1 | |
| Isotemp water bath | Fisher Scientific | 2320 | For heat shocking embryos |
| KCl | AMRESCO | 0395 | For E3 and for DNA solution for injections |
| Laser-scanning confocal microscope | Zeiss | LSM710 | |
| LE agarose | Genemate | E3120 | To create agarose injection plates |
| Low-melt agarose (LMA) | AMRESCO | J234 | |
| Mating tanks | Aquaneering, Inc. | ZHCT100 | |
| Methylene blue | Sigma | M9140 | For E3 |
| MgSO4 | Sigma | 9397 | For E3 |
| Micromanipulator | World Precision Instruments | M3301 | |
| Micropipette Puller | Sutter Instrument Co. | P-97 | |
| MS-222 Tricaine-S | Western Chemical, Inc. | Stock made at 4 mg/mL in reverse osmosis (RO) water, then added dropwise to E3 to final concentration of 0.2 mM to anesthetize embryos | |
| NaCl | J.T. Baker | 4058-01 | For E3 |
| Petri dishes (90 mm, 60 mm) | Genesee Scientific | 32-107G | To house embryos and create imaging chamber (60 mm) |
| Phenol red | Sigma | P0290 | |
| Soft stitch ring markers | Clover Needlecraft, Inc. | 354 | For creating imaging chamber with Petri dish |
| Super glue (Ultra gel control) | Loctite | 1363589 | For making embryo manipulators |
| Syringe needles | Beckton Dickinson | BD329412 | For dechorionating embryos |
Ссылки
- Lyons, D. A., Guy, A. T., Clarke, J. D. W. Monitoring neural progenitor fate through multiple rounds of division in an intact vertebrate brain. Development. 130, 3427-3436 (2003).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Florio, M., Huttner, W. B. Neural progenitors, neurogenesis and the evolution of the neocortex. Development. 141, 2182-2194 (2014).
- Mcconnell, S. K. Constructing the Cerebral Cortex: Neurogenesis and Fate Determination Review. Neuron. 15, 761-768 (1995).
- Schmidt, R., Strähle, U., Scholpp, S. Neurogenesis in zebrafish - from embryo to adult. Neural Development. 8, 3(2013).
- Chenn, A., Walsh, C. Regulation of Cerebral Cortical Size by Control of Cell Cycle Exit in Neural Precursors. Science. 297 (5580), 365-369 (2002).
- Lui, J. H., Hansen, D. V., Kriegstein, A. R. Development and Evolution of the Human Neocortex. Cell. 146 (1), 18-36 (2011).
- Nonaka-Kinoshita, M., et al. Regulation of cerebral cortex size and folding by expansion of basal progenitors. The EMBO Journal. 32, 1817-1828 (2013).
- Homem, C. C. F., Repic, M., Knoblich, J. A. Proliferation control in neural stem and progenitor cells. Nature Reviews Neuroscience. 16 (11), 647-659 (2015).
- Brockway, N. L., et al. Multicolor lineage tracing using in vivo time-lapse imaging reveals coordinated death of clonally related cells in the developing vertebrate brain. Developmental Biology. 453 (2), 130-140 (2019).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Weissman, T. A., Pan, Y. A. Brainbow: New resources and emerging biological applications for multicolor genetic labeling and analysis. Genetics. 199 (2), 293-306 (2015).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Pan, Y. A., et al. Zebrabow: multispectral cell labeling for cell tracing and lineage analysis in zebrafish. Development. 140, 2835-2846 (2013).
- Ko, S. K., Chen, X., Yoon, J., Shin, I. Zebrafish as a good vertebrate model for molecular imaging using fluorescent probes. Chemical Society Reviews. 40, 2120(2011).
- Kesavan, G., Hammer, J., Hans, S., Brand, M. Targeted knock-in of CreERT2 in zebrafish using CRISPR/Cas9. Cell and Tissue Research. 372, 41-50 (2018).
- Cook, Z. T., et al. Combining near-infrared fluorescence with Brainbow to visualize expression of specific genes within a multicolor context. Molecular Biology of the Cell. 30 (4), 491-505 (2019).
- Kuwata, M., Nikaido, M., Hatta, K. Local heat-shock mediated multi-color labeling visualizing behaviors of enteric neural crest cells associated with division and neurogenesis in zebrafish gut. Developmental Dynamics. 248, 437-448 (2019).
- Kinkhabwala, A., et al. A structural and functional ground plan for neurons in the hindbrain of zebrafish. Proceedings of the National Academy of Sciences. 108 (3), 1164-1169 (2011).
- Heap, L. A., Goh, C. C., Kassahn, K. S., Scott, E. K. Cerebellar Output in Zebrafish: An Analysis of Spatial Patterns and Topography in Eurydendroid Cell Projections. Frontiers in Neural Circuits. 7, 53(2013).
- Robles, E., Filosa, A., Baier, H. Precise Lamination of Retinal Axons Generates Multiple Parallel Input Pathways in the Tectum. The Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Dirian, L., et al. Spatial Regionalization and Heterochrony in the Formation of Adult Pallial Neural Stem Cells. Developmental Cell. 30, 123-136 (2014).
- Chen, X. A., et al. Behavioral/Cognitive QRFP and Its Receptors Regulate Locomotor Activity and Sleep in Zebrafish. The Journal of Neuroscience. 36 (6), 1823-1840 (2016).
- Albadri, S., De Santis, F., Di Donato, V., Del Bene, F. CRISPR/Cas9-Mediated Knockin and Knockout in Zebrafish. Genome Editing in Neurosciences. Jaenisch, R., Zhang, F., Gage, F. , Springer. Cham, Switzerland. 41-49 (2017).
- Furlan, G., et al. Life-Long Neurogenic Activity of Individual Neural Stem Cells and Continuous Growth Establish an Outside-In Architecture in the Teleost Pallium. Current Biology. 27, 3288-3301 (2017).
- Herget, U., Arturo Gutierrez-Triana, J., Salazar Thula, O., Knerr, B., Ryu, S. Single-cell reconstruction of oxytocinergic neurons reveals separate hypophysiotropic and encephalotropic subtypes in larval zebrafish Brainbow-guided morphology of oxytocinergic cells. eNeuro. 4 (1), (2017).
- Halloran, M. C., et al. Laser-targeted gene expression. Development. 127, 1953-1960 (2000).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50, 401-406 (2008).
- Luskin, M. B., Pearlman, A. L., Sanes, J. R. Cell lineage in the cerebral cortex of the mouse studied in vivo and in vitro with a Recombinant Retrovirus. Neuron. 1 (8), 635-647 (1988).
- Price, J., Thurlow, L. Cell lineage in the rat cerebral cortex: a study using retroviral-mediated gene transfer. Development. 104, 473-482 (1988).
- Walsh, C., Cepko, C. L. Widespread dispersion of neuronal clones across functional regions of the cerebral cortex. Science. 255 (5043), 434-441 (1992).
- Walsh, C., Cepko, C. L. Clonal dispersion in proliferative layers of developing cerebral cortex. Nature. 362 (6421), 632-635 (1993).
- Cai, L., Hayes, N. L., Nowakowski, R. S. Synchrony of Clonal Cell Proliferation and Contiguity of Clonally Related Cells: Production of Mosaicism in the Ventricular Zone of Developing Mouse Neocortex. The Journal of Neuroscience. 17 (6), 2088-2100 (1997).
- Reznikov, K., Acklin, S. E., Van Der Kooy, D. Clonal Heterogeneity in the Early Embryonic Rodent Cortical Germinal Zone and the Separation of Subventricular From Ventricular Zone Lineages. Developmental Dynamics. 210, 328-343 (1997).
- Qian, X., Goderie, S., Shen, Q., Stern, J., Temple, S. Intrinsic programs of patterned cell lineages in isolated vertebrate CNS ventricular zone cells. Development. 125, 3143-3152 (1998).
- McCarthy, M., Turnbull, D. H., Walsh, C. A., Fishell, G. Telencephalic Neural Progenitors Appear to Be Restricted to Regional and Glial Fates before the Onset of Neurogenesis. The Journal of Neuroscience. 21 (17), 6772-6781 (2001).
- Yu, Y. C., Bultje, R. S., Wang, X., Shi, S. H. Specific synapses develop preferentially among sister excitatory neurons in the neocortex. Nature. 458 (7237), 501-504 (2009).
- Nusslein-Volhard, C., Dahm, R. Zebrafish. , Oxford University Press. Oxford, UK. (2002).
- Nasiadka, A., Clark, M. D. Zebrafish Breeding in the Laboratory Environment. ILAR Journal. 53 (2), 161-168 (2012).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. Journal of Visualized Experiments. 25, e1115(2009).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- R Core Team. R: A language and environment for statistical computing. , (2017).
- Smith, M. R. Ternary: an R package to generate ternary plots. , (2017).
- Baye, L. M., Link, B. A. Development/Plasticity/Repair Interkinetic Nuclear Migration and the Selection of Neurogenic Cell Divisions during Vertebrate Retinogenesis. The Journal of Neuroscience. 27 (38), 10143-10152 (2007).
- Leung, L., Klopper, A. V., Grill, S. W., Harris, W. A., Norden, C. Apical migration of nuclei during G2 is a prerequisite for all nuclear motion in zebrafish neuroepithelia. Development. 139, 2635(2012).
- Kerr, J. F. R., Wyllie, A. H., Curriet, A. R. Apoptosis: A Basic Biological Phenomenon with Wide-ranging Implications in Tissue Kinetics. British Journal of Cancer. 26, 239(1972).
- Cole, L. K., Ross, L. S. Apoptosis in the Developing Zebrafish Embryo. Developmental Biology. 240, 123-142 (2001).
- Liao, J., He, J., Yan, T., Korzh, V., Gong, Z. A Class of NeuroD-Related Basic Helix-Loop-Helix Transcription Factors Expressed in Developing Central Nervous System in Zebrafish. DNA and Cell Biology. 18 (4), 333-344 (1999).
- Trevarrow, B., Marks, D. L., Kimmel, C. B. Organization of hindbrain segments in the zebrafish embryo. Neuron. 4 (5), 669-679 (1990).
- Yabu, T., Todoriki, S., Yamashita, M. Stress-induced apoptosis by heat shock, UV and gamma-ray irradiation in zebrafish embryos detected by increased caspase activity and whole-mount TUNEL staining. Fisheries Science. 67, 333-340 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены