Method Article
Solvent-temizlenmiş beyin dokusu kuduz virüs enfeksiyonu yüksek çözünürlüklü 3D görüntüleme
Bu Makalede
Özet
Yeni, immünostasyon uyumlu doku Temizleme teknikleri gibi solvent temizlenmiş organların nihai 3D görüntüleme kuduz virüsü beyin enfeksiyonu ve karmaşık hücresel çevre 3D görselleştirme sağlar. Kalın, antikor etiketli beyin dokusu dilimleri, görüntüleme derinliğini artırmak ve konfetik lazer tarama mikroskobu ile 3D analizini sağlamak için optik olarak şeffaf hale gelmiştir.
Özet
Enfeksiyon süreçlerinin doku ve organlarda immunolabeling tarafından görselleştirilmesi, modern enfeksiyon biyolojisinde önemli bir yöntemdir. Organ dokularının içindeki dağıtım, tropizm ve patojenlerin zenginliğini gözlemlemek ve incelemek yeteneği, hastalık gelişimi ve ilerlemesi hakkında önemli veriler sağlar. Konvansiyonel mikroskopi yöntemlerini kullanarak immünolabeling çoğunlukla parafin-katıştırılmış veya dondurulmuş örneklerden elde edilen ince bölümlerle sınırlıdır. Ancak, bu ince bölümlerin sınırlı 2D görüntü düzlemi, virüslü bir organın karmaşık yapısı ve enfeksiyonun hücresel bağlamında önemli bilgi kaybına yol açabilir. Modern çok renkli, immünostatif uyumlu doku Temizleme teknikleri şimdi virüs enfekte organ dokusu yüksek hacimli 3D görüntü yığınları incelemek için nispeten hızlı ve ucuz bir yol sağlar. Dokuyu organik çözücülere maruz bırakarak optik olarak şeffaflaşır. Bu, numunenin refraktif endeksler ile eşleşir ve sonunda ışık saçılma önemli bir azalma yol açar. Böylece, uzun serbest çalışma mesafesi hedefleri ile birlikte, yüksek çözünürlükte geleneksel Konfokal lazer tarama mikroskobu (CLSM) ile boyutu 1 mm 'ye kadar büyük doku bölümleri görüntülenmiş olabilir. Burada, virüs patogenezi, Spread, tropizm ve nöroinvazyon gibi konuları incelemek amacıyla enfekte beyinlerde kuduz virüsü dağıtımını görselleştirmek için doku temizledikten sonra derin doku görüntülemenin uygulanması için bir protokol açıklanmaktadır.
Giriş
Konvansiyonel Histoloji teknikleri çoğunlukla karmaşık bir 3D ortama sadece 2D Öngörüler sağlayabilen organ dokularının ince bölümlerine güveniyor. Prensip olarak uygulanabilir olsa da, seri ince bölümlerden 3D yeniden yapılanma hem Dilimleme ve elde edilen görüntülerin silico hizalama sonraki için teknik boru hatları talep gerektirir1. Ayrıca, mikrotome Dilimleme işleminden sonra z-hacimlerin kesintisiz yeniden oluşturulması, hem mekanik hem de Hesaplamalı eserler nedeniyle örtüşmeyen görüntü düzlemleri, boyama varyasyonları ve fiziksel doku imha, örneğin, mikrotome bıçak. Buna karşılık, bozulmamış kalın doku örneklerinin saf optik Dilimleme çakışan görüntü düzlemleri (aşırı örnekleme) satın alma ve böylece, 3D yeniden yapılanma kolaylaştırır sağlar. Bu, sırayla, karmaşık hücre nüfuslarında enfeksiyon süreçlerinin analizi için son derece yararlıdır (örneğin, çevreleyen glial ve bağışıklık hücrelerinin bağlamında nöronal ağlar). Ancak, kalın doku bölümlerinin doğal engelleri doku içine ışık saçılma ve sınırlı antikor penetrasyonunu içerir. Son yıllarda, çeşitli teknikler geliştirilmiştir ve bu sorunların üstesinden gelmek için optimize edilmiştir2,3,4,5,6,7,8 , 9 , 10 ' dan fazla , 11 ' i , 12 tane , 13. esasen, hedef dokular, sulu2,3,4,5,6,7 ile tedavi ile optik şeffaf olarak dönüşmüştür ,8,9 veya organik solvent bazlı10,11,12,13 çözümler. 3disco (solvent temizlenmiş organların 3B görüntüleme)11,12 ve onun halefi udisco (solvent temizlenmiş organların nihai 3D görüntüleme) tanıtımı13 , nispeten hızlı, basit ve ucuz bir araç sağladı mükemmel temizleme yetenekleri. Temizleme protokolünün ana bileşenleri organik çözücüler tert-Butanol (TBA), Benzil alkol (BA), Benzil benzoat (BB) ve difenil eter (DPE) ' dir. Geliştirme ve iDISCO eklenmesi (solvent temizlenmiş organların immünolabeling-etkin 3D görüntüleme)14, uyumlu bir immünostat protokolü, mevcut yöntemler üzerinde başka bir avantaj oluşturdu ve antijenlerin derin doku etiketleme etkin hem de immünosteli numunelerin uzun süreli depolanması. Böylece, iDISCO14 ve udisco13 kombinasyonu, geleneksel CLSM kullanarak büyük doku bölümlerinde (1 mm 'ye kadar) antikor etiketli proteinlerin yüksek çözünürlüklü görüntülemesinin sağlar.
Bir organın her üç boyutta kompleks yapısının korunması özellikle beyin dokusu için önemlidir. Nöronlar çok çeşitli 3D morfolojileri nörit projeksiyonlarına dayalı çok heterojen hücresel alt nüfus oluşturur (Masland tarafından gözden15). Ayrıca beyin, glial hücreler ve nöronlar (von Bartheld ve al.16tarafından gözden geçirilmiş) dahil olmak üzere farklı hücresel alt nüfus ve oranlardan oluşan bir dizi bölmeler ve alt bölmesinden oluşur. Bir nörotropik virüs olarak, kuduz virüsü (rabv, Fooks ve al.17tarafından gözden geçirilmiş) öncelikle nöronlar bozar, kendi taşıma makineleri kullanarak orta sinir sistemi (CNS) enfeksiyon birincil sitesinden akons boyunca retrograd yönde seyahat etmek. Burada açıklanan protokol (Şekil 1A) enfekte beyin dokusundan elde edilen büyük, tutarlı görüntü yığınlarında rabv ve rabv enfekte hücrelerin immünostal destekli algılama ve görselleştirme için izin verir. Bu, enfeksiyon ortamının tarafsız, 3D yüksek çözünürlüklü değerlendirmesini sağlar. Bu türlerin çeşitli beyin dokusu için uygulanabilir, tespit sonra hemen yapılabilir veya civarında formaldehite numunelerin uzun süreli depolama sonra (PFA), ve depolama ve ay için lekeli ve temizlenmiş numunelerin yeniden görüntüleme sağlar.
Protokol
RABV-enfekte, PFA-sabit arşivlenmiş beyin malzemesi kullanıldı. İlgili hayvan deneysel çalışmaları Mecklenburg-Batı Pomerania (LALFF M-V) Devlet Tarım, gıda güvenliği ve balıkçılık eyalet ofisi sorumlu hayvan bakımı, kullanımı ve Etik Komitesi tarafından değerlendirildi ve izinler ile onay kazandı 7221.3-2.1-002/11 (fareler) ve 7221.3-1-068/16 (Ferrets). Hayvan deneylerinde kullanılan genel bakım ve Yöntemler onaylanmış yönergelere göre yürütülmüştür.
DIKKAT: Bu protokol PFA, metanol (MeOH), hidrojen peroksit (H2O2), sodyum azid (NaN3), TBA, ba, BB ve DPE dahil olmak üzere çeşitli toksik ve/veya zararlı maddeler kullanır. MeOH ve TBA son derece yanıcı. Uygun kişisel koruyucu ekipman (bir laboratuar ceket, eldiven ve göz koruması) giyen ve bir duman kaputu deneyler yaparak maruz kalma kaçının. Uygun konteynerlerde ayrı olarak atık toplayın ve yerel yönetmeliklere göre bertaraf edin. Kuduz virüsü bir Biyogüvenlik seviyesi olarak sınıflandırılır (BSL)-2 patojen ve bu nedenle, genellikle BSL-2 koşulları altında ele alınabilir. Aerosoller oluşturabilir, yüksek virüs konsantrasyonlarına sahip veya yeni lyssaviruses ile çalışabilir prosedürler de dahil olmak üzere bazı faaliyetler, BSL-3 sınıflandırma gerektirebilir. Ön pozlama profilaksisi, animal Caretakers ve laboratuar işçileri de dahil olmak üzere yüksek riskli personel için tavsiye edilir18,19. Yerel yetki yönetmeliklerine bakın.
1. beyin dokusunun ve sekleme fikreme
- Beyin örneklerini, 4 °C ' de en az 48 h (1:10 [v/v] ' nin yaklaşık doku-fikratif oranı ile) için fosfat-tamponlu tuz (PBS [pH 7,4]) içinde% 4 PFA uygun bir hacimde düzeltin.
- PBS 'de 3 adet doku örneğini en az 30 dakika yıkayın ve% 0,02 NaN3/PBS 'de 4 °c ' de kullanıma kadar saklayın.
- Dokuyu bir vibratome (Blade ilerleme oranı: 0.3 – 0.5 mm/s, genlik: 1 mm, dilim kalınlığı: 1.000 μm) kullanarak 1 mm kalınlığında bölüme yerleştirin.
- Doğru dilim sırasını korumak için, her doku bölümünü ayrı bir multiwell hücre kültürü plakasının iyi olarak saklayın. 0,02% NaN3/PBS ekleyin ve doku bölümlerini kullanım kadar 4 °c ' de saklayın.
2. metanol ile numune ön tedavisi
Not: tüm inkübasyon adımlarını nazik salınımla ve aksi belirtilmediği takdirde oda sıcaklığında gerçekleştirin. Örnekleri ışığa karşı koruyun. Örnek ön tedavi, antikor difüzyon iyileştirilmesi ve MeOH ve H2O2, sırasıyla14pozlama ile doku otofloresans azaltılması genel amacı hizmet vermektedir.
- Damıtılmış suda% 20 (v/v),% 40,% 60 ve% 80 MeOH çözeltileri hazırlayın. Örneğin,% 20 MeOH için, 10 mL 100% MeOH 40 mL damıtılmış su uygun bir mühürlenebilir gemi ve mix için ters çevirme ile ekleyin.
- Numuneleri makul boyutta gemiler (örn. 5 mL reaksiyon tüpleri) ile aktarın. Bu protokolde kullanılan reaktiflere kimyasal olarak dayanıklı materyalleri kullanmak için özen yapın. Örneğin, Polipropilen uygun iken, polistiren değildir unutmayın.
Not: bu protokoldeki hacim spesifikasyonları 5 mL reaksiyon tüpüne başvurur. Farklı bir gemi kullanılırsa, hacimleri buna göre ayarlayın. - Her biri 1 h için artan düzende MeOH çözümlerinin hazırlanmış serisinin her konsantrasyonunun 4 mL 'de örneklerini inküt.
- Her biri saf (% 100) 1 saat için 2x örnekleri inküt MeOH.
- Numuneleri 4 °C ' ye (örn. laboratuar-güvenli buzdolabında) soğutur.
- Hazırlamak beyazlatma çözeltisi (5% H2o2 içinde MeOH) tarafından, örneğin, seyreltme bir 30% h2o2 stok çözüm 1:6 saf (100%) Ve 4 °C ' de sakin ol.
- 100% MeOH 'ini soğutulmuş örneklerden çıkarın ve 4 mL prechilled beyazlatma çözeltisi (% 5 H2O2 in MeOH) ekleyin. Gece 4 °C ' de inküyün.
- 80% MeOH 4 mL için beyazlatma solüsyonu değişimi ve 1 h için inkük. 1 h her biri için azalan düzende MeOH çözümleri hazırlanmış dizi kullanmaya devam edin örnekleri 1 saat 4 mL içinde% 20 MeOH.
- 4 mL PBS ile 1 saat için 1x örnekleri yıkayın.
3. immünostakajlı
Not: tüm inkübasyon adımlarını nazik salınımla ve aksi belirtilmediği takdirde oda sıcaklığında gerçekleştirin. Örnekleri ışığa karşı koruyun. Mikrobiyal büyümesini önlemek için, bu bölümdeki çözümlere% 0,02 oranında son konsantrasyona NaN3 ekleyin. Doku örnekleri, Noniyonik deterjanlar Triton X-100 ve Tween 20 ile tedavi ile daha fazla geçirgen. Normal serum, spesifik olmayan antikor bağlayıcılığı engellemek için kullanılır. Gcine ve heparin immünolabeling arka plan azaltmak için eklenir14.
- 4 mL 0,2% Triton X-100/PBS 'de her biri 1 saat için 2x örnekleri yıkayın.
- Örnekleri 2 gün 37 °C ' de 4 mL 0,2% Triton X-100/20% DMSO/0.3 M Glycine/PBS ile geçirebilin.
- 4 mL 0,2% Triton X-100/10% DMSO/% 6 normal serum/PBS olarak 37 °C ' de 2 gün boyunca numuneleri kulyatlayarak antikorların spesifik olmayan bağlayıcılığı engelleyin.
Not: İkinci antikor ideal engelleme sonuçları elde etmek için yükseltilmiş aynı türden normal serum kullanın. - Numuneleri 2 mL primer antikor çözeltisi içinde (3% normal serum/5% DMSO/PTwH [PBS-Tween 20 ile heparin] + primer antikor/antikorlar) 37 °C ' de 5 gün boyunca inküserin. 2,5 gün sonra primer antikor çözümünü yenileyin.
- PTwH için, 10 mg/mL stok çözeltisi yapmak için distile suda heparin sodyum tuzunu yeniden oluşturur (Bu çözümü 4 °C ' de yer alan bir şekilde saklayın). 10 μg/mL 'Lik son konsantrasyona% 0,2 ara 20/PBS 'ye stok çözümünü ekleyin.
Not: doğru antikor seyreltme seçiminde optimizasyon gerekebilir. Genel olarak, standart immünhistokimya konsantrasyonları iyi bir başlangıç noktasıdır.
- PTwH için, 10 mg/mL stok çözeltisi yapmak için distile suda heparin sodyum tuzunu yeniden oluşturur (Bu çözümü 4 °C ' de yer alan bir şekilde saklayın). 10 μg/mL 'Lik son konsantrasyona% 0,2 ara 20/PBS 'ye stok çözümünü ekleyin.
- Numuneleri 1 gün boyunca 4 mL PTwH 'de yıkayın, yıkama tamponunu gün boyunca en az 4X – 5x olarak değiş tokuş yapın ve gecede son yıkamayı bırakınız.
- Numuneleri 2 mL ikincil antikor çözeltisi içinde (% 3 normal serum/PTwH + ikincil antikor/antikorlar) 37 °C ' de 5 gün boyunca inküserin. 2,5 gün sonra ikincil antikor çözümünü yenileyin.
- Sekonder antikor/antikorları 1:500 at ikincil antikor çözeltisi (örn., 2 mL 'de 4 μL) seyreltin.
- Numuneleri 1 gün 3,5 adımda açıklandığı gibi yıkayın, son yıkamayı gecede bırakınız.
4. nükleer boyama
Not: tüm inkübasyon adımlarını nazik salınımla ve aksi belirtilmediği takdirde oda sıcaklığında gerçekleştirin. Örnekleri ışığa karşı koruyun. Hiçbir nükleer boyama gerekli veya uyarılma dalga boyu/emisyon spektrum TO-PRO-3 uyarılma veya başka bir fluorophore tespiti için gereklidir, bu adımı atlayın.
- PTwH içinde 1:1000 ' de nükleik asit lekesini-PRO-3 ' e seyreltin ve 5 h için 4 mL nükleer boyama çözeltisi içinde numuneleri inkük.
- Numuneleri 1 gün 3,5 adımda açıklandığı gibi yıkayın, son yıkamayı gecede bırakınız.
Not: yıkama işleminden sonra, örnekler optik temizleninceye kadar 4 °C ' de PBS 'de depolanabilir.
5. doku Temizleme
Not: tüm inkübasyon adımlarını nazik salınımla ve aksi belirtilmediği takdirde oda sıcaklığında gerçekleştirin. Örnekleri ışığa karşı koruyun. Doku numuneleri, kademeli bir TBA çözeltileri serisinde susuz kalmış durumdadır. İmmünosteme sulu çözümler gerektirdiğinden, tüm boyama prosedürleri doku temizliğiyle önce bitmiş olmalıdır. Optik boşluk ve Refraktif endeks eşleştirme, BA, BB ve DPE karışımı ile tedavi ile elde edilir. Temizleme çözümü, bir antioksidan olarak DL-α-tocopherol ile desteklenmektedir13.
- Damıtılmış suda% 30 (v/v),% 50,% 70,% 80,% 90 ve% 96 TBA çözeltileri hazırlayın. Örneğin,% 30 TBA için, uygun bir mühürlenebilir damar içinde 35 mL distile su için% 100 TBA 15 mL ekleyin ve ters çevirme ile karıştırın.
Not: TBA 'nın erime noktası 25 – 26 °C; Böylece, oda sıcaklığında katı olma eğilimindedir. TBA çözümlerini hazırlamak için, iyi mühürlü şişeyi 37 °C ' de bir kuluçba veya su banyosunda ısıtın. - 2 h her için artan düzende TBA çözümleri hazırlanmış serisinin her konsantrasyon 4 mL ile numuneleri kurutmak. Gece 96% TBA bırakın.
- Numuneleri saf (% 100) daha fazla kurutmak TBA için 2 h.
- BABB-D15 Temizleme çözümünü hazırlayın.
Not: BABB-D15, x: 1 oranında DPE ile karışık olan BA ve BB (BABB) ' nın bir kombinasyonudur ve bu durumda 15 ' in çözümün adıyla x belirtilir.- BABB için, iki parça BB ile tek parçalı BA karıştırın.
- 15:1 oranı ile BABB ve DPE karıştırın.
- Ekle 0,4 Vol% DL-α-tocopherol (vitamin E).
Not: Örneğin, 20 mL BABB-D15 için, mix 6,25 mL, BB 12,5 mL ile BA. 1,25 mL DPE ekleyin ve 0,08 mL DL-α-tocopherol ile ek.
- Temizleme çözeltisi içindeki numuneleri optik olarak saydam olana kadar temizleyin (2 – 6 saat).
- Numuneler BABB-D15 ' d e 4 °C ' de saklanabilir, ışık korumalı, montaj ve görüntüleme kadar.
6. numune montajı
- 3D yazıcı kullanarak, görüntüleme odası ve kapak baskı (malzeme: kopolyester [CPE], nozul: 0,25 mm, katman yüksekliği: 0,06 mm, duvar kalınlığı: 0,88 mm, duvar sayısı: 4, dolgu: 100%, hiçbir destek yapısı; karşılık gelen. STL dosyası bu protokolün ek malzemelerinde bulunabilir).
- Görüntüleme bölmesini birleştirin (Şekil 2).
- RTV-1 (tek bileşenli oda-sıcaklık-vulkanizasyon) silikon kauçuk ile görüntüleme odasına bir yuvarlak lamel magazini (çapı: 30 mm) monte edin. Bir su ıslatılmış pamuk çubukla ile aşırı silikon kauçuk çıkarın ve gecede tedavi.
- RTV-1 silikon kauçuk kapağında yuvarlak lamel magazini (çap: 22 mm) monte edin. Bir su ıslatılmış pamuk çubukla ile aşırı silikon kauçuk çıkarın ve gecede tedavi.
- Numuneyi bir görüntüleme odasına yerleştirin, küçük bir hacmine BABB-D15 ekleyin ve kapağı takın. Bir Hipodermik iğne kullanarak, giriş yoluyla BABB-D15 ile odası doldurun (27 G x 3/4 inç [0,40 mm x 20 mm]).
- Giriş fişini takın ve görüntüleme bölmesini RTV-1 silikon kauçukla mühürleyin. Karanlık bir gecede Cure.
7. görüntüleme ve görüntü işleme
- Kullanılan fluorophores eşleştirmek için ilgili lazer hatları seçerek görüntü edinme ayarlayın. Kanallar arasında sinyal çakışmayı önlemek için her dedektör algılama aralığını ayarlayın.
Not: Alexa Fluor 488, Alexa Fluor 568 ve TO-PRO-3 için örnek algılama aralıkları sırasıyla 500 – 550 nm, 590 – 620 nm ve 645 – 700 nm arasındadır. - Edinme parametrelerini seçin, z yığınının üst ve alt kenarlığını tanımlayın ve görüntü yığınını edinin.
Not: örnek edinme parametreleri 60-90 nm piksel boyutunda, 0,5 μm z-Step boyutu, 1 satır ortalaması, 400 Hz tarama hızı ve 1 havadar birimin iğne deliği boyutu ile sıralı bir taramalıdır. - 3B projeksiyonları oluşturmak veya derinlemesine analizler yapmak için uygun görüntü analiz yazılımını (örneğin, Fiji) kullanarak görüntü yığınını işlemektir.
Not: elde edilen görüntü dosyalarının büyük boyutu nedeniyle, bir iş istasyonu kullanımı genellikle gereklidir.- Fiji 'deki edinme veya görüntü dosyalarını (Dosya | Açık | Dosyaları seçin).
- Örneğin, kullanıyorsanız. LıF dosyaları, Bio-biçimler iletişim penceresinde istediğiniz seçenekleri seçin veya seçimini kaldırın. Hyperstackile görünüm yığını. Bunun dışında, belirli seçimler veya Ticks gerekli değildir. Oktuşuna basın.
- Dosya birden fazla görüntü yığını içeriyorsa, analiz edilecek olanları seçin ve oktuşuna basarak onaylayın.
- Birleştirilmiş görüntüyü ayrı kanallara bölerek çamaşır suyu düzeltmesi gerçekleştirin (resim | Renk | Kanallar aracınıseçin ve daha fazla | Bölünmüş kanallar). Her kanal için, çamaşır suyu düzeltmesi seçin (resim | Adjust | Bleach düzeltme) ve basit oran (arka plan yoğunluğu: 0,0) seçin.
Not: bazı durumlarda, örneğin, sinyalin doğrusal çürümesi olmadığında veya sinyal genel olarak çok zayıfsa, basit oran başarısız olabilir. Alternatif olarak, üstel Sığdır 'ı deneyin veya çamaşır suyu düzeltmesi atlayın. - Kaydırıcıları kullanarak her kanal için parlaklığı ve kontrastı ayarlayın (resim | Ayar | Parlaklık | Kontrast).
- Kanalları Birleştir (resim | Renk | Birleştirme kanalları), bileşik yapmak (resim | Renk | Kanallar aracınıseçin ve daha fazla | Bileşik olun) ve RGB biçimine dönüştürmek (resim | Renk | Kanallar aracınıseçin ve daha fazla | RGB 'ye Dönüştür).
- Gerekirse, hesaplama süresini ve dosya boyutunu azaltmak için görüntü yığınını yeniden boyutlandırın (resim | Adjust | Boyutu, her iki seçenek de çift doğrusal interpolasyon işaretli).
- 3B projeksiyon oluşturma (resim | Yığınları | 3D projesi). En parlak nokta olarak projeksiyon yöntemi seçin ve dilim aralığını, elde edilen görüntü yığınının z-Step boyutuna uyacak şekilde ayarlayın. Maksimum kalite için döndürme açısı artışını 1 olarak ayarlayın ve interpolasyonu etkinleştirin. Toplam döndürme, saydamlık eşikleri ve opaklık gerektiği gibi değiştirin.
- Gerekirse, 3D projeksiyon geri 8-bit biçimine dönüştürerek kontrast ve parlaklık yeniden (görüntü | Türü | 8-bit). İlgili sürgüleri kullanın (resim | Adjust | Parlaklık | Kontrast) ve adım 7.3.4 ' de açıklandığı gibi görüntü yığınını RGB biçimine yeniden dönüştürün.
- 3D projeksiyon olarak kaydedin. TıF dosyası (görüntü dosyası formatı) ve. AVI dosyası (video dosyası formatı).
- Fiji 'deki edinme veya görüntü dosyalarını (Dosya | Açık | Dosyaları seçin).
Sonuçlar
Yüksek çözünürlüklü CLSM ile birlikte iDISCO14 ve udisco13 kombinasyonu, beyin dokusunun ve çevreleyen hücresel bağlamda rabv enfeksiyonunun uzamsal çözünürlüğü ve plastisite içine derin öngörüler sağlar.
RABV fosfoprotein (P) immünostasyon kullanarak, enfekte nöronal hücrelerin karmaşık katmanları fare beynin kalın bölümlerde görselleştirilebilir (Şekil 3). Daha sonra, elde edilen görüntü yığınlarının Dikişsiz 3D projeksiyonları yeniden inşa edilebilir (Şekil 3A, B, sağ panel; Animasyonlu Şekil 1). Organ malzemesi kaynaklı türe karşı primer antikorlar ve ikincil antikorların kullanıldığı zaman bakım alınmalıdır. Fare beyin dokusu üzerinde anti-fare IgG antikorların kullanımı vasküler sistemin ayrı bir boyama sonuçlandı (Şekil 3B, sol panel). Görüntü yığınları ile elde edilen yüksek çözünürlük nedeniyle, enfeksiyon tek hücreli seviyeye kadar değerlendirilebilir (Şekil 4), örneğin, hücre içinde antijen bolluk ve dağılımı (Şekil 4C ).
Fare beyin dokusu dışında, protokol de diğer hayvan türlerinden beyin dokusu uygulanabilir (örneğin, Ferrets) (Şekil 5; Animasyonlu Şekil 2). Enfekte bir Ferret beynin farklı bölmeler alınan bölümler RABV enfeksiyon değişik derecede ortaya (Şekil 5a-D).
Beyin birçok farklı hücresel alt oluşur gibi, bu nüfus arasındaki farklılaşma hayati önem taşımaktadır. Hücre işaretçileri karşı yönlendirilmiş antikorlar kullanarak, virüslü ve komşu hücrelerin hücresel kimlik değerlendirmesi mümkündür. Örneğin, astrositler glial fibrilasyon asidik protein (GFAP) ifadesi ile ayırt edilebilir (Şekil 6A, C; Animasyonlu şekil 3), nörosit özellikle Microtubule ilişkili protein için lekelenmiş olabilir iken 2 (MAP2) (Şekil 6B, D; Animasyonlu Şekil 4). Aynı anda, viral proteinler, bu durumda, RABV nükreoprotein (N), virüslü hücreler ve vurgulanan hücresel alt nüfus arasındaki ilişkiyi değerlendirmek için Co, olabilir.

Şekil 1 : Temel ilke ve protokol iş akışı. (A) Renier ve al.14 ve Pan ve al.13' ten gelen protokollere dayalı iş akışının grafiksel gösterimi. (B) iki örnek Ferret Beyin dilimleri, bir önce (sol panel) ve bir organik çözücüler ile tedavi sonrası (sağ panel). Temizleme, dokuyu optik olarak saydam olarak, daha sonra okunabilir metin tarafından gözlemlenebilir olarak açar. Temizlenmiş beyin dilimi 3D baskılı görüntüleme odasına (sağ panel) gömülür. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
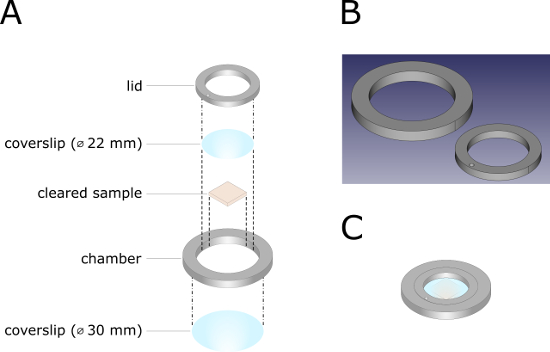
Şekil 2 : 3D baskılı görüntüleme odasının teknik Illustration. (A) görüntüleme odasının Patlatılmış görünüm çizimi. Nokta kesikli çizgiler, RTV-1 silikon kauçuk kullanarak birbirlerine monte edilmesi gereken bileşenleri vurgulamaktadır. Kesikli çizgiler, odanın sonraki montajı için yönergeleri temsil eder. (B) görüntüleme odasının CAD (bilgisayar destekli tasarım) dosyası. Karşılık gelen. Görüntüleme odasını yazdırmak için STL dosyası ek malzemelerdebulunabilir. (C) tam montaj görüntüleme odası. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 3 : RABV enfekte fare beyin dokusu derin doku görüntüleme. (A ve B) fareler rekombinant kurnaz avcı sokak virüsü ile enfekte edildi. RABV P boyama (yeşil), temizlenmiş beyin dokusu içinde büyük, karışmış nörit projeksiyonları ile enfekte nöronal katmanları ortaya çıkarır. Çekirdekler TO-PRO-3 (mavi) ile kontrlekelenmiş edildi. (B) fare dokusu üzerinde fluorophore etiketli Anti-fare IgG ikincil antikorlar (kırmızı) kullanımı vasküler sistemin ayrı bir etiketleme sonuçları. Elde edilen görüntü yığınları 3D yeniden yapılanma farklı görüş açıları (A ve B, sağ paneller) gözlem sağlar. Ölçek çubukları = 60 μm. Bu rakam daha büyük bir sürümünü görüntülemek Için lütfen buraya tıklayın .

Şekil 4 : Yüksek çözünürlüklü görüntü edinme, tek hücreli seviyeye kadar karmaşık değerlendirmelerini sağlar. Beyin sad L16-enfekte fare disseke oldu. (A) Rabv P boyama (yeşil) bireysel enfekte nöron vurgular. (B ve C) detay görüntüler ve projeksiyonlar antijen bolluk, dağıtım ve lokalizasyonu derinlemesine analizlerin gerçekleştirilebileceğini göstermektedir. Çekirdekler TO-PRO-3 (mavi) ile kontrlekelenmiş edildi. Ölçek çubukları = 20 μm (A), 5 μm (C). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
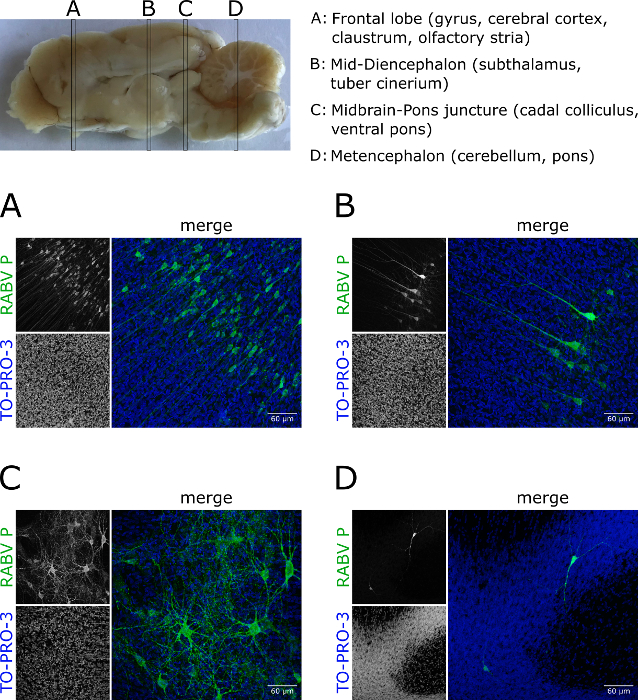
Şekil 5 : RABV-enfekte Ferret beyin dokusunun derin doku görüntüleme. Canin Sokağı RABV 'le birlikte geldiler. (A-D) Beyin belirtilen alanlardan dilimleri alınmıştır, RABV P için immünostatik (yeşil), ve optik temizlenmiş. Projeksiyonlar beynin farklı bölgelerinde enfekte hücrelerin miktarı ve morfoloji farklı olduğunu göstermektedir. Ayrıca, onlar fare türetilmiş dışında dokulara protokolün uygulanabilirliğini vurgulayın. Çekirdekler TO-PRO-3 (mavi) ile kontrlekelenmiş edildi. Ölçek çubukları = 60 μm. Bu rakam daha büyük bir sürümünü görüntülemek Için lütfen buraya tıklayın .

Şekil 6 : Multicolor immünofluorescence, hücresel belirteçlerin kobolama sağlar. Köpek Street rabv ile enfekte yaban gelinciği beyin dokusu dilimleri kullanıldı ve rabv N (kırmızı) ve ya (A ve C) GFAP (yeşil) veya (B ve D) MAP2 (yeşil) için coimmunostained. GFAP bir astrosit Marker ise, MAP2 özellikle nöronları vurgular. Çekirdekler TO-PRO-3 (mavi) ile kontrlekelenmiş edildi. (C ve D) alt kısmında, birleştirilmiş projeksiyonlardan numaralandırılmış ayrıntı görünümlerinde tek dilim ayıklamaları tasvir edilir. Ölçek çubukları = 15 μm (A ve B) 10 μm (C ve D). Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Animasyonlu Şekil 1: RABV enfekte fare beyinleri görüntü yığınları 3D rekonstrüksiyonları ve ayrıntı projeksiyonları. Projeksiyonlar Şekil 3' te açıklanan görüntü yığınlarından oluşturuldu. (A ve C) tüm ilgili z-yığınları animasyonlar. (B) videonun başında vurgulanan alanların z-yığınının bir kısmının 3D yeniden yapılanma ayrıntılı bir projeksiyon. (D) videonun başında vurgulanan alanların z-yığınının bir kısmının tomografisidir ayrıntılı bir projeksiyon. Yeşil = RABV P; Kırmızı = fare IgG; mavi = çekirdekler. Bu videoyu görüntülemek Için lütfen tıklayınız. (İndirmek için sağ tıklayın.)

Animasyonlu Şekil 2: rabv enfekte Ferret beyninden elde edilen görüntü yığınlarının 3D yeniden inşası. Projeksiyonlar Şekil 5' te açıklanan görüntü yığınlarından oluşturuldu. (A-D) Ek açıklamalar aynı rakam bakın ve dilim alınan beyin ilgili alanlarını açıklamak. Yeşil = RABV P; mavi = çekirdekler. Bu videoyu görüntülemek Için lütfen tıklayınız. (İndirmek için sağ tıklayın.)

Animasyonlu şekil 3: astrosit Marker GFAP ile Co, BIR RABV-enfekte Ferret beyin 3D yeniden yapılanma farklı kanalların kademeli projeksiyon. Şekil 6A'da açıklanan görüntü yığınından projeksiyonlar oluşturuldu. Kanal kademeli ek RABV N ile başlar (kırmızı), sonra hücre çekirdekleri takip (mavi) ve, son olarak, GFAP (yeşil), çıkarma ilk RABV N kaldırır iken, sonra hücre çekirdekleri, ve sonunda GFAP. Bu videoyu görüntülemek Için lütfen tıklayınız. (İndirmek için sağ tıklayın.)

Animasyonlu Şekil 4: BIR RABV-enfekte Ferret beyin 3D yeniden yapılanma farklı kanallar kademeli projeksiyon nöronal Marker MAP2 ile Co,. Şekil 6B'de açıklanan görüntü yığınından projeksiyonlar oluşturuldu. Kanal kademeli ek RABV N ile başlar (kırmızı), sonra hücre çekirdekleri takip (mavi) ve, son olarak, MAP2 (yeşil), çıkarma ilk RABV N kaldırır iken, sonra hücre çekirdekleri, ve sonunda MAP2. Bu videoyu görüntülemek Için lütfen tıklayınız. (İndirmek için sağ tıklayın.)
Tartışmalar
Sonyıllarda doku Temizleme tekniklerini canlandırmak ve daha da geliştirilmesi2,3,4,5,6,7,8, 9 , 10 ' dan fazla , 11 ' i , 12 tane , 13 ' ü , 14 organ dokusu yüksek hacimli görüntü yığınları elde etmek için birçok yeni olanaklar açtı. Bu, birçok diğer konular, virüs enfeksiyonu arasında çalışmak için benzersiz ve güçlü bir araç sağladı. Bu görüntü yığınlarının sonraki 3D yeniden yapılanma, örneğin, virüs tropism, bolluk ve enfeksiyon zaman ders üzerinde sofistike onaylamalarını sağlar. Bu protokol, solvent temizlenmemiş beyin dokusunda RABV enfeksiyonunun immünolabeling destekli görselleştirilmesini açıklar.
İmmünolabeled, solvent temizlenmiş doku görüntü yığınları hazırlanması ve satın alma birkaç kritik adımlar vardır. PFA uzun süreli pozlama epitopları maskeleyebilir ve böylece, azaltılmış yapılacak araştırmalar antijenite sonucu20,21,22. Bu nedenle, sabitleme sürelerini gerekli asgari oranına sınırlamak ve örnekleri uygun bir çözüme aktarmak önemlidir (örn. PBS, uzun süreli depolama için% 0,02 NaN3 ile desteklenmektedir). Bununla birlikte, burada sağlanan tüm temsili görüntüler ve projeksiyonlar, bazıları hafta boyunca PFA 'da saklanan arşivlenmiş beyin örneklerinden satın alınmıştır, bu da tekniğin PFA 'ya maruz kaldığı organ malzemesine uygulanabilirliğini vurgulayarak uzun süre. İnsan beyni örnekleri için benzer sonuçlar gösterildi13. Başka, en kritik adım değilse, antikor kuluçka olduğunu. Antikor konsantrasyonları dikkatle seçilmelidir. Çoğu durumda, standart ıHC konsantrasyonları derin doku antikor etiketleme için iyi bir başlangıç noktasıdır, bazı antijenler antikor konsantrasyonu ek optimizasyon gerektirebilir. Bu protokol hem RABV N hem de P 'nin kullanılan antikorlar tarafından kolayca algılanabilir olduğunu gösterir. MeOH ön genellikle immünolabeling geliştirir iken, bazı antijenler bu tedavi ile uyumsuzdur. Bu, Renier ve meslektaşları için14 alternatif MeOH ücretsiz örnek ön tedavi sağladı. Elde edilen görüntü yığınları analizi yeterli hesaplama gücü gerektirir. Yığın başına birkaç gigabayt kadar büyük dosya boyutları nedeniyle, güçlü bilgisayarlar görüntüleri işlemek için gereklidir. Postprocessing genellikle alma ilişkili beyazlatma efektleri telafi etmek için arka plan gürültüsü ve bir çamaşır suyu düzeltmesi çıkarma içerir. Mesafeleri ölçerken, bir yan etki olarak, temizleme işlemi sırasında doku küçülme olduğunu akılda tutulması gerekir.
Hafif sac Floresan Mikroskobu (LSFM) veya İki foton lazer tarama mikroskopisi (2PLSM) gibi diğer mikroskobik platformlara kıyasla, CLSM en sınırlı çalışma mesafesine sahiptir. Bu nedenle, görüntüleme için 1 mm kalınlıkta organları preslice gerekir. Ayrıca, CLSM yüksek görüntüleme çözünürlüğü nedeniyle en yavaş edinme hızına sahiptir. Işık levha mikroskobu kullanımı, aynı anda görüntü çözünürlüğünü feda ederken, tüm beyin görüntülemesine kadar daha büyük hacimlerin daha hızlı görüntülenmesi için izin verir. Başka bir sınırlama, azalan dalga boyu ile doku otofloresans doğal artıştır. Bu, 405 nm de lazer hattı tarafından heyecanlı fluorophores ve boyalar kullanımı yapar, Hoechst boyalar da dahil olmak üzere, imkansız pratik.
Diğer doku Temizleme teknikleri ile ilgili olarak, iDISCO14 ve udisco13 melez en olumlu niteliklerini birleştirir: immünostatif ile son derece uyumludur, çok yönlü, nispeten hızlı ve ucuz, mükemmel temizleme yetenekleri ve standart bir konfokk mikroskop ile uygulanabilir. Dahası, bu protokol bağışıklık ve beyin dokusunun temizlenmesi ile sınırlı değildir ama aynı zamanda diğer yumuşak dokular ve patojenler çeşitli uygulanabilir, hem nöroinvaziv ve non-nöroinvaziv. Sonuç olarak, burada açıklanan protokol, RABV enfekte beyin dokusu yüksek çözünürlüklü 3D görüntüleme için bir boru hattı temsil eder. Enfekte beyin dokusunun 3D rekonstrüksiyonları, RABV hastalığı ilerlemesi, patogenezi ve nöroinvazyonu ile ilgili çeşitli sorulara cevap vermek için kullanılabilir.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Yazarlar, yazının eleştirel okunması için Thomas C. Mettenleiter ve Verena te kamp 'a teşekkür ederler. Bu çalışma Mecklenburg Batı Pomerania Federal mükemmellik girişimi ve Avrupa Sosyal Fonu (ESF) Grant KoInfekt (ESF/14-BM-A55-0002/16) ve Lyssaviruses bir intramural işbirlikçi araştırma hibe tarafından destekleniyordu Friedrich-Loeffler-Enstitüsü (RI-0372).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Benzyl alcohol | Alfa Aesar | 41218 | Clearing reagent |
| Benzyl benzoate | Sigma-Aldrich | BB6630-500ML | Clearing reagent |
| Dimethyl sulfoxide | Carl Roth | 4720.2 | Various buffers |
| Diphenyl ether | Sigma-Aldrich | 240834-100G | Clearing reagent |
| DL-α-Tocopherol | Alfa Aesar | A17039 | Antioxidant |
| Donkey serum | Bio-Rad | C06SBZ | Blocking reagent |
| Glycine | Carl Roth | 3908.2 | Background reduction |
| Goat serum | Merck | S26-100ML | Blocking reagent |
| Heparin sodium salt | Carl Roth | 7692.1 | Background reduction |
| Hydrogen peroxide solution (30 %) | Carl Roth | 8070.2 | Sample bleaching |
| Methanol | Carl Roth | 4627.4 | Sample pretreatment |
| Paraformaldehyde | Carl Roth | 0335.3 | Crystalline powder to make fixative solution |
| Sodium azide | Carl Roth | K305.1 | Prevention of microbial growth in stock solutions |
| tert-Butanol | Alfa Aesar | 33278 | Sample dehydration for tissue clearing |
| TO-PRO-3 | Thermo Fisher | T3605 | Nucleic acid stain |
| Triton X-100 | Carl Roth | 3051.2 | Detergent |
| Tween 20 | AppliChem | A4974,0500 | Detergent |
| Miscellaneous | |||
| 5 mL reaction tubes | Eppendorf | 0030119401 | Sample tubes |
| Coverslip, circular (diameter: 22 mm) | Marienfeld | 0111620 | Part of imaging chamber |
| Coverslip, circular (diameter: 30 mm) | Marienfeld | 0111700 | Part of imaging chamber |
| Hypodermic needle (27 G x ¾” [0.40 mm x 20 mm]) | B. Braun | 4657705 | Filling of the imaging chamber with clearing solution |
| RTV-1 silicone rubber | Wacker | Elastosil E43 | Adhesive for the assembly of the imaging chamber |
| Ultimaker CPE 2.85 mm transparent | Ultimaker | 8718836374869 | Copolyester filament for 3D printer to print parts of the imaging chamber |
| Technical equipment and software | |||
| 3D printer | Ultimaker | Ultimaker 2+ | Printing of imaging chamber |
| Automated water immersion system | Leica | 15640019 | Software-controlled water pump |
| Benchtop orbital shaker | Elmi | DOS-20M | Sample incubation at room temperature (~ 150 rpm) |
| Benchtop orbital shaker, heated | New Brunswick Scientific | G24 Environmental Shaker | Sample incubation at 37 °C (~ 150 rpm) |
| Confocal laser scanning microscope | Leica | DMI 6000 TCS SP5 | Inverted confocal microscope for sample imaging |
| Fiji | NIH (ImageJ) | open source software (v1.52h) | Image processing package based on ImageJ |
| Long working distance water immersion objective | Leica | 15506360 | HC PL APO 40x/1.10 W motCORR CS2 |
| Vibratome | Leica | VT1200S | Sample slicing |
| Workstation | Dell | Precision 7920 | CPU: Intel Xeon Gold 5118 GPU: Nvidia Quadro P5000 RAM: 128 GB 2666 MHz DDR4 SSD: 2 TB |
| Primary antibodies | |||
| Goat anti-RABV N | Friedrich-Loeffler-Institut | Monospecific polyclonal goat anti-RABV N serum, generated by goat immunization with baculovirus-expressed and His-tag-purified RABV nucleoprotein N Dilution: 1:400 | |
| Rabbit anti-GFAP | Dako | Z0334 | Polyclonal antibody (RRID:AB_10013382) Dilution: 1:100 |
| Rabbit anti-MAP2 | Abcam | ab32454 | Polyclonal antibody (RRID:AB_776174) Dilution: 1:250 |
| Rabbit anti-RABV P 160-5 | Friedrich-Loeffler-Institut | Monospecific polyclonal rabbit anti-RABV P serum, generated by rabbit immunization with baculovirus-expressed and His-tag-purified RABV phosphoprotein P (see reference 23: Orbanz et al., 2010) Dilution: 1:1,000 | |
| Secondary antibodies | |||
| Donkey anti-goat IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Donkey anti-mouse IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Donkey anti-rabbit IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Goat anti-mouse IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Goat anti-rabbit IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
Referanslar
- Pichat, J., Iglesias, J. E., Yousry, T., Ourselin, S., Modat, M. A Survey of Methods for 3D Histology Reconstruction. Medical Image Analysis. 46, 73-105 (2018).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nature Neuroscience. 16 (8), 1154-1161 (2013).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Susaki, E. A., et al. Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis. Cell. 157 (3), 726-739 (2014).
- Susaki, E. A., et al. Advanced CUBIC protocols for whole-brain and whole-body clearing and imaging. Nature Protocols. 10 (11), 1709-1727 (2015).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10 (11), 1860-1896 (2015).
- Dodt, H. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nature Methods. 4 (4), 331-336 (2007).
- Erturk, A., et al. Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury. Nature Medicine. 18 (1), 166-171 (2011).
- Erturk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Masland, R. H. Neuronal cell types. Current Biology. 14 (13), 497-500 (2004).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- WHO. WHO Expert Consultation on Rabies, Third Report. WHO Technical Report Series. , (2018).
- CDC. . Biosafety in Microbiological and Biomedical Laboratories, 5th Edition. US Department of Health and Human Services. , (2009).
- Arnold, M. M., et al. Effects of fixation and tissue processing on immunohistochemical demonstration of specific antigens. Biotechnic & Histochemistry. 71 (5), 224-230 (1996).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on diagnostic immunohistochemistry in domestic animals. Journal of Histochemistry and Cytochemistry. 57 (8), 753-761 (2009).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. The American Journal of Surgical Pathology. 24 (7), 1016-1019 (2000).
- Orbanz, J., Finke, S. Generation of recombinant European bat lyssavirus type 1 and inter-genotypic compatibility of lyssavirus genotype 1 and 5 antigenome promoters. Archives of Virology. 155 (10), 1631-1641 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır