Method Article
Imagem latente 3D de alta resolução da infecção do vírus da raiva no tecido solvente-cancelado do cérebro
Neste Artigo
Resumo
Novel, técnicas de compensação de tecido compatível com imunocoloração, como a imagem 3D final de órgãos com solventes limpos, permitem a visualização 3D da infecção cerebral pelo vírus da raiva e seu ambiente celular complexo. As fatias grossas, anticorpo-etiquetadas do tecido de cérebro são feitas opticamente transparentes para aumentar a profundidade da imagem latente e para permitir a análise 3D pela microscopia confocal da exploração do laser.
Resumo
A visualização de processos de infecção em tecidos e órgãos por imunolabeling é um método-chave na biologia da infecção moderna. A capacidade de observar e estudar a distribuição, tropismo e abundância de patógenos dentro de tecidos de órgãos fornece dados cruciais sobre o desenvolvimento e progressão da doença. Usando métodos convencionais da microscopia, Immunolabeling é restringido na maior parte às seções finas obtidas das amostras parafina-encaixadas ou congeladas. No entanto, o plano de imagem 2D limitado dessas seções finas pode levar à perda de informações cruciais sobre a estrutura complexa de um órgão infectado e o contexto celular da infecção. As técnicas multicolor, immunomancha-compatíveis modernas do esclarecimento do tecido fornecem agora uma maneira relativamente rápida e barata de estudar pilhas de imagem 3D high-volume do tecido vírus-contaminado do órgão. Ao expor o tecido a solventes orgânicos, torna-se opticamente transparente. Isso corresponde aos índices de refração da amostra e, eventualmente, leva a uma redução significativa do espalhamento de luz. Assim, em combinação com os objetivos livres longos da distância de trabalho, as grandes seções do tecido até 1 milímetro no tamanho podem ser imaged pela microscopia confocal convencional da exploração do laser (CLSM) na alta resolução. Aqui, nós descrevemos um protocolo para aplicar a imagem latente do profundo-tecido após o esclarecimento do tecido para visualizar a distribuição do vírus de raiva em cérebros contaminados a fim estudar tópicos como a patogénese, a propagação, o tropism, e o neuroinvasion do vírus.
Introdução
As técnicas convencionais da histologia confiam na maior parte em seções finas de tecidos do órgão, que podem inerentemente fornecer somente introspecções 2D em um ambiente 3D complexo. Embora viável, em princípio, a reconstrução 3D de seções finas seriais exige condutas técnicas exigentes para fatiar e subsequente no alinhamento silico das imagens adquiridas1. Além disso, a reconstrução sem emenda de z-volumes depois que fatiar do micrótomo é crítica porque os artefatos mecânicos e computacionais podem remanescer por causa do registo suboptimal da imagem causado por planos nonsobrepor da imagem, por variações da mancha, e por física destruição do tecido por, por exemplo, a lâmina do micrótomo. Em contraste, o corte óptico puro de amostras de tecido grosso intacto permite a aquisição de planos de imagem sobrepostas (sobreamostragem) e, assim, facilita a reconstrução 3D. Isso, por sua vez, é altamente benéfico para a análise de processos de infecção em populações de células complexas (por exemplo, redes neuronais no contexto das células gliais e imunes circundantes). Entretanto, os obstáculos inerentes de seções grossas do tecido incluem o espalhamento claro e a penetração limitada do anticorpo no tecido. Nos últimos anos, uma variedade de técnicas foi desenvolvida e otimizada para superar essas questões2,3,4,5,6,7,8 , 9 anos de , 10 de , 11 anos de , 12 anos de , 13. essencialmente, os tecidos-alvo são girados opticamente transparentes pelo tratamento com2,3,4,5,6,7aquosos ,8,9 ou solvente orgânico-baseado10,11,12,13 soluções. A introdução de 3Disco (imagem latente 3D de órgãos solvente-cancelados)11,12 e seu sucessor udisco (imagem latente 3D final de órgãos solvente-cancelados)13 forneceu uma ferramenta relativamente rápida, simples, e barata com excelentes capacidades de compensação. Os principais constituintes do protocolo de compensação são os solventes orgânicos tert-butanol (TBA), álcool benzílico (BA), benzoato de benzilo (BB) e éter DIFENÍLICO (DPE). O desenvolvimento e a adição de iDISCO (Immunolabeling-permitiu a imagem latente 3D de órgãos solvente-cancelados)14, um protocolo de imunomarcação compatível, constituíram uma outra vantagem sobre métodos existentes e permitiram a rotulagem do profundo-tecido dos antígenos de interesse, bem como o armazenamento a longo prazo de amostras imuno-manchadas. Assim, a combinação de iDISCO14 e udisco13 permite a imagem latente de alta resolução de proteínas anticorpo-etiquetadas em grandes seções do tecido (até 1 milímetro) usando CLSM convencional.
A preservação da estrutura complexa de um órgão em todas as três dimensões é particularmente importante para o tecido cerebral. Os neurônios compreendem uma subpopulação celular muito heterogênea com morfologias 3D altamente diversificadas baseadas em suas projeções de neurite (revistas por Masland15). Além disso, o cérebro consiste em vários compartimentos e subcompartimentos, cada um composto por diferentes subpopulações celulares e suas proporções, incluindo células gliais e neurônios (revisados por von Bartheld et al.16). Como um vírus neurotrópico, o vírus da raiva (RABV, revisto por Fooks et al.17) infecta principalmente os neurônios, usando sua maquinaria de transporte para viajar em direção retrógrada ao longo de axônios do local primário de infecção para o sistema nervoso central (CNS). O protocolo aqui descrito (Figura 1a) permite a detecção e visualização assistida por imunocoloração de células infectadas por rabv e rabv em pilhas de imagens grandes e coerentes obtidas de tecido cerebral infectado. Isso permite uma avaliação de alta resolução 3D imparcial do ambiente de infecção. É aplicável ao tecido cerebral de uma variedade de espécies, pode ser realizada imediatamente após a fixação ou após o armazenamento a longo prazo de amostras em paraformaldeído (PFA), e permite o armazenamento e reimagem de amostras manchadas e limpas por meses.
Protocolo
RABV-Infected, material arquivado PFA-fixo do cérebro foi usado. Os respectivos estudos experimentais em animais foram avaliados pelo Comitê responsável de cuidados, uso e ética do escritório Estadual de agricultura, segurança alimentar e pescaria em Mecklemburgo-Pomerânia Ocidental (LALFF M-V) e obteve aprovação com permissões 7221.3-2.1-002/11 (camundongos) e 7221.3-1-068/16 (furões). Os cuidados gerais e os métodos utilizados nos experimentos com animais foram realizados de acordo com as diretrizes aprovadas.
PRECAUÇÃO: Este protocolo utiliza várias substâncias tóxicas e/ou nocivas, incluindo PFA, metanol (MeOH), peróxido de hidrogénio (H2O2), azida sódica (NaN3), TBA, BA, BB e DPE. MeOH e TBA são altamente inflamáveis. Evite a exposição usando equipamentos de proteção individual apropriados (um jaleco, luvas e proteção ocular) e conduzindo experimentos em uma capa de fumaça. Recolher os resíduos separadamente em recipientes apropriados e eliminá-lo de acordo com as regulamentações locais. O vírus da raiva é classificado como um nível de biossegurança (BSL)-2 patógeno e pode, portanto, geralmente ser tratado condições BSL-2. Algumas atividades, incluindo procedimentos que podem gerar aerossóis, trabalhar com altas concentrações de vírus, ou trabalhar com novos lissavírus, podem requerer classificação BSL-3. A profilaxia pré-exposição é recomendada para pessoal de alto risco, incluindo cuidadores de animais e trabalhadores de laboratório18,19. Consulte os regulamentos da autoridade local.
1. fixação de tecido cerebral e seccionamento
- Fixar amostras cerebrais num volume adequado de 4% de PFA em soro fisiológico tamponado com fosfato (PBS [pH 7,4]) durante pelo menos 48 h a 4 ° c (com uma relação tecido-a-fixativa aproximada de 1:10 [v/v]).
- Lave as amostras de tecido 3x em PBS por pelo menos 30 min cada lavagem e armazená-los em 0, 2% NaN3/PBS a 4 ° c até o uso.
- Corte o tecido em seções de 1 mm de espessura usando um do (taxa de avanço da lâmina: 0,3 – 0,5 mm/s, amplitude: 1 mm, espessura da fatia: 1.000 μm).
- Para manter a sequência de fatias correta, armazene cada seção de tecido separadamente em um poço de uma placa de cultura de células multipoços. Adicionar 0, 2% NaN3/PBS e guarde as secções de tecido a 4 ° c até à utilização.
2. amostra pré-tratamento com metanol
Nota: realize todas as etapas de incubação com oscilação suave e, se não indicado de outra forma, à temperatura ambiente. Proteja as amostras da luz. O pré-tratamento da amostra serve a finalidade geral de melhorar a difusão do anticorpo e de reduzir o autofluorescence do tecido pela exposição ao MeOH e ao H2o2, respectivamente14.
- Prepare 20% (v/v), 40%, 60%, e 80% MeOH soluções em água destilada. Por exemplo, para 20% MeOH, adicione 10 mL de 100% MeOH a 40 mL de água destilada em uma embarcação selável apropriada e misture invertendo-a.
- Transfira as amostras para embarcações de tamanho razoável (por exemplo, tubos de reacção de 5 mL). Tome cuidado para usar materiais quimicamente resistentes aos reagentes utilizados neste protocolo. Por exemplo, note que, enquanto o polipropileno é adequado, o poliestireno não é.
Nota: as especificações de volume neste protocolo referem-se a 5 mL de tubos de reacção. Se for utilizada uma embarcação diferente, ajuste os volumes em conformidade. - Incubar as amostras em 4 mL de cada concentração da série preparada de soluções de MeOH em ordem ascendente para 1 h cada.
- Incubar as amostras 2x por 1 h cada em puro (100%) MeOH.
- Resfrie as amostras a 4 ° c (por exemplo, em um refrigerador de laboratório seguro).
- Prepare a solução de branqueamento (5% H2o2 em MeOH), por exemplo, diluindo uma solução de stock de 30% h2O2 em 1:6 em puro (100%) MeOH, e Chill-lo a 4 ° c.
- Retire o 100% MeOH das amostras refrigeradas e adicione 4 mL de solução de branqueamento pré-refrigerada (5% H2O2 em MeOH). Incubar durante a noite a 4 ° c.
- Troque a solução clareador por 4 mL de 80% de MeOH e incubar por 1 h. Continue usando a série preparada de soluções de MeOH em ordem decrescente para 1 h cada um até que as amostras foram incubadas por 1 h em 4 mL de 20% MeOH.
- Lave as amostras 1x por 1 h com 4 mL de PBS.
3. imunocoloração
Nota: realize todas as etapas de incubação com oscilação suave e, se não indicado de outra forma, à temperatura ambiente. Proteja as amostras da luz. Para evitar o crescimento microbiano, adicionar NaN3 a uma concentração final de 0, 2% para as soluções nesta seção. As amostras de tecido são ainda mais permeabilizadas pelo tratamento com detergentes não iônicos Triton X-100 e Tween 20. O soro normal é usado para bloquear a ligação de anticorpos inespecíficos. Glicina e heparina são adicionadas para reduzir o fundo de imunolabeling14.
- Lave as amostras 2x durante 1 h cada uma em 4 mL de 0,2% Triton X-100/PBS.
- Permeabilize as amostras por 2 dias a 37 ° c com 4 mL de 0,2% Triton X-100/20% DMSO/0.3 M Glycine/PBS.
- Bloqueie a ligação inespecífica de anticorpos incubando as amostras durante 2 dias a 37 ° c em 4 mL de 0,2% de soro/PBS normal de Triton X-100/10% DMSO/6%.
Nota: Use o soro normal da mesma espécie que o anticorpo secundário estêve levantado dentro para conseguir resultados de obstrução ideais. - Incubar as amostras em 2 mL de solução de anticorpos primários (3% soro normal/5% DMSO/PTwH [PBS-Tween 20 com heparina] + anticorpo primário/anticorpos) durante 5 dias a 37 ° c. Atualize a solução de anticorpos primários após 2,5 dias.
- Para o PTwH, reconstitua o sal de sódio da heparina em água destilada para fazer uma solução de estoque de 10 mg/mL (armazene esta solução, aliquotados, a 4 ° c). Adicionar a solução de ações para 0,2% Tween 20/PBS a uma concentração final de 10 μg/mL.
Nota: a escolha da diluição correcta do anticorpo pode necessitar de optimização. Geralmente, as concentrações padrão de Immunohistochemistry são um bom ponto começar.
- Para o PTwH, reconstitua o sal de sódio da heparina em água destilada para fazer uma solução de estoque de 10 mg/mL (armazene esta solução, aliquotados, a 4 ° c). Adicionar a solução de ações para 0,2% Tween 20/PBS a uma concentração final de 10 μg/mL.
- Lave as amostras durante 1 dia em 4 mL de PTwH, trocando o tampão de lavagem pelo menos 4x – 5x durante o curso do dia e deixando a lavagem final durante a noite.
- Incubar as amostras em 2 mL de solução de anticorpos secundários (3% soro normal/PTwH + anticorpo secundário/anticorpos) durante 5 dias a 37 ° c. Refresque a solução secundária do anticorpo após 2,5 dias.
- Diluir o anticorpo secundário/anticorpos em 1:500 na solução de anticorpos secundários (i.e., 4 μL em 2 mL).
- Lave as amostras durante 1 dia, conforme descrito no passo 3,5, deixando a lavagem final durante a noite.
4. coloração nuclear
Nota: realize todas as etapas de incubação com oscilação suave e, se não indicado de outra forma, à temperatura ambiente. Proteja as amostras da luz. Se nenhuma mancha nuclear é exigida ou o espectro do comprimento de onda/emissão da excitação de a-PRO-3 é exigido para a excitação ou a deteção de um outro fluorophore, salte esta etapa.
- Diluir a mancha de ácido nucleico para-PRO-3 em 1:1000 em PTwH e incubar as amostras em 4 mL de solução de coloração nuclear por 5 h.
- Lave as amostras durante 1 dia, conforme descrito no passo 3,5, deixando a lavagem final durante a noite.
Nota: após as lavagens, as amostras podem ser armazenadas em PBS a 4 ° c até a limpeza óptica.
5. esclarecimento do tecido
Nota: realize todas as etapas de incubação com oscilação suave e, se não indicado de outra forma, à temperatura ambiente. Proteja as amostras da luz. As amostras de tecido são desidratadas em uma série graduada de soluções de TBA. Como a imunocoloração requer soluções aquosas, todos os procedimentos de coloração devem ser terminados antes da limpeza tecidual. O afastamento ótico e a harmonização do índice refração são conseguidos pelo tratamento com uma mistura de Ba, de BB, e de DPE. A solução de compensação é suplementada com DL-α-tocoferol como um antioxidante13.
- Prepare soluções de 30% (v/v), 50%, 70%, 80%, 90% e 96% de TBA em água destilada. Por exemplo, para 30% TBA, adicione 15 mL de 100% TBA a 35 mL de água destilada em uma embarcação selável apropriada e misture invertendo.
Nota: o TBA tem um ponto de fusão de 25 – 26 ° c; assim, tende a ser sólido à temperatura ambiente. A fim de preparar as soluções TBA, aqueça o frasco bem selado a 37 ° c em uma incubadora ou banho de água. - Desidratar as amostras com 4 mL de cada concentração da série preparada de soluções de TBA em ordem ascendente para 2 h cada. Deixe o 96% TBA durante a noite.
- Desidrata as amostras mais em puro (100%) TBA para 2 h.
- Prepare solução de compensação BABB-D15.
Nota: BABB-D15 é uma combinação de BA e BB (BABB) que é misturado com o DPE em uma relação de x: 1, onde x é especificado no nome da solução, neste caso 15.- Para BABB, misture uma parte BA com duas partes BB.
- Misture BABB e DPE em uma proporção de 15:1.
- Adicionar 0,4 vol% DL-α-tocoferol (vitamina E).
Nota: por exemplo, para 20 mL de BABB-D15, misture 6,25 mL de BA com 12,5 mL de BB. Adicionar 1,25 mL de DPE e completá-lo com 0, 8 mL de DL-α-tocoferol.
- Limpe as amostras na solução de compensação até que sejam opticamente transparentes (2 – 6 h).
- As amostras podem ser armazenadas a 4 ° c em BABB-D15, protegidas da luz, até a montagem e a imagem.
6. montagem da amostra
- Usando uma impressora 3D, imprima a câmara de imagem e a tampa (material: copoliéster [CPE], bocal: 0,25 mm, altura da camada: 0, 6 mm, espessura da parede: 0,88 mm, contagem de parede: 4, infill: 100%, sem estrutura de suporte; o correspondente. O arquivo STL pode ser encontrado nos materiais suplementares deste protocolo).
- Montar a câmara de imagem (Figura 2).
- Monte um lamela redondo (diâmetro: 30 milímetros) na câmara da imagem latente com RTV-1 (um-componente quarto-temperatura-vulcanizing) borracha de silicone. Retire o excesso de borracha de silicone com um cotonete de algodão molhado e Cure durante a noite.
- Montar uma lamínula redonda (diâmetro: 22 mm) na tampa com borracha de silicone RTV-1. Retire o excesso de borracha de silicone com um cotonete de algodão molhado e Cure durante a noite.
- Coloque a amostra em uma câmara de imagem, adicione um pequeno volume de BABB-D15 e insira a tampa. Encha a câmara com BABB-D15 através da entrada, usando uma agulha hipodérmica (27 G x 3/4 polegada [0,40 mm x 20 mm]).
- Ligue a entrada e sele a câmara de imagem com borracha de silicone RTV-1. Cure durante a noite no escuro.
7. processamento de imagens e imagens
- Configure a aquisição da imagem selecionando as respectivas linhas de laser para corresponder aos fluoróforos utilizados. Ajuste os intervalos de detecção de cada detector para evitar a sobreposição do sinal entre os canais.
Nota: intervalos de detecção exemplares para Alexa fluor 488, Alexa fluor 568 e TO-PRO-3 são 500 – 550 nm, 590 – 620 nm e 645 – 700 nm, respectivamente. - Escolha os parâmetros de aquisição, defina a borda superior e inferior da pilha z e adquira a pilha de imagens.
Nota: os parâmetros de aquisição exemplares são uma verificação sequencial com um tamanho de pixel de 60-90 nm, um tamanho z-Step de 0,5 μm, uma média de linha de 1, uma velocidade de digitalização de 400 Hz e um tamanho de furo de pino de 1 unidade arejada. - Processe a pilha de imagens usando um software de análise de imagem apropriado (por exemplo, Fiji) para gerar projeções 3D ou realizar análises aprofundadas.
Observação: devido ao tamanho grande dos arquivos de imagem adquiridos, o uso de uma estação de trabalho geralmente é necessário.- Abra o arquivo de aquisição ou imagem (s) em Fiji (File | Aberto | Selecionar arquivos).
- Se estiver usando, por exemplo,. Arquivos LIF, selecione ou desmarque as opções desejadas na janela de diálogo bio-formats. Exibir pilha com hyperstack. Além disso, não são necessárias seleções ou Ticks específicos. Prima OK.
- Se o arquivo contiver várias pilhas de imagens, selecione as que serão analisadas e confirme pressionando OK.
- Realize correção de lixívia dividindo a imagem mesclada em canais individuais (Image | Cor | Channels Toole, em seguida, selecione mais | Canais divididos). Para cada canal, selecione correção de lixívia (Image | ADJUST | Correção de lixívia) e escolha a relação simples (intensidade do fundo: 0,0).
Nota: em alguns casos, por exemplo, quando não há nenhuma deterioração linear do sinal ou o sinal é demasiado fraco total, a relação simples pode falhar. Alternativamente, tente ajuste exponencial ou pule a correção de lixívia. - Ajuste o brilho e o contraste para cada canal usando os controles deslizantes (Image | Ajustar o ajuste | Brilho | Contraste).
- Mesclar os canais (imagem | Cor | Mesclar canais), faça uma composição (imagem | Color | Channels Toole, em seguida, selecione mais | Fazer Composite), e convertê-lo para o formato RGB (Image | Color | Channels Toole, em seguida, selecione mais | Converta para RGB).
- Se necessário, redimensione a pilha de imagens para reduzir o tempo de computação e o tamanho do arquivo (Image | ADJUST | Tamanho, ambas as opções assinalada mais bilinear interpolação).
- Gerar uma projeção 3D (Image | Stacks | projeto 3D). Escolha o ponto mais brilhante como método de projeção e defina o espaçamento da fatia para corresponder ao tamanho da etapa z da pilha de imagens adquirida. Para obter a máxima qualidade, defina o incremento do ângulo de rotação para 1 e habilite a interpolação. Modifique a rotação total, os limites de transparência e a opacidade conforme necessário.
- Se necessário, reajustar o contraste e o brilho convertendo a projeção 3D de volta para o formato de 8 bits (Image | Tipo | 8 bits). Use os respectivos controles deslizantes (Image | ADJUST | Brilho | Contraste) e reconverter a pilha de imagens para o formato RGB conforme descrito na etapa 7.3.4.
- Salve a projeção 3D como. TIF arquivo (formato de arquivo de imagem) e. Arquivo AVI (formato de arquivo de vídeo).
- Abra o arquivo de aquisição ou imagem (s) em Fiji (File | Aberto | Selecionar arquivos).
Resultados
A combinação de idisco14 e de udisco13 acoplada com o CLSM de alta resolução fornece introspecções profundas na definição e na plasticidade armazenamento da infecção de rabv do tecido de cérebro e do contexto celular circunvizinho.
Usando imunocoloração da fosfoproteína RABV (P), camadas complexas de células neuronais infectadas podem ser visualizadas em cortes grossos de cérebros de camundongo (Figura 3). Subseqüentemente, as projeções 3D sem emenda das pilhas adquiridas da imagem podem ser reconstruídas (Figura 3A, B, painel direito; Figura animada 1). O cuidado deve ser tomado quando se utiliza anticorpos primários de e anticorpos secundários contra a espécie que o material de órgão origina. O uso de anticorpos anti-mouse IgG no tecido cerebral do camundongo resultou em uma coloração distinta do sistema vascular (Figura 3B, painel esquerdo). Por causa da alta resolução, as pilhas de imagens são adquiridas com, a infecção pode ser avaliada até um nível de célula única (Figura 4), permitindo asserções sobre, por exemplo, a abundância e distribuição de antígeno dentro da célula (Figura 4C ).
Além do tecido cerebral do camundongo, o protocolo também pode ser aplicado ao tecido cerebral de outras espécies animais (por exemplo, furões) (Figura 5; Figura animada 2). As seções tomadas dos compartimentos diferentes de um cérebro contaminado da doninha revelaram um grau de variação da infecção de RABV (Figura 5a-D).
Como o cérebro compreende muitas subpopulações celulares diferentes, a diferenciação entre estas populações é vital. Usando anticorpos dirigidos contra marcadores celulares, é possível avaliar a identidade celular de células infectadas e vizinhas. Por exemplo, os astrócitos podem ser diferenciados através da expressão de proteína glial fibrilhar ácida (GFAP) (Figura 6A, C; Figura animada 3), enquanto os neuritos podem ser especificamente corados para proteína associada a microtubulas 2 (map2) (Figura 6B, D; Figura animada 4). Simultaneamente, as proteínas virais, neste caso, a nucleoproteína de RABV (N), podem ser costained para avaliar a relação entre pilhas contaminadas e a subpopulação celular destacada.

Figura 1 : Princípio básico e fluxo de trabalho do protocolo. (A) representação gráfica do fluxo de trabalho com base nos protocolos de Renier et al.14 e Pan et al.13. (B) duas fatias exemplares do cérebro da doninha, uma antes (painel esquerdo) e uma após o tratamento com solventes orgânicos (painel direito). A compensação transforma o tecido opticamente transparente como observável pelo texto então legível. A fatia de cérebro desmarcada é incorporada em uma câmara de imagem impressa em 3D (painel direito). Por favor clique aqui para ver uma versão maior desta figura.
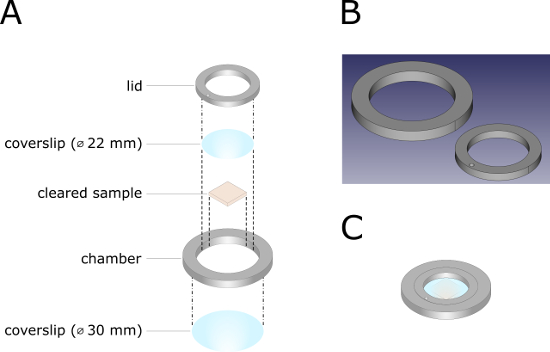
Figura 2 : Ilustração técnica da câmara de imagem 3D-printed. (A) desenho de vista explodido da câmara de imagem. As linhas ponto-tracejadas destacam os componentes que devem ser montados uns sobre os outros usando borracha de silicone RTV-1. As linhas tracejadas representam instruções para a montagem subsequente da câmara. (B) arquivo CAD (Computer-Aided Design) da câmara de imagem. O correspondente. STL arquivo para imprimir a câmara de imagem pode ser encontrada nos materiais suplementares. (C) câmara de imagem totalmente montada. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3 : Imagem latente do profundo-tecido do tecido RABV-contaminado do cérebro do rato. (A e B) camundongos foram infectados com um vírus de rua de Vulpine recombinante. RABV P coloração (verde) revela camadas neuronais infectadas com grandes, projeções de neurite emaranhados dentro do tecido cerebral limpo. Os núcleos foram contracorados com TO-PRO-3 (azul). (B) a utilização de anticorpos secundários IgG com rótulo fluoróforo (vermelho) no tecido do rato resulta numa rotulagem distinta do sistema vascular. A reconstrução 3D das pilhas adquiridas da imagem permite a observação dos ângulos de visão diferentes (a e B, painéis direito). Barras de escala = 60 μm. por favor clique aqui para ver uma versão maior desta figura.

Figura 4 : A aquisição de imagens de alta resolução permite avaliações complexas até um nível de célula única. O cérebro foi dissecado de um rato SAD L16-infected. (A) a coloração deRabv P (verde) destaca um Neuron individualmente infectado. (B e C) as imagens e projeções detalhadas demonstram que as análises aprofundadas de abundância, distribuição e localização do antígeno podem ser realizadas. Os núcleos foram contracorados com TO-PRO-3 (azul). Barras de escala = 20 μm (A), 5 μm (C). Por favor clique aqui para ver uma versão maior desta figura.
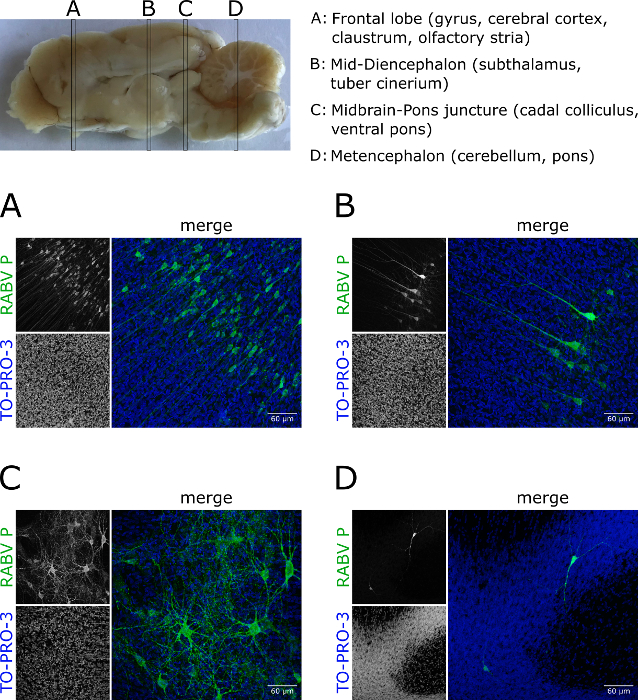
Figura 5 : Imagem latente do profundo-tecido do tecido RABV-contaminado do cérebro da doninha. Furões foram infectados com a rua canina RABV. (A–D) Fatias de áreas especificadas do cérebro foram tomadas, imunomanchadas para RABV P (verde), e opticamente desmarcada. Projeções demonstram que as células infectadas em diferentes partes do cérebro diferem em quantidade e morfologia. Além disso, destacam a aplicabilidade do protocolo a outros tecidos que não os derivados do camundongo. Os núcleos foram contracorados com TO-PRO-3 (azul). Barras de escala = 60 μm. por favor clique aqui para ver uma versão maior desta figura.

Figura 6 : A imunofluorescência multicolor permite o costaining de marcadores celulares. As fatias do tecido de cérebro dos furões contaminados com rua canina RABV foram usadas e coimmunomanchado para RABV N (vermelho) e (A e C) GFAP (verde) ou (B e D) map2 (verde). Considerando que o GFAP é um marcador astrocícito, o MAP2 destaca especificamente os neuritos. Os núcleos foram contracorados com TO-PRO-3 (azul). (C e D) na parte inferior, as extrações de fatia única dos modos de exibição de detalhes enumerados das projeções mescladas são representadas. Barras de escala = 15 μm (A e B) 10 μm (C e D). Por favor clique aqui para ver uma versão maior desta figura.

Animated Figura 1: reconstruções 3D e projeções de detalhes de pilhas de imagens de cérebros de rato infectados pelo RABV. As projeções foram geradas a partir das pilhas de imagens descritas na Figura 3. (A e C) animações de todo o respectivo z-Stacks. (B) uma projeção detalhada de uma reconstrução 3D de uma parte da pilha z das áreas destacadas no início do vídeo. (D) uma projeção detalhada de um tomograma de uma parte da z-pilha das áreas destacadas no início do vídeo. Verde = RABV P; vermelho = rato IgG; azul = núcleos. Por favor clique aqui para ver este vídeo. (Clique com o botão direito do mouse para baixar.)

Figura animada 2: reconstruções 3D de pilhas de imagens adquiridas de um cérebro de furão infectado por RABV. As projeções foram geradas a partir das pilhas de imagens descritas na Figura 5. (A–D) As anotações referem-se à mesma figura e descrevem as respectivas áreas do cérebro que as fatias foram tiradas. Verde = RABV P; azul = núcleos. Por favor clique aqui para ver este vídeo. (Clique com o botão direito do mouse para baixar.)

Figura animada 3: a projeção gradual dos canais diferentes de uma reconstrução 3D de um cérebro RABV-contaminado do Ferret costained com o marcador GFAP do astrocyte. As projeções foram geradas a partir da pilha de imagens descrita na Figura 6a. A adição gradual de canais começa com RABV N (vermelho), após o que seguem os núcleos celulares (azul) e, finalmente, GFAP (verde), enquanto a subtração primeiro remove RABV N, em seguida, os núcleos celulares, e eventualmente GFAP. Por favor clique aqui para ver este vídeo. (Clique com o botão direito do mouse para baixar.)

Figura animada 4: projeção gradual dos diferentes canais de uma reconstrução 3D de um cérebro de furão infectado com RABV costained com marcador neuronal map2. As projeções foram geradas a partir da pilha de imagens descrita na Figura 6B. A adição gradual de canais começa com RABV N (vermelho), após o que seguem os núcleos celulares (azul) e, finalmente, MAP2 (verde), enquanto a subtração primeiro remove RABV N, em seguida, os núcleos celulares, e, eventualmente, MAP2. Por favor clique aqui para ver este vídeo. (Clique com o botão direito do mouse para baixar.)
Discussão
O ressurgimento e o desenvolvimento de técnicas de compensação tecidual nos últimos anos2,3,4,5,6,7,8, 9 anos de , 10 de , 11 anos de , 12 anos de , 13 anos de , 14 abriram muitas novas possibilidades para obter pilhas de imagem de alto volume de tecido de órgãos. Isso forneceu uma ferramenta incomparável e poderosa para estudar, entre muitos outros tópicos, infecção por vírus. A reconstrução 3D subsequente destas pilhas da imagem permite asserções sofisticadas sobre, por exemplo, o tropism do vírus, a abundância, e o curso do tempo da infecção. Este protocolo descreve o visualização Immunolabeling-ajudado da infecção de RABV no tecido solvente-cancelado do cérebro.
Há diversas etapas críticas na preparação e na aquisição das pilhas da imagem do tecido immunolabeled, solvente-cancelado. A exposição prolongada ao PFA pode mascarar resumos e, assim, resultar em antigenicidade diminuída20,21,22. É, portanto, importante limitar os tempos de fixação ao mínimo necessário e transferir as amostras para uma solução adequada (por exemplo, PBS suplementado com 0, 2% NaN3 para armazenamento de longo prazo). No entanto, todas as imagens e projeções representativas fornecidas aqui foram adquiridas a partir de amostras de cérebro arquivadas, algumas das quais foram armazenadas na PFA por semanas, destacando a aplicabilidade da técnica ao material de órgãos que foi exposto à PFA para longos períodos de tempo. Resultados semelhantes foram mostrados para amostras de cérebro humano13. Outro, se não o mais, passo crítico é a incubação de anticorpos. As concentrações de anticorpos têm de ser escolhidas cuidadosamente. Quando na maioria dos casos, as concentrações padrão de IHC são um bom ponto de partida para a rotulagem do anticorpo do profundo-tecido, alguns antígenos podem exigir a optimização adicional da concentração do anticorpo. Este protocolo demonstra que o RABV N e o P são prontamente detectáveis pelos anticorpos usados. Quando o pré-tratamento de MeOH melhorar geralmente Immunolabeling, alguns antígenos são incompatíveis com este tratamento. Para aqueles, Renier e colegas14 forneceram um pré-tratamento MeOH-livre alternativo da amostra. A análise das pilhas de imagens adquiridas requer potência computacional adequada. Devido aos tamanhos de arquivo grandes de até vários gigabytes por pilha, computadores poderosos são necessários para processar as imagens. O pós-processamento geralmente inclui a subtração do ruído de fundo e uma correção de lixívia para compensar os efeitos de branqueamento associados à aquisição. Ao medir distâncias, tem que ser mantido em mente que, como um efeito colateral, o tecido está diminuindo durante o processo de compensação.
Em comparação com outras plataformas de microscopia, como microscopia de fluorescência de folha de luz (LSFM) ou microscopia de varredura a laser de dois fótons (2PLSM), o CLSM tem a distância de trabalho mais limitada. Conseqüentemente, é necessário preslice órgãos a 1 milímetro na espessura para a imagem latente. Adicionalmente, CLSM tem a velocidade a mais lenta da aquisição por causa de sua definição elevada da imagem latente. O uso de um microscópio da folha clara permitiria uma imagem latente mais rápida de volumes maiores até a imagem latente do todo-cérebro, ao sacrificar simultaneamente a definição da imagem. Outra limitação é o aumento inerente da autofluorescência tecidual com o comprimento de onda decrescente. Isso torna o uso de fluoróforos e corantes animado pela linha de laser em 405 nm, incluindo corantes Hoechst, impraticável a impossível.
Com relação a outras técnicas de compensação tecidual, o híbrido do iDISCO14 e do udisco13 combina os atributos mais positivos: é altamente compatível com imunocoloração, altamente versátil, comparativamente rápido e barato, tem excelentes capacidades de compensação, e é viável com um microscópio confocal padrão. Além disso, este protocolo não é restrito à imunocoloração e ao esclarecimento do tecido cerebral, mas também pode ser aplicado a uma variedade de outros tecidos moles e patógenos, tanto neuroinvasivos como não-neuroinvasivos. Em conclusão, o protocolo descrito aqui representa um encanamento para a imagem latente 3D de alta resolução do tecido de cérebro RABV-contaminado. As reconstruções 3D do tecido cerebral infectado podem ser usadas para responder a uma variedade de perguntas sobre a progressão da doença de RABV, patogênese e neuroinvasão.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem a Thomas C. Mettenleiter e Verena te Kamp por lerem criticamente o manuscrito. Este trabalho foi apoiado pela iniciativa de excelência Federal de Mecklenburg Pomerânia Ocidental e do Fundo Social Europeu (FSE) Grant KoInfekt (FSE/14-BM-A55-0002/16) e uma subvenção de pesquisa colaborativa intramural sobre lyssavirus na Friedrich-Loeffler-Instituto (ri-0372).
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Benzyl alcohol | Alfa Aesar | 41218 | Clearing reagent |
| Benzyl benzoate | Sigma-Aldrich | BB6630-500ML | Clearing reagent |
| Dimethyl sulfoxide | Carl Roth | 4720.2 | Various buffers |
| Diphenyl ether | Sigma-Aldrich | 240834-100G | Clearing reagent |
| DL-α-Tocopherol | Alfa Aesar | A17039 | Antioxidant |
| Donkey serum | Bio-Rad | C06SBZ | Blocking reagent |
| Glycine | Carl Roth | 3908.2 | Background reduction |
| Goat serum | Merck | S26-100ML | Blocking reagent |
| Heparin sodium salt | Carl Roth | 7692.1 | Background reduction |
| Hydrogen peroxide solution (30 %) | Carl Roth | 8070.2 | Sample bleaching |
| Methanol | Carl Roth | 4627.4 | Sample pretreatment |
| Paraformaldehyde | Carl Roth | 0335.3 | Crystalline powder to make fixative solution |
| Sodium azide | Carl Roth | K305.1 | Prevention of microbial growth in stock solutions |
| tert-Butanol | Alfa Aesar | 33278 | Sample dehydration for tissue clearing |
| TO-PRO-3 | Thermo Fisher | T3605 | Nucleic acid stain |
| Triton X-100 | Carl Roth | 3051.2 | Detergent |
| Tween 20 | AppliChem | A4974,0500 | Detergent |
| Miscellaneous | |||
| 5 mL reaction tubes | Eppendorf | 0030119401 | Sample tubes |
| Coverslip, circular (diameter: 22 mm) | Marienfeld | 0111620 | Part of imaging chamber |
| Coverslip, circular (diameter: 30 mm) | Marienfeld | 0111700 | Part of imaging chamber |
| Hypodermic needle (27 G x ¾” [0.40 mm x 20 mm]) | B. Braun | 4657705 | Filling of the imaging chamber with clearing solution |
| RTV-1 silicone rubber | Wacker | Elastosil E43 | Adhesive for the assembly of the imaging chamber |
| Ultimaker CPE 2.85 mm transparent | Ultimaker | 8718836374869 | Copolyester filament for 3D printer to print parts of the imaging chamber |
| Technical equipment and software | |||
| 3D printer | Ultimaker | Ultimaker 2+ | Printing of imaging chamber |
| Automated water immersion system | Leica | 15640019 | Software-controlled water pump |
| Benchtop orbital shaker | Elmi | DOS-20M | Sample incubation at room temperature (~ 150 rpm) |
| Benchtop orbital shaker, heated | New Brunswick Scientific | G24 Environmental Shaker | Sample incubation at 37 °C (~ 150 rpm) |
| Confocal laser scanning microscope | Leica | DMI 6000 TCS SP5 | Inverted confocal microscope for sample imaging |
| Fiji | NIH (ImageJ) | open source software (v1.52h) | Image processing package based on ImageJ |
| Long working distance water immersion objective | Leica | 15506360 | HC PL APO 40x/1.10 W motCORR CS2 |
| Vibratome | Leica | VT1200S | Sample slicing |
| Workstation | Dell | Precision 7920 | CPU: Intel Xeon Gold 5118 GPU: Nvidia Quadro P5000 RAM: 128 GB 2666 MHz DDR4 SSD: 2 TB |
| Primary antibodies | |||
| Goat anti-RABV N | Friedrich-Loeffler-Institut | Monospecific polyclonal goat anti-RABV N serum, generated by goat immunization with baculovirus-expressed and His-tag-purified RABV nucleoprotein N Dilution: 1:400 | |
| Rabbit anti-GFAP | Dako | Z0334 | Polyclonal antibody (RRID:AB_10013382) Dilution: 1:100 |
| Rabbit anti-MAP2 | Abcam | ab32454 | Polyclonal antibody (RRID:AB_776174) Dilution: 1:250 |
| Rabbit anti-RABV P 160-5 | Friedrich-Loeffler-Institut | Monospecific polyclonal rabbit anti-RABV P serum, generated by rabbit immunization with baculovirus-expressed and His-tag-purified RABV phosphoprotein P (see reference 23: Orbanz et al., 2010) Dilution: 1:1,000 | |
| Secondary antibodies | |||
| Donkey anti-goat IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Donkey anti-mouse IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Donkey anti-rabbit IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Goat anti-mouse IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
| Goat anti-rabbit IgG | Thermo Fisher Scientific | depending on conjugated fluorophore | Highly cross-absorbed Dilution: 1:500 |
Referências
- Pichat, J., Iglesias, J. E., Yousry, T., Ourselin, S., Modat, M. A Survey of Methods for 3D Histology Reconstruction. Medical Image Analysis. 46, 73-105 (2018).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nature Neuroscience. 16 (8), 1154-1161 (2013).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
- Susaki, E. A., et al. Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis. Cell. 157 (3), 726-739 (2014).
- Susaki, E. A., et al. Advanced CUBIC protocols for whole-brain and whole-body clearing and imaging. Nature Protocols. 10 (11), 1709-1727 (2015).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Treweek, J. B., et al. Whole-body tissue stabilization and selective extractions via tissue-hydrogel hybrids for high-resolution intact circuit mapping and phenotyping. Nature Protocols. 10 (11), 1860-1896 (2015).
- Dodt, H. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nature Methods. 4 (4), 331-336 (2007).
- Erturk, A., et al. Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury. Nature Medicine. 18 (1), 166-171 (2011).
- Erturk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Masland, R. H. Neuronal cell types. Current Biology. 14 (13), 497-500 (2004).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Fooks, A. R., et al. Rabies. Nature Reviews Disease Primers. 3, 17091 (2017).
- WHO. WHO Expert Consultation on Rabies, Third Report. WHO Technical Report Series. , (2018).
- CDC. . Biosafety in Microbiological and Biomedical Laboratories, 5th Edition. US Department of Health and Human Services. , (2009).
- Arnold, M. M., et al. Effects of fixation and tissue processing on immunohistochemical demonstration of specific antigens. Biotechnic & Histochemistry. 71 (5), 224-230 (1996).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on diagnostic immunohistochemistry in domestic animals. Journal of Histochemistry and Cytochemistry. 57 (8), 753-761 (2009).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. The American Journal of Surgical Pathology. 24 (7), 1016-1019 (2000).
- Orbanz, J., Finke, S. Generation of recombinant European bat lyssavirus type 1 and inter-genotypic compatibility of lyssavirus genotype 1 and 5 antigenome promoters. Archives of Virology. 155 (10), 1631-1641 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados