Method Article
Polyacrylamide jeller içinde Mango-Tagged RNA floresan görselleştirme bir Poststaining yöntemi ile
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada RNA Mango aptamers ı, II, III veya IV ile etiketlenmiş görüntü Rnas 'ında doğal veya denatüre Poliakrilamid jel elektroforezi (Page) jelleri kullanarak hassas, hızlı ve ayrımcılık sonrası jel boyama yöntemi sunuyoruz. Standart sayfa jeller çalıştırdıktan sonra, Mango-Tagged RNA kolayca TO1-biotin ile lekelenmiş ve daha sonra yaygın olarak kullanılabilir floresan okuyucular kullanılarak analiz edilebilir.
Özet
Doğal ve denatüre Poliakrilamid jelleri, ribonukleoprotein (RNP) karmaşık mobilitesini karakterize etmek ve sırasıyla RNA boyutunu ölçmek için rutin olarak kullanılır. Birçok jel görüntüleme tekniği, spesifik olmayan lekeler veya pahalı fluorophore probları, hassas, ayrımcılık ve ekonomik jel görüntüleme metodolojileri çok tercih edilir. RNA Mango çekirdek dizileri, rasgele bir RNA kökü ile kapalıyken sadece ve pahalı olmayan bir RNA 'ya eklenebilen küçük (19 – 22 NT) sıralı motifler. Bu mango Etiketler bağlama üzerine binlerce kez daha floresan olur TO1-biotin denilen bir thiazole-turuncu fluorophore ligand için yüksek yakınlık ve özgüllük ile bağlayın. Burada Mango ı, II, III ve IV, yüksek hassasiyetle jeller RNA özellikle görüntü için kullanılabilir olduğunu göstermektedir. Doğal jellerin RNA 'nın 62,5 fmol 'sı ve 125 fmol olarak da denatüre jeller,% 30 dakika boyunca potasyum ve 20 Nm to1-biotin içeren bir görüntüleme tamponunun içinde jel ile tespit edilebilir. Mango etiketli sistemin özgüllüğünü, toplam bakteriyel RNA 'nın karmaşık bir karışımı bağlamında Mango etiketli 6S bakteriyel RNA 'nın görüntülemesi ile gösteriyoruz.
Giriş
Mango (TO1-biotin, Şekil 1a) thiazole-turuncu basit türevleri için sıkıca (nanomolar bağlayıcı) bind dört küçük floresan RNA aptamers bir dizi oluşan bir RNA etiketleme sistemi,1,2,3 . Bağlayıcı üzerine, bu ligin floresans 1.000 artar-4.000-belirli aptamer bağlı olarak katlayın. Mango III, RNA Mango aptamers nanomolar bağlayıcı benzeşme ile birlikte geliştirilmiş yeşil floresan protein (eGFP), aşan Mango sisteminin yüksek parlaklık, görüntüleme ve RNA arıtma hem de kullanılmasını sağlar kompleksleri2,4.
Mango ı5, II6ve III7 ' nin X-ışını yapıları yüksek çözünürlükte tespit edilmiştir ve üç aptamer, BIND to1-biotin (Şekil 1B-D) için RNA dörtlü kullanır. Tüm üç aptamerlerin kompakt çekirdeği, kompakt adaptör motifleri ile harici RNA dizisinden yalıtılır. Mango ı ve II her ikisi de kendi Mango çekirdeğini keyfi RNA Dubleks (Şekil 1B, C) ile bağlamak için esnek bir GNRA benzeri döngü adaptörünü kullanmaktadır. Bunun aksine, Mango III, çekirdeğini rasgele bir RNA heline (Şekil 1D, mor kalıntıları) bağlamak için sert bir Tripleks motif kullanır ve Mango IV 'ün yapısı şu anda bilinmemektedir. Bu aptamerlerin her birinin ligand-bağlayıcı çekirdeği, bu helisel adaptörler tarafından harici RNA dizisinden ayrıldığı için, bunların hepsi sadece çeşitli RNAs 'larla birleştirilebilir. Bakteriyel 6s düzenleyici RNA (Mango ı), Maya spliceosome bileşenleri (Mango ı), ve insan 5s RNA, U6 RNA, ve C/D scarna (Mango II ve IV) tüm başarıyla bu moda etiketlenmiş oldu2,8, düşündüren birçok biyolojik RNAs RNA Mango aptamer sistemi kullanılarak etiketlenebilir.
Denaturing ve yerel jelleri genellikle RNAs okumak için kullanılır. Denaturing jeller genellikle RNA boyutu veya RNA işleme yargılamak için kullanılır, ancak genellikle, bir Kuzey Blot durumunda, örneğin, bir görüntü oluşturmak için birkaç yavaş ve sıralı adımlar gerektirir. RNA ıspanak ve brokoli gibi diğer RNA fluorojenik aptamers, jel görüntüleme9için başarıyla kullanılırken, bugüne kadar hiçbir flororojenik aptamer sistemi, Mango sisteminin yüksek parlaklığını ve benzeşimine sahiptir, bu da önemli bir ilgi Mango jel görüntüleme yeteneklerini araştırmak için. Bu çalışmada, RNA Mango sisteminin sadece jel görüntülemede uzatılabilir olup olmadığını merak ettik, TO1-biotin (510 nm ve 535 Nm) uyarma ve emisyon dalga boyları (sırasıyla), en floresan için ortak olan eGFP kanalında görüntüleme için uygundur. jel tarama enstrümantasyonu.
Burada sunulan jel boyama protokolü, yerel ve denatüre Poliakrilamid jel elektroforezi (Page) jelleri içinde özellikle Mango etiketli RNA moleküllerini algılamak için hızlı bir yol sağlar. Bu boyama yöntemi, potasyum ve TO1-biotin içeren bir tampon içinde jelleri içerir. RNA Mango aptamerleri bu tür yapıları stabilize etmek için G-quadruplex bazlı ve potasyum gereklidir. RNA 'nın minimal Mango-kodlama DNA şablonlarından transkripsiyonu kullanarak (protokol bölümüne bakın), basit bir boyama protokolü kullanarak, yerel jellerin RNA 'sında 62,5 fmol ve denatüre jeller arasında 125 fmol olarak az az tespit edebilirsiniz. Ortak nonspesifik nükleik asit lekeleri aksine (bkz: malzeme tablosu, hereon gelen SG atıfta), biz açıkça tanımlayabiliriz Mango-etiketlenmiş RNA yüksek konsantrasyonlarda toplam etiketsiz RNA örneklerde mevcut olduğunda bile.
Protokol
1. Reaktiflerin hazırlanması
-
TO1-biotin sonrası boyama çözeltisi (jel boyama çözeltisi)
- 1 m2HPO4 ve 158 ml 1 m Nah2Po4' ü 342 ml ekleyerek, 25 °C ' de pH 7,2 ' de 1 m fosfat tampon yapın. Uygun fosfat çözeltisi ekleyerek pH 'ı 50 mM 'ye 7,2 olarak ayarlayın. 0,2 μm filtre kullanılarak steril filtre ve solüsyonu oda sıcaklığında plastikte saklayın.
- 5x jel boyama çözeltisi (TO1-biotin olmadan) aşağıdaki gibi hazırlayın. 247,5 mL ddH2O, 700 ml 1 m kcl, 50 ml 1 m fosfat tampon (pH 7,2) ve 2,5 ml ara 20 karıştırma tarafından 1 L çözüm makyaj. 0,2 μm filtre kullanılarak steril filtre ve solüsyonu plastikte saklayın. Oda sıcaklığında saklanabilir.
Not: RNA kompleksini dengeleyebilecek şekilde gerekirse, MgCl2 bu çözüme eklenebilir. Bu floresan sinyali2üzerinde mütevazı bir etkiye sahip olacaktır. - Adım 1.1.2 ' den 5x jel boyama çözümünü kullanarak 1x jel boyama solüsyonu yapın ve kullanmadan hemen önce TO1-biotin fluorophore ( malzeme tablosunabakın) Ile 20 Nm 'lik son konsantrasyona geçin. Örneğin, 100 mL 1x jel boyama çözeltisi yapmak için 80 mL deiyonize suya 20 mL 5x jel boyama çözeltisi ekleyin ve 2 μL 1 mM TO1-biotin stokları ekleyin (dimetilformamid olarak hazırlanmıştır).
Not: 500 Nm de TO1-biotin boya için yok olma katsayısı 63.000 M-1· cm-1, boyama çözeltisi1ölçülür.
-
Denatüre sayfa (2x denatüre jel yükleme çözeltisi ve çözümleri A, B, C, amonyum Persülfat, ve tetramethylethylenediamine)
- 40 ml Formamid, 0,5 ml, 0,5 M etylenediaminetetraasetic asit (EDTA, pH 8,0) ve 9,5 ml DDH2O 'yu karıştırarak 50 ml 2x denatüre jel yükleme çözeltisi hazırlayın. Çözüm Oda sıcaklığında saklanabilir. Floresan görüntüleme belirsiz olabilir olarak bu çözüme yükleme boyalar eklenmez.
- 2x denatüre jel yükleme boyasını aşağıdaki gibi hazırlayın. RNA ve DNA oligonucleotides arındırılması, 0,5 ml% 2,5 (w/v) bromophenol mavi (BB) ve 0,5 ml% 2,5 (w/v) ksilen cyanol (XC), adım 1.2.1 'de açıklanan çözüme ekleyin ve 8,5 ml DDH2O yerine 9,5 ml ekleyin. Çözüm Oda sıcaklığında saklanabilir.
- Hazırlama 100 ml çözüm A 200,2 g üre (formül ağırlığı: 60,06 g/mol) tartım ve 312,5 ml için ekleyerek 40% 19:1 akrilamid: N, n'-methylenebisacrylamid. Çözünen maksimum hızda bir manyetik karıştırın Bar ile karıştırın (yaklaşık 3 saat) ve 500 ml için çözüm makyaj DDH2o. son konsantrasyonların 6,667 M üre ve% 25 19:1 akrilamid olduğunu unutmayın: N, n'-methylenebisacrylamid. Temiz plasticware 4 °C ' de saklayın.
- 1 L çözelti B Ürea 400,4 g tartmak ve ddH2O Ile 1 l çözüm makyaj ile hazırlayın; Üre çözülene kadar karıştırın. B çözümü oda sıcaklığında tutulabilir.
- C çözümü hazırlayın (10X Tris-borate-EDTA [TBE]) aşağıdaki gibi. 4 L 10X TBE 432 g Tris tabanı ve 220 g Borik asit tartarak hazırlamak, 160 mL 0,5 M EDTA ile pH 8 (filtrelenmiş), ekleme ve 4 L için çözüm yapma ddH2O. Aynı zamanda jel çalışan tampon olarak kullanılan bu arabellek büyük bir stok yapılır.
- % 10 amonyum Persülfat (APS) 1 g APS% 10 mL ddH2O. mağaza 4 °c toplam hacmine çözünerek hazırlayın.
- Tetramethylethylenediamine (TEMED) kullanışlı tutun. APS çözümüyle birlikte 4 °C ' de saklayın.
-
Yerel sayfa (2x yerli jel yükleme çözümü)
- Hazırlamak 50 ml 2x yerli jel yükleme solüsyonu karıştırarak 25 mL 100% gliserol, 10 mL 5x jel boyama çözeltisi, ve 15 mL ddH2O için çözüm yapmak Için 50 ml.
Not: denatüre jel bölümünde olduğu gibi, yükleme boyalar bu stokta eklenebilir, ancak bunların ilavesi potansiyel olarak jel floresan sinyali gizleyebilir ve böylece, kaçınılmalıdır.
- Hazırlamak 50 ml 2x yerli jel yükleme solüsyonu karıştırarak 25 mL 100% gliserol, 10 mL 5x jel boyama çözeltisi, ve 15 mL ddH2O için çözüm yapmak Için 50 ml.
2. denatüre jellerin hazırlanması ve yüklenmesi
- Tablo 1 'i izleyerek uygun bir yüzdeye sahip bir denatüre jel hazırlayın. Belirli jel döküm sistemi düşünün; 30 mL jeller yaygın olarak kullanılır. Uygun jel yüzdesi Tablo 2kullanılarak tahmin edilebilir: BB ve XC boyaların diplopi daha hızlı ve yavaş, sırasıyla, ilgi RNA daha var polyacrylamid yüzdesi seçin, ilgili boyutta yüksek bant ayırma sağlamak için Aralığı.
- Tablo 1 ' e göre A, B ve C çözeltileri karıştırın ve jel dökme hemen önce APS ve temed ekleyin. Temiz plasticware iyi çözümler karıştırın.
- Tüm bileşenlerin titizlikle temiz olduğundan emin olduktan sonra, jel çözümünü uygun bir jel döküm aygıtına dökün. Cihazın bir tarafını, jel içinde sıkışmış hale gelen herhangi bir hava kabarcıklarının önlenmemesi için, jelin dökülen zaman hafifçe eğilmiş şekilde kaldırın.
- İstenilen tarak yerleştirin ve polimerize (yaklaşık 30 dk) bırakın. Jel kuyuları etrafında kırılma indeksinde bir değişiklik için yakından bakarak polimerizasyon gözlemlemek. 1x çözeltisi C (1x TBE) kullanarak jel tankı makyaj ve dikkatle tarak çıkarın. Bir şırınga kullanarak, örnek yüklemeden hemen önce kuyuları dışarı Aspire.
- Denatüre örnekleri aşağıdaki gibi hazırlayın. Bir termocycler veya su banyosu kullanarak 5 dakika boyunca 95 °c ' de denatüre jel yükleme çözeltisi 1x ve ısı-denature yapmak için ilgi RNA örneklerine 2x denatüre jel yükleme çözümü ekleyin.
- Önce örnekleri yükleme, hava-onlar dokunma serin kadar birkaç dakika serin. Jel yükleme ipuçlarını kullanarak, her iyi alt katmanlama tarafından örnekleri yükleyin.
Not: yuvarlak ipuçları 1 mm kalınlığında veya daha fazla jeller için kullanılabilir; ince jeller için düz ipuçları kullanın. - Oda sıcaklığında denatüre jeller çalıştırın. Jel sisteminin cam plakaları çatlak değil böylece watt yeterince düşük olduğundan emin olun.
Not: laboratuvarımızda, 20 cm x 16 cm plaka için 28 W bu amaçla yeterli oldu.
3. yerel jeller hazırlama ve yükleme
- Tablo 3' e atıfta bulunarak yerel bir jeli uygun bir yüzdeye hazırlayın. Belirli jel döküm sistemini düşünün, ancak 30 mL jellerin yaygın olarak kullanıldığını aklınızda bulundurun. 1x TBE çözümleri Mix, 40% 29:1 akrilamid: N, n'-methylenebisacrylamid, ve gliserol Tablo 3göre, ve APS ekleyin ve hemen önce jel dökme temed. 2,3 ve 2,4 adımda açıklandığı gibi devam edin.
- Çözüm 1x yapmak ve 100 dakika boyunca tam RNA katlama sağlamak için jel çalıştırmadan önce oda sıcaklığında inküreme sağlamak için ilgi RNA örneklerine 2x yerli jel yükleme çözümü ekleyerek yerel örnekleri hazırlayın.
- 4 °C ' lik soğuk odada yerel jeli çalıştırın, watt 'ın jel ısıtmak için yeterince düşük olmasını sağlar.
Not: laboratuvarımızda, 20 cm x 16 cm plaka için 14 W bu amaçla yeterli oldu.
4. RNA hazırlama tarafından Run-off T7 transkripsiyon
Not: çalışma-off transkripsiyon için kullanılan DNA dizileri10 RNA Mango yapıları ticari olarak sipariş edildi. Bu yöntemde, hem transkripsiyonu hem de T7 promotör, bir T7 promotör üst Strand dizisine ters tamamlayıcı (RC) içeren ve sonra in vitro olarak yazılmış DNA oligonükleotidler. Aşağıda, her oligonükleotid için, Mango çekirdek dizisinin RC kalın olarak gösterilir ve T7 Organizatör bölgenin RC italik olarak gösterilir. Normal yazı tipindeki kalıntılar, Mango çekirdeğinin düzgün şekilde katılmasına izin vermek için gerekli olan diğer keyfi tamamlayıcı helisel bölgelere karşılık gelir.
Mango ı: GCA CGT ACT CTC CTC TCC GCA CCG TCC CTT cgt ACG TGC cta Tag TGA GTC GTA TTA AAG
Mango II: GCA CGT ACT CTC CTC TTC CTC TCC TCT CCT cgt ACG TGC cta Tag TGA GTC GTA TTA AAG
Mango III: GGC ACG TAC GAA tat ACC aca Tac CAA TCC TTC CTT CGT ACG TGC Cta Tag TGA GTC GTA TTA AAG
Mango IV: GCA CGT ACT CGC CTC ATC CTC ACC ACT CCC TCG GTA CGT GCC tat AGT gag TCG tat taa AG
T7 top Strand: CTT TAA TAC GAC TCA CTA TAG G
- DNA oligonükleotides Preparatif jel arıtma
- 0,2 μmol ölçekli DNA sentezi için, 100 μL DDH2O ve 100 μL 2x denatüre yükleme boya (adım 1.2.2) içinde dekorumalı DNA oligonükleotid pelletini. Bu durumda, yükleme çözümünde jel yükleme boyaları dahil, adım 1.2.2 ' de aynı konsantrasyonda tercih edilir.
- Uygun Poliakrilamid yüzdesi 50 ml hazırlık ölçekli denatüre jel kullanarak DNA oligonükleotit arındırmak; jel yüzdesini seçmek için Tablo 2 ' i kullanın. Örneğin, 50 NT dizisi için% 8 jel kullanın. İdeal olarak, bromophenol mavi oligonükleotid daha hızlı çalışmalıdır, ve ksilon cyanol yavaş çalışmalıdır.
Not: laboratuvarımızda, bu tür jelleri 1,5 mm kalınlığında ve 2 – 2.5 cm genişliğinde kuyular ile jel yükleme tarak olan döküm mesafe tutucular kullanılarak döküm edildi. - Hazırlık jeli başına 4.1.2 adımda hazırlanan DNA oligonükleotit çözeltilerin μL 100 yükü, 2.4 – 2.7 adımda açıklandığı gibi.
- Jel dışında dikkatle kurutun, cam plakaları çıkarın ve plastik sargı jeli her iki tarafını kapak. Floresan görüntüleme ekranına yerleştirin (fluorophore ile emelenmiş alüminyum destekli ince katmanlı Kromatografi plakaları ekonomik bir çözümdür) ve UV gölgeleme ile DNA bantları görselleştirmek için kısa dalga boyu UV el lambası kullanın.
- DNA sentezinin yüksek kalitede olması durumunda net, iyi tanımlanmış bir gölge gözlenmelidir. Plastik sargı bantları, kalıcı bir marker kullanarak işaretleyin.
Not: cilt ve gözleri UV ışıktan koruyun ve nükleik asit numunesi zarar görmesini önlemek için pozlama kısa tutun. - Jeli temiz bir cam plakaya yerleştirerek, işaretli bantları dikkatlice kesip 400 μL 300 mM NaCl 'de her bir jel parçasını yerleştirin. Bir gecede DNA 'Yı elute, oda sıcaklığında Rotator kullanarak.
- Temiz bir santrifüjlü tüp akıtıcı kurtarmak ve DNA çökeltmek için etanol 2,5 eşdeğerleri ekleyin. İyi Vortex ve tüpü 30 dakika boyunca-20 °C ' de yerleştirin.
- 4 °C ' de 30 dakika için 156.000 x g 'de bir tezgah üstü santrifüjte numuneyi Pelet. Dikkatle süpernatant kaldırmak ve DDH2O Pelet pelletini. DNA oligonükleotit konsantrasyonunu doğru şekilde belirlemek için spektrofotometre kullanın. -20 °C ' de kolaylık sağlamak için numuneyi 10 μM hisse senedi olarak saklayın.
- RNA numunelerinin koşmak-off transkripsiyonu ve jel arıtma
- 40 mm guanosin trifosfat (GTP, 11.400 m-1· cm-1), 25 mm sitidin trifosfat (CTP, 7.600 m-1 · cm-1), 25 mm 'lik son konsantrasyondan oluşan sıvı NTP stoklarını karıştırarak 5x nükleryan trifosfat (NTP) stoğu hazırlayın Adenozin trifosfat (ATP, 5.000 m-1· cm-1) ve 10 mm Üridin trifosfat (UTP, 10.000 m-1· cm-1); 260 Nm 'de tüm tükenme katsayıları.
Not: sıvı veya toz stokları ticari olarak elde edilebilir. Birincil stokları tozdan hazırlıyorsanız, pH 'ı 1 M NaOH kullanarak 7,9 son pH değerine dikkatle ayarlayın. 1,5 mL mikrosantrifüjü tüplerde stokta yer alan ve-20 °C ' de saklayın. - 1 m Tris-HCl 25,6 mL, 1 m Tris tabanı 14,4 mL, 1 M MgCl2, 10 ml 10% Triton X-100 ve 0,637 g spermidine karıştırmak suretiyle 100 ml 10X T7 transkripsiyon tampon stoğu hazırlayın. DdH2O ekleyerek 100 ml son hacmine stok olun.
Not: 1x çözeltisi 7,9 son pH kalibreli pH metre kullanılarak teyit edilmelidir. 10X steril olarak filtrelenmeli ve-20 °C ' de uygun büyüklükte aliquots olarak depolanmalıdır. - Transkripsiyon aşağıdaki gibi gerçekleştirin.
- 10X T7 transkripsiyon tampon stok ve DDH2O (adım 4.2.2), 1x ntps, 10 mm ditiyotreitol (DTT), 1 μM T7 üst Strand dizisi kullanarak son bir konsantrasyon 1x T7 transkripsiyon arabelleği yapmak için aşağıdaki reaktifler ekleyin (bkz. Bölüm 4 Not 1 μM jel-Purified Mango DNA dizisi (adım 2,1) ve T7 RNA polimeraz enzim (1 U/μL).
- Vortex, aşağı spin ve 37 °C ' de 2 saat veya bulutlu olana kadar ve tüpün alt kısmında beyaz bir çökelt formları kadar solüsyonu inkük. A 50 μL transkripsiyonu, jel arıtma işleminden sonra 50 μL ~ 50 μM RNA 'ya neden olmalıdır. 2x denatüre boya eşit hacim ekleyin ve jel arıtma için hazır olana kadar-20 °c ' de saklayın.
- Jel-ortaya çıkan RNA 'yı DNA oligonükleotides jel arıtma bölümünde açıklandığı gibi, 4.1.2 \ u 20124.1.8, DNA için RNA örneğini yerine koyarak arındırın.
Not: RNA RNase bozulması için son derece duyarlıdır, bu yüzden tüm adımlarla, eldiven ve temiz bir laboratuar ceket her zaman giyilir emin olun. Tüm numunelerin RNase kontaminasyonuna karşı korumak için tek kullanımlık plastikte hazırlanmış ve depolandığından emin olun ve kullanmadan önce sıcak sabun ve suyla dikkatle cam plakaları yıkayın, ddH2O ile iyice durulayın ve cam malzemeyi bir sıkmak şişe uygulanan etanol yardımı. - Son RNA örneğinden 1 μL kullanın ve damlacık bazlı spektrofotometreyi kullanarak 260 Nm 'de emici belirleyin. En yakın komşu yöntemine göre belirlenen bir tükenme katsayısı kullanarak RNA konsantrasyonunu hesaplayın ve kolaylık sağlamak için numune konsantrasyonunu ddH2O Ile 10 μM olarak ayarlayın. RNA örneklerini-20 °C ' de saklayın.
- 40 mm guanosin trifosfat (GTP, 11.400 m-1· cm-1), 25 mm sitidin trifosfat (CTP, 7.600 m-1 · cm-1), 25 mm 'lik son konsantrasyondan oluşan sıvı NTP stoklarını karıştırarak 5x nükleryan trifosfat (NTP) stoğu hazırlayın Adenozin trifosfat (ATP, 5.000 m-1· cm-1) ve 10 mm Üridin trifosfat (UTP, 10.000 m-1· cm-1); 260 Nm 'de tüm tükenme katsayıları.
- Escherichia coli Total ham nüklik asit ekstraksiyonu
Not: aşağıdaki protokol bir örnektir. Bu protokol, E. coli'de plazmid 'den Mango ı-Tagged 6s RNA 'ya endojenously ifade kullanır ve bu Plasmid 'den indüksiyon ayrıntılı olarak başka bir yerde açıklanmıştır4.- Bu çalışmanın amaçları doğrultusunda, hem pEcoli-RNA Mango hem de pEcoli-T1 plazmids için indüklenen hücrelerin 500 mL 'yi hazırlayın (hücreler 1 ' lik bir OD600nm 'de indüklenir). Hücreleri Pellet ve onları saklamak-80 °C önce kullanın.
- RNA ekstraksiyonu aşağıdaki gibi gerçekleştirin.
- İndüklenen pecoli hücre Pelet 0,5 ml alın ve 500 μL dengelenmiş fenol ekleyin. Sonra, örnek Vortex; çözüm Sütlü beyaz olacak. Katmanları ayırmak için 2 dakika maksimum hızda Santrifüjü.
- Biraz sarı olacak üst katmanı ayıklamak ve fenol, santrifüplü eşit bir hacim ekleyerek adım 4.3.2.1 tekrarlayın ve 5x (veya opak beyaz olan orta katman, uzağa gider ve sadece iki açık katmanlar bırakılıncaya kadar) için ayıklayın.
- Fenol ayıklanan sulu hacmi kloroform, girdap eşit hacmine ekleyin ve daha sonra, 2 dakika boyunca maksimum hızda Santrifüjlü.
- Sulu tabakası ayıklamak ve 300 mM son konsantrasyon NaCl ekleyin. Elde edilen nüklik asidin, 2,5 etanol, girdap, dönme ve-20 °C ' de en az 30 dakika boyunca çökelme eşdeğerleri ilavesi ile çökeltir.
- 15,6 x 1.000 x g 'de, 30 dakika boyunca 4 °c ' de bir tezgah üstü santrifüjte Pelet, süpernatant 'ı dikkatle kaldırın ve 100 μL 'deki DDH2O 'da Pelet 'i pelletini.
- Toplam RNA elde etmek için başvurulan protokol11' i takiben bu prosedüre DNase ı sindirim adımını ekleyin.
Not: Pelet kadar güçlü Vortex tamamen ddH2O çözünür.
5. jel sonrası boyama
- Adım 1.1.3 ' de tarif uyarınca 1x jel boyama çözümünü hazırlayın ve jeli rahatça sığdıracak kadar geniş olan temiz bir cam kabına ekleyin.
Not: yapışmaz kapaklar ile borosilikat cam kaplar bu amaçla iyi hizmet vermektedir. - Jel tamamen solüsyon ile kaplı böylece konteynırı için yeterli 1x jel boyama solüsyonu ekleyin ve orbital Rotator üzerine yerleştirildiğinde jel üst üzerinde sıvı Sloshes.
Not: konteynır, jeli sığdıracak kadar büyük olmalı ve jeli tam olarak kapsayacak şekilde konteynerin içinde yeterli tampon olabilir. - Bir kez yerli veya denatüre jel (Bölüm 2 veya 3, sırasıyla) çalışan bitmiş, cihazın jel çıkarın ve kuyularını kesti. Daha sonra analizinde oryantasyon için jel bir köşe kaldırmak için yararlı olabilir.
- Jeli, 5,2 adımda hazırlanan 1x jel boyama çözeltisi ile dikkatlice aktarın.
Not: jelleri hassas ve kırılmaya eğilimli olduğu için jel aktarırken dikkatli olun. Jel kirletmek değil gibi her zaman boyama kabı üzerinde kapağı tutun. - Oda sıcaklığında 30 dakika 100 rpm hızında bir orbital Rotator üzerinde jel yerleştirin.
Not: jel kendi üzerine geri kat olmadığından emin olun; Aksi takdirde, RNA jel dışarı diffü ve böylece jel farklı bir parçası etiket.
6. görüntüleme Mango-jel Tagged RNAs
- Görüntüleme tamponunu dikkatlice yapıştırın. Jel su ile hızlı bir şekilde durulayın, yeterli sıvı sağlamak jel biraz konteyner mobil tutmak için kalır.
- Jeli dikkatle görüntüleştirici üzerine aktarın. Jel kenarlarını dikkatlice toplayıp görüntü tepsisine yerleştirerek aktarın; Alternatif olarak, jel yavaşça tepsiye dökülebilir. Jel altında hiçbir kabarcıklar olduğundan emin olun ve jel altında fazla sıvı yoktur. Jel üzerinde haddelenmiş bir pipet herhangi bir aşırı sıvı kaldırmak için yararlı olabilir.
Not: aşırı sıvıyı ıslatmak için bir kağıt havlu kullanın. - Bir jel görüntü alın, uyarma dalga boyu 510 nm ve emisyon dalga boyu 535 Nm arasında floresans gözlemleyerek (örneğin, görüntüleyici üzerinde 520 nm dalga boyu floresans ayarlarında yeşil ışık). Ayarların cihaz üzerinde tam olarak optimize edildiğinden emin olun ve kullanılan enstrüman için talimatları dikkatle izleyin.
Sonuçlar
Kısa Mango-Tagged RNAs protokol bölümünde açıklandığı gibi hazırlanmıştır. Denatüre koşullarda floresan, jellerin üre varlığı nedeniyle gözlemlemek en zor olacağını varsayarsak, ilk olarak bir nüklik asit denaturant olarak davranan üre, Mango aptamers direnci okudu. Biz mango aptamers yaklaşık 1 M üre konsantrasyonuna kadar denatürasyon önemli ölçüde dirençli olduğunu bulundu (Şekil 2a). Bir denatüre jel jel boyama solüsyonu eklemeden önce, jel üre son konsantrasyonu 6 m. bu konsantrasyonu 1 m 'ye düşürmek için yeterli boyama çözeltisi eklemek, bu nedenle, dört aptamers için tam Mango floresans sağlamak için optimum olacaktır. Uygulamada, boyama protokolü bu tam olarak optimum sonucu daha az elde, ancak bu sadece daha fazla boyama çözeltisi veya boyama sırasında bir kez çözüm değiştirme basit uygununun kullanarak gerekirse düzeltilebilir.
Mango Tagged RNA yapıları denatüre bir jel içine çalıştırıldıktan sonra, boyama süresi% 8 denatüre jel içine üç farklı mango III tutarları yükleyerek maksimum jel floresan için optimize edilmiştir (Şekil 2B). Bir zaman kursu, 5 dakika sonra jel boyama çözeltisi içinde ıslatıldıktan sonra floresans açıkça görülebilir olduğunu ortaya koydu. Mango III yapısının maksimum floresan 20 – 40 dk. sonra elde edildi, bu çalışmada kullanılan küçük RNAs jel dışarı differe başladı, sonra floresan sinyal kaybı ile sonuçlanan (Şekil 2B). Sonuç olarak, her iki yerli ve denatüre jelleri 30 dakika her biri için lekelenmiş. Daha uzun RNA yapıları, jel dışında diffün daha az olması muhtemeldir daha uzun lekeli zaman kolayca tahammül olabilir.
RNA Mango aptamerlerin bazıları diğerlerinden daha hızlı katlanmış. Bu çalışmada kullanılan Mango aptamers her biri 1,5 M üre ve 100 Nm to1-biotin boya ile tamamlayıcı bir jel tampon inkübe ve bir Fluorometre kullanılarak analiz edilmiştir. Mango ı, II, ve III tamamen 10 dakika sonra katlanmış, Mango IV önemli ölçüde sadece 40 dakika sonra katlanmış oldu (Şekil 3A). Urea yokluğunda, katlama çok daha hızlı beklendiği gibi oldu (Şekil 3B). Yerli jel numunelerinin tamamen katlanmış olduğundan emin olmak için, onları yerel jellere çalıştırmadan önce 100 dk için numuneleri prekulerasyon yaptık. Pratik olarak, Şekil 3 ' teki veriler bu sefer kullanılan Mango aptamer bağlı olarak önemli ölçüde azaltılabilir önerir.
Protokol RNA Mango aptamer floresans algılayacak şekilde optimize edildikten sonra, her iki yerel jelde Mango varyantlarının her biri için postboyama yönteminin duyarlılığı belirlendi. İyi katlanmış RNAs 'lara karşılık gelen tek bantlar, yerel jellerin her biri için dört Mangos (Şekil 4A) için gözlenmiştir. Seri seyreltme üzerine, Mango II 62,5 fmol gibi az görülürken, Mango ı, III ve IV 125 fmol kadar az iken kolayca görselleştirildi. Yerli jellerin ölçülesi, Mango ı, II ve IV 'in Mango III 'den (Şekil 4b) daha doğrusal bir şekilde davranan, yaklaşık 1,5 büyüklüğü ile ilgili olarak günlük-doğrusal oldu.
Denatüre jellerin sonuçları, yerel jelden biraz daha hassastır ama daha doğrusal oldu. Mango II ve III 125 fmol kadar az olarak kolayca tespit edildi (Şekil 4c). İlginçtir ki, miktarlar (Şekil 4d) bu denatüre jellerin log-doğrusal veya iki büyüklük sipariş olduğunu belirtti. Biz hipotez, RNA kıvrımlar belki de kısmi denatürasyon jel çalışan süreci sırasında tabi olduğu yerel jellerin aksine, denaluring jel üre varlığı bir kez onlar yerleştirilir aptamers katlamak için daha homojen bir yol sağlayabilir TO1-biotin boyama solüsyonu.
Tüm jel boyama Metodolojilerinde olduğu gibi, jel konteynırı dikkatle aktarılmaz veya boyama döneminde dönen hız çok yüksektir, jel kendi üzerine geri katabilir (Şekil 5A). Bu mango-Tagged RNA örnek jel bir yerden diğerine difüzor neden olabilir ama kolayca uygulamada kaçınılabilir. Yerli jelleri ve özellikle, Mango IV için, biz tamamlanmamış katlama muhtemelen kısmen/yanlış RNA konformasyonlar karşılık gelen birden fazla bant görünümünde tezahür edilebilir gözlenen (Şekil 5B) daha kısa katlama süreleri kaynaklanan. Yerel jellerin katlama sorunları, RNA örneklerinin önceden tarif edildiği gibi prekulküle edilmesi ve soğuk bir odada yerli jelleri çalıştırarak önlenebilir. RNA 'nın jel içinde situ içinde bulunduğu denatüre jeller içinde, yanlış katlanan önemli bir sorun değildi. Son olarak, RNA yokluğunda, hem jel sisteminde çok az arka plan floresan gözlenmiştir.
Daha sonra, RNA Mango etiketinin özgüllüğü, 6S düzenleyici RNA 'nın bakterilerde aşırı ifade edilmesi ile incelendi. Bu RNA daha önce Mango ı (Şekil 1E)4kullanılarak etiketlenmiştir. Bakteriyel hücreler, pEcoli-RNA Mango Plasmid (bundan sonra M plazmid) veya pEcoli-T1 Plasmid ile negatif kontrol olarak (bundan sonra E Plasmid) dönüştürülmüştür. Dönüştürülmüş hücreler, 1,0 bir od600 kadar sıvı lysogeny suyu orta büyüdü ulaştı. Kültürler daha sonra 50 μM isopropresl β-D-1-thiogalactopyranoside (ıPTG) ile 40 dakika indüklenmiş. Hücreler santrifüjleme yoluyla hasat edildi 6.000 x g için 15 dk. Toplam RNA hücre peletleri fenol-fenol kloroform ekstraksiyon kullanılarak çıkarılan12 protokol bölümünde açıklandığı gibi. Toplam RNA numuneleri etanol yağışıyla konsantre edildi ve sonra DNase ı ile tedavi edildi, protokolü takiben, DNA 'yı kaldırmak için11. Kullanmadan önce, RNA etanol yağış ile konsantre oldu.
Toplam bakteriyel RNA 8% denatüre jeller (Şekil 6) içine çalıştırmak ve ya SG13 veya to1-biotin ile lekelenmiş. SG boyama için, 100 mL jel tampona 10 μL 10, 000x SG eklendi; Aksi takdirde, boyama Protokolü TO1-biotin için kullanılan özdeş oldu. Beklendiği gibi, güçlü SG boyama çok sayıda Rnas için gözlenen, ancak en belirgin ribozomal (rRNA) ve transfer Rnas (tRNA) (Şekil 6, sol panel). Bu SG-lekeli jelleri Mango bağımlı boyama (M şeritleri) görülebilir iken, bu evrensel leke kullanılarak gözlenen karmaşık boyama deseni verilen benzersiz olarak tanımlanamadı. Buna karşılık, TO1-biotin-lekeli jelleri en belirgin bantları olarak Mango bağımlı bantları vurgulandı. Sadece ribozomal RNA bantları 6s Mango bağımlı bantları ile rekabet olarak görülmektedir. Bazı spesifik olmayan lekeli bantlar da görülebilir. Yine de, Mango bağımlı bantları yine dominant, zayıf rakip rakip olarak rRNA ve tRNA bantları (Şekil 6, sağ panel) sahip.

Resim 1: Mango aptamer sistemi. (A) to1-biotin fluorophore. (B) Mango ı. (C) Mango II. (D) Mango III. Paneller B-D her aptamer ikincil yapısını gösterir. P1 rasgele bir kök. GNRA benzeri kök-döngü (burada GAAA) Mango ı ve II bulunan kırmızı gösterilir, Mango III Tripleks motif mor gösterilir. (E) Mango ı Ile etiketlenmiş 6s düzenleyici RNA. Bu rakam daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın .
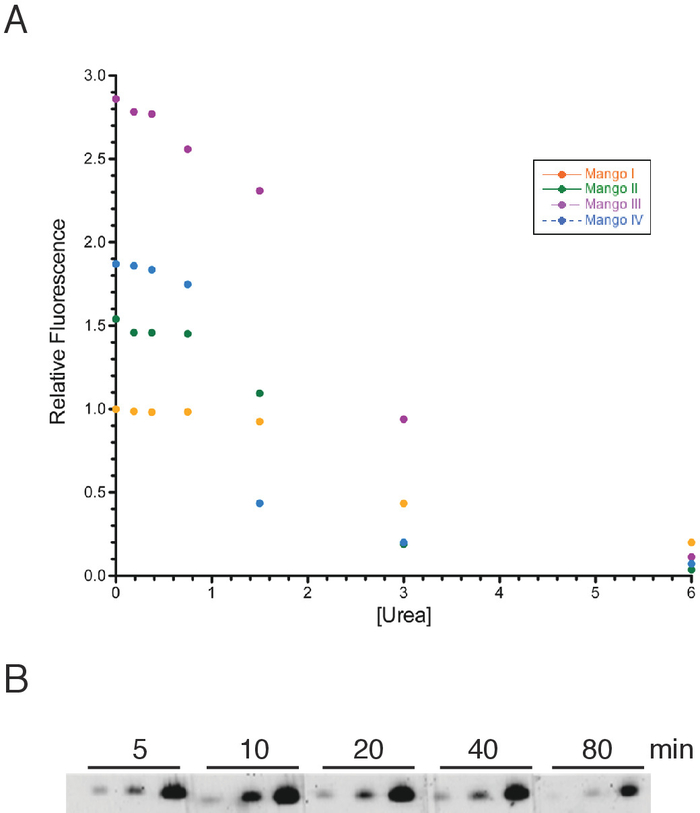
Şekil 2: üre 'nın Mango aptamer floresans ve optimum boyama süreleri üzerinde etkisi. (A) 50 nm RNA Mango ı (turuncu daireler), Mango II (yeşil daireler), Mango III (mor daireler) ve Mango IV (mavi daireler) ile birlikte 100 Nm to1-biotin boya ve belirtilen üre konsantrasyonlarında kullanarak bir üre titrasyonu. Numune, 510 nm 'nin bir uyarılma dalga boyu ve 535 nm Emisyon dalga boyu olarak okunmadan önce 40 dakika süreyle inkübe edildi. (B) Mango III RNA% 8 denatüre jel içine yüklendi ve 20 Nm final to1-biotin boya içeren bir jel çözeltisi ile lekelenmiş. Belirtilen her zaman noktası için, 0,064, 0,32, ve 1,6 pmol Mango III RNA soldan sağa kullanıldı. Jel görüntüsü, 520 nm lazer ve 10 dk pozlama kullanılarak floresans Görüntüleyici ile görselleştirildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 3: Urea varlığını ve yokluğunda Mango aptamers katlama süreleri. (A) 1,5 M üre ve 100 Nm to1-biotin varlığında, her RNA Mango yapısının 50 Nm (RNA Mango ı: turuncu noktalar, Mango II: yeşil noktalar, Mango III: mor noktalar ve Mango IV: mavi noktalar) kullanılarak floresans zaman kursları yapılmıştır. (B) üre yokluğunda hariç, Apanelinde aynıdır. Tüm zaman kursları oda sıcaklığında yapılmıştır. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 4: RNA Mango yapıları ile yerli ve denatüre sayfanın floresan görüntüleri. (A) seri olarak SEYRELTILMIŞ RNA Mango yapıları ile% 8 yerli jel. I, II, III ve IV şeritleri, sırasıyla RNA Mango ı, II, III ve IV 'nin 8 pmol son miktarlarını içerir. Sağ paneller, belirtildiği gibi 4 pmol, 2 pmol, 1 pmol, 0,5 pmol, 0,25 pmol, 0,125 pmol ve mango ı, II, III veya IV, 0,0625 pmol içeren iki kat seri dilüsyonlar vardır. Lane 12 RNA içermez. (B) yerli jelin üç çoğunun (her biri için gösterilen ortalama standart sapması) ölçülmesini. (C) bir% 8 denatüre jel aynı numuneler ile panel Aolarak yüklü, doğal jel yükleme çözeltisi yerine denatüre jel yükleme solüsyonu kullanılmış olması dışında. (D) üç nicelik denatüre jel çoğaltır (her biri için gösterilen ortalama standart sapması). Tüm jel görüntüleri, 520 nm lazer ve 10 dk pozlama ile bir jel görüntü görselleştirilmiş. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 5:% 8 yerli jel Içinde Mango IV yetersiz jelleri ve tamamlanmamış katlama. (A) Mango II için Şekil 4 ' te gösterilen bir seri seyreltme ancak boyama protokolü sırasında jel katlama etkisini gösteren. (B) jel yükleme sergi çift bantları önce doğal tampon yeterince uzun kat izin verilmedi Mango IV Native gel örnekleri. Aksi takdirde bu sonuçlar Şekil 4A'Da GÖSTERILEN Mango IV sonuçlarına benzer. Tüm jel görüntüleri 520 nm lazer ve 10 dk pozlama ile bir jel görüntü kullanılarak görselleştirildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 6: Mango-Tagged RNAs to1-biotin boyama kullanarak, toplam RNA varlığında tespit edilebilir. % 8 denatüre jeller toplam RNA 100 NG ile yüklendi ve 30 dakika boyunca çalıştırıldı. Sol jel SG ve TO1-biotin ile sağ panel ile lekelenmiş oldu. Her iki panel için, E etiketli şeritleri pEcoli-T1 100 NG ile yüklendi (Mango etiketi yok) ve M etiketli şeritler, pEcoli-RNA mango (6S RNA ile etiketlenmiş bir mango ı etiketiyle) 100 NG ile yüklendi. TO1-biotin-lekeli jel görüntüleri 520 nm lazer ve 10 dk pozlama ile bir Görüntüleyici kullanılarak görselleştirildi. SG-lekeli jel görüntüleri, 460 nm lazer ve 10 dk pozlama kullanarak bir jel Görüntüleyici kullanılarak görselleştirildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
| Yüzde | JEL HACMI | |||
| 20 mL 'Lik | 30 mL 'Lik | 50 mL | ||
| 5 | A | 4 | 6 | 10 |
| B | 14 | 21 | 35 | |
| C | 2 | 3 | 5 | |
| 6 | A | 4,8 | 7,2 | 12 |
| B | 13,2 | 19,8 | 33 | |
| C | 2 | 3 | 5 | |
| 8 | A | 6,4 | 9,6 | 16 |
| B | 11,6 | 17,4 | 29 | |
| C | 2 | 3 | 5 | |
| 10 | A | 8 | 12 | 20 |
| B | 10 | 15 | 25 | |
| C | 2 | 3 | 5 | |
| 12 | A | 9,6 | 14,4 | 24 |
| B | 8,4 | 12,6 | 21 | |
| C | 2 | 3 | 5 | |
| 15 | A | 12 | 18 | 30 |
| B | 6 | 9 | 15 | |
| C | 2 | 3 | 5 | |
| 20 | A | 16 | 24 | 40 |
| B | 2 | 3 | 5 | |
| C | 2 | 3 | 5 | |
| APS (μL) | 48 | 72 | 120 | |
| TEMED (μL) | 20 | 30 | 50 | |
Tablo 1: denaturing sayfa jel döküm tablo. A = çözüm A, B = çözüm B, C = çözüm C.
| Denaturing jel% | BB (~ mobilite NT) | XC (NT 'de hareketlilik) |
| 5 | 35 | 130 |
| 6 | 26 | 106 |
| 8 | 19 | 70-80 |
| 10 | 12 | 55 |
| 20 | 8 | 28 |
| 23 | 5-6 |
Tablo 2: Poliakrilamid denatüre jeller içinde bromophenol mavi (BB) ve ksilon cyanol (XC) jel yükleme boyalarının yaklaşık jel hareketlilik.
| Yüzde | JEL HACMI | |||
| 20 mL 'Lik | 30 mL 'Lik | 50 mL | ||
| 5 | 1X TBE | 16,5 | 24,75 | 41,25 |
| 40% 29:1 akrilamid: N, n'-methylenebisacrylamid | 2,5 | 3,75 | 6,25 | |
| Gliserol | 1 | 1,5 | 2,5 | |
| 6 | 1X TBE | 16 | 24 | 40 |
| 40% 29:1 akrilamid: N, n'-methylenebisacrylamid | 3 | 4,5 | 7,5 | |
| Gliserol | 1 | 1,5 | 2,5 | |
| 8 | 1X TBE | 15 | 22,5 | 37,5 |
| 40% 29:1 akrilamid: N, n'-methylenebisacrylamid | 4 | 6 | 10 | |
| Gliserol | 1 | 1,5 | 2,5 | |
| 10 | 1X TBE | 14 | 21 | 35 |
| 40% 29:1 akrilamid: N, n'-methylenebisacrylamid | 5 | 7,5 | 12,5 | |
| Gliserol | 1 | 1,5 | 2,5 | |
| 12 | 1X TBE | 13 | 19,5 | 32,5 |
| 40% 29:1 akrilamid: N, n'-methylenebisacrylamid | 6 | 9 | 15 | |
| Gliserol | 1 | 1,5 | 2,5 | |
| 15 | 1X TBE | 11,5 | 17,25 | 28,75 |
| 40% 29:1 akrilamid: N, n'-methylenebisacrylamid | 7,5 | 11,25 | 18,75 | |
| Gliserol | 1 | 1,5 | 2,5 | |
| 20 | 1X TBE | 9 | 13,5 | 22,5 |
| 40% 29:1 akrilamid: N, n'-methylenebisacrylamid | 10 | 15 | 25 | |
| Gliserol | 1 | 1,5 | 2,5 | |
| APS (μL) | 48 | 72 | 120 | |
| TEMED (μL) | 20 | 30 | 50 | |
Tablo 3: Yerel sayfa jel döküm tablosu.
Tartışmalar
Mango floresan etiketinin önemli bir avantajı, tek bir etiketin birden çok şekilde kullanılabilmesi. Bu aptamers yüksek parlaklık ve yakınlık onları sadece hücre görselleştirme2 için değil, aynı zamanda In vitro RNA veya RNP arıtma4için yararlı hale. Bu nedenle jel görüntüleme, Mango etiketinin çok yönlülüğünü basit bir şekilde genişletir. Mango jel görüntüleme hassasiyeti, Kuzey leke14 ' ten biraz daha azdır, ancak uzun ve sıkıcı membran transferine ve yoklama adımlarına gerek kalmadan, RNA örneğinin 60 – 120 fmol 'i kolayca algılayabilir. Bu, jel15' teki küçük Rnas 'lar için daha önce bulunan hybridizasyon tabanlı prob verimliliği ile karşılaştırılabilir. Diğer flororojenik aptamer metodolojileri-özellikle, RNA ıspanak-daha fazla hassasiyet ve özgüllüğü var9, hiçbiri şu anda aynı anda yüksek parlaklık ve mango aptamer sisteminin benzeşimi var, HANGI tek RNA etiketi olmasını sağlar hücresel görüntüleme, RNP arıtma ve şimdi jel görüntüleme için kullanılır.
Bu jel boyama protokolünde birkaç kritik adım vardır. RNA çözümleri ile çalışırken, çözümler steril filtrelenmeli ve tek kullanımlık plastiklerin kullanılması gerekir. Jelin güç seviyeleri çok yüksekse ve jel ısıtmaya neden olursa, kompleksleri veya RNA yapıları olarak yerli jelleri çalıştırmak kolayca denatüre edilebilir. Herhangi bir kullanılan cam temiz ve RNases ile kontamine değil emin olun. Ayrıca, her zaman transfer ve onlar kırılgan ve kırılma eğilimli olabilir gibi jelleri toplayıp dikkatli olun.
TO1-biotin leke hızlı bir şekilde jelleri nüfuz eder, ancak burada sunulan veriler de Mango IV katlama, özellikle, oran sınırlama olabilir gösterir (Şekil 2 ve Şekil 3). Protokol bölümünde belirtilen koşulları kullanarak, dört aptamers için, denatüre jellerin iki büyüklüğü üzerinde günlük doğrusal davranışı gözlemledik, yöntemin miktarlar için yararlı hale getirme (Şekil 4c, D). Bu çalışmada kullanılan küçük Mango aptamers jel matrisinin dışında kolayca yayılır beri, biz kantitasyon daha uzun RNA yapıları için geliştirmek bekliyoruz.
Burada gösterilen Mango etiket jel görüntüleme metodolojisi sağlam ve sadece duyarlılık ve özgüllük açısından uzatılabilir edebilmek için bekleniyor. Mango ı, II, ve III güvenilir kat, Mango IV değil iken. Biz boya uzaklaştırma protokolleri keşfedilmemiş iken, biz böyle bir yaklaşım da basitçe özgüllüğü artırabilir tahmin. Bu çalışmanın kapsamı ötesinde iken, floresans ve biotin etiketi Mango-Tagged RNA TO1-biotin fluorophore kullanırken daha fazla jel Analizi ve arıtma kolaylaştırmak için büyük olasılıkla görünür. Örneğin, ticari olarak kullanılabilen ikincil biotin etiketleme teknikleri, bu basit RNA Mango etiketleme sisteminin algılama sınırlarını daha da artıracağına söz veriyor. Aynı şekilde, yerel Mango etiketli RNA protein kompleksleri bir jel ile elüe ve böylece elüe RNA kompleksi yakalamak için streptavidin manyetik boncuk kullanarak kurtarılabilir olası görünüyor. Bu daha fazla biyolojik olarak önemli RNAs ve RNA kompleksleri rutin arıtma basitleştirmek için bir mango etiket ekleme ilgi RNA.
Açıklamalar
Mango flororojenik sistemde bir patent bekliyor.
Teşekkürler
Yazarlar, teknik yardım ve Lena dolgosheina için el yazması redaksiyon için Razvan Cojocaru ve Amir ağahzadeh teşekkür ederiz. Bu proje için bir Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi (NSERC) P.J.U. için işletme hibe tarafından finansman sağlandı
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.8mm Thick Comb 14 Wells for 30 mL PAGE gels | LabRepCo | 11956042 | |
| 101-1000 µL tips | Fisher | 02-707-511 | |
| 20-200 µL low retention tips | Fisher Scientific | 02-717-143 | |
| Acrylamide:N,N'-methylenebisacrylamide (40% 19:1) | Bioreagents | BP1406-1 | Acute toxicity |
| Acrylamide:N,N'-methylenebisacrylamide (40% 29:1) | Fisher | BP1408-1 | Acute toxicity |
| Agar | Anachemia | 02116-380 | |
| Aluminium backed TLC plate | Sigma-Aldrich | 1164840001 | |
| Amersham Imager 600 | GE Healthcare Lifesciences | 29083461 | |
| Ammonium Persulfate | Biorad | 161-0700 | Harmful |
| BL21 cells | NEB | C2527H | |
| Boric Acid | ACP | B-2940 | |
| Bromophenol Blue sodium salt | Sigma | B8026-25G | |
| Chloloform | ACP | C3300 | |
| Dithiothreitol | Sigma Aldrich Alcohols | D0632-5G | |
| DNase I | ThermoFisher | EN0525 | |
| EDTA Disodium Salt | ACP | E-4320 | |
| Ethanol | Commerial | P016EAAN | |
| Flat Gel Loading tips | Costar | CS004854 | |
| Formamide 99% | Alfa Aesar | A11076 | |
| Gel apparatus set with spacers and combs | LabRepCo | 41077017 | |
| Glass Dish with Plastic lid | Pyrex | 1122963 | Should be large enough to fit your gel piece |
| Glycerol | Anachemia | 43567-540 | |
| HCl | Anachemia | 464140468 | |
| ImageQuanTL | GE Healthcare Lifesciences | 29000605 | |
| IPTG | Invitrogen | 15529-019 | |
| KCl | ACP | P-2940 | |
| MgCl2 | Caledron | 4903-01 | |
| MgSO4 | Sigma-Aldrich | M3409 | |
| NaCl | ACP | S-2830 | |
| NaOH | BDH | BDH9292 | |
| Orbital Rotator | Lab-Line | ||
| Phenol | Invitrogen | 15513-039 | |
| Round Gel Loading tips | Costar | CS004853 | |
| Sodium Phosphate dibasic | Caledron | 8120-1 | |
| Sodium Phosphate monobasic | Caledron | 8180-01 | |
| SYBRGold | ThermoFisher | S11494 | |
| T7 RNA Polymerase | ABM | E041 | |
| TEMED | Sigma-Aldrich | T7024-50 ml | |
| TO1-3PEG-Biotin Fluorophore | ABM | G955 | |
| Tris Base | Fisher | BP152-500 | |
| Tryptone | Fisher | BP1421-500 | |
| Tween-20 | Sigma | P9496-100 | |
| Urea | Fisher | U15-3 | |
| Xylene Cyanol | Sigma | X4126-10G | |
| Yeast Extract | Bioshop | YEX401.500 |
Referanslar
- Dolgosheina, E. V., et al. RNA Mango Aptamer-Fluorophore: A Bright, High-Affinity Complex for RNA Labeling and Tracking. ACS Chemical Biology. , (2014).
- Autour, A., et al. Fluorogenic RNA Mango aptamers for imaging small non-coding RNAs in mammalian cells. Nature Communications. 9, 656(2018).
- Dolgosheina, E. V., Unrau, P. J. Fluorophore-binding RNA aptamers and their applications: Fluorophore-binding RNA aptamers. Wiley Interdisciplinary Reviews: RNA. , (2016).
- Panchapakesan, S. S., et al. Ribonucleoprotein Purification and Characterization using RNA Mango. RNA. , 1592-1599 (2017).
- Trachman, R. J. III, et al. Structural basis for high-affinity fluorophore binding and activation by RNA Mango. Nature Chemical Biology. 13, 807(2017).
- Trachman, R. J., et al. Crystal Structures of the Mango-II RNA Aptamer Reveal Heterogeneous Fluorophore Binding and Guide Engineering of Variants with Improved Selectivity and Brightness. Biochemistry. 57, 3544-3548 (2018).
- Trachman, R., et al. Mango-III is a compact fluorogenic RNA aptamer of unusual structural complexity. Nature Chemical Biology. , in review (2018).
- Panchapakesan, S. S. S., Jeng, S. C. Y., Unrau, P. J. RNA complex purification using high-affinity fluorescent RNA aptamer tags. Annals of the New York Academy of Sciences. , (2015).
- Filonov, G. S., Kam, C. W., Song, W., Jaffrey, S. R. In-gel imaging of RNA processing using Broccoli reveals optimal aptamer expression strategies. Chemistry & Biology. 22, 649-660 (2015).
- Milligan, J. F., Groebe, D. R., Witherell, G. W., Uhlenbeck, O. C. Oligoribonucleotide synthesis using T7 RNA polymerase and synthetic DNA templates. Nucleic Acids Research. 15, 8783-8798 (1987).
- A Typical DNase I Reaction Protocol (M0303). NEB. , Available from: https://www.neb.com/protocols/1/01/01/a-typical-dnase-i-reaction-protocol-m0303 (2018).
- Sambrook, J., Russell, D. W. Purification of Nucleic Acids by Extraction with Phenol:Chloroform. Cold Spring Harbor Protocols. 2006 (1), pdb.prot4455 (2006).
- Tuma, R. S., et al. Characterization of SYBR Gold Nucleic Acid Gel Stain: A Dye Optimized for Use with 300-nm Ultraviolet Transilluminators. Analytical Biochemistry. 268, 278-288 (1999).
- Streit, S., Michalski, C. W., Erkan, M., Kleeff, J., Northern Friess, H. Northern blot analysis for detection and quantification of RNA in pancreatic cancer cells and tissues. Nature Protocols. 4, 37-43 (2009).
- Ebhardt, H. A., Unrau, P. J. Characterizing multiple exogenous and endogenous small RNA populations in parallel with subfemtomolar sensitivity using a streptavidin gel-shift assay. RNA. 15, 724-731 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır