Method Article
Akut miyokard infarktüsü ve kardiyovasküler hastalık mikroRNA'lar dolaşan miktarının için dijital PCR
Bu Makalede
Özet
Dolaşımdaki mikroRNA'lar söz biyolojik kalp-damar hastalıkları ve akut miyokard enfarktüsü olarak göstermiştir. Bu çalışmada, bir protokol miRNA ayıklama, Ters transkripsiyon ve kardiyovasküler hastalığı olan hastalarda serum miRNAs mutlak miktar için dijital PCR için açıklar.
Özet
Dolaşımdaki serum mikroRNA (miRNAs) kalp-damar hastalıkları ve akut miyokard infarktüsü (AMI), biyolojik olarak kardiyovasküler hücrelerden dolaşıma serbest bırakılması söz göstermiştir. Dolaşımdaki miRNAs son derece istikrarlı ve sayısal. Belirli miRNAs nicel ifade patoloji ve bazı miRNAs gösteri yüksek doku ve hastalık özgüllük bağlanabilir. Roman biyolojik kalp-damar hastalıkları için bulma tıbbi araştırma için önem taşıyor. Oldukça yakın, dijital polimeraz zincir reaksiyonu (dPCR) icat etti. dPCR, floresan hidroliz probları ile birlikte belirli doğrudan mutlak miktar sağlar. dPCR düşük değişkenliği, yüksek doğrusallık ve nicel polimeraz zincir reaksiyonu (qPCR) göre yüksek hassasiyet gibi üstün teknik nitelikleri sergiler. Böylece, dPCR doğrudan miRNAs, özellikle büyük çok merkezi kardiyovasküler klinik çalışmalarda kullanılmak miktarının bir daha doğru ve tekrarlanabilir yöntemdir. Bu yayında nasıl etkili serum numuneleri mutlak kopya sayısında değerlendirmek için dijital PCR gerçekleştirmek açıklar.
Giriş
Dolaşımdaki miRNAs hastalıkları, kardiyovasküler hastalık1de dahil olmak üzere bir dizi için umut verici işaretler olarak tespit edilmiştir. MiRNAs küçük, kodlama-tek iplikçikli RNA molekülleri (yaklaşık 22 nükleotit uzun) söz konusu olursa çoğu düzenleme yoluyla değişiklik mesajcı RNA çeviri ve etkileyen gen ifade2, içinde ve içine fizyolojik ve patolojik durumları dolaşımda serbest bırakılır. Belirli miRNAs nicel ifade patolojiye bağlanabilir ve yüksek doku ve hastalık özgüllük1bazı miRNAs göstermektedir. Kardiyovasküler hastalıklarda miRNAs onlar serum içinde son derece kararlı olduğu ve kolayca yeni biyolojik PCR metodoloji3yardımı ile sayısal gibi çekici aday olmuştur. Miyokard infarktüsünde biyolojik olarak miRNAs potansiyel değeri küçük çalışmalarda değerlendirilmiştir ama büyük tabur bir doğrulama2eksik. Örneğin, miR-499 son derece miyokardiyal kas ifade bulunur ve bir amı4,5,6' önemli ölçüde artış gösterilmiştir. Ayrıca, düzenleyen programlanmış hücre ölümü (apoptoz) ve cardiomyocytes farklılaşma ve böylece bir amı7takip çeşitli mekanizmalar ilgilenmektedir. Bir üstünlük ve miRNAs AMI tanısı için artımlı değerini raporlama bazı küçük çalışmalar dışında üstünlük veya eşitlik yüksek-duyarlı kardiyak troponins için henüz büyük ölçekli çalışmalar2',5 kanıtlanmamıştır ,6,8. Bu nedenle, ileriye dönük çalışmalarda daha büyük tabur miRNAs olası tanı değerini değerlendirmek için gereklidir. Ayrıca, miRNA miktar yöntemleri optimize edilmiş olması gerekir ve standart karşılaştırılabilir kullanarak9protokolleri. Standart deneyleri tutarsız sonuçlar azaltabilir ve biyolojik kendi klinik uygulanabilirliği sağlamak için tekrarlanabilir bir şekilde sayısal gerek rutin klinik uygulama için potansiyel biyolojik olmak için miRNAs yardımcı olabilir.
Son zamanlarda, dPCR bir son nokta analiz olarak tanıttı. Yaklaşık 20.000 bireysel tepkiler10örnek bölümleri. DPCR sistemi standart eğri10olmadan mutlak bir miktar etkinleştirme bir matematiksel Poisson istatistiksel analiz floresan sinyallerini (pozitif ve negatif tepkiler), sonra kullanır. DPCR floresan hidroliz probları ile birleştirilirken, miRNAs çok özel doğrudan mutlak miktar mümkün olmaktadır. Dijital polimeraz zincir reaksiyonu miRNA seviyelerinde miktarının için (azalan bir değişkenliği, artan bir gün-gün tekrarlanabilirlik, doğrusallık yüksek derecede ve yüksek bir hassasiyet de dahil olmak üzere) üstün teknik özellikleri sergilemek göstermiştir nicel gerçek zamanlı PCR10,11' e göre dolaşım. Bu üstün teknik nitelikleri dolaşımdaki miRNAs biyolojik kullanma mevcut kısıtlamaları hafifletmek için yardımcı olabilir ve miRNAs kurulması için biyolojik büyük çok merkezi kardiyovasküler klinik çalışmalarda ve bir tanı yöntemi olarak neden olabilir Genel. Bir önceki çalışmada son zamanlarda dPCR miRNAs bir AMI hastalarında dolaşımdaki mutlak miktar için uygulanan ve miRNAs miktar için qPCR12ile karşılaştırıldığında üstün tanılama potansiyel göstermek başardık.
Bu yayında, dPCR kullanarak doğrudan kardiyovasküler miRNAs dolaşan miktarının için doğru ve tekrarlanabilir bir yöntem olduğunu ispat etmek istiyoruz. MiRNA düzeyleri kullanarak dijital PCR, serumda mutlak miktar büyük çok merkezi kardiyovasküler klinik deneylere kullanım için potansiyel gösterir. Bu yayında, etkili bir şekilde dijital PCR gerçekleştirmek ve serum içinde mutlak miRNA kopya numarası tespit ayrıntılı olarak anlatan.
Protokol
1. plazma/Serum üzerinden miRNA çıkarımı
Not: miRNAs uygun bir şekilde ölçmek için plazma/serum doğru mikroRNA izolasyonu önemli bir adımdır. Özellikle farklı protokoller bulunmaktadır çünkü, dikkat edilmesi gereken önemli bir şey için aynı iş akışı örnekleri işlenirken uygun etmektir. Bu protokol için miRNA 50 µL serum elde edilir. 200'den fazla µL bu sınıra doğru ayıklama işlemi kullanmayın.
- Serum hazırlamak veya donmuş numuneler çözülme.
- 250 µL (5 cilt) ticari lizis reaktif için 50 µL serum ekleyin. Lizis vortexing tarafından destekler. Tüp lysate ile 5 min için oda sıcaklığında bankta yerleştirin.
- Spike-kontrol (1.6 x 107 kopya/µL) 3.5 µL ile lysate spike ve vortexing tarafından mix onları.
- Kloroform (yani, eşit miktarda başlangıç serum örneği olarak) 50 µL faz ayrılması için ekleyin. Tüp 15 s. yer, oda sıcaklığında 2-3 dakika için bankta tüp için şiddetle çalkalanır.
- Faz ayrılması için santrifüj kapasitesi 12.000 x g 15dk için 4 ° C'de, tüp.
Not: Örnekleri şimdi RNA, beyaz bir interfaz ve daha düşük, pembe Organik faz içeren bir üst sulu aşamaya ayrılır. - Üst sulu faz (100 µL) RNA içeren yeni bir tüp içine aktarın. Bu doğru RNA sayısı onu gibi herhangi bir beyaz Interphase malzeme aktarılmaz.
- % 100 etanol 150 µL (yani, Transfer edilen örnek hacmi x 1.5) ekleyin. Onları yukarı ve aşağı pipetting tarafından malzemeleri karıştırın. Değil onları santrifüj kapasitesi ve hızlı bir şekilde bir sonraki adıma geçin.
- 250 µL üzerine 2 mL toplama tüp ticari spin sütununda örneğinin pipet. Kapağı kapatın. Adresindeki sütun santrifüj kapasitesi > 8.000 x g akışı aracılığıyla 15 s. atma için oda sıcaklığında.
- Ticari çamaşır arabellek sayının 1 700 µL spin sütununu ekleyin. Kapağı kapatın ve sütun sırasında santrifüj kapasitesi > 8.000 x g 15 s. atma çalışma çamaşır arabellek için oda sıcaklığında.
- Ticari çamaşır arabellek sayının 2 500 µL spin sütununu ekleyin. Kapağı kapatın ve sütun sırasında santrifüj kapasitesi > 8, 000 x g 15 s. atma çalışma çamaşır arabellek için oda sıcaklığında.
- 500 µL % 80 etanol spin sütuna pipet. Kapağı kapatın, adresindeki sütun santrifüj kapasitesi > 8, 000 x g 2 dakika süreyle oda sıcaklığında toplama tüp akışı aracılığıyla ile atmak.
- Spin sütun için yeni bir 2 mL toplama tüp aktarın. Sütun membran kuruması için açılan bir kapak ile tam hızda santrifüj kapasitesi. Toplama tüp akışı aracılığıyla ile atmak.
- Spin sütun yeni bir 1,5 mL toplama tüp içine aktarın. RNA membran merkezine doğrudan RNase free su 30 µL uygulayarak elute. Kapağı kapatın. Sütun 1 dk. için tam hızda santrifüj kapasitesi.
- RNA-70 ° C'de depolayın
Not: RNA hiçbir bozulma için 1 yıl-70 ° C ile-20 ° C arasında RNase free suda arıtılmış RNA depolanmasını sağlar. Üreticinin RNA sulandırmak için su RNase free en az 10 µL. 10 µL yeterince membran hidrat ve toplam RNA verim azaltmak daha az kullanarak iletişim kuralıdır.
2. Ters transkripsiyon
Not: Tamamlayıcı DNA (cDNA) (Toplam reaksiyon cilt) aşağıdaki 15 µL ters Transkripsiyon (RT) iletişim kuralını kullanarak sentez.
- RT kiti buz çözme. Enzimler dondurucu sürece onları aşağılayıcı önlemek ve onları kullanmadan önce spin mümkün unutmayın. RT astar buz çözme ve onları kullanmadan önce spin.
- Ana mix Tablo 1' de açıklandığı şekilde hazırlayın.
- Ana Mix 10 µL ve 96 iyi tabakta bir kuyu başına ayıklanan RNA'ın 5 µL birleştirir.
- 2.000 x g 2 min için 4 ° C'de de iyi plaka santrifüj kapasitesi.
- Tablo 2 ' de açıklanan Ters transkripsiyon için termal döngü protokolünü kullanır.
Not: aşağıda açıklandığı gibi cDNA doğrudan dijital PCR makinada işleme (bkz. Tablo reçetesi); Alternatif olarak,-20 ° C'de depolanmış olabilir
3. damlacık üretimi ve dijital PCR
Not: Dijital PCR aşağıdaki 40 µL protokolü kullanılarak gerçekleştirilen.
- Ticari dPCR mix, hazırlanan cDNA ve PCR astar buz çözme. Onları kısa bir süre kullanılmadan önce santrifüj kapasitesi.
- Açıklandığı gibi ana karışım hazırlamak Tablo 3.
- 1.33 μL/iyi RT ürün ekleyin ve kısa bir süre santrifüj kapasitesi.
- 20 μL örnek 8-şey kaset (orta satır) her kuyuya pipet.
Not: 8-şey kaset tamamen dolu değil, kalan wells cDNA (yani, suyu ayıklanan RNA yerine ile üretilen RT ürün) ihmal şablonu olmayan denetimleri (NTCs) ile doldurmak veya dPCR ticari arabellek. NTC kontaminasyon kontrolü hizmet vermektedir. Bu damlacık oluşumu kalitesini bozabilir çünkü su içinde kalan wells, kullanılmamış olması gerekir. - 70 μL sondalar damlacık üretimi petrol petrol kuyuları (alt satır) 8-şey kaset pipet.
- 8-şey kaset üstüne bir conta yeri ve damlacık Jeneratör ' kaset yerleştirin. Damlacık jeneratörü kapatın. 3 gösterge ışıkları sürekli yeşil kadar bekleyin.
Not: Şimdi damlacıkları oluşturuluyor. - Dikkatli ve yavaş 40 μL damlacık kurulan örnek (üst satır) pipetting tarafından bir 96-şey plaka ayrı kuyu aktarın.
- Damlacık oluşumu örnekleri üzerinde tamamladıktan sonra 4 için 180 ° C'de pierceable dPCR folyo ile PCR plaka mühür s.
- Folyo mühürlü PCR-plaka cycler yerleştirin ve rampa 2.5 oranında Tablo 4 ' te açıklandığı gibi döngüsü ° C/s.
4. damlacık okuma ve analiz
- Plaka, plaka sahibi tabanına termal cycler aktarın. PCR plaka plaka sahibi PCR plaka üzerine üstündeki yerleştirerek sıkıştırın.
- Ticari dPCR yazılımını başlatın.
- Örnek adı, deneme ve hedef adını kurulumunda girin. Mutlak miktar seçin.
- Çalıştır' ı tıklatarak okuma damlacık başlatın. FAM/HEX veya FAM/VIC hidroliz probları ile çalışırken algılama Kimya seçin.
Not: Ticari dPCR yazılım sonra auto-verileri analiz eder. - Doğru damlacık üretimi sağlamak için sonuçları tablosunda damlacık numaralarını denetleyin.
- Bütün wells ile aynı quantified miRNA seçin ve Çözümle' yi tıklatın. 2D leke olumlu damlacıkları işaretlemek ve el ile otomatik analiz verileri (Şekil 1) düzeltmek için kullanın.
5. doğru hesaplama örneği
- Örnek örnek normalleştirme faktörüyle (NF) çarparak normalleştirmek.
NF medyan [C. elegans miR-39 ölçümleri]tüm örnekleri= / [C. elegans miR-39]verilen örnek - Seyreltme faktörler (DF) için ayarlama son miRNA serum konsantrasyonu hesaplayın.
[miRNA] son DFRT DFdPCR DFEx x x x [miRNA]satır değeri =
Nerede:
[miRNA] satır değeri ticari dPCR yazılımların; sayısal miRNA =
DFRT = seyreltme faktörü şablonunun Ters transkripsiyon;
DFdPCR = dPCR; şablonunda seyreltme faktörü
DFEx = seyreltme faktörü çıkarma içinde.
6. sentetik oligonükleotid seyreltme serisi
- Sentetik oligonükleotid liyofilize buz çözme. Kısaca santrifüj kapasitesi.
- Lyophilized sentetik oligonükleotid nükleaz ücretsiz su 10 pmol son bir konsantrasyon içinde seyreltik / µL. kısaca santrifüj kapasitesi bu.
- Tablo 5' te açıklandığı gibi nükleaz ücretsiz suda sulandırmak. Kısaca 8.000 x g 10 seyreltme her adımda arasında seyreltme santrifüj kapasitesi s.
- 2. adımda açıklandığı gibi ters transkripsiyon ile devam etmek ve adım 3 ve adım 4 bölümünde açıklandığı gibi dijital PCR ile örnekleri analiz.
Sonuçlar
Dijital PCR floresan hidroliz probları ile kombine araştırmacılar doğrudan belirli miRNAs kopya/µL mutlak miktarı ölçmek için sağlar. DPCR örnekte içinde yaklaşık 20.000 bireysel PCR reaksiyonları, dPCR teknik gerektirmeyen bölümlere gibi10çoğaltır. DPCR sistemi (pozitif ve negatif tepkiler arasında farklı) Floresan sinyallerini bir matematiksel Poisson istatistiksel analizi kullanır eğri bir standart için ihtiyaç olmadan10mutlak bir miktar etkinleştirme. Bir kabul edilebilir damlacık saymak doğru konsantrasyonları hesaplamak için gereklidir (> 15.000). Hiçbir şablon denetimleri önemli nonspesifik amplifikasyon dışlanması olun. Tüm örnekleri Analize dahil elde edilen sonuçlar geçerliliğini güçlendirmek için aynı birim, yöntemi ve PCR protokolü kullanılarak işlenir. DPCR elde edilen konsantrasyonlarda çivili içinde sentetik ile analiz tüm örnekleri arasında bir medyan normalleştirme yordamı kullanarak normalleştirilmiş C. elegans miR-3913. Çivili bileşenini C. elegans ölçülen miktarı için veri normalleştirme miR-39 için örnek örnek varyasyon RNA ayıklama verimliliğini düzeltir ve daha da sonuçları geçerliliğini ekleyerek bir PCR reaksiyon kontrol olarak hizmet vermektedir. Serum miRNAs normalleştirme için kurulan hiçbir altın standart olduğunu; Ancak, eksojen denetimleri çivili bileşenini gibi endojen miRNAs sık sık çeşitli hastalık Birleşik9' değişmiş gibi C. elegans miR-39 normalleştirme yordamlar için şık bir çözüm vardır.
Analiz serum numuneleri bir perkütan koroner girişim (PCI), PCI sonra 8 h önce ve 16 h hastaların bir Akut ST-miyokard infarktüsünde (STEMI) ile bir PCI sonra satın alınan. STEMI hastalar şiddetli iskemi sergi ve böylece yeni iskemi biyolojik değerlendirme için hak. MiR-499 yayın kinetik ve potansiyel miR-499 olarak kullanımı bir biyomarker iskemi kalp-damar hastalıkları için değerlendirmek için miR-499 dPCR ile tüm hastalar için üç farklı zaman puan14arasında analiz edildi.
Şekil 1 pozitif damlacıkları yazılım tarafından hesaplanan son miRNA konsantrasyon veren seçimi gösterir. Pozitif bir kısmını kopya/µL ticari dPCR yazılım tarafından hesaplanan konsantrasyon belirler. Sonuçları da 2D plan yaptığını görüntülenmeyecektir ve pozitif el ile daireler ile işaretlenebilir. Eğer onlar NTCs nonspesifik amplifikasyon konsantrasyonları yalnızca kabul edilir.
Şekil 2 çoğaltmaları doğrusallık ve uyum iyilik bir sentetik miRNA oligonükleotid vardır-miR-499-5 p seyreltme serisi gösterir. 8-adım seyreltme dizisi 0 kopya/µL için 2.500 kopya/µL gerçekleştirildi. Hesaplanan beklenen kopya/µL Tablo 5 ' te açıklandığı gibi % 100 RT ve dijital PCR verimliliği varsayıyorum. Bu kurulum, dijital PCR doğrusallık yüksek derecede gösterir (r2 0,99 =). Algılama sınırı (LoD = 0,12) ve miktar sınırı (LoQ 0,23 =) bile bir düşük miRNA ifade başarıyla algılanabilir gösterilen Şekil 2' de de sunulmaktadır. Böylece, dPCR miRNAs dolaşan bile düşük serum düzeyleri ölçmek için kullanılabilir. Algılama (LOD olarak) sınırı ve miktar (LoQ) sınırını Forootan vd yaklaşım takip hesaplanır 15 ve are LoD tanımlanan = LoB + 1.645 x σdüşükkonsantrasyonörneknerede boş (LoB) sınırını LoB hesaplanır, = ortalamaboş + 1.645 x σboş. Tahmini çalışan çoğaltma standart15eğrileri sonra LoQ var. MiRNAs tekrarlanabilir miktar emin olmak için sadece LoD ve LoQ yalan miRNA konsantrasyonları geçerli bir tam değeri olarak kabul edilir.
Şekil 3 miR-499 düzeyleri bir ST elevasyonu miyokard infarktüsü (STEMI), n hastalarının temsilcisi sonuçlarını gösterir = 16, her zaman bir noktada. Örnekleri perkütan girişim (PCI) önce alınmıştır (t = 0), bir PCI sonra 8 h (t = 8) ve sonra bir PCI 16 h (t = 16), ve miR-499 düzeyleri hastalar miR-499 düzeylere stabil koroner arter hastalığı (CAD, n ile karşılaştırıldı = 20). Temel hasta özellikleri Tablo 6' da bulunabilir. İlk 8 h bir miyokard infarktüsü serum içine miR-499 ilk yayımlanmasından sonra tekrar 16 h sonra miR-499 düzeylerini azaltın. Bir eğilim artış zaten STEMI başında görülebilir (t = 0), ve miR-499 düzeylerinin hastalara CAD ile karşılaştırıldığında önemli bir artış görüldü 8 h sonra STEMI olabilir (t = 8, p < 0,01) ne zaman miR-499 düzeylere karşılaştırma miR-499 düzeyleri istikrarlı CAD hastaların. İşletim alıcı (ROC) gösteri miR-499 mümkün programı olarak CAD ile hasta ve hasta bir STEMI ile birbirinden ayırmak için yeni bir biyomarker eğrileri [(AUC) eğri altındaki alan 0.62 bir perkütan girişim önce (PCI), AUC alınan örnekler için = = bir PCI ve AUC sonra 8 h alınan örnekler için 0,75 0.78 sonra miR-499 hastalarda serum düzeyleri CAD ile karşılaştırıldığında PCI 16 h alınan örnekler için =].

Şekil 1: pozitif damlacıkları bir seyreltme dizisinde yelpazesi gerçekleştirilen çoğaltmaları. (A)eşik değer ayarı el ile negatif damlacıkları. (B) sonuçları 2D bir leke, çember tarafından seçilen pozitif olarak görüntülenir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
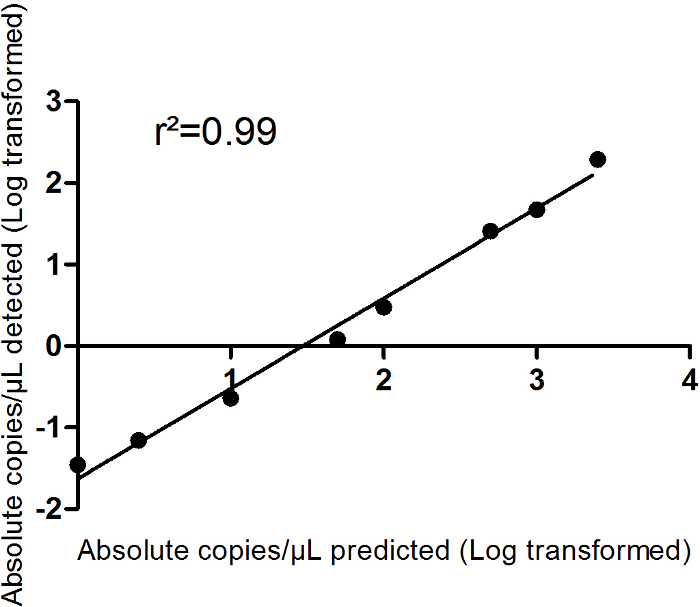
Şekil 2: sentetik miR-499 oligonükleotid seyreltme serisi. (A)ölçümleri yinelenen içinde gerçekleştirilmiştir. Verileri günlük µL. doğrusal regresyon ve uyum iyilik başına mutlak kopya olarak dönüştürülmüş sunulmaktadır (r2-değer) gösterilir. Ortalama ± SEM (B) Bu paneli algılama (LOD olarak) sınırı ve sınır olan miktar (LoQ) de görüldüğü gibi verileri sunulmaktadır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3: serum miR-499-5 p ST elevasyonu miyokard enfarktüsü hastalarında dolaşımdaki miktar (n = 16) perkütan koroner girişim (PCI), 8 h sonra PCI ve PCI sonra 16 h önce stabil koroner arter ile hastalara göre hastalığı (n = 20). (Adolaşan) serum miR-499-5 p demek anlamına karşılık gelen pile standart hatası ile olarak temsil edilir-tek yönlü ANOVA tarafından hesaplanan değer izlenen bir Bonferroni post hoc testi ile (p < 0,05 olarak olarak kabul istatistiksel olarak anlamlı). (B) A alıcı karakteristik eğrisi (ROC) analiz çalışma masası Averilerden gerçekleştirilir. ROC analiz duyarlılık ve özgüllük biyomarker gösterir. Ayrıca, eğri (AUC) değerleri karşılık gelen alanında gösterilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| örnek tutar | ||||
| n = 1 | / [μl] iyi | |||
| nükleaz ücretsiz su | 4,16 | |||
| 10 x Ters transkripsiyon arabellek | 1.5 | |||
| 100nM dNTP | 0,15 | |||
| RNAse inhibitörü | 0,19 | |||
| belirli RT astar | 3 | |||
| Ticari Ters transkriptaz enzimi 50 U/ul | 1 | |||
| Master-Mix toplam | 10 | |||
Tablo 1: Ters transkripsiyon reaktifler Mix.
| Sıcaklık | Zaman |
| 16 ° C | 30 dakika |
| 42 ° C | 30 dakika |
| 85 ° C | 5 dakika |
| 4 ° C | ∞ |
Tablo 2: Termal Bisiklet koşullarını Ters transkripsiyon için.
| örnek tutar | ||||
| n = 1 | / [μl] iyi | |||
| nükleaz ücretsiz su | 7,67 | |||
| ticari dPCR mix | 10 | |||
| 20 x belirli hidroliz astar/sonda | 1 | |||
| Master-Mix toplam | 18,67 | |||
Tablo 3: Dijital PCR reaktif Mix.
| Sıcaklık | Zaman |
| 95 ° C | 10 dakika |
| 94 ° C | 30 saniye (x40) |
| 60 ° C | 1 dk. |
| 98 ° C | 10 dakika |
| 4 ° C | ∞ |
Tablo 4: Termal Bisiklete binme için koşullar dijital PCR.
| Tüp | Sentetik oligonükleotid miR-499 (µL) transfer | Seyreltici (µL) | miRNA (kopya/µL) | Beklenen kopya/µL RT | DPCR beklenen kopya/µL |
| Özgün | 6.022 x 1012 | ||||
| 1 | 10 | 990 | 6.022 x 1010 | ||
| 2 | 10 | 990 | 6.022 x 108 | ||
| 3 | 10 | 990 | 6.022 x 106 | ||
| 4 | 18,7 | 981.3 | 1.128 x 105 | 37600 | 2500 |
| 5 | 40 | 60 | 4.511 x 104 | 15040 | 1000 |
| 6 | 50 | 50 | 2.256 x 104 | 7520 | 500 |
| 7 | 40 | 160 | 4.511 x 103 | 1504 | 100 |
| 8 | 50 | 50 | 2.256 x 103 | 752 | 50 |
| 9 | 40 | 160 | 4.511 x 102 | 150.4 | 10 |
| 10 | 50 | 150 | 1.128 x 102 | 37.6 | 2.5 |
| 11 | 0 | 50 | 0 | 0 | 0 |
Tablo 5: Sentetik seyreltme serisi miR-499.
| Karakteristik | Tüm | Kararlı CAD hastalar (n = 20) | STEMI hastalar (n = 24) | p-değeri |
| Yaş | 64.7 ± 11,9 | 66.7 ± 13,1 | 62.2 ± 9,9 | 0.2810 |
| Erkek | %77,8 | % 65 | %93,8 | 0.0392 |
| DM | %33,3 | % 40 | % 25 | 0.3428 |
| HTN | %61.1 | % 60 | % 62.5 | 0.8785 |
| Dislipidemi | %38.9 | % 65 | % 6.3 | 0,0003 |
| Sigara içen | %47.2 | % 55 | %37.5 | 0.3796 |
| Aile öyküsü | % 25 | % 35 | % 12.5 | 0.1213 |
| Kilolu | %58.3 | % 55 | % 62.5 | 0.6501 |
| Serum kreatinin düzeyinde (mg/dL) | 0,94 (0.83 - 1) | 0,98 (0.82 - 1,01) | 0,93 (0.83 - 1) | 0.7255 |
| CK tepe (U / ı) | 161 (102-611) | 126 (81-161) | 492 (228-3208) | 0.0004 |
| cTnT tepe (ng/L) | 322.5 (23,8-4533) | 18 (7-25,3) | 2492 (240-5586) | 0.0002 |
| VEF % | % 45'i (% 40-%50) | % 45 (% 32.5-%55) | % 45'i (% 45-%50) | 0.9596 |
| Değerleri ± SD demek gibi sunulur; medyan değeri (25-75 persentil aralığı) veya % | ||||
| David Merrill: Diabetes mellitus | ||||
| HTN: hipertansiyon | ||||
| CK: kreatin kinaz | ||||
| cTnT: kardiyak troponin T | ||||
| VEF: Sol ventrikül ejeksiyon fraksiyonu | ||||
Tablo 6: Ana hasta özellikleri.
Tartışmalar
Dijital PCR nükleik asitler bir örnek içinde doğrudan mutlak miktar sağlar PCR nispeten roman son nokta yöntemidir. Yöntemi belirli avantajları, azalan bir değişkenliği, artan bir gün-gün tekrarlanabilirlik ve üstün hassasiyet11,12de dahil olmak üzere sahiptir. Ayrıca, örnek yaklaşık 20.000 tek reaksiyonlar ve bitiş noktası analizleri bölümleme nedeniyle, dPCR için daha sağlam olur kantitatif RT-PCR16için karşılaştırıldığında PCR sokan maddeler. DPCR bu nitelikleri miktar için bir tanı aracı olarak kantitatif RT-PCR için cazip bir alternatif yapmak. MiRNAs dolaşan olarak şimdiye kadar bilim adamları meydan miRNAs PCR9tarafından uygun bir şekilde ölçmek için düşük serum konsantrasyonları mevcut çoğu kez. Öte yandan, dPCR bile bir düşük miRNA ifade düşük sayısı miRNA miktar17' gözlenen sorunları azaltıcı serumda uygun bir şekilde ölçmek. DPCR doğrudan sayar/µL, hatta çok düşük miRNA ifade vermek yeteneği böylece çekici bir tanı aracı miRNA biyomarker çalışmalarda kardiyovasküler araştırma topluluğu sağlar. Sayar/µL içinde verilen toplama çıkarma, RT-reaksiyonu ve dPCR kullanılan seyreltme faktörü ile çarpımı olarak 1 µL serum kopyalarda tam sayısını elde etmek mümkündür. Burada sunulan iş akışı 96 örneklerinde bu nedenle büyük kardiyovasküler çalışmalar için bir araç sağlayan bir plaka üzerinde gerçekleştirilebilir. DPCR çeşitli kantitatif RT-PCR avantajlar sergileyen bile, bu henüz düzenli olarak miRNAs kardiyovasküler çalışmalarda miktar için uygulanmaz. Ayrıca, standart veri normalleştirme yordamlar eksik vardır.
Bu yaklaşım, floresan hidroliz probları ile kombine o dPCR, kardiyovasküler hastalıklara bağlı miRNAs dolaşan belirli doğrudan mutlak miktar sağlar gösterir. Bu rapor ile hem miRNA algılama ile dPCR için en iyi duruma getirilmiş bir protokol göstermek ve dPCR avantajları kantitatif RT-PCR onaylamak amaçlanmıştır.
Biz iyi doğrusallık dPCR sergiler ve algılamayı düşük limitleri ve dPCR miRNAs miktarının için miktar doğruladı. Örnek bir sentetik oligonükleotid ile spiking tarafından örnek normalleştirme ayıklama verimlilik ve örnek örnek varyasyon için ayarlama, mümkündür.
Sonuç olarak, dijital PCR, teknik yeterlilik ve tanılama potansiyeli, üstünlük sergiler gibi miRNA miktar için en iyi geçerli yöntemdir ve daha büyük çok merkezi kardiyovasküler miRNA biyomarker çalışmaları için kullanılabilir.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar hiçbir ilgili kaynaklar var.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RNA-Extraction | |||
| miRNeasy Serum/Plasma Kit (50) | Qiagen-Sample & Assay Technologies, Hilden, Deutschland | 217184 | Kit for microRNA extraction. Kit contains commercial buffer RWT (called number one in the manuscript) and RPE (called number two in manuscript). |
| miRNeasy Serum/Plasma Spike-in-Control; Syn-cel-miR-39 miRNA; 10pmol | Qiagen-Sample & Assay Technologies, Hilden, Deutschland | 219610 | Spike-in for normalisation , Sequence: 5'-UCACCGGGUGUAAAUCAGCUUG-3' |
| Reverse Transcription | |||
| TaqMan MicroRNA Reverse Transcription Kit (1000 Reactions) | Applied Biosystems, Inc., Foster City, CA, USA | 4366597 | Kit for microRNA reverse transcription |
| TaqMan MicroRNA Assays M | Applied Biosystems, Inc., Foster City, CA, USA | 4440887 | Assays used in reverse transcription |
| hsa-miR-499 (750 RT/750 PCR rxns) | Applied Biosystems, Inc., Foster City, CA, USA | 4440887 | Assay Number 001352 |
| cel-miR-39 (750 RT/750 PCR rxns) | Applied Biosystems, Inc., Foster City, CA, USA | 4440887 | Assay Number 000200 |
| PCR Plate, 96-well, segmented, semi-skirted | Thermo Fisher Scientific, Waltham, MA, USA | AB0900 | 96 well plate for reverse transcription |
| Microseal ‘B’ seal Seals | Bio-Rad Laboratories, Inc., Hercules, CA, USA | MSB1001 | Foil to ensure proper storage |
| C1000 Touch Thermal Cycler | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1851196 | Cycler used for reverse transcription |
| Droplet Digital PCR | |||
| 100 nmole RNA oligo hsa-miR-499-5p | Integrated DNA Technologies | Custom | Sequence: 5'-phos-UUAAGACUUGCAGUGAUGUUU-3' |
| ddPCR Supermix for Probes (No dUTP) | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1863024 | Supermix used in droplet generation |
| TaqMan MicroRNA Assays | Applied Biosystems, Inc., Foster City, CA, USA | 4440887 | Assays used in digital PCR (fluorescent hydrolysis probe) |
| hsa-miR-499 (750 RT/750 PCR rxns) | Applied Biosystems, Inc., Foster City, CA, USA | 4440887 | Assay Number 001352, commercial primers |
| cel-miR-39 (750 RT/750 PCR rxns) | Applied Biosystems, Inc., Foster City, CA, USA | 4440887 | Assay Number 000200, commercial primers |
| DG8 Cartridges and Gaskets | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1864007 | Cartridge takes up to 8 samples for droplet generation |
| DG8 Cartridge Holder | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1863051 | Holds cartridges in droplet generation |
| Droplet Generation Oil for Probes | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1863005 | Oil used in droplet generation |
| ddPCR 96-Well Plates | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 12001925 | 96 well plate for ddPCR |
| PCR Plate Heat Seal, foil, pierceable | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1814040 | Pierceable foil, compatible with droplet reader |
| ddPCR Droplet Reader Oil | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1863004 | Oil used in droplet reading |
| QX100 or QX200 Droplet Generator | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1863002 | Droplet Generator, generates the droplets from sample/oil emulsion |
| PX1 PCR Plate Sealer | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1814000 | Seals the plate before PCR |
| C1000 Touch Thermal Cycler | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1851196 | Cycler used for ddPCR |
| QX100 or QX200 Droplet Reader | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1863003 | Reads PCR-positive and PCR-negative droplets with an optical detector |
| ddPCR Buffer Control for Probes | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1863052 | Blank control and to fill up the remaining wells of 8-well cassette |
| Software | |||
| QuantaSof Software | Bio-Rad Laboratories, Inc., Hercules, CA, USA | 1864011 | Program for droplet reading |
| Prism Windows 5 | GraphPad Software Inc., La Jolla, CA, USA | Program for statistical analysis |
Referanslar
- Schulte, C., Zeller, T. microRNA-based diagnostics and therapy in cardiovascular disease - summing up the facts. Cardiovascular Diagnosis and Therapy. 5, 17-36 (2015).
- Sun, T., et al. The role of microRNAs in myocardial infarction: from molecular mechanism to clinical application. International Journal of Molecular Sciences. 18, (2017).
- Dimmeler, S., Zeiher, A. M. Circulating microRNAs: novel biomarkers for cardiovascular diseases. European Heart Journal. 31, 2705-2707 (2010).
- Creemers, E. E., Tijsen, A. J., Pinto, Y. M. Circulating microRNAs: novel biomarkers and extracellular communicators in cardiovascular disease. Circulation Research. 110, 483-495 (2012).
- Oerlemans, M. I., et al. Early assessment of acute coronary syndromes in the emergency department: the potential diagnostic value of circulating microRNAs. EMBO Molecular Medicine. 4, 1176-1185 (2012).
- Olivieri, F., et al. Diagnostic potential of circulating miR-499-5p in elderly patients with acute non ST-elevation myocardial infarction. Internation Journal of Cardiology. 167, 531-536 (2013).
- Navickas, R., et al. Identifying circulating microRNAs as biomarkers of cardiovascular disease: a systematic review. Cardiovascular Research. 111, 322-337 (2016).
- Devaux, Y., et al. Diagnostic and prognostic value of circulating microRNAs in patients with acute chest pain. Journal of Internal Medicine. 277, 260-271 (2015).
- Schwarzenbach, H., da Silva, A. M., Calin, G., Pantel, K. Data normalization strategies for microRNA quantification. Clinical Chemistry. 61, 1333-1342 (2015).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Analytical Chemistry. 83, 8604-8610 (2011).
- Hindson, C. M., et al. Absolute quantification by droplet digital PCR versus analog real-time PCR. Nature Methods. 10, 1003-1005 (2013).
- Robinson, S., et al. Droplet digital PCR as a novel detection method for quantifying microRNAs in acute myocardial infarction. Internation Journal of Cardiology. 257, 247-254 (2018).
- Mitchell, P. S., et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proceedings of the National Academy of Sciences of the United States of America. , 10513-10518 (2008).
- D'Alessandra, Y., et al. Circulating microRNAs are new and sensitive biomarkers of myocardial infarction. European Heart Journal. 31, 2765-2773 (2010).
- Forootan, A., et al. Methods to determine limit of detection and limit of quantification in quantitative real-time PCR (qPCR). Biomolecular Detection and Quantification. 12, 1-6 (2017).
- Dingle, T. C., Sedlak, R. H., Cook, L., Jerome, K. R. Tolerance of droplet-digital PCR vs real-time quantitative PCR to inhibitory substances. Clinical Chemistry. 59, 1670-1672 (2013).
- Taylor, S. C., Laperriere, G., Germain, H. Droplet digital PCR versus qPCR for gene expression analysis with low abundant targets: from variable nonsense to publication quality data. Scientific Reports. 7, 2409(2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır