Method Article
Kimyasal amputasyon ve yeniden oluşturulmasını Planarian Schmidtea mediterranea yutak
Bu Makalede
Özet
Planarian Schmidtea mediterranea kök hücre ve doku rejenerasyonu çalışmak için mükemmel bir modeldir. Bu yayın seçerek bir organ, yutak, kimyasal sodyum azid hayvanlara açarak kaldırın yöntemi açıklanır. Bu iletişim kuralı Ayrıca yutak rejenerasyon izlemek için yöntem açıklar.
Özet
Planarians yeniden oluşturma işlemi son derece verimli solucanlar vardır. Bu yeteneği hızla herhangi bir yaralanma türüne yanıt verebilir kök hücreler çok sayıda borçlular. Bu hayvanların ortak yaralanma modellerinde birden çok organları zarar doku büyük miktarda kaldırın. Bu geniş doku hasarı üstesinden gelmek için burada seçerek tek bir organ, yutak, planarian Schmidtea mediterraneakaldırmak için bir yöntem açıklanmaktadır. Bu sitokrom oksidaz inhibitörü sodyum azid içeren bir çözümde iliklerine hayvanlar tarafından elde etmek. Sodyum azid kısa maruz kalma "kimyasal amputasyon." dediğimiz hayvan yutak ekstrüzyon neden olur Kimyasal amputasyon tüm yutak kaldırır ve nerede yutak bağırsak için verdiği küçük bir yara oluşturur. Geniş durulama sonra tüm uzvunu hayvanların yaklaşık bir hafta içinde tamamen işlevsel bir yutak yeniden. Vücudun geri kalanıyla kök hücre yenilenme yeni yutak sürücü. Burada, bir ayrıntılı sağlamak protokol için kimyasal amputasyon ve başarılı amputasyon ve rejenerasyon değerlendirmek için histolojik ve davranış yöntemleri açıklanmaktadır.
Giriş
Rejenerasyon hayvanlar alemi tam vücut yenilenme içinde bazı omurgasızlar omurgalıların1daha sınırlı yetenekleri için arasında değişen rejeneratif kapasiteleri ile ortaya çıkan bir olgudur. Yedek fonksiyonel dokuların karmaşık bir süreçtir ve genellikle birden çok hücre tiplerinin eşzamanlı restorasyon üzerine kuruludur. Örneğin, semender uzuv, dokusunu, kondrosit, nöronlar, kas ve epitel hücreleri gerek yeniden oluşturmak için2yerini aldı. Bu yeni oluşturulan hücre tipleri de düzgün yeni bacak işlevini kolaylaştırmak için organize olmak gerekir. Bu karmaşık süreçleri anlamak belirli hücre tipleri ve organları kendi entegrasyon rejenerasyon odaklanmak teknikler gerektirir.
Rejeneratif yanıt-e doğru çalışma kolaylaştırmak için istihdam stratejileri ya belirli hücre tiplerinin hedeflenen ablasyon veya dokuların daha büyük Koleksiyonlar biridir. Örneğin, Zebra balığı, Metronidazol3,4uygulamadan sonra imha edilmesini ifade belirli hücre tipleri içinde nitroreductase yol açar. Drosophila larva pro-apoptotik genler doku özel Organizatör altında ifade seçerek özel bölgeler Imaginal disk5,6ablate. Bu stratejileri her ikisi de hızlı ama kontrollü zarar ve moleküler ve hücresel yenilenme için sorumlu mekanizmaları incelemek için kullanılır.
Bu makale, seçmeli olarak tüm organ yutak planarian Schmidtea mediterraneaadlı ablate için bir yöntemi açıklanmaktadır. Planarians nerede bile dakika parçaları bütün hayvanlar 7,8regrow rejenerasyon, üretken rejeneratif yeteneklerini bilinen klasik bir model vardır. Kök hücreler pluripotent hücreler ve soy tarafından kısıtlanmış ataları9,10,11oluşan büyük, türdeş olmayan nüfusu var. Bu hücreler çoğalırlar ve yutak, gergin, sindirim ve boşaltım sistemleri ve kas ve epitel hücreleri9,10,12de dahil olmak üzere tüm eksik dokular yerine ayırt etmek. Bu kök hücre yenilenme başlatmak biliyoruz iken, biz tam olarak onları tüm bu farklı hücre türleri yerine götürmek moleküler mekanizmaları kavramak değil. Kesin kök hücre yanıt-e doğru çıkarmak tanımlanan yaralama yöntemleri bu karmaşık süreci belirginleştiren yardımcı olabilir.
Yutak beslenmesi için gerekli bir büyük, silindirik tüp ve nöronlar, kas, epitelyal ve salgı hücreleri13,29içerir. Normalde hayvan ventral tarafta bir kese içinde gizli, hayvanın tek vücut yiyecek varlığı algılama üzerine açılış ile uzanır. Seçmeli olarak yutak kesmek için bir kimyasal denilen sodyum azid, yaygın olarak kullanılan bir anestezi C. elegans14,15,16planarians emmek. Planarians kullanımı ilk Adler ve arktarafından bildirildi., 201412. Sodyum azid maruz dakikada planarians onların pharynges bükün ve nazik ajitasyon ile yutak hayvandan ayırır. Biz bu yutak tam ve seçici kaybına yol "kimyasal amputasyon" bakın. Bir hafta sonra amputasyon, tamamen işlevsel bir yutak geri yüklenen12olur. Yutak beslenmesi için gerekli olduğundan, fonksiyonel rejenerasyon beslenme davranışı izleyerek ölçülebilir. Aşağıda, protokolü için kimyasal amputasyon ve yutak yenileme ve restorasyon davranış beslenme değerlendirmek açıklar.
Protokol
1. hazırlık
-
Planarialar su hazırlanması 17
- Planarians 1 X Montjuïc tuz solüsyonu içinde korumak. Planarian su hazırlamak için bireysel hisse senedi 1 M CaCl2, 1 M MgSO4, 1 M MgCl2, 1 M KCl ve çözümleri ultrasaf su içinde 5 M NaCl olun. Filtre-0.2 µm şişe-üst filterfor uzun süreli depolama ile sterilize.
Not: Montjuïc tuzları hazırlamak için sadece ultrasaf deiyonize su (bir direnci 18,2 MΩ 25 ° c) kullanın. - 5 X tuz solüsyonu 1 L stokunun hazırlamak için 1 M CaCl2, 1 M MgSO4, MgCl2, 0.5 mL KCl ve 5 M NaCl çözümleri 900 mL ultrasaf su 1.6 mL 0.5 mL 5 mL 5 mL birleştirir. Bu çözüm için NaHCO3 0,504 g ekleyin ve karışımı ilave edin. PH hidroklorik asit ile 7.0 için ayarlayın.
- Bu 5 X 1 X çalışma konsantrasyonu ultrasaf su geniş kapasite damacana gibi steril bir kap içinde hisse senedi çözüm seyreltik ( Tablo reçetesigörmek). Bu 1 X çözüm eşeysiz planarians korumak için kullanın.
Not: Montjuïc tuz solüsyonu alternatif, yerel olarak satın alınan kaynak suyu veya ultrasaf su piyasada akvaryum tuz içeren kullanın (bkz. Tablo malzeme) bir konsantrasyon of0.5 g/L18karıştırın. - Statik kültür19bakteriyel enfeksiyonu önlemek için bir antibiyotik içeren suda planarians korumak. 50 mg/mL stok çözüm gentamisin sülfat ultrasaf su hazırlamak ve filtre sterilize. Nerede hayvanlar korunur kaplarına gentamisin sülfat 50 µg/mL (1: 1000 seyreltme) son bir konsantrasyon için ekleyin.
- Planarians 1 X Montjuïc tuz solüsyonu içinde korumak. Planarian su hazırlamak için bireysel hisse senedi 1 M CaCl2, 1 M MgSO4, 1 M MgCl2, 1 M KCl ve çözümleri ultrasaf su içinde 5 M NaCl olun. Filtre-0.2 µm şişe-üst filterfor uzun süreli depolama ile sterilize.
-
Karaciğer Yapıştır hazırlanması
- Planarians organik bir diyete gelişmek gibi çim beslenen sığır eti karaciğer, satın alma taze karaciğer ve işlemi 24 h içinde kaldırmak yavaşça soyulmuştu tarafından karaciğer Kapsüllenen zar kapsül. Karaciğer ~ 1 cm küpler halinde kesilmiş ve kapalı kazımak ve tüm hepatik damarları ve arterler atmak için bir bıçak kullanın.
- Karaciğer adet gıda fabrikası veya mutfak robotu kullanarak macerate ve sonra bir tel kafes gıda süzgeç aracılığıyla geçer. Hamur işi çanta birleştirmek ve şırınga veya 35 mm Petri yemekler dağıtmak. Besleme önce yavaşça hava kabarcıkları kaldırmak için santrifüj kapasitesi.
- Aliquots karaciğer için-80 ° c en çok bir yıl ve kullanmadan önce tezcan saklayın. Çözdürme sonra artık herhangi bir karaciğer bir kez yeniden dondurma veya en fazla 24 saat için 4 ° C'de depolayın.
-
Hayvan bakım
- Planarians büyüyecek ve çeşitli boyutlarda bağlı olarak besleme frekans daraltmak. Planarians her hafta (14 günde bir kez) besleme. Uzun vadeli toplu kültürler, irili ufaklı ( Tablo malzemelerigörmek) plastik kaplar kullanın.
- Hayvanları beslemek için bir metal spatula veya plastik transfer damlalıklı bir kutu içinde bir bezelye büyüklüğünde damla karaciğer eklemenizi sağlar. Hayvanlar kutusunu temizlemeden önce 1-2 h. Kaldır kalan yemek yemek izin.
- Beslenen değilse temiz worms (besleme hemen sonra bir kez ve bir kez iki gün sonra) beslenen Eğer haftada iki kez veya haftada bir kez. Temizlemek için bir plastik kabı dikkatle planarians kutusunda koruyarak suyu dökerek su tahliye. Kutusunu yüzey kağıt havlu ile silin, sonra kutunun temiz olana her tarafta tekrarlayın.
- Su (yaklaşık ¾ kutusu birimi için) eski yerine koymak ve gentamisin 50 µg/mL nihai bir konsantrasyon için ekleyin. Hayvanlar karanlık bir dolap ya da 20 ° C kuluçka saklayın.
-
Solucanlar yelpazesi
- 5-7 gün önceden beslenen edildi solucanlar seçin.
Not: Bu pharynges son zamanlarda (1-2 gün kala amputasyon) beslenen solucanlar dan kesmek önemli ölçüde daha zordur. Beslenen hayvanlar da sodyum azid için daha duyarlıdır. - Aşağı yukarı 6 mm uzunluğunda olan solucanlar seçin. Solucan boyutunu tahmin etmek için bir plastik transfer pipet kullanarak bir Petri kabına aktarın. Düz 6 - inç cetvel veya 5 x 5 mm grafik kağıdı altında Petri kabına yerleştirin ve o tarar iken solucan uzunluğu ölçmek.
Not: Solucanlar uzunluğu 6 mm daha küçük kesmek daha zordur.
- 5-7 gün önceden beslenen edildi solucanlar seçin.
-
Sodyum azid hazırlanması
- Sodyum azid toz planarialar suda çözülerek 100 mM çözüm hazırlamak.
Uyarı: Sodyum azid toksik ve dikkatle ele alınmalıdır. Sodyum azid boşa atmayın. Aşağıdaki kullanmak, bunları ayrı ayrı olarak tehlikeli atık bertarafı için toplar.
- Sodyum azid toz planarialar suda çözülerek 100 mM çözüm hazırlamak.
2. yutak amputasyon
- Yer bir 35-mm çap Petri kabına solucanlar. Dikkatle tüm planarian su yemek plastik transfer damlalıklı kullanarak kaldırın.
Not: En fazla 20 6 mm solucanlar konforlu bu büyüklükte bir tabak içinde yerleştirilebilir. - Mikroskop altında tabak yerleştirin ve birden fazla kurt-ebilmek var olmak görüş aynı anda büyütme ayarlayın (örneğin 10 X büyütme). Planarian su 100 mM sodyum azid çözüm ile değiştirin.
Not: Bir 35-mm Petri için yaklaşık 5 mL sodyum azid de yeterlidir. Çözüm tamamen planarians daldırın. Çözüm cilt daha büyük yemekler için gerektiği gibi ayarlayın. - Mikroskop ve yemek için ilk 3-4 dk taşıma kaçının altında hayvanlar izlemek.
- Yutak ekstrüzyon ile mikroskop gözlemlemek; yutak faringeal kese çıkıntı ve tam olarak uzatmak (yaklaşık 1 mm uzunluğunda) şekil 1Badımında gösterildiği gibi.
Not: Yutak tamamen devam etmeden önce uzanan işlemini tamamlayana kadar bekleyin önemlidir. Bir kez yutak hayvandan ortaya çıkıyor, tam çekiş kabaca 1 dk alır. - Bir plastik transfer damlalıklı hayvanlar çanak çevresinde bücür için kullanın. Hayvanlar damlalıklı emmek ve birkaç kez amacına zorla bırakın. Yutak tamamen uzun, bu güçlü pipetting ayırmak için neden olur.
- Alternatif olarak, yutak, uzunluğu boyunca dikey veya yatay olarak iyi forseps ( Tablo malzemelerigörmek) bir çift kullanarak onun çevresi boyunca şekil 1 ciçinde gösterildiği gibi kavramak. Forseps sıkışmak yutak ile hayvan Menisküs yukarı doğru kaldırın. Hayvan ortaya çıkar, yüzey gerilimi hayvandan ayırmak yutak sebep olacaktır.
Not: Bu yöntem, nerede güçlü dönen yeterli değil daha küçük hayvanlar (1-3 mm uzunluğunda) pharynges kaldırmak için kullanılabilir. Alay ya da başka türlü hayvan bedeni yaralanmasına kaçının. - Bir aktarım damlalıklı kullanarak, uzvunu hayvanlar taze planarialar su içeren yeni bir tabak için taşıyın.
- Bir kez transfer, durulama iyice planarialar su tamamen üç kere su alışverişi, hayvanlarda kesilmiş. Planarialar su 50µg/mL gentamisin ile içeren yeni bir tabak aktarın.
Not: Tam arabellek değişimi bu üç yıkama sırasında sodyum azid kaldırılmasını sağlamak için önemlidir. - Ertesi gün, çanak suda gentamisin 50 µg/mL içeren taze planarialar su ile değiştirin. Bundan sonra her gün tekrarlayın.
3. yutak kaldırıldıktan sonra amputasyon değerlendirilmesi
- Şekil 2Agösterildiği gibi karanlık bir nokta yutak, başarılı kaldırıldıktan sonra ortaya çıkmıştır olup olmadığını belirlemek için hayvanlar (10-20 X büyütme ile) mikroskop altında incelemek.
- Alternatif olarak, tamir ve hayvanlar Pearson ve ark. tarafından açıklanan protokolüne göre çamaşır suyu 20. emmek hayvan gecede 4', 6-diamidino-2-phenylindole (DAPI) veya fluorescently Birleşik streptavidin (1 mg/mL sulandırılmış 1:500 1 X %0,3 içeren fosfat Buffered Saline Triton-X). Hayvanlar % 80 glycerol/20% 1 X fosfat Buffered serum ve floresan stereomicroscope (şekil 2B) altında görüntü içindeki slaytları bağlama.
Not: Tüm görüntüleri bu el yazması bir floresan stereomicroscope 1.0 X amacı ile ele geçirildi.
4. yutak rejenerasyon davranış besleme ölçme tarafından değerlendirilmesi
-
Karaciğer hazırlanması
- Karaciğer hamur gerekli miktar bir microcentrifuge veya konik tüp aktarın. Kısaca hava kabarcıkları kaldırmak için spin. Karaciğer hacmi tahmin ve sonra 1/5 hacminin ve kırmızı gıda boyası toplam hacminin % 2 planarialar su ekleyin. Örneğin, 1000 µL karaciğer yapıştırın, 200 µL planarialar su ve gıda renklendirme 24 µL ekleyin.
- Gıda renklendirme eşit olarak karaciğer Yapıştır dağıtılır kadar iyice karıştırın bir plastik havaneli, pipet ucu veya metal spatula kullanarak. Tekrar kısaca spin. Karaciğer Yapıştır 24 h için 4 ° C'de depolanan veya uzun süreli depolama için-80 ° C'de aliquots donup kalan ev.
- En çok 25 hayvanlar sınama olumlu sonuçlanırsa, 25 µL çanak (yaklaşık 1 µL hayvan başına karaciğer hamur) başı karaciğer hamur hazırlayın.
-
Hayvan besleme
- Yedi gün sonra kimyasal amputasyon, hayvanlar için yeni Petri kabına aktarın. 10-15 hayvan sınama olumlu sonuçlanırsa, bir 35 mm tabak kullanın; 15'den fazla hayvan-meli var olmak sınav 60 mm kabında. Hayvanlar, besleme önce yaklaşık 1 h için bozulmamış anlatmamanı.
- Makas kullanarak, kabaca ½ cm uzakta-in dar ucuna çıkararak P200 pipet ucu genişliğini artırın. Damlalıklı 25 µL çanak içine kırmızı karaciğer yapıştırın.
Not: Son kırpma viskoz karaciğer Yapıştır daha kolay pipetting sağlar. Karaciğer yüzeyinde yüzen önlemek için dağıtımı sırasında ucuna çanak dibine kadar dokunma. - Hayvanlar için 30 dk beslemek izin.
- Hayvanlar beyaz bir arka plan üzerine yerleştirerek veya onları 10-20 X büyütme ile mikroskop altında incelenmesi tarafından yemiş hayvan sayısı puanı.
- Besleme sonra karaciğer yemek çıkarın ve temizleyin.
Sonuçlar
Sodyum azid maruz planarians, esneme ve kıvranmak hayvanlar neden normal hareketliliğini bozar. Bu hareketler yutak hayvan ventral taraftan çıkmaya zorlamak ve sodyum azid çözümünde yaklaşık 6 dakika sonra-ebilmek var olmak seen yutak beyaz ucu (şekil 1B-sol kapı aynası). Birkaç dakika sonra hayvanlar aktif olarak sözleşme ve tamamen yutak zorla vücut dışına iterek genişletir. (Şekil 1B-orta Masası). Yaklaşık 11 dk azid maruz kaldıktan sonra hayvanlar ve yutak rahatlayın. Bu aşamada, yutak karakteristik çan şeklinde açıkça görülmeye başlıyor (şekil 1B-doğru kapı aynası). Kolay amputasyon için yutak dinlenmek beklemek önemlidir.
Yutak bir büyük olduğundan, uzvunu hayvanlar (şekil 2A)sırt tarafında karanlık bir hale kaldırmadan dokusunun unpigmented yığın sonuçlanır. Bu karanlık bölge Canlı hayvanlarda başarılı amputasyon görsel bir göstergesidir. Spot hemen amputasyon sonra görülebilir ve ertesi gün daha belirgin hale gelir. Yutak yeniden oluşturur gibi bu bölge aydınlatır. Yutak rejenerasyon daha doğrusu izlemek için hayvanlar DAPI veya fluorescently Birleşik streptavidin Boyanabilen (şekil 2B)bir gecede. Kantitatif yutak rejenerasyon ölçüde değerlendirmek için kendi alan ImageJ yazılımı kullanılarak ölçülebilir.
Yutak chemosensation ve yemek yenmesi için önemli bir organdır. Bu işlevler yeniden oluşturma işlemi sırasında geri yüklenir olduğunda belirlemek için biz besleme deneyleri hayvan davranışları izlemek için kullanılır. Karaciğer salça ile boyama gıda birleştirerek, biz yiyen hayvanlar değil (şekil 3A)yapan insanlardan ayırt etmek başardık. Biz o zaman işlevsel bir yutak hayvanlarla yüzdesi değerlendirmek için kırmızı hayvan sayısı sayılabilir. Şekil 3B' gösterilen sonuçlara dayanarak, 7 gün sonra amputasyon, bir hafta sonra yutak kaldırma, işlevsel bir yutak hayvanlar yeniden gösteren başarılı beslenme davranışı geri yüklendi. Sodyum azid pozlama beslenme davranışı etkilenen olup olmadığını sınamak için hayvanlar sodyum azid batırılmış ama hemen yutak fırlatma önce onu yıkadım. Gıda-arama davranışı sodyum azid pozlama ile besleme tahlil tarafından değiştirilmiş olup olmadığını bir gün sonra biz değerlendirildi. Sodyum azid pozlama yedikten sonra sağlam bir yutak istinat tüm hayvanların bir yutak eksik kimyasal olarak kesilmiş hayvanların aksine (n = 30 hayvanlar her koşul için) gıda. Yutak sağlam olduğu sürece bu sonuç sodyum azid pozlama beslenme davranışı, etkilemez gösterir.

Resim 1 . Yutak fırlatma ve amputasyonu. (A) şeması planarian anatomi. (B) görüntülerini canlı hayvan yutak fırlatma 100 mM sodyum azid iliklerine üzerine gösterilen. Kırmızı oklar yutak vurgulayın. Ölçek çubukları 750 µm. (C) = görüntü canlı hayvan (solda) ve forseps kullanarak amputasyon şeması (sağda). Panelleri yutak sürükleyici iki farklı seçeneklerini göster. Hayvan ventral tarafı yukarı dönük. Ölçek çubukları 500 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
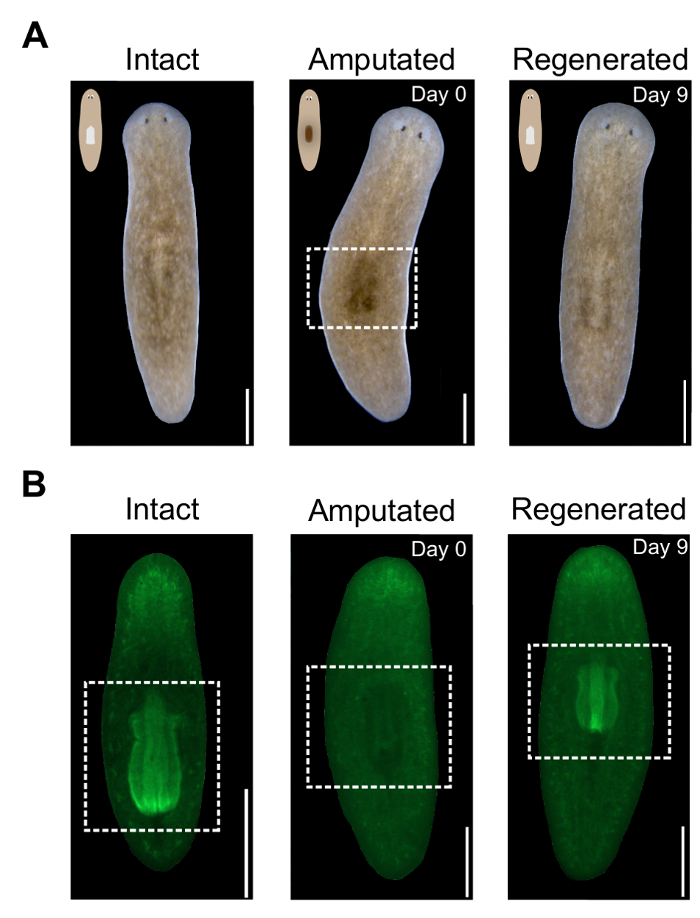
Resim 2 . Yutak amputasyon ve rejenerasyon değerlendirilmesi. (A) temsilcisi canlı hayvan görüntülerini belirtilen kez önce ve sonra kesilmiş. Orta paneli karanlık nokta kesik çizgili beyaz kutu tarafından vurgulanan amputasyon sonra faringeal bölgede gösterir. Sırt tarafı yukarı dönük. Ölçek çubukları = 500 µm. (B) temsilcisi görüntüleri ile Alexa488-streptavidin lekeli hayvanlar belirtilen kez önce ve sonra kesilmiş. Orta paneli yutak yokluğu amputasyon sonra gösterir. Faringeal bölge tarafından beyaz kutu vurgulanır. Ventral tarafı yukarı dönük. Ölçek çubuğu 500 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
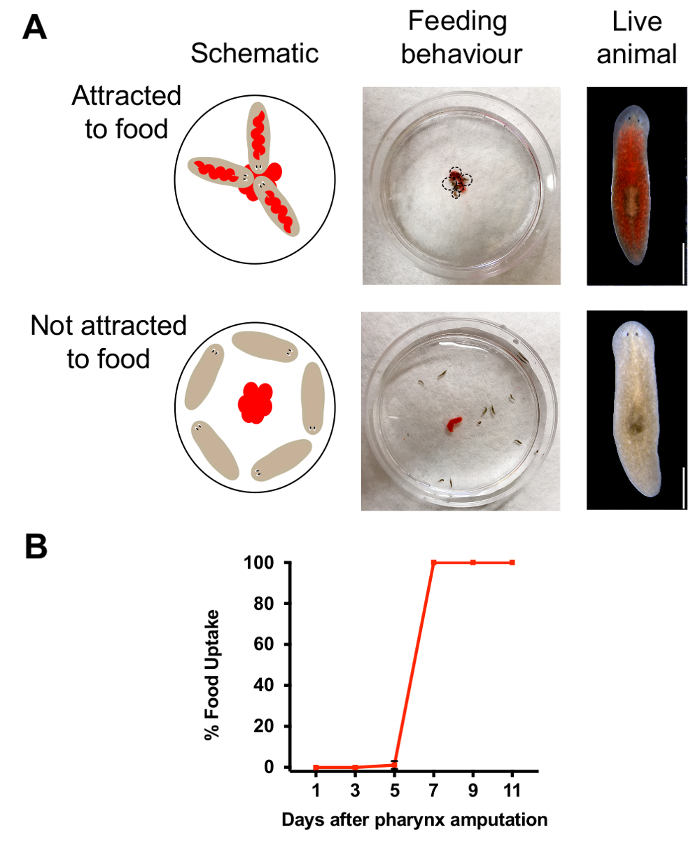
Şekil 3. Yutak rejenerasyon değerlendirilmesi. (A) görüntüleri ve şematik 60 mm Petri kabına merkezinde 25 µl karaciğer yerleştirerek yapılan tahlil, beslenme. Şematik (sol üst) ve resim (orta) show davranış hayvanlarda olduğu gibi pharynges ile besleme. Yemiş hayvan üst hakkı, görüntü. Şematik (sol alt) ve davranış 1 gün sonra amputasyon hayvanlarda beslenme görüntü (orta). Alt sağ, hayvan değil yemiş. Ölçek çubuğu 750 = µm. tahlil sonuçlarını besleme (B) . (Kırmızı rengi tarafından sayısal) gıda amputasyon sonra belirli zamanlarda yutulur hayvanlar yüzdesi. N her zaman noktası için 10 hayvan, nüsha tekrarlanan =. Hata çubuğu SD = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Bu iletişim kuralı sodyum azid kullanarak yutak seçici ablasyon yöntemi açıklar. Planarians diğer hedeflenen ablasyon çalışmaları değiştirilmiş ameliyat photoreceptors21 veya farmakolojik tedavi dopaminerjik nöron22ablate kaldırmak için kullandık. Bir önemli mevcut yöntemler üzerinde kimyasal amputasyon cerrahisi gerektirmez avantajdır. Planarian vücut diğerleri ile karşılaştırıldığında farklıdır yutak katı yapısını çok daha yumuşak gövdeli hayvan onun tümüyle kaldırılmasını kolaylaştırır. Ayrıca, yutak ve daha tekrarlanabilir bir yara birden daha büyük bir cerrahi alet tarafından indüklenen üreten bağırsak katıldığınız bir küçük Kavşağı (yemek borusu)30 hayvan yutak ayırır. Fiziksel özellikleri ve hayvan geri kalanı için küçük anatomik bağlantı göre yutak kaldırma bu nedenle diğer cerrahi amputasyon daha daha homojen yaralar oluşturur.
Sodyum azid maruz uzunluğunu da bu teknik başarısı için önemlidir. Ne kadar kısa maruz kalma sodyum azid planarians olumsuz etkilemez, uzun süre maruz toksik ve sonunda hayvanlar öldürür. Sodyum azid sitokrom oksidaz23,24inhibisyonu yoluyla enerji bağımlı işlemler inhibe olduğu bilinmektedir. Buna ek olarak, transkripsiyon ve translasyon, büyük olasılıkla bu tepkiler stres granül25anahtar bileşenleri birikimi tarafından bastırır. Planarians, sodyum azid pozlama mitoz 24 saat sonra hücrelerin proliferasyonu12devam için bastırır. Azid pozlama zaman sınırlandırılması, deneysel tasarım azid ayrıntılı durulama ve muhasebe geçici Mitotik bastırılması için kaldırma yardımcı olabilir gibi değişiklikler bu sınırlamalarının üstesinden gelir.
Yutak ve onun karakteristik Radyal simetri benzersiz anatomik konumunu önceden varolan kök hücrelerden yeni rejenere faringeal doku kolay düzeye çıkarılmasını sağlar. Yutak rejenerasyon, doku lekeleri streptavidin ve DAPI, immünhistokimya, gibi veya in situ hibridizasyon26tarafından kullanarak hücresel ve anatomik düzeyde izlenebilir. Açıklanan besleme tahlil burada yutak fonksiyonel rejenerasyon deneyleri. Yutak27,28 kemotaksisi doğru gıda gerektirir ve hayvanlar olmadan tamamen işlevsel bir yutak yemek yemek yapamam. Bu basit, kantitatif değerlendirmesi organ fonksiyon bu nedenle yapısal yeniden oluşturma işlemi tamamlar. Ayrıca, kimyasal amputasyon hayvanların nüfus üzerinde gerçekleştirilen ve aynı yaralanma ile çok sayıda hayvan oluşturabilir. Bu nedenle büyük ölçekli çalışmaları için uygun bir yöntemdir. Olgun bir yutak rejenerasyon, kök hücre gerektirir gerçeği ile birleştiğinde bu avantajları, yutak amputasyon organ yenilenme eğitim için ideal bir model yapar. Daha geniş kesimleri ile birlikte kullanıldığında, yutak kaldırma nasıl yara boyutu ve anatomik pozisyon anahtar meselesi rejenerasyon alanı21yaralanma kök hücre yanıtı etkisi hakkında hipotezler test etmek için kullanılabilir.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Alejandro Sánchez Alvarado, ilk iyileştirme ve geliştirme bu tekniğin desteklenen teşekkür etmek istiyorum. Carolyn Adler'in laboratuvar çalışmalarında Cornell Üniversitesi başlangıç fonlar tarafından desteklenir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Chemical | C79-3 | Montjuïc salt solution |
| Magnesium Sulfate Anhydrous (MgSO4) | Fisher Chemical | M65-3 | Montjuïc salt solution |
| Magnesium Chloride Hexahydrate (MgCl2) | Acros/VWR | 41341-5000 | Montjuïc salt solution |
| Potassium Chloride (KCl) | Acros Organics/VWR | 196770010 | Montjuïc salt solution |
| Sodium Chloride (NaCl) | Acros Organics/VWR | 207790050 | Montjuïc salt solution |
| Sodium Bicarbonate (NaHCO3) | Acros Organics/VWR | 123360010 | Montjuïc salt solution |
| Nalgene autoclavable polypropylene copolymer lowboy with spigot | ThermoFisher Scientific/VWR | 2324-0015 | Storing planaria water |
| Instant Ocean Sea Salt | Spectrum Brands | Amazon | Planaria water |
| Gentamicin Sulfate | Gemini Bio-products | 400-100P | Planaria water |
| Razor blades | Electron Microscopy Sciences | 71970 | Mincing liver |
| Disposable pastry bags-16”, 12 pack | Wilton | Amazon | Liver aliquots |
| 5 mL syringes | BD/VWR | 309647 | Liver aliquots |
| Petri dishes-35mm/60mm | Greiner Bio-One/VWR | 82050-536/82050-544 | |
| Plastic containers (various sizes) | Ziploc | Amazon | Housing planarians in static culture |
| Sodium Azide | Sigma | S2002 | |
| Transfer pipette | Globe Scientific | 138030 | |
| Forceps - Dumont Tweezer, Style 5 | Electron Microscopy Sciences | 72700-D (0203-5-PO) | |
| Triton X-100 | Sigma | T8787 | |
| DAPI | ThermoFisher | 62247 | |
| Streptavidin, Alexa Fluor 488 conjugate | ThermoFisher | S11223 | |
| Glycerol | Fisher BioReagents | BP229-1 |
Referanslar
- Tanaka, E. M., Reddien, P. W. The cellular basis for animal regeneration. Dev. Cell. 21, 172-185 (2011).
- Tanaka, E. M. The Molecular and Cellular Choreography of Appendage Regeneration. Cell. 165, 1598-1608 (2016).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat. Protoc. 3, 948-954 (2008).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62, 232-240 (2013).
- Smith-Bolton, R. K., Worley, M. I., Kanda, H., Hariharan, I. K. Regenerative growth in Drosophila imaginal discs is regulated by Wingless and Myc. Dev. Cell. 16, 797-809 (2009).
- Smith-Bolton, R. Drosophila Imaginal Discs as a Model of Epithelial Wound Repair and Regeneration. Adv. Wound Care. 5, 251-261 (2016).
- Newmark, P. A., Sánchez Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat. Rev. Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez Alvarado, A. Fundamentals of planarian regeneration. Annu. Rev. Cell Dev. Biol. 20, 725-757 (2004).
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Scimone, M. L., Kravarik, K. M., Lapan, S. W., Reddien, P. W. Neoblast specialization in regeneration of the planarian Schmidtea mediterranea. Stem Cell Reports. 3, 339-352 (2014).
- van Wolfswinkel, J. C., Wagner, D. E., Reddien, P. W. Single-cell analysis reveals functionally distinct classes within the planarian stem cell compartment. Cell Stem Cell. 15, 326-339 (2014).
- Adler, C. E., Seidel, C. W., McKinney, S. A., Sánchez Alvarado, A. Selective amputation of the pharynx identifies a FoxA-dependent regeneration program in planaria. Elife. 3, e02238 (2014).
- Adler, C. E., Sánchez Alvarado, A. PHRED-1 is a divergent neurexin-1 homolog that organizes muscle fibers and patterns organs during regeneration. Dev. Biol. 427, 165-175 (2017).
- Wong, M. C., Martynovsky, M., Schwarzbauer, J. E. Analysis of cell migration using Caenorhabditis elegans as a model system. Methods Mol. Biol. 769, 233-247 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C elegans chemotaxis assay. J. Vis. Exp. , e50069 (2013).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177 (2012).
- Tasaki, J., Uchiyama-Tasaki, C., Rouhana, L. Analysis of Stem Cell Motility In Vivo Based on Immunodetection of Planarian Neoblasts and Tracing of BrdU-Labeled Cells After Partial Irradiation. Methods Mol. Biol. 1365, 323-338 (2016).
- Roberts-Galbraith, R. H., Brubacher, J. L., Newmark, P. A. A functional genomics screen in planarians reveals regulators of whole-brain regeneration. Elife. 5, (2016).
- Arnold, C. P., et al. Pathogenic shifts in endogenous microbiota impede tissue regeneration via distinct activation of TAK1/MKK/p38. Elife. 5, (2016).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- LoCascio, S. A., Lapan, S. W., Reddien, P. W. Eye Absence Does Not Regulate Planarian Stem Cells during Eye Regeneration. Dev. Cell. 40, 381-391 (2017).
- Nishimura, K., et al. Regeneration of dopaminergic neurons after 6-hydroxydopamine-induced lesion in planarian brain. J. Neurochem. 119, 1217-1231 (2011).
- Wilson, D. F., Chance, B. Azide inhibition of mitochondrial electron transport. I. The aerobic steady state of succinate oxidation. Biochim. Biophys. Acta. 131, 421-430 (1967).
- Duncan, H. M., Mackler, B. Electron Transport Systems of Yeast: III. Preparation and properties of cytochrome oxidase. J. Biol. Chem. 241, 1694-1697 (1966).
- Buchan, J. R., Yoon, J. H., Parker, R. Stress-specific composition, assembly and kinetics of stress granules in Saccharomyces cerevisiae. J. Cell Sci. 124, 228-239 (2011).
- Cebrià, F. Organization of the nervous system in the model planarian Schmidtea mediterranea: An immunocytochemical study. Neurosci. Res. 61, 375-384 (2008).
- Shimoyama, S., Inoue, T., Kashima, M., Agata, K. Multiple Neuropeptide-Coding Genes Involved in Planarian Pharynx Extension. Zoolog. Sci. 33, 311-319 (2016).
- Ito, H., Saito, Y., Watanabe, K., Orii, H. Epimorphic regeneration of the distal part of the planarian pharynx. Dev. Genes Evol. 211, 2-9 (2001).
- Bueno, D., Espinosa, L., Baguñà, J., Romero, R. Planarian pharynx regeneration in tail fragments monitored with cell-specific monoclonal antibodies. Dev. Genes Evol. 206, 425-434 (1997).
- Hyman, L. . The invertebrates: Platyhelminthes and Rhynchocoela, the acoelomate Bilateria. , (1951).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır