Method Article
Química amputação e regeneração da faringe nos Turbellaria mediterranea Schmidtea
Neste Artigo
Resumo
A Turbellaria mediterranea Schmidtea é um excelente modelo para o estudo de células-tronco e regeneração de tecidos. Esta publicação descreve um método para remover seletivamente um órgão, a faringe, expondo os animais para a química de azida sódica. Este protocolo também descreve métodos para monitorar a regeneração da faringe.
Resumo
Boca é platelmintos que são extremamente eficientes em regeneração. Eles devem esta capacidade a um grande número de células-tronco que podem responder rapidamente a qualquer tipo de lesão. Modelos de lesões comuns nestes animais remover grandes quantidades de tecido, que danifica a vários órgãos. Para superar este dano de tecido largo, descrevemos aqui um método para remover seletivamente um único órgão, a faringe, na Turbellaria Schmidtea mediterranea. Conseguimos isso por animais de imersão em uma solução contendo o citocromo oxidase inibidor de azida sódica. Breve exposição a azida de sódio provoca extrusão da faringe do animal, que chamamos de "amputação química." Amputação química remove a faringe inteira e gera uma pequena ferida onde a faringe anexa para o intestino. Após enxaguar extensa, todos os animais amputados regeneram uma faringe totalmente funcional em cerca de uma semana. Células-tronco no resto do corpo conduzir a regeneração da faringe nova. Aqui, nós fornecemos um detalhado protocolo para amputação de química e descrever métodos histológicos e comportamentais para avaliar o sucesso amputação e regeneração.
Introdução
Regeneração é um fenômeno que ocorre em todo o reino animal, com capacidades regenerativas de regeneração de corpo inteiro em certos invertebrados para habilidades mais restritas em vertebrados1. Substituição de tecidos funcionais é um processo complexo e muitas vezes implica a restauração simultânea de vários tipos de células. Por exemplo regenerar o membro salamandra, osteoblastos, condrócitos, neurônios, músculos e células epiteliais precisa ser substituído2. Estes tipos de células recém-gerado também precisam ser organizado corretamente, para facilitar a nova função de membro. Compreensão destes processos complexos requer técnicas que se concentram na regeneração de tipos específicos de células e a sua integração em órgãos.
Uma das estratégias empregadas para simplificar o estudo das respostas regenerativas é a ablação alvo de certos tipos de célula ou maiores coleções de tecidos. Por exemplo, no zebrafish, expressão de nitroreductase em tipos específicos de células leva à sua destruição após a aplicação de metronidazol3,4. Em larvas de Drosophila , expressar genes pro-apoptotic sob promotores tecido-específica pode seletivamente ablate regiões específicas do disco imaginária5,6. Ambas estas estratégias causam dano rápido mas controlado e têm sido usadas para dissecar os mecanismos moleculares e celulares responsáveis pela regeneração.
Este manuscrito, descrevemos um método para ablate seletivamente um órgão inteiro chamado faringe na Turbellaria Schmidtea mediterranea. Boca é um modelo clássico de regeneração, conhecido por sua capacidade regenerativa prolífica, onde fragmentos mesmo minutos podem regenerar toda animais 7,8. Eles têm uma população grande e heterogênea de células-tronco que consiste de células pluripotentes e restrita a linhagem progenitores9,10,11. Estas células proliferam e se diferenciam para substituir todos os tecidos desaparecidos, incluindo a faringe, sistemas nervosos, digestivos e excretoras e músculo e células epiteliais9,10,12. Enquanto nós sabemos que essas células-tronco iniciar a regeneração, podemos não compreender plenamente os mecanismos moleculares que conduzi-los para substituir todos esses diferentes tipos de células. Definidos métodos ferindo que eliciam respostas precisas células-tronco podem ajudar a delinear este complexo processo.
A faringe é um tubo cilíndrico, grande necessário para a alimentação e contém neurônios, músculos, células epiteliais e secretora13,29. Normalmente escondidos em uma bolsa no lado ventral do animal, que se estende através do único corpo do animal, abrindo em cima sentindo a presença de alimentos. Para seletivamente amputar a faringe, nós mergulhe a boca em uma químico chamado azida sódica, uma anestesia comumente usada em c. elegans14,15,16. Seu uso na boca foi primeiramente relatado por Adler et al., em 2014,12. Em poucos minutos de exposição a azida de sódio, boca extrude seus pharynges, e com agitação suave, faringe desconecta-se do animal. Nos referimos a esta perda completa e seletiva da faringe como "química amputação". Uma semana após a amputação, uma faringe totalmente funcional é restaurado12. Porque a faringe é necessária para a alimentação, regeneração funcional pode ser medida pelo monitoramento do comportamento alimentar. Abaixo, descrevemos o protocolo para amputação de química e para avaliar a regeneração da faringe e restauração do comportamento alimentar.
Protocolo
1. preparação
-
Preparação da água de planária 17
- Manter a boca em uma solução de sal de X Montjuïc 1. Para preparar Turbellaria água, certifique-se soluções de ações individuais de 1 M CaCl2, 1m MgSO4, 1 M MgCl2, 1m KCl e 5 M NaCl em água ultrapura. Filtro-esterilizar com um armazenamento de longo prazo de garrafa-top filterfor de 0,2 µm.
Nota: Use apenas água desionizada ultrapura (com uma resistividade de 18,2 MΩ a 25 ° C) para preparar Montjuïc sais. - Para preparar um estoque de 1 L de solução de sal de 5 X, combinam-se 5 mL de 1 M CaCl2, 5ml de 1 M MgSO4, 0,5 mL de MgCl2, 0,5 mL de KCl e 1,6 mL das soluções de NaCl 5m em 900 mL de água ultrapura. Para esta solução, adicionar 0,504 g de NaHCO3 e mexa para misturar. Ajuste o pH a 7,0 com ácido clorídrico.
- Diluir esta 5 X solução estoque para um 1 X concentração de trabalho em água ultrapura em recipiente estéril como um garrafão de grande capacidade (veja a Tabela de materiais). Use esta solução X 1 para manter a boca assexuada.
Nota: Como uma alternativa para a solução de sal de Montjuïc, usar água de nascente-comprado localmente ou água ultrapura, contendo um sal de aquário comercialmente disponíveis (ver Tabela de materiais) se misturam em uma of0.5 de concentração g/L18. - Para prevenir a infecção bacteriana em cultura estática19, manter a boca em água contendo um antibiótico. Preparar um 50 mg/mL de solução de sulfato de gentamicina em água ultrapura e filtro-esterilizar. Para recipientes onde os animais são mantidos, adicione sulfato de gentamicina a uma concentração final de 50 µ g/mL (diluição 1: 1000).
- Manter a boca em uma solução de sal de X Montjuïc 1. Para preparar Turbellaria água, certifique-se soluções de ações individuais de 1 M CaCl2, 1m MgSO4, 1 M MgCl2, 1m KCl e 5 M NaCl em água ultrapura. Filtro-esterilizar com um armazenamento de longo prazo de garrafa-top filterfor de 0,2 µm.
-
Preparação de pasta de fígado
- Como boca prosperar em uma dieta de orgânicos, fígado, carne grass-fed compra fígado fresco e processo no prazo de 24 h. remover a cápsula membranosa, encapsulando o fígado por descascá-la suavemente. Corte o fígado em cubos de ~ 1 cm e usar uma lâmina para raspar e descartar todas as artérias e veias hepáticas.
- Macerar pedaços de fígado usando uma fábrica de alimentos ou um processador de alimentos e passá-lo através de um filtro de comida de malha de arame. Combinar em sacos de pastelaria e dispense em seringas ou 35mm placas de Petri. Antes da alimentação, centrifugue suavemente para remover as bolhas de ar.
- Loja alíquotas do fígado a-80 ° C por até um ano e descongelar antes de usar. Após o descongelamento, re-congelar qualquer sobra fígado uma vez, ou armazenar a 4 ° C por até 24 h.
-
Manutenção de animais
- Boca vai crescer e encolher de vários tamanhos, dependendo da frequência de alimentação. Alimente a boca toda semana (uma vez a cada 14 dias). Para culturas de massa a longo prazo, use recipientes de plástico de vários tamanhos (ver Tabela de materiais).
- Para alimentar os animais, use uma espátula de metal ou pipeta de transferência plástica para colocar uma gota do tamanho de ervilha de fígado em uma caixa. Permitir que os animais comer por 1-2 h remover alimentos restantes antes de limpar a caixa.
- Limpar os vermes duas vezes por semana se alimentado (uma vez diretamente após a alimentação e uma vez dois dias depois), ou uma vez por semana se não for alimentado. Para limpar, drene a água para um copo de plástico derramando cuidadosamente para fora da água, mantendo a boca na caixa. Limpe a superfície da caixa com uma toalha de papel e, em seguida, repita por todos os lados, até que a caixa está limpa.
- Água (aproximadamente ¾ do volume de caixa) e adicionar gentamicina para uma concentração final de 50 µ g/mL. Loja de animais em um armário escuro ou numa incubadora de 20 ° C.
-
Seleção de vermes
- Selecione os vermes que foram alimentados com 5-7 dias anteriores.
Nota: É significativamente mais difícil que amputar pharynges de vermes que foram alimentados recentemente (1-2 dias antes da amputação). Animais alimentados também são mais sensíveis a azida de sódio. - Selecione os vermes que são aproximadamente 6 mm de comprimento. Para estimar o tamanho do worm, transferi-lo para uma placa de Petri com uma pipeta de transferência plástica. Coloque uma régua plana 6 - em ou papel milimetrado de 5 x 5 mm por baixo da placa de Petri e medir o comprimento de verme, enquanto que rastreia.
Nota: Vermes, menores que 6 mm de comprimento são mais difíceis de amputar.
- Selecione os vermes que foram alimentados com 5-7 dias anteriores.
-
Preparação de azida de sódio
- Prepare uma solução de 100 mM, dissolvendo o pó de azida de sódio em água de planária.
Atenção: Azida de sódio é tóxica e deve ser manuseada com cuidado. Não descarte a azida de sódio no ralo. Após a utilização, coletá-lo separadamente para disposição como resíduos perigosos.
- Prepare uma solução de 100 mM, dissolvendo o pó de azida de sódio em água de planária.
2. faringe amputação
- Lugar de vermes em um diâmetro de 35 mm placa de Petri. Retire toda água Turbellaria do prato usando uma pipeta de transferência plástica.
Nota: Um máximo de 20 6mm vermes pode ser confortavelmente acomodado em um prato deste tamanho. - Coloque o prato no microscópio e ajustar a ampliação para que vários vermes podem ser visualizados simultaneamente (por exemplo, 10 ampliação de X). Substitua a água Turbellaria com solução de azida de sódio de 100 mM.
Nota: Para um prato de Petri de 35 mm, aproximadamente 5 mL de azida de sódio é suficiente. A solução completamente deve submergir a boca. Ajuste o volume da solução para pratos maiores, se necessário. - Monitore os animais sob o microscópio e abster-se de mover o prato para o primeiro 3-4 min.
- Observar a extrusão da faringe através do microscópio; a faringe vai sobressair da bolsa faríngea e estender totalmente (cerca de 1 mm de comprimento) como mostrado na figura 1B.
Nota: É importante esperar até a faringe terminou estendendo completamente antes de prosseguir ainda mais. Uma vez que a faringe emerge o animal, extensão completa leva cerca de 1 min. - Use uma pipeta de transferência plástico para esguichar animais ao redor do prato. Sugar os animais para a pipeta e forçosamente liberá-los para o prato duas vezes. Se a faringe é totalmente estendida, este vigoroso pipetagem fará com que a desanexar.
- Como alternativa, segure a faringe verticalmente ao longo de seu comprimento, ou horizontalmente ao longo de sua circunferência usando um par de pinças bem (ver Tabela de materiais) como mostrado na Figura 1. Com a faringe comprimida no fórceps, levante o animal para cima em direção do menisco. Como o animal é criado, tensão superficial fará com que a faringe desanexar do animal.
Nota: Esse método pode ser usado para remover os pharynges de animais menores (1-3 mm de comprimento) onde a agitação vigorosa não é adequada. Evite picar ou caso contrário ferir o corpo do animal. - Usando uma pipeta de transferência, mova animais amputados para um novo prato contendo água fresca planária.
- Uma vez transferido, enxágue amputadas animais completamente em água planária, completamente trocando a água três vezes. Transfira para um prato novo contendo água planaria com 50µg/mL de gentamicina.
Nota: Troca de amortecedor completo durante estes três lavagens é essencial para assegurar a remoção de azida de sódio. - No dia seguinte, substitua a água no prato com água fresca planária contendo 50 µ g/mL de gentamicina. Repetir todos os dias depois disso.
3. avaliação da remoção da faringe após amputação
- Examine os animais sob um microscópio (com ampliação de 10-20 X) para determinar se uma mancha escura apareceu após a remoção bem sucedida da faringe, como mostrado na Figura 2A.
- Alternativamente, corrigir e branquear os animais de acordo com o protocolo descrito por Pearson et al 20. animais de molho durante a noite em 4, 6-diamidino-2-phenylindole (DAPI) ou estreptavidina conjugado fluorescente (1: 500 1 mg/mL diluído em 1 X solução salina de tampão fosfato contendo 0,3% Triton-X). Monte animais em slides em 80% glycerol/20% 1 X fosfato Buffered Saline e imagem sob um microscópio fluorescente (Figura 2B).
Nota: Todas as imagens neste manuscrito foram capturadas em um microscópio fluorescente com um objetivo X 1,0.
4. avaliação da regeneração da faringe, medindo o comportamento alimentar
-
Preparação do fígado
- Transferi a quantidade necessária de pasta de fígado para uma microcentrifuga ou tubo cônico. Gire rapidamente para remover as bolhas de ar. Estimar o volume do fígado e em seguida, adicione água planária para 1/5 do seu volume e 2% do volume total de corante alimentício vermelho. Por exemplo, a 1000 µ l do fígado colar, adicionar 200 µ l de água planária e 24 µ l de corante alimentar.
- Usando um pilão de plástico, a ponta da pipeta ou espátula de metal, misture bem até o corante alimentício é uniformemente distribuída na pasta de fígado. Rotação de novo brevemente. Pasta de fígado pode ser armazenada a 4 ° C por 24 horas ou congelada em alíquotas a-80 ° C para armazenamento a longo prazo.
- Se testando até 25 animais, prepare 25 µ l de pasta de fígado por prato (aproximadamente 1 µ l de pasta de fígado por animal).
-
Alimentação de animais
- Sete dias após amputação química, transferi os animais para uma nova placa de Petri. Se o teste de 10-15 animais, use um prato de 35mm; mais de 15 animais devem ser testados em uma placa de Petri 60mm. Manter os animais no escuro, imperturbável, por aproximadamente 1h antes da alimentação.
- Usando a tesoura, aumente a largura da ponta da pipeta P200 por aparar aproximadamente ½ cm fora a extremidade estreita. Pipetar 25 µ l de pasta de fígado vermelha no prato.
Nota: Aparar o fim faz pipetagem a pasta de fígado viscosa mais fácil. Para impedir que o fígado flutuando na superfície, toca a ponta para o fundo do prato durante o fornecimento. - Permitir que os animais se alimente durante 30 min.
- Marca o número de animais que tenham comido por colocar os animais em um fundo branco ou sob um microscópio com ampliação de 10-20 X.
- Após a alimentação, retire o prato de fígado e limpar.
Resultados
Exposição a azida de sódio interrompe a motilidade normal da boca, fazendo com que os animais se esticar e se contorciam. Estes movimentos forçar a faringe que emergem do lado ventral do animal, e após aproximadamente 6 min em solução de azida de sódio, a ponta branca da faringe pode ser vista (figura 1B-painel esquerdo). Poucos minutos depois, os animais ativamente contraem e estendem totalmente a faringe, empurrando-o com força fora do corpo. (Fig. 1B-painel médio). Aproximadamente 11 min após a exposição de azida, os animais e a faringe relaxa. Nesta fase, a forma de sino característico da faringe é claramente visível (figura 1B-painel direito). Para amputação fácil, é importante esperar a faringe relaxar.
Porque a faringe é um grande, unpigmented massa de tecido, removê-lo resulta no aparecimento de uma mancha escura no lado dorsal dos animais amputados (Figura 2A). Essa região escura é um indicador visual de sucesso amputação em animais vivos. O local é visível imediatamente após a amputação e torna-se mais proeminente no dia seguinte. Como a faringe regenera, clareia nesta região. Para monitorar a regeneração da faringe mais precisamente, os animais podem ser manchados com DAPI ou estreptavidina conjugado fluorescente durante a noite (Figura 2B). Para avaliar quantitativamente a extensão da regeneração da faringe, sua área pode ser medida usando software ImageJ.
A faringe é um órgão essencial para a ingestão de alimentos e chemosensation. Para determinar quando essas funções são restauradas durante a regeneração, usamos alimentação ensaios para monitorar o comportamento animal. Combinando alimentos de coloração com pasta de fígado, fomos capazes de distinguir animais que comeram de aqueles que fizeram não (Figura 3A). Nós então quantificado o número de animais vermelhos para avaliar a percentagem de animais com uma funcional da faringe. Baseia-se os resultados mostrados na Figura 3B, comportamento alimentar bem sucedido foi restaurado 7 dias depois da amputação, indicando que uma semana após a remoção da faringe, os animais têm regenerado uma funcional da faringe. Para testar se a exposição de azida de sódio afetou o comportamento alimentar, embebido de animais em azida de sódio, mas lavado para fora imediatamente antes da ejeção da faringe. Um dia depois, avaliaram-se o comportamento de busca de alimentos foi alterado pela exposição de azida de sódio com o ensaio de alimentação. Em contraste com animais quimicamente amputado, faltando uma faringe, todos os animais, mantendo uma faringe intacta após exposição de azida de sódio comeu (n = 30 animais para cada condição) a comida. Este resultado indica que exposição de azida de sódio não afeta o comportamento alimentar, enquanto a faringe permanece intacta.

Figura 1 . Ejeção de faringe e amputação. (A) diagrama esquemático da anatomia Turbellaria. (B) imagens de animais vivos, mostrando a ejeção de faringe mediante imersão em azida sódica 100 mM. Setas vermelhas destacam a faringe. Escala de barras = 750 µm. (C) imagem de animal vivo (à esquerda) e a planta (à direita) de amputação usando fórceps. Painéis mostram duas opções diferentes para a preensão da faringe. Lado ventral do animal virado para. Escala de barras = 500 µm. clique aqui para ver uma versão maior desta figura.
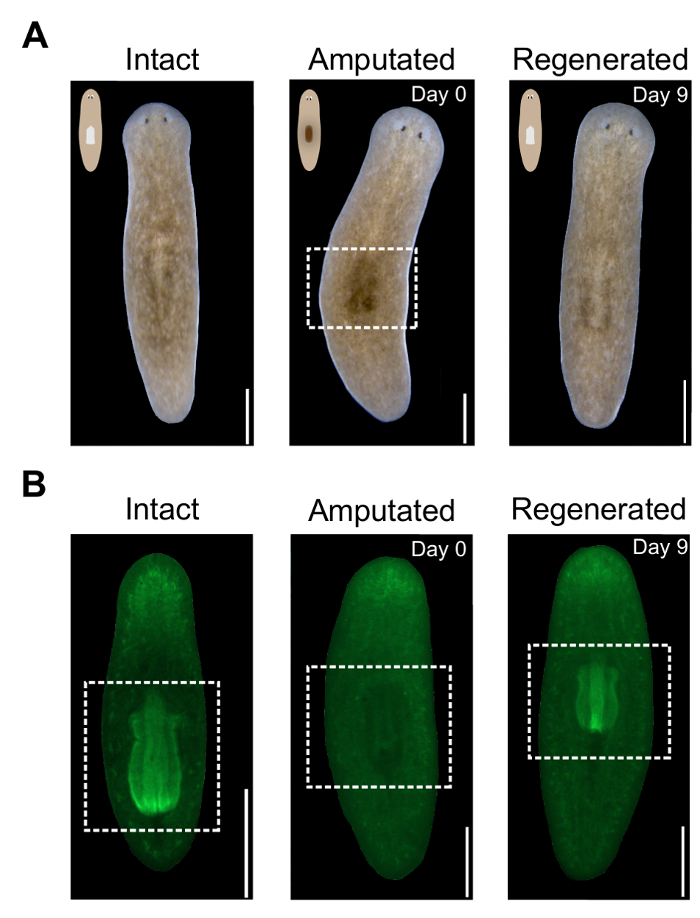
Figura 2 . Avaliação da amputação da faringe e regeneração. (A) imagens representativas de animais vivos no especificado vezes antes e depois da amputação. Painel médio mostra mancha escura na região faríngea após amputação, destacada por caixa branca tracejada. Lado dorsal virado para. Escala de barras = 500 imagens representativas µm. (B) de animais manchados com Alexa488-estreptavidina no especificado vezes antes e depois da amputação. Painel médio mostra ausência da faringe após amputação. Região faríngea, destacado por caixa branca. Lado ventral virado para. Barra de escala = 500 µm. clique aqui para ver uma versão maior desta figura.
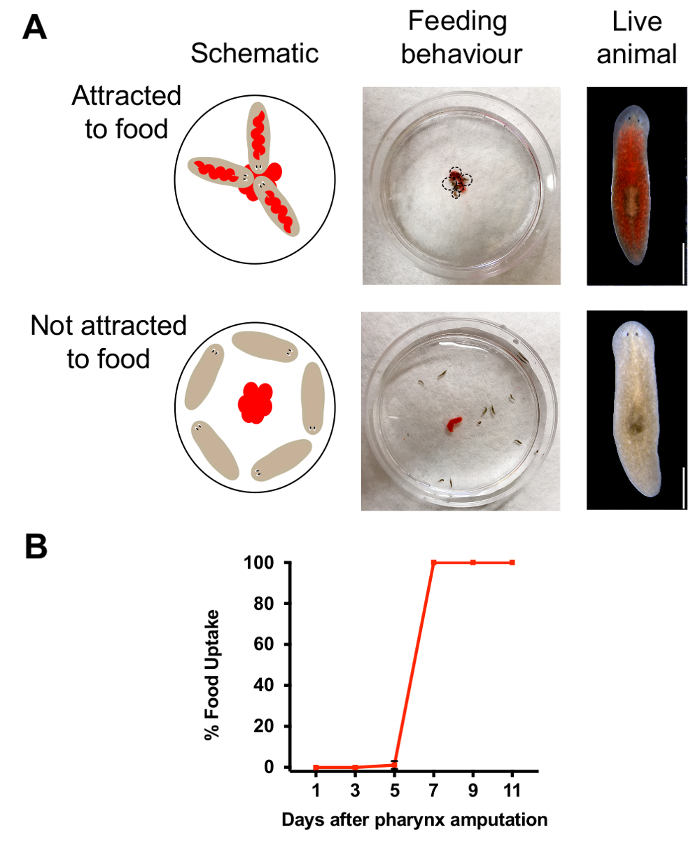
Figura 3. Avaliação da regeneração da faringe. (A) imagens e esquema de alimentação do ensaio, realizado pela colocação de 25 µ l de fígado no centro de um prato de Petri de 60 mm. Diagrama esquemático (superior, esquerda) e imagem (médio) mostram comportamento alimentar em animais com pharynges intactos. Superior direita, imagem de animal que tem comido. Diagrama esquemático (inferior esquerdo) e imagem (médio) do comportamento alimentar em animais 1 dia após a amputação. Parte inferior direito, animal que não tem comido. Barra de escala = 750 µm. (B) resultados da alimentação do ensaio. Percentagem de animais que ingeriram alimentos (quantificado pela coloração vermelha) em alturas específicas após amputação. Para cada ponto de tempo, n = 10 animais, repetidos em triplicado. Barra de erro = SD. clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve um método da ablação seletiva da faringe usando a azida de sódio. Outros estudos de ablação alvejado na boca têm usado modificada cirurgia para remover fotorreceptores21 ou tratamento farmacológico para ablação de neurônios dopaminérgicos22. Uma vantagem significativa de amputação química sobre os métodos existentes é que não requer cirurgia. A estrutura rígida da faringe em comparação com o resto do corpo Turbellaria facilita a sua remoção completa do animal, que é muito mais macio-bodied. Além disso, a faringe desconecta-se do animal em uma pequena junção (esôfago)30 juntar-se a faringe e o intestino, gerando uma ferida mais reprodutível do que um induzido por um instrumento cirúrgico maior. Com base em suas propriedades físicas e pequena articulação anatômica para o resto do animal, remoção da faringe, portanto, gera feridas mais homogéneas do que outras amputações cirúrgicas.
Comprimento de exposição a azida de sódio é também fundamental para o sucesso desta técnica. Embora breve exposição a azida de sódio não afeta negativamente a boca, a exposição prolongada é tóxica e eventualmente vai matar animais. Azida de sódio é conhecida por inibir processos dependentes de energia através da inibição da citocromo oxidase23,24. Além disso, que suprime a transcrição e tradução, provavelmente pelo acúmulo de componentes-chave destas reações no estresse grânulos25. Na boca, exposição de azida de sódio suprime mitose durante 24 h, após o qual células retomar a proliferação12. Modificações, tais como limitar o tempo de exposição de azida, removendo azida com enxaguamento completo e contabilidade para a supressão transitória mitótica em delineamento experimental pode ajudar a superar essas limitações.
A única posição anatômica da faringe e sua simetria radial característica permitem a fácil distinção de tecido da faringe recém regenerada pré-existentes das pilhas de haste. Regeneração da faringe pode ser monitorada a nível celular e anatômicas usando manchas de tecido como streptavidin e DAPI, imuno-histoquímica, ou por em situ da hibridação26. O ensaio de alimentação descrito aqui ensaios de regeneração funcional da faringe. Quimiotaxia para alimentar requer a faringe27,28 e animais sem uma faringe totalmente funcional não podem ingerir alimentos. Esta avaliação simples, quantitativa da função do órgão, portanto, complementa regeneração estrutural. Além disso, química amputação pode ser executada em populações de animais e pode gerar inúmeros animais com lesões idênticas. O procedimento é, portanto, conveniente para estudos em grande escala. Estas vantagens, juntamente com o fato de que a regeneração de uma faringe madura requer células-tronco, faz amputação faringe um modelo ideal para estudar a regeneração do órgão. Usado em combinação com amputações mais amplas, remoção da faringe pode ser usada para testar hipóteses sobre como o tamanho da ferida e posição anatômica afetam a resposta de células-tronco a lesão, o que é uma questão chave na regeneração campo21.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer a Alejandro Sánchez Alvarado, que apoiaram a otimização inicial e desenvolvimento desta técnica. Trabalho no laboratório de Carolyn Adler é suportado por fundos de start-up da Universidade de Cornell.
Materiais
| Name | Company | Catalog Number | Comments |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Chemical | C79-3 | Montjuïc salt solution |
| Magnesium Sulfate Anhydrous (MgSO4) | Fisher Chemical | M65-3 | Montjuïc salt solution |
| Magnesium Chloride Hexahydrate (MgCl2) | Acros/VWR | 41341-5000 | Montjuïc salt solution |
| Potassium Chloride (KCl) | Acros Organics/VWR | 196770010 | Montjuïc salt solution |
| Sodium Chloride (NaCl) | Acros Organics/VWR | 207790050 | Montjuïc salt solution |
| Sodium Bicarbonate (NaHCO3) | Acros Organics/VWR | 123360010 | Montjuïc salt solution |
| Nalgene autoclavable polypropylene copolymer lowboy with spigot | ThermoFisher Scientific/VWR | 2324-0015 | Storing planaria water |
| Instant Ocean Sea Salt | Spectrum Brands | Amazon | Planaria water |
| Gentamicin Sulfate | Gemini Bio-products | 400-100P | Planaria water |
| Razor blades | Electron Microscopy Sciences | 71970 | Mincing liver |
| Disposable pastry bags-16”, 12 pack | Wilton | Amazon | Liver aliquots |
| 5 mL syringes | BD/VWR | 309647 | Liver aliquots |
| Petri dishes-35mm/60mm | Greiner Bio-One/VWR | 82050-536/82050-544 | |
| Plastic containers (various sizes) | Ziploc | Amazon | Housing planarians in static culture |
| Sodium Azide | Sigma | S2002 | |
| Transfer pipette | Globe Scientific | 138030 | |
| Forceps - Dumont Tweezer, Style 5 | Electron Microscopy Sciences | 72700-D (0203-5-PO) | |
| Triton X-100 | Sigma | T8787 | |
| DAPI | ThermoFisher | 62247 | |
| Streptavidin, Alexa Fluor 488 conjugate | ThermoFisher | S11223 | |
| Glycerol | Fisher BioReagents | BP229-1 |
Referências
- Tanaka, E. M., Reddien, P. W. The cellular basis for animal regeneration. Dev. Cell. 21, 172-185 (2011).
- Tanaka, E. M. The Molecular and Cellular Choreography of Appendage Regeneration. Cell. 165, 1598-1608 (2016).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat. Protoc. 3, 948-954 (2008).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62, 232-240 (2013).
- Smith-Bolton, R. K., Worley, M. I., Kanda, H., Hariharan, I. K. Regenerative growth in Drosophila imaginal discs is regulated by Wingless and Myc. Dev. Cell. 16, 797-809 (2009).
- Smith-Bolton, R. Drosophila Imaginal Discs as a Model of Epithelial Wound Repair and Regeneration. Adv. Wound Care. 5, 251-261 (2016).
- Newmark, P. A., Sánchez Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat. Rev. Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez Alvarado, A. Fundamentals of planarian regeneration. Annu. Rev. Cell Dev. Biol. 20, 725-757 (2004).
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Scimone, M. L., Kravarik, K. M., Lapan, S. W., Reddien, P. W. Neoblast specialization in regeneration of the planarian Schmidtea mediterranea. Stem Cell Reports. 3, 339-352 (2014).
- van Wolfswinkel, J. C., Wagner, D. E., Reddien, P. W. Single-cell analysis reveals functionally distinct classes within the planarian stem cell compartment. Cell Stem Cell. 15, 326-339 (2014).
- Adler, C. E., Seidel, C. W., McKinney, S. A., Sánchez Alvarado, A. Selective amputation of the pharynx identifies a FoxA-dependent regeneration program in planaria. Elife. 3, e02238 (2014).
- Adler, C. E., Sánchez Alvarado, A. PHRED-1 is a divergent neurexin-1 homolog that organizes muscle fibers and patterns organs during regeneration. Dev. Biol. 427, 165-175 (2017).
- Wong, M. C., Martynovsky, M., Schwarzbauer, J. E. Analysis of cell migration using Caenorhabditis elegans as a model system. Methods Mol. Biol. 769, 233-247 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C elegans chemotaxis assay. J. Vis. Exp. , e50069 (2013).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177 (2012).
- Tasaki, J., Uchiyama-Tasaki, C., Rouhana, L. Analysis of Stem Cell Motility In Vivo Based on Immunodetection of Planarian Neoblasts and Tracing of BrdU-Labeled Cells After Partial Irradiation. Methods Mol. Biol. 1365, 323-338 (2016).
- Roberts-Galbraith, R. H., Brubacher, J. L., Newmark, P. A. A functional genomics screen in planarians reveals regulators of whole-brain regeneration. Elife. 5, (2016).
- Arnold, C. P., et al. Pathogenic shifts in endogenous microbiota impede tissue regeneration via distinct activation of TAK1/MKK/p38. Elife. 5, (2016).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- LoCascio, S. A., Lapan, S. W., Reddien, P. W. Eye Absence Does Not Regulate Planarian Stem Cells during Eye Regeneration. Dev. Cell. 40, 381-391 (2017).
- Nishimura, K., et al. Regeneration of dopaminergic neurons after 6-hydroxydopamine-induced lesion in planarian brain. J. Neurochem. 119, 1217-1231 (2011).
- Wilson, D. F., Chance, B. Azide inhibition of mitochondrial electron transport. I. The aerobic steady state of succinate oxidation. Biochim. Biophys. Acta. 131, 421-430 (1967).
- Duncan, H. M., Mackler, B. Electron Transport Systems of Yeast: III. Preparation and properties of cytochrome oxidase. J. Biol. Chem. 241, 1694-1697 (1966).
- Buchan, J. R., Yoon, J. H., Parker, R. Stress-specific composition, assembly and kinetics of stress granules in Saccharomyces cerevisiae. J. Cell Sci. 124, 228-239 (2011).
- Cebrià, F. Organization of the nervous system in the model planarian Schmidtea mediterranea: An immunocytochemical study. Neurosci. Res. 61, 375-384 (2008).
- Shimoyama, S., Inoue, T., Kashima, M., Agata, K. Multiple Neuropeptide-Coding Genes Involved in Planarian Pharynx Extension. Zoolog. Sci. 33, 311-319 (2016).
- Ito, H., Saito, Y., Watanabe, K., Orii, H. Epimorphic regeneration of the distal part of the planarian pharynx. Dev. Genes Evol. 211, 2-9 (2001).
- Bueno, D., Espinosa, L., Baguñà, J., Romero, R. Planarian pharynx regeneration in tail fragments monitored with cell-specific monoclonal antibodies. Dev. Genes Evol. 206, 425-434 (1997).
- Hyman, L. . The invertebrates: Platyhelminthes and Rhynchocoela, the acoelomate Bilateria. , (1951).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados