Method Article
Amputation chimique et la régénération du Pharynx dans le planaire Schmidtea mediterranea
Dans cet article
Résumé
La planaire Schmidtea mediterranea est un excellent modèle pour l’étude des cellules souches et la régénération des tissus. Cette publication décrit une méthode pour éliminer sélectivement un organe, le pharynx, en exposant les animaux à l’azoture de sodium chimique. Ce protocole décrit également les méthodes de suivi de la régénération du pharynx.
Résumé
Platyhelminthes sont vers plats qui sont extrêmement efficaces à la régénération. Ils doivent cette capacité à un grand nombre de cellules souches qui peuvent répondre rapidement à tout type de blessure. Modèles de lésion commune chez ces animaux retirer de grandes quantités de tissus, qui endommage plusieurs organes. Pour surmonter ces dommages de tissu large, nous décrivons ici une méthode pour supprimer sélectivement un organe unique, le pharynx, dans le planaire Schmidtea mediterranea. Nous y parviendrons par des animaux trempage dans une solution contenant de l’azide de sodium inhibiteur du cytochrome oxydase. Une exposition brève à l’azoture de sodium provoque extrusion du pharynx de l’animal, que nous appelons « amputation chimique. » Amputation chimique supprime le pharynx entier et génère une petite plaie où le pharynx s’attache à l’intestin. Après le rinçage approfondie, amputé de tous les animaux régénèrent un pharynx entièrement fonctionnel dans environ une semaine. Régénération du pharynx nouvelle en voiture des cellules souches dans le reste du corps. Ici, nous fournissons un détaillé protocole d’amputation chimique et décrire les méthodes histologiques et comportementales pour évaluer l’amputation réussie et la régénération.
Introduction
La régénération est un phénomène qui se produit dans tout le règne animal, avec une capacité régénératrice de régénération du corps entier à certains invertébrés aux capacités plus restreintes dans les vertébrés1. Remplacement des tissus fonctionnels est un processus complexe et implique souvent la restauration simultanée de plusieurs types de cellules. Par exemple, pour régénérer la branche salamandre, ostéoblastes, chondrocytes, neurones, muscles et les cellules épithéliales doivent être remplacé2. Ces types de cellules nouvellement généré doivent également s’organiser correctement pour faciliter la nouvelle fonction membre. Compréhension de ces processus complexes nécessite des techniques qui mettent l’accent sur la régénération des types spécifiques de cellules et de leur intégration dans les organes.
Une des stratégies employées pour simplifier l’étude des réponses régénératrices est l’ablation ciblée soit certains types de cellules ou plus grandes collections de tissus. Par exemple, chez le poisson zèbre, expression de la nitroréductase dans les types spécifiques de cellules conduit à leur destruction après application du métronidazole3,4. Chez les larves de drosophile , exprimant des gènes pro-apoptotiques sous tissu-spécifiques promoteurs peut sélectivement l’ablation des régions spécifiques du disque imaginal5,6. Deux de ces stratégies endommager rapide mais maîtrisé et ont servi à décortiquer les mécanismes moléculaires et cellulaires responsables de la régénération.
Dans ce manuscrit, nous décrivons une méthode pour enlever sélectivement un organe entier appelé le pharynx dans le planaire Schmidtea mediterranea. Platyhelminthes sont un modèle classique de la régénération, connue pour leur capacité régénératrice prolifique, où même infimes fragments peuvent repousser toute animaux 7,8. Ils ont une grande population hétérogène de cellules souches composée de cellules pluripotentes et lignée restreints progéniteurs9,10,11. Ces cellules prolifèrent et se différencient pour remplacer tous les tissus manquants, y compris le pharynx, les systèmes nerveux, digestifs et excréteurs et les muscle et les cellules épithéliales9,10,12. Alors que nous savons que ces cellules souches lancer régénération, nous ne comprenons pas complètement les mécanismes moléculaires qui chasser pour remplacer tous ces différents types de cellules. Méthodes blessantes définies qui déclenchent des réponses précises des cellules souches peuvent aider à délimiter ce processus complexe.
Le pharynx est un gros tube cylindrique requis pour l’alimentation et contient des neurones, les muscle, les cellules épithéliales et sécrétoire13,29. Normalement caché dans une poche sur la face ventrale de l’animal, il s’étend à travers l’unique corps de l’animal, ouvrant sur la détection de la présence de nourriture. Pour sélectivement amputer le pharynx, nous tremper Platyhelminthes dans un azoture de sodium appelé chimique un anesthésique couramment utilisé dans c. elegans14,15,16. Son utilisation en Australie a été signalée par Adler et al., en 2014,12. Quelques minutes d’exposition à l’azoture de sodium, Platyhelminthes extruder leur déjà, et en agitant doucement, le pharynx se détache de l’animal. Nous appelons cette perte complète et sélective du pharynx « amputation chimique ». Une semaine après l’amputation, un pharynx entièrement fonctionnel est restaurée12. Parce que le pharynx est nécessaire pour l’alimentation, régénération fonctionnelle peut être mesurée en surveillant le comportement alimentaire. Ci-dessous, nous décrivons le protocole d’amputation chimique et pour l’évaluation de la régénération du pharynx et la restauration du comportement alimentaire.
Protocole
1. préparation
-
Préparation de l’eau planaria 17
- Maintenir les Platyhelminthes dans une solution de sel de X Montjuïc 1. Pour préparer planaire eau, faire des solutions mères de 1 M CaCl2, 1 M MgSO4, 1 M MgCl2, KCl 1 M et 5 M de NaCl dans l’eau ultrapure. Filtre-stériliser avec un stockage à long terme de filterfor flacon de 0,2 µm.
Remarque : Utiliser uniquement l’eau déionisée ultrapure (avec une résistivité de 18,2 MΩ à 25 ° C) pour préparer les sels de Montjuïc. - Pour préparer un stock de 1 L de solution de sel de 5 X, mélanger 5 mL de 1 M CaCl2, 5 mL de 1 M MgSO4, 0,5 mL de MgCl2, 0,5 mL de KCl et 1,6 mL de 5 M des solutions de NaCl dans 900 mL d’eau ultrapure. Pour cette solution, ajouter 0,504 g de NaHCO3 et pour mélanger. Ajuster le pH à 7.0 avec l’acide chlorhydrique.
- Diluer ce 5 X solution mère à un 1 X travail de concentration dans l’eau ultrapure dans un contenant stérile comme une tourie de grande capacité (voir la Table des matières). Utilisez cette solution de X 1 pour maintenir les Platyhelminthes asexuées.
Remarque : Comme alternative à la solution de sel de Montjuïc, utiliser l’eau de source achetés localement ou eau ultrapure contenant aquarium disponible dans le commerce du sel mélanger (voir Table des matières) à une concentration de of0.5 g/L18. - Pour éviter une infection bactérienne dans la culture statique19, maintenir Platyhelminthes dans l’eau contenant un antibiotique. Préparer un 50 mg/mL de solution de sulfate de gentamicine dans de l’eau ultrapure et filtre-stériliser. Aux conteneurs où les animaux est entretenus, ajouter le sulfate de gentamicine à une concentration finale de 50 µg/mL (dilution 1 : 1000).
- Maintenir les Platyhelminthes dans une solution de sel de X Montjuïc 1. Pour préparer planaire eau, faire des solutions mères de 1 M CaCl2, 1 M MgSO4, 1 M MgCl2, KCl 1 M et 5 M de NaCl dans l’eau ultrapure. Filtre-stériliser avec un stockage à long terme de filterfor flacon de 0,2 µm.
-
Préparation de la purée de foie
- Platyhelminthes prospèrent sur une diète de bio, boeuf nourri à l’herbe du foie, foie frais d’achat et processus au sein de 24 h. Retirer la capsule membraneuse encapsulant le foie en décollant doucement. Couper le foie en cubes de 1 cm et utiliser une lame pour gratter et jeter toutes les artères et veines hépatiques.
- Faire macérer les morceaux de foie à l’aide d’un moulin ou un robot culinaire et ensuite passer à travers une passoire à filet alimentaire. Combiner dans des sacs de pâtisserie et répartir dans des seringues ou des plats de Pétri de 35 mm. Avant repas, centrifuger doucement pour enlever les bulles d’air.
- Stocker les aliquotes de foie à-80 ° C pendant jusqu'à une année et le dégel avant d’utiliser. Après décongélation, recongeler une fois toute foie reste ou conserver à 4 ° C pendant 24 h.
-
Entretien des animaux
- Platyhelminthes vont se développer et de réduire de différentes tailles selon la fréquence d’alimentation. Nourrir les Platyhelminthes toutes les deux semaines (une fois tous les 14 jours). Pour les cultures à long terme en vrac, utiliser des récipients en plastique de différentes tailles (voir Table des matières).
- Pour nourrir les animaux, utilisez une spatule métallique ou une pipette de transfert en plastique pour mettre une goutte de noisette de foie dans une boîte. Permettre aux animaux de manger pendant 1-2 h. sortir l’aliment restant avant de nettoyer la zone.
- Nettoyer les vers deux fois par semaine si nourris (une fois directement après le repas et une fois deux jours plus tard), ou une fois par semaine si non nourris. Pour nettoyer, évacuer l’eau dans un bécher en plastique soigneusement déversant de l’eau tout en conservant l’Australie dans la zone. Essuyez la surface de la boîte avec du papier absorbant, puis répéter sur tous les côtés jusqu'à ce que la zone est propre.
- Remplacer l’eau (à environ ¾ du volume de la boîte) et ajoute une concentration finale de 50 µg/mL de gentamicine. Ranger les animaux dans une armoire sombre ou dans un incubateur à 20 ° C.
-
Sélection de worms
- Sélectionnez vers qui ont été nourris de 5 à 7 jours avant.
Remarque : Il est beaucoup plus difficile d’amputer déjà des vers qui ont été alimentés ces derniers temps (1 à 2 jours avant l’amputation). Animaux nourris est également plus sensibles à l’azoture de sodium. - Sélectionnez vers qui sont d’environ 6 mm de longueur. Pour estimer la taille du ver, les transférer dans un plat de Pétri à l’aide d’une pipette en plastique. Placez une règle plate 6 po ou papier quadrillé 5 x 5 mm sous la boîte de Pétri et mesurez la longueur de la vis sans fin, alors qu’il se traîne.
Remarque : Vers inférieurs à 6 mm de long sont plus difficiles à entraîner l’amputation.
- Sélectionnez vers qui ont été nourris de 5 à 7 jours avant.
-
Préparation de l’azide de sodium
- Préparer une solution de 100 mM en dissolvant de sodium en poudre dans l’eau planaria azoture.
Mise en garde : L’azoture de sodium est toxique et doit être manipulé avec soin. Ne pas jeter de l’azide de sodium dans les égouts. Après utilisation, ramasser séparément pour l’élimination comme déchets dangereux.
- Préparer une solution de 100 mM en dissolvant de sodium en poudre dans l’eau planaria azoture.
2. pharynx Amputation
- Lieu vers de terre dans un diamètre de 35 mm boîte de Pétri. Retirez soigneusement toute eau planaire de la capsule à l’aide d’une pipette de transfert en plastique.
Remarque : Un maximum de 20 mm 6 vers peut être confortablement logé dans un plat de cette taille. - Placer le plat sous le microscope puis réglez grossissement afin qu’on peut considérer simultanément vers plusieurs (par exemple 10 un grossissement de X). Remplacer l’eau planaire avec solution d’azoture de sodium 100 mM.
Remarque : Pour un plat de Pétri de 35 mm, 5 mL environ d’azoture de sodium est suffisante. La solution devrait submerger complètement Platyhelminthes. Régler le volume de solution pour des plats plus que nécessaire. - Surveiller les animaux sous le microscope et s’abstenir de passer le plat pendant les premières 3-4 min.
- Observer l’extrusion du pharynx au microscope ; le pharynx se dépassent de la poche pharyngée et étendre complètement (environ 1 mm de longueur) comme illustré à la Figure 1 b.
Remarque : Il est important d’attendre que le pharynx a fini d’étendre complètement avant de poursuivre. Une fois que le pharynx se dégage de l’animal, extension complète prend environ 1 min. - Utiliser une pipette de transfert en plastique pour gicler des animaux partout dans le plat. Aspirer les animaux dans la pipette et de les libérer par la force dans le plat une couple de fois. Si le pharynx est étirée, ce vigoureux pipetage provoquera à détacher.
- Vous pouvez également saisir le pharynx verticalement le long de sa longueur, ou horizontalement le long de sa circonférence à l’aide d’une paire de pinces fines (voir Table des matières) comme illustré à la Figure 1. Avec le pharynx pincé dans la pince, soulever l’animal vers le haut, vers le ménisque. L’animal est augmentée, tension superficielle provoque le pharynx de se détacher de l’animal.
Remarque : Cette méthode peut servir pour enlever le déjà de petits animaux (1-3 mm de long) où tourbillonnant énergique n’est pas suffisant. Évitez de piquer ou autrement blessant le corps de l’animal. - À l’aide d’une pipette de transfert, déplacement d’animaux amputé d’un mets nouveau contenant de l’eau fraîche planaria.
- Une fois transférées, rinçage amputé animaux soigneusement dans l’eau planaria, complètement d’eau trois fois. Transfert à une autre boite contenant de l’eau planaria 50µg/ml de gentamicine.
Remarque : Change de tampon complète au cours de ces trois lavages est essentielle pour garantir l’élimination de l’azide de sodium. - Le lendemain, remplacer l’eau dans le plat avec de l’eau fraîche planaria contenant 50 µg/mL de gentamicine. Répéter tous les deux jours par la suite.
3. évaluation de Pharynx enlèvement après Amputation
- Examiner les animaux sous un microscope (avec un grossissement de X 10-20) pour déterminer si une tache sombre est apparue après suppression réussie du pharynx, comme illustré à la Figure 2 a.
- Vous pouvez également fixer et blanchir les animaux selon le protocole décrit par Pearson et al. 20. animaux de trempage pour la nuit en 4', 6-diamidino-2-phénylindole (DAPI) ou streptavidine conjugué fluorescent (1 mg/mL dilué 1/500 à 1 X Phosphate Buffered Saline contenant 0,3 % Triton-X). Monter les animaux sur des lames en glycerol/20% 80 % 1 X Phosphate Buffered Saline et image sous un stéréomicroscope fluorescent (Figure 2 b).
Remarque : Toutes les images de ce manuscrit ont été capturés sur un stéréomicroscope fluorescent avec un objectif X 1,0.
4. évaluation de la régénération du Pharynx en mesurant le comportement alimentaire
-
Préparation du foie
- Transférer la quantité requise de purée de foie dans une micro-centrifugeuse ou tube à fond conique. Tourner brièvement pour enlever les bulles d’air. Estimation du volume du foie et puis ajoutez l’eau planaria à 1/5 de son volume et 2 % du volume total de colorant alimentaire rouge. Par exemple, à 1000 µL du foie coller, ajouter 200 µL d’eau planaria et 24 µL de colorant alimentaire.
- À l’aide d’un pilon en plastique, la pointe de pipette ou la spatule métallique, bien mélanger jusqu'à ce que le colorant alimentaire est réparti uniformément dans la purée de foie. Tourner à nouveau brièvement. Purée de foie peut être conservée à 4 ° C pendant 24 h ou congelée en aliquotes à-80 ° C pour le stockage à long terme.
- Si les tests jusqu'à 25 animaux, préparer 25 µL de purée de foie par plat (environ 1 µL de purée de foie par animal).
-
Alimentation des animaux
- Sept jours après amputation chimique, transférer les animaux à une nouvelle boîte de Pétri. Si les tests animaux de 10-15, utilisez un plat 35 mm ; plus de 15 animaux devrait être testés dans un plat de Pétri de 60 mm. Garder les animaux dans l’obscurité, non perturbée, pendant environ 1 h avant repas.
- À l’aide de ciseaux, d’augmenter la largeur d’une pointe de pipette P200 en taillant environ ½ cm de l’extrémité la plus étroite. Pipetter 25 µL de rouge de purée de foie dans le plat.
Remarque : Tailler la fin rend pipetage la purée de foie visqueuse plus facile. Pour éviter que le foie flottant à la surface, toucher la pointe vers le bas du plat pendant la distribution. - Que les animaux puissent se nourrir pendant 30 min.
- Marquer le nombre d’animaux qui ont mangé en plaçant les animaux sur fond blanc ou de les examiner au microscope avec un grossissement de X 10-20.
- Après l’alimentation, retirer le plat de foie et nettoyer.
Résultats
Exposition à l’azoture de sodium perturbe la motilité normale des Platyhelminthes, causant des animaux à s’étirer et se tordent. Ces mouvements forcer le pharynx à émerger de la face ventrale de l’animal, et après environ 6 min dans une solution d’azoture de sodium, on peut considérer la pointe blanche du pharynx (Figure 1 b-panneau gauche). Quelques minutes plus tard, les animaux activement sur les contrats et déployez le pharynx en l’enfonçant avec force hors du corps. (Figure 1 b-panneau central). Environ 11 minutes après l’exposition de l’azoture, les animaux et le pharynx se détendent. À ce stade, la forme de cloche caractéristique du pharynx est clairement visible (Figure 1 b-panneau droit). Pour amputation facile, il est important d’attendre le pharynx pour se détendre.
Parce que le pharynx est un grand, non pigmentée masse de tissu, désolidarisé provoque l’apparition d’une tache sombre sur la face dorsale des animaux amputé (Figure 2 a). Cette région obscure est un indicateur visuel de l’amputation réussie dans les animaux vivants. Le spot est visible immédiatement après l’amputation et devient plus important le lendemain. Comme le pharynx se régénère, cette région s’éclaircit. Pour contrôler plus précisément la régénération du pharynx, des animaux peut être coloré avec DAPI ou fluorescent conjugué streptavidine (Figure 2 b)pour la nuit. Pour évaluer de façon quantitative la mesure de la régénération du pharynx, sa superficie peut être mesurée à l’aide de logiciels ImageJ.
Le pharynx est un organe essentiel pour l’ingestion de chémosensation et de la nourriture. Pour déterminer si ces fonctions sont restaurées pendant la régénération, nous avons utilisé des tests alimentation pour surveiller le comportement des animaux. En combinant la nourriture à colorier avec purée de foie, nous avons été en mesure de distinguer les animaux qui ont mangé de ceux qui n’ont pas (Figure 3 a). Ensuite, nous avons quantifié le nombre d’animaux rouge afin d’évaluer le pourcentage d’animaux avec un pharynx fonctionnel. Selon les résultats affichés dans la Figure 3 b, comportement alimentaire réussi a été restauré 7 jours après l’amputation, ce qui indique qu’une semaine après l’enlèvement du pharynx, animaux ont régénéré un pharynx fonctionnel. Pour vérifier si l’exposition de l’azoture de sodium affecté le comportement alimentaire, nous imbibé d’animaux d’azide de sodium mais emportées immédiatement avant l’éjection du pharynx. Le lendemain, nous avons évalué si les comportements de recherche de nourriture a été altéré par l’exposition d’azoture de sodium avec le test de l’alimentation. Contrairement aux animaux chimiquement amputé manque un pharynx, conservant un pharynx intact après exposition d’azide de sodium a mangé tous les animaux (n = 30 animaux pour chaque condition) la nourriture. Ce résultat indique que l’exposition de l’azoture de sodium n’affecte pas le comportement alimentaire, tant que le pharynx reste intact.

Figure 1 . Éjection du pharynx et amputation. (A) schéma d’anatomie planaire. (B) des Images d’animaux vivants, montrant l’éjection du pharynx à tremper dans de l’azide de sodium 100 mM. Flèches rouges font ressortir du pharynx. Barreaux de l’échelle = 750 µm. (C) Image d’animal vivant (à gauche) et le schéma (à droite) de l’amputation avec une pincette. Panneaux montrent deux options différentes pour la préhension du pharynx. La face ventrale de l’animal vers le haut. Barreaux de l’échelle = 500 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
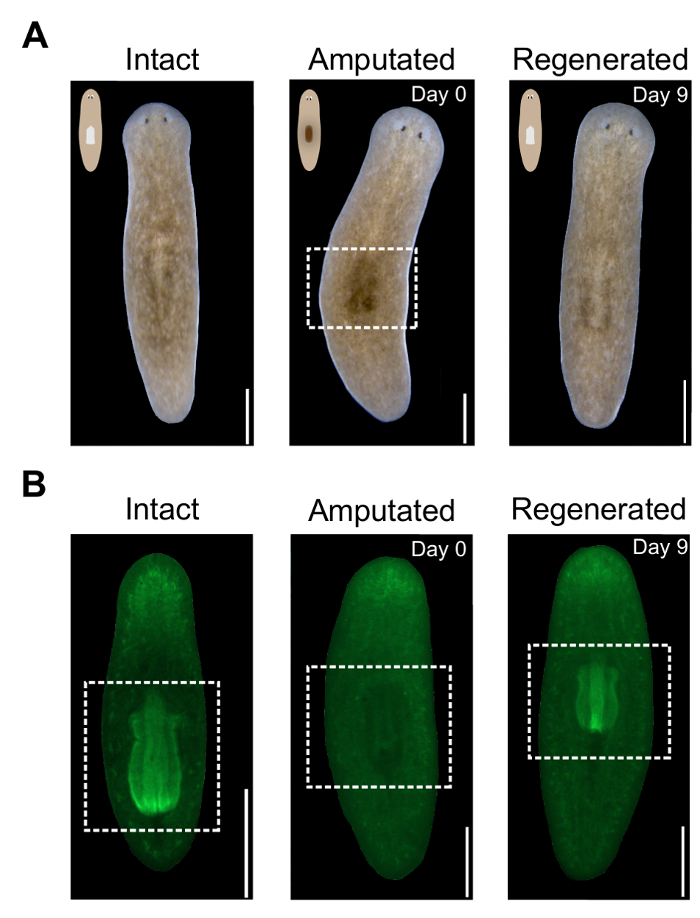
Figure 2 . Évaluation de l’amputation du pharynx et de la régénération. (A) des images représentant des animaux vivants à spécifié fois avant et après l’amputation. Panneau central montre la tache sombre dans la région du pharynx après amputation, a mis en évidence par une boîte blanche en pointillés. Face dorsale vers le haut. Barreaux de l’échelle = 500 µm. (B) images représentant des animaux colorés avec la Streptavidine-Alexa488 à spécifié fois avant et après l’amputation. Panneau central montre l’absence du pharynx après amputation. Région pharyngée surlignée en boîte blanche. La face ventrale vers le haut. Echelle = 500 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
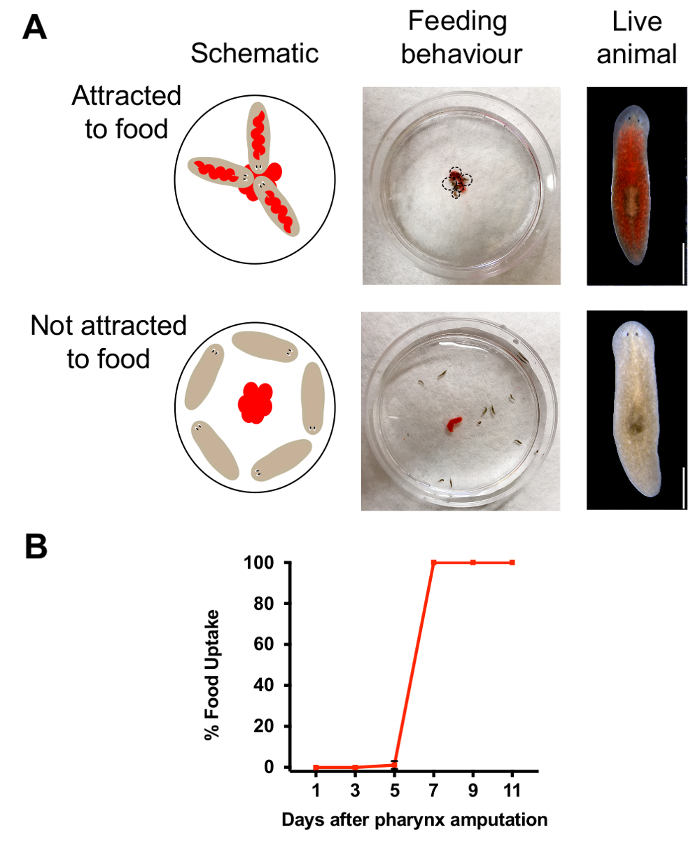
La figure 3. Évaluation de la régénération du pharynx. (A) Images et schéma de l’alimentation d’essai, effectué en plaçant 25 µl de foie au centre d’une boîte de Pétri de 60 mm. Schéma (en haut, à gauche) et image (au milieu) spectacle comportement alimentaire chez les animaux ayant déjà intacte. Image de droite, supérieure de l’animal qui a mangé. Schéma (en bas à gauche) et image (milieu) du comportement alimentaire chez les animaux un jour après l’amputation. Bas droite, animal n’a pas mangé. Echelle = 750 µm. répéter les résultats (B) de l’alimentation. Pourcentage d’animaux qui ont ingéré des aliments (quantifié par la coloration rouge) à des moments précis après l’amputation. Pour chaque point dans le temps, n = 10 animaux, répétés en triple exemplaire. Barre d’erreur = DS. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce protocole décrit une méthode d’ablation sélective du pharynx à l’aide de l’azide de sodium. Autres études ciblées ablation en Australie ont utilisé mis à jour le chirurgie pour enlever les photorécepteurs21 ou traitement pharmacologique pour l’ablation de neurones dopaminergiques22. Un avantage significatif de l’amputation chimique par rapport aux méthodes existantes, c’est qu’il ne nécessite pas de chirurgie. La structure rigide du pharynx par rapport au reste du corps planaire facilite son retrait complet de l’animal, qui est beaucoup plus doux-bodied. En outre, le pharynx se détache de l’animal à un petit Carrefour (l’oesophage)30 rejoignant le pharynx et l’intestin, générant une plaie plus reproductible que celle induite par un plus grand outil chirurgical. Basé sur ses propriétés physiques et un petit lien anatomique avec le reste de l’animal, enlèvement du pharynx génère donc des blessures plus homogènes que les autres amputations chirurgicales.
Durée de l’exposition de l’azoture de sodium est également essentielle pour la réussite de cette technique. Bien que l’exposition brève à l’azoture de sodium n’altère pas Platyhelminthes, exposition prolongée est toxique et finira par tuer animaux. L’azoture de sodium est connu pour inhiber les processus dépendant de l’énergie par le biais de l’inhibition du cytochrome oxydase23,24. En outre, il supprime la transcription et la traduction, probablement par l’accumulation des éléments clés de ces réactions au stress granules25. En Australie, exposition de l’azoture de sodium supprime la mitose pendant 24 h, après quoi les cellules reprendre la prolifération12. Modifications telles que limiter la durée d’exposition de l’azoture, enlever azoture avec rinçage complet et de la comptabilité pour la suppression mitotique transitoire dans une conception expérimentale peut aider à surmonter ces limites.
La position anatomique unique du pharynx et sa symétrie radiale caractéristique permettent la distinction facile de tissu nouvellement régénéré pharyngienne des cellules souches préexistantes. Régénération du pharynx peut être surveillée au niveau cellulaire et anatomique, à l’aide de tissus taches comme la Streptavidine et DAPI, immunohistochimie, ou par in situ hybridation26. L’alimentation essai décrit ici tests fonctionnelle régénération du pharynx. Chimiotactisme vers alimentaire exige le pharynx27,28 et animaux sans un pharynx entièrement fonctionnel ne peuvent ingérer des aliments. Cette évaluation simple et quantitative de la fonction des organes complète donc la régénération structurelle. En outre, amputation chimique peut être effectuée sur les populations d’animaux et peut générer de nombreux animaux avec des blessures identiques. La procédure est donc pratique pour les études à grande échelle. Ces avantages, associées au fait que la régénération du pharynx mature nécessite des cellules souches, amputation du pharynx en fait un modèle idéal pour étudier la régénération d’organes. Utilisé en combinaison avec amputation plus large, enlèvement du pharynx peut être utilisé pour tester des hypothèses sur la taille de la plaie et la position anatomique l’impact de la réponse des cellules souches à l’injure, qui est une question clé dans la zone de régénération21.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Alejandro Sánchez Alvarado, qui ont soutenu l’optimisation initiale et le développement de cette technique. Travail en laboratoire de Carolyn Adler est pris en charge par les fonds de démarrage de l’Université Cornell.
matériels
| Name | Company | Catalog Number | Comments |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Chemical | C79-3 | Montjuïc salt solution |
| Magnesium Sulfate Anhydrous (MgSO4) | Fisher Chemical | M65-3 | Montjuïc salt solution |
| Magnesium Chloride Hexahydrate (MgCl2) | Acros/VWR | 41341-5000 | Montjuïc salt solution |
| Potassium Chloride (KCl) | Acros Organics/VWR | 196770010 | Montjuïc salt solution |
| Sodium Chloride (NaCl) | Acros Organics/VWR | 207790050 | Montjuïc salt solution |
| Sodium Bicarbonate (NaHCO3) | Acros Organics/VWR | 123360010 | Montjuïc salt solution |
| Nalgene autoclavable polypropylene copolymer lowboy with spigot | ThermoFisher Scientific/VWR | 2324-0015 | Storing planaria water |
| Instant Ocean Sea Salt | Spectrum Brands | Amazon | Planaria water |
| Gentamicin Sulfate | Gemini Bio-products | 400-100P | Planaria water |
| Razor blades | Electron Microscopy Sciences | 71970 | Mincing liver |
| Disposable pastry bags-16”, 12 pack | Wilton | Amazon | Liver aliquots |
| 5 mL syringes | BD/VWR | 309647 | Liver aliquots |
| Petri dishes-35mm/60mm | Greiner Bio-One/VWR | 82050-536/82050-544 | |
| Plastic containers (various sizes) | Ziploc | Amazon | Housing planarians in static culture |
| Sodium Azide | Sigma | S2002 | |
| Transfer pipette | Globe Scientific | 138030 | |
| Forceps - Dumont Tweezer, Style 5 | Electron Microscopy Sciences | 72700-D (0203-5-PO) | |
| Triton X-100 | Sigma | T8787 | |
| DAPI | ThermoFisher | 62247 | |
| Streptavidin, Alexa Fluor 488 conjugate | ThermoFisher | S11223 | |
| Glycerol | Fisher BioReagents | BP229-1 |
Références
- Tanaka, E. M., Reddien, P. W. The cellular basis for animal regeneration. Dev. Cell. 21, 172-185 (2011).
- Tanaka, E. M. The Molecular and Cellular Choreography of Appendage Regeneration. Cell. 165, 1598-1608 (2016).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat. Protoc. 3, 948-954 (2008).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62, 232-240 (2013).
- Smith-Bolton, R. K., Worley, M. I., Kanda, H., Hariharan, I. K. Regenerative growth in Drosophila imaginal discs is regulated by Wingless and Myc. Dev. Cell. 16, 797-809 (2009).
- Smith-Bolton, R. Drosophila Imaginal Discs as a Model of Epithelial Wound Repair and Regeneration. Adv. Wound Care. 5, 251-261 (2016).
- Newmark, P. A., Sánchez Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat. Rev. Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez Alvarado, A. Fundamentals of planarian regeneration. Annu. Rev. Cell Dev. Biol. 20, 725-757 (2004).
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Scimone, M. L., Kravarik, K. M., Lapan, S. W., Reddien, P. W. Neoblast specialization in regeneration of the planarian Schmidtea mediterranea. Stem Cell Reports. 3, 339-352 (2014).
- van Wolfswinkel, J. C., Wagner, D. E., Reddien, P. W. Single-cell analysis reveals functionally distinct classes within the planarian stem cell compartment. Cell Stem Cell. 15, 326-339 (2014).
- Adler, C. E., Seidel, C. W., McKinney, S. A., Sánchez Alvarado, A. Selective amputation of the pharynx identifies a FoxA-dependent regeneration program in planaria. Elife. 3, e02238 (2014).
- Adler, C. E., Sánchez Alvarado, A. PHRED-1 is a divergent neurexin-1 homolog that organizes muscle fibers and patterns organs during regeneration. Dev. Biol. 427, 165-175 (2017).
- Wong, M. C., Martynovsky, M., Schwarzbauer, J. E. Analysis of cell migration using Caenorhabditis elegans as a model system. Methods Mol. Biol. 769, 233-247 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C elegans chemotaxis assay. J. Vis. Exp. , e50069 (2013).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177 (2012).
- Tasaki, J., Uchiyama-Tasaki, C., Rouhana, L. Analysis of Stem Cell Motility In Vivo Based on Immunodetection of Planarian Neoblasts and Tracing of BrdU-Labeled Cells After Partial Irradiation. Methods Mol. Biol. 1365, 323-338 (2016).
- Roberts-Galbraith, R. H., Brubacher, J. L., Newmark, P. A. A functional genomics screen in planarians reveals regulators of whole-brain regeneration. Elife. 5, (2016).
- Arnold, C. P., et al. Pathogenic shifts in endogenous microbiota impede tissue regeneration via distinct activation of TAK1/MKK/p38. Elife. 5, (2016).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- LoCascio, S. A., Lapan, S. W., Reddien, P. W. Eye Absence Does Not Regulate Planarian Stem Cells during Eye Regeneration. Dev. Cell. 40, 381-391 (2017).
- Nishimura, K., et al. Regeneration of dopaminergic neurons after 6-hydroxydopamine-induced lesion in planarian brain. J. Neurochem. 119, 1217-1231 (2011).
- Wilson, D. F., Chance, B. Azide inhibition of mitochondrial electron transport. I. The aerobic steady state of succinate oxidation. Biochim. Biophys. Acta. 131, 421-430 (1967).
- Duncan, H. M., Mackler, B. Electron Transport Systems of Yeast: III. Preparation and properties of cytochrome oxidase. J. Biol. Chem. 241, 1694-1697 (1966).
- Buchan, J. R., Yoon, J. H., Parker, R. Stress-specific composition, assembly and kinetics of stress granules in Saccharomyces cerevisiae. J. Cell Sci. 124, 228-239 (2011).
- Cebrià, F. Organization of the nervous system in the model planarian Schmidtea mediterranea: An immunocytochemical study. Neurosci. Res. 61, 375-384 (2008).
- Shimoyama, S., Inoue, T., Kashima, M., Agata, K. Multiple Neuropeptide-Coding Genes Involved in Planarian Pharynx Extension. Zoolog. Sci. 33, 311-319 (2016).
- Ito, H., Saito, Y., Watanabe, K., Orii, H. Epimorphic regeneration of the distal part of the planarian pharynx. Dev. Genes Evol. 211, 2-9 (2001).
- Bueno, D., Espinosa, L., Baguñà, J., Romero, R. Planarian pharynx regeneration in tail fragments monitored with cell-specific monoclonal antibodies. Dev. Genes Evol. 206, 425-434 (1997).
- Hyman, L. . The invertebrates: Platyhelminthes and Rhynchocoela, the acoelomate Bilateria. , (1951).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon