Method Article
Chimica l'amputazione e la rigenerazione della faringe nella Planaria planarie mediterranea
In questo articolo
Riepilogo
La planaria planarie mediterranea è un eccellente modello per studiare le cellule staminali e rigenerazione dei tessuti. Questa pubblicazione descrive un metodo per rimuovere selettivamente un solo organo, la faringe, esponendo gli animali per la chimica sodio azide. Questo protocollo delinea anche metodi per il monitoraggio di rigenerazione della faringe.
Abstract
Planarie sono vermi piatti che sono estremamente efficienti in rigenerazione. Devono questa capacità di un gran numero di cellule staminali che possono rispondere rapidamente a qualsiasi tipo di ferita. Modelli di lesione comune in questi animali rimuovono grandi quantità di tessuto, che danneggia gli organi multipli. Per superare questo danno di tessuto ampio, descriviamo qui un metodo per rimuovere in modo selettivo un singolo organo, la faringe, in Planaria planarie mediterranea. Raggiungiamo questo dagli animali ammollo in una soluzione contenente l'azoturo di sodio inibitore dell'ossidasi del citocromo. Breve esposizione al sodio azide provoca estrusione della faringe dall'animale, che noi chiamiamo "amputazione chimica." Amputazione chimica rimuove l'intera faringe e genera una piccola ferita, dove la faringe si attacca all'intestino. Dopo il risciacquo vasto, tutti gli animali amputati rigenerano una faringe completamente funzionale in circa una settimana. Cellule staminali nel resto del corpo di auto rigenerazione della faringe nuova. Qui, forniamo un dettagliato protocollo per amputazione chimica e descrivere i metodi sia istologici e comportamentali per valutare il successo amputazione e rigenerazione.
Introduzione
La rigenerazione è un fenomeno che si verifica in tutto il Regno animale, con capacità rigenerative che vanno dalla rigenerazione di corpo pieno in alcuni invertebrati a più limitate capacità in vertebrati1. Sostituzione dei tessuti funzionali è un processo complesso e spesso comporta il ripristino simultaneo di più tipi di cellule. Ad esempio, per rigenerare l'arto di Salamandra, osteoblasti, condrociti, neuroni, muscoli e cellule epiteliali c'è bisogno di essere sostituito2. Questi tipi di cellule appena generato anche bisogno di essere organizzato correttamente per facilitare la nuova funzione dell'arto. Comprensione di tali processi complessi richiede tecniche che si concentrano sulla rigenerazione di tipi cellulari specifici e la loro integrazione negli organi.
Una delle strategie impiegate per semplificare lo studio della risposta rigenerativa è l'ablazione mirata di alcuni tipi di cellule o di più grandi collezioni di tessuti. Ad esempio, in zebrafish, espressione di nitroreductase in tipi cellulari specifici conduce alla loro distruzione dopo l'applicazione di metronidazole3,4. Nelle larve di Drosophila , espressione dei geni pro-apoptotici sotto promotori tessuto-specifici possono selettivamente l'ablazione regioni specifiche del disco immaginale5,6. Entrambe queste strategie causare danni rapido ma controllato e sono state utilizzate per analizzare i meccanismi molecolari e cellulari responsabili di rigenerazione.
In questo manoscritto, descriviamo un metodo per rimuovere in modo selettivo un intero organo chiamato faringe in Planaria planarie mediterranea. Planarie sono un classico modello di rigenerazione, noto per la loro capacità rigenerativa prolifico, dove anche minuscoli frammenti possono ricrescere interi animali 7,8. Hanno una grande, eterogenea popolazione di cellule staminali che consiste di cellule pluripotenti e di progenitori lignaggio-limitata9,10,11. Queste cellule proliferano e si differenziano per sostituire tutti i tessuti mancanti, tra cui il faringe, sistema nervoso, apparato digerente ed escretore e muscolo e cellule epiteliali9,10,12. Mentre sappiamo che queste cellule staminali iniziare la rigenerazione, non comprendiamo pienamente i meccanismi molecolari che guidano loro di sostituire tutti questi tipi differenti delle cellule. Metodi definiti ferentesi che suscitano le risposte precise sulle cellule staminali possono aiutare a delineare questo complesso processo.
La faringe è un tubo grande, cilindrico, necessario per l'alimentazione e contiene neuroni, muscolo, cellule epiteliali e secretiva13,29. Normalmente nascosti in una tasca sul lato ventrale dell'animale, si estende attraverso il corpo dell'animale singolo apertura su sentendo la presenza di cibo. Per selettivamente amputare la faringe, siamo ammollo planarie in una chimico chiamato sodio azide, un anestetico usato comunemente in c. elegans14,15,16. Suo uso in planarie in primo luogo è stato segnalato da Adler et al., nel 201412. In pochi minuti di esposizione al sodio azide, planarie estrudere loro pharynges, e con agitazione delicata, la faringe si stacca dall'animale. Ci riferiamo a questa perdita completa e selettiva della faringe come "chimica amputazione". Una settimana dopo l'amputazione, una faringe completamente funzionale è restaurato12. Poiché la faringe è necessaria per l'alimentazione, rigenerazione funzionale può essere misurata monitorando il comportamento alimentare. Di seguito descriviamo il protocollo per l'amputazione di chimica e valutare la riqualificazione della faringe e del comportamento alimentare.
Protocollo
1. preparazione
-
Preparazione di acqua planaria 17
- Mantenere planarie in una soluzione di sale di X Montjuïc 1. Per preparare l'acqua Planaria, rendere singole soluzioni di riserva di 1m CaCl2, 1m MgSO4, 1 M MgCl2, 1m KCl e 5 M di NaCl in acqua ultrapura. Filtro-sterilizzare con una conservazione a lungo termine del filterfor parte superiore della bottiglia di 0,2 µm.
Nota: Utilizzare solo acqua deionizzata ultrapura (con una resistività di 18,2 MΩ a 25 ° C) per preparare Montjuïc sali. - Per preparare un brodo di 1 L di soluzione di sale X 5, combinare 5 mL di 1 M CaCl2, 5ml di 1m MgSO4, 0,5 mL di MgCl2, 0,5 mL di KCl e 1,6 mL delle soluzioni di NaCl 5m in 900 mL di acqua ultrapura. A questa soluzione, aggiungere 0,504 g di NaHCO3 e mescolare. Regolare il pH a 7.0 con acido cloridrico.
- Diluire questa soluzione di riserva a una concentrazione di lavoro in acqua ultrapura in un contenitore sterile come una damigiana di grande capacità di 1x a 5x (Vedi la Tabella materiali). Utilizzare questa soluzione 1x per mantenere planarie asessuale.
Nota: Come alternativa alla soluzione di sale di Montjuïc, utilizzare acqua sorgiva acquistati localmente o acqua ultrapura contenente un sale di commercialmente disponibile acquario mescolare (Vedi Tabella materiali) a una concentrazione of0.5 g/L18. - Per prevenire l'infezione batterica in coltura statica19, mantenere planarie in acqua contenente un antibiotico. Preparare un 50 mg/mL di soluzione madre di gentamicina solfato in acqua ultrapura e filtro-sterilizzare. Ai contenitori dove gli animali sono mantenuti, aggiungere solfato di gentamicina a una concentrazione finale di 50 µ g/mL (diluizione 1: 1000).
- Mantenere planarie in una soluzione di sale di X Montjuïc 1. Per preparare l'acqua Planaria, rendere singole soluzioni di riserva di 1m CaCl2, 1m MgSO4, 1 M MgCl2, 1m KCl e 5 M di NaCl in acqua ultrapura. Filtro-sterilizzare con una conservazione a lungo termine del filterfor parte superiore della bottiglia di 0,2 µm.
-
Preparazione della pasta del fegato
- Come planarie prosperano su una dieta di organico, manzo nutrito con erba epatica, acquisto di fegato fresco e processo entro 24 h. rimuovere la capsula membranosa che incapsula il fegato di staccando delicatamente. Tagliare il fegato a dadini ~ 1 cm e utilizzare una lama per raschiare e scartare tutte le arterie e le vene epatiche.
- Macerare i pezzi del fegato usando una passaverdure o un robot da cucina e poi passarlo attraverso un colino di cibo della maglia di filo. Combinare in sac e dispensare in siringhe o 35 mm piastre di Petri. Prima dell'alimentazione, centrifugare delicatamente per rimuovere le bolle d'aria.
- Conservare le aliquote del fegato a-80 ° C per fino a un anno e scongelare prima dell'utilizzo. Dopo lo scongelamento, ricongelare qualsiasi rimanente fegato una volta, o conservare a 4 ° C per 24 h.
-
Mantenimento degli animali
- Planarie crescerà e ridursi a vari formati a seconda della frequenza di alimentazione. Feed per planarie ogni due settimane (una volta ogni 14 giorni). Per colture a lungo termine di massa, utilizzare recipienti di plastica di varie dimensioni (Vedi Tabella materiali).
- Per nutrire gli animali, utilizzare una spatola di metallo o una pipetta di trasferimento in plastica per mettere una goccia di pisello di fegato in una scatola. Permettere agli animali di mangiare per 1-2 h. Remove rimanente cibo prima di pulire la casella.
- Pulire i vermi due volte a settimana se alimentato (una volta direttamente dopo la poppata e una volta due giorni dopo), o una volta a settimana, se non alimentati. Per pulire, drenare l'acqua in un becher plastica versando con attenzione l'acqua pur mantenendo planarie nella casella. Pulire la superficie della scatola con un tovagliolo di carta, quindi ripetere su tutti i lati fino a quando la casella è pulita.
- Sostituire l'acqua (a circa ¾ del volume casella) e aggiungere gentamicina a una concentrazione finale di 50 µ g/mL. Negozio animali in un armadio scuro o in un incubatore a 20 ° C.
-
Selezione di vermi
- Selezionare i vermi che sono stati alimentati 5-7 giorni prima.
Nota: È molto più difficile da amputare pharynges da vermi che sono recentemente stati alimentati (1-2 giorni prima dell'amputazione). Animali nutriti sono anche più sensibili al sodio azide. - Selezionare i vermi che sono circa 6 mm di lunghezza. Per stimare le dimensioni del verme, trasferirlo in una capsula Petri utilizzando una pipetta di trasferimento in plastica. Posizionare un righello piatto 6 - in o la carta millimetrata 5 x 5 mm sotto la piastra di Petri e misurare la lunghezza della vite senza fine, mentre la ricerca per indicizzazione.
Nota: Vermi inferiore a 6 mm di lunghezza sono più difficili da amputare.
- Selezionare i vermi che sono stati alimentati 5-7 giorni prima.
-
Preparazione di sodio azide
- Preparare una soluzione di 100 mM sciogliendo polvere di azoturo di sodio in acqua planaria.
Attenzione: Sodio azide è tossica e dovrebbe essere maneggiata con cura. Non gettare via giù per lo scarico di sodio azide. Dopo l'uso, si raccolgono separatamente per lo smaltimento come rifiuti pericolosi.
- Preparare una soluzione di 100 mM sciogliendo polvere di azoturo di sodio in acqua planaria.
2. faringe amputazione
- Posto i vermi in un diametro di 35 mm di Petri. Rimuovere attentamente tutta l'acqua Planaria dal piatto utilizzando una pipetta di trasferimento in plastica.
Nota: Un massimo di 20 6 mm vermi possa essere comodamente alloggiato in un piatto di queste dimensioni. - Mettere il recipiente sotto il microscopio e regolare ingrandimento in modo che più vermi possono essere visualizzati contemporaneamente (es. 10 ingrandimenti). Sostituire Planaria acqua con soluzione di azoturo di sodio di 100 mM.
Nota: Per un piatto di Petri di 35 mm, circa 5 mL di sodio azide è sufficiente. La soluzione dovrebbe completamente sommergere planarie. Regolare il volume di soluzione per piatti più grandi come necessario. - Monitorare gli animali sotto il microscopio e si astengono da spostare il piatto per i primi 3-4 min.
- Osservare l'estrusione della faringe attraverso il microscopio; la faringe si sporgono dal sacchetto pharyngeal ed estendere completamente (circa 1 mm di lunghezza) come mostrato in Figura 1B.
Nota: È importante attendere la faringe ha terminato estendendo completamente prima di procedere ulteriormente. Una volta che la faringe emerge dall'animale, estensione completa richiede circa 1 min. - Utilizzare una pipetta di trasferimento in plastica a schizzare animali intorno il piatto. Gli animali succhiano la pipetta e forzatamente rilasciarli nel piatto un paio di volte. Se la faringe è completamente estesa, questo vigoroso pipettaggio farà sì che staccare.
- In alternativa, afferrare la faringe o verticalmente lungo la sua lunghezza, o orizzontalmente lungo la sua circonferenza utilizzando una coppia di una pinzetta (Vedi Tabella materiali) come mostrato in Figura 1. Con la faringe pizzicata nel forcipe, sollevare l'animale verso l'alto verso il menisco. L'animale viene generato, tensione superficiale causerà la faringe staccare dall'animale.
Nota: Questo metodo può essere utilizzato per rimuovere il pharynges di animali più piccoli (1-3 mm di lunghezza) dove il forte di turbine non è adeguata. Evitare di frugare o altrimenti ferendo il corpo dell'animale. - Utilizzando una pipetta da trasferimento, spostare gli animali amputati un nuovo piatto contenente acqua fresca planaria.
- Una volta trasferiti, sciacquare amputati animali accuratamente in acqua planaria, completamente lo scambio di acqua tre volte. Trasferimento a un nuovo piatto contenente acqua planaria con 50 µ g/mL di gentamicina.
Nota: Scambio di buffer completo durante questi tre lavaggi è essenziale per garantire la rimozione di sodio azide. - Il giorno successivo, sostituire l'acqua nel piatto con acqua fresca planaria contenente 50 µ g/mL di gentamicina. Ripetere ogni giorno da allora in poi.
3. valutazione della faringe rimozione dopo l'amputazione
- Esaminare gli animali sotto un microscopio (con 10-20 ingrandimenti) per determinare se una macchia scura è apparso dopo la rimozione di successo del faringe, come mostrato nella Figura 2A.
- In alternativa, difficoltà e bleach animali secondo il protocollo descritto da Pearson et al. 20. animali di ammollo durante la notte in 4', 6-diamidino-2-phenylindole (DAPI) o fluorescente coniugato streptavidina (1 mg/mL diluito 1: 500 a 1 X Phosphate Buffered Saline contenenti 0,3% Triton-X). Montare gli animali sulle diapositive nel 80% glycerol/20% 1 X Phosphate Buffered Saline e immagine sotto un microscopio stereoscopico fluorescente (Figura 2B).
Nota: Tutte le immagini in questo manoscritto sono state catturate su uno stereomicroscopio fluorescente con un obiettivo X 1,0.
4. valutazione della faringe rigenerazione misurando il comportamento alimentare
-
Preparazione del fegato
- Trasferire la quantità richiesta di incolla del fegato in una microcentrifuga o tubo conico. Girare brevemente per rimuovere le bolle d'aria. Stimare il volume di fegato e poi aggiungere acqua planaria al 1/5 del suo volume e il 2% del volume totale di colorante alimentare rosso. Ad esempio, a 1000 µ l di fegato incollare, aggiungere 200 µ l di acqua planaria e 24 µ l di colorante alimentare.
- Usando un pestello in plastica, puntale o spatola metallica, mescolare accuratamente fino a quando il colorante alimentare è distribuito uniformemente nella pasta di fegato. Girare di nuovo brevemente. Pasta di fegato può essere conservato a 4 ° C per 24 h o congelato in aliquote a-80 ° C per la conservazione a lungo termine.
- Se il test fino a 25 animali, preparare 25 µ l di fegato incolla per ogni piatto (circa 1 µ l di fegato incolla per animale).
-
Alimentazione degli animali
- Sette giorni dopo l'amputazione chimica, trasferire gli animali un nuovo piatto di Petri. Se gli esperimenti su animali 10-15, utilizzare un piatto 35 mm; più di 15 animali dovrebbero essere testati in una capsula di Petri 60mm. Tenere gli animali al buio, indisturbato, per circa 1 h prima dell'alimentazione.
- Utilizzando le forbici, aumentare la larghezza della punta di una pipetta di P200 tagliando circa ½ cm fuori l'estremità più stretta. Dispensare 25 µ l di pasta rossa del fegato nel piatto.
Nota: Taglio alla fine rende la pasta viscosa del fegato più facile il pipettaggio. Per impedire che galleggiano sulla superficie del fegato, toccare la punta verso il basso del piatto durante l'erogazione. - Permettere agli animali di feed per 30 min.
- Segnare il numero di animali che hanno mangiato posizionando gli animali su un fondo bianco o esaminarli al microscopio con ingrandimento X 10-20.
- Dopo l'alimentazione, rimuovere il fegato dal piatto e pulito.
Risultati
L'esposizione al sodio azide sconvolge la normale motilità delle planarie, causando gli animali ad allungare e si contorcono. Questi movimenti forzare la faringe ad emergere dal lato ventrale dell'animale, e dopo circa 6 min in soluzione di sodio azide, la punta bianca della faringe può essere visto (Figura 1B-pannello di sinistra). Pochi minuti dopo, animali attivamente contraggono ed estendono completamente la faringe spingendolo con forza fuori dal corpo. (Figura 1B-pannello centrale). Circa 11 min dopo l'esposizione azide, gli animali e la faringe relax. In questa fase, la forma a campana caratteristico della faringe è chiaramente visibile (Figura 1B-pannello di destra). Per amputazione facile, è importante attendere la faringe per rilassarsi.
Perché la faringe è un grande, unpigmented massa del tessuto, la rimozione provoca la comparsa di una macchia scura sul lato dorsale dell'amputato animali (Figura 2A). Questa regione buia è un indicatore visivo di successo amputazione in animali vivi. Lo spot è visibile immediatamente dopo l'amputazione e diventa più prominente il giorno successivo. Come la faringe rigenera, questa regione si schiarisce. Per monitorare più precisamente rigenerazione faringe, animali possono essere macchiati con DAPI o fluorescente coniugato streptavidina pernottamento (Figura 2B). Per valutare quantitativamente l'entità della rigenerazione della faringe, la zona può essere misurata utilizzando il software ImageJ.
La faringe è un organo essenziale per l'ingestione di cibo e chemosensation. Per determinare quando queste funzioni vengono ripristinate durante la rigenerazione, abbiamo usato le analisi d'alimentazione per monitorare il comportamento degli animali. Combinando il colorante con fegato pasta alimentare, siamo stati in grado di distinguere gli animali che abbiamo mangiato da quelli che hanno fatto non (Figura 3A). Abbiamo poi quantificato il numero di animali rossi per valutare la percentuale di animali con una faringe funzionale. Basato sui risultati mostrati nella Figura 3B, successo comportamento alimentare è stata ristabilita 7 giorni dopo l'amputazione, che indica che una settimana dopo la rimozione della faringe, gli animali hanno rigenerato una faringe funzionale. Per verificare se l'esposizione di azoturo di sodio influenzato il comportamento alimentare, abbiamo imbevuto animali di sodio azide ma lavato fuori immediatamente prima dell'espulsione della faringe. Il giorno dopo, abbiamo valutato se comportamento diricerca è stata alterata dall'esposizione di azoturo di sodio con l'analisi di alimentazione. In contrasto con animali chimicamente amputata manca una faringe, tutti gli animali mantenendo una faringe intatta dopo mangiato l'esposizione di azoturo di sodio (n = 30 animali per ogni condizione) il cibo. Questo risultato indica che l'esposizione di azoturo di sodio non influisce comportamento alimentare, purché la faringe rimane intatta.

Figura 1 . Espulsione di faringe e amputazione. (A) schema di anatomia Planaria. (B) immagini di animali vivi risultati espulsione faringe su ammollo in SodioAzide di 100 mM. Frecce rosse evidenziano faringe. Scala bar = 750 µm. (C) immagine dell'animale vivo (a sinistra) e schema (a destra) di amputazione usando il forcipe. Pannelli mostrano due diverse opzioni per la presa della faringe. Lato ventrale dell'animale rivolto verso l'alto. Scala bar = 500 µm. Clicca qui per visualizzare una versione più grande di questa figura.
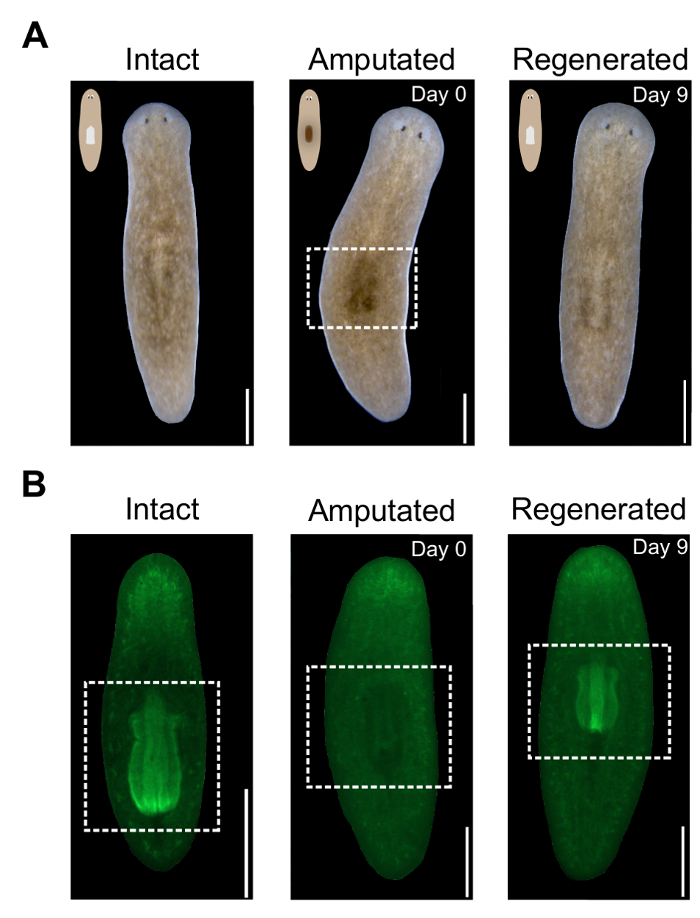
Figura 2 . Valutazione dell'amputazione di faringe e rigenerazione. (A) immagini rappresentative di animali vivi in determinati momenti prima e dopo l'amputazione. Pannello centrale Mostra macchia scura nella regione pharyngeal dopo l'amputazione, evidenziato da casella bianca tratteggiata. Lato dorsale rivolto verso l'alto. Scala bar = 500 µm. (B) immagini rappresentative degli animali macchiati con Alexa488-streptavidina a determinati momenti prima e dopo l'amputazione. Pannello centrale mostra l'assenza di faringe dopo l'amputazione. Regione pharyngeal evidenziato dalla scatola bianca. Lato ventrale rivolto verso l'alto. Barra della scala = 500 µm. Clicca qui per visualizzare una versione più grande di questa figura.
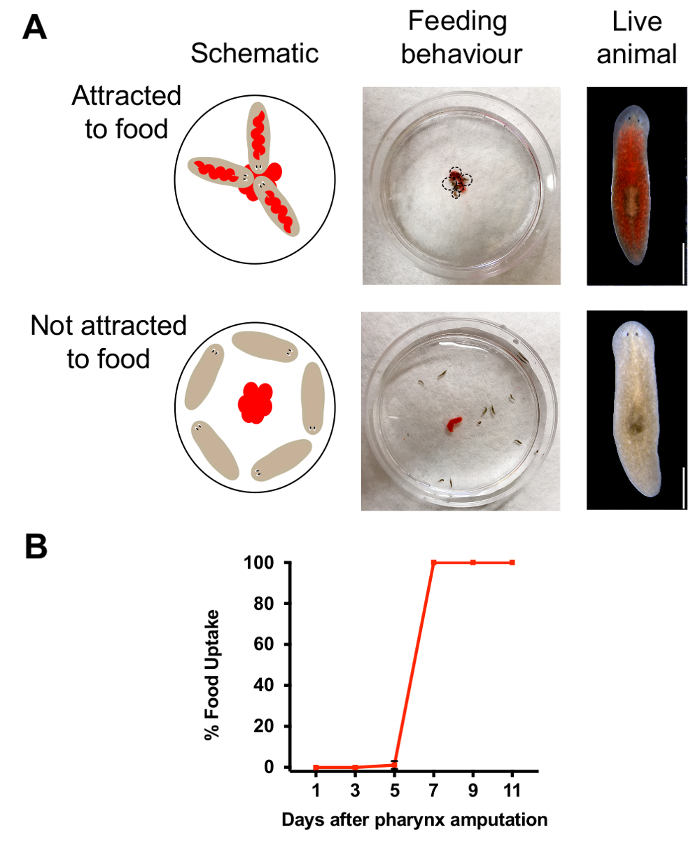
Nella figura 3. Valutazione della rigenerazione della faringe. (A) schema di alimentazione test, condotto ponendo 25 µ l di fegato al centro di un 60mm di Petri e immagini. Schema elettrico (alto, a sinistra) e immagine (al centro) mostrano comportamento alimentare negli animali con pharynges intatta. Superiore destra, immagine dell'animale che ha mangiato. Schema elettrico (in basso a sinistra) e immagine (al centro) del comportamento alimentare negli animali 1 giorno dopo l'amputazione. Animale giusto, inferiore che non ha mangiato. Barra della scala = 750 µm. (B) risultati di alimentazione dosaggio. Percentuale di animali che hanno ingerito cibo (quantificato dalla colorazione rossa) in momenti specifici dopo l'amputazione. Per ogni punto di tempo, n = 10 animali, ripetuti in triplice copia. Barra di errore = SD. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo descrive un metodo di ablazione selettiva della faringe utilizzando sodio azide. Altri studi di ablazione mirati in planarie hanno utilizzato modificata chirurgia per rimuovere fotorecettori21 o trattamento farmacologico per l'ablazione di neuroni dopaminergici22. Un vantaggio significativo di amputazione chimico rispetto ai metodi esistenti è che non richiede intervento chirurgico. La struttura rigida della faringe rispetto al resto del corpo Planaria facilita la sua completa rimozione dall'animale, che è molto più morbido-bodied. Inoltre, la faringe si stacca dall'animale a un piccolo incrocio (esofago)30 entrare a far parte della faringe e dell'intestino, generando una ferita più riproducibile rispetto a uno indotto da un più grande strumento chirurgico. Basato sulle sue proprietà fisiche e anatomiche piccolo sollevatore per il resto dell'animale, rimozione di faringe genera pertanto ferite più omogenee rispetto altre amputazioni chirurgiche.
Durata di esposizione al sodio azide è anche fondamentale per il successo di questa tecnica. Anche se breve esposizione al sodio azide non influisca negativamente planarie, esposizione prolungata è tossico e alla fine uccide gli animali. Sodio azide è conosciuta per inibire i processi di energia-dipendente attraverso l'inibizione del citocromo ossidasi23,24. Inoltre, esso sopprime la trascrizione e traduzione, probabilmente da accumulo di componenti chiave di queste reazioni a stress granuli25. Nelle planarie, esposizione di azoturo di sodio sopprime la mitosi per 24 h, dopo di che le cellule riprendere proliferazione12. Modifiche come limitando il tempo di esposizione di azide, rimozione di azide con risciacquo e l'accounting per la soppressione dei transienti mitotica nel disegno sperimentale può aiutare a superare queste limitazioni.
L'unica posizione anatomica della faringe e sua caratteristica simmetria radiale consentono la facile distinzione di tessuto recentemente rigenerato pharyngeal da cellule staminali pre-esistenti. Rigenerazione di faringe può essere monitorato a livello cellulare e anatomico, usando le macchie di tessuto come streptavidina e DAPI, immunohistochemistry, o di in situ di ibridazione26. Il dosaggio di alimentazione descritto qui saggi funzionali rigenerazione della faringe. Chemiotassi verso il cibo richiede la faringe27,28 e gli animali senza una faringe completamente funzionale non possono ingerire cibo. Questa semplice valutazione quantitativa della funzione dell'organo pertanto completa rigenerazione strutturale. Inoltre, l'amputazione chimica possa essere eseguita sulle popolazioni di animali e può generare numerosi animali con ferite identiche. La procedura è quindi conveniente per gli studi su larga scala. Questi vantaggi, accoppiati con il fatto che la rigenerazione di una matura faringe richiede cellule staminali, rende l'amputazione faringe un modello ideale per studiare la rigenerazione dell'organo. Usato in combinazione con amputazioni più ampie, rimozione di faringe utilizzabile per testare le ipotesi sull'impatto di ferita dimensione e posizione anatomica la risposta delle cellule staminali alla ferita, che è una questione chiave nel campo rigenerazione21.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare Alejandro Sánchez Alvarado, che hanno sostenuto l'ottimizzazione iniziale e lo sviluppo di questa tecnica. Lavoro in laboratorio di Carolyn Adler è sostenuta da fondi di Start-up di Cornell University.
Materiali
| Name | Company | Catalog Number | Comments |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Chemical | C79-3 | Montjuïc salt solution |
| Magnesium Sulfate Anhydrous (MgSO4) | Fisher Chemical | M65-3 | Montjuïc salt solution |
| Magnesium Chloride Hexahydrate (MgCl2) | Acros/VWR | 41341-5000 | Montjuïc salt solution |
| Potassium Chloride (KCl) | Acros Organics/VWR | 196770010 | Montjuïc salt solution |
| Sodium Chloride (NaCl) | Acros Organics/VWR | 207790050 | Montjuïc salt solution |
| Sodium Bicarbonate (NaHCO3) | Acros Organics/VWR | 123360010 | Montjuïc salt solution |
| Nalgene autoclavable polypropylene copolymer lowboy with spigot | ThermoFisher Scientific/VWR | 2324-0015 | Storing planaria water |
| Instant Ocean Sea Salt | Spectrum Brands | Amazon | Planaria water |
| Gentamicin Sulfate | Gemini Bio-products | 400-100P | Planaria water |
| Razor blades | Electron Microscopy Sciences | 71970 | Mincing liver |
| Disposable pastry bags-16”, 12 pack | Wilton | Amazon | Liver aliquots |
| 5 mL syringes | BD/VWR | 309647 | Liver aliquots |
| Petri dishes-35mm/60mm | Greiner Bio-One/VWR | 82050-536/82050-544 | |
| Plastic containers (various sizes) | Ziploc | Amazon | Housing planarians in static culture |
| Sodium Azide | Sigma | S2002 | |
| Transfer pipette | Globe Scientific | 138030 | |
| Forceps - Dumont Tweezer, Style 5 | Electron Microscopy Sciences | 72700-D (0203-5-PO) | |
| Triton X-100 | Sigma | T8787 | |
| DAPI | ThermoFisher | 62247 | |
| Streptavidin, Alexa Fluor 488 conjugate | ThermoFisher | S11223 | |
| Glycerol | Fisher BioReagents | BP229-1 |
Riferimenti
- Tanaka, E. M., Reddien, P. W. The cellular basis for animal regeneration. Dev. Cell. 21, 172-185 (2011).
- Tanaka, E. M. The Molecular and Cellular Choreography of Appendage Regeneration. Cell. 165, 1598-1608 (2016).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat. Protoc. 3, 948-954 (2008).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62, 232-240 (2013).
- Smith-Bolton, R. K., Worley, M. I., Kanda, H., Hariharan, I. K. Regenerative growth in Drosophila imaginal discs is regulated by Wingless and Myc. Dev. Cell. 16, 797-809 (2009).
- Smith-Bolton, R. Drosophila Imaginal Discs as a Model of Epithelial Wound Repair and Regeneration. Adv. Wound Care. 5, 251-261 (2016).
- Newmark, P. A., Sánchez Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat. Rev. Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez Alvarado, A. Fundamentals of planarian regeneration. Annu. Rev. Cell Dev. Biol. 20, 725-757 (2004).
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Scimone, M. L., Kravarik, K. M., Lapan, S. W., Reddien, P. W. Neoblast specialization in regeneration of the planarian Schmidtea mediterranea. Stem Cell Reports. 3, 339-352 (2014).
- van Wolfswinkel, J. C., Wagner, D. E., Reddien, P. W. Single-cell analysis reveals functionally distinct classes within the planarian stem cell compartment. Cell Stem Cell. 15, 326-339 (2014).
- Adler, C. E., Seidel, C. W., McKinney, S. A., Sánchez Alvarado, A. Selective amputation of the pharynx identifies a FoxA-dependent regeneration program in planaria. Elife. 3, e02238 (2014).
- Adler, C. E., Sánchez Alvarado, A. PHRED-1 is a divergent neurexin-1 homolog that organizes muscle fibers and patterns organs during regeneration. Dev. Biol. 427, 165-175 (2017).
- Wong, M. C., Martynovsky, M., Schwarzbauer, J. E. Analysis of cell migration using Caenorhabditis elegans as a model system. Methods Mol. Biol. 769, 233-247 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C elegans chemotaxis assay. J. Vis. Exp. , e50069 (2013).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177 (2012).
- Tasaki, J., Uchiyama-Tasaki, C., Rouhana, L. Analysis of Stem Cell Motility In Vivo Based on Immunodetection of Planarian Neoblasts and Tracing of BrdU-Labeled Cells After Partial Irradiation. Methods Mol. Biol. 1365, 323-338 (2016).
- Roberts-Galbraith, R. H., Brubacher, J. L., Newmark, P. A. A functional genomics screen in planarians reveals regulators of whole-brain regeneration. Elife. 5, (2016).
- Arnold, C. P., et al. Pathogenic shifts in endogenous microbiota impede tissue regeneration via distinct activation of TAK1/MKK/p38. Elife. 5, (2016).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- LoCascio, S. A., Lapan, S. W., Reddien, P. W. Eye Absence Does Not Regulate Planarian Stem Cells during Eye Regeneration. Dev. Cell. 40, 381-391 (2017).
- Nishimura, K., et al. Regeneration of dopaminergic neurons after 6-hydroxydopamine-induced lesion in planarian brain. J. Neurochem. 119, 1217-1231 (2011).
- Wilson, D. F., Chance, B. Azide inhibition of mitochondrial electron transport. I. The aerobic steady state of succinate oxidation. Biochim. Biophys. Acta. 131, 421-430 (1967).
- Duncan, H. M., Mackler, B. Electron Transport Systems of Yeast: III. Preparation and properties of cytochrome oxidase. J. Biol. Chem. 241, 1694-1697 (1966).
- Buchan, J. R., Yoon, J. H., Parker, R. Stress-specific composition, assembly and kinetics of stress granules in Saccharomyces cerevisiae. J. Cell Sci. 124, 228-239 (2011).
- Cebrià, F. Organization of the nervous system in the model planarian Schmidtea mediterranea: An immunocytochemical study. Neurosci. Res. 61, 375-384 (2008).
- Shimoyama, S., Inoue, T., Kashima, M., Agata, K. Multiple Neuropeptide-Coding Genes Involved in Planarian Pharynx Extension. Zoolog. Sci. 33, 311-319 (2016).
- Ito, H., Saito, Y., Watanabe, K., Orii, H. Epimorphic regeneration of the distal part of the planarian pharynx. Dev. Genes Evol. 211, 2-9 (2001).
- Bueno, D., Espinosa, L., Baguñà, J., Romero, R. Planarian pharynx regeneration in tail fragments monitored with cell-specific monoclonal antibodies. Dev. Genes Evol. 206, 425-434 (1997).
- Hyman, L. . The invertebrates: Platyhelminthes and Rhynchocoela, the acoelomate Bilateria. , (1951).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon