Method Article
Química la amputación y la regeneración de la faringe en el Planarian Schmidtea mediterranea
En este artículo
Resumen
El planarian Schmidtea mediterranea es un excelente modelo para estudiar las células madre y regeneración de los tejidos. Esta publicación describe un método para eliminar selectivamente un órgano, la faringe, por la observación de animales de la azida de sodio químicos. Este protocolo también describe métodos para el monitoreo de la regeneración de la faringe.
Resumen
Planarias son gusanos planos que son muy eficientes en la regeneración. Deben esta capacidad a un gran número de células madre que pueden responder rápidamente a cualquier tipo de lesión. Modelos de lesiones comunes en estos animales eliminar grandes cantidades de tejido, lo cual daña múltiples órganos. Para superar el daño de tejido amplia, se describe aquí un método para eliminar selectivamente un único órgano, la faringe, en el planarian Schmidtea mediterranea. Logramos esto por los animales remojo en una solución que contiene la azida de sodio inhibidor de la citocromo oxidasa. Breve exposición a azida de sodio provoca la protuberancia de la faringe del animal, que llamamos "química amputación." Química amputación elimina la faringe entera y genera una pequeña herida en la faringe se fija al intestino. Después de lavado amplia, todos los animales amputados regeneran una faringe completamente funcional en aproximadamente una semana. En el resto de la regeneración de la unidad de cuerpo de la faringe nuevas células. Presentamos un detallado protocolo de amputación química y describir los métodos histológicos y de comportamiento para evaluar éxito amputación y regeneración.
Introducción
La regeneración es un fenómeno que ocurre en todo el reino animal, con capacidad regenerativa de la regeneración de todo el cuerpo de ciertos invertebrados a más facultades en vertebrados1. Sustitución de tejido funcional es un proceso complejo y a menudo implica la restauración simultánea de múltiples tipos de células. Por ejemplo regenerar el miembro de Salamandra, osteoblastos, condrocitos, neuronas, músculos y células epiteliales deben ser reemplazado2. Estos tipos de celda recién generado también tiene que organizarse adecuadamente para facilitar la nueva función del miembro. Comprensión de estos procesos complejos requiere de técnicas que se centran en la regeneración de tipos celulares específicos y su integración en órganos.
Una de las estrategias empleadas para simplificar el estudio de la respuesta regenerativa es la ablación dirigida de ciertos tipos celulares o colecciones más grandes de los tejidos. Por ejemplo, en el pez cebra, expresión de nitroreductase en tipos celulares específicos conduce a su destrucción después de la aplicación de metronidazol3,4. En larvas de Drosophila , expresando genes pro-apoptosis en promotores específicos de tejido selectivamente puede ablar regiones específicas del disco imaginal5,6. Dos de estas estrategias dañar rápido pero controlado y han sido utilizados para diseccionar los mecanismos moleculares y celulares para la regeneración.
En este manuscrito, se describe un método para extirpar selectivamente un órgano entero llamado la faringe en el planarian Schmidtea mediterranea. Planarias son un modelo clásico de la regeneración, conocido por su prolífica capacidad regenerativa, donde fragmentos incluso minutos pueden volver a crecer todo animales de 7,8. Tienen una población grande y heterogénea de las células madre de células pluripotentes y progenitores de linaje restringido9,10,11. Estas células proliferan y diferencian para reemplazar todos los tejidos faltantes, incluyendo la faringe, sistemas nerviosos, digestivos y excretorios y músculo y las células epiteliales9,10,12. Si bien sabemos que estas células madre iniciar la regeneración, no comprendemos plenamente los mecanismos moleculares que conducen a sustituir todos estos diferentes tipos de células. Definidos métodos heridos que provocan respuestas precisas células madre pueden ayudar a delinear este complejo proceso.
La faringe es un tubo cilíndrico, grande necesario para la alimentación y contiene neuronas, músculo, células epiteliales y secreción13,29. Normalmente oculto en una bolsa en la parte ventral del animal, se extiende por el cuerpo del animal una apertura sobre la detección de la presencia de alimentos. Para amputar selectivamente la faringe, remojan planarias en un químico llamado sódica, un anestésico utilizado en C. elegans14,15,16. Su uso en planarias primero fue divulgado por Adler et al., en el 201412. A minutos de exposición a la azida sódica, planarias sacan su musculo y con suave agitación, se separa la faringe del animal. Nos referimos a esta pérdida selectiva y completa de la faringe como "amputación química". Una semana después de la amputación, una faringe completamente funcional es restaurado12. Ya que la faringe se requiere para la alimentación, regeneración funcional puede medirse mediante el control de comportamiento de alimentación. A continuación, se describe el protocolo para amputación química y para evaluar la regeneración de la faringe y la restauración del comportamiento alimentario.
Protocolo
1. preparación
-
Preparación de agua de la planaria 17
- Mantener planarias en una solución de sal de X Montjuïc 1. Para preparar el planarian agua, hacer soluciones stock individuales de 1 M CaCl2, 1 M MgSO4, 1 M de MgCl2, 1 M KCl y 5 M de NaCl en agua ultrapura. Filtro-esterilizar con un almacenamiento a largo plazo de la filterfor superior de la botella de 0.2 μm.
Nota: Utilizar sólo agua desionizado ultrapura (con una resistividad de 18,2 MΩ a 25 ° C) para preparar Montjuïc sales. - Para preparar un stock de 1 L de solución salina de 5 X, mezclar 5 mL de 1 M CaCl2, 5 mL de 1 M MgSO4, 0,5 mL de MgCl2, 0.5 mL de KCl y 1,6 mL de soluciones de NaCl de 5 M en 900 mL de agua ultrapura. A esta solución, Añadir 0,504 g de NaHCO3 y revuelva para mezclar. Ajustar el pH a 7.0 con ácido clorhídrico.
- Diluir este 5 X solución madre a un 1 X concentración de trabajo en agua ultrapura en un recipiente estéril como una Damajuana de gran capacidad (véase la Tabla de materiales). Utilice esta solución de X 1 para el mantenimiento de planarias asexuales.
Nota: Como alternativa a la solución de sal de Montjuïc, use agua de manantial local comprado o agua ultrapura que contiene una sal de acuario disponible comercialmente (véase Tabla de materiales) de la mezcla en una concentración of0.5 g/L18. - Para evitar la infección bacteriana en cultura estática19, mantener planarias en agua que contenga un antibiótico. Prepare un 50 mg/mL solución de sulfato de gentamicina en agua ultrapura y esterilizar por el filtro. Contenedores donde se mantienen animales, añadir sulfato de gentamicina a una concentración final de 50 μg/mL (dilución 1: 1000).
- Mantener planarias en una solución de sal de X Montjuïc 1. Para preparar el planarian agua, hacer soluciones stock individuales de 1 M CaCl2, 1 M MgSO4, 1 M de MgCl2, 1 M KCl y 5 M de NaCl en agua ultrapura. Filtro-esterilizar con un almacenamiento a largo plazo de la filterfor superior de la botella de 0.2 μm.
-
Preparación de pasta de hígado
- Como planarias prosperan en una dieta orgánica, alimentada con pasto de carne de vaca hígado, hígado fresco de compra y proceso dentro de 24 horas retire la cápsula membranosa encapsulando el hígado desprendiendo suavemente. Cortar el hígado en cubos de ~ 1 cm y use una hoja para raspar y eliminar todas las arterias y las venas hepáticas.
- Macerar el hígado piezas usando un pasapurés o una batidora y luego pasarlo por un colador de alambre malla de alimentos. Se combinan en bolsas de pasta y dispensan en jeringas o platos de Petri de 35 mm. Antes de la alimentación, centrifugar suavemente para eliminar las burbujas de aire.
- Guardar alícuotas de hígado a-80 ° C por hasta un año y descongelar antes de usar. Después de descongelar, volver a congelar cualquier hígado sobrante una vez, o almacenar a 4 ° C por 24 h.
-
Mantenimiento de los animales
- Planarias se crecen y decrecen en varios tamaños dependiendo de la frecuencia de la alimentación. Alimentación de planarias cada dos semanas (una vez cada 14 días). Para cultivos a largo plazo de a granel, use recipientes de plástico de varios tamaños (véase Tabla de materiales).
- Para alimentar animales, utilice una espátula de metal o pipeta de transferencia plástica para colocar una gota del tamaño de un guisante de hígado en una caja. Permiten animales comer de 1-2 h. retirar la comida que quedaba antes de limpiar la caja.
- Limpiar gusanos dos veces a la semana si (una vez directamente después de la alimentación y una vez dos días más tarde), o una vez por semana si no es alimentado. Para limpiar, drenar el agua en un vaso de plástico por verter con cuidado el agua conservando planarias en el cuadro. Limpie la superficie de la caja con una toalla de papel, luego repetir por todos lados hasta que la caja esté limpia.
- Agua (aproximadamente 3/4 del volumen de caja) y se añade gentamicina a una concentración final de 50 μg/mL. Tienda animales en un gabinete oscuro o en una incubadora de 20 ° C.
-
Selección de gusanos
- Seleccione gusanos que se alimentaron con 5-7 días antes.
Nota: Es significativamente más difícil que amputarle musculo de gusanos que han sido alimentados recientemente (1-2 días antes de la amputación). Animales alimentados también son más sensibles a la azida sódica. - Seleccione gusanos que miden aproximadamente 6 mm de longitud. Para estimar el tamaño del gusano, transfiéralo a un plato de Petri utilizando una pipeta de transferencia plástica. Coloque una regla plana 6 - en o papel cuadriculado de 5 mm x 5 mm por debajo de la caja Petri y medir la longitud de gusano mientras arrastra.
Nota: Gusanos más pequeños de 6 mm de longitud son más difíciles de amputar.
- Seleccione gusanos que se alimentaron con 5-7 días antes.
-
Preparación de la azida de sodio
- Preparar una solución de 100 mM disolviendo polvo de azida de sodio en agua planaria.
PRECAUCIÓN: Azida sódica es tóxica y debe manipularse con cuidado. No se deshaga de azida de sodio por el desagüe. Después de su utilización, recoger por separado para su eliminación como residuos peligrosos.
- Preparar una solución de 100 mM disolviendo polvo de azida de sodio en agua planaria.
2. faringe amputación
- Lugar los gusanos en un diámetro de 35 mm placa de Petri. Retire con cuidado toda el agua planarian del plato utilizando una pipeta de transferencia plástica.
Nota: Un máximo de 20 gusanos de 6 mm puede ser alojado cómodamente en un plato de este tamaño. - Coloque el plato bajo el microscopio y ajustar magnificación para que varios gusanos pueden verse simultáneamente (por ejemplo 10 aumentos). Reemplace planarian agua con solución de azida de sodio 100 mM.
Nota: Para un plato de Petri de 35 mm, aproximadamente 5 mL de azida de sodio es suficiente. La solución debe sumergir completamente planarias. Ajustar el volumen de solución para los platos más grandes según sea necesario. - Monitorear los animales bajo el microscopio y abstenerse de mover el plato para los primeros 3-4 minutos.
- Observar la extrusión de la faringe a través del microscopio; la faringe se sobresale de la bolsa faríngea y extienda completamente (aproximadamente 1 mm de longitud) como se muestra en la figura 1B.
Nota: Es importante esperar hasta que haya terminado la faringe que se extiende completamente antes de continuar. Una vez que el animal se desprende de la faringe, extensión total toma aproximadamente 1 minuto. - Utilice una pipeta de transferencia plástica para squirt animales alrededor del plato. Aspirar los animales en la pipeta y liberarlos por la fuerza en el plato un par de veces. Si la faringe está completamente extendida, este vigoroso uso hará que se suelte.
- Como alternativa, tome la faringe verticalmente a lo largo de su longitud, u horizontalmente a lo largo de su circunferencia usando un par de Pinzas finas (véase Tabla de materiales) como se muestra en la figura 1. La faringe atrapada en las pinzas, levantar el animal hacia arriba hacia el menisco. Mientras que el animal se levanta, tensión superficial hará que la faringe para desprenderse del animal.
Nota: Este método puede utilizarse para eliminar el musculo de animales más pequeños (1-3 mm de longitud) donde se arremolinan contundente no es el adecuado. Evitar meter o herida de lo contrario el cuerpo del animal. - Utilizando una pipeta de transferencia, hacia animales amputados un nuevo plato que contenga agua fresca de la planaria.
- Una vez transferidos, enjuague animales amputados completamente en el agua de la planaria, cambio totalmente el agua tres veces. Traslado a un nuevo plato que contiene agua de planaria con 50 μg/mL de gentamicina.
Nota: Cambio de buffer completo durante estos tres lavados es esencial para asegurar el retiro de azida de sodio. - Al día siguiente, reemplace el agua en el plato con agua fresca planaria 50 μg/ml de gentamicina. Repita todos los días después de eso.
3. evaluación de la eliminación de la faringe después de la amputación
- Examinar los animales bajo el microscopio (con aumentos de 10-20) para determinar si una mancha oscura ha aparecido después de la eliminación exitosa de la faringe, como se muestra en la figura 2A.
- Por otra parte, fijar y bleach animales según el protocolo descrito por Pearson et al. 20. animales de remojo durante la noche en 4', 6-diamidino-2-phenylindole (DAPI) o fluorescente conjugado estreptavidina (1 mg/mL diluido 1: 500 en el 1 X de tampón de fosfato salino que contiene 0.3% Triton-X). Montar animales de diapositivas glycerol/20% 80% 1 X solución salina tamponada de fosfato y la imagen bajo un estereomicroscopio fluorescente (figura 2B).
Nota: Todas las imágenes de este manuscrito fueron capturadas en un estereomicroscopio fluorescente con un objetivo X 1,0.
4. evaluación de la regeneración de la faringe mediante la medición de comportamiento alimentario
-
Preparación de hígado
- Transferir la cantidad necesaria de pasta de hígado en un tubo cónico o microcentrífuga. Girar brevemente para eliminar burbujas de aire. Estimar el volumen del hígado y luego añadir planaria de agua a 1/5 de su volumen y 2% del volumen total de colorante de alimento rojo. Por ejemplo, a 1000 μl de hígado pegar, añadir 200 μL de agua de la planaria y 24 μl de colorante de alimento.
- Con un mortero plástico, pipeta o espátula de metal, mezcle bien hasta que el colorante se distribuya uniformemente la pasta de hígado. Vuelta otra vez brevemente. Pasta de hígado puede ser almacenado a 4 ° C durante 24 h o congelada en alícuotas a-80 ° C para almacenamiento a largo plazo.
- Si la prueba hasta 25 animales, preparar 25 μl de pasta de hígado por plato (aproximadamente 1 μl de pasta de hígado por animal).
-
Alimentación de animales
- Siete días después de la amputación química, transferencia de animales a una nueva placa de Petri. Si pruebas el 10-15 animales, utilizar un plato de 35 mm; más de 15 animales deben analizarse en un plato de Petri de 60 mm. Mantener los animales en la oscuridad, sin perturbaciones, de aproximadamente 1 h antes de la alimentación.
- Usando las tijeras, aumentar el ancho de una punta de pipeta P200 de ajuste aproximadamente 1/2 cm en el extremo estrecho. Pipetear 25 μl de rojo pasta de hígado en el plato.
Nota: Recorte el extremo hace uso la pasta viscosa de hígado más fácil. Para evitar que el hígado flotando en la superficie, toque la punta en la parte inferior del plato mientras. - Permiten animales alimentar durante 30 minutos.
- Anotar el número de animales que han comido por los animales la colocación sobre un fondo blanco o examinarlos bajo un microscopio con aumentos de 10-20.
- Después de alimentar, retirar el plato de hígado y limpiar.
Resultados
Exposición a la azida de sodio altera la motilidad normal de planarias, causando animales y writhe. Estos movimientos la fuerza la faringe de la parte ventral del animal, y después de aproximadamente 6 minutos en solución de azida de sodio, puede verse la punta blanca de la faringe (figura 1B-panel de la izquierda). Unos minutos más tarde, animales activamente contraen y extienden totalmente la faringe empujando con fuerza fuera del cuerpo. (Figura 1B-panel central). Aproximadamente 11 minutos después de la exposición de la azida, los animales y la faringe relajación. En esta etapa, la forma de campana característico de la faringe es visible (figura 1B-panel de la derecha). Para amputación fácil, es importante esperar a que la faringe para relajarse.
Debido a que la faringe es un grande, unpigmented masa de tejido, sacarlo resulta en la aparición de una mancha oscura en el lado dorsal de animales amputados (figura 2A). Esta región oscura es un indicador visual de amputación exitosa en animales vivos. El punto es visible inmediatamente después de la amputación y llega a ser más prominente al día siguiente. Como la faringe se regenera, aclara esta región. Para monitorear la regeneración de la faringe más precisamente, animales pueden ser teñidos con DAPI o fluorescente conjugado estreptavidina durante la noche (figura 2B). Evaluar cuantitativamente el grado de regeneración de la faringe, se puede medir su área utilizando el software ImageJ.
La faringe es un órgano esencial para la ingestión de alimentos y chemosensation. Para determinar cuando estas funciones se restauran durante la regeneración, se utilizan análisis de alimentación para monitorear el comportamiento de los animales. Mediante la combinación de colorante con pasta de hígado, hemos sido capaces de distinguir animales que comían de los que lo hicieron no (Figura 3A). Luego cuantificamos el número de animales rojo para evaluar el porcentaje de animales con una faringe funcional. Basado en los resultados mostrados en la figura 3B, comportamiento de alimentación exitoso fue restaurada 7 días después de la amputación, lo que indica que una semana después del retiro de la faringe, los animales han regenerado una faringe funcional. Para probar si la exposición de azida de sodio afectados alimentación comportamiento, había empapado animales en azida de sodio pero lavar inmediatamente antes de la eyección de la faringe. Un día después, se evaluó si el comportamiento de búsqueda de alimentos fue alterada por la exposición de azida de sodio en el ensayo de alimentación. En contraste con animales químicamente amputada que carece una faringe, manteniendo una faringe intacto después de exposición de azida de sodio se comió todos los animales (n = 30 animales para cada condición) la comida. Este resultado indica que exposición de azida de sodio no afecta el comportamiento de alimentación, como la faringe se mantiene intacta.

Figura 1 . Eyección de la faringe y la amputación. (A) esquema de la anatomía del planarian. (B) imágenes de animales vivos con eyección de faringe a remojo en azida de sodio 100 mM. Flechas rojas destacan faringe. Barras de escala = 750 μm. (C) imagen de animal vivo (izquierda) y esquema (derecha) de amputación con unas pinzas. Los paneles muestran dos diferentes opciones para agarrar la faringe. Parte ventral del animal quede hacia arriba. Barras de escala = 500 μm. haga clic aquí para ver una versión más grande de esta figura.
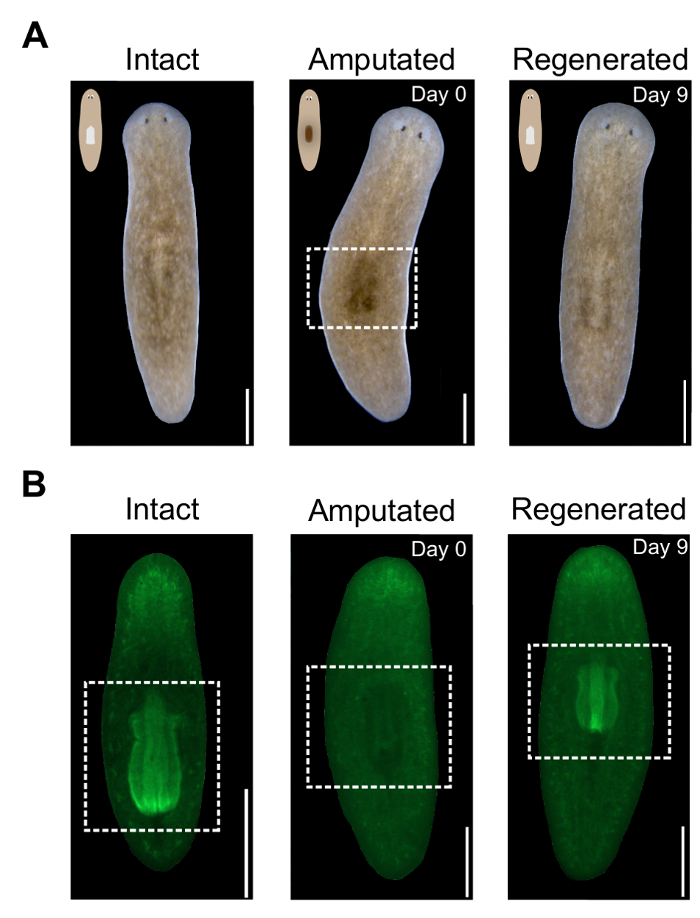
Figura 2 . Evaluación de la amputación de la faringe y regeneración. (A) imágenes representativas de animales vivos en especificado veces antes y después de la amputación. El panel central muestra mancha oscura en la región faríngea después de la amputación, resaltada en caja blanca discontinua. Lado dorsal quede hacia arriba. Barras de escala = 500 μm. (B) imágenes representativas de animales manchados con Alexa488-estreptavidina en especificado veces antes y después de la amputación. El panel central muestra ausencia de faringe después de la amputación. Región faríngea resaltada en caja blanca. Lado ventral quede hacia arriba. Barra de escala = 500 μm. haga clic aquí para ver una versión más grande de esta figura.
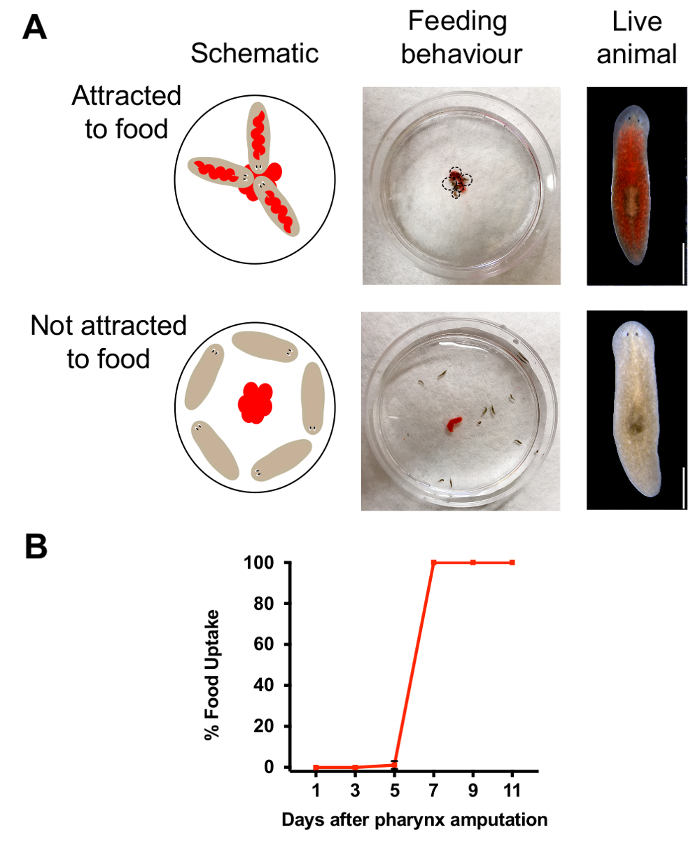
Figura 3. Evaluación de la regeneración de la faringe. (A) imágenes y esquema de análisis, llevado a cabo mediante la colocación de 25 μl de hígado en el centro de un plato de Petri de 60 mm de alimentación. Esquema (arriba, izquierda) y demostración de la imagen (centro) comportamiento de alimentación en animales con musculo intacto. Superior derecha, imagen del animal que ha comido. Esquema (abajo izquierda) e imagen (medio) del comportamiento de alimentación en animales de 1 día después de la amputación. Parte inferior derecha, con animales que no se ha comido. Barra de escala = 750 μm. análisis (B) resultados de la alimentación. Porcentaje de animales que han ingerido alimentos (cuantificada por la coloración roja) en momentos específicos después de la amputación. Para cada punto del tiempo, n = 10 animales, repetidos por triplicado. Barra de error = SD. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe un método de ablación selectiva de la faringe con azida de sodio. Otros estudios de ablación dirigida en planarias han utilizado cirugía modificada para eliminar fotorreceptores21 o tratamiento farmacológico a la ablación de las neuronas dopaminérgicas22. Una ventaja importante de amputación química sobre los métodos existentes es que no requiere cirugía. La estructura rígida de la faringe en comparación con el resto del cuerpo planarian facilita su retiro completo del animal, que es mucho más suave-bodied. Además, la faringe se separa del animal en un pequeño cruce (el esófago)30 a la faringe y el intestino, generando una herida más reproducible que inducida por una herramienta quirúrgica más grande. Basado en sus propiedades físicas y pequeña vinculación anatómica con el resto de los animales, eliminación de faringe por lo tanto genera heridas más homogéneas que otras amputaciones quirúrgicas.
Duración de la exposición a la azida de sodio también es crítico para el éxito de esta técnica. Aunque la exposición breve a la azida sódica no afecta planarias, exposición prolongada es tóxica y eventualmente matará a animales. La azida sódica se sabe para inhibir procesos dependientes de energía a través de la inhibición de la citocromo oxidasa23,24. Además, suprime la transcripción y traducción, probablemente por la acumulación de componentes clave de estas reacciones de estrés gránulos25. En planarias, exposición de azida de sodio suprime mitosis durante 24 h, después de que las células volver a proliferación12. Modificaciones tales como limitar el tiempo de exposición de la azida, quitando azida con un enjuague a fondo y que representa la supresión transitoria de mitotic en diseño experimental pueden ayudar a superan estas limitaciones.
La única posición anatómica de la faringe y su característica simetría radial permiten la fácil distinción del recién regenerado tejido faríngeo de células preexistentes. Regeneración de la faringe puede ser monitoreada a nivel celular y anatómica, con manchas de tejido como la estreptavidina y DAPI, immunohistochemistry, o en situ hibridación26. El ensayo de alimentación descrito aquí ensayos de regeneración funcional de la faringe. Quimiotactismo hacia alimentos requiere la faringe27,28 y animales sin una faringe completamente funcional no pueden ingerir alimentos. Esta evaluación simple, cuantitativa de la función del órgano, por tanto, complementa la regeneración estructural. Además, amputación química puede realizarse en poblaciones de animales y puede generar numerosos animales con lesiones idénticas. El procedimiento es por lo tanto conveniente para estudios a gran escala. Estas ventajas, juntadas con el hecho de que la regeneración de una faringe maduro requiere las células madre, hace que la amputación de la faringe un modelo ideal para estudiar la regeneración de órganos. Utilizado en combinación con amputaciones más amplio, retiro de faringe puede ser utilizado para probar las hipótesis acerca de cómo el tamaño de la herida y posición anatómica impactan la respuesta de la célula de vástago a la lesión, que es una pregunta clave en la regeneración de campo21.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Alejandro Sánchez Alvarado, quien apoyó la optimización inicial y el desarrollo de esta técnica. Trabajo en laboratorio de Carolyn Adler está financiado por fondos de puesta en marcha de la Universidad de Cornell.
Materiales
| Name | Company | Catalog Number | Comments |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Chemical | C79-3 | Montjuïc salt solution |
| Magnesium Sulfate Anhydrous (MgSO4) | Fisher Chemical | M65-3 | Montjuïc salt solution |
| Magnesium Chloride Hexahydrate (MgCl2) | Acros/VWR | 41341-5000 | Montjuïc salt solution |
| Potassium Chloride (KCl) | Acros Organics/VWR | 196770010 | Montjuïc salt solution |
| Sodium Chloride (NaCl) | Acros Organics/VWR | 207790050 | Montjuïc salt solution |
| Sodium Bicarbonate (NaHCO3) | Acros Organics/VWR | 123360010 | Montjuïc salt solution |
| Nalgene autoclavable polypropylene copolymer lowboy with spigot | ThermoFisher Scientific/VWR | 2324-0015 | Storing planaria water |
| Instant Ocean Sea Salt | Spectrum Brands | Amazon | Planaria water |
| Gentamicin Sulfate | Gemini Bio-products | 400-100P | Planaria water |
| Razor blades | Electron Microscopy Sciences | 71970 | Mincing liver |
| Disposable pastry bags-16”, 12 pack | Wilton | Amazon | Liver aliquots |
| 5 mL syringes | BD/VWR | 309647 | Liver aliquots |
| Petri dishes-35mm/60mm | Greiner Bio-One/VWR | 82050-536/82050-544 | |
| Plastic containers (various sizes) | Ziploc | Amazon | Housing planarians in static culture |
| Sodium Azide | Sigma | S2002 | |
| Transfer pipette | Globe Scientific | 138030 | |
| Forceps - Dumont Tweezer, Style 5 | Electron Microscopy Sciences | 72700-D (0203-5-PO) | |
| Triton X-100 | Sigma | T8787 | |
| DAPI | ThermoFisher | 62247 | |
| Streptavidin, Alexa Fluor 488 conjugate | ThermoFisher | S11223 | |
| Glycerol | Fisher BioReagents | BP229-1 |
Referencias
- Tanaka, E. M., Reddien, P. W. The cellular basis for animal regeneration. Dev. Cell. 21, 172-185 (2011).
- Tanaka, E. M. The Molecular and Cellular Choreography of Appendage Regeneration. Cell. 165, 1598-1608 (2016).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat. Protoc. 3, 948-954 (2008).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62, 232-240 (2013).
- Smith-Bolton, R. K., Worley, M. I., Kanda, H., Hariharan, I. K. Regenerative growth in Drosophila imaginal discs is regulated by Wingless and Myc. Dev. Cell. 16, 797-809 (2009).
- Smith-Bolton, R. Drosophila Imaginal Discs as a Model of Epithelial Wound Repair and Regeneration. Adv. Wound Care. 5, 251-261 (2016).
- Newmark, P. A., Sánchez Alvarado, A. Not your father's planarian: a classic model enters the era of functional genomics. Nat. Rev. Genet. 3, 210-219 (2002).
- Reddien, P. W., Sánchez Alvarado, A. Fundamentals of planarian regeneration. Annu. Rev. Cell Dev. Biol. 20, 725-757 (2004).
- Wagner, D. E., Wang, I. E., Reddien, P. W. Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration. Science. 332, 811-816 (2011).
- Scimone, M. L., Kravarik, K. M., Lapan, S. W., Reddien, P. W. Neoblast specialization in regeneration of the planarian Schmidtea mediterranea. Stem Cell Reports. 3, 339-352 (2014).
- van Wolfswinkel, J. C., Wagner, D. E., Reddien, P. W. Single-cell analysis reveals functionally distinct classes within the planarian stem cell compartment. Cell Stem Cell. 15, 326-339 (2014).
- Adler, C. E., Seidel, C. W., McKinney, S. A., Sánchez Alvarado, A. Selective amputation of the pharynx identifies a FoxA-dependent regeneration program in planaria. Elife. 3, e02238 (2014).
- Adler, C. E., Sánchez Alvarado, A. PHRED-1 is a divergent neurexin-1 homolog that organizes muscle fibers and patterns organs during regeneration. Dev. Biol. 427, 165-175 (2017).
- Wong, M. C., Martynovsky, M., Schwarzbauer, J. E. Analysis of cell migration using Caenorhabditis elegans as a model system. Methods Mol. Biol. 769, 233-247 (2011).
- Margie, O., Palmer, C., Chin-Sang, I. C elegans chemotaxis assay. J. Vis. Exp. , e50069 (2013).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177 (2012).
- Tasaki, J., Uchiyama-Tasaki, C., Rouhana, L. Analysis of Stem Cell Motility In Vivo Based on Immunodetection of Planarian Neoblasts and Tracing of BrdU-Labeled Cells After Partial Irradiation. Methods Mol. Biol. 1365, 323-338 (2016).
- Roberts-Galbraith, R. H., Brubacher, J. L., Newmark, P. A. A functional genomics screen in planarians reveals regulators of whole-brain regeneration. Elife. 5, (2016).
- Arnold, C. P., et al. Pathogenic shifts in endogenous microbiota impede tissue regeneration via distinct activation of TAK1/MKK/p38. Elife. 5, (2016).
- Pearson, B. J., et al. Formaldehyde-based whole-mount in situ hybridization method for planarians. Dev. Dyn. 238, 443-450 (2009).
- LoCascio, S. A., Lapan, S. W., Reddien, P. W. Eye Absence Does Not Regulate Planarian Stem Cells during Eye Regeneration. Dev. Cell. 40, 381-391 (2017).
- Nishimura, K., et al. Regeneration of dopaminergic neurons after 6-hydroxydopamine-induced lesion in planarian brain. J. Neurochem. 119, 1217-1231 (2011).
- Wilson, D. F., Chance, B. Azide inhibition of mitochondrial electron transport. I. The aerobic steady state of succinate oxidation. Biochim. Biophys. Acta. 131, 421-430 (1967).
- Duncan, H. M., Mackler, B. Electron Transport Systems of Yeast: III. Preparation and properties of cytochrome oxidase. J. Biol. Chem. 241, 1694-1697 (1966).
- Buchan, J. R., Yoon, J. H., Parker, R. Stress-specific composition, assembly and kinetics of stress granules in Saccharomyces cerevisiae. J. Cell Sci. 124, 228-239 (2011).
- Cebrià, F. Organization of the nervous system in the model planarian Schmidtea mediterranea: An immunocytochemical study. Neurosci. Res. 61, 375-384 (2008).
- Shimoyama, S., Inoue, T., Kashima, M., Agata, K. Multiple Neuropeptide-Coding Genes Involved in Planarian Pharynx Extension. Zoolog. Sci. 33, 311-319 (2016).
- Ito, H., Saito, Y., Watanabe, K., Orii, H. Epimorphic regeneration of the distal part of the planarian pharynx. Dev. Genes Evol. 211, 2-9 (2001).
- Bueno, D., Espinosa, L., Baguñà, J., Romero, R. Planarian pharynx regeneration in tail fragments monitored with cell-specific monoclonal antibodies. Dev. Genes Evol. 206, 425-434 (1997).
- Hyman, L. . The invertebrates: Platyhelminthes and Rhynchocoela, the acoelomate Bilateria. , (1951).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados