Method Article
Deneysel aspergilloz akciğer mantar yükünü belirlemek için histolojik miktar
Bu Makalede
Özet
Burada tarif biz miktar histolojik bölümlerde boyama Gomori'nın değiştirilmiş methanamine gümüş tarafından invazif aspergillosis ile farelerde akciğer mantar yükünü belirlemek için bir iletişim kuralı. Bu yöntemin kullanılması için mantar yükünün değerlendirmesi akciğer mantar DNA kantitatif PCR ile karşılaştırıldığında daha az hayvan ile karşılaştırılabilir sonuçlarında sonuçlandı.
Özet
Akciğer mantar yükünün miktar göreli düzeyde bağışıklık koruma ve fare modelleri akciğer mantar enfeksiyonu, mantar virülans belirlenmesi için önemlidir. Birden çok yöntem mantar yük değerlendirmek için kullanılmasına rağmen nicel Polimeraz zincir reaksiyonu (qPCR) Mantar DNA'ın bir teknik önceki kültür tabanlı yöntemleri çeşitli avantajlar ile ortaya çıkmıştır. Şu anda, kapsamlı bir değerlendirme akciğer patoloji, lökosit işe alım, mantar yük ve gen ekspresyonu ile invazif aspergillosis (IA) farelerde deneysel önemli sayıda ve denetim hayvanlar kullanımını gerektirir. Burada akciğer mantar yük hayvanları azaltılmış bir dizi kullanarak belirlemek için boyama histolojik miktar ayrıntılı olarak incelenmiştir. Akciğer bölümleri boyama mantar yapıları ile Gomori'nın değiştirilmiş methanamine gümüş (GMS) tanımlamak için lekeli. Görüntüleri GMS lekeli bölümlerini her formalin sabit parafin gömülü akciğer 4 ayrı alanlarda alındı. Her görüntü içindeki alanların lekeli GMS bir görüntü analiz programı kullanarak sayısal ve bu miktar ortalama yüzdesini lekeli alan her örnek için tespit edildi. IA ile vahşi tipi fareler caspofungin ile geliştirmek değil iken bu stratejiyi kullanarak, eozinofil eksikliği fareler sergilenen mantar yük ve hastalığı caspofungin terapisiyle azalmıştır. Benzer şekilde, mantar yük farelerde γδ T hücreleri eksik da bir gelişme caspofungin tarafından qPCR ve GMS miktar tarafından ölçülen. GMS miktar bu nedenle sonuçta deneysel hayvan invazif aspergillosis kapsamlı çalışmalar için gerekli miktarı azaltabilir, göreli akciğer mantar yükünün belirlenmesi için bir yöntemi olarak tanıttı.
Giriş
IA konjenital veya edinsel bağışıklık eksiklikleri nedeniyle immün süpresif tedavi veya kronik enfeksiyon1,2ile duyarlı bireylerde gelişebilir bir fırsatçı enfeksiyon var. Birincil enfeksiyonu genelde akciğerlerde, bazı örnekleri yayılması Aspergillus fumigatus rağmen karaciğer, böbrekler, kalp için ortaya çıkan ve ağır hastalıklar ve yüksek eşliğinde hif geniş doku işgali kaynaklanan beyin oluşabilir oranları ölüm1,2. Ayrıca, varolan sağaltımı etkinliği sınırlıdır ve daha fazla çevre3antifungal dirençli suşların ortaya çıkması tarafından zayıflamış. Bu nedenle gelişmesini teşvik mekanizmaları mantar virülans ve ana patoloji veya alevlenmesi invazif mantar hastalığı anlamak önemlidir.
Araştırmacılar mantar virülans genlerin rol değerlendirmek ve kuruluş ve gelişmesi A. fumigatus içinde vivo4,5için bağışıklık effectors ev sahibi izin olarak fare modelleri mekanik IA çalışmaları için önemli kalır. Sonuç olarak, çoklu stratejiler etkili bir şekilde ölçmek veya mantar yükünü gruplar halinde deneysel hayvan6,7karşılaştırmak için taktığı. Bu stratejileri kültür tabanlı, biyokimyasal, immunoassay veya qPCR yöntemleri, her biri farklı avantajları ve dezavantajları dahil. Ayrıca, bu yöntemlerin her biri bir alt hayvanlar için bağışıklık efektör işlevi, gen ifade analizi ve karşılaştırmalı histopatoloji7değerlendirme feda ek olarak özveri gerektirir. Böylece, kapsamlı IA çalışmalar genellikle önemli bir maliyetle araştırma hayvanların önemli sayıda gerektirir. Deneysel zaman, hayvan maliyeti ve etik kaygılar birden çok analizleri için hayvan dokuları kullanarak azaltmak etkili stratejiler bu nedenle son derece değerli7vardır.
Bu raporda, farelerin IA ile deneysel grupları arasında göreli mantar yükünün histolojik bölümlerde karşılaştırma için boyama GMS miktar bir yöntem tanıttı. Mantar kültürü her adımından enfeksiyon, doku hasat ve işleme ve resim alma ve veri analizi, ayrıntılı olarak açıklanmıştır. Mantar yükleri GMS miktar tarafından elde edilen qPCR Nötropenik modelleri Ia ve IA8ile vahşi-türü veya eozinofil eksikliği fareler caspofungin tedavi ile karşılaştırıldı. Sonuçlar GMS miktar ve mantar DNA'ın qPCR ile benzerlik gösterir. Bu GMS miktar karşılaştırma IA ile farelerde göreli mantar yükünün tamamlayıcı ya da alternatif bir yöntem olarak histolojik analizler yapan araştırmacılar için yararlı olabilir ve sonuçta araştırma hayvanlarda kullanımı ve maliyetini azaltabilir göstermektedir karmaşık, mekanik çalışmalar.
Protokol
Tüm hayvan yordamları hayvan bakım ve Indiana State University kullanım Komitesi Ana Kampüs Indiana Üniversitesi Tıp Fakültesi tarafından kabul edildi — Terre Haute.
1. enfeksiyon için A. fumigatus Conidia hazırlanması
- İyi havalandırılmış duman mahallede çalışırken, A. fumigatus 293 hisse senedi çözüm 125 µL 900 µL hücre kültür sınıf su (CCGW) ekleyin. O zaman çözüm malt özü agar (MEA) plaka pipet ile ve inoculating bir döngü ile eşit yayılmış transferi.
- Mantar plaka 24 ° c en az 14 gün için ve en fazla 28 gün karanlıkta saklamak.
- Cam boncuk yukarıda açıklanan9olarak kullanarak conidia hasat.
- 0.5 mm 1,5 g cam boncuk plaka üzerine dökün ve boncuk conidia ayıklamak için kaplı kadar yavaşça ileri geri tilt. 15 mL konik tüp boncuk/conidia karışımı toplamak. 5 mL Dulbecco'nın fosfat tamponlu tuz çözeltisi (DPBS) ve girdap askıya alma.
- 50 x seyreltme süpernatant bir hemasitometre kullanarak DPBS, conidia saymak. Conidia şekil 1 ' de gösterilen alanda saymak ve Denklem 1 konsantrasyon hesaplamak için kullanın.
#Conidia × seyreltme faktörü × 104Conidia/mL (Denklem 1) =
Not: Ek 4 x 4 kare köşe alanlarda, Denklem 1' #Conidia olarak kullanılan bu alanların ortalamaya sahip sayılması.
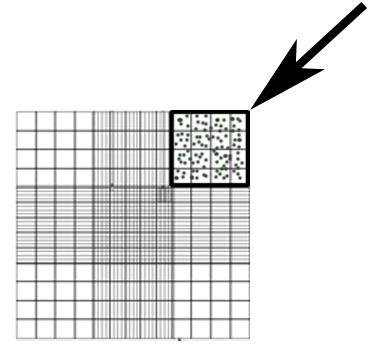
Resim 1: sayma conidia için kullanılan hemasitometre temsilcisi alanı (kutusu, ok).
- Conidia süspansiyon ile steril serum fizyolojik (DPBS) istenen konsantrasyon, 1.0 x 108 conidia/mL conidia çözüm 5 x 106 conidia/50 µL. hazırlamak 50 µL ile enfeksiyon için edinme başına seyreltik 'n + pipetting için hesabına bulaşması için 2' fareler bir hata oluştu.
Not: Standart mantar hasat ve hazırlık/filtrasyon alternatif olarak kullanılan10olabilir. Cam boncuk yöntemi en iyi conidia örnekleri çok az küçük/çözünür hyphal antijenleri ile aspirasyon için elde edilen sağlamak için kullanılır.
2. immünosupresyon ve enfeksiyon fare modeli
- 7-10-hafta-yaşlı fareler kullanın.
Not: BALB/c, C57BL/6 (B6), eozinofil eksikliği (ΔdblGATA, BALB/c arka plan) ve γδ T hücre-eksik (TCRδ-/-, B6 arka plan) fareler bu çalışma için kullanılmıştır. Her deneme, yaş ve cinsiyet uyumlu (kadın ve erkek) fareler her grup için kullanılmıştır. - Nötrofil üzerinden mayi (IP) enjeksiyon 0.1 mL (0.5 mg) anti-mouse-Ly - 6 G antikor 45 ° yanal alt sağ bölümündeki steril serum fizyolojik içinde tüketmek (deneysel bir program için bkz: Şekil 2).
- 24 saat sonra aspirasyon ile 5.0 x 106A. fumigatus conidia 50 askıya tarafından fareler bulaştırmak µL steril serum fizyolojik (2.4-2,10 adımlara bakın) daha önce açıklandığı gibi11. Enfeksiyon, aşağıdaki gibi 5 mg/kg caspofungin diacetate DPBS bu çalışmada kullanılan antifungal ajan ile bir alt hayvanların enjekte (günlük, bkz: Şekil 2).
- Fareler bir veteriner anestezi makine kullanarak % 99.9 isoflurane ile anestezi.
- Dışkı ve idrar yakalamak için indüksiyon odası katta bir kağıt havlu koyun.
- İndüksiyon odasında fareyi getirin, kapağı güvenli ve 2 dk ve %30 5 isoflurane Buharlaştırıcı ayarlamak s.
Not: anestezi altında toplam süre daha az 5 dk olduğundan veteriner merhem kullanılır. - Maksimum ayar 30 yarısı Buharlaştırıcı azaltmak s.
- Onaylamak fare düzgün gözlemleyerek anestezi nefes, hareket eksikliği ve yanıt-e doğru ayak parmağı-çimdik uyaran eksikliği yavaşladı.
- İndüksiyon odası ve bir eğik tahtada yer fareyi kaldırın. Fare ile sırtını tahta karşı koyun. Onun üst kesici dişler yavaşça bir lastik bant ile sınırlanmıştır ve alt kesici yavaşça bir metal tel ile ölçülü olun.
- Dikkatle dil tam uzantısı'küçük forseps ve pipet 50 µL conidia/PBS süspansiyon dilin temelini tutarsınız.
- Dil tam uzatma tutun; Hızlı solunum ve aspirasyon farklı sesi dinle. 20 için tutun s veya süspansiyon tam emişli kadar.
- Fare çekik tahta çıkarmak ve gözlem için bir kafes içinde yavaşça yerleştirin.
- Aspirasyon fareyi bilinç içinde 1 dk. monitör fare tamamen bilinçli ve güçlü-e doğru belgili tanımlık kafes yürümek kadar geri. Hayvanlar 21 ° C'de yer alan ve akciğerleri hasat kadar günde iki kez izlenen.
- Nötrofil (Adım 2.2) 24 saat sonrası enfeksiyon (Şekil 2) tükenmesi yineleyin.

Şekil 2: deneysel programı. Bu rakam bir önceki yayın8güncellenmiştir.
3. hasat ve fare akciğerler korunması histolojik analizler için
- Derin 390 mg/ml Fentobarbital sodyum çözüm IP 0.1 ml ölümcül bir doz hayvanla anestezi.
- Ötenazi spontan solunum yetersizliği ve yanıt-e doğru bacak stimülasyon yokluğu cımbızla gözlemleyerek onaylayın. Bir kez ötenazi, karkas sterilize etmek için % 70 etanol ile sprey.
- Karkas emici bir yastık ile kaplı bir köpük tahta yerleştirin.
Not: Karkas sırtında köpük kuruluna tüm dört bacaklarda güvenliğini sağlama pimleri ile yer almalıdır. - Dikkatle makas kullanarak üst göğüs boşluğu açın. Göğüs kafesi akciğer ve kalp ortaya çıkarmak için sadece... kes gitsin. Perfüzyon için izin vermek için inferior vena kava kesti. Kan damarları kesme ve delme organları kaçının.
- Yavaş yavaş ile 5 mL soğuk DPBS 45 ° açıyla kalbin sağ ventrikül içinde de 25-G iğne ile sıvı. 5 mL ile perfüzyon % 10 formalin, tekrarlayın.
- Dikkatle Trakea açığa ve çevresindeki yağ yastıkları bağlantısını kesin. Dikkatli olun ve nefes borusu delinme kaçının. Aşırı bağ dokusu tamamen devam etmeden önce Trakea görselleştirmek için kaldırılır emin olun. Trakea maruz kez forseps bu yükseltmesine Trakea altında yerleştirin.
- 25-G iğne kullanarak üst Trakea küçük bir delik poke.
Not: tüm kanül borusunda sığması delik yerleştirilmiş olmalıdır. Trakea parçalanma önlemek için dikkatli olun. - Bir kanül delikten ve akciğerlere doğru yerleştirin. Kanül Trakea gevşek bağlı bir cerrahi iplik ile güvenli.
Not: Eğer nefes borusu patladı, kanül Trakea hava yolu mümkün olduğunca geçmiş takýlý olabilir. - Bir Ģırınga kullanarak, 1 mL % 10 formalin arabelleği kanül ile akciğerlere şişirmek. Akciğerleri enflasyon görünür olduğundan emin olun. Eğer değilse, kateter ayarlamak ve tekrarlayın. Bir zamanlar ciğerler şişirilir, hızlı bir şekilde kanül dikkatle çıkarın ve güvenli bir şekilde nefes borusu mühürlemek için iş parçacığı sıkın.
Not: Trakea yırtıldı ve akciğerleri şişirmek, ciğerler hala hasat ama bu uygun fiksasyon engelleyebilir. - Yavaşça nefes borusu ve akciğerler göğüs dikkatle Trakea bağ dokusu Forseps ile hafifçe yukarı çekerek iş parçacığında ederken keserek çıkarın. Akciğerler ve nefes borusu 50 mL konik tüp ile 15 mL % 10 formalin arabelleği yerleştirin. İş parçacığı tüp dışında bir ucunu yerleştirin ve kapağı kapatın. Tamamen sabitleştirici örnekte daldırın tüp tersine çevirin.
- Örnekleri, oda sıcaklığında en az 24 saat veya daha fazla işlem kadar saklayın.
Uyarı: Formalin zararlıdır. Uygun kişisel koruyucu gözlük ve yüz maskesi dahil olmak üzere donanım giymek. Kimyasal bir başlık altında işleme örnekleri çalışır.
4. hasat ve fare akciğerler korunması için DNA mantar yük
- 3.1-3.5 üzerinde ayrı bir fare yukarıda açıklandığı gibi adımları.
- Yavaş yavaş soğuk DPBS 45 ° açıyla kalbin sağ ventrikül içinde 10 mL ile 25-G iğne ile sıvı.
- Akciğerleri makasla tüketim ve etiketli 1,5 mL tüpler içinde yer.
- Akciğer-80 ° C'de daha fazla işleme kadar saklayın.
- Standart teknikleri (gömme ve kesit) açıklandığı gibi ve üreticinin iletişim kuralları ( Tablo malzemelerigörmek) göre kullanın.
5. mikroskobu ve görüntüleme
- Görüntü miktar programında açın (bkz. Tablo malzeme).
- Hafif bir mikroskop kullanarak, farklı alanlarında en az 4: slayt (10 X amaç) lekeli GMS elde edilir. Görüntüleri benzer doku yoğunluğu ile akciğer içinde virüslü airways temsilcisi olduğundan emin olun.
Not: yoğunluk ve hyphal foci dağıtımını kontrol ve deneysel grupları arasında belirgin farklı görünüyorsa, ek alanlar alınabilir veya GMS alan tüm akciğer bölümün yansıma (4 X amaç). Arzu edilirse Hematoksilen ve Eozin, lekeli bir seri akciğer bölümünde (eşdeğer doku Morfoloji tarafından tanımlanan) akciğer aynı alanlarda görüntüleri elde edilir. - Gerektiğinde resimlere ölçek çubukları ekleme ve sayısal için görüntüleri kaydedebilirsiniz. Seçin, Düzenle > Ekle/Düzenle kalibrasyon işaretleri > menü: çizgi kalınlığı, rengi ve ölçek çubuğu boyutu seçin > ölçek çubuğu yerleştirilir nerede için resmin üzerine tıklayın. Menüyü kapatmak ve seçin, Düzenle > birleştirme > kalibrasyon işaretleri birleştirme > dosya farklı kaydet seçin > dosyayı adlandırın ve tıkırtı üstünde kurtarmak.
6. mantar yük (şekil 3) hesaplamak için bir görüntü işleme programı kullanma
- Bir görüntü işleme programı açın. Dosyayı seçin > Klasör ölçmek için örnekleri ile > görüntü (şekil 3A). Görüntü seçin > türü > "RGB yığınına" (şekil 3B) dönüştürmek.
- Üç belirli görüntüleri (şekil 3B) ikinci seçmek için sağ ok tuşunu kullanın. Vurmak "CTRL + ÜST KARAKTER + T" "Eşik" menü ayarları erişimiz (şekil 3 c) getirmek için. Bir referans olarak orijinal .tiff veya .jpg görüntü bulun ve programı (şekil 3 c) ile ilgilenen bir görüntü ile açın.
- Üst kaydırıcıyı sonuna kadar sola doğru çekin ve (kırmızı) seçili alanı (genellikle 130-160 (şekil 3 c) kaydırıcıyı sağa belirtildiği şekilde değişen. mikroskobu görüntüsünün temsilcisidir kadar alt kaydırıcıyı ayarlayın
- Bir kez seçme, "Set" tuşuna basın > "Tamam" (şekil 3D). "Analiz" seçin > "Set ölçümleri" > "Alan, alan kesir, eşik, görüntü etiketini sınırla" kontrol ve alt ayarları (damla-aşağı yemek listesi ve ondalık basamak) varsayılan bırakın > "Tamam" (şekil 3D).
- Boşluk veya arka plan boyama önemli alanlarında uygun doku bir alan veya çokgen aracıyla seçime göre atlanabilir.
- Son olarak seçin "Analiz" > "Ölçü" (verileri içeren bir pencere belirmelidir veya etiketli, "Sonuçlar" windows görev çubuğu sekmesinde görünür) (şekil 3E). Grafik için veri analiz programı verileri aktarmak ve istatistiksel analiz.
- Dört alan yüzdeleri ortalaması her akciğer örnek için girin. 5-8 örnekleri gruplar arasında önemli farklılıklar tespit etmek genellikle yeterlidir. İki deneysel grup karşılaştırarak, gerçekleştirin unpaired bir öğrenci t-testi önemini belirlemek için.

Şekil 3: temsilcisi ekran GMS histolojik her adımı için alan miktar. (A)dosyasını Seç > Klasör ölçmek için örnekleri ile > select görüntü. (B) görüntü Seç > türü > "RGB yığıta" dönüştürmek. İkinci üç belirli görüntülerin seçmek için sağ ok tuşunu kullanın. (C) Hit "CTRL + ÜST KARAKTER + T" "Eşik" menü ayarları erişimiz getirmek için. Bir referans olarak orijinal .tiff veya .jpg görüntü bulun ve fotoğraf Görüntüleyici programı ile açın. Üst kaydırıcıyı sonuna kadar yaptı ve (kırmızı) seçili alanı (genellikle 130-160 belirtildiği şekilde kaydırıcıyı sağa ranging. mikroskobu görüntüsünün temsilcisidir kadar alt kaydırıcıyı ayarlayın çekin (Bir kez seçilen basın "koymak"D) > "Tamam". "Analiz" seçin > "Set ölçümleri" > "Alan, alan kesir, eşik, görüntü etiketini sınırla" kontrol ve alt ayarları (damla-aşağı yemek listesi ve ondalık basamak) varsayılan bırakın > "Tamam". (E) son olarak seçin "analiz" > "Ölçü" (verileri içeren bir pencere belirmelidir veya etiketli "Sonuçlar" windows görev çubuğu sekmesinde görünür). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
7. DNA mantar yük
- Akciğer-80 ° C'den kaldırmak ve en az 4 h için lyophilize (gecede en iyi yöntemdir) veya kadar tamamen kuru bir dondurma kuru sistem tarafından.
- Akciğerleri kurutma iken, DNA ekstraksiyon arabellek (0.1 M NaCl, 10 mM EDTA pH 8.0, 10 mM Tris HCl pH 8.0 ve % 0,5 SDS) hazırlayın.
- Hazırlanan DNA ekstraksiyon arabellek önceden ısıtmak için bir 60 ° C su banyosunda yerleştirin. Ayrıca, fenol yerleştirin: kloroform: izoamil alkol (25:24:1) bir 50 mL konik tüp ve ayrılması için izin verir.
- Lyophilized akciğer 0.2 mL cam boncuk ile 2 mL vidalı kapak tüp yerleştirin. İnce bir toz oluşturur kadar bir boncuk çırpıcı kullanarak, Kuru Akciğer doku 15-30 s için eziyet.
- 0.8 mL sıcak DNA ekstraksiyon arabellek her tüp ve girdap de ekleyin. Her tüpün 15dk bir 65 ° C boncuk banyo ve sonra girdap için ek bir 15dk için kuluçka önce kuluçkaya. Kuluçka sonra girdap ve sonra santrifüj tüpleri 25.000 x g 10 min için de.
- 1.5 mL tüpler 3 set her örnekleri için etiket ve süpernatant üst tabakası tüpler bir dizi içine aktarın. Sulu üst tabaka pipetting Orta tabaka rahatsız edici önlemek için dikkatli olun.
- Fenol: kloroform: izoamil alkol eşit miktarda ekleyin ve iyice karıştırın. Sonra 15 dk için 25.000 x g de üst katmanı tüpler ikinci kümesi pipetting önce santrifüj kapasitesi.
- Kloroform: izoamil kloroform eşit miktarda ekleyin, karıştırın ve 25.000 x g 10 dk. dikkatle pipet üst katmana dışarı için de tüpler üçüncü seti santrifüj kapasitesi.
- 500 eklemek isopropanol µL ve 50 µL NaoAc (pH 5.2), mix iyi ve 10 dakika oda sıcaklığında kuluçkaya örnekleri sağlar. 25.000 x g 30 dk için de santrifüj kapasitesi ve süpernatant dikkatle boşaltmak.
- DNA Pelet 750 µL buz soğuk % 70 etanol ve 5 min için santrifüj ile 25.000 x g. Decant etanol yıkama ve 40 min için bir duman davlumbaz tüplerde hava için granül Makinası izin.
- Kuru granül TE arabellek 300 µL içinde resuspend.
Not: DNA-20 ° C de sayısal kadar depolanabilir. - DNA bir Spektrofotometre kullanarak ölçmek ve 0.2 µg/µL her DNA örneğinin 100 µL qPCR analiz için hazırlanın.
- Standart qPCR DNA örneği, mantar 18S rDNA astar, 1 µg ile daha önce açıklanan nüsha gerçekleştirmek ve sonda ayarlar değiştirilmiş sonda içki ile (5'- / 56-FAM/AGC CAG CGG/ZEN/CCC GCA AAT G/3IABkFQ /-3')12,13.
- Standart bir eğri A. fumigatus genomik DNA'sı hazırlamak ve pg mantar DNA toplama her hesapla ortalama muhabiri kullanarak örnek Ct değerleri boya.
- Standart hata ortalamaya ile pg/µg mantar DNA'ın arsa. Öğrenci'nin tgerçekleştirmek-test önemini belirlemek için analizi.
Not: olarak daha az toksik alternatif burada kullanılan fenol kloroform DNA ekstraksiyon için sütun temel DNA ekstraksiyon kitleri-ebilmek var olmak kullanılmış.
Sonuçlar
Şekil 4 vahşi türünün hayatta kalma bir grafik içeriyorsa veya eozinofil eksikliği fareler IA ile caspofungin ile tedavi. Eozinofil eksikliği fareler vahşi tipi fareler için karşılaştırıldığında artan hayatta kalma sergilenen sonuçlar gösterir (% 50 mortalite % 100 ölüm karşı sırasıyla). Şekil 5 Nötropenik boyama temsilcisi GMS vahşi-türü gösterilir ve eozinofil eksikliği fareler IA ile tedavi veya caspofungin ile tedavi edilmezse. Göreli mantar geçiş izni eozinofil eksikliği, farelerde değil vahşi-tip (doğru panelleri) ama Caspofungin tedavi sonucunda, almadım her iki grup caspofungin benzer (sol kapı aynası). Şekil 6 caspofungin tedavi mantar yük karşılaştırmasını gösterir ve tedavi edilmezse vahşi-türü veya eozinofil eksikliği fare kontrol, 4 (10 X amaç) Miktar alanı (her iki qPCR mantar DNA (6A rakam) ve temsilcisi GMS kullanma Şekil 6B). Her iki teknikleri oluşturulan sonuçların caspofungin tedavi sonuçlarında en önemli mantar yük vahşi tipi ve eozinofil eksikliği fareler (şekil 6A) arasında azaltmak göster. Ancak, tedavi edilmemiş farelerde, eozinofil (şekil 6B) eksik fareler önemli bir azalma sadece GMS miktar sonuçlandı. Ne zaman GMS lekeli bütün akciğer bölümlerinin ortalama alan hesaplanan (4 X amaç), farklılıklar vardı benzer 4 temsilcisi 10 X alanları ile elde edilen sonuçlar ile daha az istatistiksel anlamlılık rağmen (şekil 6C). Şekil 7 hayatta kalma, temsilcisi GMS boyama (4 10 X alanları) görüntülerini ve miktar mantar yükünün caspofungin ile karşılaştırıldığında kontrol ile tedavi edildi, farelerde tedavi edilmezse T hücre-eksik (TCRδKO) fareler γδ tarafından her iki yöntem gösterir. Caspofungin tedavi hayatta kalma (şekil 7A) ve mantar yük (şekil 7B-D) TCRδKO farelerde geliştirilmiş. Şekil 6sonuçlarına, mantar yükünün sonuçları GMS miktar (şekil 7C) qPCR (şekil 7B) ve temsilcisi tarafından ölçülen karşılaştırılabilir benzerdi.
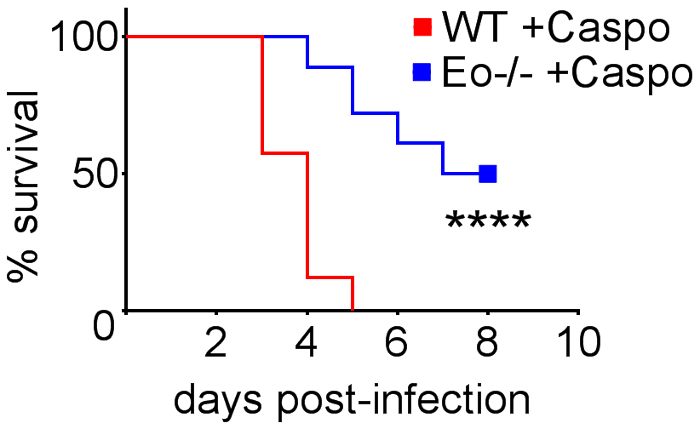
Şekil 4: artan eozinofil eksikliği (ΔdblGATA) farelerde IA ile hayatta kalma caspofungin ile tedavi sonrası. 15-30 fareler/grup. 3-6 deneyler özetini. p < 0,0001. Bu rakam bir önceki yayın8güncellenmiştir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
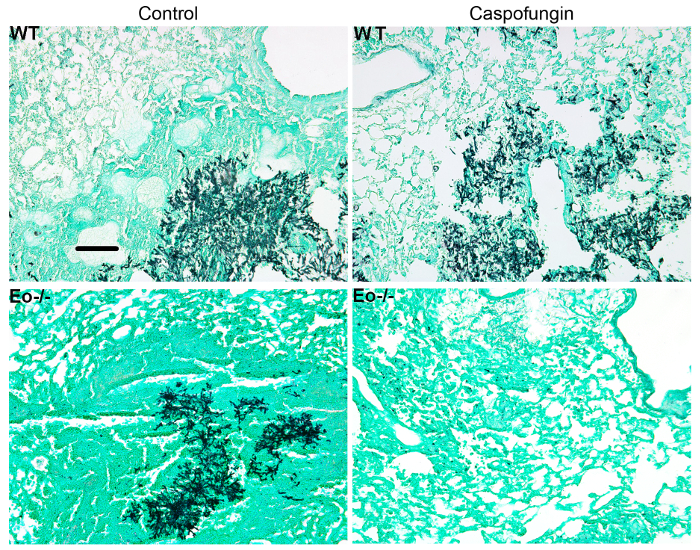
Şekil 5: vahşi-türü, eozinofil eksik ve caspofungin tedavi veya denetim GMS lekeli akciğer bölümlerinin temsilcisi görüntüleri tedavi edilmezse fare IA. ile 3-4 fareler/grup temsilcisi. Ölçek çubuğu için 100 µm eşdeğerdir. Bu rakam bir önceki yayın8güncellenmiştir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 6: mantar yük vahşi-tip eozinofil eksikliği farelerde tedavi IA veya denetim ile tedavi ile caspofungin. Mantar DNA'ın(a)qPCR. 15-30 fareler/grup, 3-6 deney Özet. (B) GMS miktar ortalama % 4 alanlardan (10 x amaç) Boyama GMS histolojik bölümlerinin. (C) GMS miktar, ortalama % tüm akciğer bölümün (4 X amaç). B ve C 5 fare/grup bir özeti vardır. p < 0.05. p < 0,001. p < 0,0001. Bu rakam bir önceki yayın8' rapor edilmiştir verileri kullanarak oluşturulmuştur. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
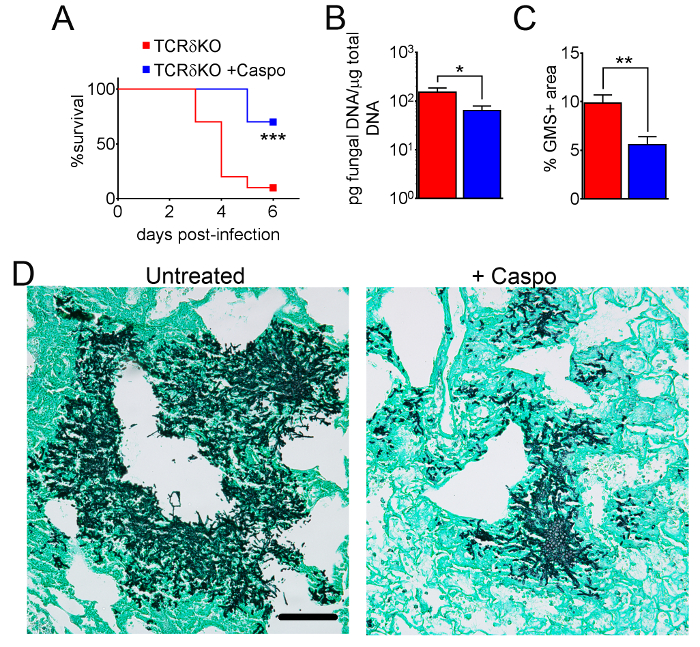
Şekil 7: γδ T hücre eksikliği farelerde IA önem caspofungin tedaviden sonra azaldı. (A) hayatta kalma. Mantar DNA'ın (B) qPCR. Histoloji (C) GMS miktar. γδ T hücreleri ile IA, işlenmiş veya işlenmemiş ile caspofungin GMS lekeli bölümlerin (D) temsilcisi görüntüleri. A ve B iki deney 7-10 fareler/grup ile bir özeti vardır. C ve D 4 fareler/grup bir özeti vardır. p < 0.05. p < 0,01. p < 0,001. Bu rakam bir önceki yayın8güncellenmiştir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Bu makalenin amacı, IA ile farelerde akciğer mantar yükünün belirlenmesi için bir yöntem görüntü analizi ve miktar GMS lekeli akciğer histolojik bölümleri kullanarak tanıtmak oldu. Bu çalışmada, tedavi ile beta-glukan-sentez-hedefleme antifungal ilaç caspofungin14 hayatta kalma ya da mantar yük IA8ile Nötropenik vahşi tipi farelerde geliştirmek mi değil. Ancak, eozinofil veya γδ T hücreleri yokluğunda, hayatta kalma ve mantar yük geliştirilmiş. Bizim çalışmanın sonuçlarını da benzer sonuçlar GMS mantar yük yaygın olarak kullanılan mantar DNA qPCR yöntem6ile karşılaştırıldığında elde gösterdi.
GMS mantar yük miktar kullanmak için birçok faydası vardır. İlk olarak, işlem varolan histolojik örnekleri, böylece potansiyel olarak deneyler önemli farkları belirlemek için gerekli sayısını azaltarak kullanabilir. İkinci olarak, bu çalışmada, daha az hayvan GMS mantar yük miktar qPCR mantar DNA (şekil 6, Şekil 7) göre önemli farklılıklar elde etmek için gerekli idi. Üçüncü olarak, karşılaştırma qPCR tarafından farklı yalıtır mantar yükünün ribozomal DNA kopyalama sayı15farklılıkları izole bağımlı tarafından etkilenebilir. Buna ek olarak, mantar yük akciğer mantar büyüme göreli düzeyleri tarafından belirlendiği şekilde GMS miktar kopya numarası tarafından etkilenmez. Böylece, mantar yük için GMS miktar kullanımını omurgalı hayvanlar kullanımını azaltır ve öncesi rDNA kopya numarası tayini gerektirmez. Son olarak, üstelik fungal Morfoloji değiştirebilirsiniz, caspofungin terapi mantar parçalanma artırır ve böylece yapay akciğer homogenates12,16 koloni oluşturan birimlerin yalıtım tarafından ölçülen zaman mantar yükü artırabilir ,17. Böylece, GMS miktar mantar yükünün diğer sık kullanılan yöntemler ile bazı sınırlamaları doğasında önler.
Ancak, GMS miktar ve/veya bu çalışma sınırlamaları unutmayın. İlk olarak, yazarlar her deney grubu hyphal büyüme akciğerlere boyunca karşılaştırılabilir bir dağıtım kabul ve böylece miktar 4 temsilcisi 10 üzerinden tüm akciğer mantar yük için temsili bir ölçüyü objektif alanlar kullanılmış (Şekil 6B). Mantar yük qPCR yöntemi tarafından bu yöntem ve eşdeğer ile farklı görünür böylece bazı durumlarda göreli dağıtım, boyutu ve yoğunluğu hyphal foci yeterince farklı olacaktır ki mümkündür. Ancak, ek sonuçlarımız 4 X objektif alanları kullanarak tüm akciğer bölümüne miktar ile daha az gruplar (şekil 6C) arasında istatistiksel olarak anlamlı farklılıklar olsa benzer, gösterdi. Bu miktar standart hatası büyük olasılıkla nedeniyle azalmış hyphal çözünürlük 4 X amaç ve artan arka planda suboptimal alanları ile bu strateji ile artış olmuştur. Bu nedenle, daha az alan yüksek büyütmede temsilcisi bir miktar tercih edilir. İkinci olarak, yalnızca bir tek, Merkezi bölümü her örnek için kullanıldı. Mümkün, mantar yalıtır dayalı veya fareler suşları kullanıldığında, bazı çalışmalarda hyphal büyüme düzensiz bir dağılım içinde neden olabilir. Bu durumlarda, ek bölümleri her parafin blok boyunca daha temsili bir yük almak için sayısal. Üçüncü olarak, (Yani, sayısal hava yolu mantar büyüme Alerjik Bronkopulmoner aspergilloz (Hastalarını)18 veya Kistik fibrozis (CF)18), mucins GMS reaktivite ile önemli üretimini teşvik deneylerde polisakkarit zengini mucins19 non-spesifik GMS + sonuçlar ve böylece daha yüksek mantar yük lehine bazı örnekler çarpık. Sadece Nötropenik model IA bu çalışmada kullanılan bu yana, diğer bağışıklık baskılayıcı veya yetkili modellerinin kullanımı sonuçlarında az karşılaştırılabilir sonuçlar olabilir mümkündür. Bu uyarılar rağmen GMS miktar mantar yükünü belirlemek için karşılaştırılabilir bir tekniği sağlar ve sürekli kullanımı ile ek çalışmalar daha da tutarlı, güvenilir ve düşük maliyetli olarak bu yöntemin yarar doğrulamak.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu çalışmada kısmen tarafından bir Indiana Üniversitesi okul tıp araştırma geliştirme Grant'ın ve NIH NIAID 1R03AI122127-01 tarafından desteklenmiştir. N.A. kısmen bu dönemde İmmünoloji bursu bir kariyer üzerinden Immunologists Amerikan Derneği tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aspergillus fumigatus 293 Stock Solution | Fungal Genetics Stock Center | FGSC #A1100 | |
| HyPure Cell Culture Grade Water | Thermo Fisher Scientific | SH30529.03 | |
| Malt Extract | MP Biomedicals | 2155315 | White Powder |
| BD BBL Acidicase Dehydrated Culture Media: Peptone | Fisher Scientific | L11843 | |
| Dextrose (D-Glucose) Anhydrous (Granular Powder/Certified ACS) | Fisher Scientific | D16-3 | |
| Fisher BioReagents Agar, Powder / Flakes, Fisher BioReagents | Fisher Scientific | BP1423-500 | |
| Auto Dry Cabinet | Shanghai Hasuc Instrument Manufacture Co.,LTD | HSFC160FD | |
| 1300 Series Class II, Type A2 Biological Safety Cabinet | Thermo Fisher Scientific | 1375 | |
| 0.5 mm Glass Beads | BioSpec Products | 11079105 | |
| 15 ml Conical Tubes | Thermo Fisher Scientific | 339650 | |
| Hemacytometer | Fisher Scientific | # 0267110 | |
| Leica Model DME Microscope | Leica | 13595XXX | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8662-500 ml | |
| 1.5 ml tubes | Fisher Scientific | # 05-408-129 | |
| BD Precisionglide syringe needles, gauge 27, L 1/2 in. | Sigma-Aldrich | Z192384 | |
| Anti-mouse-Ly-6G antibody | BioXCell | BP0075-1 | Clone 1A8 |
| Caspofungin diacetate | Sigma-Aldrich | SML0425 | |
| Isoflurane | Henry Schein Animal Health | 1169567762 | |
| Non-Rebreathing Table Top Veterinary Anesthesia Machine | Supera Anesthesia Innovations | M3000 | |
| Pureline Oxygen Concentrator | Supera Anesthesia Innovations | OC8000 | |
| Slant Board Restraint | Indiana State University Facilities Management | Custom made | |
| Gilson PIPETMAN Classic 200 ml Pipets | Fisher Scientific | F123601G | |
| Pentobarbital Sodium (Fatal-Plus) | Vortech Pharmaceuticals | 0298-9373-68 | |
| General-Purpose Broad-Tipped Forceps | Fisher Scientific | 10-300 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | |
| Fisherbrand General-Purpose Curved Forceps | Fisher Scientific | 10-275 | |
| Ethyl Alcohol-200 Proof | PHARMCO-AAPER | 111000200 | |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-63 | |
| BD Precisionglide syringe needles, gauge 25, L 1 in. | Fisher Scientific | Z192406 | |
| All-Plastic Norm-Ject Syringes | Fisher Scientific | 14-817-30 | |
| IV CATH ANGIOCATH 22GX1GIN 50B | Fisher Scientific | NC9742754 | |
| Formalin Solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | |
| 50 ml Conical Tubes | Thermo Fisher Scientific | 339652 | |
| Thermo Scientific Shandon Embedding Cassettes II in Tube Packs | Fisher Scientific | B1000729 | |
| Fisherfinest Histoplast Paraffin Wax | Fisher Scientific | 22-900-700 | |
| Disposable Base Molds | Fisher Scientific | 22-363-554 | |
| Reichert Jung Histocut 820 Microtome | Labequip.com | 31930 | |
| Water Bath | Precision Scientific | 66630-23 | |
| CO2 Incubator | Fisher Scientific | 116875H | |
| Silver Stain (Modified GMS) Kit | Sigma-Aldrich | HT100A-1KT | |
| Fast Green FCF | Fisher Scientific | AC410530250 | |
| Frosted Microscope Slides | Fisher Scientific | 12-550-343 | |
| Fisherfinest Superslip Cover Glass | Fisher Scientific | 12-545-89 | |
| Cytoseal XYL | Fisher Scientific | 22-050-262 | |
| Olympus Provis AX70 Microscope | Olympus | OLYMPUS-AX70 | |
| U-PHOTO Universal Photo System | Olympus | OLYMPUS-U-PHOTO | |
| U-MCB-2 MULTI CONTROL BOX | Olympus | OLYMPUS-U-MCB-2 | |
| U-PS POWER SUPPLY UNIT | Olympus | OLYMPUS-U-PS | |
| FreeZone 1 Liter Benchtop Freeze Dry System | LABCONCO | 7740020 | |
| Maxima C Plus Vacuum Pump | Fisher Scientific | 01-257-80 | Displacement- 6.1 cfm |
| 1-Butanol | Fisher Scientific | A383-4 | |
| AMRESCO PHENOL-CHLORFORM-OSOAMYL 100ML DFS | Fisher Scientific | NC9573988 | |
| Free-Standing Microcentrifuge Tubes with Screw Caps | Fisher Scientific | # 02-682-557 | |
| Mini-Beadbeater-24 | BioSpec Products | 112011 | |
| BioSpec ProductsSupplier Diversity Partner 2.3 MM ZIRCONIA BEADS | Fisher Scientific | NC0451999 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-1 | |
| Hydrochloric Acid, Certified ACS Plus | Fisher Scientific | A144S | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Sodium Dodecyl Sulfate (SDS), White Powder, Electrophoresis | Fisher Scientific | BP166 | |
| Chloroform/isoamyl alcohol 24:1 | Fisher Scientific | AC327155000 | |
| Biotek Epoch Microplate Spectrophotometer | Fisher Scientific | 11-120-570 | |
| Thermo Scientific™ ABsolute Blue qPCR Mixes | Fisher Scientific | AB4137A | |
| Hybridization Probe, 5′-FAM-AGCCAGCGGCCCGCAAATG-TAMRA-3′ | Integrated DNA Technologies | N/A | |
| Sense Amplification Primer, 5′-GGCCCTTAAATAGCCCGGT-3′ | Integrated DNA Technologies | N/A | |
| Antisense Amplification Primer, 5′-TGAGCCGATAGTCCCCCTAA-3′ | Integrated DNA Technologies | N/A | |
| Applied Biosystems™ MicroAmp™ Optical 8-Tube Strip, 0.2mL | Fisher Scientific | 43-165-67 | |
| Thermo Scientific Domed and Flat PCR Cap Strips | Fisher Scientific | AB-0386 | |
| Mx3005P QPCR System, 110 Volt | Agilent | 401443 | Stratagene is now owned by Agilent |
| BALB/c mice | The Jackson Laboratory | 000651 | |
| C57BL/6 (B6) mice | The Jackson Laboratory | 000664 | |
| Eosinophil-deficient (ΔdblGATA, BALB/c background) mice | The Jackson Laboratory | 005653 | |
| γδ T cell-deficient (TCRδ-/-, B6 background) mice | The Jackson Laboratory | 002120 | |
| ImageJ Software | National Institutes of Health | N/A | https://imagej.nih.gov/ij/ |
| Spot Advanced Software | Spot Imaging | SPOT53A | http://www.spotimaging.com/software/spot-advanced/ |
| GraphPad Prism 6 | GraphPad Software | N/A | https://www.graphpad.com/scientific-software/prism/ |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-62 | |
| Step 4.5 | http://www.bdbiosciences.com/sg/resources/protocols/paraffin_sections.jsp ; https://www-jove-com.remotexs.ntu.edu.sg/science-education/5039 ; http://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/General_Information/1/ht100.pdf |
Referanslar
- Hohl, T. M., Feldmesser, M. Aspergillus fumigatus: principles of pathogenesis and host defense. Eukaryot Cell. 6 (11), 1953-1963 (2007).
- Kwon-Chung, K. J., Sugui, J. A. Aspergillus fumigatus--what makes the species a ubiquitous human fungal pathogen?. PLoS Pathog. 9 (12), e1003743 (2013).
- Ostrosky-Zeichner, L., Casadevall, A., Galgiani, J. N., Odds, F. C., Rex, J. H. An insight into the antifungal pipeline: selected new molecules and beyond. Nat Rev Drug Discov. 9 (9), 719-727 (2010).
- Desoubeaux, G., Cray, C. Rodent Models of Invasive Aspergillosis due to Aspergillus fumigatus: Still a Long Path toward Standardization. Front Microbiol. 8, 841 (2017).
- Hohl, T. M. Overview of vertebrate animal models of fungal infection. J Immunol Methods. 410, 100-112 (2014).
- Sheppard, D. C., et al. Comparison of three methodologies for the determination of pulmonary fungal burden in experimental murine aspergillosis. Clin Microbiol Infect. 12 (4), 376-380 (2006).
- Patterson, T. F. The future of animal models of invasive aspergillosis. Med Mycol. 43 Suppl 1, S115-S119 (2005).
- Amarsaikhan, N., et al. Caspofungin Increases Fungal Chitin and Eosinophil and gammadelta T Cell-Dependent Pathology in Invasive Aspergillosis. J Immunol. 199 (2), 624-632 (2017).
- Templeton, S. P., Buskirk, A. D., Law, B., Green, B. J., Beezhold, D. H. Role of germination in murine airway CD8+ T-cell responses to Aspergillus conidia. PLoS One. 6 (4), e18777 (2011).
- Brunel, S. F., et al. Live Imaging of Antifungal Activity by Human Primary Neutrophils and Monocytes in Response to A. fumigatus. J Vis Exp. (122), (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Bowman, J. C., et al. Quantitative PCR assay to measure Aspergillus fumigatus burden in a murine model of disseminated aspergillosis: demonstration of efficacy of caspofungin acetate. Antimicrob Agents Chemother. 45 (12), 3474-3481 (2001).
- Li, H., et al. The small GTPase RacA mediates intracellular reactive oxygen species production, polarized growth, and virulence in the human fungal pathogen Aspergillus fumigatus. Eukaryot Cell. 10 (2), 174-186 (2011).
- Sucher, A. J., Chahine, E. B., Balcer, H. E. Echinocandins: the newest class of antifungals. Ann Pharmacother. 43 (10), 1647-1657 (2009).
- Herrera, M. L., Vallor, A. C., Gelfond, J. A., Patterson, T. F., Wickes, B. L. Strain-dependent variation in 18S ribosomal DNA Copy numbers in Aspergillus fumigatus. J Clin Microbiol. 47 (5), 1325-1332 (2009).
- Kirkpatrick, W. R., Perea, S., Coco, B. J., Patterson, T. F. Efficacy of caspofungin alone and in combination with voriconazole in a Guinea pig model of invasive aspergillosis. Antimicrob Agents Chemother. 46 (8), 2564-2568 (2002).
- Petraitiene, R., et al. Antifungal efficacy of caspofungin (MK-0991) in experimental pulmonary aspergillosis in persistently neutropenic rabbits: pharmacokinetics, drug disposition, and relationship to galactomannan antigenemia. Antimicrob Agents Chemother. 46 (1), 12-23 (2002).
- Cowley, A. C., Thornton, D. J., Denning, D. W., Horsley, A. Aspergillosis and the role of mucins in cystic fibrosis. Pediatr Pulmonol. 52 (4), 548-555 (2017).
- Taylor, M. J., et al. Detection of fungal organisms in eosinophilic mucin using a fluorescein-labeled chitin-specific binding protein. Otolaryngol Head Neck Surg. 127 (5), 377-383 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır