Method Article
Histologique Quantification pour déterminer la charge fongiques dans les poumons dans l’aspergillose expérimentale
Dans cet article
Résumé
Nous décrivons ici un protocole visant à déterminer les poids de fongiques pulmonaires chez les souris présentant l’aspergillose invasive par quantification de mis à jour le méthanamine coloration à l’argent de Gomori dans les coupes histologiques. Utilisation de cette méthode aboutit à des résultats comparables avec moins animaux par rapport à l’évaluation du fardeau fongique par PCR quantitative de l’ADN fongique de poumon.
Résumé
La quantification de la charge fongiques dans les poumons est essentielle pour déterminer les niveaux relatifs de protection immunitaire et virulence fongique dans des modèles murins de Mycose pulmonaire. Bien que plusieurs méthodes sont utilisées pour évaluer la charge fongique, réaction en chaîne par polymérase quantitative (qPCR) d’ADN est devenue une technique avec plusieurs avantages par rapport aux méthodes précédentes basée sur l’élevage. Actuellement, une évaluation globale de la pathologie pulmonaire, le recrutement des leucocytes, fardeau fongique et l’expression des gènes chez les souris présentant l’aspergillose invasive (IA) nécessite l’utilisation d’un nombre important d’expérimentales et des animaux témoins. Ici, la quantification du poumon histologique de coloration pour déterminer la charge fongique en utilisant un nombre réduit d’animaux a été étudiée en détail. Sections du poumon ont été colorées afin d’identifier les structures fongiques avec de l’argent de mis à jour le méthanamine de Gomori (GMS) de coloration. Images ont été prises des sections colorées GMS de 4 champs discrets de chaque poumon de paraffine fixés au formol. Les GMS teintés de zones au sein de chaque image ont été quantifiés à l’aide d’un programme d’analyse image, et de cette quantification, le pourcentage moyen de la zone tachée a été déterminé pour chaque échantillon. En utilisant cette stratégie, souris déficientes en éosinophiles exposées diminué fardeau fongique et la maladie avec la thérapie de la caspofungine, tandis que les souris de type sauvage avec IA ne s’améliorait pas avec la caspofungine. De même, fardeau fongique chez les souris dépourvues de cellules de T de γδ ont été également améliorées par caspofungine, telle que mesurée par qPCR et quantification de la GMS. Quantification de la GMS est donc présentée comme une méthode pour la détermination du fardeau fongique relative dans les poumons qui peut-être réduire la quantité d’animaux de laboratoire requis pour les études approfondies de l’aspergillose invasive.
Introduction
IA est une infection opportuniste qui peut se développer chez les personnes sensibles, atteints d’une déficience immunitaire congénital ou acquis en raison de système immunitaire suppressif ou infection chronique1,2. Souvent une infection primaire se produit dans les poumons, bien que dans certains diffusion d’instances d’Aspergillus fumigatus de foie, reins, coeur et cerveau peut se produire, entraînant invasion tissulaire étendue d’hyphes accompagnée d’une maladie grave et haute taux de mortalité de1,2. En outre, l’efficacité des pharmacothérapies existants est limitée et peut être encore affaiblie par l’émergence de souches résistantes aux antifongiques dans l’environnement3. Il est donc important de comprendre les mécanismes de la pathologie fongique de virulence et de la foule qui encouragent le développement ou l’aggravation des maladies fongiques invasives.
Les modèles murins demeurent importantes pour les études mécanistiques de IA, car elles permettent aux chercheurs d’évaluer les rôles des gènes de virulence fongique et accueillir des effecteurs immunitaires pour l’établissement et la croissance d’a. fumigatus in vivo4,5. En conséquence, plusieurs stratégies ont été conçues afin de quantifier ou comparer fardeau fongique dans les groupes d’animaux de laboratoire6,7efficacement. Ces stratégies impliquent immunologique basée sur l’élevage, biochimique, ou qPCR méthodes, chacune avec des inconvénients et des avantages distincts. En outre, chacune de ces méthodes impliquent la dédicace d’un sous-ensemble des animaux en plus de ceux sacrifiés à des évaluations de la fonction immunitaire effectrice, analyse de l’expression génique et histopathologie comparative7. Ainsi, des études approfondies de IA nécessitent souvent un nombre important d’animaux de la recherche à un coût considérable. Des stratégies efficaces qui réduisent les temps expérimental, animaux frais et considérations éthiques en utilisant des tissus animaux pour analyses multiples sont donc extrêmement précieux7.
Dans le présent rapport, on introduit une méthode décrivant la quantification des GMS de coloration dans les coupes histologiques de comparaison du fardeau fongique relatif des groupes expérimentaux de souris avec IA. Chaque étape de culture fongique infection, récolte de tissus et traitement et acquisition d’images et analyse des données, est décrite en détail. Fongiques charges obtenus par quantification de GMS ont été comparés à qPCR neutropéniques modèles de IA et caspofungine sauvage ou éosinophiles déficients chez les souris traitées avec IA8. Les résultats montrent la similitude avec la quantification de la GMS et qPCR d’ADN. Cela suggère que la quantification de la GMS peut être utile pour les chercheurs engagés dans les analyses histologiques comme une méthode complémentaire ou alternative de comparaison du fardeau fongique relatif chez les souris avec IA et peut réduire le coût et l’utilisation des animaux de recherche en études complexes et mécanistes.
Protocole
Toutes les procédures d’animaux ont été approuvées par le Comité utilisation of Indiana State University, le campus de l’hôte de l’Indiana University School of Medicine et animalier — Terre Haute.
1. préparation des conidies d’a. fumigatus d’Infection
- Tout en travaillant sous une hotte ventilée, ajouter 125 µL de la solution mère de a. fumigatus 293 à 900 µL la culture qualité d’eau cellulaire (CCGW). Puis transférer la solution pour l’extrait de gélose (MEA) par l’intermédiaire de pipette de malt et de répartir uniformément avec une boucle d’inoculation.
- Stocker la plaque fongique dans l’obscurité à 24 ° C pendant au moins 14 jours et pas plus de 28 jours.
- Les conidies de récolte à l’aide de perles de verre comme précédemment décrit9.
- Versez 1,5 g de 0,5 mm, perles de verre sur la plaque et incliner délicatement en arrière jusqu'à ce que les perles soient enduites afin d’en extraire les conidies. Recueillir le mélange de perle/conidies dans un tube conique de 15 mL. Suspension dans une solution saline tamponnée au phosphate (SPD) et les vortex de 5 mL Dulbecco.
- Compter les conidies dans une dilution de 50 x de surnageant dans le SPD utilisant un hémocytomètre. Compter le nombre de conidies dans la zone indiquée à la Figure 1 et 1 équation permet de calculer la concentration.
Facteur de dilution × #Conidia × 10,4= conidies/mL (équation 1)
Remarque : Des zones de coin carré 4x4 supplémentaires peuvent être comptés, avec la moyenne de ces zones utilisées comme #Conidia dans l’équation 1.
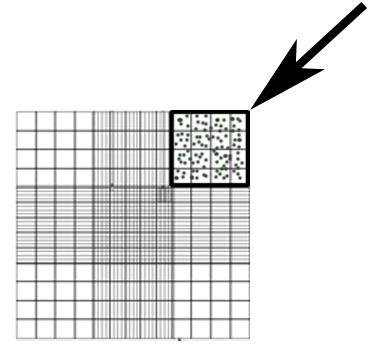
Figure 1 : Hémocytomètre aire utilisée pour compter les conidies (boîte, flèche).
- Diluer la suspension de conidies avec du sérum physiologique stérile (SPD) pour obtenir la concentration désirée, 1,0 x 108 conidies/mL pour l’infection avec 5 x 106 conidies/50 µL. préparer 50 µL de solution de conidies par ' n + 2' souris infectées pour tenir compte de pipetage erreur.
Remarque : Récolte de champignon Standard et la préparation/filtration peuvent être alternativement utilisé10. La méthode de perle de verre est mieux utilisée pour s’assurer que les échantillons de conidies avec des antigènes des hyphes petit/soluble minimes sont obtenus pour aspiration.
2. immunosuppression et Infection du modèle murin
- Utilisez la souris 7-10-week-old.
NOTE : BALB/c, C57BL/6 (B6), éosinophile déficient (ΔdblGATA, fond de souris BALB/c) et des lymphocytes T γδ déficient (TCRδ-/-, fond B6) souris ont été utilisés pour cette étude. Car chacun expérimenter, âge et sexe assortie souris (mâles et femelles) ont été utilisés pour chaque groupe. - Appauvrissent les neutrophiles via intrapéritonéale (IP) injection de 0,1 mL (0,5 mg) d’anticorps anti-mouse-Ly - 6G dans du sérum physiologique stérile à 45° dans le quadrant inférieur droit latéral (pour une planification expérimentale, voir Figure 2).
- 24 h plus tard, infecter les souris par aspiration avec 5.0 x 106a. fumigatus conidies en suspension dans 50 sérum physiologique stérile µL (voir étapes 2.4-2.10) tel que décrit précédemment11. Suite à une infection, injecter un sous-ensemble des animaux avec un agent antifongique comme diacétate caspofungine 5 mg/kg dans le SPD utilisée dans cette étude (tous les jours, voir Figure 2).
- Anesthésier souris avec 99,9 % isoflurane, à l’aide d’une machine d’anesthésie vétérinaire.
- Placer une serviette en papier sur le plancher de la chambre de l’induction pour attraper les excréments et l’urine.
- Placez votre souris dans la chambre de l’induction, fixez le couvercle et affectez le vaporisateur isoflurane 5 % pendant 2 min et 30 s.
NOTE : Pommade vétérinaire n’est pas utilisé parce que le temps total sous anesthésie est inférieur à 5 min. - Réduire le vaporisateur à la moitié de la mise maximale pendant 30 s.
- Confirmer que la souris est correctement anesthésiée en observant a ralenti à respirer, manque de mouvement et absence de réponse au stimulus de l’orteil-pincée.
- Retirer la souris de la chambre de l’induction et la place sur une planche de pente. Placez votre souris avec le dos contre le Conseil d’administration. S’assurer que ses incisives supérieures sont légèrement retenus par un élastique et les incisives inférieures sont légèrement retenus par un fil métallique.
- Soigneusement tenir la langue en pleine extension avec petites pinces et prélever 50 µL de suspension de conidies/PBS à la base de la langue.
- Tenir la langue en pleine extension ; Attendez la respiration rapide et le bruit de cliquetis distinct d’aspiration. Pendant 20 s ou jusqu'à ce que la suspension est entièrement aspirée.
- Retirer la souris de la carte de la pente et placer délicatement dans une cage pour l’observation.
- Après l’aspiration, la souris devrait reprendre conscience dans 1 min. surveiller la souris jusqu'à ce que pleinement conscient et capable de marcher autour de la cage. Les animaux devraient être logés à 21 ° C et contrôlés deux fois par jour jusqu'à ce que les poumons sont récoltés.
- Répétez l’appauvrissement de l’infection après 24h neutrophiles (étape 2.2) (Figure 2).

Figure 2 : annexe expérimentale. Ce chiffre a été modifié depuis une précédente publication8.
3. la récolte et la conservation des poumons de souris pour faire une analyse histologique
- Profondément anesthésier l’animal avec une dose fatale de 0,1 ml de pentobarbital sodique de 390 mg/ml solution IP.
- Confirmer l’euthanasie en observant l’absence de respiration spontanée et de réponse à la stimulation de la branche avec des pincettes. Une fois euthanasiés, vaporiser la carcasse d’éthanol à 70 % pour stériliser.
- Placez la carcasse sur une planche de mousse recouverte d’un tampon absorbant.
Remarque : La carcasse doit être placée sur le dos avec des épingles, sécurisation des quatre membres à la Commission de la mousse. - Ouvrir la cage thoracique supérieure à l’aide de ciseaux avec prudence. Découper la cage thoracique afin d’exposer les poumons et le cœur. Couper la veine cave inférieure pour permettre la perfusion. Évitez de couper les vaisseaux sanguins et de perforer les organes.
- Lentement perfuse avec 5 mL de froid SPD dans le ventricule droit du cœur à un angle de 45° avec une aiguille 25 G. Répétez la perfusion avec 5 mL de formol 10 %.
- Avec précaution, exposer la trachée et détacher les coussinets adipeux environnants. Soyez prudent et éviter la ponction de la trachée. Assurez-vous de que retirer l’excès du tissu conjonctif afin de visualiser entièrement la trachée avant de continuer. Une fois que la trachée affleure, placer la pince dans la trachée à élever.
- Piquez un petit trou dans la trachée supérieure à l’aide d’une aiguille 25 G.
Remarque : Le trou doit être placé de sorte que la canule toute s’inscrit dans la trachée. Soyez prudent afin d’éviter une rupture de la trachée. - Insérer une canule dans le trou et vers les poumons. Fixer la canule avec un fil chirurgical noué lâchement autour de la trachée.
Remarque : Si la trachée est rompue, la canule peut être insérée après la trachée aussi loin que possible dans les voies respiratoires. - À l’aide d’une seringue, gonfler les poumons avec 1 mL de tampon de formol 10 % grâce à la canule. Veiller à ce que l’inflation des poumons est visible. Si ce n’est pas le cas, ajustez le cathéter et répéter. Une fois que les poumons sont gonflés, rapidement retirer la canule avec prudence et serrer le fil fermement pour assurer l’étanchéité de la trachée.
NOTE : Si est rompue la trachée et les poumons ne peuvent pas être gonflés, les poumons peuvent encore être récoltés, mais cela peut empêcher la fixation correcte. - Retirez délicatement la trachée et les poumons de la poitrine en retirant soigneusement le tissu conjonctif de la trachée avec une pince tout en tirant doucement sur le fil. Placer les poumons et la trachée dans un tube conique de 50 mL avec 15 mL de tampon de 10 % de formol. Placez une extrémité du fil à l’extérieur du tube et sceller le bouchon. Il faut inverser le tube pour submerger complètement l’échantillon dans le fixateur.
- Stocker les échantillons à la température ambiante pendant au moins 24 heures ou jusqu'à ce que la poursuite de la procédure.
Mise en garde : Formol est dangereux. Porter des équipements de protection individuelle appropriés, y compris des lunettes et un masque facial. Travailler sous une hotte chimique lors du traitement des échantillons.
4. la récolte et la conservation des poumons de souris pour ADN fongique fardeau
- Suivez les étapes 3.1-3.5 comme décrit ci-dessus sur une souris distincte.
- Lentement perfuse avec 10 mL de froid SPD dans le ventricule droit du cœur à un angle de 45° avec une aiguille 25 G.
- Exciser les poumons avec des ciseaux et placer en tubes étiquetés 1,5 mL.
- Stocker les poumons à-80 ° C jusqu'à ce que la poursuite de la procédure.
- Utiliser des techniques standards telle que décrite (enrobage et découpe) et selon les protocoles du fabricant (voir Table des matières).
5. microscopie et imagerie
- Ouvrez le programme d’imagerie de quantification (voir Table des matières).
- À l’aide d’un microscope optique, obtenir au moins 4 domaines distincts des GMS, teintés de diapositives (objectif 10 X). Veiller à ce que les images sont représentatives des voies respiratoires infectées du poumon avec la densité des tissus similaires.
Remarque : Si la densité et la répartition des foyers des hyphes apparaissent nettement différentes entre le contrôle et les groupes expérimentaux, des champs supplémentaires peuvent être prises, ou la zone de GMS de la section de poumon entier peut être photographiée (objectif 4 X). Obtenir des images des mêmes zones du poumon (selon la morphologie tissulaire équivalent) sur une coupe de poumon série colorée à l’hématoxyline et éosine, si vous le souhaitez. - Ajouter des barres d’échelle aux images si nécessaire et enregistrer les images d’être quantifiées. Sélectionnez, Edition > Ajout/modification d’étalonnage marques > Menu : choisir la taille de ligne épaisseur, couleur et échelle de bar > cliquez sur l’image pour où la barre d’échelle doit être installé. Fermer le Menu et choisissez, Edition > fusion > fusionner les marques de calibrage > Choisissez Fichier Enregistrer sous > nommez le fichier, puis cliquez sur Enregistrer.
6. en utilisant un programme de traitement d’Image pour calculer la charge fongique (Figure 3)
- Ouvrez un programme de traitement d’image. Sélectionnez Fichier > dossier avec échantillons de quantifier > image (Figure 3 a). Sélectionnez Image > Type > convertir en « RVB Stack » (Figure 3 b).
- Utilisez la touche flèche droite pour sélectionner la seconde des trois images donnés (Figure 3 b). Appuyez sur « Ctrl + Maj + T » pour faire apparaître la vis de réglage « Seuil » menu paramètres (Figure 3). Recherchez l’image .tiff ou .jpg d’origine comme référence et ouvrir avec une image Regarde un programme (Figure 3).
- Tirez le curseur dessu tout le chemin à gauche et réglez le bas jusqu'à ce que la zone sélectionnée (en rouge) est représentative de l’image de microscopie (qui vont généralement de 130-160 comme il est indiqué à droite du curseur (Figure 3).
- Une fois sélectionné, appuyez sur « Set » > « OK » (Figure 3D). Sélectionnez « Analyser » > « Définir les mesures » > cochez « Limite de zone, zone Fraction, au seuil, étiquette d’affichage » et laissez les paramètres de fond (le menu déroulant et décimales) comme valeur par défaut > « OK » (Figure 3D).
- D’importantes zones de l’espace blanc ou un fond de coloration peuvent être exclus par le choix du tissu approprié avec un zone l’outil Polygone.
- Enfin sélectionnez, « Analyser » > « Mesure » (doit apparaître une fenêtre avec des données, ou un onglet dans la barre des tâches windows apparaîtra marqué, « Résultats ») (Figure 3E). Transférer les données vers un programme d’analyse de données à une représentation graphique et l’analyse statistique.
- Entrer dans la moyenne des pourcentages quatre zone pour chaque échantillon de poumon. 5-8 échantillons sont généralement suffisants pour détecter des différences significatives entre les groupes. Si l'on compare deux groupes expérimentaux, effectuer d’un étudiant non apparié t-test pour déterminer la signification.

Figure 3 : captures d’écran représentant pour chaque étape de GMS histologiques champ quantification. (A) sélectionner Fichier > dossier avec échantillons de quantifier > sélectionnez l’image. (B) sélectionnez Image > Type > convertir en « RVB Stack ». Utilisez la touche flèche droite pour sélectionner la seconde des trois images donnés. (C) Hit « Ctrl + Maj + T » pour faire apparaître la vis de réglage paramètres du menu « Seuil ». Recherchez l’image .tiff ou .jpg d’origine comme référence et ouvrez avec programme de visionneuse de photo. Tirez le curseur dessu tout le chemin à gauche et réglez le bas jusqu'à ce que la zone sélectionnée (en rouge) est représentative de l’image de microscopie (qui vont généralement de 130-160 comme il est indiqué à droite du curseur. (D) une fois sélectionnée Appuyez sur « Set » > « OK ». Sélectionnez « Analyser » > « Définir les mesures » > cochez « Limite de zone, zone Fraction, au seuil, étiquette d’affichage » et laissez les paramètres de fond (le menu déroulant et décimales) comme valeur par défaut > « OK ». (E), enfin sélectionnez « Analyze » > « Mesure » (une fenêtre avec des données doit apparaître, ou un onglet dans la barre des tâches de windows s’affiche intitulée « Résultats »). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
7. ADN fongique fardeau
- Retirez les poumons de-80 ° C et lyophiliser pendant au moins 4 h (une nuit est optimale) ou jusqu'à ce que complètement séché par un système sec de gel.
- Pendant que les poumons sont séche, préparer le tampon d’extraction de l’ADN (0,1 M NaCl, 10 mM EDTA pH 8.0, 10 mM Tris HCl, pH 8,0 et 0,5 % SDS).
- Placer le tampon d’extraction ADN préparé dans un bain d’eau de 60 ° C afin de préchauffer. Aussi, placer phénol : chloroforme : alcool isoamylique (25:24:1) dans un tube conique de 50 mL permettant la séparation.
- Placez les poumons lyophilisées dans un tube à bouchon à vis 2 mL avec 0,2 mL de billes de verre. À l’aide d’un batteur de perle, moudre le tissu de poumon sec pour 15-30 s jusqu'à ce qu’elle forme une fine poudre.
- Ajouter 0,8 mL de tampon Extraction d’ADN chaleureux à chaque tube puis vortexer bien. Incuber chaque tube pendant 15 min dans un bain de perle de 65 ° C, puis vortex avant incubation pendant une 15 minutes supplémentaires. Après incubation, les tubes vortex et puis centrifuger à 25 000 x g pendant 10 min.
- L’étiquette de 3 séries de tubes de 1,5 mL pour chaque échantillon et transférer la couche supérieure du liquide surnageant dans un ensemble de tubes. Soyez prudent lors de pipetage sur la couche aqueuse pour ne pas perturber la couche intermédiaire.
- Ajouter un volume égal de phénol : chloroforme : isoamylique alcool et bien mélanger. Puis centrifuger à 25 000 x g pendant 15 min avant le pipetage à la couche supérieure dans le deuxième ensemble de tubes.
- Ajouter un volume égal de chloroforme : isoamyle chloroforme, bien mélanger et centrifuger à 25 000 x g pendant 10 min. soigneusement la pipette sur la couche supérieure dans le troisième set de tubes.
- Ajouter 500 µL d’isopropanol 50µl NaoAc (pH 5,2), bien mélanger et laisser incuber à température ambiante pendant 10 min échantillons. Puis centrifuger à 25 000 x g pendant 30 min et éliminer le surnageant.
- Laver le culot d’ADN avec 750 µL d’éthanol 70 % froid de glace et centrifuger pendant 5 min à 25 000 x g. Décanter l’éthanol et laisser que les boulettes à l’air sec dans les tubes dans un hottes pendant 40 min.
- Resuspendre les granulés secs dans 300 µL de tampon TE.
Remarque : L’ADN peut-être être conservé à-20 ° C jusqu'à ce que quantifié. - Quantifier l’ADN à l’aide d’un spectrophotomètre et préparer 100 µL de 0,2 µg/µL de chaque échantillon d’ADN pour l’analyse de qPCR.
- Effectuer un qPCR standard en triple exemplaire, tel que décrit précédemment avec 1 µg d’échantillon d’ADN, fongique 18 s rADN amorce, et sonde définit avec un désactiveur sonde modifiée (5'- / 56-FAM/AGC CGG CAG/ZEN/CCC GCA AAT G/3IABkFQ /-3')12,13.
- Préparer la courbe d’étalonnage de l’ADN génomique d’a. fumigatus et calculer la concentration d’ADN en pg dans chaque échantillon à l’aide de la journaliste moyen teindre les valeurs de Ct.
- Tracer les pg/µg d’ADN avec l’erreur standard de la moyenne. Effectuer un étudiant t-essai d’analyse pour déterminer l’importance.
Remarque : comme un moins toxique alternative à l’extraction d’ADN de phénol-chloroforme utilisée dans les présentes, colonne en fonction de l’extraction d’ADN peut être utilisé.
Résultats
Figure 4 comprend un graphique de la survie du type sauvage ou les souris déficientes en éosinophiles avec IA traitement par caspofungine. Les résultats montrent que les souris déficientes en éosinophiles montraient survie accrue par rapport aux souris de type sauvage (mortalité de 50 % par rapport à la mortalité de 100 %, respectivement). La figure 5 illustre représentant GMS coloration de neutropéniques sauvage et souris déficientes en éosinophiles avec IA traitement ou non avec la caspofungine. Le traitement caspofungine a relative clairance fongique chez eosinophil déficients, mais pas sauvage souris (panneaux de droite), tandis que les deux groupes n’ayant pas reçu caspofungine étaient similaires (panneaux de gauche). Figure 6 montre la comparaison fardeau fongique à caspofungine traités et contrôler la souris sauvage ou éosinophiles-deficient non traitées, en utilisant les deux qPCR d’ADN fongique (Figure 6 a) et GMS représentant quantification des 4 (objectif 10 X) champs) Figure 6 b). Les résultats générés par les deux techniques montrent que les résultats de traitement caspofungine dans le plus lourd fardeau fongique diminution entre sauvage et éosinophiles-deficient mice (Figure 6 a). Cependant, chez les souris non traitées, seulement quantification de GMS a entraîné une diminution significative chez les souris manquant éosinophiles (Figure 6 b). Quand la surface moyenne des ensemble-poumon teinté GMS sections ont été calculés (objectif 4 X), les différences étaient similaires aux résultats obtenus avec 4 représentant 10 champs de X, mais avec moins signification statistique (Figure 6). La figure 7 illustre survie, images de représentant GMS coloration (champs 4 10 X) et la quantification du fardeau fongique par ces deux méthodes dans γδ souris déficientes en lymphocytes T (TCRδKO) qui ont été traités avec la caspofungine par rapport à la commande, sans traitement de souris. Caspofungine traitement a amélioré la survie (Figure 7 a) et fongique fardeau (Figure 7 b-D) chez les souris TCRδKO. Similaires aux résultats de la Figure 6, les résultats du fardeau fongique tel que mesuré par qPCR (Figure 7 b) et représentant de quantification GMS (Figure 7) étaient comparables.
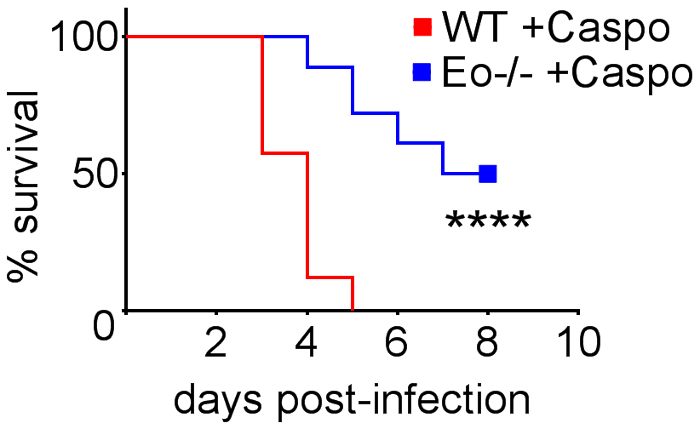
Figure 4 : augmente la survie chez les souris déficientes en éosinophiles (ΔdblGATA) avec IA après traitement avec la caspofungine. souris/groupe 15-30 ans. Résumé des expériences de 3-6. p < 0,0001. Ce chiffre a été modifié depuis une précédente publication8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
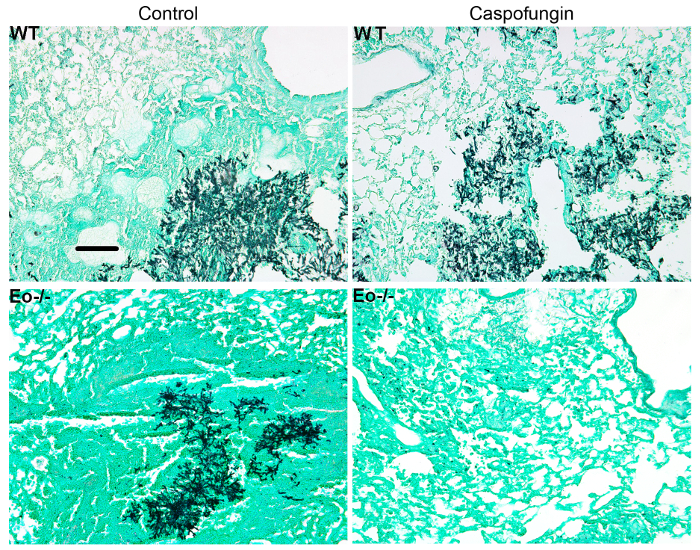
Figure 5 : des images représentant des sections GMS colorés poumon de type sauvage, éosinophile déficiente et imprégnées d’insecticide caspofungine ou contrôle n’est pas traité souris avec Ia Représentant du groupe de souris 3-4. Barre d’échelle équivaut à 100 µm. Ce chiffre a été modifié depuis une précédente publication8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : fardeau fongique en sauvage, éosinophile-deficient souris avec IA traités ou contrôle traitées avec caspofungine. QPCR (A) de l’ADN fongique. 15-30 souris/groupe, résumé des expériences de 3-6. (B), GMS quantification des coupes histologiques, moyenne % de GMS coloration de 4 champs (objectif 10 x). (C) GMS quantification, moyenne % de section poumon entier (objectif 4 X). B et C sont un résumé de 5 souris/groupe. p < 0,05. p < 0,001. p < 0,0001. Ce chiffre a été généré à l’aide de données qui ont été signalées dans une précédente publication8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
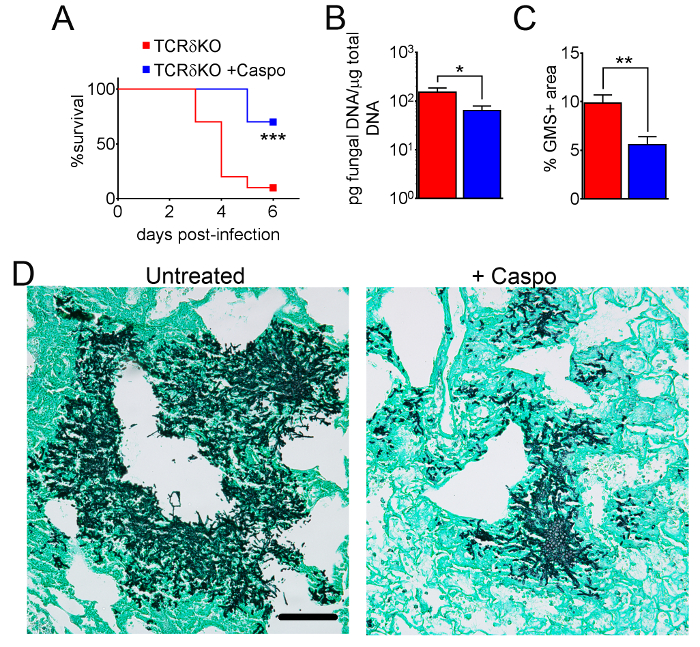
Figure 7 : diminue la gravité de IA chez les souris déficientes en lymphocytes T γδ après traitement caspofungine. (A) la survie. QPCR (B) de l’ADN fongique. (C) GMS quantification de l’histologie. (D) les images représentant des sections colorées GMS de cellules de T de γδ avec IA, traitée ou non traitée avec caspofungine. A et B sont un résumé des deux expériences avec des souris/groupe de 7-10. C et D sont un résumé de 4 souris/groupe. p < 0,05. p < 0,01. p < 0,001. Ce chiffre a été modifié depuis une précédente publication8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Cet article visait à mettre en place une méthode de détermination de la charge fongiques dans les poumons chez les souris avec IA en utilisant des coupes histologiques de poumon GMS teinté d’analyse d’images et de quantification. Dans cette étude, le traitement avec le médicament antifongique β-glucanes-synthèse-ciblage caspofungine14 n’a pas amélioré la survie ou le fardeau fongique chez la souris sauvage neutropéniques avec IA8. Cependant, en l’absence d’éosinophiles ou cellules de T de γδ, survie et fardeau fongique améliorées. Les résultats de notre étude a également démontrent que des résultats comparables peuvent être obtenus par le fardeau fongique GMS en comparaison avec le répandu fongiques ADN qPCR méthode6.
Il y a plusieurs avantages à utiliser la quantification fongiques fardeau GMS. Tout d’abord, le processus peut avoir recours à des échantillons histologiques existants, ce qui pourrait réduire le nombre d’expériences pour déterminer des différences significatives. En second lieu, dans cette étude, moins animaux était nécessaires pour la quantification fongiques fardeau GMS réaliser des différences significatives par rapport à qPCR d’ADN (Figure 6, Figure 7). En troisième lieu, comparaison du fardeau fongique chez différents isolats de qPCR peut être aux différences isolat dépendant ribosomal DNA copie numéro15. En revanche, quantification de GMS n’est pas affectée par le nombre de copies, fardeau fongique est déterminé par les niveaux relatifs de développement fongique des poumons. Ainsi, l’utilisation de la quantification de la GMS pour charge fongique réduit l’utilisation d’animaux vertébrés et ne nécessite pas de prédétermination du nombre de copies d’ADNr. Enfin, en plus de modifier la morphologie fongique, caspofungine thérapie augmente la fragmentation fongique et donc peut augmenter artificiellement fardeau fongique lorsqu’elle est mesurée par l’isolement des unités formant colonie de poumon homogénats12,16 ,,17. Ainsi, quantification de GMS du fardeau fongique évite plusieurs limitations inhérentes avec d’autres méthodes couramment utilisées.
Cependant, les limites de quantification de la GMS ou cette étude sont importants à noter. Tout d’abord, les auteurs ont supposé une distribution comparable de la croissance des hyphes travers les poumons de chaque groupe expérimental et donc utilisé quantification de 4 représentant 10 x objectifs champs comme une mesure représentative pour la charge fongique dans l’ensemble du poumon (Figure 6 b). Il est possible que dans certains cas la distribution relative, la taille et la densité des foyers des hyphes seraient suffisamment différent afin que le fardeau fongique semble différent avec cette méthode et l’équivalent de la méthode de qPCR. Cependant, nos résultats supplémentaires avec quantification de section de poumon entier en utilisant les 4 champs objectives X ont montré similaires, quoique moins statistiquement significative, différences entre les groupes (Figure 6). L’erreur-type de cette quantification a été augmentée avec cette stratégie, probablement en raison d’une diminution de résolution des hyphes avec le 4 X objectif et fond accrue dans les domaines sous-optimale. Par conséquent, une quantification représentative des champs moins à un grossissement supérieur est préférable. En second lieu, qu’une section unique, la centrale a été utilisée pour chaque échantillon. Il est possible, basé sur les isolats fongiques ou souches de souris utilisées, que certaines études peuvent aboutir à une répartition inégale de la croissance des hyphes. Dans ces cas, les sections supplémentaires tout au long de chaque bloc de paraffine doivent être quantifiées pour obtenir un fardeau plus représentatif. En troisième lieu, dans les expériences qui induisent une production importante de mucines (c.-à-d.quantification croissance fongique des voies aériennes d’aspergillose bronchopulmonaire allergique18 ou la fibrose kystique (FK)18), réactivité GMS avec riche en polysaccharides mucines19 pourrait non-spécifiques GMS + des résultats et l’inclinaison ainsi quelques échantillons en faveur de charge fongique supérieure. Étant donné que seul le modèle neutropéniques de IA a été utilisé dans cette étude, il est possible que l’utilisation d’autres modèles compétentes ou suppressives immunitaires pourrait conduit à des résultats moins comparables. Malgré ces avertissements, quantification de GMS fournit une technique comparable pour déterminer la charge fongique, et son utilisation continue dans d’autres études peut-être valider l’utilité de cette méthode comme cohérents, fiables et rentables.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée en partie par l’Indiana University School de médecine recherche amélioration concession et de NIH NIAID 1R03AI122127-01. N.A. a été partiellement soutenue pendant cette période par une carrière à immunologie Fellowship de l’American Association of Immunologists.
matériels
| Name | Company | Catalog Number | Comments |
| Aspergillus fumigatus 293 Stock Solution | Fungal Genetics Stock Center | FGSC #A1100 | |
| HyPure Cell Culture Grade Water | Thermo Fisher Scientific | SH30529.03 | |
| Malt Extract | MP Biomedicals | 2155315 | White Powder |
| BD BBL Acidicase Dehydrated Culture Media: Peptone | Fisher Scientific | L11843 | |
| Dextrose (D-Glucose) Anhydrous (Granular Powder/Certified ACS) | Fisher Scientific | D16-3 | |
| Fisher BioReagents Agar, Powder / Flakes, Fisher BioReagents | Fisher Scientific | BP1423-500 | |
| Auto Dry Cabinet | Shanghai Hasuc Instrument Manufacture Co.,LTD | HSFC160FD | |
| 1300 Series Class II, Type A2 Biological Safety Cabinet | Thermo Fisher Scientific | 1375 | |
| 0.5 mm Glass Beads | BioSpec Products | 11079105 | |
| 15 ml Conical Tubes | Thermo Fisher Scientific | 339650 | |
| Hemacytometer | Fisher Scientific | # 0267110 | |
| Leica Model DME Microscope | Leica | 13595XXX | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8662-500 ml | |
| 1.5 ml tubes | Fisher Scientific | # 05-408-129 | |
| BD Precisionglide syringe needles, gauge 27, L 1/2 in. | Sigma-Aldrich | Z192384 | |
| Anti-mouse-Ly-6G antibody | BioXCell | BP0075-1 | Clone 1A8 |
| Caspofungin diacetate | Sigma-Aldrich | SML0425 | |
| Isoflurane | Henry Schein Animal Health | 1169567762 | |
| Non-Rebreathing Table Top Veterinary Anesthesia Machine | Supera Anesthesia Innovations | M3000 | |
| Pureline Oxygen Concentrator | Supera Anesthesia Innovations | OC8000 | |
| Slant Board Restraint | Indiana State University Facilities Management | Custom made | |
| Gilson PIPETMAN Classic 200 ml Pipets | Fisher Scientific | F123601G | |
| Pentobarbital Sodium (Fatal-Plus) | Vortech Pharmaceuticals | 0298-9373-68 | |
| General-Purpose Broad-Tipped Forceps | Fisher Scientific | 10-300 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | |
| Fisherbrand General-Purpose Curved Forceps | Fisher Scientific | 10-275 | |
| Ethyl Alcohol-200 Proof | PHARMCO-AAPER | 111000200 | |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-63 | |
| BD Precisionglide syringe needles, gauge 25, L 1 in. | Fisher Scientific | Z192406 | |
| All-Plastic Norm-Ject Syringes | Fisher Scientific | 14-817-30 | |
| IV CATH ANGIOCATH 22GX1GIN 50B | Fisher Scientific | NC9742754 | |
| Formalin Solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | |
| 50 ml Conical Tubes | Thermo Fisher Scientific | 339652 | |
| Thermo Scientific Shandon Embedding Cassettes II in Tube Packs | Fisher Scientific | B1000729 | |
| Fisherfinest Histoplast Paraffin Wax | Fisher Scientific | 22-900-700 | |
| Disposable Base Molds | Fisher Scientific | 22-363-554 | |
| Reichert Jung Histocut 820 Microtome | Labequip.com | 31930 | |
| Water Bath | Precision Scientific | 66630-23 | |
| CO2 Incubator | Fisher Scientific | 116875H | |
| Silver Stain (Modified GMS) Kit | Sigma-Aldrich | HT100A-1KT | |
| Fast Green FCF | Fisher Scientific | AC410530250 | |
| Frosted Microscope Slides | Fisher Scientific | 12-550-343 | |
| Fisherfinest Superslip Cover Glass | Fisher Scientific | 12-545-89 | |
| Cytoseal XYL | Fisher Scientific | 22-050-262 | |
| Olympus Provis AX70 Microscope | Olympus | OLYMPUS-AX70 | |
| U-PHOTO Universal Photo System | Olympus | OLYMPUS-U-PHOTO | |
| U-MCB-2 MULTI CONTROL BOX | Olympus | OLYMPUS-U-MCB-2 | |
| U-PS POWER SUPPLY UNIT | Olympus | OLYMPUS-U-PS | |
| FreeZone 1 Liter Benchtop Freeze Dry System | LABCONCO | 7740020 | |
| Maxima C Plus Vacuum Pump | Fisher Scientific | 01-257-80 | Displacement- 6.1 cfm |
| 1-Butanol | Fisher Scientific | A383-4 | |
| AMRESCO PHENOL-CHLORFORM-OSOAMYL 100ML DFS | Fisher Scientific | NC9573988 | |
| Free-Standing Microcentrifuge Tubes with Screw Caps | Fisher Scientific | # 02-682-557 | |
| Mini-Beadbeater-24 | BioSpec Products | 112011 | |
| BioSpec ProductsSupplier Diversity Partner 2.3 MM ZIRCONIA BEADS | Fisher Scientific | NC0451999 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-1 | |
| Hydrochloric Acid, Certified ACS Plus | Fisher Scientific | A144S | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Sodium Dodecyl Sulfate (SDS), White Powder, Electrophoresis | Fisher Scientific | BP166 | |
| Chloroform/isoamyl alcohol 24:1 | Fisher Scientific | AC327155000 | |
| Biotek Epoch Microplate Spectrophotometer | Fisher Scientific | 11-120-570 | |
| Thermo Scientific™ ABsolute Blue qPCR Mixes | Fisher Scientific | AB4137A | |
| Hybridization Probe, 5′-FAM-AGCCAGCGGCCCGCAAATG-TAMRA-3′ | Integrated DNA Technologies | N/A | |
| Sense Amplification Primer, 5′-GGCCCTTAAATAGCCCGGT-3′ | Integrated DNA Technologies | N/A | |
| Antisense Amplification Primer, 5′-TGAGCCGATAGTCCCCCTAA-3′ | Integrated DNA Technologies | N/A | |
| Applied Biosystems™ MicroAmp™ Optical 8-Tube Strip, 0.2mL | Fisher Scientific | 43-165-67 | |
| Thermo Scientific Domed and Flat PCR Cap Strips | Fisher Scientific | AB-0386 | |
| Mx3005P QPCR System, 110 Volt | Agilent | 401443 | Stratagene is now owned by Agilent |
| BALB/c mice | The Jackson Laboratory | 000651 | |
| C57BL/6 (B6) mice | The Jackson Laboratory | 000664 | |
| Eosinophil-deficient (ΔdblGATA, BALB/c background) mice | The Jackson Laboratory | 005653 | |
| γδ T cell-deficient (TCRδ-/-, B6 background) mice | The Jackson Laboratory | 002120 | |
| ImageJ Software | National Institutes of Health | N/A | https://imagej.nih.gov/ij/ |
| Spot Advanced Software | Spot Imaging | SPOT53A | http://www.spotimaging.com/software/spot-advanced/ |
| GraphPad Prism 6 | GraphPad Software | N/A | https://www.graphpad.com/scientific-software/prism/ |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-62 | |
| Step 4.5 | http://www.bdbiosciences.com/sg/resources/protocols/paraffin_sections.jsp ; https://www-jove-com.remotexs.ntu.edu.sg/science-education/5039 ; http://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/General_Information/1/ht100.pdf |
Références
- Hohl, T. M., Feldmesser, M. Aspergillus fumigatus: principles of pathogenesis and host defense. Eukaryot Cell. 6 (11), 1953-1963 (2007).
- Kwon-Chung, K. J., Sugui, J. A. Aspergillus fumigatus--what makes the species a ubiquitous human fungal pathogen?. PLoS Pathog. 9 (12), e1003743 (2013).
- Ostrosky-Zeichner, L., Casadevall, A., Galgiani, J. N., Odds, F. C., Rex, J. H. An insight into the antifungal pipeline: selected new molecules and beyond. Nat Rev Drug Discov. 9 (9), 719-727 (2010).
- Desoubeaux, G., Cray, C. Rodent Models of Invasive Aspergillosis due to Aspergillus fumigatus: Still a Long Path toward Standardization. Front Microbiol. 8, 841 (2017).
- Hohl, T. M. Overview of vertebrate animal models of fungal infection. J Immunol Methods. 410, 100-112 (2014).
- Sheppard, D. C., et al. Comparison of three methodologies for the determination of pulmonary fungal burden in experimental murine aspergillosis. Clin Microbiol Infect. 12 (4), 376-380 (2006).
- Patterson, T. F. The future of animal models of invasive aspergillosis. Med Mycol. 43 Suppl 1, S115-S119 (2005).
- Amarsaikhan, N., et al. Caspofungin Increases Fungal Chitin and Eosinophil and gammadelta T Cell-Dependent Pathology in Invasive Aspergillosis. J Immunol. 199 (2), 624-632 (2017).
- Templeton, S. P., Buskirk, A. D., Law, B., Green, B. J., Beezhold, D. H. Role of germination in murine airway CD8+ T-cell responses to Aspergillus conidia. PLoS One. 6 (4), e18777 (2011).
- Brunel, S. F., et al. Live Imaging of Antifungal Activity by Human Primary Neutrophils and Monocytes in Response to A. fumigatus. J Vis Exp. (122), (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Bowman, J. C., et al. Quantitative PCR assay to measure Aspergillus fumigatus burden in a murine model of disseminated aspergillosis: demonstration of efficacy of caspofungin acetate. Antimicrob Agents Chemother. 45 (12), 3474-3481 (2001).
- Li, H., et al. The small GTPase RacA mediates intracellular reactive oxygen species production, polarized growth, and virulence in the human fungal pathogen Aspergillus fumigatus. Eukaryot Cell. 10 (2), 174-186 (2011).
- Sucher, A. J., Chahine, E. B., Balcer, H. E. Echinocandins: the newest class of antifungals. Ann Pharmacother. 43 (10), 1647-1657 (2009).
- Herrera, M. L., Vallor, A. C., Gelfond, J. A., Patterson, T. F., Wickes, B. L. Strain-dependent variation in 18S ribosomal DNA Copy numbers in Aspergillus fumigatus. J Clin Microbiol. 47 (5), 1325-1332 (2009).
- Kirkpatrick, W. R., Perea, S., Coco, B. J., Patterson, T. F. Efficacy of caspofungin alone and in combination with voriconazole in a Guinea pig model of invasive aspergillosis. Antimicrob Agents Chemother. 46 (8), 2564-2568 (2002).
- Petraitiene, R., et al. Antifungal efficacy of caspofungin (MK-0991) in experimental pulmonary aspergillosis in persistently neutropenic rabbits: pharmacokinetics, drug disposition, and relationship to galactomannan antigenemia. Antimicrob Agents Chemother. 46 (1), 12-23 (2002).
- Cowley, A. C., Thornton, D. J., Denning, D. W., Horsley, A. Aspergillosis and the role of mucins in cystic fibrosis. Pediatr Pulmonol. 52 (4), 548-555 (2017).
- Taylor, M. J., et al. Detection of fungal organisms in eosinophilic mucin using a fluorescein-labeled chitin-specific binding protein. Otolaryngol Head Neck Surg. 127 (5), 377-383 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon