Method Article
Cuantificación histológica para determinar la carga micótica pulmonar en aspergilosis Experimental
En este artículo
Resumen
Aquí se describe un protocolo para determinar la carga micótica pulmonar en ratones con aspergilosis invasiva por cuantificación de la coloración en cortes histológicos de plata de methanamine modificado de Gomori. Uso de este método dio lugar a resultados comparables con menos animales en comparación con evaluación de la carga de hongos por PCR cuantitativa de ADN fúngico de pulmón.
Resumen
La cuantificación de la carga fúngica pulmonar es fundamental para la determinación de los niveles relativos de protección inmune y la virulencia fúngica en modelos murinos de infección fúngica pulmonar. Aunque varios métodos son usados para evaluar la carga fúngica, reacción en cadena de polimerasa cuantitativa (qPCR) de ADN fúngico ha emergido como una técnica con varias ventajas sobre los anteriores métodos basados en la cultura. En la actualidad, una evaluación integral de la patología pulmonar, reclutamiento leucocitario, carga fúngica y expresión génica en ratones con aspergilosis invasiva (AI) exige el uso de un número significativo de experimental y control de animales. Aquí la cuantificación de pulmón histológico de tinción para determinar la carga micótica utilizando un reducido número de animales fue examinada detalladamente. Secciones del pulmón fueron manchadas para identificar estructuras fúngicas con plata de methanamine modificado de Gomori (GMS) de tinción. Imágenes fueron tomadas de las secciones manchadas de GMS de 4 campos discretos de cada pulmón de parafina-encajado formalina-fijo. El GMS manchadas áreas dentro de cada imagen se cuantificaron utilizando un programa de análisis de imagen, y de esta cuantificación, se determinó el porcentaje promedio de área manchada para cada muestra. Usando esta estrategia, ratones deficientes de eosinófilos exhibió disminución carga fúngica y la enfermedad con la terapia de la caspofungina, mientras que los ratones de tipo salvaje con IA no mejoró con caspofungina. Del mismo modo, la carga fúngica en ratones que carecen de células de T del γδ también fueron mejoradas por caspofungina, medida por qPCR y cuantificación de GMS. Cuantificación de GMS por lo tanto se presenta como un método para la determinación de la carga fúngica pulmonar relativa que puede reducir la cantidad de animales de experimentación necesarios para estudios integrales de la aspergilosis invasora.
Introducción
IA es una infección oportunista que puede desarrollarse en individuos susceptibles con inmunodeficiencias congénitas o adquiridas debido a la terapia represiva inmune o infección crónica1,2. A menudo la infección primaria ocurre en los pulmones, aunque en algunos difusión de casos de Aspergillus fumigatus para el hígado, riñones, corazón y cerebro puede ocurrir, dando por resultado la invasión extensa del tejido de hifas acompañada de enfermedad severa y alta tasas de mortalidad1,2. Además, la eficacia de farmacoterapias existentes es limitada y puede ser debilitada aún más por la aparición de cepas resistentes a antifúngicos en el medio ambiente3. Por lo tanto es importante entender los mecanismos de la patología fúngica de virulencia y host que promueven el desarrollo o exacerbación de la enfermedad fúngica invasiva.
Modelos murinos siguen siendo importantes para estudios mecanísticos de la IA, ya que permiten a los investigadores a evaluar las funciones de los genes de virulencia micótica y anfitrión de efectores inmunes para el establecimiento y crecimiento de a. fumigatus en vivo4,5. Por lo tanto, varias estrategias han sido concebidas con el fin de efectivamente cuantificar o comparar la carga fúngica en los grupos de animales experimentales6,7. Estas estrategias implican inmunoensayo basado en la cultura, bioquímico, o métodos de qPCR, cada una con distintas ventajas y desventajas. Además, cada uno de estos métodos implican la dedicación de un subconjunto de animales además de los sacrificados por la evaluación de la función inmune efectora, análisis de expresión génica y la histopatología comparativa7. Así, estudios integrales de IA a menudo requieren un número significativo de animales de investigación en un costo significativo. Estrategias que reducen el tiempo experimental animal costos y consideraciones éticas mediante la utilización de tejidos animales para múltiples análisis son, por lo tanto, extremadamente valioso7.
En este informe, se presenta un método que describe la cuantificación de la coloración en cortes histológicos para la comparación de la carga fúngica relativa entre grupos experimentales de ratones con IA GMS. Cada paso de la cultura fungicida a infección, cosecha de tejido y procesamiento y adquisición de imágenes y análisis de datos se describe en detalle. Carga fúngica obtenido por cuantificación de GMS fueron comparado con qPCR en neutropénicos modelos de IA y en ratones tratados con caspofungina de tipo salvaje o carentes de eosinófilos con IA8. Los resultados muestran similitud con cuantificación de GMS y qPCR de ADN fúngico. Esto sugiere que la cuantificación de GMS puede ser útil a los investigadores que participan en el análisis histológicos como un método alternativo o suplementario de la comparación de la carga fúngica relativa en ratones con IA y puede reducir el costo y uso de animales de investigación en estudios complejos y mecanicistas.
Protocolo
Todos los procedimientos animales fueron aprobados por el cuidado Animal y uso Comité de Indiana State University, el campus de anfitrión de la escuela de medicina de la Universidad de Indiana, Terre Haute.
1. preparación de conidios de a. fumigatus para infección
- Mientras trabaja en una campana bien ventilada, añadir 125 μl de solución stock de a. fumigatus 293 a 900 μl célula cultura grado de agua (CCGW). Luego transferir la solución para la placa de agar (MEA) del extracto mediante pipeta de Malta y extensión uniformemente con una asa de inoculación.
- Almacenar la placa micótica en la oscuridad a 24 ° C durante al menos 14 días y no más de 28 días.
- La cosecha conidios con perlas de cristal como se describió previamente9.
- Vierta 1.5 g de 0.5 mm perlas de vidrio sobre la placa y suavemente incline hacia adelante y hacia atrás hasta que los granos están recubiertos para extraer conidios. Recoge la mezcla de grano/conidias en un tubo cónico de 15 mL. Suspensión en solución salina tamponada con fosfato (DPBS) 5 mL Dulbecco y vortex.
- Contar las conidias en una dilución de 50 x de sobrenadante en DPBS usando un hemocitómetro. Contar el número de conidios en la zona indicada en la figura 1 y utilizar la ecuación 1 para calcular la concentración.
Factor de dilución de × #Conidia × 104conidios/mL (ecuación 1)
Nota: Otras áreas de la esquina cuadrada de 4 x 4 pueden ser contadas, con la media de estas áreas utilizada como #Conidia en la ecuación 1.
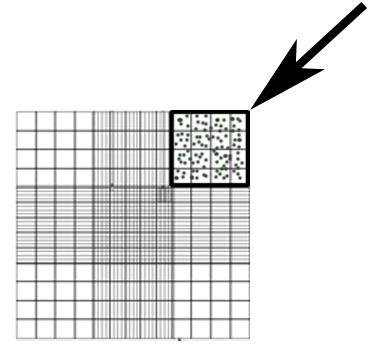
Figura 1: Hemocitómetro representante área usada para el conteo de conidios (caja, flecha).
- Diluir la suspensión de conidios con solución salina estéril (DPBS) para obtener la concentración deseada, 1.0 x 108 conidias/mL para la infección con 5 x 106 conidios/50 μl. preparar 50 μl de solución de conidios por n ' + 2' ratones infectados a cuenta para el pipeteo error.
Nota: Cosecha de hongos estándar y la preparación/filtración pueden ser utilizado alternativamente10. El método de cristal del grano se utiliza mejor para garantizar la obtención de muestras de conidios con antígenos hyphal pequeño/solubilidad mínima de aspiración.
2. inmunosupresión e infección del modelo murino
- Utilizar ratones de 7-10 semanas de edad.
Nota: Ratones BALB/c, C57BL/6 (B6), deficiencia de eosinófilos (ΔdblGATA, antecedentes BALB/c) y deficiencia de células T γδ (TCRδ-/-, B6 fondo) ratones se utilizaron para este estudio. Para cada experimento, la edad y sexo-emparejado ratones (tanto machos como hembras) fueron utilizados para cada grupo. - Agotar los neutrófilos vía intraperitoneal (IP) inyección de anticuerpo anti-anti-ratón-Ly - 6G de 0,1 mL (0,5 mg) en solución salina estéril a 45 º en el cuadrante derecho inferior lateral (para un programa experimental, ver figura 2).
- 24 h más tarde, infectar ratones por la aspiración de 5.0 x 106conidios dea. fumigatus suspendidos en 50 salina μl (ver pasos 2.4-2.10) como describió anteriormente11. Después de la infección, inyectar un subconjunto de los animales con el agente antihongos como Diacetato de caspofungina de 5 mg/kg en DPBS utilizados en este estudio (todos los días, ver figura 2).
- Anestesiar ratones con isoflurano 99,9% mediante una máquina de anestesia veterinaria.
- Coloque una toalla de papel en el piso de la cámara de inducción para recoger las heces y la orina.
- Colocar el ratón en la cámara de inducción, la tapa y ajuste el vaporizador a isoflurano 5% por 2 min y 30 s.
Nota: Ungüento veterinario no se utiliza debido a que el tiempo total bajo anestesia es menos de 5 minutos. - Reducir el vaporizador a la mitad del valor máximo de 30 s.
- Confirmar que el ratón correctamente está anestesiado observando lenta respiración, falta de movimiento y falta de respuesta al estímulo del pellizco del dedo del pie.
- Quitar el ratón de la cámara de inducción y el lugar en un tablero inclinado. Coloque el ratón con su espalda contra la Junta. Asegúrese de que sus incisivos superiores se refrenan suavemente con una goma elástica y los incisivos inferiores están sujetos ligeramente con un alambre de metal.
- Cuidadosamente mantenga la lengua en extensión completa con pinzas pequeñas y pipeta 50 μl de la suspensión de conidios/PBS en la base de la lengua.
- Sostenga la lengüeta en extensión completa; Escuche la respiración rápida y el chasquido distinto de aspiración. Mantenga durante 20 s o hasta que la suspensión es totalmente equipada.
- Quitar el mouse del tablero inclinado y coloque con cuidado en una jaula de observación.
- Tras la aspiración, el ratón debe recuperar la conciencia dentro de 1min Monitor el ratón hasta que totalmente consciente y capaz de caminar alrededor de la jaula. Los animales deben ser ubicados a 21 ° C y monitoreados dos veces al día hasta que los pulmones se cosechan.
- Repita el agotamiento de la infección después de 24 h de neutrófilos (paso 2.2) (figura 2).

Figura 2: programa Experimental. Esta figura fue modificada de una anterior publicación8.
3. la cosecha y conservación de los pulmones de ratón para análisis histológico
- Profundamente anestesiar al animal con una fatal dosis de 0,1 ml de pentobarbital sódico de 390 mg/ml solución IP.
- Confirmar la eutanasia observando falta de respiración espontánea y la ausencia de respuesta a la estimulación de extremidades con las pinzas. Una vez sacrificados, rocíe el cadáver con etanol al 70% para esterilizar.
- Colocar el cadáver en un tablero de espuma cubierto con un paño absorbente.
Nota: La canal debe colocarse en la espalda con alfileres asegurar los cuatro miembros a la Junta de espuma. - Abrir la cavidad de la parte superior del tórax usando las tijeras con cuidado. Corte la caja torácica para exponer los pulmones y el corazón. Cortar la vena cava inferior para permitir la perfusión. Evitar cortar los vasos sanguíneos y órganos de perforación.
- Lentamente perfusión con 5 mL de DPBS frío en el ventrículo derecho del corazón a un ángulo de 45° con una aguja de 25 G. Repetir la perfusión con 5 mL de formalina al 10%.
- Exponer la tráquea y separar las almohadillas de grasa circundantes. Tenga cuidado y evitar la punción de la tráquea. Asegúrese de que el exceso de tejido conectivo se quita para poder visualizar completamente la tráquea antes de proceder. Una vez la tráquea es expuesta, coloque pinzas en la tráquea para elevarlo.
- Haga un pequeño agujero en la tráquea superior utilizando una aguja de 25 G.
Nota: El orificio debe colocarse para que la cánula toda cabe en la tráquea. Tenga cuidado para evitar la ruptura de la tráquea. - Inserte una cánula a través del agujero y hacia los pulmones. Fijar la cánula con un hilo quirúrgico atado flojamente alrededor de la tráquea.
Nota: Si la tráquea está roto, puede insertarse la cánula más allá de la tráquea lo más lejos posible en la vía aérea. - Utilizando una jeringa, inflar los pulmones con 1 mL de tampón de formalina de 10% a través de la cánula. Asegúrese de que la inflación de los pulmones es visible. Si no, ajustar la sonda y repetir. Una vez que los pulmones se inflan, rápidamente Retire la cánula con cuidado y tense el hilo firmemente para sellar la tráquea.
Nota: Si se rompe la tráquea y los pulmones no pueden inflarse, los pulmones pueden cosecharse pero esto puede prevenir la fijación adecuada. - Suavemente Retire la tráquea y los pulmones del pecho desconectar con cuidado el tejido conectivo de la tráquea con pinzas mientras tira suavemente hacia arriba en el hilo. Coloque los pulmones y la tráquea de un tubo cónico de 50 mL con 15 mL de solución de formol 10%. Coloque un extremo del hilo fuera del tubo y la tapa. Invertir el tubo para sumergir completamente la muestra en el fijador.
- Almacenar las muestras a temperatura ambiente durante al menos 24 h o hasta que la transformación posterior.
PRECAUCIÓN: Formol es peligroso. Use equipo de Protección Personal como gafas y una mascarilla. Trabajar bajo una campana química al procesar las muestras.
4. la cosecha y conservación de los pulmones de ratón de ADN carga micótica
- Siga los pasos 3.1 a 3.5 como se describió anteriormente en un ratón aparte.
- Lentamente perfusión con 10 mL de DPBS frío en el ventrículo derecho del corazón a un ángulo de 45° con una aguja de 25 G.
- Suprimir los pulmones con tijera y colocar en tubos de 1,5 mL etiquetado.
- Almacenar los pulmones a-80 ° C hasta el procesamiento posterior.
- Utilizar técnicas estándar como se describe (inclusión y corte) y de acuerdo con protocolos del fabricante (véase Tabla de materiales).
5. microscopía e imagen
- Abrir el programa de cuantificación de imagen (véase Tabla de materiales).
- Utilizando un microscopio de luz, obtenga al menos 4 campos distintos de las GMS manchados diapositivas (objetivo de 10 X). Asegúrese de que las imágenes son representativas de las vías respiratorias infectadas dentro de los pulmones con densidad de tejido similar.
Nota: Si la densidad y la distribución de focos hyphal aparecen marcadamente diferentes entre los grupos experimentales y control, campos adicionales pueden tomarse, o el área de GMS de la sección de pulmón entero puede ser reflejado (objetivo de 4 X). Obtener imágenes de las mismas áreas del pulmón (identificado por morfología de tejido equivalente) en una sección del pulmón serial manchada con hematoxylin y eosina, si lo desea. - Agregar barras de escala a las imágenes cuando sea necesario y guardar las imágenes para ser cuantificada. Seleccionar, Editar > Agregar/editar marcas de calibración > menú: elegir la línea de espesor, color y escala de tamaño de barra > haga clic en la imagen para que la barra de escala debe ser colocado. Cerrar el menú y elegir, Editar > combinar > combinar marcas de calibración > elegir guardar como > nombre del archivo y haga clic en guardar.
6. usando un programa de procesamiento de imagen para calcular la carga fúngica (figura 3)
- Abra un programa de procesamiento de imagen. Seleccione Archivo > carpeta con muestras a cuantificar > imagen (Figura 3A). Seleccione Imagen > tipo > convertir a 'RGB pila' (figura 3B).
- Utilice la tecla flecha derecha para seleccionar a la segunda de las tres imágenes dadas (figura 3B). Golpe "control + shift + T" para que aparezca el regulador de configuración del menú de "Umbral" (figura 3). Localice la imagen .tiff o .jpg original como referencia y abra una imagen viendo el programa (figura 3).
- Tire el control deslizante superior hacia la izquierda y ajuste el regulador inferior hasta que el área seleccionada (en rojo) es representativo de la imagen de la microscopia (típicamente oscilan entre 130-160 como se indica a la derecha de la barra deslizante (figura 3).
- Una vez seleccionado, presione "Configurar" > "Aceptar" (figura 3D). Seleccionar "Analizar" > "Establecer medidas" > comprobar "Límite de la zona, fracción de área, umbral, etiqueta de la pantalla" y dejar la configuración de la parte inferior (el menú desplegable y decimales) como por defecto > "Aceptar" (figura 3D).
- Áreas significativas del espacio en blanco o tinción de fondo pueden ser excluidas por la selección del tejido adecuado con una herramienta de área o polígono.
- Finalmente, seleccione, "Analizar" > "Medida" (debería aparecer una ventana con los datos, o una pestaña en la barra de tareas de windows aparece la etiqueta, "Resultados") (figura 3E). Transferir los datos a un programa de análisis de datos para gráficos y análisis estadístico.
- Introduzca la media de los porcentajes de cuatro área para cada muestra de pulmón. 5-8 muestras son generalmente suficientes para detectar diferencias significativas entre los grupos. Si al comparar dos grupos experimentales, realizar un desapareado estudiante t-pruebas para determinar la significación.

Figura 3: cuantificación del campo representante de imágenes para cada paso de GMS histológicas. (A) Seleccione Archivo > carpeta con muestras a cuantificar > seleccione imagen. (B) seleccionar imagen > tipo > convertir a 'Pila de RGB'. Utilice la tecla flecha derecha para seleccionar a la segunda de las tres imágenes dadas. (C) Hit "control + shift + T" para que aparezca el regulador de configuración del menú de "Umbral". Localice la imagen .tiff o .jpg original como referencia y abrir con el programa visor de fotos. Tire de la corredera superior completamente a la izquierda y ajuste el regulador inferior hasta que el área seleccionada (en rojo) es representativo de la imagen de la microscopia (típicamente desde 130-160 como se indica a la derecha del control deslizante. (D) una vez seleccionado Presione "Set" > "OK". Seleccionar "Analizar" > "Establecer medidas" > comprobar "Límite de la zona, fracción de área, umbral, etiqueta de la pantalla" y dejar la configuración de la parte inferior (el menú desplegable y decimales) como por defecto > "OK". (E) finalmente seleccionar "analizar" > "Medida" (debería aparecer una ventana con los datos, o una pestaña en la barra de tareas de windows aparece etiquetado como "Resultados"). Haga clic aquí para ver una versión más grande de esta figura.
7. ADN carga micótica
- Retirar los pulmones de-80 ° C y liofilizar durante al menos 4 horas (durante la noche es óptimo) o hasta que seque totalmente por un sistema seco de helada.
- Mientras se secan los pulmones, preparar el tampón de extracción de DNA (0.1 M NaCl, 10 mM EDTA pH 8.0, 10 mM Tris HCl pH 8.0 y 0,5% SDS).
- Colocar el tampón de extracción de ADN preparado en un baño de agua de 60 º C para precalentar. También, colocar el fenol: cloroformo: alcohol isoamílico (25:24:1) en un tubo cónico de 50 mL y permitir la separación.
- Coloque los pulmones liofilizados en un tubo de tapón de rosca de 2 mL con 0.2 mL de granos de cristal. Usando un batidor de grano, moler tejidos de pulmón seco para 15-30 s hasta que se forme un polvo fino.
- Agregar 0,8 mL de tampón de extracción de ADN caliente a cada tubo y agitar bien. Incubar cada tubo durante 15 min en un baño del grano de 65 ° C y luego vórtice antes de incubar un adicional 15 min. Después de incubar, vortex y centrifugar los tubos a 25.000 x g durante 10 minutos.
- 3 juegos de tubos de 1,5 mL de la etiqueta para cada una de las muestras y transferir la capa superior del sobrenadante en un set de tubos. Tenga cuidado al pipetear la capa acuosa superior para evitar molestar a la capa media.
- Añadir igual volumen de fenol: cloroformo: isoamílico alcohol y mezclar bien. Luego centrifugar a 25.000 x g durante 15 min antes de pipetear la capa superior en la segunda serie de tubos.
- Agregar igual volumen de cloroformo cloroformo: isoamílico, mezcle bien y centrifugue a 25.000 x g durante 10 minutos con cuidado la pipeta a la capa superior en el tercer juego de tubos.
- Añadir 500 μl de isopropanol 50 μl NaoAc (pH 5,2), mezclar bien y muestras a incubar a temperatura ambiente durante 10 minutos. Luego centrifugar a 25.000 x g durante 30 minutos y decantar el sobrenadante.
- Lavar el pellet de ADN con 750 μl de etanol frío al 70% hielo y centrifugar durante 5 minutos a 25.000 x g. decantar el etanol y deje que seca el pellet al aire en los tubos en un campanas durante 40 minutos.
- Resuspender el pellet seco en 300 μL de tampón TE.
Nota: El ADN puede ser almacenado a-20 ° C hasta cuantificado. - Cuantificar el ADN utilizando un espectrofotómetro y preparar 100 μl de 0,2 μg/μl de cada muestra de ADN para el análisis de qPCR.
- Realizar una qPCR estándar por triplicado como se describió anteriormente con 1 μg de muestra de ADN, hongos 18S rDNA cartilla, y sonda fija con un extintor de sonda modificada (5'- / 56-FAM/AGC CAG CGG/ZEN/CCC GCA AAT G/3IABkFQ /-3') de12,13.
- Preparar una curva estándar de ADN genómico de a. fumigatus y calcular la concentración de ADN fúngico en pg en cada muestra utilizando el reportero promedio valores de Ct del tinte.
- Parcela la pg/μg de ADN fúngico con error estándar de la media. Realizar un estudiante t-análisis para determinar la significación de la prueba.
Nota: como menos tóxico alternativa a la extracción de DNA de fenol-cloroformo utilizada en el presente documento, columna basado en la extracción de ADN se pueden usar paquettes.
Resultados
Figura 4 incluye un gráfico de supervivencia de tipo salvaje o ratones deficientes de eosinófilos con IA trataron con caspofungina. Los resultados muestran que ratones deficientes de eosinófilos exhibieron aumento de la supervivencia en comparación con ratones wild type (mortalidad de 50% versus 100% de mortalidad, respectivamente). Figura 5 muestra representante GMS manchas de ratones de tipo salvaje y eosinófilos-deficiente neutropénicos con IA tratados o no tratados con caspofungina. Tratamiento de caspofungina resultó en la remoción de hongos relativa en deficiencia de eosinófilos, pero no de tipo salvaje ratones (paneles de la derecha), mientras que ambos grupos que no recibieron caspofungina fueron similares (paneles de la izquierda). Figura 6 muestra la comparación de la carga fúngica en tratados con caspofungina y controlar ratones de tipo salvaje o carentes de eosinófilos no tratados, utilizando ambos qPCR de ADN fúngico (figura 6A) y representante GMS cuantificación de 4 (objetivo de X 10) campos) Figura 6B). Los resultados generados a partir de ambas técnicas muestran que caspofungina resultados del tratamiento de la carga fúngica más importante disminuyen entre ratones de tipo salvaje y deficiencia de eosinófilos (figura 6A). Sin embargo, en ratones no tratados, cuantificación de GMS sólo produjo una disminución significativa en ratones que carecen de eosinófilos (Figura 6B). Cuando se calculó el área media de las secciones GMS-manchadas pulmonar total (objetivo de 4 X), las diferencias fueron similares a los resultados obtenidos con 4 campos de representante 10 X, aunque con menos significación estadística (figura 6). La figura 7 muestra la supervivencia, imágenes de representante GMS tinción (4 10 X campo) y cuantificación de la carga fúngica por ambos métodos en γδ ratones deficientes de células T (TCRδKO) que fueron tratados con caspofungina en comparación con el control, no se trata de ratones. Caspofungina el tratamiento mejoró la supervivencia (Figura 7A) y carga fúngica (figura 7B-D) en ratones TCRδKO. Similar a los resultados de la figura 6, los resultados de carga fúngica medida por qPCR (figura 7B) y representante de cuantificación de GMS (figura 7) fueron comparables.
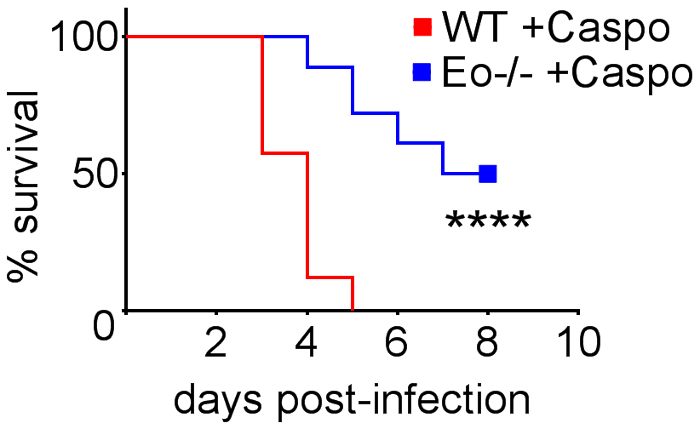
Figura 4: aumento de la supervivencia en ratones deficientes de eosinófilos (ΔdblGATA) con IA después del tratamiento con caspofungina. ratones/grupo de 15-30. Resumen de experimentos 3-6. p < 0.0001. Esta figura fue modificada de una anterior publicación8. Haga clic aquí para ver una versión más grande de esta figura.
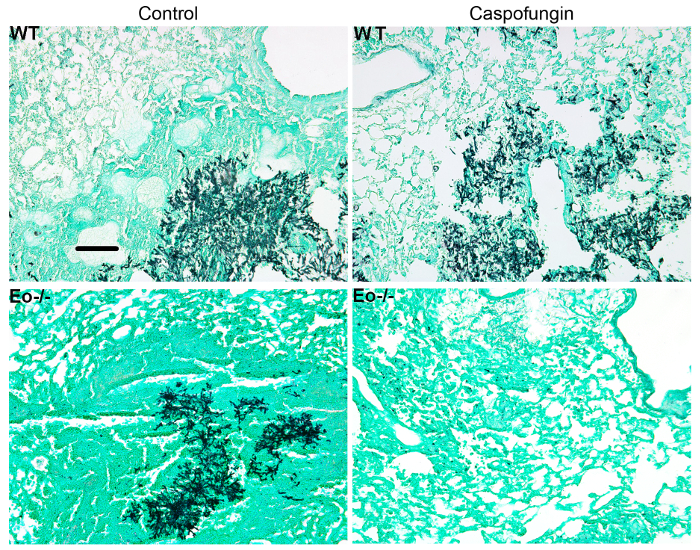
Figura 5: imágenes representativas de las secciones de pulmón manchado GMS de tipo salvaje, eosinófilos deficiente y tratados con caspofungina o control sin tratan a ratones con IA Representante de ratones/grupo de 3-4. Barra de escala es equivalente a 100 μm. Esta figura fue modificada de una anterior publicación8. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: carga hongos de tipo silvestre, ratones deficientes en eosinófilos con IA tratado o control trataron con caspofungina. (A) qPCR de ADN fúngico. 15-30 ratones/grupo, Resumen de los experimentos de 3 a 6. (B) GMS cuantificación de secciones histológicas, % medio de GMS manchas de 4 campos (objetivo de 10 x). (C) GMS cuantificación, % medio de la sección de pulmón entero (objetivo de 4 X). B y C son un resumen de 5 ratones/grupo. p < 0.05. p < 0.001. p < 0.0001. Esta figura fue generada utilizando los datos que se informaron en la publicación anterior8. Haga clic aquí para ver una versión más grande de esta figura.
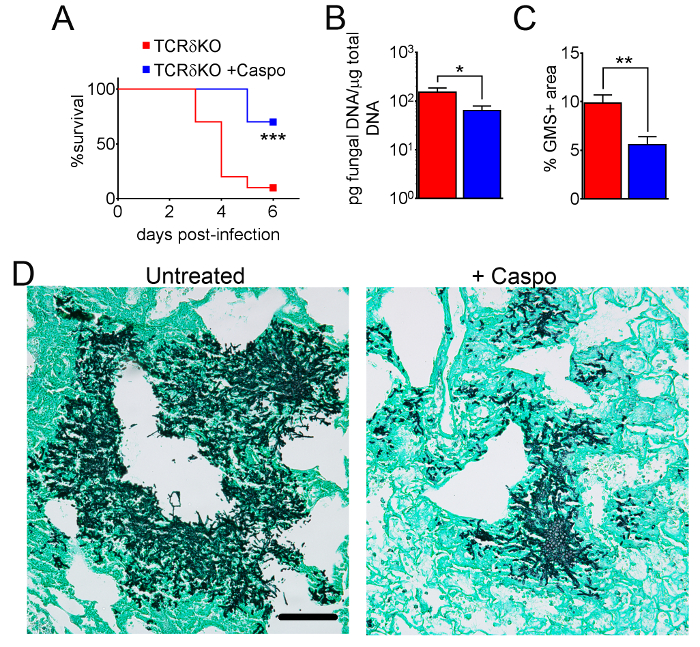
Figura 7: disminuyó la severidad de la IA en los ratones de deficiencia de células T γδ después del tratamiento de la caspofungina. Supervivencia (A). (B) qPCR de ADN fúngico. (C) GMS cuantificación de histología. (D) imágenes representativas de las secciones manchadas de GMS de las células de T del γδ con IA, tratado o no tratado con caspofungina. A y B son un resumen de dos experimentos con ratones/grupo de 7-10. C y D son un resumen de 4 ratones/grupo. p < 0.05. p < 0.01. p < 0.001. Esta figura fue modificada de una anterior publicación8. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El propósito de este artículo era presentar un método para la determinación de la carga fúngica pulmonar en ratones con IA utilizando cortes histológicos de pulmón manchado de GMS para análisis de imagen y cuantificación. En este estudio, el tratamiento con el fármaco antifúngico β-glucano-síntesis-dirigidas a caspofungina14 no mejoró la supervivencia o la carga fúngica en neutropénicos ratones de tipo salvaje con IA8. Sin embargo, en la ausencia de eosinófilos o células de T del γδ, supervivencia y carga micótica mejoraron. Los resultados de nuestro estudio también demostraron que pueden obtenerse resultados comparables por carga micótica GMS en comparación con el ampliamente utilizado fungicidas ADN qPCR método6.
Hay varias ventajas para utilizar la cuantificación de la carga fúngica de GMS. En primer lugar, el proceso puede utilizar muestras histológicas existentes, reduciendo potencialmente el número de experimentos para determinar diferencias significativas. En segundo lugar, en este estudio, menos animales se requiere para la cuantificación de carga fúngica de GMS lograr diferencias significativas en comparación con la qPCR de ADN fúngico (figura 6, figura 7). En tercer lugar, comparación de la carga fúngica en diferentes aislados por qPCR puede verse afectada por las diferencias de cepa dependiente de ribosomal DNA copia número15. En cambio, cuantificación de GMS no está afectada por número de copia, como carga fúngica está determinada por los niveles relativos de crecimiento fúngico de pulmón. Así, el uso de cuantificación de GMS para carga micótica reduce el uso de animales vertebrados y no requiere la previa determinación del número de copia del rDNA. Finalmente, además de modificar la morfología de hongos, caspofungina terapia aumenta la fragmentación de hongos y así puede incrementar artificialmente carga micótica cuando se mide por el aislamiento de unidades formadoras de colonias de pulmón homogenados12,16 ,17. Así, cuantificación de GMS de carga fungicida evita varias limitaciones inherentes con otros métodos comúnmente utilizados.
Sin embargo, las limitaciones de la cuantificación de GMS o este estudio son importantes tener en cuenta. En primer lugar, los autores supone una distribución similar de crecimiento hifal a través de los pulmones de cada grupo experimental y así utilizan cuantificación del representante 4 10 x objetivo campos como una medida representativa de la carga fúngica en el pulmón entero (Figura 6B). Es posible que en algunos casos la distribución relativa, el tamaño y la densidad de focos hyphal suficientemente diferenciaría para que la carga fúngica parecería diferente con este método y equivalente por el método de la qPCR. Sin embargo, nuestros resultados adicionales con cuantificación de sección de pulmón entero con los 4 campos objetivo X mostraron similar, aunque menos diferencias estadísticamente significativas entre grupos (figura 6). El error estándar de esta cuantificación se incrementó con esta estrategia, probablemente debido a la menor resolución hifal con el 4 X objetivo y mayor experiencia en campos subóptimos. Por lo tanto, se prefiere una cuantificación representante de menos campos de aumento mayor. En segundo lugar, solamente una sección central, solo se utilizó para cada muestra. Es posible, basado en los aislamientos o cepas de ratones utilizados, que algunos estudios pueden resultar en una distribución desigual del crecimiento hifal. En esos casos, secciones adicionales a lo largo de cada bloque de parafina deben ser cuantificadas para obtener una carga más representativa. En tercer lugar, en experimentos que inducen la producción substancial de mucinas (es decir, crecimiento fúngico de cuantificación de la vía aérea en broncopulmonar alérgica (ABPA) la aspergilosis18 o la fibrosis quística (FQ)18), reactividad de GMS con Rica en polisacárido mucinas19 podrían no específica GMS + resultados y así inclinar algunas muestras a favor de la mayor carga fúngica. Puesto que sólo el modelo neutropénicos de IA fue utilizado en este estudio, es posible que el uso de otros modelos competentes o represivos inmunes podría resultado en resultados menos comparables. A pesar de estas advertencias, cuantificación de GMS proporciona una técnica comparable para determinar la carga de hongos y su uso continuado en los estudios adicionales puede validar aún más la utilidad de este método como consistente, confiable y rentable.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado en parte por un Indiana University escuela de medicina mejora beca de investigación y por NIH NIAID 1R03AI122127-01. N.A. en parte apoyaron durante este período una carreras en beca de Inmunología de la Asociación Americana de inmunólogos.
Materiales
| Name | Company | Catalog Number | Comments |
| Aspergillus fumigatus 293 Stock Solution | Fungal Genetics Stock Center | FGSC #A1100 | |
| HyPure Cell Culture Grade Water | Thermo Fisher Scientific | SH30529.03 | |
| Malt Extract | MP Biomedicals | 2155315 | White Powder |
| BD BBL Acidicase Dehydrated Culture Media: Peptone | Fisher Scientific | L11843 | |
| Dextrose (D-Glucose) Anhydrous (Granular Powder/Certified ACS) | Fisher Scientific | D16-3 | |
| Fisher BioReagents Agar, Powder / Flakes, Fisher BioReagents | Fisher Scientific | BP1423-500 | |
| Auto Dry Cabinet | Shanghai Hasuc Instrument Manufacture Co.,LTD | HSFC160FD | |
| 1300 Series Class II, Type A2 Biological Safety Cabinet | Thermo Fisher Scientific | 1375 | |
| 0.5 mm Glass Beads | BioSpec Products | 11079105 | |
| 15 ml Conical Tubes | Thermo Fisher Scientific | 339650 | |
| Hemacytometer | Fisher Scientific | # 0267110 | |
| Leica Model DME Microscope | Leica | 13595XXX | |
| Dulbecco's Phosphate Buffered Saline | Sigma-Aldrich | D8662-500 ml | |
| 1.5 ml tubes | Fisher Scientific | # 05-408-129 | |
| BD Precisionglide syringe needles, gauge 27, L 1/2 in. | Sigma-Aldrich | Z192384 | |
| Anti-mouse-Ly-6G antibody | BioXCell | BP0075-1 | Clone 1A8 |
| Caspofungin diacetate | Sigma-Aldrich | SML0425 | |
| Isoflurane | Henry Schein Animal Health | 1169567762 | |
| Non-Rebreathing Table Top Veterinary Anesthesia Machine | Supera Anesthesia Innovations | M3000 | |
| Pureline Oxygen Concentrator | Supera Anesthesia Innovations | OC8000 | |
| Slant Board Restraint | Indiana State University Facilities Management | Custom made | |
| Gilson PIPETMAN Classic 200 ml Pipets | Fisher Scientific | F123601G | |
| Pentobarbital Sodium (Fatal-Plus) | Vortech Pharmaceuticals | 0298-9373-68 | |
| General-Purpose Broad-Tipped Forceps | Fisher Scientific | 10-300 | |
| Fisherbrand Standard Dissecting Scissors | Fisher Scientific | 08-951-20 | |
| Fisherbrand General-Purpose Curved Forceps | Fisher Scientific | 10-275 | |
| Ethyl Alcohol-200 Proof | PHARMCO-AAPER | 111000200 | |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-63 | |
| BD Precisionglide syringe needles, gauge 25, L 1 in. | Fisher Scientific | Z192406 | |
| All-Plastic Norm-Ject Syringes | Fisher Scientific | 14-817-30 | |
| IV CATH ANGIOCATH 22GX1GIN 50B | Fisher Scientific | NC9742754 | |
| Formalin Solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | |
| 50 ml Conical Tubes | Thermo Fisher Scientific | 339652 | |
| Thermo Scientific Shandon Embedding Cassettes II in Tube Packs | Fisher Scientific | B1000729 | |
| Fisherfinest Histoplast Paraffin Wax | Fisher Scientific | 22-900-700 | |
| Disposable Base Molds | Fisher Scientific | 22-363-554 | |
| Reichert Jung Histocut 820 Microtome | Labequip.com | 31930 | |
| Water Bath | Precision Scientific | 66630-23 | |
| CO2 Incubator | Fisher Scientific | 116875H | |
| Silver Stain (Modified GMS) Kit | Sigma-Aldrich | HT100A-1KT | |
| Fast Green FCF | Fisher Scientific | AC410530250 | |
| Frosted Microscope Slides | Fisher Scientific | 12-550-343 | |
| Fisherfinest Superslip Cover Glass | Fisher Scientific | 12-545-89 | |
| Cytoseal XYL | Fisher Scientific | 22-050-262 | |
| Olympus Provis AX70 Microscope | Olympus | OLYMPUS-AX70 | |
| U-PHOTO Universal Photo System | Olympus | OLYMPUS-U-PHOTO | |
| U-MCB-2 MULTI CONTROL BOX | Olympus | OLYMPUS-U-MCB-2 | |
| U-PS POWER SUPPLY UNIT | Olympus | OLYMPUS-U-PS | |
| FreeZone 1 Liter Benchtop Freeze Dry System | LABCONCO | 7740020 | |
| Maxima C Plus Vacuum Pump | Fisher Scientific | 01-257-80 | Displacement- 6.1 cfm |
| 1-Butanol | Fisher Scientific | A383-4 | |
| AMRESCO PHENOL-CHLORFORM-OSOAMYL 100ML DFS | Fisher Scientific | NC9573988 | |
| Free-Standing Microcentrifuge Tubes with Screw Caps | Fisher Scientific | # 02-682-557 | |
| Mini-Beadbeater-24 | BioSpec Products | 112011 | |
| BioSpec ProductsSupplier Diversity Partner 2.3 MM ZIRCONIA BEADS | Fisher Scientific | NC0451999 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-1 | |
| Hydrochloric Acid, Certified ACS Plus | Fisher Scientific | A144S | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate | Fisher Scientific | S311 | |
| Sodium Dodecyl Sulfate (SDS), White Powder, Electrophoresis | Fisher Scientific | BP166 | |
| Chloroform/isoamyl alcohol 24:1 | Fisher Scientific | AC327155000 | |
| Biotek Epoch Microplate Spectrophotometer | Fisher Scientific | 11-120-570 | |
| Thermo Scientific™ ABsolute Blue qPCR Mixes | Fisher Scientific | AB4137A | |
| Hybridization Probe, 5′-FAM-AGCCAGCGGCCCGCAAATG-TAMRA-3′ | Integrated DNA Technologies | N/A | |
| Sense Amplification Primer, 5′-GGCCCTTAAATAGCCCGGT-3′ | Integrated DNA Technologies | N/A | |
| Antisense Amplification Primer, 5′-TGAGCCGATAGTCCCCCTAA-3′ | Integrated DNA Technologies | N/A | |
| Applied Biosystems™ MicroAmp™ Optical 8-Tube Strip, 0.2mL | Fisher Scientific | 43-165-67 | |
| Thermo Scientific Domed and Flat PCR Cap Strips | Fisher Scientific | AB-0386 | |
| Mx3005P QPCR System, 110 Volt | Agilent | 401443 | Stratagene is now owned by Agilent |
| BALB/c mice | The Jackson Laboratory | 000651 | |
| C57BL/6 (B6) mice | The Jackson Laboratory | 000664 | |
| Eosinophil-deficient (ΔdblGATA, BALB/c background) mice | The Jackson Laboratory | 005653 | |
| γδ T cell-deficient (TCRδ-/-, B6 background) mice | The Jackson Laboratory | 002120 | |
| ImageJ Software | National Institutes of Health | N/A | https://imagej.nih.gov/ij/ |
| Spot Advanced Software | Spot Imaging | SPOT53A | http://www.spotimaging.com/software/spot-advanced/ |
| GraphPad Prism 6 | GraphPad Software | N/A | https://www.graphpad.com/scientific-software/prism/ |
| Fisherbrand Absorbent Underpads | Fisher Scientific | 14-206-62 | |
| Step 4.5 | http://www.bdbiosciences.com/sg/resources/protocols/paraffin_sections.jsp ; https://www-jove-com.remotexs.ntu.edu.sg/science-education/5039 ; http://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/General_Information/1/ht100.pdf |
Referencias
- Hohl, T. M., Feldmesser, M. Aspergillus fumigatus: principles of pathogenesis and host defense. Eukaryot Cell. 6 (11), 1953-1963 (2007).
- Kwon-Chung, K. J., Sugui, J. A. Aspergillus fumigatus--what makes the species a ubiquitous human fungal pathogen?. PLoS Pathog. 9 (12), e1003743 (2013).
- Ostrosky-Zeichner, L., Casadevall, A., Galgiani, J. N., Odds, F. C., Rex, J. H. An insight into the antifungal pipeline: selected new molecules and beyond. Nat Rev Drug Discov. 9 (9), 719-727 (2010).
- Desoubeaux, G., Cray, C. Rodent Models of Invasive Aspergillosis due to Aspergillus fumigatus: Still a Long Path toward Standardization. Front Microbiol. 8, 841 (2017).
- Hohl, T. M. Overview of vertebrate animal models of fungal infection. J Immunol Methods. 410, 100-112 (2014).
- Sheppard, D. C., et al. Comparison of three methodologies for the determination of pulmonary fungal burden in experimental murine aspergillosis. Clin Microbiol Infect. 12 (4), 376-380 (2006).
- Patterson, T. F. The future of animal models of invasive aspergillosis. Med Mycol. 43 Suppl 1, S115-S119 (2005).
- Amarsaikhan, N., et al. Caspofungin Increases Fungal Chitin and Eosinophil and gammadelta T Cell-Dependent Pathology in Invasive Aspergillosis. J Immunol. 199 (2), 624-632 (2017).
- Templeton, S. P., Buskirk, A. D., Law, B., Green, B. J., Beezhold, D. H. Role of germination in murine airway CD8+ T-cell responses to Aspergillus conidia. PLoS One. 6 (4), e18777 (2011).
- Brunel, S. F., et al. Live Imaging of Antifungal Activity by Human Primary Neutrophils and Monocytes in Response to A. fumigatus. J Vis Exp. (122), (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Bowman, J. C., et al. Quantitative PCR assay to measure Aspergillus fumigatus burden in a murine model of disseminated aspergillosis: demonstration of efficacy of caspofungin acetate. Antimicrob Agents Chemother. 45 (12), 3474-3481 (2001).
- Li, H., et al. The small GTPase RacA mediates intracellular reactive oxygen species production, polarized growth, and virulence in the human fungal pathogen Aspergillus fumigatus. Eukaryot Cell. 10 (2), 174-186 (2011).
- Sucher, A. J., Chahine, E. B., Balcer, H. E. Echinocandins: the newest class of antifungals. Ann Pharmacother. 43 (10), 1647-1657 (2009).
- Herrera, M. L., Vallor, A. C., Gelfond, J. A., Patterson, T. F., Wickes, B. L. Strain-dependent variation in 18S ribosomal DNA Copy numbers in Aspergillus fumigatus. J Clin Microbiol. 47 (5), 1325-1332 (2009).
- Kirkpatrick, W. R., Perea, S., Coco, B. J., Patterson, T. F. Efficacy of caspofungin alone and in combination with voriconazole in a Guinea pig model of invasive aspergillosis. Antimicrob Agents Chemother. 46 (8), 2564-2568 (2002).
- Petraitiene, R., et al. Antifungal efficacy of caspofungin (MK-0991) in experimental pulmonary aspergillosis in persistently neutropenic rabbits: pharmacokinetics, drug disposition, and relationship to galactomannan antigenemia. Antimicrob Agents Chemother. 46 (1), 12-23 (2002).
- Cowley, A. C., Thornton, D. J., Denning, D. W., Horsley, A. Aspergillosis and the role of mucins in cystic fibrosis. Pediatr Pulmonol. 52 (4), 548-555 (2017).
- Taylor, M. J., et al. Detection of fungal organisms in eosinophilic mucin using a fluorescein-labeled chitin-specific binding protein. Otolaryngol Head Neck Surg. 127 (5), 377-383 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados