Method Article
Yüksek çözünürlüklü ses görüntüleme, nöronlar Floresans kullanım dışlama yöntemi tarafından ve adanmış mikrosıvısal aygıtları
Bu Makalede
Özet
Cilt hücrelerinin fizyolojik ve patolojik özellikleri ile ilgili önemli bir parametredir. Biz tam alan ölçüm-in vitro nöron birim neurites ve dinamik yapıları nöronal artışa örtülü analizi için gerekli alt micrometric eksenel çözünürlük ile sağlayan bir floresan dışlama yöntemi açıklanmaktadır.
Özet
Birim nöronların farklı zaman ölçeklerde fizyolojik ve patolojik özellikleri ile ilgili önemli bir parametredir. Nöronlar oldukça benzersiz hücre ile ilgili onların genişletilmiş ramified türleri morfoloji ve sonuç olarak ses ölçüm için birkaç metodolojik sorunlar yükseltmek. Vitro nöron büyüme özel durumda seçilen metodoloji dakika zaman ölçekten saat veya gün için tam alanlı gözlem ile birlikte alt micrometric eksenel çözünürlük içermelidir. Confocal görüntüleme, elektrikle tabanlı ölçümleri veya Atomik kuvvet mikroskobu kullanarak hücre şekli yeniden yapılanma gibi diğer yöntemlerinden farklı olarak, son zamanlarda geliştirilen Floresans dışlama yöntemi (FXm) bu zorlukları karşılamak için potansiyele sahiptir. Ancak, onun ilke olarak basit olmasına rağmen birden fazla ayarlamaları ve adanmış bir metodoloji nöronlar için yüksek çözünürlüklü bir FXm uygulanması gerektirir. Burada Floresans dışlama, düşük-pürüzlülük çok bölmeleri mikrosıvısal aygıtlar ve nihayet yerel nöronal birim vitro ölçümleri elde etmek için micropatterning kombinasyonuna göre bir yöntem mevcut. Aygıt tarafından sağlanan yüksek çözünürlüklü nöronal işlemleri (neurites) yerel birim ve belirli bazı yapılar büyüme koniler (GCs) gibi nöronal büyüme dahil hacmi ölçmek izin verdi.
Giriş
Hücresel biriminin kesin bilgi hücre boyutu homeostazı tek hücreli mikroorganizmalar 1 ve daha genel olarak Mitotik hücre 2' deki sayısında tarafından tahrik son yıllarda artış dikkat çekti. Ancak, hücre hacmi için nöronlar paradigmatik bir örnek teşkil da sonrası Mitotik hücreler için ilgili sorunu.
Gerçekten de farklı ölçekler ve zaman-Puan fizyolojik ve patolojik olayların önemli bir imza elektriksel aktivite (milisaniye ölçek) 3 ' e geri dönüşü ile ilişkili geçici aksonal deformasyon gelen nöronal hayatında birimdir nöronal nörodejeneratif hastalıklar (insanlarda yılda) 4, asemptomatik aşamasında meydana gelen şişlik. Ancak, gün veya hafta (bağlı olarak düşünülmüş organizma) nöronal büyüme sırasında bir ara zaman ölçeği içinde en büyük birim değişikliği oluşur. Nöronların uzun ve karmaşık morfolojisi arasında hangi katları sorunlara yol açtı hücre boyutu düzenlenmesi. Aksonal uzunluğu ve çapı gerçekten sıkı bir şekilde düzenlenmiş vivo içindeher nöronal tip 5,6için belirli değerleri vardır.
Vivo, adrese karmaşık bu sorunları da basitleştirilmiş bir şekilde ele alınması tüp bebek. Bu amaçla adanmış Birim ölçümü için hızlı bir yöntem yeterli büyüme dinamikleri (Yani bir zaman ölçeğinde dakika) ve uyumlu saatler veya günler içinde gözlem ile takip etmek gereklidir. Yılda bir hücresel birim içinde vitrodoğrudan veya dolaylı erişim sağlamak için çeşitli yöntemler geliştirilmiştir. Hücre imar confocal görüntüleme üzerinden onlardan biri, ama bu yöntem yaklaşık 500 nm 7sınırlı Aksiyel çözünürlüğe gösterilen süre etiketleme ve tekrarlanan pozlama ışık anlamına gelir. Bu iki son sakıncaları kısmen kafes ışık sayfalık mikroskobu 8isimli daha sofistike ve son yöntemi tarafından üstesinden vardır unutmayın. Atomik kuvvet mikroskobu kullanılan 9 oldu ama bu tarama yöntemi tarafından yavaş ve sıkıcı özüdür. Ayrıca, fiziksel temas ile hücre gerektirir nöronlar 10aşırı yumuşaklığını dikkate alınarak ölçüm ile etkileşebilir. Empedans veya rezonans kullanarak dolaylı yöntem istihdam için 11farklı hücre türleri ama yetersiz yapışkanlı hücrelerin nöronlar gibi genişletilir.
En umut verici yöntemlerden birini hücreleri floresan bir boya ile dolu bir yakın odasında dışlanan hacmi ölçüsü temel alır. Floresans dışlama yöntemi (FXm) hiçbir etiketleme gerektirdiğinden, prensip olarak basittir ve hücre popülasyonlarının potansiyel olarak alt optik Aksiyel çözünürlüğü ile hızlı, uzun vadeli optik görüntüleme için uygundur. Gürültü çeşitli kaynaklardan bu nihai çözüm sınırlamak daha doğrusu, z çözünürlükte maksimum floresan yoğunluğu odasında kameranın dinamik alanı tarafından bölünmüş kültür (Yani bölgedeki hücreleri yoksun) bağlıdır. Bu yöntem çok güçlü geçirme yapışık hücreleri 12 hacmi takip etmek veya birim değişikliği sırasında mitoz iyice 13açıklandığı gibi memeli hücrelerinin çalışma olmuştur. Ancak, nöronlar için onların geniş yaklaşım alt micrometric süreçlerini göz önünde bulundurarak FXm metodolojik bir meydan okuma teşkil.
Burada düzgün FXm odaları imalatı için yüksek hassasiyetli birim ve nöronal dalları ve dinamik yapılar büyüme koni gibi nöronal büyüme dahil yüksekliği ile erişmek için önde gelen bir yöntem mevcut.
Chambers Aksiyel çözünürlük iyileştirmek amacıyla ölçmek için nesne daha benzer boyutlara sahip olmalıdır. Bu nedenle, biz üç farklı yükseklikte Merkezi ölçüm Odaları tarafından karakterize farklı FXm cihazlar tasarlanmıştır. En ince (3 µm) yüksekliği neurite ölçüm için adanmış: hangi çevre 15 µm yüksek orta odası içinde kalmak soma, bu düşük yükseklik dışlar. Daha kalın Merkezi chambers (10 ve 12 µm) bütün hücre büyüme takip için yeterince yüksek. Cihazın Ayrıca Merkezi odasının her iki tarafında bulunan iki rezervuarlar içerir. Dört enjeksiyon delik (ıh) böylece uygulanır ve aşağıdaki gibi belirlenir: diğer iki rezervuarlar besleme ise hücresel süspansiyonlar çipin tanıtmak için giriş ve çıkış hizmet.
İlk fabrikasyon kalibrasyon coverslips bilinen geometri fotorezist yapıları kullanarak yükseklik ölçüleri için var. Biz-sonra yansıma ücretsiz büyüyen nöronlar, ama aynı zamanda morfolojik kısıtlanmış nöronlar yapışma micropatterns.
Protokol
Çalışma bakım ve laboratuvar hayvanlarının kullanımı Avrupa toplum kuralları uyarınca gerçekleştirilmiştir: 86/609/EEC. Araştırma amaç ve protokol ERCadg etik ek proje kabul edildi ve ERCEA tarafından düzenli olarak gözden çello açıklanmıştır. 24/04/2012, Comité d'Ethique tr matière d için raporlama #C75-05-18, Institut hayvan tesisi aldı Curie ruhsat ' expérimentation animale Paris Merkezi et Sud (Ulusal kayıt numarası: #59).
1. kalıp imalatı
Not: Kalıp bir giriş ve bir çıkış, artı iki su depoları (alıcılar) Merkezi odasının her iki tarafında bulunan bağlı Merkez ve orta düzey odaları içerir.
- 51 mm çapında silikon gofret işlemek ve bir yerden diğerine aktarmak için düz cımbız kullanın.
- Orta Odası silikon kalıp
- 2-mL plastik pipet ile pozitif fotorezist doldurun. Pipet 51 mm çapında silikon gofret merkezinde konumlandırabilir ve fotorezist gofret yüzeyle yaklaşık % 75'i kapsayan kadar onun rezervuar üzerinde basabilirsiniz. Spin-kat 30 için 3000 rpm'de s.
- Gofret bir aspiratör, yüzey sıcaklığı 100 ° c, 50 için spin-coater aktarmak s.
- Gofret Pinar maskesi aligner substrat sahibine (chuck) aktarın. "DRIE maskesi" maruz (bkz: ek dosyalar "masks_neuron_volume_chips.tiff" ve "masks_neuron_volume_chips.dxf").
- Gofret Chuck'tan kaldırın sonra dalış Geliştirici (seyreltme deiyonize su 1:4) içeren yemek crystallizing bir 100 mL cam. Gofret yayın ve crystallizing çanak sürekli ve yavaşça karıştırarak 1 dk. için korumak.
Not: reaktifler kaydetmek için 1 cm yüksekliği maksimum crystallizing çanak doldurun. - Geliştiricinin yeri: gofret al ve yaklaşık 10 s.Then yer bir emici kağıt üzerine gofret deiyonize su ile dolu bir 100 mL crystallizing çanak içine daldırın ve bir hava darbe silah kullanarak basınçlı azot ile kuru.
- Gofret 50 yer bir Pinar 115 ° c yüzey sıcaklığı ile s
- Derin-reaktif iyon gravür (DRIE) (DRIE tekniği hakkında daha fazla bilgi başvuruları 14 ve 15bulunabilir) aşağıdaki parametrelerle gerçekleştirmek; Pasivasyon adım: C4F8, o yedekleme 50 sccm 10 sccm akış, CP 10 W, İndüktif birleştiğinde plazma (ICP) 1500 W, toplam basınç 24 mbar, sıcaklığı 18 ° C; Gravür adım: SF6, o yedekleme 100 sccm 10 sccm akış, CP 11 W, ICP 1500 W, toplam basınç 24 mbar, sıcaklığı 18 ° C; Pasivasyon zaman: 4 s; Zaman aşındırma: 7 s; Toplam işlem süresi: genellikle yaklaşık 10 µm için 5 dk derinlik kazınmış.
- Fotorezist aseton ile dolu bir crystallizing çanak içine belgili tanımlık substrate dalış tarafından çözülür.
- Gofret bir piranha çözümde daldırın (2/3 H2O2 (% 30) ve 1/3 H2SO4 (95 5 min için %)).
Dikkat: Her zaman önce H2O2 ekleyin ve temizlendikten sonra4 ve durulama en az 3 kez bu yüzden H2su deiyonize.
- 1.2.1 1.2.11 Tablo 1-3' te listelenen parametreleri aşağıdaki adımları uygulayarak ara odalarına karşılık gelen kalıpları imal.
Not: Her tablo belirli bir aygıt Merkezi gözlem odası belirli bir yüksekliğe tarafından karakterize karşılık gelir.
Not: artan photoresists heights (maskeleri 1-3 her aygıt için bkz: ek dosyalar "masks_neuron_volume_chips.tiff" ve "masks_neuron_volume_chips.dxf") kullanarak tüm süreci gerçekleştirmek.- Kazınmış silikon gofret yer spin-coater substrat tutucu üzerinde.
- Belgili tanımlık substrate aspirasyon (substrat ve spin bir yerde kalmak sırasında nominal dönüş hızı) etkili olduğunu doğrulayarak spin coater düzgün çalıştığını denetleyin.
- SU-8 viskozite hedeflenen kalınlığı aralığı yüksekliği ile artar. Her zaman SU-8 photoresists depolamak ve bu spin-kaplama önce gofret dökmek için 20-30 ml'lik şişe kullanın (SU-8 ile bir plastik pipet manipüle edilebilir çok viskoz olabilir).
- Negatif epoksi-türü fotorezist SU-8 substrat ortasındaki silikon gofret yaklaşık % 75'i kapsayan kadar dökün, sonra spin-ceket parametreleri kullanarak tabloları sıra "Spincoating" olarak gösterilir.
- Yer kaplı gofret süresi ve sıcaklık için bir ocağın üzerinde satır "yumuşak kek" belirtti.
- Kazınmış gofret ve yeterli "SU-8 maskesi" maskesi aligner bağlayın.
- Kazınmış gofret adanmış hizalama haçlar kullanarak maskesi ile hizalamak (Bu haçlar tipik boyutu: 50 µm × 150 µm) her maske üzerine tasarlanmış.
Not: Cihazın her tarafında iki Haçlar sol alt köşesinde yeterli (bir) ve bir sağ üst vardır. - Ben-hattının maskesi aligner (dalga boyu 365 nm) uygun UV dozu ile "Pozlama enerji" satırında gösterildiği gibi kullanarak maruz.
Not: Pozlama süresi her fotorezist pozlama enerji E özel UV lambası etkili güç tarafından bölünmesi ile hesaplanır, maske absorpsiyonu ile modüle: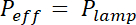 x (1 - emmemaskesi). Emme yaklaşık %20 için esnek maskeleri ve krom zor maskesi için önemsiz olduğunu.
x (1 - emmemaskesi). Emme yaklaşık %20 için esnek maskeleri ve krom zor maskesi için önemsiz olduğunu. - Kaplı gofret süresi ve "Post fırında" satır belirtilen sıcaklık için bir ocağın koyun.
- 100 mL cam crystallizing tabağı, bir geliştirici, diğer boş içeren hazır olun. Dalış süresi için geliştirici gofret satır "Kalkınma" belirtti. Yavaşça boyunca geliştirme crystallizing çanak kışkırtmak
- Yukarıda boş crystallizing yemek için yaklaşık 5 gofret isopropanol ile serpin s. Son olarak, gofret bir emici kağıt üzerine yerleştirin ve bir hava darbe silah kullanarak basınçlı azot ile kuru.
- Kaplı gofret süresi ve sıcaklık için bir ocağın üzerinde belirtilen satır "sabit fırında" yer (isteğe bağlı).
Not: Bu adım fotorezist çatlakları önlemek ve homojen düz bir yüzey için sonraki adımlar sağlamak kullanışlıdır. - 1.3.1 - 1.3.10 Tablo 1-3' te listelenen işlemleri tamamlaması için yineleyin.
- Fotolitografi son adımdan sonra silanize son ana kalıp oluşan 3 kat iki gönderme tarafından negatif photoresists Trichloro(1H,1H,2H,2H-perfluoro-octyl) silane 100-mm Petri kabına master her tarafında 100 µL damlacıkları. Bir plastik parafin film Petri diskle mühür ve oda sıcaklığında (RT) 20 dk kuluçkaya.
Not: Ana kalıp hazır olduğunu ve birkaç kez kullanılabilir.
- Kazınmış silikon gofret yer spin-coater substrat tutucu üzerinde.
2. PDMS çip imalatı
- Silikon bazlı organik polimer 90 g dökün (Polydimethylsiloxane: PDMS) 100 mL plastik bir kap içine. Kür Aracısı (1:10 kilo) 10 g ekleyin. 2-3 dakika için bir plastik pipet kullanarak karışımı ilave edin.
Not: 90 g PDMS aracı 6 cips imalatı için kür, 10 g ile karıştırın. - İçinde bir vakum desiccator ve pompa yaklaşık 30 dk için PDMS hapsolmuş hava kabarcıkları kaldırmak için karışımı yerleştirin.
- Ana kalıp P100 kabında yerleştirin ve bir şırınga kullanarak kalıp 15 mL karışımı dökün.
Not: 1.5 mm toplam çip yüksekliğe 15 mL yol açar. - Yok daha fazla hava kabarcıkları PDMS yüzeyde patlama olana bir vakum desiccator ve pompa PDMS-kalıp bünyesinde yerleştirin.
Not: Bu adımı yaklaşık 30 dakika sürer. - Gofret aşağıda ölü PDMS birim için bir koni ipucu kullanarak Petri kabına dibinde gofret itin. PDMS-kalıp aygıt için en az 2 h 70 ° C'de ayarla fırında yerleştirin.
- PDMS blok bir paslanmaz çelik düz spatula kullanarak bir kimyasal başlık altında ve yonga üzerinde dökülen isopropanol tarafından demold. Başlık paslanmaz çelik tezgah üzerinde yerleştirin.
- Silikon gofret kesme ve neşter kullanarak PDMS yineleme demold.
- (İzni 2 mm kenar boşluğu) bir bistüri veya jilet kullanarak çip kesti.
- Alıcılar 1.5 mm çap zımba sıkıca basarak yumruk ve bu kesmek ve giriş deliği bölmek için harekete. Nerede sıvı enjekte dört özel bölgelerde çipin aynı şeyi.
- Çip yapışmasını ve yapışkan bant microstructured tarafta peeling temizleyin. İsopropanol her iki tarafta serpin. O zaman çip bir hava darbe silah kullanarak basınçlı azot ile kuru.
3. desenli coverslips (24 × 24 mm2) imalatı
Not: coverslips eğri cımbızla işlemek.
- Poli-Ornitin (PLO) desenleri
- Cam coverslips plazma Temizleme bir O2 uygulayın. Plazma parametreleri: basıncı aşağı pompalama: 0,25 mbar; O2 tedarik süresi: 3 dk; gaz akışı: 10 sccm; maksimum sapma: ±5 sccm; Plazma süresi: 3 dk; ayarla basınç: 0,36 mbar; maksimum sapma: ±0.10 mbar; ayarlamak güç: 50 W; maksimum sapma: % 5; Havalandırma süresi: 45 s.
- Mix 484 µL Asetik asit ve 3-methacryloxypropyl-trimethoxysilane, 56 µL 15 mL toplam hacmi elde etmek için mutlak etanol ile tamamlayın.
- 1-mL ucu koni kullanarak, her coverslip üzerinde 500 µL Bu çözümün bir damla koymak, 2-3 dk. kuru bir temiz oda mikrofiber silecek kullanarak bekleyin.
Not: Silanized cam coverslips ile bir plastik parafin film mühürlü plastik kutular içinde oda sıcaklığında 1 ay için saklanabilecek olan. - Her coverslip bir steril ortamda bulunan bir spin coater yerleştirin. Yaklaşık % 75 coverslip (yaklaşık 500 µL) ve spin-kat 30 4000 devirde kapsayan bir pozitif fotorezist bir damla koymak s son 0,45 µm kalınlığında ulaşmak için.
- Bir ocağın bir yüzey sıcaklığı 115 ° c için 1 dk coverslips yerleştirin
- Bir maske aligner kullanarak açığa her coverslip bir dalga boyu 435, nm (G-line) aracılığıyla fabricant parametrelere göre özel maske (UV dozu hakkında 50-60 mJ.cm-1)
- 2 cam crystallizing yemekleri, bir geliştirici (hiçbir seyreltme), diğer içeren deiyonize su içeren hazırlamak.
- Tek tek her coverslip geliştirici 1 dk crystallizing çanak sürekli ve yavaşça karıştırarak dalış. O zaman deiyonize su gofret için yaklaşık 5 s. yer gofret bir emici kağıt üzerine daldırın ve bir hava darbe silah kullanarak basınçlı azot ile kuru.
- Bir harekete geçirmek O2 plazma 3.1.1 olduğu gibi aynı parametrelerle geçerlidir.
- Başlık altında dört 170 ifadesini µL damla P100 Petri kabına başına 100 µg/mL PLO çözüm. Coverslips desenli yüzü her Bu damlalar üzerinde koymak. Petri kabına kurutma önlemek için plastik parafin film ile kapatın. Gecede RT. kuluçkaya
Not: PLO çözüm coverslips için capillarity tarafından bağlı kalmalıdır. - Dört alıcıları (genellikle P60 Petri yemekler) hazır ol, üç tane PBS ve dördüncüyü deiyonize su ile doldurun. Saf etanol iki cam crystallizing yemekleri hazırlamak.
- Her coverslip Petri yemeklerin çıkar, 10-15 s için ilk PBS banyoda daldırın, coverslip dikey olarak yan koyarak bir emici doku üzerinde sıvı tahliye, örneğin ile etanol banyo içinde desenli yüzünü takın.
Not: fotorezist dağılması tamamlandığında, coverslip desenli yan bulmak zor olur. Bu nedenle, bu aşamada konumunu izlemek için önemlidir. - Çanak içinde bir ultrasonik banyo sonicator crystallizing etanol yerleştirin (120 W / 35 kHz) ve 3 dakikadır çözünmüş fotorezist izin.
Not: etanol banyo seyreltme fotorezist dağılması silmesini isteyebilir PBS tarafından sınırlamak için her 4 coverslips değiştirin. - Etanol banyo gelen coverslip çıkarmak, sonra ikinci PBS banyo içine birkaç kez dalış. Yüzey boy art arda kalan sıvı film sonuçlarını etanol kaybolur yağlı benzeri yüzey kadar kontrol edin.
- 5-10 s için coverslip üçüncü PBS banyo içine daldırın. Sonra hemen deiyonize su banyosu için transfer. Coverslip bir emici kağıt üzerine yerleştirin ve bir hava darbe silah kullanarak basınçlı azot ile kuru.
Not: Deiyonize su son durulama kurutma adım sırasında PBS kristallerinin oluşumunu önlemek için kullanılır.
- Fotorezist yapıları için yükseklik ayarlama
- Sadece 3.1.4 adımları gerçekleştirin. 3.1.8 için. adanmış maskesi (maske "Fotorezist çizgili", bkz: ek dosya "Mask_Photoresist-stripes.dxf") kullanma.
4. chip montaj ve son uygulama
- Cam alt yemekleri üzerinde montaj chip
- PDMS chip ve üzerinde bağlı cam tabak yüzey harekete geçirmek için plazma odasına koy. Parametreler: basıncı aşağı pompalama: 0,25 mbar; O2 tedarik süresi: 3 dk; gaz akışı: 10 sccm; maksimum sapma: ±5 sccm; Plazma süresi: 30 s; ayarla basınç: 0.40 mbar; maksimum sapma: ±0.10 mbar; ayarlamak güç: 50 W; maksimum sapma: % 5; Havalandırma süresi: 45 s.
- Cam coverslip ile temas halinde aktif PDMS çip kırmadan ve ince çip çip coverslip için bağ kenarlarında basınç uygulayın. Bağ gücünü artırmak için aygıt için 5-10 dk 70 ° C fırında yerleştirin.
Not: sütunlar içeren parçaları üzerinde tuşuna değil, çok fazla baskı altında daraltmak. - (Yani , RT) başlık altında ve IHs bir 100 µg/mL PLO çözüme dolu 10 µL ipucu koni yapıştırma sonra 30 dk içinde yer, o zaman sıvı enjekte. Bir damla her IHs üstündeki oluşturmak üzere sesi ayarlayın. Sonra 1 mL ucu koni kullanarak, PBS çipi çevresinde Petri kabına ekleyin.
- RT fişi en az 2 h kuluçka süresi ver. Gecede kuluçka için Petri kabına kurutma önlemek için plastik parafin film kullanarak kapatın.
Not: Sıvı çip atılmalıdır çip dışında başka türlü sızıntı değil. - 10 µL ipucu koni hafifçe her IH basın ve sıvı aşırı kadar emmek. O zaman tamamen ipucu koni çıkış içinde sopa ve geri kalan sıvı kadar çizin.
- PLO laminin izleyerek adım 4.1.5 (boşalma) ve 4.1.3 (doldurma) verilen talimatları yerine. RT 1 h için kuluçkaya.
- Laminin kültür orta aşağıda adım 4.1.5 (boşalma) ve 4.1.3 (doldurma) verilen talimatları yerine. Kültür orta bileşimi: MEM %81.8; Sodyum Pyruvate 100 mM % 1; Glutamax 200 mM % 1; Serum % 5 at; B27 ek % 2, N2% %0,2 1, gentamisin ek; çözüm 220 nm filtre kullanarak filtre. 1-mL ucu koni kullanarak, çip bu orta tarafından çevreleyen PBS da eski yerine koymak.
- Çip 37 ° C ve % 5 CO2 en az 5 h (veya gece) önce nöron tohum için düzenlenmiş kuluçka makinesi içine koymak.
- Desenli coverslips kullanarak montaj chip
Not: desenli coverslips olumlu fotorezist başvuru nesneleri dahil ederseniz, adımları 4.2.1 4.2.9 gerçekleştirin. Aksi takdirde, sadece 4.2.3, desenli PLO coverslip PDMS aygıtta 4.1.2 içinde belirtildiği gibi kültür orta içine koymak sopa adımı gerçekleştirmeniz ve chip 4.2.10 adıma geçin.- Bir damla su bir dikdörtgen kalın mikroskop cam slayt üzerinde mevduat ve coverslip capillarity (sigara desenli yan cam slayt karşı karşıya) tarafından cam slayt üzerinde sopa. Mikroskop altında bir keçeli kalem kullanarak cam slayt arka fotorezist çizgili konumunu işaretleyin.
- Desenli cam coverslip maskesi aligner maskesi sahibinin yerleştirin. Fotorezist başvuru nesneleri ortalamak için keçe kalemle yapılan işareti güveniyor.
- Plazma adımıysa PDMS çipte 4.1.1 içinde açıklandığı gibi.
- PDMS çip yer maskesi aligner, mobil substrat tutucu (chuck).
Not: optik kontrastı arttırmak için silikon gofret PDMS çip altında yerleştirin. Hizalama işlemi (kullanım Chuck'a sopa bir saydam bandı) sırasında silikon gofret üzerinde chuck sıkıca bağlı kalması gerekir. - Çip üzerinde coverslip bulunan fotorezist çizgiler dizisi ile hizalamak için mekanik temas limitte chuck kaldır.
- Belgili tanımlık küçük parça ve coverslip arasında mekanik temas PDMS yüzey dokunmatik sütun kadar cam coverslip chuck kaldırma bitirerek elde etmek.
- Chuck daha düşük. Şimdi çip için maskesi sahibinden gümrüklü coverslip kaldırın. Sonra cihazın 35-mm Petri kabına yerleştirin ve her şeyi fırın içine aktarmak (sıcaklık: 70 ° C) 5-10 bağ gücünü artırmak üzere min için.
- Adımı 4.1.3 olduğu gibi gerçekleştirin.
Not: PLO kullanarak coverslips desenli, doğrudan adım 4.2.7 4.2.9 adıma gidin. - PLO yordamları açıklanan adımlardaki 4.1.5 (boşalma) ve (doldurma) 4.1.3 kaplama orta şunlarla değiştirin. 1-mL ucu koni kullanarak, çip bu orta tarafından çevreleyen PBS da eski yerine koymak.
- Çip nöron, tohum kadar en az 5 h kuluçka süresi ile 37 ° C ve % 5 CO2 ' de düzenlenen kuluçka makinesi içine koymak.
5. nöron kültürü
- Diseksiyon orta (HH orta) 100 mL HBSS 10 10 mL karıştırarak hazırlayın x, Hepes 1 M 2 mL ve 88 mL steril su 200 mL plastik şişe.
Not: HH orta kültür önceki gün hazır olun. - Hippocampus E18 fareler embriyo rahim ağzı çıkığı (Charles Rivers dan C57BL/6J fareler) tarafından euthanized bir anneden çıkarılan incelemek. 16' ayrıntılı örneğin kandan adımlardır.
- Hippocampus tripsin (w/o içine HH orta 2.7 mL EDTA tripsin %2.5 0.3 mL) 37 ° C'de 10 dakika için kimyasal ayrışma başlatmak için içeren bir plastik tüp yerleştirin.
- Hemen hemen tüm sıvı atın ve eski yerine koymak o ile 5-10 mL tek kullanımlık plastik Pipetler kullanarak SS. 3 kez yapın. Son doldurmak için orta yerine HH kaplama 1 mL kullanın.
- Mekanik bir 1 mL ipucu-koni isteyen ve birkaç kez tam ses çıkarma, kabarcıklar yapma ve en fazla 15-20 pasajlar kullanarak kaçınarak kullanarak doku ayırmak.
- Ayrı bir 500 µL alıcıya, PBS 45 µL içinde seyreltilmiş hücre süspansiyon 5 µL kullanarak bir çözüm hazırlamak. 10 µL pipet kullanarak bu çözümün 1 µL al ve seyreltilmiş süspansiyon Malassez hücre sayaçtaki yerleştirin. 17 ' sağlanan göstergeler hücre sayısını tahmin etmek için kullanın.
Not: Bir tek Hipokampus genellikle yaklaşık 0.5 milyon nöronların sağlar. - 6 dk RT. az için 100 x g, santrifüj
- Süpernatant atmak ve 10 milyon hücre/mL konsantrasyonu elde etmek için gerekli kaplama orta hacmine göre değiştirin. Resuspend hücreleri tarafından gittikçe aspire ve hücre süspansiyon 1 mL ucu koni ile dışarı atmak.
- İçinde çip mevcut kaplama orta yukarı çekmek (4.1.5 adıma bakın). 2-3 µL 10 µL pipet kullanarak taze resuspended çözüm toplamak ve girişi enjekte (4.1.3 adımda açıklanan enjeksiyon yordama bakın). Hemen çıkış aynı işlemi tekrarlayın.
- Her su deposu kaplama ortamda aynı birim hakkında enjekte (4.1.3 adıma bakın).
Not: Hızlı bir şekilde hücreleri yoğunluğunu kontrol etmek mikroskop altında çip gözlemlemek. Büyüklük optimum hücre yoğunluğu hakkında için karşılık gelen 5-10 4 sütunlar tarafından ayrılmış kare yüzey hücrelerde (0.3 mm hakkında2, Yani hakkında mm2başına 15-20 hücre). - Sonunda onun yerine 0,5-1 kullanarak 5.10 yineleyin µL hedeflenen hücre yoğunluğu ulaşmak için hücre süspansiyon.
- 37 ° C % 5 CO2' de düzenlenen bir kuluçka numaralı seribaşı çip yerleştirin.
6. Floresans dışlama gözlem
- Kültür orta görüntüleme orta yerine.
- 4.1.7 olduğu gibi görüntüleme orta hazırlamak ama MEM fenol red yoksun kullanın ve floresan dextran ekleyin. Bu amaçla dextran (Moleküler ağırlığı 10.000 g/mol, hisse senedi çözüm 10 mg/mL PBS, konsantre) seyreltik 0.5-1'in son bir konsantrasyon sağlamak için mg/mL görüntüleme orta.
Not: Kullanım Dextran emme/emisyon maxima 496/524 veya 650/668 conjugates. 0,45 µm yüksek pozitif fotorezist yapıları (onların otomatik Floresans kırmızı bant genişliği kurtulmak için) ve görüntü nöronlar (daha az toksik) ikinci resim için ilk tercih ederim. - Tüm alıcılar 10 µL pipet kullanarak boş ve onları tamamen yeniden görüntüleme orta ile doldurmak (Adım 4.1.3 ve 4.1.5 orta yerine kesin metodolojisi için bakın).
- 4.1.7 olduğu gibi görüntüleme orta hazırlamak ama MEM fenol red yoksun kullanın ve floresan dextran ekleyin. Bu amaçla dextran (Moleküler ağırlığı 10.000 g/mol, hisse senedi çözüm 10 mg/mL PBS, konsantre) seyreltik 0.5-1'in son bir konsantrasyon sağlamak için mg/mL görüntüleme orta.
- Görüntüleme
- 37 ° C ve CO%25 düzenlenmiş bir çevre odası ile donatılmış bir epifluorescence mikroskop altında belgili tanımlık küçük parça yerleştirin. 40 X, sayısal diyafram (NA) 0.8 kuru kullanım amacı, % 30'u tam güç (tam güç: 3 W) ve çekim hızı 30 ms. Görüntü odağı (ile hızlandırılmış deneyler durumunda birden çok ardışık görüntülere tek), hücre elde.
- Görüntü analizi
- Homojen bir arka plan almak için adanmış Yazılımda uygulanan arka plan azaltma rutin kullanarak görüntüleri normalleştirmek. 13 görüntü işleme adımları bu yazılım dahil ilgili ayrıntılar için bkz. Çıkış görüntü var bir. MAT biçimi.
- Dönüştürün. MAT dosyasına. Ek malzeme (conversion_mattotiff.m, importfilevol.m için çağıran) koymak rutin kullanarak TIFF 8 bit görüntüleri.
- Alma işlemini gerçekleştirmek > görüntü sırası üzerinde bir video oluşturmak için ImageJ. TIFF görüntüleri.
- Bir ayağı (başvuru nesnesi) ve bir kare alan hücreler (arka plan, Yani yüksekliği sıfır) yoksun odasının ortalama yoğunluğu B ortasına yerelleştirilmiş bir kare alan ortalama yoğunluğu P hesaplamak. 18 detaylı görüntü işleme metodolojisi örneği için bkz.
Not: Yoğunluk başvurular olmalıdır gibi kullanılan kare alanları yanal boyutunu piksel yeterli sayıda ayağı kenarlarından ışık kirliliği kaçınırken almak için ayağı çapı yaklaşık yarısı. - Yoğunluk ben doğrusal dönüşüm Kanunu yüksekliği hkurmak için P ve B değerleri kullanın:

sc odası, bilinen yüksekliği ile ve
ve
Not: Hiçbir tespit autofluorescence PDMS görüntüler. - Faiz bölgenin çevresinde bir alan seçme, yoğunluğu ImageJ kullanarak entegre ( 19 daha fazla bilgi için bkz:) ve 6.3.5 içinde bir hücreyi bölme hacmi ölçmek için elde edilen dönüşüm yasa geçerli.
Not: Aktin, örneğin, büyüme seçimi için GFP-LifeAct nöronlar, select GFP emisyon kanalı Kaydet Bu kontur ilgi bölgenin konileri gibi alt hücresel öğeleri Floresans üzerinde dayanan ilgi alanı seçilebilir dextran (kırmızılı) emisyon kanal aynı bölge içinde bir ROI Yöneticisi aracı, daha sonra hücre hacmi içine ölçü kullanarak bölgesi.
Sonuçlar
1 ve 2 bölümlerinde açıklandığı imalat sürecinin sonucu şekil 1Agörüntüleri tarafından resimli-1B ve şekil 1 ceğrisi. Şekil 1 d PDMS çip, Yani orta ve 20 µm yüksek sonraki orta odası iki farklı temsilcisi alanı pürüzlülük değerlerini görüntüler. Pürüzlülük yaklaşık 7 faktör tarafından bir düşüş yerine SU-8 fotorezist kazınmış Si gofret kullanarak elde edilmiştir. O zaman, FXm ilk 10 µm yüksek odası içinde bilinen geometri (şekil 2A) fotorezist şerit üzerinde uygulandı. Görüntü işleme ve yoğunluk yükseklik dönüşüm sonra (bkz. şekil 2Bgrafik) kesit bu Şerit (şekil 2C) boyunca üzerinde gerçekleştirilen FXm profilleri sağlar istenilen yükseklik profilleri (şekil 2B). Şekil 2B mekanik profilometrisi ve FXm yöntemleri kullanılarak elde profilleri arasında karşılaştırma gösterir. Kenar ve yayla değer, dahil olmak üzere bu profiller, doğrulama yöntemi çok benzer. Not FXm veri saçılma olarak daha fazla şekil 3 ve şekil 4, değerlendirildi yönteminin son çözünürlük temsilcisi değildir ama çok zayıf bir olası etkisini önlemek için düşük yoğunluklu sonuçlarından istihdam Auto-Floresan, GFP kanaldaki fotorezist.
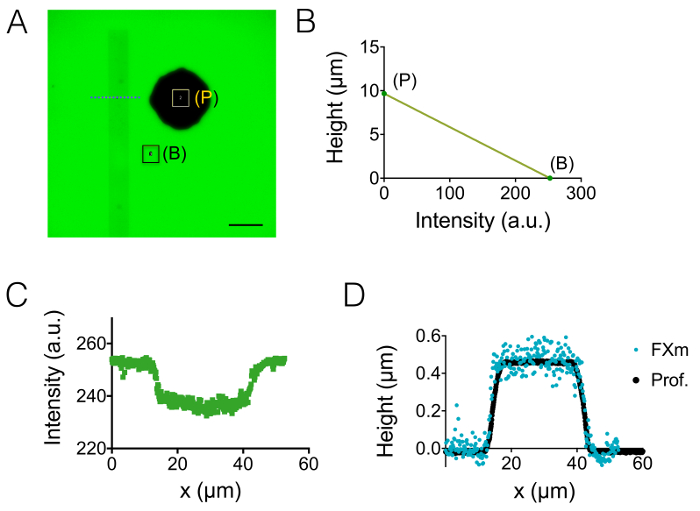
O zaman, biz neurites 3 µm ve 10 µm yüksek chambers (şekil 3) gözlenen. Yaklaşık 18 arka plan gürültü standart sapmasıdır nm yoğunluğu için yükseklik dönüşüm ve arka plan düzeltme sonra. Bu değer biraz yüksek--dan fiziksel PDMS yüzeylerde döküm silikon yüzey pürüzlülüğü (12 nm, şekil 1 dtablo bkz:) ama SU-8 kalıpları PDMS üzerinde ölçülen pürüzlülüğü elde daha çok daha düşük. Bu sonuçlar ayağı oyuncular için SU-8 fotorezist delik açmak yerine silikon gofret kuyu sondaj, katma değer vurgulayın. Düşük bir değer şekil 3Aiçinde görüntülenen bir birimdeki bir yüksek sinyal-gürültü oranı ve çok net görüntüler sağlar. Böyle görüntüleri alınabilmesi için veri örneği, biz 1,6 µm (Yani 10 piksel) geniş neurite hacmi hesaplanan (bkz. şekil 3Bgrafik) dilim. Bu veri doğrusal bir uyum içinde bir ilk yaklaşım kullanarak verir ortalama neurite yükseklik değeri yaklaşık 400 nm 500 nm aksonal çapı bulundu 10 gün içinde eski pups içinde corpus callosum 5 örneğin ile karşılaştırılmak üzere,. Ayrıca micropatterns oluşan seri olarak abutted 2 µm ve uzunluğu 30 µm 6 µm geniş çizgili yapıştırılması ile FXm birlikte. Amacımız neurite genişliği etkisi 3D şeklini çalışma olmuştur. Şekil 3 c 10 µm yüksek odasında elde edilen bütün nöron görüntünün yanlış renkte bir 3D temsil gösterir. Soma en büyük şerit ekstremite üzerinde bulunan, ancak Neurites 2 µm ve 6 µm geniş çizgili, yayılıyor. Yükseklik profilleri içinde üç farklı kesit çizildi. Şekil 3Aiçinde görüntülenen grafik ile tutarlılık içinde yüzey neurite genişliği (3D şekil) ile kesit artışı üzerinde entegre.
Biz de büyüme Koni (GC) 3D yapılar üzerinde duruldu. Şekil 4 A-B hangi dallı alt yapılarını vurgulamak bir 3 µm yüksek odasında, elde edilen iki farklı GC profillerini görüntüler. Buna ek olarak, GCs bir 12 µm yüksek odasında hacmi dinamikleri takip etmek zaman hata deneyler yapılır. Şekil 4 c daralma bir döngüsü ve birkaç dakika onlarca zaman ölçeğini içinde belirli bir GC reaktivasyonu görüntüler. GFP-lifeact fare kullanımı sayesinde, büyüme koniler GFP emisyon dalga boyu içinde lokalize (510 nm)--dan onların yüksek aktin konsantrasyon. Dalga boyu belirlenen yüzey dextran emisyon dalga boyu, 647 üzerinde entegre etmek için kullanılan nm GC birim hesaplamak için. Şekil 4 d sonunda yaklaşık 6 µm3değerini üzerinde ortalanmış üç farklı nöronlar GC birim farklı zaman noktaları ve konumu itibariyle dağılımı gösterir.

Şekil 1: FXm PDMS chambers. (A) şemaları microfabrication son kalıp önde gelen dört farklı ana adımları. Giriş, çıkış ve su depoları konumunu belirtilir. Ölçek çubukları: 1 mm. (B) PDMS FXm odası bir optik profilometer kullanılarak elde görüntüsü. Bu görüntü 10 µm yüksek sütun ve 3 satır ve yüksekliği 20, 50 ve 90 µm ara odaları içeren orta odası gösterir. Ölçek çubuğu: 500 µm. (C) (B) çizilmiş iki kesik çizgiler boyunca çipin kesit görünümü. Sarı/altın: kesiti boyunca sütunlar, mavi: kesit sütunlar arasında. (D) PDMS pürüzlülük değerleri ölçülen üzerinde 50 × 50 µm2 alanları silikon ve 20 µm yüksek SU-8 orta odası kalıp demek (oklar bu alanların konum için bakınız). Ortalama değerleri üç farklı alanlarda ölçümleri elde edilmiştir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Şekil 2: Kalibrasyon fotorezist şerit ilgi nesnesi kullanarak FXm yönteminin. (A) bir 10 µm yüksek odasında alınan GFP-floresan görüntü 10.000 MW dextran 488 emici dolu nm'de 1 mg/mL. (B: arka plan, P: ayağı). Gözlem kuru 40 X NA 0,8 amacı ile. Ölçek çubuğu: 50 µm. (B) doğrusal kalibrasyon hukuk fotorezist geçiş A. (C) floresan yoğunluğu profil (A), görüntülenen mavi Kesikli çizgi düzeyde elde gösterilen iki renkli dikdörtgenlerin ortalama yoğunluğu elde Şerit (0,45 µm yüksek pozitif fotorezist). (D) mekanik profilometer (siyah nokta) ve FXm Yükseklik (B) (mavi noktalar) veri dönüştürme sonra yoğunluğu elde profilleri karşılaştırılması. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
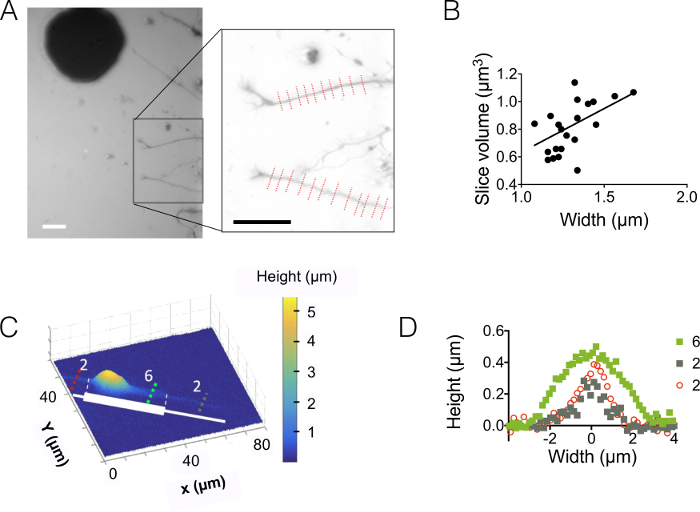
Şekil 3: Neurite birim görüntüleme. (A) Neurite soma sonraki 15 µm ara odasında bulunan Merkez 3 µm yüksek odanın içine uzanan. 488 10.000 MW dextran emici kullanılarak gerçekleştirilen görüntüleme nm ve 40 X, NA 0,8 kuru amaç. İlave arka plan azaltma rutin olayları kullanımdan sonra iki neurites ve sağdaki grafik çizmek için seçilen elde. Ölçek çubukları: 30 µm. (B) Neurite dilim birim neurite genişliği bir fonksiyonu olarak elde edilen (A) gösterilen 22 profillerinden (ortalama 10 piksel, Yani 1.6 µm "neurite dilim" Tarih olarak). Düz çizgiyi başlangıç noktası geçen yamaç 0,4 µm lineer bir uyum gösterir. (C) bir yapıştırıcı şerit üzerinde desenli bir neuron yanlış renk imajı art arda 2 µm ve 6 µm geniş kütükleri (beyaz olarak temsil edilen) yaptı. Ölçümler 10.000 MW dextran 647 emici dolu bir 10 µm yüksek odasında yapılmıştır nm ve 40 x NA kullanarak 0,8 kuru amaç. (D) yükseklik profilleri aynı tutmak (C), gösterilen renkli kesik çizgiler için karşılık gelen renk kodu. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4: statik ve dinamik büyüme koni görüntüleme. (A-B) 3 µm yüksek odasında yükseklik dönüşüm ilişkili Albümdeki görüntülenen sarı çizgiler boyunca yoğunluk sonra elde edilen büyüme koni yükseklik profilleri de içerir. 10.000 MW dextran 488 emici ile dolgu kullanılarak gerçekleştirilen gözlem nm ve 40 X, NA 0,8 kuru amaç. (C) bütün nöron görüntüleme 12 µm yüksek odasında 10.000 MW dextran 647 emici dolu nm. Gözlem iki floresan kanallarında yapılan: GFP büyüme koni yerelleştirme (Kesikli sarı çizgiler) ve floresan dışlama birimden GC hesaplamak için CY5 için. Kesikli sarı çizgilerle dahil yüzey GC birim hesaplamak için kullanıldı. Grafik, iki temsilcisi farklı zaman noktalarda GFP ve CY5 kanaldaki GC birim varyasyon zaman ve ilişkili türleri Morfoloji üzerinde gösterir. Tüm verileri bir 40 x NA kullanarak satın alınan 0.8 kuru amaç her 3 dk. ölçek çubukları: 10 µm. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Adım | 1:8 µm katman maskesi | 2:30 maske µm tabaka | 3:40 maske µm tabaka |
| SU-8 tipi | 2007 | 2025 | 2050 |
| Spincoating | 30 s @ 2000 rpm | 30 s @ 3050 rpm | 30 s @ 3250 devir/dakika |
| Yumuşak kek | 3 dakikada 95 ° C | 2 dakikada 65 ° C + 6 dakikada 95 ° C | 3 dakikada 65 ° C + 7 dakikada 95 ° C |
| Pozlama enerji | 110 mJ/cm2 | 155 mJ/cm2 | 170 mJ/cm2 |
| Sonrası pozlama fırında | @ 95 ° C 4 dk | 1 dakikada 65 ° C + 6 dakikada 95 ° C | 2 dakikada 65 ° C + 7 dakikada 95 ° C |
| Geliştirme | 2 dk 30 sn | 5 dk | 6 dk |
| Sabit fırında (isteğe bağlı) | 3-5 dakikada 200 ° C | 3-5 dakikada 200 ° C | 3-5 dakikada 200 ° C |
Tablo 1: Merkez TMMOB yüksekliği 12 mikron içeren bir aygıtı oluşturmak için gerçekleştirilen fotolitografi adımlar. Ara chambers yükseklikleri: 20, 50 ve 90 µm.
| Adım | Maske 1:10 µm tabaka | 2:30 maske µm tabaka | 3:40 maske µm tabaka |
| SU-8 tipi | 2007 | 2025 | 2050 |
| Spincoating | 30 s @ 1500 rpm | 30 s @ 3050 rpm | 30 s @ 3250 devir/dakika |
| Yumuşak kek | 3 dakikada 95 ° C | 2 dakikada 65 ° C + 6 dakikada 95 ° C | 3 dakikada 65 ° C + 7 dakikada 95 ° C |
| Pozlama enerji | 125 mJ/cm2 | 155 mJ/cm2 | 170 mJ/cm2 |
| Sonrası pozlama fırında | @ 95 ° C 4 dk | 1 dakikada 65 ° C + 6 dakikada 95 ° C | 2 dakikada 65 ° C + 7 dakikada 95 ° C |
| Geliştirme | 2 dk 30 sn | 5 dk | 6 dk |
| Sabit fırında (isteğe bağlı) | 3-5 dakikada 200 ° C | 3-5 dakikada 200 ° C | 3-5 dakikada 200 ° C |
Tablo 2: yüksekliği 10 mikron merkezi bir odası içeren bir aygıtı oluşturmak için gerçekleştirilen fotolitografi adımlar. Ara chambers yükseklikleri: 20, 50 ve 90 µm.
| Adım | 1:12 maske µm tabaka | 2:32 maske µm tabaka | 3:40 maske µm tabaka |
| SU-8 tipi | 2015 | 2025 | 2050 |
| Spincoating | 30 s @ 3250 devir/dakika | 30 s @ 2500 rpm | 30 s @ 3250 devir/dakika |
| Yumuşak kek | 3 dakikada 95 ° C | 2 dakikada 65 ° C + 5 dakikada 95 ° C | 3 dakikada 65 ° C + 7 dakikada 95 ° C |
| Çekim hızı | 140 mJ/cm2 | 157 mJ/cm2 | 170 mJ/cm2 |
| Sonrası pozlama fırında | @ 95 ° C 4 dk | 1 dakikada 65 ° C + 5 dakikada 95 ° C | 2 dakikada 65 ° C + 7 dakikada 95 ° C |
| Geliştirme | 3 dk. | 5 dk | 6 dk |
| Sabit fırında (isteğe bağlı) | 3-5 dakikada 200 ° C | 3-5 dakikada 200 ° C | 3-5 dakikada 200 ° C |
Tablo 3: yüksekliği 3 μm kalınlığında bir orta odası içeren bir aygıtı oluşturmak için gerçekleştirilen fotolitografi adımlar. Ara chambers yükseklikleri: 18, 50 ile 90 µm.
Ek veri 1: masks_neuron_volume_chips.tiff. Şematik PDMS aygıt (DRIE maskesi ve maskeleri 1-3) imal için kullanılan maskeler. Bu dosyayı indirmek için buraya tıklayınız.
Ek veri 2: dosyasını "masks_neuron_volume_chips.dxf". DRIE maskesi ve maskeleri 1-3 imal etmek izin elektronik dosyaları. Bu dosyayı indirmek için buraya tıklayınız.
Ek veri 3: "Mask_Photoresist-stripes.dxf". Fotorezist çizgili fotolitografi için kullanılan maskeyi imal etmek izin elektronik dosyaları. Bu dosyayı indirmek için buraya tıklayınız.
Ek veri 4: conversion_mattotiff.m dosya Bu dosyayı indirmek için buraya tıklayınız.
Ek veri 5: importfilevol.m dosya Bu dosyayı indirmek için buraya tıklayınız.
Tartışmalar
Birim görüntüleme nöronların uzun ve ince uzantıları bu hücreler nedeniyle FXm tekniği için bir meydan okuma kabul ettiğiniz anlamına gelir. Bu iletişim kuralı aynı nöron görüntüleme için adanmış mikrosıvısal aygıt türü türevleri açıklar.
Mikrosıvısal tasarım yönleri, yanında objektif seçimi Floresans dışlama görüntüleme için esastır ve yanal çözünürlük ve görüntü netliği arasında bir denge anlamına gelir. 13 ' te odak derinliğe kadar Oda yüksekliği daha küçük önde gelen yüksek bir NA görüntüleme odak gerçekleştirdiyseniz ve ben nesnenin kontur arasında yeterli bir kenar boşluğu bırakıldığı takdirde birim ölçü duyarlık için zararlı olmadığını gösterilmiştir nterest ve entegrasyon yüzeyi sınırları. Ancak, odak derinliği yüksek bir odası kullanımı faiz nesnelerin kenarlarını foton difüzyon, hangi düzgünleştirir nedeniyle görüntü netliği bozar. 3 µm yüksek odası imalatı bu yanal bulanıklaştırma azaltılmış ve son derece iyi tanımlanmış floresan dışlama görüntüleri bile yüksek NA kullanarak sağlanan (0.8) 40 X hedefleri nöronal dalları yüksek yanal çözünürlük ile görselleştirmek için.
Montaj çip bir kritik adım, özellikle söz konusu olduğunda 3 µm yüksek chambers, ama dikkatli işleme 4.1.2 içinde açıklandığı gibi çatı çöküşü önler. Bu ince odalarına ilişkili hacim oranı yüksek yüzeye de zamanla Dextran konsantrasyon kararlılığını gündeme. Biz Dextran yüzey emilimini kuluçka bir geceden sonra önemsiz kontrol ettirin: PBS tarafından Dextran değiştirdikten sonra yoğunluk farkı ayağı ile arka plan arasında yaklaşık 1000 arasında ilk yoğunluğu kontrast başına 1 oldu Bu iki bölgenin Dextran huzurunda. Nöronların alt coverslip hem PDMS çatıda uygun unutmayın. Desenli coverslips (ne zaman PDMS odası içinde yapışkan molekülleri kuluçkaya değilYani ), kaplama olarak kullanarak bu nedenle kesinlikle odası dibinde yerelleştirildiğinde bu etkisi kaybolur.
Gerçeğini yöntemi, Yani dextran endositoz, büyük sınırlandırılması biridir çok sınırlı nedeniyle zorlu onların morfolojisi dışında nöronlar FXm için oldukça uygundur bu hücrelerde. Bir 10 seçtiğimiz kDa formülasyonu uzun bastırmak için aralığı (saat) herhangi görünür endositoz olayları.
Sonuç olarak, FXm kavramsal sadeliği bir dizi nanometric PDMS pürüzlülük ve micrometric odası yükseklik veya eşitsizlik için düzeltmek için arka plan düzeltme gibi mevcut protokolü tarafından çözüldüğünü deneysel sorununu tarafından dengelenir sütunlar arasında PDMS tavan. Ancak, floresan orta sınırlamak için yakın mikrosıvısal odası kullanımı birkaç belirli kısıtlamalar etkili yüzey hücre adezyon veya merkezden soma dışlamak için zorunluluk için kullanılabilir düşüren destek ayağı, ihtiyaç gibi verimleri odası nöronal uzantıları yüksek çözünürlüklü gözlem için erişilebilir hücre bölgelerinde kısıtlar en yüksek netlik ile gözlemlemek için. Bu yöntemin olası bir evrim optik bir tarafından değiştirilmesi bu fiziksel doğumdan kurtulmak olacaktır. Hafif levha mikroskobu yeni gelişme avantajlı FXm ile gelecekte birlikte.
Açıklamalar
Yazarlar hiçbir çıkar çatışması beyan ederim.
Teşekkürler
Yazarlar süreç geliştirme ve cihaz imalat değerli destek için ChiLab, malzeme ve Microsystems laboratuvar - Politecnico di Torino - DISAT, Prof. C F Pirri, Dr. M Cocuzza ve Dr. S L Marasso, bizzat kabul etmek istiyorum. Victor Racine Quantacell üzerinden tartışma ve görüntü işleme desteği için teşekkürler. GFP LifeAct fareler ile bize sağlamak için hayvan tesisin Institut Curie destekleri için fare ve Pablo Vargas ve Ana-Maria Lennon (Institut Curie) Isabelle Grandjean ve Manon Chartier için sana şükrediyoruz. Olivier Thouvenin Institut Langevin ve Clotilde Cadart, Larisa Venkova ve Matthieu Piels üzerinden Institut Curie - UMR 144, Floresans dışlama yöntemi anlamada yardım için minnettarız. Nihayet, Institut Pierre-Gilles de Gennes (CNRS UMS 3750) teknolojik platform desteklerinden dolayı microfabrication içinde teşekkür ederim. Bu eser Avrupa Araştırma Konseyi gelişmiş Grant No 321107 tarafından "Çello," kısmen desteklenen PSL Université (SwithNeuroTrails Projesi), ANR Investissement d'Avenir ve IPGG Labex ve Equipex.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Plasmalab System 100 | Oxford Instruments | To perform DRIE | |
| MJB4 mask aligner | SUSS MicroTec | SU-8 photolithography | |
| NXQ 4006 Mask aligner | Neutronix Quintel | Photolithography associated to DRIE | |
| Plasma cleaner | Diener Electronic | Pico PCCE | |
| Cell culture hood | ADS Laminaire | Optimale 12 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Multifuge X1R | |
| Incubator 37 °C 5% CO2 | Panasonic | MCO-170AICUVH-PE IncuSafe CO2 Incubator | |
| Epifluorescence microscope | Leica | DMi8 | |
| PDMS Oven between 65 and 80 °C | Memmert | ||
| Mechanical profilometer | Veeco | Dektak 6M Stylus Profiler | |
| Optical profilometer | Veeco | Wyko NT9100 | |
| Vacuum desiccator | Verrerie Villeurbanaise (Kartel Labware) | 230KAR | Diameter 200 mm |
| Ultrasonic bath sonicator | Labo Moderne | SHE1000 | Volume of the bath: 0.8 liter |
| Hotplate | Stuart SD162 | SD162 | |
| Masks | |||
| DRIE | Supplementary data | ||
| Su8 Mask 1 | Supplementary data | ||
| Su8 Mask 2 | Supplementary data | ||
| Su8 Mask 3 | Supplementary data | ||
| S1805 calibration stripes | Supplementary data | ||
| Small laboratory equipment | |||
| 1.5 mm hole puncher | Sigma-Aldrich | 29002519 (US reference) | |
| Scalpel or razor blade | |||
| 9" Stainless Steel Flat Spatula with Spoon | VWR International | 82027-532 | To demold PDMS |
| Top Lip Wafer Handling | VWR International | 63042-096 | |
| Curved tweezer | FST | Dumont #7 Forceps - Standard / Dumoxel | To manipulate glass coverslips |
| Substrates | |||
| Silicon wafer | Prolog Semicor Ltd | ||
| 24x24 mm glass coverslips | VWR | 631-0127 | |
| Photoresists and developpers | |||
| AZ 1518 positive photoresist | Microchemicals GmbH | Before DRIE process, thicknes 1.8 µm | |
| AZ 351B developer | Microchemicals GmbH | To develop positive AZ 1518 photoresist | |
| SU-8 2007 | MicroChem | ||
| SU-8 2025 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| PGMA developer | Technic | To develop SU-8 negative photoresist | |
| Microposit S1805 resist | Chimie Tech Services | Positive photoresist used to obtain 0.5µm high structures | |
| MF 26A developer | Chimie Tech Services | To develop positive S1805 photoresist | |
| Laboratory consumables | |||
| Disposable plastic pipette 3 mL | LifeTechnologies - ThermoFisher | ||
| P100 Petri dishes | TPP | 93100 | |
| 20 mL syringe | Terumo | SS+20ES1 | |
| Transparent scotch tape | |||
| Square wipes | VWR | 115-2148 | |
| Parafilm | DUTSCHER | 90260 | Plastic paraffin film |
| Chemicals | |||
| (3-Methacryloxypropyl)trichlorosilane | abcr | AB 109004 | |
| PDMS and curing agent Sylgard 184 | Sigma-Aldrich | 761036 | |
| isopropanol | W292907 | ||
| poly-ornithine | Sigma-Aldrich | P4957 - 50 mL | |
| Ethanol absolute | Sigma-aldrich | 02865 | 99.8% |
| 3-methacryloxypropyl-trimethoxysilane | Sigma-aldrich | M6514-25ML | (C4H5O2)-(CH2)3- Si(OCH3)3 |
| acetic acid | Sigma-aldrich | 71251-5ML-F | |
| Dextran 10kW conjugated with Alexa488 | LifeTechnologies - ThermoFisher | D22910 | Absoprtion at 488 nm |
| Dextran 10kW conjugated with Alexa647 | LifeTechnologies - ThermoFisher | D22914 | Absoprtion at 647 nm |
| Culture medium | |||
| MEM | LifeTechnologies - ThermoFisher | 21090-022 | |
| Horse Serum | LifeTechnologies - ThermoFisher | 26050088 | |
| B27 | LifeTechnologies - ThermoFisher | 12587-010 | |
| Glutamax 200 mM | LifeTechnologies - ThermoFisher | 35050-061 | |
| Sodium Pyruvate GIBCO 100 mM | LifeTechnologies - ThermoFisher | 11360-070 | |
| Gentamicin | LifeTechnologies - ThermoFisher | 15710-049 | |
| PBS | Sigma-Aldrich | D8537-500ML | |
| HBSS 10x | LifeTechnologies - ThermoFisher | 14180-046 | |
| Hepes 1M | LifeTechnologies - ThermoFisher | 15630-056 | |
| trypsin-EDTA | Sigma-Aldrich | 59418C-100ML | |
| Neurobasal | LifeTechnologies - ThermoFisher | 21103-049 | |
| Neurobasal without phenol red | LifeTechnologies - ThermoFisher | 12348-017 | |
| Softwares | |||
| Routine in Matlab for background normalization | Quantacell | Contact Victor Racine: victor.racine@quantacell.com | |
| ImageJ | To select specific ROI for image analysis | ||
| Routine | ImageJ | Supplementary data | |
| Routine | Matlab | Supplementary data |
Referanslar
- Jun, S., Taheri-Araghi, S. Cell-size maintenance: universal strategy revealed. Trends Microbiol. 23 (1), 4-6 (2015).
- Zlotek-Zlotkiewicz, E., Monnier, S., Cappello, G., Le Berre, M., Piel, M. Optical volume and mass measurements show that mammalian cells swell during mitosis. J. Cell Biol. 211 (4), 765-774 (2015).
- Kim, G. H., Kosterin, P., Obaid, A. L., Salzberg, B. M. A mechanical spike accompanies the action potential in Mammalian nerve terminals. Biophys J. 92 (9), 3122-3129 (2007).
- Iacono, D., et al. Neuronal Hypertrophy in Asymptomatic Alzheimer Disease. J Neuropathol Exp Neurol. 67 (6), 578-589 (2008).
- Cheli, V. T., et al. Conditional Deletion of the L-Type Calcium Channel Cav1. 2 in Oligodendrocyte Progenitor Cells Affects Postnatal Myelination in Mice. J Neurosci. 36 (42), 10853-10869 (2016).
- Kneynsberg, A., Collier, T. J., Manfredsson, F. P., Kanaan, N. M. Quantitative and semi-quantitative measurements of axonal degeneration in tissue and primary neuron cultures. J Neurosci Methods. 266, 32-41 (2016).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PloS one. 10 (3), (2015).
- Aguet, F., et al. Membrane dynamics of dividing cells imaged by lattice light-sheet microscopy. Mol Biol Cell. 27 (22), 3418-3435 (2016).
- Roland, A. B., et al. Cannabinoid-induced actomyosin contractility shapes neuronal morphology and growth. eLife. 3, (2014).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci USA. 103 (47), 17759-17764 (2006).
- Chen, J., Xue, C., Zhao, Y., Chen, D., Wu, M. H., Wang, J. Microfluidic impedance flow cytometry enabling high-throughput single-cell electrical property characterization. Int J Mol Sci. 16 (5), 9804-9830 (2015).
- Bottier, C., et al. Dynamic measurement of the height and volume of migrating cells by a novel fluorescence microscopy technique. Lab Chip. 11, 3855-3863 (2011).
- Cadart, C., et al. Fluorescence eXclusion Measurement of volume in live cells. Methods Cell Biol. 139, 103-120 (2017).
- Marasso, S. L., et al. A novel graphene based nanocomposite for application in 3D flexible micro-supercapacitors. Materials Research Express. 3 (6), 065001(2016).
- Welch, C. C., Goodyear, A. L., Wahlbrink, T., Lemme, M. C., Mollenhauer, T. Silicon etch process options for micro-and nanotechnology using inductively coupled plasmas. Microelectronic Engineering. 83 (4), 1170-1173 (2006).
- Fath, T., Ke, Y. D., Gunning, P., Götz, J., Ittner, L. M. Primary support cultures of hippocampal and substantia nigra neurons. Nat. Protoc. 4 (1), 78-85 (2008).
- abcam. Counting cells using a hemocytometer. , Available from: http://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2017).
- ImageJ. Getting intensity values from single ROI. Image Intensity Processing. , Available from: https://imagej.net/Image_Intensity_Processing (2017).
- ImageJ. 19. Tools. ImageJ User Guide. , Available from: https://imagej.nih.gov/ij/docs/guide/146-19.html (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır