Method Article
高解像度ボリューム イメージングのニューロンを蛍光使用排除法によってと専用マイクロ流体デバイス
要約
ボリュームは、細胞の生理学的および病理学的特徴に関する重要なパラメーターです。神経突起および暗黙の神経成長の動的構造の分析に必要なサブ ミクロ軸分解能生体外で神経ボリュームの全視野計測を可能にする蛍光排除法について述べる。
要約
ボリュームは、異なるタイム スケールでニューロンの生理学的および病理学的特性に関する重要なパラメーターです。ニューロンはその拡張区分された形態に関する非常にユニークなセルであり、したがって体積測定のためのいくつかの方法論的課題を上げます。生体外で神経成長の特定のケースで選択した方法論は分からに時間または数日間の時間スケールでの全視野観察と組み合わせてサブ ミクロの軸解像度を含める必要があります。共焦点レーザー顕微鏡、電気ベースの測定あるいは原子間力顕微鏡を用いた細胞形状復元のような他の方法とは異なり最近開発された蛍光方式 (FXm) これらの課題を満たすために可能性があります。しかし、神経細胞の高解像度 FXm の実装をその原理でシンプルながら、複数の調整と専用の方法論が必要です。蛍光除外、低粗度多区画マイクロ流体デバイス、そして神経のローカル ボリュームの生体外の測定を達成するために微細の組み合わせに基づいてメソッドをご紹介します。デバイスの高解像度では、神経突起 (突起) のローカル ボリュームと成長円錐 (GCs) など、神経細胞の成長に関与するいくつかの特定の構造の量を測定することができました。
概要
細胞容積の正確な知識は、セルの大きさの恒常性単一 celled の微生物1とより一般的に細胞分裂の細胞2の問題によって駆動される最後の年に増加した注目を集めています。しかし、細胞容積の質問は分裂細胞、ニューロンが、典型的な例を構成するものにも関連します。
ボリュームは確かに不可逆的に電気的活動 (ミリ秒) 3に関連付けられている一時的な軸索の変形から、神経の人生のスケールが異なると時間点で生理学的および病理学的イベントの重要な署名神経変性疾患 (年間人間の) 4の段階で無症候性神経腫脹発生。しかし、最大のボリューム変更に数日または神経成長中 (考慮される有機体) によって数週間の中間の時間スケールで発生します。ニューロンの拡張と複雑な形態を発生させる倍数問題、その中でセルのサイズの規則。軸索の長さと直径規制実にきっちりと生体内で、各神経タイプ5,6に固有の値です。
これらの問題に対処するため生体内で、複雑な簡単な方法で対処できます体外。その目的の容積測定に専用の高速メソッド十分成長ダイナミクス (すなわち分の時間スケールで) と互換性のある時間または数日間の観察に従うことが必要です。複数の方法は細胞容積体外への直接的または間接的なアクセスを提供するために長年にわたって開発されています。共焦点イメージングからセルの再構成は、それらの 1 つが、このメソッドは約 500 nm 7の限られた軸の解像度を見せながら光にラベリング反復暴露を意味します。これらの 2 つの最後の欠点は、格子ライト シート顕微鏡8をというより高度な最近のメソッドによって克服部分的に注意してください。この走査法はゆっくりと退屈な本質が原子間力顕微鏡は使用される9にしました。さらに、それでセルは、物理的な接触はニューロンの10の極端な柔らかさを考慮した計測と干渉する可能性があります。別のセルタイプを11の不十分な拡張接着細胞ニューロンのようなインピー ダンスまたは共鳴を用いた間接的手法が採用されています。
最も有望な方法の一つは、蛍光色素で満ちていた近い区域の細胞の排除体積の測定に基づいています。蛍光方式 (FXm) ラベル、必要ないとその原理はシンプルで、高速、長期的潜在的サブ光軸の解像度を持つ細胞集団の光イメージングに適しています。いくつかノイズの源を制限するこの究極の解像度がより正確に、z の解像度はカメラのダイナミック レンジで割った値 (すなわち細胞に欠けている地域の) 培養室で最大蛍光強度に依存します。このメソッドは、移行する付着性のセル12の量に従うまたは徹底的に13に記載されている、哺乳類細胞の有糸分裂の間の体積変化を研究する非常に強力なされています。しかし、ニューロンは fxm サブ ミクロ プロセスに彼らの広範な分枝を考慮した方法論的課題を構成します。
高精度ボリュームと神経の枝と成長円錐のような神経細胞の成長に関与する動的構造体の高さにアクセスする滑らかな FXm チャンバーの作製につながる方法をご紹介します。
部屋軸の解像度を最適化するために測定するオブジェクトより同じような高さが必要です。したがって、3 つの異なる高さの中央測定室によって特徴付けられるさまざまな FXm デバイスを考案しました。神経突起の測定に、薄 (3 μ m の高さ) を専用: この低い高さ除く相馬近く 15 μ m の高い中間チャンバー内に残る。厚い中央室 (10 と 12 μ m) が全体の細胞の成長に十分に高いです。デバイスには、中央の部屋のどちら側に位置する 2 つの貯水池も含まれています。4 つの注入穴 (IH) ため実装されています、次のように示される: 入口と出口、チップに細胞懸濁液を紹介し、他の 2 つは、貯水池をフィードに対しサービスします。
我々 は知られているジオメトリのフォトレジスト構造を使用した高さ測定の最初の試作した校正 coverslips あります。接着のマイクロ パターンに無料成長ニューロン、しかしまた形態学的制約付きニューロン、イメージしています。
プロトコル
介護や実験動物の使用に欧州共同体ガイドラインに従って実施されました: 86/609/EEC。研究の目的とプロトコルは、倫理的な別館の ERCadg プロジェクト チェロが成立し、ERCEA を定期的にレビューのとおりです。動物実験施設を受けた Institut キュリー ライセンス #C75-05-18、2012/04/24、Comité d'Ethique en マチエール d に報告 ' expérimentation animale パリ中心部 et シュッド (国民登録番号: #59)。
1. 金型の作製
注: 金型に接続して入口とコンセント、プラス 2 貯水池 (入り江) 中央の部屋の両側にある中央および中間の部屋が含まれています。
- フラット ピンセットを使用して、51 mm 径シリコンウエハを操作し、1 つの場所から別に転送します。
- 中央の部屋のシリコンモールド
- ポジ型フォトレジストで 2 mL プラスチック ピペットを埋めます。直径 51 mm のシリコンウェハーの中心にピペットを置き、その貯水池にフォトレジストとウェーハ表面の約 75% をカバーまで押します。30 の 3000 rpm でスピン コート s。
- 表面温度は 100 ° C、50 ので、ホット プレートにスピン コーターからウェハを転送 s。
- マスク露光装置の基板ホルダー (チャック) に、ホット プレートからウェハを転送します。「DRIE マスク」を公開 (補助ファイル"masks_neuron_volume_chips.tiff"と"masks_neuron_volume_chips.dxf"を参照してください).
- チャックからウェハを削除し、結晶皿開発者 (脱イオン水で希釈 1:4) を含む 100 mL ガラスに飛び込みます。ウェハを解放し、ゆっくりと継続的に結晶皿を攪拌しながら 1 分、それを維持します。
注: 試薬を保存するには、最大で高さ 1 cm を結晶皿を入力します。 - 開発者からウェハを取り戻すし、約 10 s.Then 場所吸水紙の上のウェハを脱イオン水で満たされた 100 mL 結晶皿に水没加圧窒素空気の打撃銃を使用して乾燥します。
- 50 のウエハーを置く表面温度は 115 ° C でホット プレート s
- 深い反応イオン エッチング (DRIE) (参照14と15では DRIE 技術についての詳細を見つけることが) 次のパラメーター; を実行します。パッシベーション ステップ: 50 sccm C4F8、バックアップ彼の流れ 10 sccm、CP 10 W, 誘導結合プラズマ (ICP) 1500 W、合計圧力 24 mbar、温度 18 ° C。エッチング ・ ステップ: SF6、バックアップ彼の 100 sccm フロー 10 sccm、CP 11 W, ICP 1500 W、合計圧力 24 mbar、温度 18 ° C。パッシベーション時間: 4 s;エッチング時間: 7 s;プロセス実行時間の合計: 通常 5 分約 10 μ m エッチング深さ。
- アセトンでいっぱい結晶皿に基板をダイビングで、レジストを溶解します。
- ピラニア ソリューション内のウェハが水没 (H2O2 (30%) の 2/3、1/3 H2SO4 (95 %)) で 5 分。
注意: 常に最初に H2O2を追加し、脱イオン H24とすすぎ、少なくとも 3 回で、水洗浄後。
- 1.2.11 に 1.2.1表 1-3に記載されているパラメーターを次の手順に従って、中間室に対応する金型を作製します。
注: 各テーブルは、中央監視室の特定の高さによって特徴付けられる特定のデバイスに対応します。
注: は、増加フォトレジスト ハイツ (各デバイスの 3 マスク 1 参照の補助ファイル"masks_neuron_volume_chips.tiff"と"masks_neuron_volume_chips.dxf") を使用してプロセス全体を実行します。- スピンコーター基板ホルダーにエッチングされた si ウェハを配置します。
- 基板の吸引が有効 (基板では、スピンし、公称回転中の場所に滞在する必要があります) であることを確認することにより、スピン コーターが正常に機能していることを確認します。
- 対象となる厚さの範囲の高さと SU 8 の粘度が高くなります。常に 20-30 mL ボトルを使用して SU 8 フォトレジストを格納し、スピン コーティング前にウェーハの上に注ぐ (SU 8 があまりにもプラスチック製のピペットを操作する粘性かもしれない)。
- Si ウエハの約 75% をカバーまで基板の中心に否定的なエポキシ型フォトレジスト SU 8 を注ぎ、スピンコート パラメーターを使用して、テーブルの行「コーティング」に示されています。
- 場所期間および温度のホット プレートにコーティングされたウェーハは、行「ソフト焼き」で示されます。
- マスクア ライナー、エッチングのウェーハと十分な「SU 8 マスク」をマウントします。
- 専用配置十字架を使用してマスク エッチングのウェハを揃える (これらの交差の典型的なサイズ: 50 μ m × 150 μ m) 各マスクの設計されています。
注: デバイスのそれぞれの側に 2 つの十字は、十分な (左下に 1 つ)、右上の 1 つです。 - 「露光量」の行に記載されている適切な紫外線線量と私-ライン マスクア (波長 365 nm) のを使用して公開います。
注: 露光時間は各フォトレジスト用露出エネルギー E の特定を UV ランプの有効電力で除して算出した、マスクの吸収による変調: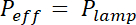 x (1 -吸収マスク)。吸収は約 20% 柔軟なマスクとクロム ハードマスクのごくわずかです。
x (1 -吸収マスク)。吸収は約 20% 柔軟なマスクとクロム ハードマスクのごくわずかです。 - 期間および行「ポスト焼く」に示されている温度のホット プレートにコーティングされたウェーハを配置します。
- 100 mL ガラス結晶 2品、開発者、その他の空を含んでいるものを準備します。「開発」行に示されている期間の開発者のウェーハをダイビングします。優しく開発に沿って結晶皿を扇動します。
- 約 5 空結晶皿上イソプロパノールでウェハを振りかける s。最後に、吸水紙の上のウェハを配置し、加圧窒素空気の打撃銃を使用して乾燥します。
- 期間および温度のホット プレートにコーティングされたウェーハは行「ハード焼く」に示されている場所 (省略可能)。
注: この手順は、フォトレジストの亀裂を避けるため、均質な平らな面は、次の手順を実行すると便利です。 - 1.3.1 - 1.3.10表 1-3に記載されているプロセスを完了するための手順を繰り返します。
- Silanize 最終的なマスターは金型の写真平版の最後のステップの後で構成される 2 つを派遣してネガティブフォトレジストの 3 層の 100 mm ペトリ皿でマスターの各側に Trichloro(1H,1H,2H,2H-perfluoro-octyl) シランの 100 μ L の液滴。プラスチック パラフィン フィルム付きペトリネット ディスクを密封し、20 分間室温 (RT) を孵化させなさい。
注: マスター型ができて、複数回使用できます。
- スピンコーター基板ホルダーにエッチングされた si ウェハを配置します。
2. PDMS チップの作製
- 有機高分子のシリコン ベースの 90 g を注ぐ (ポリジメチルシロキサン: PDMS) 100 mL プラスチックのカップに。その硬化剤 (1:10 重量) の 10 グラムを追加します。2-3 分のプラスチック製のピペットを使用して混合物をかき混ぜなさい。
注: は、10 g 硬化剤 6 チップ作製のための PDMS の 90 グラムを混ぜます。 - PDMS に閉じ込められた気泡を削除する真空デシケータと約 30 分のためのポンプ内の混合物を配置します。
- P100 ペトリ皿でマスター型を配置し、注射器を使用して、金型に混合物の 15 mL を注ぐ。
注: 15 mL 合計チップ高さ 1.5 mm につながります。 - 真空デシケータとポンプ内にある PDMS 金型構造を置きます、PDMS 表面で破裂ないより多くの空気泡があります。
注: この手順は、約 30 分かかります。 - ウェハ下 PDMS 容積を避けるためにコーンの先端を使用してシャーレの下部にウェーハをプッシュします。少なくとも 2 時間の 70 ° C で設定オーブンで PDMS 金型装置を配置します。
- ステンレス鋼フラットへらを使用して化学のフードの下で、チップ上の注ぐイソプロパノール PDMS ブロックを脱型します。フードのステンレス鋼のベンチ上に置きます。
- シリコンウエハの周りカットし、メス PDMS レプリカを脱型します。
- メスまたはかみそりの刃を使用してチップを (残す 2 mm 余白) の周りカットします。
- 1.5 mm 径パンチャーをしっかりと押すことによって入口を開けるし、口の穴を彫るを切り取ってそれを作動させます。液体が注入されるチップの 4 つの専用ゾーンで同じことを行います。
- こだわりと微細構造の側に粘着テープを剥離してチップをクリーニングします。両側にイソプロパノールを振りかけます。空気ブローガンを用いた加圧窒素ガスでチップを乾燥します。
3. パターン coverslips (24 × 24 mm2) の作製
注: は、ピンセット使って coverslips を操作できます。
- ポリ オルニチン (PLO) パターン
- ガラス coverslips プラズマ クリーニング O2を適用します。プラズマパラ メーター: 圧力をポンプ: 0.25 mbar;O2供給期間: 3 分;ガスの流れ: 10 sccm;最大偏差: ± 5 sccm;プラズマ持続時間: 3 分;圧を設定: 0.36 mbar;最大偏差: に対してプラス マイナス 0.10 mbar;電源設定: 50 W最大偏差: 5%;ガス抜き期間: 45 s。
- 酢酸のミックス 484 μ L と 3-成功-した 56 μ は、15 mL の合計容積を得るため無水エタノールを完了します。
- 1 mL のチップコーンを使用して、各 coverslip でこのソリューションを 500 μ l 添加のドロップを入れ、2-3 分はクリーン マイクロファイバー ワイパーを使用して乾燥を待ちます。
注: シラン処理ガラス coverslips は、パラフィンをプラスチック フィルムで密封プラスチック ボックス内の室温で 1 ヶ月格納することができます。 - クリーン ルーム環境であるスピンコーターに各 coverslip を配置します。ポジ型フォトレジスト coverslip (約 500 μ L) と 30 の 4000 rpm でスピン コートの約 75% をカバーのドロップを置く 0.45 μ m の最終的な厚さに到達する s。
- ホット プレート表面温度は 115 ° C で 1 分 coverslips に配置します。
- 使用するマスクア ライナー、公開 435 波長で各 coverslip ボートドック パラメーターに従って専用のマスクを通じて nm (G 線) (について紫外線線量 50 60 mJ.cm-1)
- 2 ガラス結晶皿を用意し、1 つ、その他を含む開発者 (無希釈) を含む脱イオン水。
- ゆっくりと継続的に結晶皿を攪拌しながら 1 つずつ 1 分の開発者の各 coverslip をダイビングします。吸水紙の上約 5 s. 位ウェハ脱イオン水内のウェハが水没し、空気の打撃銃を用いた加圧窒素ガスを乾燥します。
- 3.1.1 のように同じパラメーターを持つ活性化 O2プラズマを適用します。
- フードの下, 4 170 を退陣 P100 シャーレあたり 100 μ g/mL PLO ソリューションの μ L が値下がりしました。これらの低下のそれぞれに、coverslips のパターンの顔を置きます。乾燥を防ぐためビニール パラフィン フィルムでシャーレをシールします。室温一晩インキュベートします。
注意: PLO ソリューションは毛管現象によって、coverslips に接続されている必要があります残ります。 - 4 つの受信者 (通常 P60 ペトリ皿) を準備、PBS と脱イオン水を 4 分の 1 でそれらの 3 つを埋めます。純粋なエタノールの 2 つのガラス結晶料理を準備します。
- 各 coverslip ペトリ皿から取り出し、10-15 s の最初 PBS のお風呂で水没、吸収組織側、coverslip を垂直方向に置くことによって液体を避難、エタノール内湯をパターンの顔などを挿入します。
注: フォトレジストの溶解が完了すると、カバーガラスの模様の側面を見つけることは困難なります。したがって、それはその場所をトレースするこの段階で重要です。 - 配置、超音波風呂超音波発生装置内の皿を結晶化エタノール (120 W/35 kHz) し、3 分間溶解するフォトレジスト。
注: は、フォトレジストの解散を損なう可能性のある PBS で希釈を制限するすべての 4 の coverslips エタノールお風呂を変更します。 - エタノール風呂から coverslip を取るし、2 番目の PBS 風呂に数回をダイビングします。エタノールの残り液膜からの結果消えて脂のような表面になるまで繰り返し表面の側面を確認します。
- 5-10 s、coverslip 3 番目の PBS 風呂に水没します。脱イオン水のお風呂にすぐに転送します。吸水紙の上、coverslip を置き、空気の打撃銃を用いた加圧窒素ガスで乾燥します。
注: 脱イオン水で最後のすすぎ、乾燥のステップの間に PBS 結晶の形成を避けるために使用されます。
- 高さ校正用フォトレジスト構造
- 3.1.4 の手順だけに従います。3.1.8 を。専用マスク (マスク「フォトレジスト ストライプ」、"Mask_Photoresist stripes.dxf"の補足ファイルを参照してください) を使用します。
4. チップの組立と最終的な実装
- ガラス底培養皿にチップします。
- 表面活性化のためプラズマ室に PDMS チップとそれは、接着されるガラスの皿を置きます。パラメーター: ポンプ圧ダウン: 0.25 mbar;O2供給期間: 3 分;ガスの流れ: 10 sccm;最大偏差: ± 5 sccm;プラズマ持続時間: 30 s圧を設定: 0.40 mbar;最大偏差: に対してプラス マイナス 0.10 mbar;電源設定: 50 W最大偏差: 5%;ガス抜き期間: 45 s。
- ガラス基板と接触して活性化の PDMS チップをそっとし、微妙、coverslip のチップを接着するチップの端に圧力を適用します。5 〜 10 分のための 70 の ° C のオーブンでデバイスを配置、接合強度を高めること。
注: を含む柱部分に押さないでください、彼らがあまりにも多くの圧力の下で崩壊しかねない。 - ボンネット (すなわち常温) 接合後 30 分以内、IHs で 100 μ g/mL PLO 液でいっぱい 10 μ L 先端コーンを配置し、液体を注入します。各 IHs の上部にドロップを形成するために、ボリュームを調整します。その後、1 mL 先端コーンを使用すると、シャーレ チップ周りのすべての PBS を追加します。
- 2 h、インキュベーション時間を最小限に抑えて RT でチップをしましょう。一晩インキュベートの乾燥を避けるために使用してプラスチック パラフィン フィルム ペトリ皿をシールします。
注: 液体がチップを破棄する必要がありますそれ以外の場合のチップの外に流出する必要があります。 - 各 IH に 10 μ L のチップコーンを軽く押すし、液体の過剰を吸います。コンセント内部チップコーンを完全に固執し、残りの液体を描画します。
- 4.1.5 (空) と 4.1.3 (充填) の手順で表示される指示ラミニン次に PLO を置き換えます。1 時間室温で孵化させなさい。
- 4.1.5 (空) と 4.1.3 (充填) の手順で表示される指示培次ラミニンを置き換えます。培地の組成: MEM 81.8%;ピルビン酸ナトリウム 100 mM 1% です。Glutamax 200 mM 1% です。馬の血清 5%;B27 補足 2%、N2 サプリメント ゲンタマイシン 1% 0.2%;220 nm のフィルターを使用して、ソリューションをフィルター処理します。1 mL のチップコーンを使用して、この媒体によってチップを取り巻く PBS で交換も。
- シード ニューロンの前に少なくとも 5 時間 (または夜通し) の CO2を 37 ° C、5% に調整したインキュベーターにチップを置きます。
- Coverslips パターン化されたチップを使用して組み立てる
注: パターン coverslips には、ポジ型フォトレジストの参照オブジェクトが含まれている場合 4.2.1 に 4.2.9 の手順に従います。そうでなければ、4.2.3、スティック パターン PLO coverslip の PDMS デバイス、4.1.2 に示すように入れて培養液の中の手順のみを実行し、チップ周り 4.2.10 の手順に進みます。- 長方形の厚い顕微鏡スライド ガラスに一滴の水を入金、毛管現象 (非パターン化側スライド ガラス) によってスライド ガラス、coverslip を固執します。顕微鏡の下でフェルトのペンを使用してスライド ガラスの背面にフォトレジスト ストライプの位置をマークします。
- アライナ、マスクのマスク ホルダーにパターン化されたガラス基板を配置します。フォトレジストの参照オブジェクトを中心にフェルトのペンで作られたマークに依存します。
- 4.1.1 PDMS チップの説明としては、プラズマの手順を実行します。
- マスクア ライナーの移動式のサブストレート ホルダー (チャック) PDMS チップを置きます。
注: 光のコントラストを高める、PDMS チップの下にシリコンのウエハを配置します。(チャックに固執する透明テープを使用) の配置処理中チャックにしっかりと接続したままシリコンウエハ。 - 上に位置するフォトレジストのストライプの配列とチップを合わせて機械的な接触の限界でチャックを持ち上げます。
- 持ち上げる、チャック、PDMS 表面柱タッチまでガラス基板の仕上げによってチップと、coverslip の機械的な接触を達成します。
- チャックを下げます。今マスク ホルダーからチップに接着された coverslip を削除します。35 mm のペトリ皿にデバイスを配置し、オーブンにすべての転送 (温度: 70 ° C) 接着強度が向上する 5 〜 10 分のため。
- 4.1.3 の手順を実行します。
注: 場合は PLO を使って coverslips パターン、ステップ ステップ 4.2.9 4.2.7 から直接行きます。 - 4.1.5 (空) と (充填) 4.1.3 手順の手順でめっき中下記のものによって PLO を交換してください。1 mL のチップコーンを使用して、この媒体によってチップを取り巻く PBS で交換も。
- 5 h、インキュベーション時間を最小限に抑えて、ニューロンの播種までの 37 ° C、5% CO2で規制されているインキュベーターにチップを置きます。
5. ニューロンの文化
- HBSS 10 の 10 mL を混合することによって郭清培地 (HH 中) 100 mL を準備 x、Hepes 1 M 2 mL と 200 mL のプラスチック フラスコに滅菌水の 88 mL。
注: HH 媒体を文化前日用意できます。 - 頚部転位 (チャールズ川から c57bl/6 j マウス) によって安楽死させた母から抽出した E18 マウス胚から海馬を解剖します。解剖の手順は例えば 16の詳細です。
- 化学分解を開始するためにトリプシン (HH 媒体の 2.7 mL に EDTA w/o、トリプシン 2.5 %0.3 mL) 37 ° C で 10 分間を含むプラスチック製のチューブに海馬を配置します。
- ほとんどすべての液体を破棄し、HH 使い捨てプラスチック ピペットの使用の 5 ~ 10 mL を置き換えます。それを 3 回行います。最後の塗りつぶしの HH の代わりに媒体をめっきの 1 mL を使用します。
- 機械的に意欲的なフル ・ ボリュームの数回を取り出し、泡を作るとより 15-20 の通路を使用して回避して 1 mL のチップコーンを使用して組織を切り離して考えます。
- 別の 500 μ L 受信者で 45 μ L の PBS で希釈した細胞懸濁液 5 μ L を使用してソリューションを準備します。1 μ 10 μ L ピペットを使用してこのソリューションを取るし、マラッセ細胞カウンターに希釈懸濁液を挿入します。セルの数を推定するのに17の兆候を使用します。
注: 単一の海馬は通常約 50 万のニューロンを提供します。 - 100 × g で遠心する室温 6 分
- 上澄みを廃棄し、1000 万セル/ml の濃度を達成するために必要なめっき中のボリュームで置き換えます。による細胞を再懸濁しますは連続して熱望する、1 mL のチップコーンに細胞懸濁液を取り出します。
- メッキ媒体チップの現在を描く (4.1.5 の手順を参照してください)。新鮮な再懸濁溶液 10 μ L ピペットを使用して 2-3 μ L を収集し、入口に注入 (ステップ 4.1.3 の注入手順を参照してください)。すぐに出口に同じ操作を繰り返します。
- 各タンクのメッキ媒体の同じボリュームについて注入 (ステップ 4.1.3 を参照)。
注: は、すぐに細胞の密度を確認する顕微鏡下でチップを観察します。約に対応する最適な細胞密度の一桁の 4 本の柱で区切られた正方形の表面の中で 5-10 セル (約 0.3 mm2、すなわち約 mm2あたりの 15-20 セル)。 - 最終的に手順 5.10 代わりに 0.5-1 を使用して標的細胞密度に到達する細胞を懸濁液の μ L。
- 37 ° C 5% CO2で規制されているインキュベーターにシードのチップを配置します。
6. 蛍光除外観察
- イメージングの培地で培養液の交換。
- 4.1.7 のようにイメージング メディアの準備が、フェノールレッドを欠いて MEM を代わりに使用し、蛍光のデキストランを追加します。その目的で希釈デキストラン (分子量 10,000 g/mol、PBS で 10 mg/mL に濃縮原液) 0.5-1 の最終的な集中を達成するために mg/mL のイメージング中。
注: 使用デキストラン吸収/放出マキシマ 496/524 または 650/668 と抱合体します。画像 0.45 μ m 高のポジ型フォトレジスト構造 (赤の帯域幅での自己蛍光を取り除く) と (毒性) が少ない画像ニューロンへの第 2 に最初を好みます。 - 10 μ L ピペットを使用してすべての入り江を空にして再イメージングの中でそれらを完全に埋める (4.1.3 および培地交換の正確な方法は、4.1.5 の手順を参照してください)。
- 4.1.7 のようにイメージング メディアの準備が、フェノールレッドを欠いて MEM を代わりに使用し、蛍光のデキストランを追加します。その目的で希釈デキストラン (分子量 10,000 g/mol、PBS で 10 mg/mL に濃縮原液) 0.5-1 の最終的な集中を達成するために mg/mL のイメージング中。
- イメージング
- 37 ° C と CO2の 5% に調整した環境チャンバーを搭載した落射蛍光顕微鏡下でチップを置きます。40 X、開口数 (NA) 0.8 乾燥使用フルパワーの客観的、30% (電力: 3 W) と露光時間の 30 ms。(コマ撮り実験の場合複数の連続したイメージを 1 つ) からフォーカスをセルの画像を取得します。
- 画像解析
- 専用ソフトウェアで実装されたバック グラウンド低減ルーチンを使用して均一な背景画像を正規化します。13処理手順は、このソフトウェアに含まれている画像の詳細を参照してください。出力イメージがします。マット形式。
- 変換します。マットのファイルをします。ルーチンを使用して 8 ビットの TIFF イメージは、補足資料 (conversion_mattotiff.m、importfilevol.m の呼び出し) に置きます。
- インポートを実行 > からビデオを構築する ImageJ の像。TIFF イメージ。
- 支柱 (reference オブジェクト)、細胞 (背景、すなわち高さゼロ) を欠いている商工会議所の面積の平均強度 B のセンターでローカライズの正方形領域の平均強度 P を計算します。18画像処理の詳細な方法の例を参照してください。
注: する必要があります強度参照として使用される正方形の区域の横方向の寸法の柱端からの光害を回避しながらピクセルの十分な数を取得する柱の直径の約半分。 - P と B の値を使用して、強度は私から高さhの線形変換法を確立します。

hc室の既知の高さと と
と
注: PDMS を検出可能な蛍光を表示しません。 - 興味の地帯の周りの領域を選択、ImageJ を用いた強度を統合 (詳細については、 19参照) セル区画の体積を測定する 6.3.5 で得られた変換法の適用と。
注: 金利のゾーンがに基づいて選択サブ細胞成分の蛍光アクチン、例えば成長の選択コーン GFP LifeAct ニューロン、選択で GFP 放出チャネル、これの輪郭保存に興味の地帯のような(赤) はデキストランの放出チャネルで同じゾーン内で ROI マネージャー ツール、細胞体積が囲まれたメジャーを使用してゾーン。
結果
図 1 aのイメージによって作製セクション 1 と 2 で説明されているプロセスの結果を示す-1 bと図 1の曲線。図 1の表には、PDMS チップ、すなわち中央と 20 μ m 高次中間室の 2 つの異なる代表的なエリアの粗さの値が表示されます。SU 8 フォトレジストの代わりにエッチングの Si ウェハを使用して、約 7 倍の粗さの減少が得られました。その後、FXm は最初、10 μ m の高い商工会議所内知られているジオメトリ (図 2 a) のフォトレジスト ストライプに適用されました。画像処理と強度高さ変換後 (図 2 bのグラフを参照)、このストライプ (図 2) に沿って 2 次元断面に対して FXm プロファイル提供希望の高さプロファイル (図 2 D)。図 2 Dは、機械的形状測定と FXm メソッドを使用して取得したプロファイルの比較を示しています。エッジと高原の値を含め、これらのプロファイルが非常に似ている方法を検証します。FXm データの散乱が、さらに図 3および図 4、評価法の究極的な解決の代表ではないことに注意してくださいが、低強度からの結果が非常に弱いの可能な効果を避けるために採用GFP チャネルでのフォトレジストの自家蛍光。
その後、3 μ m と 10 μ m 高室 (図 3) の神経突起を見ました。バック グラウンド ノイズの標準偏差は約 18 nm 高さの変換とバック グラウンドの補正に強度の後。この値はシリコン表面にキャストした PDMS 表面の物理的な粗さよりわずかに高い (12 nm、図 1の表を参照) PDMS で測定された粗さが SU 8 金型から得られたよりもはるかに低いが。これらの結果は、シリコンウェハーに井戸を掘削するのではなく、柱をキャストする SU 8 フォトレジストに穴が開いての付加価値を強調表示します。このような低値は、図 3 aで表示されるなどボリュームの非常に鮮明な画像とノイズ比の高い信号をことができます。このようなイメージから取得できるデータの例として我々 は 1.6 μ m (すなわち10 ピクセル) ワイド神経突起のボリュームを計算 (図 3 bのグラフを参照してください) をスライスします。約 400 の平均神経突起の高さの値を与える最初の近似でこれらのデータの線形フィットを使用して nm、例えば軸索直径の 500 nm、10 日脳梁5内の古い子犬と比較します。我々 はまた接着における出力直列 2 μ m と 30 μ m の長さの 6 μ m の広い縞から成るのと FXm を組み合わせます。私たちの目的は神経突起の幅がその 3次元形状に及ぼす影響を研究するだった。図 3は、10 μ m の高い部屋で得られた全体のニューロン イメージの偽色の 3 D の表現を示しています。最大のストライプの極みに、相馬があるに対し、神経突起は 2 μ m と 6 μ m の広い縞、広がっています。3 つの異なる断面の高さプロファイルを描いた。図 3 aに表示されるグラフとの一貫性、表面 (図 3 D) 神経突起幅断面増加に統合されています。
成長円錐 (GC) の立体構造にも着目。図 4A Bプロファイルが表示されます 2 つ異なる GC 3 μ m の高い部屋で得られた彼らの分岐部分の構造を強調します。さらに、我々 は 12 μ m の高い部屋で Gc がボリュームのダイナミクスに従うタイムラプス実験を行った。図 4には、数十分の時間スケール内で指定された GC の再活性化と縮小のサイクルが表示されます。Lifeact GFP マウスの使用のおかげで成長円錐に GFP の発光波長ローカライズされた (510 nm) のアクチンの高濃度から。波長で特定されるサーフェスは 647 でデキストラン発光波長にわたって統合に使用された GC の体積を計算する nm。図 4は最終的に約 6 μ m3の値を中心とした 3 つの異なるニューロンに異なる時点および場所で GC のボリュームの分布を示します。

図 1: FXm PDMS チャンバ。(A)最終型につながる微細加工の 4 つの主な手順のスキーム。入口、出口、貯水池の場所が示されます。バーをスケール: 1 mm。(B)光学測定機を用いて PDMS FXm 室の画像。この画像は、10 μ m 高柱の 3 つの行と高さは 20、50、90 μ m の中間室を含む中央の部屋を示します。スケール バー: 500 μ m。 (C) (B) に描かれた 2 本の破線に沿ってチップの断面図。イエロー/ゴールド: 青の柱に沿って断面: 断面柱の間。(D) PDMS の粗さの値は実測 50 × 成形シリコンと 20 μ m 高 SU 8 中間室 50 μ m2のエリアを意味する (これらの区域の場所の矢印を参照)。平均値は、3 つの異なる分野の測定から得られました。この図の拡大版を表示するのにはここをクリックしてください。
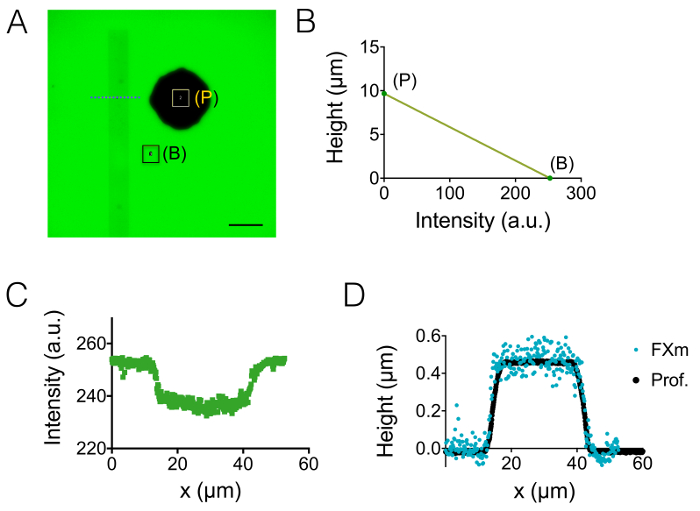
図 2: FXm 用いたフォトレジスト ストライプの興味の対象としての校正します。(A) 10 μ m の高い部屋で撮影した GFP 蛍光画像 10,000 MW デキストラン 488 で吸収でいっぱい nm 1 mg/mL で。(B: 背景、p: 柱)。乾燥 40 X ナ 0.8 目的の観察。スケール バー: 2 色の四角形の (A) に表示されている青い点線のレベルで得られる A. (C)蛍光強度分布に示すようにフォトレジストを渡る平均強度から得られる(B)線形校正法 50 μ m。ストライプ (0.45 μ m 高ポジ型フォトレジスト)。(D) (B) (青い点) のデータの高さの転換へ強度後機械的測定機 (黒い点) や FXm から得られるプロファイルの比較。この図の拡大版を表示するのにはここをクリックしてください。
図 3: 神経突起ボリューム イメージングします。(A)の突起が次に 15 μ m の中間室にある相馬から中央の 3 μ m 高の室に拡張します。488 で吸収 10,000 MW デキストランを用いてイメージング nm と 40 X、NA 0.8 乾燥目的。はめ込み式バック グラウンド低減ルーチンの使用は 2 つの突起をハイライトした後を取得し、右側のグラフをプロットすることを選択。スケール バー: 30 μ m。( B) (A) に示す 22 プロファイル (10 ピクセル、すなわち1.6 μ m「神経突起スライス」の上平均) から得られた神経突起幅の関数として突起スライス ・ ボリューム。実線は、原点を通る傾き 0.4 μ m の線形フィットを表します。(C)接着ストライプにパターン化されたニューロンの偽色のイメージから成って連続 2 μ m と 6 μ m の広い切り株 (白で表されます)。10,000 MW デキストラン 647 で吸収で満ちていた 10 μ m の高い区域で測定を行い nm と 40 x NA を用いた 0.8 乾燥目的。(D)色の破線 (C) に示すように、同じ維持に対応する高さプロファイルは色コードです。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 静的および動的成長円錐イメージングします。(B)成長円錐の高さプロファイル強度関連画像に表示される黄色の線に沿って高さ変換後 3 μ m の高い商工会議所で得られました。488 で吸収 10,000 MW デキストランと塗りつぶしを用いて観測 nm と 40 X、NA 0.8 乾燥目的。(C) 12 μ m の高い部屋で全体のニューロン イメージング 10,000 MW デキストラン 647 で吸収でいっぱい nm。観測は、2 つの蛍光チャネルで行われている: GFP 成長円錐 (黄色破線)、および CY5 蛍光除外から GC の体積を計算します。黄色破線で含まれている表面は、GC の体積を計算する使用されました。グラフでは、2 つの代表的な異なる時点で GFP および cy5 の組合せの両方のチャンネルで GC 量の時間、および関連付けられている形態上の変化を示します。40 x NA を使用してすべてのデータを取得した 0.8 乾燥目的すべての 3 分のスケール バー: 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
| ステップ | 1:8 μ m の層をマスクします。 | マスク 2:30 μ m の層 | マスク 3:40 μ m の層 |
| SU 8 型 | 2007 | 2025 | 2050 |
| コーティング | 30 s 2000 rpm @ | 30 s 3050 rpm @ | 30 s 3250 rpm @ |
| ソフト焼き | 95 ° C @ 3 分 | 65 ° C + 6 分 @ @ 95 ° C 2 分 | 65 ° C + 7 分 95 ° C @ @ 3 分 |
| 照射エネルギー量 | 110 mJ/cm2 | 155 mJ/cm2 | 170 mJ/cm2 |
| 露光後ベーク | 4 分 @ 95 ° C | 65 ° C + 6 分 @ @ 95 ° C 1 分 | 65 ° C + 7 分 @ @ 95 ° C 2 分 |
| 開発 | 2 分 30 秒 | 5 分 | 6 分 |
| ハード ディスク焼く (オプション) | @ 200 ° C 3-5 分 | @ 200 ° C 3-5 分 | @ 200 ° C 3-5 分 |
表 1: 高さ 12 μ m の中央の部屋を含むデバイスを構築するフォトリソグラフィの手順を実行します。中間室の高さ: 20、50、90 μ m。
| ステップ | マスク 1:10 μ m の層 | マスク 2:30 μ m の層 | マスク 3:40 μ m の層 |
| SU 8 型 | 2007 | 2025 | 2050 |
| コーティング | 30 s 1500 rpm @ | 30 s 3050 rpm @ | 30 s 3250 rpm @ |
| ソフト焼き | 95 ° C @ 3 分 | 65 ° C + 6 分 @ @ 95 ° C 2 分 | 65 ° C + 7 分 95 ° C @ @ 3 分 |
| 照射エネルギー量 | 125 mJ/cm2 | 155 mJ/cm2 | 170 mJ/cm2 |
| 露光後ベーク | 4 分 @ 95 ° C | 65 ° C + 6 分 @ @ 95 ° C 1 分 | 65 ° C + 7 分 @ @ 95 ° C 2 分 |
| 開発 | 2 分 30 秒 | 5 分 | 6 分 |
| ハード ディスク焼く (オプション) | @ 200 ° C 3-5 分 | @ 200 ° C 3-5 分 | @ 200 ° C 3-5 分 |
表 2: 10 μ m の高さの中央の部屋を含むデバイスを構築するフォトリソグラフィの手順を実行します。中間室の高さ: 20、50、90 μ m。
| ステップ | マスク 1:12 μ m の層 | マスク 2:32 μ m の層 | マスク 3:40 μ m の層 |
| SU 8 型 | 2015 | 2025 | 2050 |
| コーティング | 30 s 3250 rpm @ | 30 s 2500 rpm @ | 30 s 3250 rpm @ |
| ソフト焼き | 95 ° C @ 3 分 | 65 ° C + 5 分 @ @ 95 ° C 2 分 | 65 ° C + 7 分 95 ° C @ @ 3 分 |
| 露光時間 | 140 mJ/cm2 | 157 mJ/cm2 | 170 mJ/cm2 |
| 露光後ベーク | 4 分 @ 95 ° C | 65 ° C + 5 分 @ @ 95 ° C 1 分 | 65 ° C + 7 分 @ @ 95 ° C 2 分 |
| 開発 | 3 分 | 5 分 | 6 分 |
| ハード ディスク焼く (オプション) | @ 200 ° C 3-5 分 | @ 200 ° C 3-5 分 | @ 200 ° C 3-5 分 |
テーブル 3: 3 μ m の高さの中央の部屋を含むデバイスを構築するフォトリソグラフィの手順を実行します。中間室の高さ: 18、50、90 μ m。
補足データ1: masks_neuron_volume_chips.tiff。(DRIE マスクとマスク 1-3) PDMS のデバイスを作製するためのマスクの模式図。このファイルをダウンロードするここをクリックしてください。
補足データ 2:ファイル"masks_neuron_volume_chips.dxf"。電子ファイル DRIE マスクとマスク 1-3 を作製することができます。このファイルをダウンロードするここをクリックしてください。
補足資料 3: 「Mask_Photoresist stripes.dxf」。電子ファイルは、フォトレジストのストライプのフォトリソグラフィーに使用されるマスクを作製することができます。このファイルをダウンロードするここをクリックしてください。
補足資料 4: conversion_mattotiff.m ファイルファイルのダウンロードは、こちらをご覧ください。
補足資料 5: importfilevol.m ファイルファイルのダウンロードは、こちらをご覧ください。
ディスカッション
ニューロンのボリューム イメージングは、これらの細胞の長くて細い拡張のための FXm 技術の挑戦を構成します。このプロトコルでは、ニューロン イメージングへ専用マイクロ流体デバイスの同じ型の変形について説明します。
マイクロ流体設計の側面と横にある目的の選択は蛍光の排除のための基本でありトレードオフ水平解像度と画像の鮮明さを意味します。これは、商工会議所の高さより小さい焦点深度につながる高 NA なかったこと容積測定の精密のため有害なフォーカスでイメージングを行った、私のオブジェクトの輪郭間に十分な余白が残っている場合13に示されています。暴騰と積分面の境界。ただし、商工会議所の焦点深度よりもはるかに高いは、関心のオブジェクトのエッジが滑らかになり、光子拡散による画像の鮮明さを損ないます。この横方向のぶれを軽減の 3 μ m の高い部屋の作製と高 NA を使用しても非常によく定義された蛍光除外画像を提供した (0.8) 40 X 目標高い空間分解能と神経の枝を視覚化します。
チップ組立が重要なステップ、特に 3 μ m の高い部屋の場合が、慎重に操作 4.1.2 の説明に従って屋根の崩壊を回避できます。これらの薄い部屋に関連付けられた容積の比率に高い表面に時間をかけてデキストラン濃度の安定性の問題も発生します。我々 は、インキュベーションの 1 泊後、デキストランの表面の吸収はごくわずかだったことをチェックしている: PBS によるデキストランを交換した後柱と背景の強度の違いは初期強度のコントラストの 1000 人あたり約 1デキストランの存在下でのこれらの 2 つの領域。下部 coverslip と PDMS 屋根の両方神経細胞が付着することに注意してください。この効果は、コーティングとしてパターン coverslips (すなわち我々 は PDMS チャンバ内接着分子を孵化しない場合) を使用して、ローカライズ チャンバーの底に厳密にしたがってときに消えます。
法、すなわちデキストラン エンドサイトーシスの主要な限定の 1 つは非常に限られたという事実のために、その挑戦的な形態から離れてニューロンではなく FXm に適しているこれらの細胞で。我々 は、10 を選択して長期的に抑える kDa の定式化の範囲 (時間) すべて表示エンドサイトーシスの現象。
FXm の概念的なシンプルさのバランスが取れて議定書、ナノメートルの PDMS の粗さやミクロ室高さの凹凸を補正するためのバック グラウンド補正などにより解決されている実験の問題の結論として、柱間 PDMS の天井。ただし、蛍光メジウムを閉じ込めるに近い流体チャンバーの使用によって効果的な表面の細胞接着、または中央から相馬を除外する必要を下げるサポート柱の必要性のようないくつかの特定の制約高分解能観察にアクセス可能なセルの領域を制限する最高の明快さと神経の拡張を観察する商工会議所。このメソッドの 1 つの可能な進化は光一で交換するこの物理的な監禁をなくすでしょう。光シート顕微鏡の新展開が有利と組み合わせる FXm、将来的に。
開示事項
著者は利益相反を宣言しません。
謝辞
著者は、プロセス開発、デバイス作製の貴重なサポート ChiLab ・ マイクロ システム研究室 - トリノ工科大学 - 教授 C F Pirri、博士 M Cocuzza、博士 S L Marasso の人に DISAT を確認します。Quantacell からビクター ラシーンは、議論と画像処理の支援を感謝いたします。GFP LifeAct マウスと私たちを提供するため、マウスのためのサポートのための Institut キュリーとパブロ ・ バルガスとアナ · マリア ・ レノン (Institut キュリー) の動物施設からイザベル グランジャンとマノン変わって感謝しております。蛍光除外法の理解で彼らの助けのための Institut ランジュバンとクロティルデ Cadart、ラリサ Venkova インスティトゥート キュリー - umr を 144 からマチュー Piel からオリビエ Thouvenin に感謝しております。最後に、我々 は微細加工の彼らのサポートのための Institut ピエール ・ ジル de Gennes (CNRS UMS 3750) の技術プラットフォームを感謝します。この作品は一部、欧州研究評議会高度なグラント号 321107「チェロ」によって支えられた PSL ユニヴェルシテ (SwithNeuroTrails プロジェクト)、ANR Investissement d'Avenir 地球 Labex と Equipex。
資料
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Plasmalab System 100 | Oxford Instruments | To perform DRIE | |
| MJB4 mask aligner | SUSS MicroTec | SU-8 photolithography | |
| NXQ 4006 Mask aligner | Neutronix Quintel | Photolithography associated to DRIE | |
| Plasma cleaner | Diener Electronic | Pico PCCE | |
| Cell culture hood | ADS Laminaire | Optimale 12 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Multifuge X1R | |
| Incubator 37 °C 5% CO2 | Panasonic | MCO-170AICUVH-PE IncuSafe CO2 Incubator | |
| Epifluorescence microscope | Leica | DMi8 | |
| PDMS Oven between 65 and 80 °C | Memmert | ||
| Mechanical profilometer | Veeco | Dektak 6M Stylus Profiler | |
| Optical profilometer | Veeco | Wyko NT9100 | |
| Vacuum desiccator | Verrerie Villeurbanaise (Kartel Labware) | 230KAR | Diameter 200 mm |
| Ultrasonic bath sonicator | Labo Moderne | SHE1000 | Volume of the bath: 0.8 liter |
| Hotplate | Stuart SD162 | SD162 | |
| Masks | |||
| DRIE | Supplementary data | ||
| Su8 Mask 1 | Supplementary data | ||
| Su8 Mask 2 | Supplementary data | ||
| Su8 Mask 3 | Supplementary data | ||
| S1805 calibration stripes | Supplementary data | ||
| Small laboratory equipment | |||
| 1.5 mm hole puncher | Sigma-Aldrich | 29002519 (US reference) | |
| Scalpel or razor blade | |||
| 9" Stainless Steel Flat Spatula with Spoon | VWR International | 82027-532 | To demold PDMS |
| Top Lip Wafer Handling | VWR International | 63042-096 | |
| Curved tweezer | FST | Dumont #7 Forceps - Standard / Dumoxel | To manipulate glass coverslips |
| Substrates | |||
| Silicon wafer | Prolog Semicor Ltd | ||
| 24x24 mm glass coverslips | VWR | 631-0127 | |
| Photoresists and developpers | |||
| AZ 1518 positive photoresist | Microchemicals GmbH | Before DRIE process, thicknes 1.8 µm | |
| AZ 351B developer | Microchemicals GmbH | To develop positive AZ 1518 photoresist | |
| SU-8 2007 | MicroChem | ||
| SU-8 2025 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| PGMA developer | Technic | To develop SU-8 negative photoresist | |
| Microposit S1805 resist | Chimie Tech Services | Positive photoresist used to obtain 0.5µm high structures | |
| MF 26A developer | Chimie Tech Services | To develop positive S1805 photoresist | |
| Laboratory consumables | |||
| Disposable plastic pipette 3 mL | LifeTechnologies - ThermoFisher | ||
| P100 Petri dishes | TPP | 93100 | |
| 20 mL syringe | Terumo | SS+20ES1 | |
| Transparent scotch tape | |||
| Square wipes | VWR | 115-2148 | |
| Parafilm | DUTSCHER | 90260 | Plastic paraffin film |
| Chemicals | |||
| (3-Methacryloxypropyl)trichlorosilane | abcr | AB 109004 | |
| PDMS and curing agent Sylgard 184 | Sigma-Aldrich | 761036 | |
| isopropanol | W292907 | ||
| poly-ornithine | Sigma-Aldrich | P4957 - 50 mL | |
| Ethanol absolute | Sigma-aldrich | 02865 | 99.8% |
| 3-methacryloxypropyl-trimethoxysilane | Sigma-aldrich | M6514-25ML | (C4H5O2)-(CH2)3- Si(OCH3)3 |
| acetic acid | Sigma-aldrich | 71251-5ML-F | |
| Dextran 10kW conjugated with Alexa488 | LifeTechnologies - ThermoFisher | D22910 | Absoprtion at 488 nm |
| Dextran 10kW conjugated with Alexa647 | LifeTechnologies - ThermoFisher | D22914 | Absoprtion at 647 nm |
| Culture medium | |||
| MEM | LifeTechnologies - ThermoFisher | 21090-022 | |
| Horse Serum | LifeTechnologies - ThermoFisher | 26050088 | |
| B27 | LifeTechnologies - ThermoFisher | 12587-010 | |
| Glutamax 200 mM | LifeTechnologies - ThermoFisher | 35050-061 | |
| Sodium Pyruvate GIBCO 100 mM | LifeTechnologies - ThermoFisher | 11360-070 | |
| Gentamicin | LifeTechnologies - ThermoFisher | 15710-049 | |
| PBS | Sigma-Aldrich | D8537-500ML | |
| HBSS 10x | LifeTechnologies - ThermoFisher | 14180-046 | |
| Hepes 1M | LifeTechnologies - ThermoFisher | 15630-056 | |
| trypsin-EDTA | Sigma-Aldrich | 59418C-100ML | |
| Neurobasal | LifeTechnologies - ThermoFisher | 21103-049 | |
| Neurobasal without phenol red | LifeTechnologies - ThermoFisher | 12348-017 | |
| Softwares | |||
| Routine in Matlab for background normalization | Quantacell | Contact Victor Racine: victor.racine@quantacell.com | |
| ImageJ | To select specific ROI for image analysis | ||
| Routine | ImageJ | Supplementary data | |
| Routine | Matlab | Supplementary data |
参考文献
- Jun, S., Taheri-Araghi, S. Cell-size maintenance: universal strategy revealed. Trends Microbiol. 23 (1), 4-6 (2015).
- Zlotek-Zlotkiewicz, E., Monnier, S., Cappello, G., Le Berre, M., Piel, M. Optical volume and mass measurements show that mammalian cells swell during mitosis. J. Cell Biol. 211 (4), 765-774 (2015).
- Kim, G. H., Kosterin, P., Obaid, A. L., Salzberg, B. M. A mechanical spike accompanies the action potential in Mammalian nerve terminals. Biophys J. 92 (9), 3122-3129 (2007).
- Iacono, D., et al. Neuronal Hypertrophy in Asymptomatic Alzheimer Disease. J Neuropathol Exp Neurol. 67 (6), 578-589 (2008).
- Cheli, V. T., et al. Conditional Deletion of the L-Type Calcium Channel Cav1. 2 in Oligodendrocyte Progenitor Cells Affects Postnatal Myelination in Mice. J Neurosci. 36 (42), 10853-10869 (2016).
- Kneynsberg, A., Collier, T. J., Manfredsson, F. P., Kanaan, N. M. Quantitative and semi-quantitative measurements of axonal degeneration in tissue and primary neuron cultures. J Neurosci Methods. 266, 32-41 (2016).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PloS one. 10 (3), (2015).
- Aguet, F., et al. Membrane dynamics of dividing cells imaged by lattice light-sheet microscopy. Mol Biol Cell. 27 (22), 3418-3435 (2016).
- Roland, A. B., et al. Cannabinoid-induced actomyosin contractility shapes neuronal morphology and growth. eLife. 3, (2014).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci USA. 103 (47), 17759-17764 (2006).
- Chen, J., Xue, C., Zhao, Y., Chen, D., Wu, M. H., Wang, J. Microfluidic impedance flow cytometry enabling high-throughput single-cell electrical property characterization. Int J Mol Sci. 16 (5), 9804-9830 (2015).
- Bottier, C., et al. Dynamic measurement of the height and volume of migrating cells by a novel fluorescence microscopy technique. Lab Chip. 11, 3855-3863 (2011).
- Cadart, C., et al. Fluorescence eXclusion Measurement of volume in live cells. Methods Cell Biol. 139, 103-120 (2017).
- Marasso, S. L., et al. A novel graphene based nanocomposite for application in 3D flexible micro-supercapacitors. Materials Research Express. 3 (6), 065001 (2016).
- Welch, C. C., Goodyear, A. L., Wahlbrink, T., Lemme, M. C., Mollenhauer, T. Silicon etch process options for micro-and nanotechnology using inductively coupled plasmas. Microelectronic Engineering. 83 (4), 1170-1173 (2006).
- Fath, T., Ke, Y. D., Gunning, P., Götz, J., Ittner, L. M. Primary support cultures of hippocampal and substantia nigra neurons. Nat. Protoc. 4 (1), 78-85 (2008).
- Getting intensity values from single ROI. Image Intensity Processing Available from: https://imagej.net/Image_Intensity_Processing (2017)
- 19. Tools. ImageJ User Guide Available from: https://imagej.nih.gov/ij/docs/guide/146-19.html (2017)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved