Method Article
Zebra balığı
Bu Makalede
Özet
Bu yazıda zebra balığı embriyolarının ve larva spinal nöronların elektrofizyolojik kayıtları için yöntemleri tarif eder. Hazırlık yerinde nöronları korur ve genellikle asgari diseksiyonu kapsar. Bu yöntemler, erken larva aşamalarında ilk elektrik uyarılma alımından spinal nöronların çeşitli elektrofizyolojik çalışmaları için izin verir.
Özet
İlk gelişimsel model olarak tanıtılan Zebra balığı, diğer pek çok alanda popülerlik kazanmıştır. hızla gelişen organizma çok sayıda büyütme kolaylığı, embriyonik optik netlik ile birlikte, bu modelin ilk zorlayıcı nitelikleri olarak görev yaptı. Son yirmi yılda, bu modelin başarısı daha da büyük ölçekli mutajenez ekranlarına kendi uyumluluğuyla ve transgenesis kolaylığı ile tahrikli edilmiştir. Daha yakın zamanlarda, gen düzenleme yaklaşımlar modelinin gücünü genişletmiştir.
nöro çalışmalar için, zebra balığı embriyo ve larva birden çok yöntem uygulanabilir olan bir model sunmaktadır. Burada, nöronların, elektrik eksitabiliteye temel bir özelliğinin çalışma izin yöntemleri üzerinde durulacak. Zebra balığı spinal nöronların elektrofizyolojik çalışma için Bizim hazırlık bir kayıt odasına hazırlık sabitlemek için veteriner dikiş tutkal kullanımını içerir. kayıt için alternatif yöntemlerzebra balığı embriyolarının ve larva ince bir tungsten pimi 1, 2, 3, 4, 5, kullanılarak bölmesine hazırlama eki içerir. O kadar 4 larva dorsal tarafına monte etmek için kullanılmış olsa da bir tungsten pim çoğunlukla, bir yanal yönde hazırlama monte etmek için kullanılır. dikiş tutkal her iki doğrultuda embriyolar ve larvaları monte etmek için kullanılmıştır. tutkal kullanılarak, en az bir diseksiyon ve böylece sonuç olarak ortaya çıkan zarar vermeden, bir enzimatik işlem kullanılmadan spinal nöronlar erişimi sağlayan, gerçekleştirilebilir. Ancak, larva için, omuriliği çevreleyen kas dokusu çıkarmak için kısa bir enzim tedavisi uygulamak gerekir. Burada tarif edilen yöntemler, birçok developmentà motor nöronlar, internöronlar ve duyu nöronlarının içsel elektriksel özelliklerini incelemek için kullanılmıştırL 6, 7, 8, 9 aşamaları.
Giriş
George Streisinger, omurgalı gelişimi 10 genetik analizi için bir model sistem olarak yaygın zebrabalıkları olarak bilinen Danio rerio kullanımını öncülük etmiştir. Model de dahil olmak üzere birçok avantaj sunmaktadır: (1) nispeten basit ve pahalı olmayan bir hayvancılık; (2) dış gübreleme, erken olgunlaşma aşamalarındaki embriyolar kolay erişim sağlayan; ve (3) saydam bir embriyo, oluştuklarında hücreler, dokular ve organlarda doğrudan ve tekrar gözlemler imkan verir.
takip eden yıllarda, birçok ilerlemeler daha da zebrabalıkları modelin gücünü artırmıştır. Özellikle, ileri genetik ekranlar ve tam genom dizileme çabalar çok gelişim süreçleri 11, 12, 13, 14 mutasyonlar ve kritik genlerin tanımlanmasında önemli roller oynadığı,"> 15, 16. Gateway klonlama yöntemleri transkripsiyon aktivatörü gibi (TALENS) ile örneklenen,. Transgenik rutin bir uygulama 17, 18 yaklaşır genom düzenleme son ilerlemelere ve kümelenmiş düzenli aralıklı bırakılmış kısa palindromik tekrarlar (CRISPR) -Cas9 nükleazlar, mutasyonların hedeflenen giriş için izin, hem de knock-out ve knock-in 22. Kombine, bu yöntemler Zebra balığı belirli davranışları ve çok sayıda insan hastalıkların altında yatan genetik mekanizmaların çalışma için güçlü bir model yapmak, 21, 20, 19 yaklaşır 23, 24, 25, 26, 27.
Bu eser geliştirmek odaklanırZihinsel düzenleme ve nöronal gelişim elektriksel aktivitenin rolü. Odak Zebra balığı modeli çeşitli avantajlar sağladığı için omurilik üzerindedir. Birincisi, embriyonik ve larva aşamasında zebrafish erişmek için nispeten kolaydır; Dolayısıyla, bir eksik nöronlar ve daha basit devreyi 28, 29 sahip gelişimsel aşamalarında omurilik fonksiyonunu çalışabilirsiniz. Ayrıca, zebra balığı omurilik transkripsiyon karakteristik ve ayırt edici desen ile gösterilir, 30, 31, 32, 33, 34, 35 faktörler gibi diğer omurgalı benzer nöronların, çeşitli bir grubu vardır.
omurilik devrelerinin fonksiyonunu altında yatan mekanizmaları ortaya çıkarmak amacı zebrafish çalışmaların büyük çoğunluğu, özelliklelokomosyonunu destekleyen olanlar, anlaşılır larva aşamalarında 36, 37, 38, 39, 40, 41, 42, 43 odaklandık. Bununla birlikte, omurilik lokomotif ağları oluşturan nöronların çok erken evrelerinde de farklılaşmasını başlatmak, ~ 9-10 saat sonra fertilizasyon (HPF) 44, 45, 46, 47, 48, 49, 50, 51. Bu bakışa göre, spinal nöronların morfolojik ve elektriksel özellikleri ortaya ve embriyonik ve larva aşamaları arasında değişiklik bir Overa için önemli olan, anlamayarak nasıllokomotor devre oluşumu ve işlevi ll anlama.
Burada tarif edilen yöntemler, diseksiyon spinal nöronların yama kelepçe kayıtları sağlamak ve başarılı bir şekilde embriyonik aşamada (~ 17-48 büyük büyütme) ve larva aşamalarında (~ 3-7 gün sonra döllenme [dpf]) de uygulanmıştır. Bu yaklaşım ilgi nöronların erişim sağlamak için gereken diseksiyon miktarını sınırlar. Protokol kayıt odasına embriyo ya da larva takmak için, oldukça ince bir tungsten iğnesi, kullanılan bu veteriner dikiş yapıştırıcı zebra balığı, spinal nöronların kayıt için diğer yayınlanmış yöntemlerin çoğunda farklıdır. İki farklı yaklaşımların kullanılabilirliği (yani, tungsten pimi karşı sütür tutkal) elektrofizyolojik analizi için zebrafish embriyolar veya larva monte etmek için alternatif seçenekler araştırmacılar kendi özel deneysel hedeflere ulaşmak için sağlar.
İlk olarak, bir pop erişmek ve kayıt prosedürleri birincil duyu nöronlarının ABS ayarlaması, Rohon-Sakal hücreler tarif edilir. Bu nöronların hücre gövdeleri dorsal omurilik içinde yalan. Rohon-Sakal hücreleri, çok sayıda omurgalı türlerinde de mevcuttur erken gelişim ayırt ve embriyonik dokunun yanıtı 6, 44, 47, 48 altında yer alır.
İkinci olarak, erişim ve spinal motor nöron kayıt prosedürleri ayrıntılı olarak açıklanmıştır. Zebra balığı spinal motor nöronlar nöron iki dalgaları sırasında ortaya çıkar. Daha önce doğumlu primer motor nöronların hemisegment 45, 46, 49 başına mevcut 3-4 primer motor nöron, gastrülasyon (~ 9-16 HPF) sonunda ortaya çıkar. Bunun aksine, ikinci motor nöron Daha sonra doğan popülasyonu daha çok ve ~ 14 büyük büyütme başlayarak uzun bir süre sırasında ortaya çıkanef "> 45, 50. orta gövde bölümlerinin sekonder motor nöron oluşum en çok 51 büyük büyütme 50 ile tamamlanır. İkincil motor nöronlar amniotları motor nöronlarının muadili olarak kabul edilir 46. İlginç bir şekilde, omurga üstünde nöronlar, dopamin ile, lokomosyon düzenleyen larva ve ikinci motor nöron oluşumu embriyo ve genç larva 50, 51. birincil ve ikincil motor nöronlar her biri birçok farklı alt tipi içerirler. her bir primer motor nöron alt tipi projeleri basmakalıp bir sonuçlanan karakteristik kas grubu uyaran çevresel bir akson, aksonal yörünge tanımlanması. Genel olarak, ikinci motor nöronlar, daha önce birinci motor nöronlar tarafından kurulan aksonal yolları takip ederler. bu nedenle, aksonal yörüngeleri ile ilgili olarak, birinci ve ikinci motor nöronların haricinde, benzer olduğu aksonal kalınlığı ve somata boyutuprimer motor nöronlar 45 için daha büyük yeniden.
Üçüncüsü, internöron birkaç türlerinden kayıt için yöntemler tartışılmaktadır. Bununla birlikte, bu gibi durumlarda, diğer omurilik hücreleri çıkarılması için sınırlı bir miktarda gereklidir ve bu nedenle omurilik Rohon-Sakal hücreleri veya motor nöron kayıtlar için daha az sağlamdır.
Protokol
(; Laboratuar Hayvan Kaynakları Dairesi, Colorado ANSCHÜTZ Üniversitesi Tıp Kampüsü IACUC) Bütün hayvan prosedürleri Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylandı.
1. Zebra balığı Yetiştiriciliği
- Kaldırın ve 10 saat karanlık / 14 saatlik ışık döngüsüne ve uygun su arıtma ve karşılığında 52 ile 28.5 ° C 'de, yetişkin zebra balığı (Danio rerio) korur.
- Arzu edilen aşamaya (örneğin, 2 dpf) oluşana kadar embriyo ortamda 28.5 ° C 'de zebra balığı embriyolar / larva kaldırın.
Diseksiyon Malzemelerin 2. Hazırlık
- Zebra balığı diseksiyon için tutkal dağıtıcı
NOT: Bu protokol kayıt odasına hazırlık takmak için veteriner dikiş tutkal kullanımını içerir. dikiş tutkal başarılı kullanımı, kontrollü bir şekilde tutkal az miktarda uygulanmasını gerektirir. tutkal bunun en kısa sürede sertleşmeye başlarsulu bir ortam ile karşılaşır. Bu nedenle, bir mikropipet tutkal çekmek ve ağızdan negatif ya da pozitif basınç uygulanmasına olanak tanıyan bir ev yapımı "yapıştırıcı dağıtıcı" kullanarak küçük miktarlarda sağlar. Tutkal dağıtıcının orta kısmı, bir cam deliği, borosilikat ince cidarlı cam kapilerleri (Şekil 1A) ihtiva eden bir paket içinde yer almaktadır bir parçadır. Bir ucunda, delik diğer ucu cam mikropipet (Şekil 1) tutarken, bir ağızlık esnek bir boru parçası aracılığıyla bağlanır.- Bir cam deliğin siyah ampul çıkarın ve bir cam deliğinin (Şekil 1B ve 1C) beyaz kauçuk adaptörü ile değiştirin.
Not: Bu çift adaptör kapaklı cam deliği, küçük bir düz polipropilen uydurma (Şekil 1B, ek) ile esnek bir boru parçasına, diğer ucunda, bir ucunda, bir cam mikropipet bağlantı sağlar ve. - ~ 38 cm uzunlukta esnek bir boru parça kesin. Cam deliğine bağlı olmayan esnek boru ucuna ağızlığı (örneğin, san bir 200 uL mikropipet ucu) takın.
Not: boru parçası mikropipet sarı ucu ağız (Şekil 1D) iken kesici bir alan altında cam mikropipet manipülasyonunu sağlamak için yeterince uzun olmalıdır.
- Bir cam deliğin siyah ampul çıkarın ve bir cam deliğinin (Şekil 1B ve 1C) beyaz kauçuk adaptörü ile değiştirin.

Şekil 1: Tutkal dağıtıcı. (AC) bir cam deliği bir ucunda ve diğer cam mikropipet esnek boru bağlanır. Kauçuk adaptörler diğer ucunda bir cam mikropipet için, en sonunda, boru küçük bir polipropilen bağlantısına (B, ek) ile bağlantıya olanak vermek ve. (D), son tutkal dağıtıcı (bir ağızlık bulunur, örneğin, bir plas yapılmıştlc hortumun bir ucunda pipet) ve diğer (ok ucu tutturulmuş mikropipet ile cam deliği).
- Diseksiyon / kayıt odası
NOT: diseksiyon haznesi de elektrofizyoloji kayıt odasına olarak hizmet vermektedir. Bölme sertleştirilmiş silikon elastomer (Şekil 2A) önceden kesilmiş parçalarını kullanarak, bir cam slayt üzerinde oluşturulur.- Silikon elastomerinin 4 bir plastik konik tüp baz ve bir sertleştirme ajanı eklemek için: sırasıyla 1 oranında elde edildi.
- İyice elastomer tabanı ve kür ajanı karıştırın ve iki 100 mm Petri kapları içine karışımı dökün. • başka 2.5 mm <1, bir Petri tabağı içinde mm bir kalınlığa elastomer dökün.
- silikon elastomer ~ 4-5 gün süreyle havaya maruz bırakılarak bekletilmelidir. sertleşmiş elastomerin daha önce gerekli ise, 60 ° C'de inkübe edin.
- şu boyutlarla sertleştirilmiş silikon elastomer parça kesin:
- Yaklaşık 1 mm'denum kalınlığındaki, elastomer işlenmiş bir ~ 3.8 x 6,3 cm dikdörtgen kesilir; bu parça bölmesi (Şekil 2A) alt olarak hizmet vermektedir. -2.5 mm kalınlıkta sert silikondan bir dikdörtgen ~ 3.8 x 6.3 cm kesmek. ikinci dikdörtgen kaynaktan, bir iç dikdörtgen -2.5 x 5 cm kesilir; Elde edilen çerçeve bölmesi (Şekil 2A) en olarak hizmet vermektedir.
- Diseksiyon / kayıt oda yapmak silikon ve cam (Şekil 2A) arasında bir hava kabarcıklarını çıkarmak için emin, cam bir slaytta (5 x 7.6 cm) üzerinde doğrudan ince silikon dikdörtgen yerleştirilmelidir. silikon ince alt tabakanın üzerine daha kalın elastomer kesilen silikon dikdörtgen çerçeve, koyun.
- Silikon tabakaları birbirine iyi takmak olduğu ve iki tabakadan (Şekil 2A) arasında bir hava kabarcığı olduğundan emin olun.
- Kullanımdan sonra, alt silikon yumurtlama kalın dikdörtgen silikon çerçeve kaldırarak odası demontajer, cam slayt bağlanmıştır. GKD 2 O kullanımdan önce ve her bir kayıt seansından sonra, kuru, az tüylü mendil ile birlikte silikon yüzeyler durulanır.
- silikon iki adet arasında mantar büyümesini önlemek için bölme kuru saklayın.
NOT: silikon kolayca durulama olabilir toksinler ya da farmakolojik maddeler kullanıldığı takdirde, bu amaçlar için özel odaları ayırmak.

Şekil 2: Elektrofizyoloji bölmesi ve diseksiyon araçları. (A), disseksiyonlarında ve elektrofizyolojik kayıtları için kullanılan hazne bir çerçeve ve bir gece için bir taban oluşturmak üzere birbirine üstüne, sertleştirilmiş silikon elastomer iki parça yerleştirilir tabakalı bunun üzerine bir cam lam oluşur. Kuyunun boyutu, yaklaşık 2.5 x 5 cm, hücre dışı kayıt küçük hacimlerde (2-2.5 ml) kullanımına izin verirçözüm. alt silikon tabakası cam yapışmayan zebra balığı embriyo kullanarak doku yapıştırıcı güvenli bir şekilde konumlandırılmasını sağlar. (B), bir cam mikropipet (üst) Diseksiyon sırasında tutkal besleme için kullanılır. İnce duvarlı cam 75 um aralığında bir çapa sahip olan bir uç oluşturma, daha sonra kesilen bir uzun, konik uç oluşturmak için çekilir. Konik cam mikropipet emme uygulanması yoluyla yapıştırıcı ile dolu ön yapıştırıcı dağıtıcı (Şekil 1D, ok başı) ve serbest ucuna bağlanmıştır. , Arka beyin transeksiyonu için ve cilt çıkarılması için kullanılan bir Patch-clamp kayıt için kullanılan bir gibi başka Mikropipet (alt) çekilir. Dik bir mikroskop altında (C), bir mikromanipülatör son diseksiyon adımları için mikropipet manevra için kullanılır. Bir cam mikropipet, B, alt gibi, elektrot tutucu (ok) bağlanmıştır. Kas çıkarılması ile elde edilirhava çıkışına (ok başı) bağlı boru içinden emme pplying. Diğer ucunda, hortum, (yıldız) ile, diğer tarafta, bir ağız parçasına tutturulmuş boru olan bir vana (siyah ok başı) bağlanır.
Omurga Nöronlar Patch-kelepçe kayıtları için Embriyolar ve larva 3. Diseksiyon

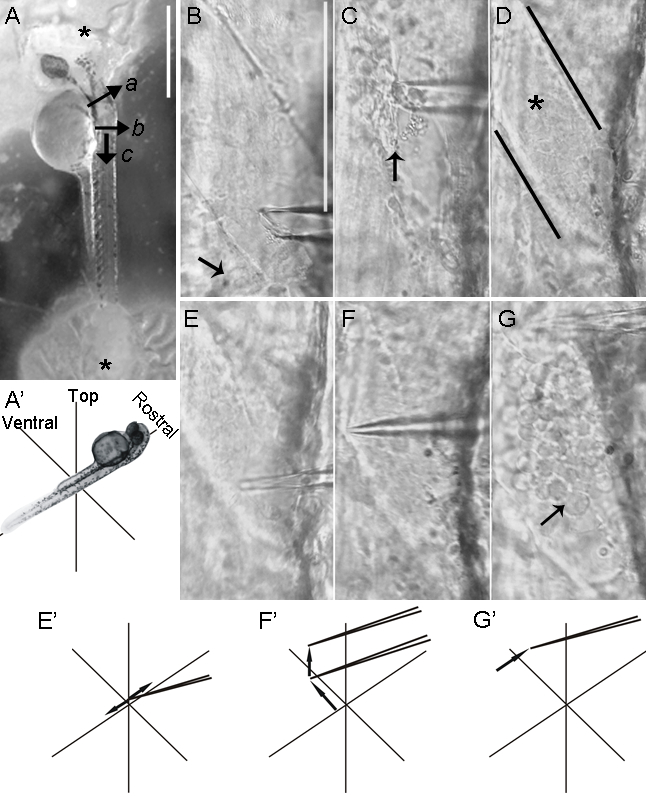
Şekil 3: Bir zebra balığı omuriliğin dorsal teşrih. Arka beyin transeksiyonu (a) 2-dpf embriyo, deri embriyo, (b) ve sol ve sağ tarafta kesildikten sonra (AA'). İkinci bir kesim, birinci dik, sonra, (c) gerçekleştirilir. Daha sonra, deri cımbız kapmak ve cilt çekmeye izin veren bir mikropipet kullanılarak kaldırılır. Derinin (B) çıkarılması sırt omuriliği ortaya koyar. siyah çizgi rostralinde, kayakN kaldırıldı ve meninkslerde içinde bulunan omurilik (yıldız), yüzeyi maruz bırakılır. Cilt siyah çizgi (ok) sağlam kaudal kalır. Cam mikro-pipetinin ucu (CC) meninkslerde basıldığında ve hızlı, yanal, kısa hareketler meninksleri delmek için gerçekleştirilmektedir. Beyin zarı (DD) delinir kez (DD ve EE) (iki parça halinde meninksleri gözyaşı rostral hareket, mikropipet, gelişmiş ve EE) '. Rohon-Sakal nöronların somata genellikle beyin zarı (ok) çıkarılması sırasında ortaya çıkar. 7 dpf larva olarak (FG'), kas katmanları Rohon-Sakal nöronlar erişimi engelleyen, omurilik dorsal kapsamaktadır. Cilt çıkarılmasından sonra, larva,% 0.05 kolajenaz ile işlenir. (F),% 0.05 kolajenaz ile 5 dakika inkübasyon sonuçlanan çok sıkı olduğuaşırı kas hasar gibi yıpranmış kas (ok ve ek) ile ispatlanmıştır. Hattı (F '') aşırı kolajenaz işlemiyle Tg (GFP islet2b) GFP eksprese etmeleriyle burada ortaya Rohon-Sakal nöronlar (ok), zarar verebilir. Tg (islet2b: GFP) olarak çizgi, arka kök gangliyon nöronlarının GFP (ok başı) ifade etmektedir. Miyotom gözüyle morfolojisi (ok ve ek) muhafaza ederken,% 0.05 kolajenaz ile bir daha kısa 1 dakika inkübasyon yeterli kas (G) gevşer. (G') Pigment hücreleri en geride kas tabakası (ok başı) üstünde bulunmaktadır. Tg (islet2b: GFP) 'de (H ve I) hattı, Rohon-Sakal nöronlar (oklar) ve dorsal kök ganglion (ok başı) 7 dpf GFP ifade devam etmektedir. Tg manzarası Dorsal: 2 dpf (islet2b GFP) zebra balığı embriyolar (H), bird 7 dpf (I) '. Panel A, Ölçek çubukları olarak = 500 um; çubukları Scale (Panel B'de gösterilen) BE 80 um =; (Panel F de gösterilmiştir) F 've G' çubukları Scale = 200 um; (Panel H gösterilmiştir) H ve I = 100 um çubukları Scale. Bu rakamın büyük halini görmek için buraya tıklayın.
- Rohon-Sakal hücrelerinden kayıtları için embriyo Diseksiyon
- Ringer solüsyonu ~ 2-3 mL (Şekil 2A) ihtiva eden bir diseksiyon odasında bir embriyo yerleştirin. bölmeye% 0.4 tricaine solüsyonu ~ 100 uL eklenmesiyle embriyo hareketsiz.
- Bir enjeksiyon mikropipet (Şekil 2B, üst) 53 'e benzer bir uzun, ince bir uç elde etmek için bir kutu filament kullanarak çekici bir mikropipet ince duvarlı cam mikropipetler çekin.
- Cam deliği o çekilmiş cam mikropipet takınTutkal dağıtıcı f. Ucu, böylece mikroskop altında, kullanım cımbız ~ 75 um (Şekil 2B, üst) cam mikropipet ucu kırmak için.
Not: uç boyutu negatif basınç (ağız emiş) uygulanması yoluyla ucuna tutkal etkin yükün izin vermek için yeterince büyük olmalıdır mikropipet ön-doldurma fakat pozitif basınç ile tutkal kesin uygulamaya izin vermek için yeterince küçük . - ağız yoluyla emme uygulanarak tutkal ~ 3-5 uL cam mikropipet yükleyin. Diseksiyon bölmesine tutkal doldurulmuş ucu getirin.
NOT: yapıştırıcı ile mikropipet Dolum güçlü emiş gerektirir. Mikropipet zayıf emme ile hızla dolarsa ucu çok büyük. - Kayıt odasına (Şekil 3A ve 3A') embriyo yerleştirin; embriyo ve genç larvaları (≤72 hpf) den kayıtlar için, kas dokusu çıkarmak için gerek yoktur.
- getirmekağız borusu üzerinden mikropipete hafif bir pozitif basıncı korurken embriyo / larva kafasının yakınında tutkal yüklü mikro-pipetinin ucu (sulu çözelti girişini önlemek için). uç embriyo kafasının yakınında sonra, bölmenin tabanı üzerine yapıştırıcı küçük bir damla çıkarılması için yeterli pozitif basınç uygulanır.
Not: tutkal sulu bir çözelti ile temas halinde bir kez sertleşen, nedenle uygulama ve diseksiyon çözeltisi yerleştirilir gibi hafif pozitif basıncı muhafaza etmek önemlidir. - Kafa yapıştırıcı ile temas eder, böylece tutkal azalmasına doğru embriyo / larva taşımak için diseksiyon pimi aracını kullanın. yapıştırıcı ile iyi bir temas sağlamak için baş embriyo kadar sırt tarafı ve basın döndürün.
- Tutkal yavaş sertleşen gibi, aşağı sırt tarafı yukarı ventral tarafı bitişik olacak şekilde embriyo / larva yeniden konumlandırmak için kesme pimi kullanılır. tutkal damla içine diseksiyon pimi aletini batırın ve üzerinde baş ve tutkal konuları çizmekEmbriyonun daha da konumunu sabitlemek için.
NOT: Tricaine tutkal sertleşir hızını hızlandırır. yapıştırıcı ile çalışmak için daha fazla zaman izin vermek için, embriyo / larva hareketsiz hale getirmek için gerekli olan tricaine az miktarda kullanılır. Buna ek olarak, sertleşme hızı yapıştırıcı farklı birçok değişiklik gösterebilir. tutkal, yeni bir serisi kullanılarak Buna göre, diseksiyon için kullanmadan önce sertleşmesinin oranını tespit. - Kafasının güvenli bir silikona bağlı olan ve yapıştırıcı katılaşmasından sonra, başka bir cam mikropipet ile arka beyin düzeyinde transeksiyonu embriyo / larva kurban (Şekil 3A, bir ve 4A- a).
NOT: arka beyin transeksiyonu insancıl hayvan kurban için buraya kullanılan yöntemdir. Ancak, deneysel hedeflerine bağlı (örneğin kurgusal yüzme çalışması), başka bir yöntem gerekebilir. - odasına kuyruk takmadan önce, gövde deri kaldırmak.
- kullanımtaze cam mikropipet (Şekil 2B, alt) yüzeysel arka beyin (Şekil 3A, b ve 4A- b) için bir konum kaudal cilt birkaç kez kesmek. Pierce cilt yüzeysel dorsal için gövde her iki tarafında rostro-kaudal eksenine dik pipet taşıyarak (Şekil 3A b) örnekleri monte edilmesi veya yan duvarına monte numuneler (Şekil 4A- b) için gövde maruz tarafında.
- Kapmak için cımbızlar sarkık bir deri parçası oluşturmak için, seviyesinde ve dikey basamak 3.1.10.1 (Şekil 3A ° ve 4A- c) 'de başlangıç kesmek için cilt mikropipet ile bir kaç kez kazıyın.
- cımbız kullanarak, kademeli olarak cilt kapağı kaldırın ve kaudal cildi çekin.
NOT: Bu genellikle gövdesinden derinin bütünlüğü uzaklaştırılması ile sonuçlanır. Ancak, someti olduğunuGerekli mes mükerrer performans kazıma ve derinin çekerek çeşitli bölümlerde deri kaldırmak. Bazı uygulamalar için, derinin kısmen kaldırılması ilgi (Şekiller 3B ve 4B), omurilik segmentlerine yeterli erişim sağlayabilir. - embriyo / larva kuyruğuna yakın tutkal küçük bir damla sunun. Diseksiyon odasının altına kuyruk takmak için bu yapıştırıcı kullanın. Tutkal sertleştikçe Bu adım sırasında, gövde dorsal yönlendirilmiş kalır ve sıkıca bölmeye bağlı olduğu sağlamak için kesme pimi aracı ile gövde konumunu ayarlamak.
- Bu ilk diseksiyon sonra, tricaine ve artıkları ayırmak için Ringer çözeltisi ile yoğun bir hazırlık yıkayın. Hazırlık ~ 5 dakika dinlenmeye bırakın.
- Hücre dışı kayıt solüsyonu ile diseksiyon çözüm değiştirin. Gerekirse, (hazırlama için bir hareketsizleştirici madde ilave örn., Α-buganrotoksin [son yoğunlaşmayla1 uM'lik ntration]).
Not: 1 uM α-buganrotoksin 30 dakika ~ içinde 1 embriyolar dpf 2 hareketsiz hale getirir. Büyük larva için, α-buganrotoksin daha yüksek bir konsantrasyonu gerekli olabilir. a-buganrotoksin tipik olarak 1 saatlik bir süre içinde gerçekleştirilir kayıtları sırasında banyo çözeltisi içinde muhafaza edilmektedir. kobalt gibi iki değerli katyonları içeren kayıt çözeltiler, immobilize edici bir madde ilave edilmesini gerektirmez. (1 saat boyunca) uzun süreli kayıt sürelerini gerektiren deneyler için, preparat 0.5-1 mL / dakika bir hızda banyo çözeltisi ile perfüze edilmiştir. - 40X suya daldırma, uzun çalışma mesafesi hedefi ile donatılmış olan bir dik bir bileşik mikroskop safhasına yerleştirilmiş embriyo diseksiyon odası hareket ettirin.
NOT: Bu mikroskop kayıtları yapılacaktır donanımının parçasıdır. Teçhizat da headstage, yama-kenet büyütücü bir mikromanipülatör, ve bir veri toplama / bilgisayar sistemi (Şekil 2C ile donatılmış olmalıdır). - Giriş katının (Şekil 2B, alt ve 2C, ok) elektrot tutucu üzerine boş borosilikat kalın duvarlı bir cam mikropipet monte edin. Boru takın (: 0.16 cm, dış çap: 0.32 cm, uzunluk: iç çap ~ 90 cm) elektrot tutucu (ok başı) hava çıkışına, bir ucunda (Şekil 2C, bir üç-yollu diğer ucunda siyah ok).
- (~ Uzunluğu 60-70 cm) boru başka bir parça, bir ucunda bir ağız parçasını yerleştirin ve diğer ucu (Şekil 2C, siyah yıldız) üç-yollu ekleyin.
NOT: Bu boru sistemi conta oluşumu sırasında kayıt pipetinin içine pozitif ve negatif basıncın uygulanmasına izin verir.
- (~ Uzunluğu 60-70 cm) boru başka bir parça, bir ucunda bir ağız parçasını yerleştirin ve diğer ucu (Şekil 2C, siyah yıldız) üç-yollu ekleyin.
- omurilik en dorsal kısmına mikropipet ucu getirin ve yavaşça meninks delmek. Swift ile izleyin kısa, yanlara hareketler loosen beyin zarı (Şekil 3C ve 3C').
- Mikropipet ucu meninksleri geçilen sonra, ilerlemek ve uzak omurilik (Şekil 3D ve 3D') den meninksleri çekmek için mikropipet yükseltmek.
- Rohon-Sakal hücreleri (Şekil 3E ve 3E') ortaya çıkarmak için 1 ila 2 hemisegments üzerinde ilerleyen, rostral mikropipet hareket ettirin.
NOT: Sadece birkaç Rohon-Sakal hücrelerini ortaya çıkarmak için gerekli meninkslerin az miktarda parçalara ayır. Her bir kayıt sonra ek diseksiyon daha Rohon-Sakal hücreleri ortaya çıkarmak için yapılır. Her iki embriyo ve larva olarak, Rohon-Sakal nöronlar bazen yama mikropipet ile temas ettiğinde patlayabilir. Diğer omurilik nöronları bu tür kendi mechanosensitivity olarak Rohon-Sakal hücrelerinin eşsiz özelliklerini yansıtacak kalabileceğini öne sürerek bu şekilde davranmazlar. Bunu desteklemek için, çeşitli çözüm bileşimleri (örneğin, iyonik bileşenlerve osmolarite) test edildi ve hiçbiri Rohon-Sakal hücrelerinin bu davranışı engellemiş.
- Rohon-Sakal hücrelerinden kayıtları için larva Diseksiyon
NOT: 7 dpf larvaları, dorsal omuriliği çevreleyen kas çıkarılmalıdır. adımları 3.1.15 3.1.1 takip enzimi ile tedaviden önce (bir embriyo için ikame edilmiş bir larva ile).- kas kaldırmak için, 1 dakika için% 0.05 kolajenaz ile larva inkübe edin.
- Ringer solüsyonu ile hazırlık ~ 5 kez durulayarak kollajenaz çıkarın. Tamamen kollajenaz kaldırmak için hücre dışı solüsyon 5 ~ ile durulama izleyin.
- kayıt teçhizat mikroskop aşamasında kayıt odası montajdan sonra diseksiyon kalan yürütmek. Elektrot tutucu bir borosilikat kalın duvarlı yama mikropipet (Şekil 2B, alt) takın ve hafifçe altına karşı fırçalayarak mikropipet ucu kırmakSilikon odası.
- uzakta kas kızdırmak ve dorsal spinal kord ortaya çıkarmak için hafifçe kırık mikropipet kullanın. preparattan kas lifleri kaldırmak için, elektrot tutucu prizine takılı boru içinden emme uygulanır. emme uygularken kas elyafın uzunluğu boyunca mikropipet taşımak için mikromanipülatör kullanın.
NOT: Hedef ilk mekanik kas gevşetmek için mikropipet kullanımı ve uzağa emmek ve bireysel kas lifleri kaldırmaktır. Bazen, kas çıkarılması sırasında, mikropipet emilen dokusu ile tıkandığında.- Bölmenin tabanına karşı mikropipet fırça içindekileri çıkartmak için boru boyunca hava üflerken, hafif uç kırma, mikropipet unclog için.
NOT: mikro pipet boyutu aşırı büyük hale gelirse, yeni bir mikropipet ihtiyaç duyulabilir. kas katmanları cl çıkartırken mikro pipet boyutu daha kritikomurilik veya meninksler (küçük mikropipet uçları daha kontrollü çalışma için izin) çevreleyen zarların için osest.
- Bölmenin tabanına karşı mikropipet fırça içindekileri çıkartmak için boru boyunca hava üflerken, hafif uç kırma, mikropipet unclog için.
- Adımlarda açıklandığı gibi meninks çıkarın 3.1.18-3.1.20 yeni mikropipet (Şekil 2B, alt) kullanılmıştır.
Şekil 4: zebra balığı omuriliğin lateral diseksiyon. bir yanal yönde zebra balığı embriyolar Montaj motor nöronlar erişimi kolaylaştırır. Motor nöronların ortaya çıkarmak için, kas ve meninkslerin diseksiyon çıkarılması 40X suya daldırma objektif ile uyarlanmış dik bir mikroskop altında gerçekleştirilir (bakınız Şekil 2). (A), motor nöron hücre gövdeleri omuriliğin içinde ventral ve lateral yer almaktadır. dorsal yan elektrot tutucu bakacak şekilde Embriyolar bölmeye eklenir.O (yıldız) sertleşir kez sütür tutkal beyaz göründüğünü unutmayın. Arka beyin (a) transekte sonra, cilt bir cam mikropipet kullanılarak Beyin bir site (b) kaudal de yüzeysel birkaç kez kesilir. İlk set dik ek yüzeysel kesimler (c), (b), cımbız derinin çıkarılması için yakalayabilir deri bölümü oluşturacak. (BG) boş bir cam mikropipet, kısa, konik uç (Şekil 2B, alt) çekilmiş, elektrot tutucuya takılmaktadır. Mikropipet sonraki ince diseksiyon ve kas dokusunun çıkarılması için mikro manipülatörün kullanılması manevra. (B), cam mikro-pipetinin ucu ilk yavaşça haznenin tabanına karşı fırçalama çentikli uca ve daha büyük bir uç çapına oluşturarak hafifçe kırılır. Emme uygulanırken mikropipet kas liflerinin uzunluğu boyunca hareket eder. Kas lifleri bir tabaka çıkarılırBir seferde yatan Meninkslerin bozulmasını önlemek için. Bu ince olma eğilimi embriyolarda, en geride kas katmanları, ilk çıkarılır. Cilt daha kaudal hemisegments (ok) kaldırılmaz. (C) bir hemisegment kas dorsal yarısı (ok) kaldırıldı. (D), siyah çizgiler omurilik (yıldız) kapsayan dokunulmamış meningeste kas liflerinin yoksun bir hemisegment, sınırlamaktadır. Mikropipet kullanılarak (EE), basınç daha da motor nöron somata dorsal bir pozisyonda meningeste uygulanır. Mikropipet Çabuk, kısa, yatay hareketler meninkslerin delici yol açar. (FF) mikropipet hemisegment ventral doğru ventral ileri ve nöronal doku meninksleri ayırmak için kaldırılmaktadır. (GG) zarları uzunluğu boyunca rostral mikropipet hareket ile kesişen edilirhemisegment. Nöronlar hemen maruz omurilik ortaya şimdi yama elektrot (ok) erişilebilir. Ölçek çubukları = (A), 500 um; Ölçek çubukları = (Panel B'de gösterilen) BG 100 um.
- Motor nöron ve interneuron kayıtları için embriyo Diseksiyon
- Ringer çözeltisi ihtiva eden bir diseksiyon odasında embriyo yerleştirin ve aşama 3.1.1 gibi tricaine embriyo hareketsiz.
- dorsal tarafında kullanıcı için en uygun olan haznenin tarafına bakacak şekilde, yanal olarak embriyo monte (tipik olarak ellilik bağlıdır). Adımları 3.1.2-3.1.17 ve embriyo silikon (Şekil 4A ve Şekil 4A') karşı düz kalmasını sağlar.
- 3.2.4-3.2.4.1 (Şekil 4B ~ 25 um kazımak için kırılmış olan bir ucu olan bir borosilikat kalın duvarlı mikropipet kullanın ve uzak kas içinden emme ve adımlarda açıklandığı gibi, beyin zarları maruz - 4D).
- Kas katmanları ilgi (Şekil 4D), hemisegment (ler) çıkarıldıktan sonra, bir intakt ucu (Şekil 2B, alt) sahip yeni bir cam mikropipet değiştirin. Hedef nöronlara dorsal olan bir pozisyonda meninksleri delinme. Mikromanipülatör kullanarak menenjlerin üzerine mikropipet aşağıya bastırın ve yırtılma ve meninks (Şekil 4E ve 4E') çapraz yan hızla hareket ettirin.
- Meninksleri kırılmasıyla, ilerlemek ve uzak omurilik (Şekil 4F ve 4F') den meninksler kaldırmak için mikropipet yükseltmek. Hemisegment (Şekil 4G ve 4G') uzunluğu boyunca membran gözyaşı rostral mikropipet getirin.
Not: Rohon-Sakal hücrelerinde ve primer motor nöron kayıtları için, diseksiyon Immediat uzak meninks temizleme sınırlıdırE, hedef bölgesi. Buna karşılık, internöron ve ikincil motor nöronların gelen kayıtları için, ilgi hücreye erişimi engelleyen omurilik içindeki nöronları kaldırmak için gereklidir. Bu ikinci durumda, omurilik devrenin geniş bozulması nedeniyle, çalışma içsel elektrik membran özelliklerinin analizi ile sınırlıdır.
Omurga nöronlar 4. Elektrofizyolojik kayıtlar
- Pipet çözeltisi (Şekil 2B, alt) ile doldurulduğu zaman Rohon-Sakal hücreleri ve motor nöron kayıtları için, ~ 3 MO'luk bir dirence çekilmiş borosilikat kalın duvarlı bir cam kılcal kullanımı.
- önceki banyosunda mikropipet daldırılması elektrot tutucuya bağlanmış boru içinden yavaşça üfleyerek pozitif basınç uygulanır.
NOT: pozitif basınç mikropipet ucu tıkanmasını artıkları önler ve kapalı p üç yollu valf çevirerek korunurzayıfsa. Bir kez hedef nöron yakınında, pozitif basınçlı hücre zarı, mikropipet mühür oluşumunu başlatmak için yeterince yakın olan bir yardımcı göstergesinin belirgin girinti sonuçlanacaktır. - ağız yoluyla ilave bir ışık emme uygularken açık konuma musluk vanası çevirerek pozitif basınç serbest bırakın.
- hücre zarı ve mikro pipet arasında bir GΩ-contanın oluşmasından sonra, membran bozulması ve bir bütün hücre konfigürasyonunu elde etmek için emme kısa darbeler uygulanır.
- Bir giriş direnci 500 MQ ve bir erişim direnci 10 MQ ile, stabil bir tam hücre konfigürasyonu oluşturulduktan sonra ya da voltaja veya akım kelepçe modunda kayıtları elde.
- önceki banyosunda mikropipet daldırılması elektrot tutucuya bağlanmış boru içinden yavaşça üfleyerek pozitif basınç uygulanır.
Sonuçlar
Başarıyla dpf larvaları ile 7 17 büyük büyütme embriyolar Rohon-Sakal nöronlardan kaydettik (Şekil 5A ve 5B). Rohon-Sakal hücreler kaydedildi preparasyon sırt tarafı yukarı monte edilmiştir. Bu tür montaj bunların yüzeysel sırt konum ve büyük soma boyutlarına göre Rohon-Sakal hücrelerinin açık tanımlanmasına izin verir. Kimlik ek bu nöronların basmakalıp hiperpolarize dinlenme membran potansiyelinin (Şekil 5, ek tablo) 6, 54 ile teyit edilir. Ayrıca, birincil duyu nöronları gibi Rohon-Sakal nöronlar sinaptik girişi eksikliği. Akım kelepçe modunda (Şekil 5B') kayıt sırasında nedenle, elektrik uyarımı yokluğunda, membran potansiyelinde herhangi bir değişiklik yapılması gerekir. Rohon-Sakal hücrelerinden ilk kayıtlarında yana zebrabalıkları gerçekleştirilmiştir 6, çeşitli transgenik çizgiler (örneğin, Tg (islet2b: GFP), Tg (ngn: GFP) ve Tg (isletss: GFP)) bu nöronların floresan raportörleri eksprese üretilmiş olan, daha da kolaylaştırmak bunların tanımlanması 55, 56, 57.
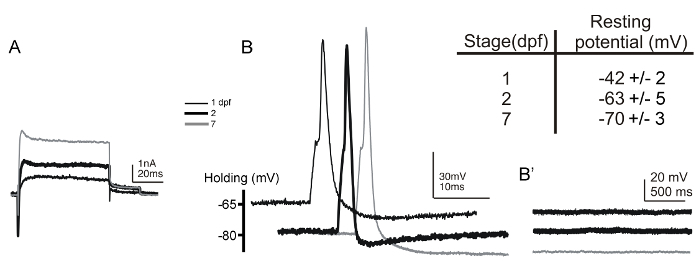
Şekil 5: Tüm hücre voltaj ve akım kelepçe 1'de Rohon-Sakal nöronlardan kayıtları ve dpf larvaları embriyolar dpf 2 ve 7. (A), voltaj-kelepçe dışa kayıtları ve içeri doğru akımlar 2- (kalın siyah çizgi), 1- (ince siyah çizgi) içerisinde Rohon-Sakal nöronlardan elde edilir ve 7-dpf (gri çizgi) embriyo / larva edildi. Tutma potansiyeli -80 mV ve daha akımları +20 mV'luk bir depolarize edici aşaması ortaya çıkarıldığını göstermektedir. (B) tek bir eylem potansiyelleri kısa (1 ms) akım ile teminenjeksiyonlar 1- (ince siyah çizgi) Rohon-Sakal nöronlara (~ 0.35 nA), 2- (kalın siyah çizgi) ve 7-dpf (gri çizgi) embriyo / larva. Elektriksel uyarımın yokluğunda (B'), bu şekilde kendiliğinden postsinaptik depolarizasyonlarından membran potansiyelinde herhangi bir değişiklik, Rohon-Sakal nöronlarda meydana gelir. ilave Tablo 1- (n = 21) ve 2- (n = 9) embriyo dpf ve 7- (n = 7) larvaları dpf Rohon-Sakal nöronlardan kaydedilen membran potansiyelinde dinlenme değerlerini özetlemektedir. Bu rakamın büyük halini görmek için buraya tıklayın.
diğer spinal nöron alt tiplerinin kesin olarak belirlenmesine izin transjenik soylar da kullanılabilir. Bunlar arasında, mnx1 transgen doğru Tg (mnx1: GFP) yakında tarifnamede (~ 14-16 büyük büyütme) sonra, spinal motor nöron bir alt grubunda, yeşil floresan protein (GFP) ifade 58, 59. Nedeniyle birlikte mnx1 transgenik GFP tanımı her hemisegment (Şekil 6A) içinde primer motor nöron basmakalıp konumlandırma için, çeşitli primer motor nöron alt tiplerini (Şekil 6B ve 6C) belirlemek mümkündür. Çizgi: kayıt elektrot çözeltisi içinde bir floresan boya dahil bazı internöron Tg (GFP mnx1) GFP eksprese olarak, motor nöron kimlik ek doğrulama sağlayan aksonal yörüngelerin olarak gösterebilir. Alternatif olarak, motor nöron tanımlanmasına imkan tanıyan başka bir transjenik nesil ET2 hattı 60'tır.
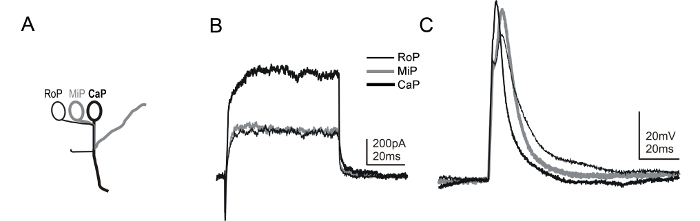
Şekil 6: zebra balığı Embry dpf 1 motor nöron Tüm hücre voltajı ve akım-kelepçe kayıtlarıişletim sistemi. (A), bir çizgi zebra balığı omurilikte bulunan primer motor nöron alt tiplerinin özel morfolojik özellikler göstermektedir. Birincil motor nöronlar, bir segmentin içindeki soma konumu ile tanımlanır (diğer bir deyişle, rostral [ROP] medial [MiP] veya kaudal [PKa]) 45 vardır. Buna ek olarak, her bir alt-tip farklı bir yol üzerinden çevresine bir akson uzanır. Tg (mnx1: GFP) 'nin kombine kullanımı hattı ve boya Etiketleme basmakalıp aksonal mili ve bir kayıt esnasında motor nöron alt tipinin kimliğini ortaya koymaktadır. Burada sunulan yöntemleri kullanarak, aynı hemisegment içinde üç farklı primer motor nöron alt tipleri Kaydı sırayla mümkündür. (B), voltaj-kelepçe kayıtları tek bir hemisegment PR, MIP ve prostat, tüm elde edildi gösterilmektedir. +20 mV'ye bir voltaj adımını, -80 mV'luk bir tutma potansiyelinden akımları ortaya çıkarmak için kullanıldı. Akım kelepçe r boyunca (° C)ROP, MIP ve prostat, kısa (1 ms, ~ 0.4 nA) gelen ecordings mevcut enjeksiyonları bir eylem potansiyelini tetiklemek için uygulanmıştır. zar potansiyeli ~ gerçekleştirildi -65 mV. Bu rakamın büyük halini görmek için buraya tıklayın.
birinci ve ikinci motor nöronlar arasındaki temel fark, önceki asıllı nöronların büyük somata olup. Bununla birlikte, ikincil motor nöron alt tipleri soma boyutu veya konumu ile belirlenememektedir. Belirli bir ikincil motor nöron kayıtları için, iki transjenik soy, Tg (gata2: GFP) ve TG (islet1: GFP), sırasıyla, 55, 61, ventral ve dorsal çıkıntı aksonlar, ikincil motor nöron tanımlanması için kullanılmıştır. Bununla birlikte, üçüncü sekonder motor nöron alt tip AXO ile, zebra balığı omurilikte mevcut olduğuBu proje dorsal ns ve ventral 62. Buna uygun olarak, boya morfolojiye göre (Şekil 7A) 8, 9 alt tiplerini tespit etmek kayıtları sırasında ikinci motor nöronları doldurmak için kullanılabilir. Çoğu zaman, ikinci motor nöron gelen voltaj kelepçe (Şekil 7B, yıldızlar) veya akım-kelepçe kayıtları (Şekil 7C ve 7C', ok başları) boyunca kendiliğinden veya sinaptik etkinlik kaydedilir.

Şekil 7: embriyoların dpf 2'nin ikinci motor nöron Tüm hücre voltajı ve akım-kelepçe kayıtları. Tg (gata2: GFP) (A) doğrultusunda, iki farklı ikincil motor nöron alt tipleri GFP 62 ifade eder. Sol hemisegment olarak, ventral orta motor nöron(Yıldız işareti ve ok sırasıyla soma ve akson gösterir). Komşu hemisegment olarak, sağ (kaudal) üzerinde, ventral / dorsal orta motor nöron (; oklar ventral [alt ok] çıkıntı yapan iki aksonlar, bir ve diğer dorsal [üst ok] göstermektedir yıldız soma gösterir) vardır. Bu nöronlar, kayıt sırasında kırmızı flüoresan boya ile etiketlenmiştir. Ventral / dorsal orta motor nöronları belirlemek için, diseksiyon ve böylece zarar veya dorsal akson çıkarılması, bitişik kaudal hemisegment olarak kas kaldırmaz sağlamak için çok önemlidir. Bu preparasyon (sağ üst yıldız) uzağa çekildiğinde kaydından sonra, nöron soma mikropipet bağlı kalır. Kayıt sırasında nöronlar doldurmak için boyalar kullanıldığında elektrot, kırmızı flöresanlı arka plana neden banyosunda omurilik ve rostral [sol] hemisegment Notokordun (alt yıldız işareti görülebilir iken, boya genellikle sızıntıları / Em>). (B), voltaj-kelepçe kayıtları ventral ve ventral / dorsal orta motor nöron elde edilmiştir. Voltaj adım (-30, -10, + 10, + 30, + 50, + 70, +90 ve + 110 mV) dışa ve içe doğru akımlar ortaya çıkardı. Sıkıştırılması ortadan kalktığında aksiyon potansiyelleri / depolarizasyonlar kayıtları (yıldız) içinde mevcut olabilir. İkinci motor nöron, kısa (1 ms) artan genlikte mevcut enjeksiyonları akım kelepçe kayıtları sırasında (C) bir aksiyon potansiyeli (yıldız) tetiklemek için nöronlar uygulanmıştır. (C') ~ 0.4-nA akımı enjeksiyonu ile orta motor nöronlarında tetiklenen bir aksiyon potansiyelinin örnekleri gösterilmiştir. Bu aşamada, kendiliğinden aksiyon potansiyelleri, aynı zamanda (C ve C', ok başları) gözlenir. Uzun süreli (D) (100 ms) mevcut enjeksiyonları (~ 0.35 nA) aksiyon potansiyellerinin tekrarlayan ateş tetikler. zar potansiyeli ~ gerçekleştirildi -65 mV.yük / 55507 / 55507fig7large.jpg" target = '_ blank'> bu rakamın büyük halini görmek için lütfen buraya tıklayın.
Tartışmalar
Burada tarif edilen yöntemler, omuriliğin en az diseksiyon sonra zebra balığı embriyolarının duyu ve motor nöronların elektriksel ve morfolojik özelliklerini belirlemek için izin verir. Nöronlar, en az 1 saat, bu kayıtların üzerine uygulanan süre sağlıklı kalması. Nöronlar, standart tam hücre konfigürasyonu kullanılarak kaydedilmiştir da çekirdekli yamalardan gibidir; ikinci yöntem iyon akımlarının 9 detaylı bir biyofiziksel çalışma engelleyebilirler yer kelepçe sorunları en aza indirir.
Önemli bir meydan okuma derinin temizlenmesi ve ilgi nöronların erişim sağlamak için gereken sınırlı bir diseksiyon için odasına embriyo veya larva firması eki ulaşmaktır. hazırlama işlemi aynı zamanda uygun bir şekilde tam hücre patch-clamp yöntemleri için kayıt bölmesine sabitlenmiş olması gerekir. Veteriner dikiş yapıştırıcının kullanılması ile bu sorun uygun bir yöntem olup embriyo ya da larva takmak içinDiseksiyon / kayıt odası, burada diğer model organizmaların diseksiyon için kullanılmış olan bir yaklaşım (örneğin, Drosophila) 63 tarif edilmiştir. deneyimlerimiz eğitim başkaları, biz usta en kritik adım tutkal az miktarda kontrollü ve hassas teslim olduğunu bulmak. Burada, bir kullanıcının içine tutkal yüklemek için veya bir mikropipet ucundan biçimde dışarı vermesi negatif ve pozitif basınç uygulamak için olanak sağlayan bir bağlantı dağıtım düzeneği tartışılmıştır. dikiş tutkal kullanılarak, embriyolar ve larva sıkıca hazneye bağlanmış ve yukarı veya yan ya da dorsal tarafına dönük olabilir. Bu şekilde, nöronların çeşitli farklı erişim seçenekleri mevcuttur. Aynı zamanda, bölme alt silikon elastomer tabakası, potansiyel optik avantajlar sağlayan Burada belirtilen 1 mm, daha ince olabilir. Bir başka yöntem, bir kayıt odasına hazırlama bağlamak için kullanılan daha genel olarak, ince tungsten pimleri kullanımını gerektirir 1 , 2, 3, 4, 5. yöntemler farklılık gösterdiğini de, her iki amaç ve deney sorunları dayalı seçilebilir seçenekleri ile araştırmacıların elde, zebra balığı spinal nöronlar için elektrofizyolojik erişim sağlar.
Burada tarif edilen zebra balığı hazırlama farklılaşmasının erken aşamalannda sırasında yerinde spinal nöronların elektriksel ve morfolojik çalışma sağlar. Bu yöntemleri kullanarak spinal nöronlar kayıt ederek, hatta öncesinde lezyonlu gen 6, 64, 65 belirlenmesine yol, birkaç mutasyonların hücresel sonuçlarına anlayış kazanmıştır.
Açıklamalar
Yazarlar herhangi mali çıkarlarını beyan ederim.
Teşekkürler
Bu çalışma, (ABR'ye RLM ve R01NS25217 ve P30NS048154 için F32 NS059120) NIH hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Vacuum filter/Storage bottle, 0.22 mm pore | Corning | 431096 | |
| Syringe filter 0.2 mm | Whatman | 6780-2502 | |
| Tricaine | Sigma | A-5040 | Ethyl 3-aminobenzoate methanesulfonate salt |
| α-bugarotoxin | Tocris | 11032-79-4 | |
| Tetrodotoxin | Tocris | 4368-28-9 | |
| Alexa-549 hydrazine salt | Molecular Probes | A-10438 | fluorescent dye |
| Spin-X centrifuge tube filter | Corning | 8161 | |
| Glass microscope slide | Fisher | 12-550C | |
| Sylgard silicone elastomer kit | Dow Corning | 184 | silicone elastomer |
| Petri dishes | Falcon | 351029 | |
| Borosilicate glass capillaries | Harvard Apparatus | 30-0038 | inner and outer diameters of 0.78 and 1.0 mm (thin walled glass capillaries) |
| Borosilicate glass capillaries | Drummond Scientific | 1-000-1000-100 | inner and outer diameters of 1.13 and 1.55 mm (thick walled glass capillaries) |
| Miniature barbed polypropylene fitting | Cole-Palmer | 6365-90 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Collagenase XI | Sigma | C7657 | |
| Microelectrode puller | Sutter Instruments | Model P-97 | |
| Amplifier | Molecular Devices | Axopatch 200B | |
| Head stage | Molecular Devices | CV203BU | |
| Motorized micromanipulator | Sutter Instruments | MP-285 | |
| Tygon tubing | Fisher | 14-169-1B | ID 1/16 IN, OD 1/8 IN and WALL 1/32 IN (flexible laboratory tubing) |
| Electrode holder | Molecular Devices | 1-HC-U | |
| Pharmaseal Three-Way Stopcocks | Baxter | K75 | |
| Digitizer | Axon Instruments | Digidata 1440A | |
| Inverted microscope | Zeiss | Axioskop2 FS plus | |
| 40X/0.80W Achroplan objective | Zeiss | ||
| Data acquisition and analysis software | Axon Instruments | PClamp 10 - Clampex and Clampfit | |
| Micropipette puller | Sutter Instruments | Model P-97 | |
| Name | Company | Catalog Number | Comments |
| Dissection and Recording Solutions (in mM) | |||
| All solutions, except the intracellular, are stable for ~2-3 months when filtered (0.22 mm filter cups) and stored at room temperature (RT). | |||
| The intracellular solution is filtered (0.2 mm syringe filters) and stored frozen (-20 °C) in small aliquots that are individually thawed on the day of use. | |||
| Dissection/Ringer’s solution | 145 NaCl, 3 KCl, 1.8 CaCl2.2H2O, 10 HEPES; pH 7.4 (with NaOH) | ||
| Pipette (intracellular) recording solution | 135 KCl, 10 EGTA-acid, 10 HEPES; pH 7.4 (with KOH). | ||
| Bath (extracellular) recording solution/voltage and current-clamp | 125 NaCl, 2 KCl, 10 CaCl2.2H2O, 5 HEPES; pH 7.4 (with NaOH). | ||
| Alexa-594 hydrazine salt stock solution. | Prepare a 13.2 mM stock in ddH2O, aliquot (~100 µl) and store at -20 °C. For use, dilute the stock solutiond 132 fold with pipette solution to a final concentration of 100 mM. After dilution, filter the Alexa-594 containing pipette solution with a centrifuge tube filter. | ||
| Name | Company | Catalog Number | Comments |
| Immobilizing agents | |||
| 0.4% ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Prepare a 0.4% stock solution in 0.2 M Tris, pH 9 (0.4 g Tricaine/100 mL 0.2 M Tris | ||
| Adjust pH to 7 with NaOH and store at -20 °C. | |||
| For use, dilute the stock solution ~25 fold in embryo media | |||
| 250 mM α-bungarotoxin | Prepare a 250 mM stock in ddH2O (1 mg/500 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,500-fold with extracellular solution to a final concentration of 100 nM. | |||
| 1 mM Tetrodotoxin | Prepare a 1 mM stock in ddH2O (1 mg/3 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,000-fold with extracellular solution to a final concentration of 500 nM. | |||
Referanslar
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J Neurosci Methods. 88 (1), 1-13 (1999).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog Neurobiol. 68 (2), 85-111 (2002).
- Saint-Amant, L., Drapeau, P. Whole cell patch-clamp recordings from identified spinal neurons in the zebrafish embryo. Methods Cell Sci. 25, 59-64 (2003).
- Masino, M. A., Fetcho, J. R. Fictive Swimming Motor Patterns in Wild Type and Mutant Larval Zebrafish. J Neurophysiol. 93 (6), 3177-3188 (2005).
- Wen, H., Brehm, P. Paired motor neuron-muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J Neurosci. 25 (35), 8104-8111 (2005).
- Ribera, A. B., Nüsslein-Volhard, C. Zebrafish Touch-Insensitive Mutants Reveal an Essential Role for the Developmental Regulation of Sodium Current. J Neurosci. 18, 9181-9191 (1998).
- Pineda, R. H., Heiser, R. A., Ribera, A. B. Developmental, molecular, and genetic dissection of INa in vivo in embryonic zebrafish sensory neurons. J Neurophysiol. 93, 3582-3593 (2005).
- Moreno, R. L., Ribera, A. B. Zebrafish motor neuron subtypes differ electrically prior to axonal outgrowth. J Neurophysiol. 102, 2477-2484 (2009).
- Moreno, R. L., Ribera, A. B. Spinal neurons require Islet1 for subtype-specific differentiation of electrical excitability. Neural Dev. 9 (1), 19 (2014).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Driever, W., et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development. 123, 37-46 (1996).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Vogel, G. Genomics: Sanger will sequence zebrafish genome. Science. 290 (5497), 1671 (2000).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. 2 (12), 956-966 (2001).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21 (1), 48-64 (2011).
- Yates, A., et al. Ensembl. Nucleic Acids Res. 44 (D1), D710-D716 (2016).
- Kawakami, K. Transgenesis and gene trap methods in zebrafish by using the Tol2 transposable element. Methods Cell Biol. 77, 201-222 (2004).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Huang, P., Xiao, A., Zhou, M., Zhu, Z., Lin, S., Zhang, B. Heritable gene targeting in zebrafish using customized TALENs. Nat Biotechnol. 29, 699-700 (2011).
- Sander, J. D., et al. Targeted gene disruption in somatic zebrafish cells using engineered TALENs. Nat Biotechnol. 29 (8), 697-698 (2011).
- Chang, N., et al. Genome editing with RNA-guided Cas9 nuclease in zebrafish embryos. Cell Res. 23 (4), 465-472 (2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol. 31 (3), 227-229 (2013).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nature Rev Genet. 8 (5), 353-367 (2007).
- Levin, E. D., Cerutti, D. T., Buccafusco, J. J. Behavioral neuroscience of zebrafish. Methods of behavior analysis in neuroscience. , (2009).
- Stewart, A., Gaikwad, S., Kyzar, E., Green, J., Roth, A., Kalueff, A. Modeling anxiety using adult zebrafish: A conceptual review. Neuropharmacology. 62, 135-143 (2012).
- Mushtaq, M. Y., Verpoorte, R., Kim, H. K. Zebrafish as a model for systems biology. Biotechnol Genet Eng Rev. 29 (2), 187-205 (2013).
- Phillips, J. B., Westerfield, M. Zebrafish models in translational research: tipping the scales toward advancements in human health. Dis Model Mech. 7 (7), 739-743 (2014).
- Weis, J. S. Analysis of the development of nervous system of the zebrafish, Brachydanio rerio. I. The normal morphology and development of the spinal cord and ganglia of the zebrafish. J Embryol Exp Morphol. 19 (2), 109-119 (1968).
- Bernhardt, R. R., Chitnis, A. B., Lindamer, L., Kuwada, J. Y. Identification of spinal neurons in the embryonic and larval zebrafish. J Comp Neurol. 302 (3), 603-616 (1990).
- Tsuchida, T., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Guillemot, F. Spatial and temporal specification of neural fates by transcription factor codes. Development. 134, 3771-3780 (2007).
- Goulding, M. Circuits controlling vertebrate locomotion: Moving in a new direction. Nat Rev Neurosci. 10, 507-518 (2009).
- Fetcho, J. R., McLean, D. L. Some principles of organization of spinal neurons underlying locomotion in zebrafish and their implications. Ann N Y Acad Sci. 1198, 94-104 (2010).
- Del Barrio, M. G., et al. A transcription factor code defines nine sensory interneuron subtypes in the mechanosensory area of the spinal cord. PLoS One. 8 (11), (2013).
- Satou, C., Kimura, Y., Hirata, H., Suster, M. L., Kawakami, K., Higashijima, S. Transgenic tools to characterize neuronal properties of discrete populations of zebrafish neurons. Development. 140 (18), 3927-3931 (2013).
- McLean, D. L., Fan, J., Higashijima, S., Hale, M. E., Fetcho, J. R. A topographic map of recruitment in spinal cord. Nature. 446, 71-75 (2007).
- McLean, D. L., Masino, M. A., Koh, I. Y., Lindquist, W. B., Fetcho, J. R. Continuous shifts in the active set of spinal interneurons during changes in locomotor speed. Nat. Neurosci. 11, 1419-1429 (2008).
- McLean, D. L., Fetcho, J. R. Spinal interneurons differentiate sequentially from those driving the fastest swimming movements in larval zebrafish to those driving the slowest ones. J. Neurosci. 29, 13566-13577 (2009).
- Ampatzis, K., Song, J., Ausborn, J., El Manira, A. Separate microcircuit modules of distinct V2a interneurons and motoneurons control the speed of locomotion. Neuron. 83, 934-943 (2014).
- Ljunggren, E. E., Haupt, S., Ausborn, J., Ampatzis, K., El Manira, A. Optogenetic activation of excitatory premotor interneurons is sufficient to generate coordinated locomotor activity in larval zebrafish. J. Neurosci. 34, 134-139 (2014).
- Menelaou, E., VanDunk, C., McLean, D. L. Differences in the morphology of spinal V2a neurons reflect their recruitment order during swimming in larval zebrafish. J Comp Neurol. 522, 1232-1248 (2014).
- Hubbard, J. M., et al. Intraspinal Sensory Neurons Provide Powerful Inhibition to Motor Circuits Ensuring Postural Control during Locomotion. Curr Biol. 26 (21), 2841-2853 (2016).
- Song, J., Ampatzis, K., Björnfors, E. R., El Manira, A. Motor neurons control locomotor circuit function retrogradely via gap junctions. Nature. 529 (7586), 399-402 (2016).
- Lamborghini, J. E. Rohon-beard cells and other large neurons in Xenopus embryos originate during gastrulation. J. Comp. Neurol. 189, 323-333 (1980).
- Myers, P. Z., Eisen, J. S., Westerfield, M. Development and axonal outgrowth of identified motoneurons in the zebrafish. J Neurosci. 6, 2278-2289 (1986).
- Kimmel, C. B., Westerfield, M., Edelman, G. M., Gall, W. E., Cowan, W. M. Primary neurons of the zebrafish. Signals and Sense: Local and Global Order in Perceptual Maps. , 561-588 (1990).
- Metcalfe, W. K., Myers, P. Z., Trevarrow, B., Bass, M. B., Kimmel, C. B. Primary neurons that express the L2/HNK-1 carbohydrate during early development in the zebrafish. Development. 110 (2), 491-504 (1990).
- Rossi, C. C., Kaji, T., Artinger, K. B. Transcriptional control of Rohon-Beard sensory neuron development at the neural plate border. Dev Dyn. 238, 931-943 (2009).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Progress in Neurobiology. 69 (6), 419-449 (2003).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Dev Cell. 25 (5), 478-491 (2013).
- Lambert, A. M., Bonkowsky, J. L., Masino, M. A. The conserved dopaminergic diencephalospinal tract mediates vertebrate locomotor development in zebrafish larvae. J Neurosci. 32 (39), 13488-13500 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (1995).
- Oesterle, A. . Pipette Cookbook 2015 P-97 & P-1000 Micropipette pullers. , (2015).
- Spitzer, N. C. The ionic basis of the resting potential and a slow depolarizing response in Rohon-Beard neurons of Xenopus tadpoles. J Physiol. 255 (1), 105-135 (1976).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20, 206-218 (2000).
- Blader, P., Plessy, C., Strahle, U. Multiple regulatory elements with spatially and temporally distinct activities control neurogenin1 expression in primary neurons of the zebrafish embryo. Mech Dev. 120, 211-218 (2003).
- Palanca, A. M., et al. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev Neurobiol. 73, 152-167 (2013).
- Flanagan-Street, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132, 4471-4481 (2005).
- Arkhipova, V., Wendik, B., Devos, N., Ek, O., Peers, B., Meyer, D. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365, 290-302 (2012).
- Balciunas, D., Davidson, A. E., Sivasubbu, S., Hermanson, S. B., Welle, Z., Ekker, S. C. Enhancer trapping in zebrafish using the Sleeping Beauty transposon. BMC Genomics. 5 (1), 62 (2004).
- Meng, A., Tang, H., Ong, B. A., Farrell, M. J., Lin, S. Promoter analysis in living zebrafish embryos identifies a cis-acting motif required for neuronal expression of GATA-2. Proc. Natl. Acad. Sci. USA. 94, 6267-6272 (1997).
- Menelaou, E., McLean, D. L. A gradient in endogenous rhythmicity and oscillatory drive matches recruitment order in an axial motor pool. J Neurosci. 32, 10925-10939 (2012).
- Rohrbough, J., Pinto, S., Mihalek, R. M., Tully, T., Broadie, K. latheo, a Drosophila gene involved in learning, regulates functional synaptic plasticity. Neuron. 23 (1), 55-70 (1999).
- McKeown, K. A., Moreno, R., Hall, V. L., Ribera, A. B., Downes, G. B. Disruption of Eaat2b, a glutamate transporter, results in abnormal motor behaviors in developing zebrafish. Dev Biol. 362 (2), 162-171 (2012).
- Carmean, V., et al. pigk mutation underlies macho behavior and affects Rohon-Beard cell excitability. J Neurophysiol. 114 (2), 1146-1157 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır